Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Yavrularda Duyarlılık ve Esnekliği Incelemek için Poli (I: C) Kullanarak Orta Gebelik Maternal İmmün Aktivasyonun Yeniden Üretilebilir Bir Modelinin Oluşturulması
Bu Makalede
Özet
Maternal enfeksiyon nörogelişimsel bozukluklar için bir risk faktörüdür. Maternal immün aktivasyonun (MIA) fare modelleri, enfeksiyonun beyin gelişimi ve fonksiyonu üzerindeki etkisini açıklığa kavuşturabilir. Burada, MIA'ya maruz kalan güvenilir esnek ve duyarlı yavrular üretmek için genel kılavuzlar ve bir prosedür sağlanmıştır.
Özet
Hamilelik sırasında maternal immün aktivasyon (MIA), yavrularda nörogelişimsel ve nöropsikiyatrik bozukluk riskinin artmasıyla sürekli olarak bağlantılıdır. MIA'nın hayvan modelleri, nedenselliği test etmek, mekanizmaları araştırmak ve bu bozukluklar için tanı ve tedaviler geliştirmek için kullanılır. Yaygın kullanımlarına rağmen, birçok MIA modeli tekrarlanabilirlik eksikliğinden muzdariptir ve neredeyse hepsi bu risk faktörünün iki önemli yönünü görmezden gelir: (i) birçok yavru MIA'ya karşı dirençlidir ve (ii) duyarlı yavrular farklı fenotipler kombinasyonları sergileyebilir. Tekrarlanabilirliği arttırmak ve MIA'ya hem duyarlılığı hem de esnekliği modellemek için, gebelikten önce dişi farelerin temel immünoreaktivitesi (BIR), hangi gebeliklerin MIA'ya maruz kaldıktan sonra dirençli yavrulara veya tanımlanmış davranışsal ve moleküler anormalliklere sahip yavrulara yol açacağını tahmin etmek için kullanılır. Burada, gebeliğin 12.5. gününde çift sarmallı RNA (dsRNA) viral mimik poli(I:C)'nin intraperitoneal (i.p.) enjeksiyonu yoluyla MIA'yı indüklemek için ayrıntılı bir yöntem sunulmaktadır. Bu yöntem, barajda akut bir enflamatuar yanıta neden olur ve bu da insan psikiyatrik ve nörogelişimsel bozukluklarında (NDD'ler) benzer şekilde etkilenen alanlara haritalanan farelerde beyin gelişiminde bozulmalara neden olur.
Giriş
Epidemiyolojik kanıtlar, maternal enfeksiyonu şizofreni (SZ) ve otizm spektrum bozukluğu (ASD) dahil olmak üzere psikiyatrik ve NDD riskinin artmasına bağlamaktadır 1,2,3,4,5,6,7. MIA fare modeli, bu bozuklukların etiyolojisinde nedenselliği ve mekanik rolünü test etmek, moleküler biyobelirteçleri tanımlamak ve hem tanısal hem de terapötik araçlar geliştirmek için geliştirilmiştir 4,6. Bu modelin yararlılığına ve artan popülaritesine rağmen, alandaki MIA indüksiyon protokollerinde önemli farklılıklar vardır, bu da sonuçları çalışmalar arasında karşılaştırmayı ve bulguları çoğaltmayı zorlaştırır 8,9. Ek olarak, modelin çoğu yinelemesi MIA'nın iki önemli translasyonel yönünü araştırmaz: (i) birçok yavru MIA'ya karşı dirençlidir ve (ii) duyarlı yavrular fenotiplerin 8'in farklı kombinasyonlarını sergileyebilir.
Tekrarlanabilir bir MIA modeli oluşturmak için, araştırmacılar barajlarda indüklenen MIA büyüklüğünün en az bir nicel ölçüsünü rapor etmelidir. Gebelik sırasında MIA'yı indüklemek için laboratuvarımız çift sarmallı RNA viral mimik poliinositiğinin intraperitoneal (i.p.) enjeksiyonlarını gerçekleştirir: polisitidilik asit [poli (I: C)]. Poli (I: C), toll-like reseptör 3 (TLR3) 10 tarafından tanındığı için influenza virüslerine benzer bir bağışıklık kaskadını indükler. Sonuç olarak, poli(I:C), proinflamatuar sitokinlerin 8,11,12 hızlı yükselmesiyle sonuçlanan akut faz yanıtını aktive eder. Önceki çalışmalar, interlökin-6 (IL-6) dahil olmak üzere proinflamatuar sitokinlerin yükselmesinin, MIA 11,12,13'ün bir sonucu olarak yavrularda davranışsal anormallikler ve nöropatoloji üretmek için gerekli olduğunu göstermiştir. Bu nedenle, poli (I: C) enjeksiyonu takiben 2.5 saatte zirve sırasında toplanan maternal serumdaki IL-6 seviyesi, sahadaki laboratuvarlardaki sonuçları karşılaştırmak için kullanılabilecek zorlayıcı bir MIA nicel ölçüsüdür.
Tek bir indüksiyon protokolü 8,14 ile direnç ve duyarlılığın translasyonel olarak gerekli unsurlarını ele alan bir MIA modeli oluşturmak için araştırmacılar, tipik indüksiyon yaklaşımlarını hamilelikten önce barajın temel immünoreaktivitesinin (BIR) karakterizasyonu ile birleştirebilirler8. Son zamanlarda, bakire dişi C57BL / 6 farelerin, hamilelikten önce poli (I: C) 'ye düşük dozda maruz kalmaya karşı çok çeşitli IL-6 yanıtları gösterdiği keşfedilmiştir8. Duyarlı yavrular üretmeye devam eden bu dişilerin sadece bir alt kümesidir ve sadece BIR ve poli (I: C) doz8'in kombinasyonu tarafından dikte edildiği gibi bağışıklık aktivasyonunun belirli büyüklüklerindedir. MIA, ters çevrilmiş bir U paterninde fenotipleri indükler; Yavrular, barajlar orta derecede immünoreaktif olduğunda en büyük davranışsal ve moleküler sapmaları gösterir ve maternal inflamasyonun büyüklüğü kritik bir aralık8'e ulaşır, ancak geçmez. Burada, orta gebelik düzeyinde poli(I:C) enjeksiyonu sonucunda farklı davranışsal fenotiplere sahip hem dirençli hem de duyarlı yavruların güvenilir bir şekilde nasıl oluşturulacağına dair ayrıntılı bir yöntem sunulmaktadır.
Protokol
Tüm protokoller Kaliforniya Üniversitesi-Davis Kurumsal Hayvan Bakımı ve Kullanımı Komitesi'nin (IACUC) onayı altında gerçekleştirilir.
1. Hayvan hazırlığı
- Hayvanları edinirken, maksimum tekrarlanabilirliği sağlamak için aşağıdaki parametreleri tutarlı tutun.
- Satıcı ve satıcı konumu: Daha önce bildirildiği gibi, vahşi tip C57BL / 6J fareler, satıcıya bağlı olarak aynı dozda poli (I: C) için farklı tepkiler sergiler8. Tutarlı bir yanıt gösteren bir satıcı ve fare suşu seçin. Buradaki deneyler için, Charles River'dan elde edilen C57BL / 6 fareleri, orta gebelik MIA'sına maruz kaldıktan sonra davranışta tutarlı değişiklikler sergilerken, Taconic'ten satın alınanlar, Charles River fareleri8'e kıyasla tedavi grupları arasında bazı farklılıklarla daha büyük bir büyüklük yanıtı göstermektedir.
- Suş: C57BL / 6J fareleri en yaygın kullanılanlardır, ancak BTBR fareleri ve diğer suşlar orta gebelik MIA9'a diferansiyel yanıtlar gösterir. Bu diferansiyel tepkilere dikkat edin, çünkü bunlar yöntemin tekrarlanabilirliğini arttırır ve yavrularda diferansiyel sonuçlara katkıda bulunmada potansiyel bir değişken olabilir.
- Minimum değişkenliği sağlamak için, MIA çalışmaları8 için yalnızca bakire kadınları kullanın ve yöntemlerdeki ayrıntıları açıkça not edin.
- Nakliye ve alışma dönemindeki yaş: 7 haftadan önce gönderilen fareler düzensiz endokrin sistemler gösterir15. Hayvanların en az 48 saat16,17 oranında alışmasına izin verin. Farelerin 7 haftada (± 2 gün) gönderilmesini ve 8 haftada (± 2 gün) BIR için enjekte edilmesini sipariş edin.
- Çiftleşme yaşı: Hayvanların bağışıklık sistemleri ömürleri boyunca dinamiktir. Çiftleşme / enjeksiyon yaşını mümkün olduğunca tutarlı tutarak değişkenliği en aza indirmeye özen gösterin18,19,20. Dişi fareleri 9 haftada eşleştirin (± 2 gün). Çiftleşme için 6 aylıktan büyük erkekleri kullanmayın.
2. Poli (I: C) lot testi ve hazırlığı
- Aşağıda açıklandığı gibi yüksek moleküler ağırlıklı poli (I: C) hazırlayın.
- Depolama için otoklav 1,5 mL mikrosantrifüj tüpleri. Yeniden askıya alınmış poli (I: C) -20 ° C'de saklanabilir, ancak tekrarlanan donma çözülmeleri potensi etkileyebilir. Su banyosunu 70 °C'ye ısıtın.
- Steril tekniği kullanarak, bir şırınga kullanarak liyofilize poli (I: C) 10 mL steril fizyolojik salin (NaCl% 0.9) ekleyin. Tam tavlamaya izin vermek için 70 °C su banyosunda 15 dakika ısıtın. Çıkarın ve oda sıcaklığına soğumaya bırakın.
- Steril bir davlumbazda, şişeye ilave 40 mL fizyolojik salin ekleyin ve karıştırmak için birkaç kez ters çevirin. Poli (I: C) şişenin üstünü çıkarın veya 1,5 mL mikrosantrifüj tüplerine aliquot yapmak için bir şırınga kullanın. -20 °C'de saklayın.
- Aşağıda açıklandığı gibi karışık moleküler ağırlıklı poli (I: C) hazırlayın.
- Depolama için otoklav 1,5 mL mikrosantrifüj tüpleri. Yeniden askıya alınmış poli (I: C) -20 ° C'de saklanabilir, ancak tekrarlanan donma çözülmeleri potensi etkileyebilir. Su banyosunu 50 °C'ye ayarlayın.
- Steril tekniği kullanarak, liyofilize poli (I: C) içine 10 mL steril% 0.9 NaCl ekleyin ve kapağı sabitleyin. Tam tavlamaya izin vermek için 50 °C su banyosunda 25 dakika ısıtın. Çıkarın ve oda sıcaklığına soğumaya bırakın.
- Steril tekniği kullanarak, 1.5 mL mikrosantrifüj tüplerine aliquot yapın ve -20 ° C'de saklayın.
- Poli (I: C) 'yi aşağıda açıklandığı gibi intraperitoneal (i.p.) enjeksiyonlarla uygulayın.
- Doğru dozlamayı belirlemek için fareyi tartın. 0,5 cc'lik bir insülin iğnesi kullanarak, yeniden askıya alınmış poli (I: C) çizin. fareyi scruff ve karın açığa çıkacak şekilde çevirin.
- Öte yandan, iğneyi ön iki meme ucu arasına yaklaşık 45 ° 'lik bir açıyla yaklaşık 0,5 cm derinliğe yerleştirin.
- Enjekte etmeden önce şırıngaya kan veya idrar girmediğini belirlemek için çizin. Her ikisi de olursa, iğneyi yeniden konumlandırın ve tekrar deneyin. Yavaşça enjekte edin. Poli (I: C) kabarcıklar çıkarsa, enjeksiyon muhtemelen deri altındaydı. Başarılı bir enjeksiyon yerleştirme, iğne yerleştirildikten sonra hiçbir şeyin çizilmemesine ve çıkarıldıktan sonra sızıntı yapılmasına neden olmaz.
- MMW poli (I: C) lot potensini aşağıda açıklandığı gibi testedin 8.
- İstenilen poli (I: C) formunu elde edin. Bazı üreticiler, araştırmacıların daha sonra aynı anda birden fazla şişe elde edilebilmesi için potens test edilirken tam veya kısmi bir partiye bir bekletme koymalarına izin verecektir. Tipik olarak, bunlar donma-çözülmeden kaçınılırsa birkaç yıl boyunca -20 ° C'de liyofilize edilebilir.
- Test için 30 hamile barajı elde edin veya yetiştirin. E12.5'te, doz başına en az 10 farede 20, 30 ve 40 mg / kg'lık i.p. enjeksiyonları gerçekleştirin.
- Enjeksiyondan 2,5 saat sonra, kuyruk kanaması yoluyla kan toplayın. Periferik kan ve gövde kanının sitokin seviyelerinde farklılık gösterebileceğini unutmayın, bu nedenle toplama yöntemini bir çalışmada tutarlı tutun.
- Kanın oda sıcaklığında gece boyunca pıhtılaşmasına izin verin. 12-24 saat sonra, kan örneklerini 8 dakika boyunca 4 ° C'de 3.768 x g'de döndürün. Serumu toplayın ve analiz edilene kadar -80 ° C'de saklayın.
- Serumu izole edin ve ELISA veya Luminex yoluyla IL-6 seviyelerini ölçün. Farklı modaliteler ve üreticilerle ölçülen toplam konsantrasyonda önemli farklılıklar olduğu için ölçüm araçlarını tutarlı tutun. Bir pilot kohort kullanarak fenotipleri indüklemek için gereken IL-6 yanıtının büyüklüğünü belirleyin.
3. Temel immünoreaktivite (BIR) testi
NOT: Şekil 1 , adımların şemasını gösterir. Bileşiğe adaptif bağışıklık tepkileri olasılığını azaltmak için gestasyonel ile karşılaştırıldığında BIR testi için farklı bir moleküler ağırlıklı poli (I: C) kullanın.
- Bakire dişi farelerin 7 haftalıkken gönderilmesini sipariş edin. Varışta, bir kafeste dört ila beş fareyi gruplayın ve barındırın ve çiftleşene kadar grubu evde tutun. Kulak çentiği veya başka bir tanımlama sistemi kullanın.
- Kadınlara varıştan 1 hafta sonra intraperitoneal olarak 5 mg / kg poli (I: C) enjekte edin. Enjeksiyondan sonraki 2.5 saatte, IL-6 dolaşımı en yüksek6 olduğunda, enjekte edilen hayvanlardan kuyruk kopması yoluyla tam kan toplayın.
- Kanın oda sıcaklığında gece boyunca pıhtılaşmasına izin verin. 12-24 saat sonra, kan örneklerini 8 dakika boyunca 4 ° C'de 3.768 x g'de döndürün.
- Her numuneden en az 32 μL serum toplayın. Sitokinleri test etmeye hazır olana kadar -80 ° C'de dondurun. IL-6 seviyelerini en tutarlı şekilde ölçmek için, Luminex gibi bir multipleks testi kullanın. Farklı modaliteler ve üreticilerle ölçülen toplam konsantrasyonda önemli farklılıklar olduğu için ölçüm araçlarını tutarlı tutun.
- Luminex tahlil protokolü için Bruce et al.21'e bakınız.
- Göreceli IL-6 seviyelerini kullanarak, hayvanları düşük (alt çeyrek), orta (orta iki çeyrek) ve yüksek (en yüksek çeyrek) BIR gruplarına ayırın.
4. Kan alımı için kuyruk kanaması yöntemi
NOT: Potansiyel immünomodülatör yatıştırıcıların kullanımından kaçınmak için, kan alımında kuyruk kanaması yöntemini kullanın.
- Kurmak için, baskın olmayan elin yanındaki bir yüzeye bir lehimleme standı ve kısıtlama kabı yerleştirin. 35 mm'lik bir Petri kabında, 1-2 mL gıda sınıfı, yenilebilir yağ ekleyin. Kapağı hızlı kan tıpasından çıkarın ve kurulumun yanına yerleştirin.
- Lehimleme standına ve ilk kılcal boruyu bir klipse birkaç kat kağıt havlu yerleştirin, farenin kuyruk ucunun tutulacağı ve masanın yüzeyine paralel tutulacağı yere yakın bir yere yerleştirin. Yanınızda bir tıraş bıçağı bulundurun.
- Kanı toplamak için aşağıdaki adımları uygulayın.
- Gerekli zamanda, fareyi kafesten çıkarın ve kuyruğu tabandaki çentikten çıkacak şekilde bardağın altına yerleştirin. Taze bir tıraş bıçağı kullanarak, kuyruğun en ucunu (1-2 mm) kesin ve lehimleme standına tutturulmuş kılcal tüpteki ilk kan damlasını toplayın.
- Baskın elin parmaklarını yenilebilir yağa batırın ve kuyruğun tabanından ucuna kadar sıkmak için kullanın, sonuçta ortaya çıkan kan damlalarını toplamak için kuyruk ucunu kılcal tüpe yönlendirin. ~ 200 μL kan toplanana kadar devam edin.
- Üst kapaktan önce kılcal borunun konik ucuna küçük bir uç kapağı koyun. İlk önce üst kapak takılırsa, numune tüpün konik ucundan dışarı atılacaktır. Tüpü koruyucu dış kabuğa koyun.
- Oda sıcaklığında gece boyunca pıhtılaşmaya bırakın. Bir mikrosantrifüjü 4 ° C'ye soğutun ve adım 3.3'te belirtildiği gibi kanı aşağı doğru döndürün.

Şekil 1. Bakire kadınların temel immünoreaktivitesini ve çiftleşmesini test etmek için zaman çizelgesi. Farelerin 7 haftalık olmasına ulaşmasını emredin ve 1 hafta boyunca tesise alışmalarına izin verin. Hayvanlara 5 mg / kg poli (I: C) enjekte edin ve 2.5 saat sonra kan alın. Kanın gece boyunca pıhtılaşmasına izin verin, ardından 8 dakika boyunca 3.768 x g, 4 ° C'de santrifüj yapın. Serum toplayın ve ELISA veya Multiplex yoluyla göreceli IL-6 seviyelerini değerlendirin. 9 haftalıkken, çiftleşme çiftleri kurun. BioRender.com kullanılarak oluşturulmuştur Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
5. Çiftleşme ve gestasyonel E12.5 enjeksiyonu için ağırlık bazlı yöntem
NOT: Şekil 2 , adımların şemasını gösterir. Çiftleşme çiftlerini ayarlamak ve E12.5 zaman noktasını belirlemek için iki yöntem kullanılabilir. Birincisi, zamanlanmış çiftleşme, başka bir yerde tanımlanmıştır22. Ağırlık bazlı hesaplamalar, E12.5 gebelik23'ü değerlendirmek için de kullanılabilir. Bu yaklaşımın yararı, barajın çiftleşme yaşının zaman kilitlenmesine izin vermesi ve bağışıklık tepkisindeki değişkenliği azaltmasıdır. Bu prosedür burada kullanılır.
- Erkekleri temiz kafeslere yerleştirin ve en az 2 saat boyunca alışmalarına izin verin. Bu, kadın saldırganlığı olasılığını azaltır, çünkü erkekler zaten kafeste baskın bir koku oluşturacaktır.
- Dişi erkeğin kafesine ekleyerek bekar erkek, tek dişi üreme çiftleri kurun. Onu kafese koymadan önce, onu tartın ve ağırlığı kaydedin. Çiftleşme verimliliğini artırmak için her kafese küçük bir avuç ayçiçeği çekirdeği ekleyin.
- Kilo alma aralığını belirlemek için aşağıdaki adımları uygulayın.
- Bir test dişi grubu edinin ve çiftleşme sırasında ağırlık kaydederek çiftleşme çiftleri kurun.
- Dişiler gözle görülür şekilde hamile görünmeye başladığında, onları tartın ve 8.5 g, 9.5 g, 10.5 g ve 11.5 g kilo alınan alt kümelere bölün. E12.5'teki fetüsler pençelerinde belirgin rakamlar geliştirmeye başlamıştır. E12.5'e ulaşmak için ortalama kilo alımını belirlemek için fetal morfolojiyi kullanın.
- Çiftleşmeden 12 gün sonra, dişileri tartın ve kilo alımını belirleyin. Bir test tesisinde, dişiler çiftleşme zamanından E12.5'e kadar sürekli olarak 9.5-10.5 g kazanırlar. Dişinin kilo alımı önceden belirlenmiş aralıkta düştüğünde adım 2.3.2'de belirlenen çözünür poli (I: C) dozunu i.p. yoluyla enjekte edin.
- Aşağıdaki parametreleri kullanarak barajlarda MIA'ya verilen yanıtı gözlemleyin.
- Hastalık davranışı: 1-3 ölçeğinde aktif barajların ele alınmaya tepki olarak nasıl aktif hale geldiğini, 1'in ele alınmaya yanıt olarak çok az hareket ettiği veya hiç hareket etmediği ve 3'ün yakalama ve kısıtlamaya normal bir yanıt olduğu öznel puanları toplayın. Daha fazla bağışıklık tepkisi olan hayvanlar,8'i kullanmaya karşı daha az direnç gösterecektir.
- Ateşli yanıt: Bir IR termometre kullanarak, enjeksiyon öncesi ve enjeksiyon sonrası 2.5 saat sıcaklıkları toplayın. Daha büyük büyüklükte bağışıklık tepkilerine sahip hayvanlar genellikle daha büyük bağışıklık aktivitesine yanıt olarak hipotermi gösterir8.
- Ağırlık değişimi: Enjeksiyondan 24 saat sonra hayvanları tartın. Daha büyük büyüklükte bağışıklık tepkisi olan hayvanlar genellikle daha fazla kilo verir8.
- Gestasyonel IL-6düzeylerini aşağıdaki 8 gibi ölçün.
- Enjeksiyondan 2,5 saat sonra, tercih edilen yöntemle kan toplayın. Kanın oda sıcaklığında gece boyunca pıhtılaşmasına izin verin. 12-24 saat sonra, kan örneklerini 8 dakika boyunca 4 ° C'de 3.768 x g'de döndürün.
- Serumu toplayın ve analiz edilene kadar -80 ° C'de saklayın. Serumu izole edin ve ELISA veya Luminex yoluyla IL-6 seviyelerini ölçün. Farklı modaliteler ve üreticilerle ölçülen toplam konsantrasyonda önemli farklılıklar olduğu için ölçüm araçlarını tutarlı tutun.
- Enjeksiyondan sonra barajı tek başına nestletler ve zenginleştirme cihazları gibi uygun zenginleştirme ile barındırın. Zenginleştirmedeki değişikliklerin kemirgen davranışı üzerinde önemli etkileri olabileceğinden tüm zenginleştirmeyi tutarlı tutun 24,25,26,27,28,29.
- C57 fareleri için gebelik süresi 18.5-20.5 gün arasında değişmektedir. Enjeksiyonun doğru zaman noktasında yapıldığından emin olmak için hayvanların bu aralıkta doğup doğmadığını belirlemek için çöp kontrolleri yapın. Litreleri kontrol ederken, kafesi mümkün olduğunca az rahatsız edin. Çöp doğduktan hemen sonra stres, yamyamlık riskini artırabilir.
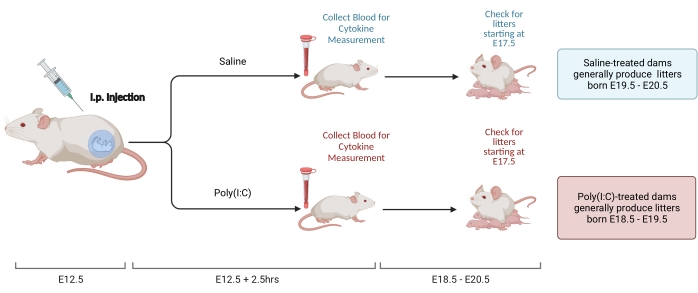
Şekil 2. MIA indüksiyonu. MIA indüksiyonu, gebeliğin değerlendirilmesini, yani poli (I: C) enjeksiyonunu ve maternal inflamasyonun doğru zamanlamasını sağlamak için çöp kontrollerini gerektirir. Gebelik gününü zamanlanmış çiftleşme veya kilo alma yöntemiyle değerlendirdikten sonra, E12.5'te bir i.p. poli (I: C) enjeksiyonu yapın. İmmün aktivasyonu doğrulamak ve IL-6 aktivasyon seviyesini belirlemek için enjeksiyondan 2.5 saat sonra bir kan örneği toplayın. Litreler yaklaşık E18.5-E20.5'te doğacaktır. BioRender.com kullanılarak oluşturulmuştur Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
6. Yetişkin MIA'daki davranış değişikliklerinin araştırılması ve yavruların kontrol edilmesi (isteğe bağlı)
- P60'tan başlayarak ve davranış testleri yapmadan önce, art arda 3 gün boyunca günde 1 dakika boyunca nazik kullanımla hayvanları insan temasına alıştırın. Kafes değiştirme günlerinin davranış testlerinin yapıldığı gün gerçekleşmediğinden emin olun.
- Davranışsal testlere başlamadan önce farelerin her zaman 30-60 dakika boyunca test odasına alışmasına izin verin. Kaygıyı en aza indirmek için loş ışıklı (15-20 lüks) odalar kullanın.
- Tekrarlayan tımar için, fareleri tek başlarına kapaklı temiz, yataksız kafeslere yerleştirin. Bir kamera kullanarak, bu kafeslerdeki fareleri 20 dakika boyunca kaydedin. İlk 10 dakika alışma periyodu olarak işlev görür, son 10 dakika test süresidir.
- Kaydedilen videoları ve kronometreyi kullanarak, 10 dakikalık test süresi boyunca her fare için kümülatif bakım süresini puanlayın. Bu videolardan elde edilebilecek diğer davranışlar arasında yetiştirme (arka ayaklar üzerinde durma), donma ve atlama8 sayılabilir.
- MIA modeli için prepulse inhibisyon (PPI) 14,30,31,32, açık alan12,33,34, 3 odacıklı sosyal yaklaşım 13,35,36, yeni nesne tanıma 37, y-labirent 30, yükseltilmiş artı labirent 33 ve bağlam / ipucu korku koşullandırma 38 gibi diğer yaygın testleri kullanın.
- Postnatal immünoblotlama8 (isteğe bağlı)
- P0'da, hızla kafa kesin ve HBSS'de fetal beyin dokusunu diseke edin, sıvı azotta dondurun ve -80 ° C'de saklayın.
- 2x Laemmli tamponunda 5 s için% 20 genliğe sahip bir prob sonicator kullanarak numuneleri bozun, ardından 5 dakika boyunca 85 ° C'de denatüre edin. Oda sıcaklığında 10 dakika boyunca 16.000 x g'da santrifüj lizat. Süper natantı toplayın ve -80 ° C'de saklayın.
- Üreticinin talimatlarını izleyerek ticari bir BCA protein tahlil kiti kullanarak toplam protein içeriğini ölçün ve kalibrasyon standardı olarak sığır serum albümini kullanın.
- 100 mM'lik son konsantrasyon olarak numunelere indirgeyici bir ajan olarak dithiothreitol ekleyin. Bir jel üzerine yüklemeden önce 2 dakika boyunca 85 ° C'ye ısıtın.
- %7,5 TGS jelleri üzerinde indirgeme koşulları altında 5 μg/şerit protein çalıştırın ve elektroforetik olarak PVDF membranlara aktarın. Membranları bloke edici tamponla bloke edin ve seçilen antikorlarla inkübe edin.
- TBS +% 0.05 Ara 20 ile üç kez yıkayın ve membranları floresan etiketli ikincil antikorlarla 45 dakika boyunca inkübe edin.
- TBS/Tween 20 ve görüntü sonuçlarında dört kez daha yıkayın. Anti-β-tübülin kullanılarak tespit edilen β-tübülin kullanarak sonuçları standartlaştırın.
Sonuçlar
E12.5'te 30 mg / kg poli (I: C) maruz kalan tüm hayvanlar, tutarlı davranışsal anormalliklere sahip yavrular üretmez 8,31. Hem 30 mg / kg hem de 40 mg / kg poli (I: C), azalmış aktivite seviyeleri, hipotermik yanıtlar ve kilo kaybı da dahil olmak üzere barajlarda güvenilir bir şekilde hastalık davranışları üretmesine ve ayrıca IL-6'da önemli yükselmelere neden olmasına rağmen, MIA'ya maruz kalan litrelerin sadece bir alt kümesi, insan psiki...
Tartışmalar
Maternal enfeksiyon, insanlarda ve hem kemirgenlerde hem de insan olmayan primatlarda beyin gelişiminin seyrini değiştirir 4,5,7. Burada, farelerde MIA'yı poli (I: C) kullanarak gebelik ortası bir zaman noktasında indüklemek için bir prosedür özetlenmiştir. Bu yöntem, gebelikten önce BIR'in değerlendirilmesini içerir, bu da tekrarlanabilirliği arttırır ve yavruların MIA8'e karşı esnek...
Açıklamalar
Yazarların açıklayacağı bir çıkar çatışması yoktur.
Teşekkürler
Dr. Myka Estes'e, fare MIA modelindeki değişkenliği ele almadaki ısrarı için ve Estes ve ark.8'deki tüm katkıda bulunanlara, burada açıklanan yöntem protokolünün geliştirilmesine yol açan çalışmaları için teşekkür ederiz. Burada bildirilen araştırma NIMH 2P50 MH106438-06 (A.K.M.) ve NIMH T32MH112507 (K.P.) tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 0.9% NaCl physiological endotoxin free saline | Sigma-Aldrich | 7647-14-5 | Control and vehicle for Poly(I:C) |
| 35mm petri dish | Thomas Scientific | 1219Z45 | Used to hold oil during tail bleed |
| 7.5% TGX gels | Bio-rad | 4561084 | Optional |
| Ancare Nestlets | Fisher Scientific | NC9365966 | Optional |
| anti-β-tubulin | Millipore | MAB3408 | Optional |
| Bio-Plex Pro Mouse Cytokine Standards Group I | Bio-rad | 171I50001 | |
| Bio-Plex Pro Reagent Kit with Flat Plate | Bio-rad | 171304070M | |
| Bovine Serum Albumin | ThermoFisher | 23209 | Optional |
| Centrifuge | Eppendorf | 5810R | Optional |
| Covidien Monoject 1/2 mL Insulin Syringe with 28G x 1/2 in. Needle | Spectrum | 552-58457-083 | |
| Dithiothreitol | Sigma-Aldrich | D9779-10G | Optional |
| Environmental enrichment | Bio-serv | K3327 and K3322 | Optional |
| Ethovision | Noldus | Ethovision | Optional |
| Fluorsecent-tagged seondary ntibodies | Li-cor | 925-32213 and 925-68072 | Optional |
| Food-grade edible oil (like olive, canola or grapeseed) | Various vendors | Use to lubricate tail during tail bleeds | |
| HBSS | ThermoFisher | 14060040 | Optional |
| High molecular weight polyinositic:polycytidilic acid | Invivogen | #tlrl-pic-5 | Used to establish females' BIR |
| Humane Mouse Restrainer | AIMS | 1000 | Used to restrain mouse during tail bleeds |
| Image Studio Software | Licor | 5.2 | Optional |
| Laemmli buffer | Bio-rad | 1610737EDU | Optional |
| Luminex200 | ThermoFisher | APX10031 | |
| Microvette CB300 300μl Serum capillary tube | Sarstedt | 16.440.100 | |
| Mixed molecular weight polyinositic:polycytidilic acid | Sigma-Aldrich | #P0913 | Gestational induction of MIA |
| monoclonal anti-MEF2A | AbCam | ab76063 | Optional |
| monoclonal anti-STAT3 | Cell signaling | 12640S | Optional |
| Observer | Noldus | Observer | Optional |
| Odyssey blocking buffer (TBS) | Li-cor | 927-50003 | Optional |
| Odyssey CLx imaging system | Li-cor | 9140 | Optional |
| Omnipure PBS | Millipore | 65054L | Optional |
| Pierce BCA Protein Assay Kit | ThermoFisher | 23227 | Optional |
| polyclonal anti_TH | Pel-Freez | P4101-150 | Optional |
| PVDF membrane | Bio-rad | 162-0177 | Optional |
| Qsonica Sonicator Q500 | Fisher Scientific | 15-338-282 | Optional |
| Quick blood stopper | Petco | 17140 | |
| Seal-Rite 1.5 ml microcentrifuge tube, natural non-sterile | USA Scientific | 1615-5500 | |
| Soldering stand | Amazon | B08Y12QC73 | Used to hold capillary tube during tail bleeds |
| Sunflower seeds | Bio-serv | S5137-1 | Use to increase breeding efficiency |
| The Bio-Plex Pro Mouse IL-6 set, | Bio-rad | 171G5007M | |
| Tris base | Fisher Scientific | BP152-1 | Optional |
| Tween 20 | Bio-rad | 23209 | Optional |
Referanslar
- Adams, W., Kendell, R. E., Hare, E. H., Munk-Jørgensen, P. Epidemiological evidence that maternal influenza contributes to the aetiology of schizophrenia. An analysis of Scottish, English, and Danish data. The British Journal of Psychiatry: The Journal of Mental Science. 163 (4), 522-534 (1993).
- Brown, A. S., et al. Serologic evidence of prenatal influenza in the etiology of schizophrenia. Archives of General Psychiatry. 61 (8), 774-780 (2004).
- Brown, A. S., Derkits, E. J. Prenatal infection and schizophrenia: a review of epidemiologic and translational studies. The American Journal of Psychiatry. 167 (3), 261-280 (2010).
- Patterson, P. H. Immune involvement in schizophrenia and autism: etiology, pathology and animal models. Behavioural Brain Research. 204 (2), 313-321 (2009).
- Patterson, P. H. Maternal infection and immune involvement in autism. Trends in Molecular Medicine. 17 (7), 389-394 (2011).
- Estes, M. L., McAllister, A. K. Immune mediators in the brain and peripheral tissues in autism spectrum disorder. Nature Reviews. Neuroscience. 16 (8), 469-486 (2015).
- Estes, M. L., McAllister, A. K. Maternal immune activation: Implications for neuropsychiatric disorders. Science. 353 (6301), 772-777 (2016).
- Estes, M. L., et al. Baseline immunoreactivity before pregnancy and poly(I:C) dose combine to dictate susceptibility and resilience of offspring to maternal immune activation. Brain, Behavior and Immunity. 88, 619-630 (2020).
- Kentner, A. C., et al. Maternal immune activation: reporting guidelines to improve the rigor, reproducibility, and transparency of the model. Neuropsychopharmacology. 44 (2), 245-258 (2019).
- Zhou, Y., et al. TLR3 activation efficiency by high or low molecular mass poly I:C. Innate Immunity. 19 (2), 184-192 (2013).
- Hsiao, E. Y., Patterson, P. H. Activation of the maternal immune system induces endocrine changes in the placenta via IL-6. Brain, Behavior and Immunity. 25 (4), 604-615 (2011).
- Smith, S. E., Li, J., Garbett, K., Mirnics, K., Patterson, P. H. Maternal immune activation alters fetal brain development through interleukin-6. The Journal of Neuroscience. 27 (40), 10695-10702 (2007).
- Choi, G. B., et al. The maternal interleukin-17a pathway in mice promotes autism-like phenotypes in offspring. Science. 351 (6276), 933-939 (2016).
- Meyer, U. Neurodevelopmental resilience and susceptibility to maternal immune activation. Trends in Neurosciences. 42 (11), 793-806 (2019).
- Laroche, J., Gasbarro, L., Herman, J. P., Blaustein, J. D. Reduced behavioral response to gonadal hormones in mice shipped during the peripubertal/adolescent period. Endocrinology. 150 (5), 2351-2358 (2009).
- Aguila, H. N., Pakes, S. P., Lai, W. C., Lu, Y. S. The effect of transportation stress on splenic natural killer cell activity in C57BL/6J mice. Laboratory Animal Science. 38 (2), 148-151 (1988).
- Landi, M. S., Kreider, J. W., Lang, C. M., Bullock, L. P. Effects of shipping on the immune function in mice. American Journal of Veterinary Research. 43 (9), 1654-1657 (1982).
- Menees, K. B., et al. Sex- and age-dependent alterations of splenic immune cell profile and NK cell phenotypes and function in C57BL/6J mice. Immunity & Ageing. 18 (1), 3 (2021).
- Shaw, A. C., Goldstein, D. R., Montgomery, R. R. Age-dependent dysregulation of innate immunity. Nature Reviews Immunology. 13 (12), 875-887 (2013).
- Starr, M. E., Saito, M., Evers, B. M., Saito, H. Age-associated increase in Cytokine production during systemic inflammation-II: the role of IL-1beta in age-dependent IL-6 upregulation in adipose tissue. The Journals of Gerontology. Series A, Biological Sciences and Medical Sciences. 70 (12), 1508-1515 (2015).
- Bruce, M., et al. Acute peripheral immune activation alters cytokine expression and glial activation in the early postnatal rat brain. Journal of Neuroinflammation. 16 (1), 200 (2019).
- Mader, S. L., Libal, N. L., Pritchett-Corning, K., Yang, R., Murphy, S. J. Refining timed pregnancies in two strains of genetically engineered mice. Lab Animal. 38 (9), 305-310 (2009).
- Heyne, G. W., et al. A simple and reliable method for early pregnancy detection in inbred mice. Journal of the American Association for Laboratory Animal Science. 54 (4), 368-371 (2015).
- Hutchinson, E., Avery, A., VandeWoude, S. Environmental enrichment for laboratory rodents. ILAR Journal. 46 (2), 148-161 (2005).
- Bayne, K. Environmental enrichment and mouse models: Current perspectives. Animal Models and Experimental Medicine. 1 (2), 82-90 (2018).
- Toth, L. A., Kregel, K., Leon, L., Musch, T. I. Environmental enrichment of laboratory rodents: the answer depends on the question. Comparative Medicine. 61 (4), 314-321 (2011).
- Sparling, J. E., Barbeau, K., Boileau, K., Konkle, A. T. M. Environmental enrichment and its influence on rodent offspring and maternal behaviours, a scoping style review of indices of depression and anxiety. Pharmacology Biochemistry and Behavior. 197, 172997 (2020).
- Xiao, R., Ali, S., Caligiuri, M. A., Cao, L. Enhancing effects of environmental enrichment on the functions of natural killer cells in mice. Frontiers in Immunology. 12, 695859 (2021).
- Girbovan, C., Plamondon, H. Environmental enrichment in female rodents: considerations in the effects on behavior and biochemical markers. Behavioural Brain Research. 253, 178-190 (2013).
- Mueller, F. S., Polesel, M., Richetto, J., Meyer, U., Weber-Stadlbauer, U. Mouse models of maternal immune activation: Mind your caging system. Brain, Behavior, and Immunity. 73, 643-660 (2018).
- Mueller, F. S., et al. neuroanatomical, and molecular correlates of resilience and susceptibility to maternal immune activation. Molecular Psychiatry. 26 (2), 396-410 (2021).
- Nyffeler, M., Meyer, U., Yee, B. K., Feldon, J., Knuesel, I. Maternal immune activation during pregnancy increases limbic GABAA receptor immunoreactivity in the adult offspring: implications for schizophrenia. Neuroscience. 143 (1), 51-62 (2006).
- Babri, S., Doosti, M. H., Salari, A. A. Strain-dependent effects of prenatal maternal immune activation on anxiety- and depression-like behaviors in offspring. Brain, Behavior, and Immunity. 37, 164-176 (2014).
- Vigli, D., et al. Maternal immune activation in mice only partially recapitulates the autism spectrum disorders symptomatology. Neuroscience. 445, 109-119 (2020).
- Malkova, N. V., Yu, C. Z., Hsiao, E. Y., Moore, M. J., Patterson, P. H. Maternal immune activation yields offspring displaying mouse versions of the three core symptoms of autism. Brain, Behavior, and Immunity. 26 (4), 607-616 (2012).
- Shin Yim, Y., et al. Reversing behavioural abnormalities in mice exposed to maternal inflammation. Nature. 549 (7673), 482-487 (2017).
- Ito, H. T., Smith, S. E., Hsiao, E., Patterson, P. H. Maternal immune activation alters nonspatial information processing in the hippocampus of the adult offspring. Brain, Behavior, and Immunity. 24 (6), 930-941 (2010).
- Zuckerman, L., Weiner, I. Maternal immune activation leads to behavioral and pharmacological changes in the adult offspring. Journal of Psychiatric Research. 39 (3), 311-323 (2005).
- Mueller, F. S., Polesel, M., Richetto, J., Meyer, U., Weber-Stadlbauer, U. Mouse models of maternal immune activation: Mind your caging system. Brain, Behavior, and Immunity. 73, 643-660 (2018).
- Careaga, M., Murai, T., Bauman, M. D. Maternal immune activation and autism spectrum disorder: from rodents to nonhuman and human primates. Biological Psychiatry. 81 (5), 391-401 (2017).
- Lazic, S. E., Essioux, L. Improving basic and translational science by accounting for litter-to-litter variation in animal models. BMC Neuroscience. 14, 37 (2013).
- Spencer, S. J., Meyer, U. Perinatal programming by inflammation. Brain, Behavior, and Immunity. 63, 1-7 (2017).
- Mouihate, A., Kalakh, S. Maternal Interleukin-6 hampers hippocampal neurogenesis in adult rat offspring in a sex-dependent manner. Developmental Neuroscience. 43 (2), 106-115 (2021).
- Zhang, Z., van Praag, H. Maternal immune activation differentially impacts mature and adult-born hippocampal neurons in male mice. Brain, Behavior, and Immunity. 45, 60-70 (2015).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır