Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Akustoakışkan Mikrocihaz Temelinde Hücre ve Çekirdeğin Sıkıştırılabilirliğinin Ölçülmesi
Bu Makalede
Özet
Burada, akustoakışkan mikrocihaza dayalı hücre veya çekirdek sıkıştırılabilirliğini ölçmek için hızlı ve tahribatsız bir sistem oluşturmak için bir protokol sunulmaktadır. Epitelyal-mezenkimal geçiş veya iyonlaştırıcı radyasyon sonrası tümör hücrelerinin mekanik özelliklerinde meydana gelen değişiklikler araştırılarak bu yöntemin bilimsel araştırma ve klinik pratikte uygulama olasılığı ortaya konmuştur.
Özet
Hücre mekaniği tümör metastazında, hücrelerin malign transformasyonunda ve radyosensitivitede önemli rol oynamaktadır. Bu işlemler sırasında, hücrelerin mekanik özelliklerini incelemek genellikle zordur. Sıkıştırma veya germe gibi temasa dayalı geleneksel ölçüm yöntemleri, hücre hasarına neden olmaya, ölçüm doğruluğunu ve ardından hücre kültürünü etkilemeye eğilimlidir. Yapışkan durumdaki ölçümler, özellikle ışınlamadan sonra doğruluğu da etkileyebilir, çünkü iyonlaştırıcı radyasyon hücreleri düzleştirir ve yapışmayı arttırır. Burada akustoakışkan yönteme dayalı bir hücre mekaniği ölçüm sistemi geliştirilmiştir. Hücre sıkıştırılabilirliği, askıya alınmış durumda hızlı ve tahribatsız ölçüm yapabilen akustik kuvvetin etkisi altında hücre hareket yörüngesinin kaydedilmesiyle elde edilebilir. Bu yazıda çip tasarımı, numune hazırlama, yörünge kaydı, parametre çıkarma ve analiz protokolleri ayrıntılı olarak anlatılmaktadır. Farklı tipte tümör hücrelerinin sıkıştırılabilirliği bu yönteme dayanarak ölçüldü. Çekirdeğin sıkıştırılabilirliğinin ölçülmesi, piezoelektrik seramiğin rezonans frekansını ve mikrokanalın genişliğini ayarlayarak da sağlandı. İmmünofloresan deneylerinin moleküler düzeyde doğrulanması ile birlikte, ilaca bağlı epitelden mezenkimal geçişe (EMT) öncesi ve sonrası hücre sıkıştırılabilirliği karşılaştırıldı. Ayrıca, farklı dozlarda X-ışını ışınlamasından sonra hücre sıkıştırılabilirliğinin değişmesi ortaya çıkmıştır. Bu yazıda önerilen hücre mekaniği ölçüm yöntemi evrensel ve esnektir ve bilimsel araştırma ve klinik uygulamada geniş uygulama beklentilerine sahiptir.
Giriş
Hücre mekanik özellikleri tümör metastazında, hücrelerin malign transformasyonunda ve radyosensitivitede önemli rol oynar 1,2. Yukarıdaki süreçte hücre mekanik özelliklerinin rolünü derinlemesine anlamak için, hücresel mekaniğin doğru ölçümü kritik öneme sahiptir ve ölçüm, sonraki kültür ve analiz için hücrelere zarar vermemelidir. Ölçüm işlemi mümkün olduğunca hızlı olmalıdır, aksi takdirde hücreler yetiştirme ortamından uzun süre çıkarılırsa hücre canlılığı etkilenebilir.
Mevcut hücre mekaniği ölçüm yöntemleri bazı sınırlamalarla karşı karşıyadır. Manyetik bükümlü sitometri, manyetik cımbız ve parçacık izleme mikroreolojisi gibi bazı yöntemler, parçacıkların hücrelere girmesi nedeniyle hücre hasarına neden olur 3,4,5. Atomik kuvvet mikroskobu (AFM), mikropipet aspirasyonu, mikro daralma ve paralel plaka tekniği gibi hücrelerle temas yoluyla ölçüm yapan yöntemler de hücre hasarına eğilimlidir ve verimin 6,7,8 oranında artması zordur. Ek olarak, iyonlaştırıcı radyasyon hücreleri düzleştirecek ve yapışmalarını artıracaktır9; bu nedenle süspansiyondaki tüm hücre mekaniğini ölçmek gerekir.
Yukarıdaki zorluklara yanıt olarak, akustoakışkan yöntem10,11,12,13,14'e dayanan bir hücre mekaniği ölçüm sistemi geliştirilmiştir. Kanal genişliği akustik yarım dalga boyuna eşleştirilir, böylece mikrokanalın orta hattında durağan bir dalga düğümü oluşturulur. Akustik radyasyon kuvvetinin etkisi altında, hücreler veya standart boncuklar akustik basınç düğümüne hareket edebilir. Standart boncukların fiziksel özellikleri (boyut, yoğunluk ve sıkıştırılabilirlik) bilindiğinden, akustik enerji yoğunluğu belirlenebilir. Daha sonra, akustik alandaki hücrelerin hareket yörüngelerinin kaydedilmesiyle hücre sıkıştırılabilirliği elde edilebilir. Süspansiyon durumundaki hücrelerin tahribatsız yüksek verimli ölçümü sağlanabilir. Bu yazıda mikroakışkan çipin tasarımı, sistemin kurulması ve ölçüm adımları tanıtılacaktır. Yöntemin doğruluğunu doğrulamak için çeşitli tümör hücrelerinin ölçümü yapılmıştır. Bu yöntemin uygulama kapsamı, piezoelektrik seramiğin rezonans frekansı ve mikrokanalın genişliği ayarlanarak hücre altı yapılara (çekirdek gibi) genişletilmiştir. Ek olarak, ilaca bağlı EMT veya farklı dozlarda X-ışını ışınlamasından sonra hücre sıkıştırılabilirliğindeki değişiklikler araştırılmıştır. Sonuçlar, bu yöntemin biyokimyasal değişiklikler ve hücresel mekanik özellikler arasındaki korelasyonu incelemek için güçlü bir araç olarak geniş uygulanabilirliğini göstermektedir.
Protokol
1. Akustoakışkan mikrocihazın imalatı ve montajı
- Mikroakışkan çipin imalatı.
- Şekil 1'de gösterildiği gibi yalnızca bir giriş ve çıkışa sahip tek kanallı bir çip tasarlayın. Hücreleri ölçmek için, mikrokanalın dikdörtgen kesitini 740 μm genişliğinde ve 100 μm derinliğinde tutun. Hücre çekirdeğini ölçmek için, mikrokanalın genişliğini ve derinliğini sırasıyla 250 μm ve 100 μm olarak değiştirin.
- Reaktif iyon aşındırma yoluyla silikon gofret üzerindeki mikrokanalı hazırlayın. Mikrokanalın üst kısmını, anodik yapıştırma15 ile şeffaf ısıya dayanıklı bir cam parçası ile kapatın. Talaşları 10 dakika boyunca ultrasonik temizleyici ile yıkayın. Daha sonra kullanmak üzere 50 °C'de bir etüv fırınında kurulayın.
- Polidimetilsiloksan (PDMS) blokları imal edin.
- 100 mm (çapında) cam kaba 30 mL prepolimer ekleyin. Bir şırınga ile prepolimere 3 mL kürleme maddesi ekleyin.
NOT: Kürleme maddesinin ve ön polimerin hacim oranı 1:10'dur. - PDMS ön polimerini ve kürleme maddesini yaklaşık 10 dakika boyunca bir cam çubukla kuvvetlice karıştırın. Çözeltide, PDMS ön polimerinin ve kürleme maddesinin iyi karıştırıldığını gösteren küçük ve düzgün bir şekilde ayrılmış hava kabarcıkları arayın.
- Cam kabı vakumlu bir kurutucuya yerleştirin ve 15-25 s için tahliye edin. Karışımda hava kabarcığı kalmayana kadar bu işlemi tekrarlayın.
- Karışımın sertleşmesi için cam kabı 1 saat boyunca 50 °C'de ayarlanmış bir etüv fırınına yerleştirin. Kuluçkadan sonra, PDMS'yi yaklaşık 1,2 cm uzunluğunda ve 1 cm genişliğinde uygun boyutta bloklar halinde kesmek için bir neşter kullanın.
NOT: PDMS bloğunun uzunluğu, çipin genişliği ile tutarlıdır ve çip üzerine iki PDMS bloğu yapıştırıldığında piezoelektrik seramik için ortada yeterli alan olduğundan emin olmak için genişlik seçilir.
- 100 mm (çapında) cam kaba 30 mL prepolimer ekleyin. Bir şırınga ile prepolimere 3 mL kürleme maddesi ekleyin.
- PDMS bloğunu çipe bağlayın.
- Giriş ve çıkış portları için PDMS bloğunda 1 mm çapında içi boş iğneli delikler açın. PDMS bloklarını ve çipi (arka tarafı yukarı) 1 dakika boyunca bir plazma temizleyiciye koyun.
- PDMS bloklarındaki delikleri çip girişi ve çıkışı ile hizalayın. PDMS bloklarını çipe 15 saniye boyunca yavaşça bastırın. Bu, PDMS blokları ile çipin yüzeyi arasında yapışmanın gerçekleşmesine neden olmalıdır.
- Politetrafloroetilen (PTFE) kateteri çipe bağlayın (Şekil 2B).
- İç çapı 0,8 mm ve uzunluğu 10 cm olan iki parça PTFE kateteri kesin. İç çapı 0,7 mm ve uzunluğu 1,5 cm x 90° olan paslanmaz çelik bir iğneyi L şeklinde bükün. Kateterin bir ucuna bağlayın. İğnelerle iki kateter hazırlayın.
- Paslanmaz çelik iğneleri PDMS bloklarının deliklerine yerleştirin. Giriş için, bir şırınga için bir konektör olarak kateterin diğer ucuna 19 G'lik bir dağıtım iğnesi bağlayın.
- Yukarıdaki adımları tamamladıktan sonra, genel kanalın sızdırmazlığını test etmek için deiyonize su enjekte edin. Suya karşı geçirimsiz, iyi bir sızdırmazlık anlamına gelir.
- Piezoelektrik seramik montaj (Şekil 2C)
- 2 cm çapındaki piezoelektrik seramik levhaları 5 mm genişliğinde dört şerit halinde kesmek için bir elmas tel kesici kullanın.
- Piezoelektrik seramiğin rezonans frekansının çip mikrokanalının genişliğiyle eşleştiğinden emin olun. 740 μm ve 250 μm genişliğindeki mikro kanal için, sırasıyla 1 MHz ve 3 MHz rezonans frekanslarına sahip piezoelektrik seramikler kullanın.
- Piezoelektrik seramiğin her iki tarafındaki kaynak telleri bir ucunda.
- Piezoelektrik seramiği çipin arkasının ortasına siyanoakrilat yapıştırıcı ile yapıştırın.
- Yapıştırıcıyı eşit şekilde yaymak için, piezoelektrik seramiğe bir damla yapıştırıcı yerleştirin, yapıştırıcıyı bir kürdan ile pürüzsüzleştirin ve fazla yapıştırıcıyı çıkarın. Ardından, çipin üzerine hızlıca bastırın ve yaklaşık 1 dakika boyunca basmaya devam edin. Piezoelektrik seramiğin ve çipin sıkıca bağlandığından ve eşit şekilde temas ettiğinden emin olun.
- Mikro cihazı takın (Şekil 2D).
- Mikrocihazın tabanı olarak bir parça PDMS (yaklaşık 1,5 cm uzunluğunda ve 1 cm genişliğinde) kesin. Çift taraflı bant kullanarak, tabanın bir tarafını giriş ve çıkış PDMS bloklarına, diğer tarafını şeffaf bir cam kızağa yapıştırın. Çipi tek bir odak düzleminde tutmak için tüm mikro cihazı mikroskop aşamasına sabitleyin.
2. Numune hazırlama
- Polistiren standart partikül çözeltilerinin hazırlanması.
- 10 mL fosfat tamponlu saline (PBS) 0,05 mL polistiren partikül (6 μm çapında) çözeltisi (2,1 x 108 parçacık / mL) ekleyin ve iyice karıştırın.
NOT: Akustik enerji yoğunluğunun değişmesinden kaynaklanan ölçüm hatasını azaltmak için, polistiren parçacık çözeltisi, kalibrasyon olarak her deneyde numune çözeltisi ile karıştırılmıştır.
- 10 mL fosfat tamponlu saline (PBS) 0,05 mL polistiren partikül (6 μm çapında) çözeltisi (2,1 x 108 parçacık / mL) ekleyin ve iyice karıştırın.
- Hücre süspansiyonlarının hazırlanması.
- Yapışkan hücreleri (örneğin, MCF7, MDA-MB-231, HCT116) PBS ile% 90 akıcılıkta (~ 5 x 105 hücre) yıkayın. Oda sıcaklığında (25 °C) 1-2 dakika boyunca 500 μL %0,25 tripsin (1x) ekleyin. Tripsini çıkarın, 1 mL tam ortam ekleyin ve pipetleme ile bir hücre süspansiyonu oluşturun.
- Hücre süspansiyonunu 5 dakika boyunca 100 x g'de santrifüj yapın. Süpernatantı çıkarın ve bir hücre süspansiyonu elde etmek için 0.5-1 mL PBS'de yeniden askıya alın. Hücreler hemositometre ile sayıldı ve konsantrasyon yaklaşık 3-5 x 105 hücre / mL idi.
- Hücre çekirdeği süspansiyonunun hazırlanması
- Adım 2.2'yi uygulayın. Daha sonra, süpernatantı çıkarın ve 20 μL hücre peleti (yaklaşık 5 milyon hücre) başına 200 μL sitoplazmik protein ekstraksiyon reaktifi A (% 1 PMSF ile desteklenmiş) ekleyin ve iyice karıştırın.
- Yukarıdaki karışımı 5 s için 220 x g'da vorteks yapın ve ardından 10 dakika boyunca buz banyosuna koyun. Kuluçkadan sonra, çözeltiye 10 μL sitoplazmik protein ekstraksiyon reaktifi B ekleyin.
- 5 s için 220 x g'de vorteks. 1 dakika boyunca buz banyosuna koyun ve 5 s için 220 x g'de tekrar vorteks. Ardından, son olarak, 4 ° C'de 5 dakika boyunca 1.000 x g'de santrifüj yapın.
NOT: Sitoplazmik protein ekstraksiyon reaktifleri A ve B'nin hacim oranı 20: 1'dir. - Süpernatantı çıkarın ve peleti 1 mL PBS içinde yeniden askıya alın. Ardından, 4 dakika boyunca 4 ° C'de 1.000 x g'de santrifüj yapın. Süpernatantı çıkarın ve hücre çekirdeği süspansiyonu olarak 100 μL PBS'de yeniden askıya alın.
- Yukarıdaki hücre çekirdeği süspansiyonuna tripan mavisi ekleyin ve oda sıcaklığında (25 ° C) 4 dakika boyunca lekeleyin. Tripan mavisi çözeltisinin çekirdek süspansiyonuna hacim oranı 1:1'dir. Ters çevrilmiş mikroskop altındaki çekirdek sayısını 10x hedefle sayın.
NOT: Mikroskop altında hücre çekirdeklerini net bir şekilde tanımlamak için, tripan mavisi boyama gereklidir. Tripan mavisi çözeltisi, etkili boyama için kullanılmadan önce 10 dakika boyunca 37 ° C'lik bir su banyosunda olmalıdır. - Yukarıdaki hücre çekirdeği süspansiyonunu PBS tamponu ile 2-3 x 105 çekirdek/mL konsantrasyonda seyreltin. Hücre çekirdeği süspansiyonunu 70 μm'lik bir elek ile filtreleyin.
3. Hücre ve çekirdeğin sıkıştırılabilirliğinin ölçülmesi
- Ölçüm sistemini kurma (Şekil 3)
- Mikroskobun ışık kaynağını açın ve kamera yazılımını açın. Mikrokanalın orta konumunu, yani piezoelektrik seramiğin konumunu bulmak için 4x hedefini kullanın.
- Telleri bağlayın ve sırasıyla piezoelektrik seramik üzerindeki sinyal jeneratörü çıkışının pozitif ve negatif terminallerine kaynak yapın.
- Şırıngayı mikroenjeksiyon pompasına yerleştirin ve giriş kateterine bağlayın. Mikrokanaldan akan sıvıyı tutmak için çıkış kateterinin sonuna küçük bir kap yerleştirin.
- Ölçüm parametrelerini belirleme
- Polistiren partikül çözeltisini şırınga ile aspire edin ve çip mikrokanalına enjekte edin. Doğru ölçüm sağlamak için çip mikro kanalındaki hava kabarcıklarından kaçının. Parçacıkların çip mikro kanalında eşit olarak dağıtıldığından emin olun.
NOT: Ölçüm akış veya şırınga pompası olmadan gerçekleştirilebilir. Gerekirse, mikroenjeksiyon pompasının akış hızı uygun bir değere ayarlanmalıdır. Burada, akış hızı aralığı 0-20 μL / s'dir. - Sinyal üretecinin çıkışını 1 MHz (hücre çekirdeği ölçümü için 3 MHz) frekanslı ve 10 V'luk tepeden tepeye voltaja (Vpp) sahip bir sinüs sinyaline ayarlayın.
- Parçacıkların mikrokanalın orta hattına doğru hareket ettiği ve orta hatta ulaştıktan sonra orta hat boyunca ileri yönde hareket halinde kaldığı gözlemlenene kadar sinyalin frekansına ince ayar yapın (Şekil 4).
NOT: Orta hatta doğru hareket eden parçacıkların hızı, 5 Vpp ile 20 Vpp arasında ayarlanabilen voltaj genliği ile belirlenir.
- Polistiren partikül çözeltisini şırınga ile aspire edin ve çip mikrokanalına enjekte edin. Doğru ölçüm sağlamak için çip mikro kanalındaki hava kabarcıklarından kaçının. Parçacıkların çip mikro kanalında eşit olarak dağıtıldığından emin olun.
- Hücreleri ve çekirdekleri ölçme
- 1 mL hücre veya çekirdek süspansiyonunu standart parçacık çözeltisi ile 1: 1 oranında karıştırın ve bir şırınga ile mikrokanala enjekte edin.
- Hücreler veya çekirdekler görüş alanına girdiğinde CCD kamera ile kayda başlayın. Ardından, sinyal üretecini açın. Hücreler veya çekirdekler orta hatta ulaştığında kaydı durdurun.
- Mikrokanalı daha sonra kullanmak üzere sırayla deiyonize su,% 75 alkol ve deiyonize su ile durulayın.
4. Veri işleme
- Parçacık veya hücre yörüngelerini eşleyin.
- Çekilen videoyu ImageJ yazılımına aktarın: Dosya > Açık> Klasör Seç. İlgilenilen hücreyi ve bitişik parçacığını seçmek için ImageJ yazılımının araç çubuğundaki elips şekline tıklayın (Şekil 5).
- Şekil 5'te gösterildiği gibi, ImageJ yazılımındaki ölçüm parametrelerini Analiz→ Set Ölçümü →Alan, Centroid, Ekran Etiketi olarak ayarlayın.
- Hedef hücrenin veya parçacığın uzunlamasına yer değiştirmeden geçtiği çerçeveyi başlangıç çerçevesi olarak almak; mikrokanalın orta çizgisine ulaşana kadar her karedeki hücrenin veya parçacığın piksel konumunu ve boyutunu kaydedin. Verileri bir elektronik tablo dosyası olarak dışa aktarın ve ilgilenilen tüm hücreler için yörüngeler elde edilene kadar adımı tekrarlayın.
- Dönüşümü ve düzeltmeyi koordine edin.
- Bu görüş alanındaki mikrokanalın dört köşesinin piksel koordinatlarını (0, y1), (0, y2), (x3, y3), (x4, y4) olarak kaydedin. Burada x3 = x4.
- Her ölçüm noktası (xi, yi) için, aşağıdaki formülleri kullanarak rotasyon düzeltmesinden sonra yeni koordinatı (xi', yi') hesaplayın:
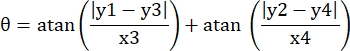
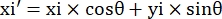

- Piksel koordinatlarını gerçek boyutlu koordinatlara dönüştürün. Gerçek koordinatlar, piksel koordinatlarının oranla çarpılmasıyla elde edilebilir. Oran, mikro kanalın gerçek genişliğinin, mikro kanalın piksel genişliğine (H) bölünmesiyle elde edilen orandı.
- Adım 4.1'de elde edilen hücrelerin ve parçacıkların piksel koordinatlarını son hareket yörüngesi verilerine dönüştürün ve düzeltin. Tüm koordinatlar sol alt köşenin koordinatlarını eksi alır, yani (0, y2). Videonun kare hızı saniyede 40 karedir, bu nedenle parçacık hareketinin zamanını elde etmek için her koordinata karşılık gelen kare sayısını 0,025 s ile çarpın, böylece konumun zamanla y yönünde değişmesini sağlayın.
- Akustik enerji yoğunluğunu hesaplayın (Şekil 6A,B).
- Hücrenin veya parçacığın Y yönündeki hareketi, akustik kuvvet F ac ve hidrodinamik kuvvet FD tarafından tahrik edilir. Aşağıdaki formülleri kullanarak hareket yörüngesini hesaplayın:
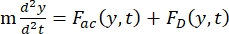 (1)
(1)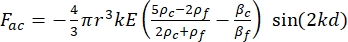 (2)
(2)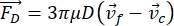 (3)
(3)
burada r ve D , hücrenin veya parçacığın yarıçapı ve çapı, ρ ve β yoğunluk ve sıkıştırılabilirlik, ν hız vektörüdür. c ve f alt simgeleri sırasıyla hücreyi ve sıvıyı gösterir. d , en yakın akustik basınç düğümüne olan mesafedir, μ akışkanın dinamik viskozitesi, k dalga numarasıdır ve E akustik enerji yoğunluğudur.
NOT: MCF7, HCT116, A549 ve hücre çekirdeklerinin yoğunluğu sırasıyla 1068 kg/m 3, 1077 kg/m 3, 1073 kg/m 3 ve 1155 kg/m 3 12,16,17 idi. - Adım 4.3.1'de açıklanan formüllere göre, sonlu fark yöntemiyle akustik alan altındaki standart parçacık yörüngesi için sayısal çözümü elde etmek üzere MATLAB yazılımını kullanın.
- Önceden ayarlanmış akustik alan aralığında, akustik enerji yoğunluğunu değiştirin ve standart parçacık için sayısal çözeltiyi (adım 4.3.2'de elde edilen) ve ölçülen hareket yörüngesini (adım 4.2'de elde edilen) sığdırın. Montaj ortalama kare hatasına göre en uygun sonucu seçin. Burada elde edilen akustik enerji yoğunluğu, hücre sıkıştırılabilirliğinin daha sonraki hesaplanması için bir parametre olarak kullanılır.
- Hücrenin veya parçacığın Y yönündeki hareketi, akustik kuvvet F ac ve hidrodinamik kuvvet FD tarafından tahrik edilir. Aşağıdaki formülleri kullanarak hareket yörüngesini hesaplayın:
- Hücre sıkıştırılabilirliğini hesaplayın (Şekil 6C,D).
- Akustik enerji yoğunluğunu adım 4.3.3'te elde edilen değere ayarlayın.
- Adım 4.3.1'de açıklanan formüllere göre, sonlu fark yöntemiyle akustik alan altındaki hücre yörüngesi için sayısal çözümü elde etmek için MATLAB yazılımını kullanın.
- Adım 4.3.3'e benzer şekilde, önceden ayarlanmış sıkıştırılabilirlik aralığında, sıkıştırılabilirliği değiştirin ve sayısal çözeltiyi (adım 4.4.2'de elde edilen) ve hücre için ölçülen hareket yörüngesini (adım 4.2'de elde edilen) sığdırın. Ölçülen hücre sıkıştırılabilirliği olarak en uygun sonuca karşılık gelen sıkıştırılabilirlik katsayısını kullanın.
Sonuçlar
Burada, çalışma, akizoakışkan mikrocihaza dayanan hızlı ve tahribatsız bir hücre sıkıştırılabilirlik ölçüm sisteminin inşası için bir protokol sundu ve farklı durumlarda hücre ve çekirdeğin ölçülmesinde avantajlarını gösterdi. Şekil 1 , mikroakışkan kanalın şemasını göstermektedir. Akustoakışkan mikrocihazın bileşenleri ve montajı Şekil 2'de gösterilmiştir. Şekil 3 , ölçüm sisteminin...
Tartışmalar
Yaygın olarak kullanılan hücre mekaniği ölçüm yöntemleri AFM, mikropipet aspirasyonu, mikroakışkanlar yöntemleri, paralel plaka tekniği, optik cımbız, optik sedye ve akustik yöntemlerdir20. Mikroakışkanlar yöntemleri üç yaklaşımla çalışabilir: mikro daralma, uzatma akışı ve kesme akışı. Bunlar arasında optik sedye, optik cımbız, akustik yöntemler, ekstansiyonel akış ve kesme akışı yaklaşımları temassız ölçümlerdir. Temas ölçümlerinin aksine, temass...
Açıklamalar
Yazarların rakip finansal çıkarları veya diğer çıkar çatışmaları yoktur.
Teşekkürler
Bu çalışma, Çin Ulusal Doğa Bilimleri Vakfı (Hibe numaraları 12075330 ve U1932165) ve Çin'in Guangdong Eyaleti Doğa Bilimleri Vakfı (Hibe numarası 2020A1515010270) tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 0.25% trypsin(1x) | GIBCO | 15050-065 | |
| 502 glue | Evo-bond | cyanoacrylate glue | |
| A549 | ATCC | CCL-185 | lung adenocarcinoma |
| Cytonucleoprotein and cytoplasmic protein extraction kit | Beyotime | P0027 | Contains cytoplasmic protein extraction reagents A and B |
| Dulbecco’s modified Eagle medium (DMEM) | corning | 10-013-CVRC | |
| Fetal Bovine Srum(FBS) | AUSGENEX | FBS500-S | |
| HCT116 | ATCC | CCL247 | colorectal carcinoma |
| Heat-resistant glass | Pyrex | ||
| Leibovitz’s L-15 medium | GIBCO | 11415-064 | |
| MCF-7 | ATCC | HTB-22 | breast Adenocarcinoma |
| MDA-MB-231 | ATCC | HTB-26 | breast Adenocarcinoma |
| Minimum Essential Medium (MEM) | corning | 10-010-CV | |
| Penicillin-Streptomycin | GIBCO | 15140-122 | |
| Phosphate buffer | corning | 21-040-cvc | |
| PMSF | Beyotime | ST506 | 100mM |
| Polybead Polystyrene Red Dyed Microsphere | polysciences | 15714 | The diameter of microshpere is 6.00µm |
| propidium iodide(PI) | Sigma-Aldrich | P4170 | |
| SYLGARD 184Silicone ELASTOMER | Dow-Corning | 1673921 | Contains prepolymers and curing agents |
| Trypan Blue | Beyotime | C0011 |
Referanslar
- Wirtz, D., Konstantopoulos, K., Searson, P. C. The physics of cancer: the role of physical interactions and mechanical forces in metastasis. Nature Reviews. Cancer. 11 (7), 512-522 (2011).
- Frame, F. M., et al. HDAC inhibitor confers radiosensitivity to prostate stem-like cells. British Journal of Cancer. 109 (12), 3023-3033 (2013).
- Tseng, Y., Kole, T. P., Wirtz, D. Micromechanical mapping of live cells by multiple-particle-tracking microrheology. Biophysical Journal. 83 (6), 3162-3176 (2002).
- Möller, W., Brown, D. M., Kreyling, W. G., Stone, V. Ultrafine particles cause cytoskeletal dysfunctions in macrophages: role of intracellular calcium. Particle and Fibre Toxicology. 2, 7 (2005).
- Wang, X., et al. A three-dimensional magnetic tweezer system for intraembryonic navigation and measurement. IEEE Transactions on Robotics. 34 (1), 240-247 (2018).
- Machida, S., et al. Direct manipulation of intracellular stress fibres using a hook-shaped AFM probe. Nanotechnology. 21 (38), 385102 (2010).
- Bufi, N., et al. Human primary immune cells exhibit distinct mechanical properties that are modified by inflammation. Biophysical Journal. 108 (9), 2181-2190 (2015).
- Hogan, B., Babataheri, A., Hwang, Y., Barakat, A. I., Husson, J. Characterizing cell adhesion by using micropipette aspiration. Biophysical Journal. 109 (2), 209-219 (2015).
- Jung, J. -. W., et al. Ionising radiation induces changes associated with epithelial-mesenchymal transdifferentiation and increased cell motility of A549 lung epithelial cells. European Journal of Cancer. 43 (7), 1214-1224 (2007).
- Hartono, D., et al. On-chip measurements of cell compressibility via acoustic radiation. Lab-on-a-Chip. 11 (23), 4072-4080 (2011).
- Sitters, G., et al. Acoustic force spectroscopy. Nature Methods. 12 (1), 47-50 (2015).
- Augustsson, P., Karlsen, J. T., Su, H. -. W., Bruus, H., Voldman, J. Iso-acoustic focusing of cells for size-insensitive acousto-mechanical phenotyping. Nature Communications. 7 (1), 11556 (2016).
- Cushing, K. W., et al. Ultrasound characterization of microbead and cell suspensions by speed of sound measurements of neutrally buoyant samples. Analytical Chemistry. 89 (17), 8917-8923 (2017).
- Riaud, A., Wang, W., Thai, A. L. P., Taly, V. Mechanical characterization of cells and microspheres sorted by acoustophoresis with in-line resistive pulse sensing. Physical Review Applied. 13 (3), 034058 (2020).
- Petersson, F., Aberg, L., Swärd-Nilsson, A. -. M., Free Laurell, T. flow acoustophoresis: microfluidic-based mode of particle and cell separation. Analytical Chemistry. 79 (14), 5117-5123 (2007).
- Griwatz, C., Brandt, B., Assmann, G., Zänker, K. S. An immunological enrichment method for epithelial cells from peripheral blood. Journal of Immunological Methods. 183 (2), 251-265 (1995).
- Katholnig, K., Poglitsch, M., Hengstschläger, M., Weichhart, T. Lysis gradient centrifugation: a flexible method for the isolation of nuclei from primary cells. Methods in Molecular Biology. 1228, 15-23 (2015).
- Fu, Q., Zhang, Y., Huang, T., Liang, Y., Liu, Y. Measurement of cell compressibility changes during epithelial-mesenchymal transition based on acoustofluidic microdevice. Biomicrofluidics. 15 (6), 064101 (2021).
- Zhang, Y., et al. Ionizing radiation-induced DNA damage responses affect cell compressibility. Biochemical and Biophysical Research Communications. 603, 116-122 (2022).
- Hao, Y., et al. Mechanical properties of single cells: Measurement methods and applications. Biotechnology Advances. 45, 107648 (2020).
- Yousafzai, M., et al. Effect of neighboring cells on cell stiffness measured by optical tweezers indentation. Journal of Biomedical Optics. 21 (5), 057004 (2016).
- Wei, M. -. T., et al. A comparative study of living cell micromechanical properties by oscillatory optical tweezers. Optics Express. 16 (12), 8594-8603 (2008).
- Khan, Z. S., Vanapalli, S. A. Probing the mechanical properties of brain cancer cells using a microfluidic cell squeezer device. Biomicrofluidics. 7 (1), 011806 (2013).
- Hirawa, S., Masudo, T., Okada, T. Acoustic recognition of counterions in ion-exchange resins. Analytical Chemistry. 79 (7), 3003-3007 (2007).
- Joosse, S. A., Gorges, T. M., Biology Pantel, K. detection, and clinical implications of circulating tumor cells. EMBO Molecular Medicine. 7 (1), 1-11 (2015).
- Martin, O. A., Anderson, R. L., Narayan, K., MacManus, M. P. Does the mobilization of circulating tumour cells during cancer therapy cause metastasis. Nature Reviews Clinical Oncology. 14 (1), 32-44 (2017).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır