Method Article
Bir Memeli Konağında Aktif Enfeksiyon Sırasında Candida albicans Mutant Suşlarında Morfogenez Fenotiplerini Taramak için In Vivo Görüntülemenin Kullanımı
Bu Makalede
Özet
Bu makalede, non-invaziv konfokal mikroskopi kullanılarak bir memeli konakçısında aktif enfeksiyon sırasında morfogenez fenotipleri için orta büyüklükte Candida albicans mutant kütüphanelerinin taranması için bir yöntem anlatılmaktadır.
Özet
Candida albicans önemli bir insan patojenidir. Morfolojik formlar arasında geçiş yapabilme yeteneği, patogenezinin merkezindedir; Bu morfolojik değişiklikler, çevresel uyaranlara yanıt olarak kontrol edilen karmaşık bir sinyal ağı tarafından düzenlenir. Bu düzenleyici bileşenler oldukça çalışılmıştır, ancak hemen hemen tüm çalışmalar filamentasyonu tetiklemek için çeşitli in vitro uyaranlar kullanmaktadır. Patogenez sürecinde morfogenezin nasıl düzenlendiğini belirlemek için, memeli konakçısında hifal oluşumu geçiren organizmaların yüksek uzamsal çözünürlüklü görüntülerini elde etmek için bir in vivo mikroskopi sistemi geliştirdik. Burada sunulan protokol, bu sistemin C. albicans mutant suşlarının küçük koleksiyonlarını taramak için kullanımını açıklamakta ve enfeksiyon bölgesinde meydana gelen morfogenezin anahtar düzenleyicilerini tanımlamamıza izin vermektedir. Transkripsiyonel regülatör Efg1 gibi bazı morfogenez düzenleyicilerinin in vitro ve in vivo tutarlı fenotiplere sahip olduğunu, oysa adenil siklaz (Cyr1) gibi diğer düzenleyicilerin in vitro'ya kıyasla in vivo olarak anlamlı derecede farklı fenotiplere sahip olduğunu gösteren temsili sonuçlar sunulmuştur.
Giriş
Candida albicans, mukokutanöz hastalığa, yayılmış hastalığa ve lokalize doku enfeksiyonlarına neden olan yaygın bir insan mantar patojenidir1. C. albicans fizyolojisinin önemli bir özelliği, hem kommensal hem de patojen 2,3,4 olarak rolüyle bağlantılı olan karmaşık polimorfik büyümesidir. 30 ° C'de in vitro zengin besin koşulları altında, tipik olarak oval tomurcuklanan bir maya olarak büyür. Besin yoksunluğu, pH değişiklikleri, 37 ° C'de büyüme, seruma maruz kalma ve agar'a gömüldüğünde büyüme dahil olmak üzere çeşitli çevresel tetikleyiciler, polarize bir büyüme modeline geçişle sonuçlanır ve gerçek hiflerin ve / veya psödohifaların oluşumuna neden olur5. Polarize büyümenin başlaması ve bunun sonucunda filamentli organizmaların büyümesi morfogenez olarak adlandırılır.
Morfogenezin organizmanın virülansındaki önemi nedeniyle, hifal oluşumunun düzenlenmesi kapsamlı bir şekilde incelenmiştir 6,7. Morfogenezi tetikleyen karmaşık bir sinyal yolları ve transkripsiyonel düzenleme ağı vardır. C. albicans morfogenezinin patogenez ile ilişkisine rağmen, morfogenezi araştıran çoğu çalışmada hifal oluşumunu tetiklemek için in vitro uyaranlar kullanılmıştır. Çeşitli in vitro filamentasyon modellerinin, uyarılan bireysel düzenleyici yollar açısından aynı olmadığı giderek daha açık hale gelmektedir. Ayrıca, in vitro büyüme koşulları, konağın karmaşık ortamına sıkı sıkıya karşılık gelmez. C. albicans'ın bir insan patojeni olarak önemi göz önüne alındığında, bu protokolün amacı, bir memeli konakçısında aktif enfeksiyon sırasında morfogenezini orta derecede verime sahip bir sistem kullanarak araştırmak ve böylece bir araştırmacının C. albicans mutant kütüphanelerini taramasına izin vermektir.
Bu araştırmaları kolaylaştırmak için, ters çevrilmiş bir konfokal mikroskop 8,9,10 kullanılarak anestezi uygulanmış bir farenin pinnasının enfeksiyonu sırasında C. albicans hücrelerinin yüksek uzamsal çözünürlüklü görüntülerini elde etmemizi sağlayan bir in vivo görüntüleme sistemi geliştirilmiştir. İğnenin derisi oldukça ince olduğu için doku diseksiyonuna gerek kalmadan bu görüntüler elde edilebilir. Böylece, kantitatif fenotip verileri, konakçı doku içindeki aktif enfeksiyonların bulunduğu yerde ölçülebilir. Burada açıklanan protokol, bir referans suşun ve farklı floresan protein ekspresyon kasetleri11,12 ile bir veya daha fazla mutant suşun dönüşümünü içerir. Floresan protein eksprese eden suşlar daha sonra karıştırılır ve intradermal olarak birlikte enjekte edilir. Enfeksiyon kurulduktan sonra, hem filamentasyon sıklığını hem de oluşan filamentlerin uzunluğunu ölçmek için konfokal görüntüleme kullanılır. Mutant suşlardan elde edilen veriler, aynı doku bölgesinde bulunan referans suştan elde edilene normalleştirilerek iç kontrol sağlanır. Bu sistem, birçoğu in vitro 9,10 morfogenez defektlerine sahip birkaç dizi C. albicans mutant suşunu başarıyla taramamızı sağlamıştır. Bu suşların birçoğu in vivo olarak kolayca filament yaparak, morfogenezin araştırılması için in vivo modellerin önemini vurgulamaktadır.
Protokol
Bu protokoldeki çalışmalar Iowa Üniversitesi Kurumsal Hayvan Bakımı ve Kullanımı Komitesi (IACUC) tarafından onaylanmıştır. BSL2 organizmaları ile çalışmak için ekipman ve prosedürler için CDC kılavuzlarına bakınız13.
1. Candida albicans suşlarının hazırlanması
- Pozitif kontrol olarak kullanılmak üzere uygun bir referans gerinimi belirleyin. Bu suşun, soyu ve genetik manipülasyonları açısından deneysel suşlarla yakından eşleştiğinden emin olun.
NOT: Burada sunulan temsili deneyler için, mutantlar SN152'den inşa edilen Homann, et al.14'te açıklanan suşlardan yaratılmıştır. Bu mutantlar Arg-'dır. Bu nedenle, seçilen referans suşu SN152'den oluşturulan ve aynı zamanda Arg-olan SN250 idi. Beslenme stresörleri, maya Saccharomyces cerevisiae15'te polarize büyümenin düzenlenmesinde kritik öneme sahiptir; ayrıca C. albicans ve diğer mantarlarda filamentasyona da karışmışlardır16,17,18. Bu nedenle, referans suşu, beslenme stresinden kaynaklanan potansiyel kafa karıştırıcı etkilerden kaçınmak için mümkün olduğunda deneysel suşlarla auxotrophies için eşleştirilmelidir. - Floresan protein ekspresyon yapılarını seçin. Çeşitli deneysel suşları tararken, bir floresan proteinini ifade eden bir referans suşu oluşturun ve mutant suşları işaretlemek için diğer floresan proteinleri kullanın.
NOT: Burada sunulan temsili veriler, referans gerinim için NEON ve mutant gerinimler için iRFP kullanır. Herhangi bir floresan protein, yüksek oranda eksprese edilmiş, nispeten parlak ve kullanılan mikroskop tarafından uyarılabilir / tespit edilebilirse kullanılabilir. Farklı floresan proteinlerini ifade eden referans suşlarını karşılaştıran kontrol deneyleri, floresan protein ekspresyonunun morfogenez üzerinde herhangi bir etkisi göstermemiştir. - Floresan protein ekspresyon yapıları ile suşları dönüştürün.
NOT: Birçok kurum, C. albicans ile çalışmak için Biyolojik Güvenlik Seviye 2 önlemlerinin kullanılmasını gerektirir. Tüm çalışmalar yerel güvenlik yönetmeliklerine uygun olmalıdır. Yerel düzenlemelerden bağımsız olarak, C. albicans ile çalışan araştırmacılar, organizmanın güvenli kullanımı konusunda eğitilmelidir.- Standart lityum asetat protokollerini kullanarak referans ve deneysel suşları dönüştürün19.
NOT: Burada açıklanan deneyler, Dr. RobertWheeler 11,12 tarafından cömertçe sağlanan pENO1-NEON-NAT R ve pENO1-iRFP-NATR plazmidlerini kullanmaktadır. Plazmidler NotI9 kullanılarak doğrusallaştırıldı. - Nourseothricin veya diğer ilgili seçim ortamlarında büyümeye dayalı dönüştürücüleri seçin.
- Başarılı dönüştürücüleri tanımlayın. Bir kürdan kullanarak her koloniden küçük bir hücre damlası seçin ve ardından bunları mikroskop slaytında 2.5 μL'lik bir damla suya karıştırın. Bir kapak lipi uygulayın ve 10x-40x büyütmede inceleyin. Konfokal görüntüleme sistemi (protokolün geri kalanı için kullanılır) veya herhangi bir standart geniş alan floresan mikroskobu ile inceleyin. Uygun transformantlar, uygun uyarma ve emisyon dalga boylarına sahip parlak bir sinyale sahip olacaktır.
NOT: Temsili sonuçlar için, NEON eksprese eden suşlar, 472/30 nm bandpass uyarma filtresi, 520/35 nm bandpass emisyon filtresi ve 495 nm tek kenarlı dikroik ışın ayırıcı ile uzun geçirgen filtre setine sahip dik bir floresan mikroskobu kullanılarak görselleştirilmiştir. iRFP gözle görülmediğinden, iRFP eksprese eden suşlar, in vivo görüntüleme için kullanılan konfokal mikroskopi sistemi kullanılarak, uyarma için 638 nm lazer kullanılarak ve 655-755 nm'den emisyon ışığını tespit ederek görselleştirildi.- Alternatif olarak, floresan stereomikroskopi, el tipi floresan uyarma sistemleri veya tipik olarak jeller ve Batı lekeleri için kullanılan floresan algılama sistemlerini kullanarak makroskopik koloni floresansını değerlendirin.
- Seçilen dönüştürücülerin dondurucu stoklarını oluşturun.
- Standart lityum asetat protokollerini kullanarak referans ve deneysel suşları dönüştürün19.
- YPD (maya özü pepton dekstroz) katı ortamını, enjeksiyondan 3 gün önce flüoresan proteini eksprese eden bir referans ve dondurucu stoklarından deneysel suşlarla aşılayın, dondurucu stoğundan YPD katı ortamına bir parça organizma aktarmak için bir kürdan kullanın. 2 gün boyunca 30 ° C'de inkübe edin.
- Her suş için, enjeksiyondan 1 gün önce birkaç koloniden alınan C. albicans hücreleri ile 25 mL YPD içeren bir şişeyi aşılayın. Bunu, bir koloniden YPD'ye bir parça organizma aktarmak için bir kürdan kullanarak yapın; Birkaç farklı koloniden hücre elde etmek için birkaç kez tekrarlayın. 175 rpm'de bir orbital çalkalayıcı inkübatöründe 30 ° C'de gece boyunca inkübe edin.
NOT: İnokulum için bir kaynak olarak birden fazla koloni kullanmak önemlidir, çünkü C. albicans yüksek sıklıkta spontan genetik değişikliklere sahiptir. İnokulum kültürüne başlarken birden fazla koloni kullanmak, inokulumdaki tüm organizmaların önemli spontan değişikliklere sahip bir ebeveynden ortaya çıkma şansını en aza indirir. - Enjeksiyon gününde:
- 500 x g'da 2 dakika boyunca kültürün 1 mL'sini santrifüj edin.
- Kültürü 1 mL steril Dulbecco'nun fosfat tamponlu salini (dPBS) ile üç kez yıkayın. Son yıkamadan sonra, peleti 1 mL steril dPBS içinde yeniden askıya alın.
- Yıkanmış kültürün bir örneğini 1:100'de seyreltin ve bir hemositometre kullanarak sayın.
- dPBS kullanarak yıkanmış kültürün yoğunluğunu mL başına 1 x 108 organizmaya ayarlayın.
- Enjekte edilecek her bir suş seti için, referans gerinimin ve deneysel suşların eşit hacimlerini karıştırarak inokulumu oluşturun. Bu, inokulumun yoğunluğunu mL başına 1 x 108 organizmada tutar.
NOT: Kulak başına değerlendirilebilecek suşların sayısı, kullanılan mikroskopi sisteminin her bir floresan proteininden gelen sinyali açıkça ayırt etme yeteneği ile sınırlıdır. - İnokulum hazırlandıktan sonra, doğrudan hayvan enjeksiyonlarına devam edin. Kullanmadan önce inokulumu saklamayın.
2. Hayvan hazırlığı
- Yerel Kurumsal Hayvan Bakım ve Kullanım Komitesi'nden veya ilgili yerel yönetim organından onay alın.
- Bir satıcıdan veya üreme programından 6-12 haftalık fareler edinin. Ev fareleri, aşılamadan önce en az 1 hafta boyunca deney boyunca yaşayacakları tesiste.
NOT: Temsili sonuçlar için 6 haftalık dişi DBA2/N fareler kullanıldı. - Hayvanları aşılamadan en az 7 gün önce klorofil içermeyen chow besleyin.
3. Epilasyon ve aşılama
- Cerrahi anestezi düzlemini indükleyin (Şekil 1).
DİKKAT: Solunan anestezik ajanlar tehlikeli maddelerdir ve göz veya cilt tahrişine ve sinir sistemi toksisitesine neden olabilir. Solunan anesteziklerin kullanımı için tüm kurumsal politika ve prosedürler ile genel laboratuvar güvenliği uygulamalarına uyulmalıdır. Sadece inhale anesteziklerin kullanımı konusunda eğitilmiş kişiler bu adımları gerçekleştirebilir. Standart uygulamalar arasında eldiven giymek, laboratuvar önlüğü, göz koruması, anestezi temizleyici sisteminin kullanılması ve kurumsal yönergelere göre dikkatli kayıt tutma yer almaktadır.- Önceden ısıtılmış bir anestezi indüksiyon odasına bir fare yerleştirin. Genel anestezi boyunca hayvanı sıcak bir ortamda tutun. Bunu, bu amaç için tasarlanmış ısıtma pedleri ve ısıtılmış bir mikroskop aşaması kullanarak gerçekleştirin. Aşırı ısınabileceği ve yanıklara neden olabileceği için tezgah üstü bir ısıtma yastığı kullanmayın.
- Fare sağ refleksini kaybedene ve solunumlar yavaş ve sabit olana kadar indüksiyon odasına% 2-3 izofluran sağlayın. Anestezinin indüksiyon odasını temizleyin ve hayvanı% 1 -% 2 izofluran sağlayan solunum yapmayan bir burun konisine aktarın.
- Ayak parmağı sıkışma refleksini veya diğer doğrulama mekanizmalarını kullanarak anestezi düzlemini doğrulayın. Deney boyunca, hayvanın solunum paternini ve anestezik düzlemini izleyin ve anestezik konsantrasyonu gerektiği gibi ayarlayın.
- Kornea kurumasını önlemek için göz yağlayıcısı uygulayın.
- Epilasyon (Şekil 1C,D)
- Pamuk uçlu bir çubuk kullanarak her iki kulağın iç ve dış yüzeyine reçetesiz satılan tüy dökücü kremi serbestçe uygulayın.
- 2-3 dakika sonra (veya üreticinin talimatlarına göre), tüm krem ve saçları çıkarmak için kulağı kuru bir gazlı bezle hafifçe silin. Tüy dökücü krema kalıntılarını tamamen gidermek için steril suya doymuş gazlı bezlerle iki kez daha silin. Tüm tüy dökücü kremlerin çıkarılmaması cilt tahrişine / iltihabına neden olur.
- Enjeksiyon (Şekil 1E, F)
- Enjekte edilecek kulağın yüzeyini% 70 etanol içine doymuş bir gazlı bezle silin ve havanın kurumasını bekleyin.
- İnokulumu, birden çok kez ters çevirerek veya girdap yaparak iyice karıştırın.
- Bir insülin şırıngasına 20-30 μL inokülum çekin. İğneyi yukarı bakacak şekilde tutarak, namludaki herhangi bir havanın üstte olduğundan emin olmak için şırıngaya hafifçe dokunun. Havayı ve fazla inokulumu, piston 10 μL işaretinde olacak şekilde inokulum tüpüne veya bir atık tüpüne dikkatlice geri atın.
- Baskın olmayan elin parmağına veya baş parmağına bir hırsızlık takarak, kulağı zımba boyunca sararak stabilize edin. Alternatif olarak, tezgah üstü çift taraflı cilt bandını (moda bandı) küçük bir konik veya yuvarlak tabanlı plastik tüpe uygulayın ve kulağı bant boyunca örtün. Bunu yaparken anestezi burun konisini yerinden çıkarmamaya özen gösterin. Burun konisini çalışma yüzeyine bantlamak yararlı olabilir.
NOT: Kulağın iç veya dış tarafı, araştırmacının fiziksel rahatlığına bağlı olarak enjekte edilebilir. Mikroskopi için, fareyi, enjekte edilen kulağın tarafı objektif lense doğru bakacak şekilde yerleştirdiğinizden emin olun. - Şırınga iğnesini cilde neredeyse tamamen paralel tutarak ve büyük damarlardan kaçınarak, iğnenin ucunu eğim yeni kaplanana kadar cildin en dış tabakasına yerleştirin.
- İnokulumu intradermal olarak yavaşça enjekte edin. İyi bir intradermal enjeksiyon ciltte küçük bir kabarcık oluşturacaktır. Sızıntıyı en aza indirmek için iğneyi kulaktan çıkarmadan önce 15-20 s yerinde tutun.
- Hayvanın kulağının alt tarafı nemlenirse, iğne çok derindi ve kulaktan tamamen geçti. Bu durumda, enjeksiyonu kulağın farklı bir bölgesinde tekrarlayın.
- Hayvanın diğer kulağını kullanarak işlemi tekrarlayın. Bu, bir replika için aynı C. albicans suşlarıyla veya farklı bir C. albicans suşu kümesiyle yapılabilir.
- Hemen görüntülenmezse, hayvanı ısıtılmış bir iyileşme odasına yerleştirin. Anesteziden kurtulana kadar hayvanı gözlemleyin ve ardından barınma kafesine geri döndürün.
- Kurumsal protokolleri takiben, kafesi biyolojik tehlike etiketleriyle açıkça işaretleyin ve kafesteki hayvanlara Candida albicans bulaştığını belirtin.
- Hayvan anestezisi ve diğer gerekli kurumsal uygulamalarla ilgili gerekli tüm kayıt tutmayı tamamlayın.
- Hayvan Biyolojik Güvenlik Seviye 2 önlemlerini kullanarak hayvanı hayvan tesisi koşullarında barındırın.
4. İn vivo sonuçlarla karşılaştırmak için in vitro morfogenezi ölçün
- İnokulumu hazırlamak için kullanılan aynı yıkanmış kültürleri kullanarak, RPMI1640 +% 10 ısıl inaktive fetal sığır serumunda organizmaların 1:50 seyreltilmesini sağlayın ve 4 saat boyunca yuvarlanarak 37 ° C'de inkübe edin. Alternatif olarak, in vitro morfogenezi uyaran diğer ortamlar da kullanılabilir.
- Numuneyi 500 x g'de 5 dakika santrifüj yapın ve 0,5 mL dPBS'de yeniden askıya alın.
- Numuneyi 1:10 oranında seyreltin, seyreltilmiş numunenin 2.5 μL'sini mikroskop slaytına yerleştirin ve bir kapak kayması ile örtün.
- Floresan mikroskobu kullanarak numuneyi inceleyin. Her suş için maya ve filamentli hücrelerin sayısını kaydederek en az 100 hücre sayın. Burada sunulan temsili sonuçlarda, filamentli bir hücre, ana hücrenin uzunluğunun iki katından daha uzun olan herhangi bir hücre olarak tanımlanmaktadır.
NOT: İn vitro morfogenezin miktarı, hayvanların aşılanması ile aynı gün yapılabilir. İnokulumu enjeksiyon için hazırlarken in vitro morfogenez testini başlatmak ve 4 saatlik kuluçka döneminde hayvanların aşılamasını gerçekleştirmek mümkündür. Tüm hayvan prosedürleri 4 saatlik kuluçka süresinin bitiminden önce tamamlanırsa, doğrudan in vitro uyarılmış hücrelerin incelenmesine devam edin. Alternatif olarak, hücreler dPBS'de% 3.7 formaldehit içinde (adım 4.2'de) yeniden askıya alınabilir ve birkaç gün boyunca 4 ° C'de saklanabilir. Sabit organizmalar daha sonra zamanın izin verdiği ölçüde ölçülebilir. Hayvanların aşılanması, in vitro nicelleştirme testi için geciktirilmemelidir.
5. İn vivo görüntüleme için hazırlık
- Mikroskopu hazırlayın (Şekil 2A).
- Tüm mikroskopi ekipmanlarını açın ve görüntüleme yazılımını başlatın.
- Varsa, önceden belirlenmiş görüntüleme ayarlarını yükleyin.
- Kullanılan floresan proteinleri tespit etmek için gereken lazerleri ve dedektörleri etkinleştirin.
- Isıtılmış mikroskop aşamasını açın ve 37 ° C'ye kadar ısınmasına izin verin.
NOT: Isıtılmış bir sahne yerine tamamen kapalı bir çevre odasına sahip bir mikroskop kullanmak mümkündür. - Netleme düzlemi kapak kaymasının üst yüzeyinde olacak şekilde bir z ekseni referans noktası ayarlayın. Bu, sahne açıklığı üzerine bir kapak kayması bantlanarak ve kapak kaymasına bir damla su damlası konularak yapılabilir. Su damlacığının kenarına odaklanmak için daha düşük bir büyütme (10x) "kuru" hedefi kullanın ve ardından z ekseni referans noktasını ayarlayın. Sahneden çıkarmadan önce suyu kapak kaymasından emmek için bir parça havlu kullanın.
- Çok uzun çalışma mesafesi hedefini yerine döndürün ve lensin üzerine bir damla daldırma sıvısı yerleştirin. Kapak kapağını yerleştirirken olası hasarları önlemek için lensi indirin.
- Sahne açıklığının üzerine #1,5 kapak kapağı yerleştirin ve yerine bantlayın. Herhangi bir sıvının kapak kaymasının altında mikroskopa karışmasını önlemek için bandın kapak kaymasının tüm kenarlarını tamamen kapladığından emin olun. Daldırma sıvısının hem objektif lens hem de kapak kayması ile temas halinde olması için hedefi z ekseni referans noktasına yükseltin.
- Birden fazla basınca duyarlı bant parçası hazırlayın, böylece burun konisini ve fareyi konumlandırırken kullanıma hazır olurlar.
- Tüm mikroskopi ekipmanlarını açın ve görüntüleme yazılımını başlatın.
- Yukarıdaki gibi görüntülenmek üzere farede genel anesteziyi indükleyin (adım 3.1).
- Fareyi konumlandırın (Şekil 2B-D).
- Mikroskop aşamasında bir anestezi burun konisi, burun konisi hayvan görüntüleme için pozisyondayken hayvanın burnunu tamamen kaplayacak şekilde konumlandırılmıştır. Bu, iki araştırmacı ile daha kolay başarılabilir. İlk araştırmacının anestezi uygulanan farenin burnunu burun konisine yerleştirmesini sağlayın ve burun konisini hayvanın burnunun üzerinde tutmaya devam ederken fareyi görüntüleme için pozisyona getirin. Diğer araştırmacının burun konisini bantlamasını ve boruyu yerine oturtmasını sağlayın, böylece farenin burnunun üzerinde sabit bir şekilde oturur. Burun konisi yerine bantlandıktan sonra, görüntüleme seansının geri kalanında orada bırakın.
- Burun konisini yerleştirmek için en iyi yeri belirledikten sonra, konumunu not edin. Sonraki görüntüleme seansları için, burun konisi mikroskopa bir hayvan getirmeden önce aşamaya sabitlenebilir.
- Objektif lensin üzerindeki kapak kapağına bir damla steril su yerleştirin.
- Fareyi mikroskop aşamasına getirin. Kulağın su damlacığının üstünde olduğundan ve kapak kaymasına karşı düz olduğundan emin olun.
- Kulağı düzleştirmek için ikinci bir (üstteki) kapak kayması kullanın.
- Kapak kapağının kenarını farenin gövdesine paralel olarak, kenar kulağın kafayla buluştuğu yere dokunacak şekilde yerleştirin.
- Kapak kapağının serbest kenarını bir menteşe hareketi ile mikroskop aşamasına indirin. Kapak kayması mikroskop aşamasına karşı geldiğinde, kulağı düzleştirecektir. Kulakta kıvrımlar veya sırtlar oluşturmamaya dikkat edin.
- Üst kapak kaymasını güvenli bir şekilde yerine bantlayın, böylece kulağı düz tutmak için yeterli basıncı tutar. Farenin saçını veya bıyıklarını bantta yakalamamaya dikkat edin.
- Çevre odasına sahip bir mikroskop kullanılmadığı sürece, normotermik bir ortamı korumak için farenin vücudunu steril bir örtü ile gevşek bir şekilde örtün.
- Bir ilgi alanı belirleyin.
- Hedefin z ekseni referans noktasında olduğundan emin olun.
- Beyaz ışıklı/geniş alanlı görüntüleme özelliğini kullanarak odak düzlemini kulak dokusuna ayarlayın. İyi bir strateji kan damarlarına odaklanmaktır - eğer kan damarlarında hareket eden kırmızı kan hücreleri görülebilirse, odak düzlemi doku içindedir.
- Mikroskop geniş alan floresan yeteneği ile donatılmışsa, bir ilgi alanını tanımlamak için kullanın. Değilse, konfokal görüntüleme kullanın. Genel olarak, ilgi alanlarını tanımlamak için geniş alan mikroskobu kullanmak daha hızlıdır ve kulak dokusunun daha az ışınlanmasını gerektirir.
- Referans geriniminde ifade edilen floresan proteinini algılamak için bir filtre küpü kullanarak, referans geriniminden floresan sinyali olan bir görüş alanı tanımlayın. Odak dışı ışığın muhtemelen bireysel organizmalara odaklanma yeteneğini engelleyeceğini unutmayın. Bu adımın amacı, konfokal görüntüleme için bir ilgi alanı belirlemektir.
- Deneysel suşlar tarafından ifade edilen floresan proteini algılayacak ve seçilen görüş alanındaki varlıklarını doğrulayacak bir filtre küpüne geçin.
6. Görüntüleme
- Ayarları belirleyin.
- Görüntüleme yazılımı canlı konfokal moddayken, odak düzlemi z ekseni boyunca hareket ettirilirken ilgi alanını inceleyin. Kullanılan tüm floresan proteinlerinden güçlü bir sinyal içeren bir z ekseni düzlemi seçin.
- Görüş alanındaki tüm hücreler için morfolojinin belirlenebileceği kadar güçlü bir sinyal elde etmek için lazer gücünü ve / veya görüntüleme hızını ayarlayın. Doku hasarını önlemek için, mümkün olan en düşük lazer gücünü kullanın.
NOT: Tüm görüntülemelerde olduğu gibi, lazer gücü, edinme hızı ve çözünürlük arasında bir denge vardır. Kulak dokusunun ışınlanmasını en aza indirmek için hızı ve lazer gücünü dengelerken organizma morfolojisini net bir şekilde tanımlayan ayarları tanımlayın. Görüntüleme dış dermisten meydana geldiğinden, uyarma için slaytlara monte edilmiş geleneksel örneklerin konfokal görüntülemesi için tipik olarak gerekli olandan daha yüksek lazer gücü gereklidir. Neyse ki, morfolojinin analizi için gereken uzamsal çözünürlük seviyesi aşırı değildir. Böylece, doku hasarına neden olmadan organizma morfolojisini belirlemek için yeterli sinyale sahip görüntüler elde etmek kolayca elde edilebilir. - Bu parametreler belirlendikten sonra, sonraki görüntüleme oturumları için bir başlangıç noktası olarak hizmet etmek üzere bunları görüntüleme oturumu boyunca kullanın. Bu nedenle görüntüleme ayarlarının kaydedilmesi yararlı olacaktır.
NOT: Bireysel enfeksiyon alanları doku içinde daha sığ veya daha derin olabilir. Daha derin alanlar lazer gücünde bir artış gerektirebilir. Bu tahlil, sinyalin yoğunluğundan ziyade uzamsal dağılımına dayandığından, görüntü ayarlarının alanlar arasında gerektiği gibi değiştirilmesi kabul edilebilir.
- Görüntüleri edinin.
- Referans suşunda açık filament oluşumuna sahip olan ve çoğu organizmanın morfolojilerinin belirlenebileceği kadar yayıldığı bir görüş alanı seçin.
- Bir z-yığını için üst ve alt odak düzlemlerini ayarlayın. Enfekte alanın tüm derinliğini örtmek gerekli değildir, ancak görüntülenen hacmin üstündeki veya altındaki organizmaların tipik olarak analizden hariç tutulduğunu unutmayın.
- Z-stack görüntüleri alın, her bir suşu ayırt etmek için her kanalı sahte renklendirin ve kanalları kaplayın. Görüntüleri kaydedin.
- Diğer görüş alanları için bu işlemi tekrarlayın. Morfogenez bölgeden bölgeye değişebilir; bu nedenle, her kulaktan en az üç alanın edinilmesi ve analiz edilmesi önemlidir.
7. Manuel iki boyutlu analiz: Filamentasyon frekansı
- Z-yığınının iki boyutlu bir görüntüye maksimum projeksiyonunu gerçekleştirmek için görüntüleme yazılımını kullanın. Burada verilen talimatlar FIJI/Image J içindir.
- ImageJ yazılımını kullanarak mikroskopi görüntülerini açın.
- Gerekirse, her C. albicans suşunun doğrudan tanımlanmasına izin vermek için her kanala sahte bir renk uygulayın. Bunun için Image > Lookup Table (Resim > Arama Tablosu ) üzerine LUT Color (LUT Rengi) tıklayın ve seçilen sahte rengi seçin.
- Yığın dosyasını maksimum yoğunluklu projeksiyon iki boyutlu görüntüye dönüştürün:
- z-stack dosyasını seçin. Z projeksiyonu > Resim > yığınlarına tıklayın.
- Üst ve alt düzlemi seçin ve Maksimum Yoğunluk projeksiyon türünü seçin.
- Maksimum projeksiyon görüntülerinde görülen her organizmayı gerinim tipine (kanal rengiyle ayırt edilir) ve morfolojiye göre sayın.
- Önemli ölçüde örtüşen organizmalar veya çok yüksek organizma yoğunluğuna sahip alanların doğru bir şekilde sayılması zor olacaktır. Bunları sayımdan hariç tutun, ancak örtüşme olasılığı daha yüksek olan filamentli formlara karşı önyargı oluşturmamaya dikkat edin.
- Doğrudan z-yığınının içine veya dışına yansıyan filamentli formlar, maksimum projeksiyonda küçük yuvarlak nesneler olarak görünecektir. Benzer şekilde, görüntünün sınırı tarafından kesilen organizmalar maya gibi görünebilir, çünkü filament görüş alanının dışındadır. Bu nedenle, iki boyutlu analiz her zaman maya formlarının yüzdesini fazla tahmin edecektir. Bu, referans ve deneysel suş(lar)la eşit olarak gerçekleşeceğinden, deneysel sonuçları her zaman bir referans suşunkiyle karşılaştırın.
- Sonuçların deneysel tasarım tarafından dikte edildiği şekilde istatistiksel karşılaştırmalarını yapın.
8. Manuel iki boyutlu analiz: Filament uzunluğu
- C. albicans için, anormal filament oluşumu meydana gelebilir, çünkü: a) daha az "anne" maya hücresi morfogeneze uğrar, b) filamentler daha yavaş bir oranda büyür veya c) filamentli büyüme başlatılır ancak sürdürülmez. Bu olasılıkları değerlendirmek için, maksimum projeksiyon görüntüsündeki her bir filamentin eğri yolu uzunluğunu, gerçek üç boyutlu uzunluk için bir vekil olarak ölçün (aşağıda tartışılmıştır).
- Bir ana hücre üzerinde bir tomurcuk gelişirken, bir filament mi yoksa maya mı olacağını söylemek mümkün değildir. Bu analize yalnızca filamentli hücrelerin dahil edilmesini sağlamak için, yalnızca yavru hücrenin ana hücrenin en az iki katı uzunluğunda olduğu organizmaları ölçün.
- 7. adımda oluşturulan maksimum projeksiyon görüntüsünü açın.
- ImageJ araç setinde, Düz/ Segmentlere Ayrılmış çizgi aracını sağ tıklayın ve Segmentlere Ayrılmış Çizgi seçeneğini belirleyin. Parçalı çizgi seçeneği, kullanıcının kavisli bir yol boyunca filament uzunluğunu ölçmesini sağlar, bu da C. albicans filamentlerinin plastisitesi göz önüne alındığında bir zorunluluktur.
- Filament uzunluğunu tomurcuk boynundan filamentin büyüyen ucuna kadar ölçün. Tomurcuk boynuna sol tıklayın; işaretçi küçük bir kareye dönüşür. Filamenti uzunluğu boyunca izleyin, filamentin uzun ekseninde her eğri, dönüş veya değişiklik olduğunda filamentin merkezine tıklayın. Filamentin büyüyen ucuna çift tıklayın.
- Control + M tuşlarına basın. Bu, Alan, Ortalama, Min, Maks ve Uzunluk ölçümlerini tablolaştıran bir açılır pencere açar. Her filamenti ölçtükten sonra, akım ölçümünü ölçüm tablosuna eklemek için Control + M tuşlarına tekrar basın.
- Tüm filamentler ölçüldüğünde, uzunluk ölçümlerini kopyalayıp bir veri analiz dosyasına yapıştırın.
- Referans gerinim ve mutant suşundaki filament uzunluklarının dağılımını değerlendirmek için istatistiksel analiz yapın.
9. Manuel üç boyutlu analiz
- Maya formlarının abartılmasını önleyen ve psödohife ile hifaj arasında ayrıma izin verebilecek daha kesin bir morfogenez ölçümü elde etmek için, her organizmanın morfolojisini üç boyutlu olarak değerlendirirken z-yığını boyunca manuel olarak yukarı ve aşağı kaydırın.
- Alternatif olarak, her z-yığınının üç boyutlu bir görüntüsünü oluşturun ve görüntüyü döndürürken her organizmanın şeklini analiz edin.
10. Otomatik analiz
- Görüntüleme yazılımını kullanarak, organizmaların sayımını ve morfolojilerini iki veya üç boyutta otomatikleştirin.
NOT: Morfoloji türlerinin ayrımcılığı için bazı algoritmalar önyargıya neden olabilir. Bu nedenle, otomasyon stratejilerinin deneysel tasarımla ilgili olarak dikkatlice doğrulanması gerekir. İyi tasarlanmış ve doğrulanmış otomatik görüntü analizi, analiz adımının verimini artırabilir.
Sonuçlar
Burada sunulan sonuçlar daha önce yayınlanmış 9,10 raporlarına dayanmaktadır. Bu analizin amacı, mutant C. albicans suşlarının aktif enfeksiyonlar sırasında morfogeneze maruz kalma yeteneğini nicel olarak değerlendirmektir. Psödohifaları hiflerden ayıran tipik parametrelerin, kompleks bir in vivo ortamda üç boyutlu büyüyen organizmalarda değerlendirilmesi zor olabilir. Bu, özellikle konfokal görüntüleme tarafından oluşturulan iki boyutlu kesitlere bakıldığında geçerlidir. Bu nedenle, bu tarama analizi, mayaya karşı filamentli olarak büyüyen organizmaları tanımlamaya odaklanmıştır. Üç boyutlu rekonstrüksiyonlar da dahil olmak üzere daha derinlemesine bir analiz kullanan takip çalışmaları için, bu yöntem maya, hifaj ve psödohifaları ayırt etmek için uyarlanabilir.
Bir floresan proteinin C. albicans'ın bir referans veya mutant suşunda ekspresyonu, in vivo olarak gerinim morfolojisinin doğrudan tespit edilmesini sağlar (Şekil 3 ve Şekil 4). Genel olarak, nicel ışık mikroskobu analizi, görüntüdeki piksellerin çok azı veya hiçbiri doygun olmadığında en iyi şekilde gerçekleştirilir. Bununla birlikte, bu protokol için, görüntünün doygunluğu genellikle analizi basitleştirir. Floresan protein lokalizasyonu hücre boyunca homojen değildir ve genellikle ana mayada filamentlerden daha yüksektir. Neyse ki, morfogenezin araştırılması için, sinyalin yoğunluğundan ziyade uzamsal dağılımı sonucu tanımlar. Bu nedenle, birçok pikselin doygun olduğu görüntülerin elde edilmesi, bu tahlilde morfogenezi ölçme yeteneğini geliştirir.
Morfogenezin in vivo olarak değerlendirilmesinin önemini göstermek için, referans suşu (SN250) ve iki mutant için temsili sonuçlar sunulmuştur: biri transkripsiyon faktörü Efg1'den yoksun ve diğeri adenilil siklaz Cyr1'den yoksundur. In vitro, bu suşların hiçbiri filamentler20,21 olarak büyümez. % 10 serum ile desteklenmiş RPMI ortamında in vitro olarak yetiştirildiğinde, referans suş hızla filamentler oluştururken, efg1ΔΔ ve cyr1ΔΔ suşları oluşmaz (Şekil 3 ve Şekil 4). Bu koşullar altında, efg1ΔΔ mutantı biraz polarize büyüme gösterir, yavru hücreler ana hücrelere kıyasla hafifçe uzar. Bu, filamentasyonun net bir tanımını kullanmanın önemini vurgulamaktadır. Böyle bir tanım varsayılan olarak keyfidir, ancak fenotipin tutarlı bir şekilde değerlendirilmesi için gereklidir. Bu çalışmalar için, filamentli bir büyüme paterni, bir yavru hücrenin en uzun boyutuna ana hücrenin iki katından daha fazla olan bir organizma olarak tanımlanmaktadır. Bu tanımı kullanarak, uzatılmış efg1ΔΔ hücreleri filamentli değildir.
İn vitro fenotipiyle tutarlı olarak, efg1 ΔΔ in vivo olarak önemli bir filamentasyon defekti sergiler: efg1ΔΔ hücrelerinin yaklaşık% 9'u in vivo filamentler olarak büyüdü (Şekil 3). Buna karşılık, cyr1ΔΔ mutant hücrelerinin% 53'ü in vivo filamentler olarak büyüdü (Şekil 4). İn vivo filamentasyona uğrayan cyr1 ΔΔ mutant hücrelerinin sayısı referans suşundan önemli ölçüde daha düşük olmasına rağmen, cyr1ΔΔ mutantının in vivo filamentler oluşturma yeteneği, in vitro morfogenezin tamamen eksikliğinden önemli bir değişikliği temsil eder. Görsel olarak, cyr1ΔΔ mutantı tarafından oluşturulan filamentlerin referans suşundan daha kısa olduğu ortaya çıktı. Bunu nicel olarak değerlendirmek için, filamentli hücrelerin eğri yol uzunluğu, in vivo görüntülerin iki boyutlu bir projeksiyonu kullanılarak ölçülmüştür (Şekil 4E). Kir1 ΔΔ filamentlerinin medyan uzunluğu, referans suşun filamentlerinden% 29 daha kısaydı.
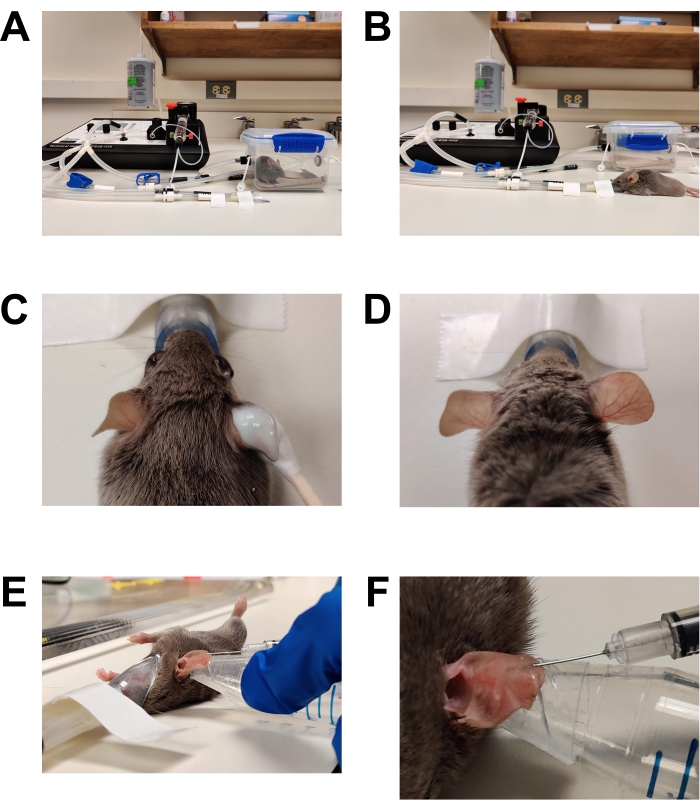
Şekil 1: Anestezi ve aşılama . (A) Bir indüksiyon odası kullanılarak anestezi indüksiyonu. (B) Anestezi, farenin gerektiği gibi yeniden konumlandırılmasına izin veren bir burun konisi kullanılarak sürdürülür. (C) Epilasyon kremi pamuk uçlu aplikatör kullanılarak uygulanır. Göz yağlama jeli, anestezi sırasında gözleri korumak için uygulanmıştır. (D) Sağ kulağın etkili epilasyonu. Tedavi edilmeyen sol kulakla karşılaştırın. (E) C. albicans'ın fare kulağına intradermal enjeksiyonu. Kulak, çift taraflı cilt bandı (moda bandı) ile sarılmış konik bir tüpün ucu kullanılarak yerinde tutulur. (F) İntradermal enjeksiyonun yakın çekimi. Deride soluk bir kabarcık oluşur, bu da başarılı bir intradermal yerleşimin bir işaretidir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.

Şekil 2: Görüntüleme için hazırlık . (A) Görüntüleme için hazırlanan mikroskop aşaması. Anestezi burun konisi yerine sabitlenir. Lens açıklığını kaplayan sahne alanına bir kapak kayması bantlanır. Ek bant parçaları mevcuttur. Isıtılmış aşama 37 ° C'ye kadar önceden ısıtılır (gösterilmemiştir). (B) Anestezi uygulanan farenin anestezi burun konisine yerleştirilmesi. (C) Fare, aşılanan kulağın yan tarafı alt kapak kaymasına/objektif lense bakacak şekilde hafifçe döndürülür. Kulak daha sonra alt kapak kaymasına karşı düzleştirilir ve kulağın üstüne ikinci bir kapak kayması yerleştirilerek yerine sabitlenir. (D) Üst kapak kayması, kulağı mikroskop aşamasına göre yerine sabitlemek için sahneye bantlanır. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.

Resim 3: Efg1ΔΔ mutant suşunun in vitro ve in vivo morfolojisi. (A) 4 saat boyunca 37 °C'de RPMI + %10 serumda büyüyen hücreler tarafından filamentasyonun in vitro indüksiyonundan sonra WT ve efg1ΔΔ mutant suşlarının geniş alan görüntüsü. Ölçek çubukları 10 μm'yi temsil eder. Görüntü kontrastı, görüntülemeyi kolaylaştırmak için fotoğraf düzenleme yazılımı kullanılarak ayarlandı. (B) WT ve efg1ΔΔ mutant suşlarında gözlenen in vitro filamentasyon yüzdesi. Und = tespit edilemez (hiçbir filament tespit edilmedi). Çubuk yüksekliği, en az 100 hücrenin ölçüldüğü üç bağımsız deneyden filamentli hücrelerin medyan yüzdesini temsil eder. Hata çubukları standart sapmayı gösterir (sonuçlar öğrencinin t-testi ile karşılaştırıldığında, p < 0.001). (C) WT (yeşil) ve efg1ΔΔ mutantının (kırmızı) konfokal mikrografisi, aşılama sonrası in vivo 24 saat büyür. Oklar, "filamentli" tanımımızı karşılayan efg1ΔΔ mutant hücrelerinin örneklerini gösterir. Ölçek çubuğu 50 μm. (D) WT ve efg1ΔΔ mutant suşlarında gözlenen in vivo filamentasyon yüzdesini temsil eder. Çubuk yüksekliği, iki bağımsız deneyden elde edilen filamentli hücrelerin medyan yüzdesini temsil eder. Hata çubukları standart sapmayı gösterir (sonuçlar öğrencinin t-testi ile karşılaştırıldığında, p < 0.001). Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
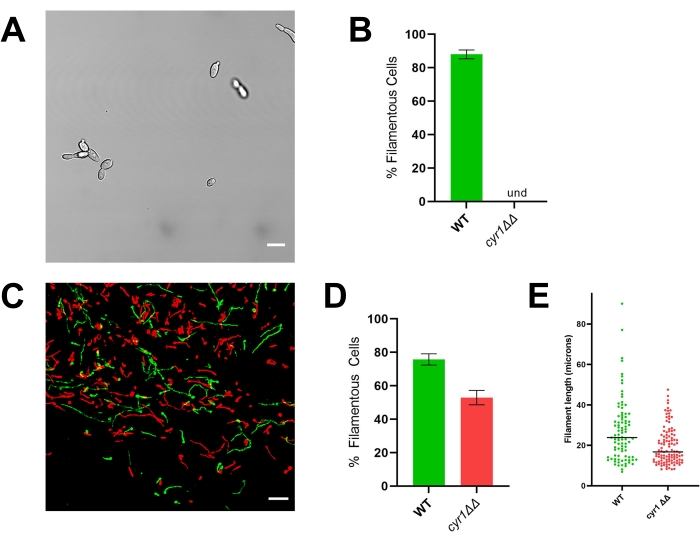
Şekil 4: Cyr1 ΔΔ mutant suşunun in vitro ve in vivo morfolojisi. (A) RPMI'da büyüyen hücreler tarafından filamentasyonun in vitro indüksiyonundan sonra cyr1ΔΔ mutant suşunun geniş alan görüntüsü + 4 saat boyunca 37 °C'de% 10 serum. Ölçek çubuğu 10 μm'yi temsil eder. Görüntü kontrastı, görüntülemeyi kolaylaştırmak için fotoğraf düzenleme yazılımı kullanılarak ayarlandı. (B) WT ve cyr1ΔΔ mutant suşlarında gözlenen in vitro filamentasyon yüzdesi. Und = tespit edilemez (hiçbir filament tespit edilmedi). Çubuk yüksekliği, en az 100 hücrenin ölçüldüğü üç bağımsız deneyden filamentli hücrelerin medyan yüzdesini temsil eder. Hata çubukları standart sapmayı gösterir (sonuçlar öğrencinin t-testi ile karşılaştırıldığında, p < 0.001). (C) WT (yeşil) ve cyr1ΔΔ mutantının (kırmızı) konfokal mikrografisi, aşılama sonrası in vivo 24 saat büyür. Ölçek çubuğu 50 μm'yi temsil eder. (D) WT ve cyr1ΔΔ mutant suşlarında gözlenen in vivo filamentasyon yüzdesi. Çubuk yüksekliği, iki bağımsız deneyden elde edilen filamentli hücrelerin medyan yüzdesini temsil eder. Hata çubukları standart sapmayı gösterir (sonuçlar öğrencinin t-testi ile karşılaştırıldığında, p < 0.001). (E) Z-yığınının iki boyutlu bir projeksiyonunda eğri yolu uzunluğu ile ölçülen filament uzunluğunun in vivo dağılımı. Her nokta bir filamentin uzunluğunu temsil eder. Maya olarak büyüyen hücreler bu analize dahil edilmedi. Çubuk medyan filament uzunluğunu gösterir. Uzunlukların dağılımı, bir Mann-Whitney U testi kullanılarak analiz edildiğinde anlamlı derecede farklıdır (p < 0.001). Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Bu model, bir memeli konağının dokusu içinde büyürken C. albicans organizmalarının görüntülerini elde etmek için konfokal mikroskopi kullanır, böylece aktif enfeksiyon sırasında morfogenez fenotiplerini değerlendirmemize izin verir. Morfogenez süreci C. albicans patogenezinin merkezindedir ve çeşitli in vitro tahliller 2,3,4 kullanılarak yaygın olarak incelenmiştir. Bununla birlikte, hiçbir in vitro test, konağın karmaşık biyokimyasal ve yapısal ortamını tam olarak modelleyemez.
Burada açıklanan protokol, enfeksiyon sırasında morfogenezde rol oynayan genleri tanımlamak için C. albicans mutantlarının bir serisini / kütüphanesini taramak için bu in vivo görüntüleme sisteminin kullanımına odaklanmıştır. Farklı floresan proteinleri ifade eden C. albicans suşlarının kullanımı, C. albicans mutant suşlarının in vivo morfogenezini referans suşunkine kıyasla ölçmemizi sağlar. Mutanttaki morfogenezi aynı enfeksiyon alanındaki referans suşu ile karşılaştırmak, organizmaların aynı ortamlara maruz kalmasını sağlar. Bu, filamentasyona tabi tutulan hücrelerin yüzdesinin ve filamentasyonun kapsamının nicel olarak ölçülmesini sağlar. Mutant suş(lar)ın ölçümlerinin referans suşunkilerle normalleştirilmesi, bir mutantın performansını diğeriyle daha iyi karşılaştırmamızı sağlar.
Burada sunulan temsili sonuçlar, in vitro ve in vivo fenotipler arasında önemli bir tutarsızlık potansiyelini göstermektedir. C. albicans efg1ΔΔ mutant suşu genellikle morfogenez testleri için negatif bir kontrol olarak kullanılır, çünkü hemen hemen tüm in vitro koşullarda filament yapamaz20. İn vivo sonuçlar in vitro sonuçlara çok benzer olmasına rağmen, bu ciddi şekilde engellenmiş suş bile zaman zaman konakçı doku ortamında filamentler oluşturmuştur (Şekil 3). Bu, morfogenezi tetiklemede konakçı ortamın gücünü vurgular.
Buna karşılık, cyr1ΔΔ mutant suşu, in vitro ve in vivo büyüme arasında önemli bir uyumsuzluk gösterir; mutant hücrelerin hiçbiri in vitro filamentasyona uğramasa da, hücrelerin yaklaşık yarısı in vivo filamentler halinde büyür (Şekil 4)10,21. İlginç bir şekilde, bu filamentler referans suşu tarafından oluşturulanlardan önemli ölçüde daha kısaydı, bu da CYR1'in filament büyüme hızına veya filamentli bir fenotipi sürdürme yeteneğine katkıda bulunduğunu düşündürmektedir. Filament uzunluğunun analizini kolaylaştırmak için, filamentlerin eğri yol uzunluğu, görüntülerin iki boyutlu bir projeksiyonu kullanılarak ölçülmüştür. Üç boyutlu büyüyen filamentlerin iki boyutlu projeksiyonlarında, xy düzlemine paralel olmayan bir eksende büyüyen herhangi bir filament, gerçek uzunluğundan daha kısa olarak yansıtılacaktır. Bu ön kısalma, referans suşu için de meydana geldiğinden, filament uzunluklarının iki boyutlu bir projeksiyondaki dağılımını değerlendirmek, referans ve mutant suşlar arasında nicel bir karşılaştırmaya izin verir. Filament uzunluğunun üç boyut yerine iki boyutta analizi daha az yoğun görüntü analizi gerektirir; Böylece, tipik bir masaüstü bilgisayarda nispeten hızlı bir şekilde gerçekleştirilebilir. Bu daha basit analizin kullanılması, filament uzunluğu dağılımının bir tarama protokolünün bir parçası olarak dahil edilmesine izin verir ve her mutantın verimde önemli gecikmelere neden olmadan morfogenez geçirme kabiliyetinin daha nüanslı bir şekilde anlaşılmasını sağlar.
Burada sunulan temsili çalışmalar, kompleman sistemlerinde nötrofillerin C. albicans enfeksiyonu22 bölgesine alınamamasına neden olan bir kusuru olan DBA2 / N fareleri kullanılarak gerçekleştirilmiştir. Bu çalışmaların amacı, konakçı doku içinde C. albicans filamentasyonunun regülasyon mekanizmalarını araştırmaktır. Bu nedenle, DBA2 / N fareleri, bireysel bir suşun nötrofillere duyarlılığı veya direnci nedeniyle sonuçların karıştırılmasını önlemek için kullanılmıştır. Nötrofil anti-C. albicans yanıtı filamentasyon23'ü etkileyebildiğinden, enfeksiyon bölgesine nötrofil alımı bir morfogenez testinin sonuçlarını etkileyebilir. Bir suş in vivo filamentleme yeteneğine sahipse, ancak nötrofiller mevcut olduğunda filamentasyondan güçlü bir şekilde inhibe edilirse, DBA2 / N farelerde filamentasyon tespit edilir, ancak bozulmamış nötrofil kemotaksisli fareler kullanılırken görülmesi olası değildir. Bu nedenle, konakçı olarak kullanılan farenin gerginliği, bu protokolü kullanırken önemli bir faktördür.
Efg1ΔΔ mutant suşunun in vivo filamentte başarısız olduğu gözleminin, konakçı nötrofil tepkileriyle ilişkili olması muhtemel değildir, çünkü bu suş da in vitro filamentte başarısız olur. Cyr1ΔΔ suşu ile in vivo olarak gözlenen filamentasyon, in vitro filamentasyona uymaması nedeniyle uyumsuzdur. C. albicans enfeksiyonunun zebra balığı modelinden elde edilen veriler, yanıt veren nötrofillerin morfogenez24'ün önlenmesinde önemli olduğunu göstermektedir. Bu nedenle, nötrofil yanıtlarından yoksun olan DBA2 / N farelerinin kullanımının, in vitro'ya kıyasla cyr1ΔΔ'nun in vivo filamentasyonundaki artışı hesaba katması muhtemel değildir. Bununla birlikte, in vivo ortam, cyr1ΔΔ suşunun morfogenezini açıkça etkilemektedir; Bu nedenle, bu suşun daha fazla araştırılması, aktif enfeksiyonlar sırasında C. albicans morfogenezinin düzenlenmesi hakkında önemli bilgiler sağlayabilir. Burada açıklanan protokol, gelecekteki çalışmalarda kullanılacak cyr1ΔΔ suşu gibi suşları tanımlamak için bir tarama testi olarak tasarlanmıştır.
Düşük akışlı gaz anestezi sisteminin kullanılması bu protokol için çok yararlıdır (Şekil 1A,B). Bu protokolün ilk gelişimi sırasında, fareler ksilazin ile karıştırılmış enjekte edilebilir bir ketamin anestezik kokteyli kullanılarak anestezi altına alındı. Bu anestezik yöntemle sınırlı görüntüleme yapmak mümkün olsa da, anestezi süresi tahmin edilemezdi, bu da görüntüleme sırasında farenin anesteziden iyileşmesini önlemek için görüntüleme seanslarının hızlı bir şekilde sonlandırılmasını gerektiriyordu. Geleneksel inhale anestezik sistemler hantaldır ve genellikle bir duman davlumbazında kullanılmalarını gerektiren yüksek oranda anestezik gaz akışı gerektirir. Bu nedenle, geleneksel inhale anestezik sistemlerin, araştırmacıları yanlışlıkla anestezik ajanlara maruz bırakmadan konfokal bir mikroskobun alan kısıtlamaları ile kullanılması çok zor olacaktır. Düşük akışlı inhale anestezik sistemin kullanılması, araştırmacı için güvenli bir ortam sağlarken hayvanın tutarlı anestezisine izin verir. Düşük akışlı burun konisi, hayvanın hem aşılama hem de mikroskopi için kolay konumlandırılmasını sağlar. Küçük kalibreli, düşük hacimli dağıtım borusu, anestezi makinesinin mikroskopiye müdahale etmemek için yeterli bir mesafeye yerleştirilmesini sağlayan nispeten uzun tüplerin kullanılmasına izin verir.
Tipik fare chow'unda bulunan klorofil, önemli doku otofloresansına yol açar25. Bu, görüntülerde önemli miktarda parazit oluşturarak yüksek kaliteli, yüksek uzamsal çözünürlüklü görüntüler elde etmeyi zorlaştırır. Hayvanlara görüntülemeden önceki 7 gün boyunca klorofil içermeyen chow beslendiğinde, otofloresanın arka planı dokuda önemli ölçüde azaldı, ancak saçta biriken klorofil sorunlu olmaya devam etti. Reçetesiz satılan kimyasal tüy dökücü krem kullanılarak pinnadaki saçların çıkarılması, saçtaki otofloresansı en aza indirmede etkilidir (Şekil 1C,D). Böylece, klorofil içermeyen chow ve yeterli epilasyon kombinasyonu, otofloresanı önemli ölçüde azalttı ve görüntü kalitesini önemli ölçüde artırdı. Görüntüleme öncesinde saçlar kulaktan çıkarıldığı için hayvanın saçının rengi bu sistemi etkilemez. Bu protokol, BALB / c (beyaz), C57BL / 6 (siyah) ve DBA2 / N (kahverengi) farelerde C. albicans enfeksiyonlarını incelemek için başarıyla kullanılmıştır. Protokol, çeşitli konakçı genlerinde eksik olan C57BL / 6 nakavt fareleri ile de kullanılabilir; Bu, memeli konakçı bağışıklık sisteminin filamentasyonu nasıl etkilediğine dair gelecekteki araştırmalara izin verecektir. Bu modelin bu protokolde tartışılmayan bir özelliği, bu görüntüleme sistemi invaziv olmadığı için, aynı hayvanın birkaç gün boyunca tekrar tekrar görüntülenebilmesi ve zaman içinde bireysel enfeksiyonun ilerlemesini takip etmesine izin vermesidir. Bu özellik, konakçı-patojen etkileşimi üzerine gelecekteki çalışmalarda önemli bir rol oynayacaktır.
Özetle, bu protokol, canlı bir memeli konağının dokusunda büyüyen C. albicans'ın yüksek uzamsal çözünürlüklü görüntüleriyle sonuçlanır ve mutant suşlarda morfogenezin doğru bir şekilde değerlendirilmesine olanak tanır 8,9,10. Burada sunulan sonuçlar, bu protokolün C. albicans mutantlarının bir kütüphanesini taramak için nasıl kullanılabileceğini göstermektedir. Bugüne kadar test edilen C. albicans mutantlarından, in vitro morfogenezde bilinen kusurları olan mutantların büyük bir kısmı kolayca in vivo 9,10 filamentasyona uğrar. Bu, C. albicans patogenezinin mekanizmalarını aydınlatmak için tasarlanmış deneylere bunun gibi bir in vivo sistemin dahil edilmesinin önemini vurgulamaktadır.
Açıklamalar
Yazarların açıklayacağı bir çıkar çatışması yoktur.
Teşekkürler
Bu çalışma NIH hibe 1R01AI33409 ve Iowa Üniversitesi Carver Tıp Fakültesi, Pediatri Bölümü tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| #1.5 coverslips | Thermo-Fisher | 20811 | large enough to cover the universal stage opening |
| 0.1 mL Insulin syringes | EXELint | 26018 | Can use syringes that are 5/16"–1/2" long and 29–32 G |
| 3.7% formaldehyde in dPBS | Sigma-Aldrich | SHBJ5734 | |
| 70% Ethanol/30% water | Decon Laboratories | A05061001A | |
| Alcohol prep pads | Covidien | 5110 | Alternative: gauze pads soaked in 70% isopropyl alcohol |
| C.albicans reference strain and experimental strains | SN250 | FGSC Online Catalog | The specific C. albicans strain varies with experiment and the investigators goals. We have used strains derived from SC5314 as well as other clinical isolates. |
| Chlorophyl free mouse chow | Envigo | 2920x | |
| Computer | Dell | Optiplex 7050 | Computer that can run imaging software for acquisition and for analysis of images. A variety of imaging software is available and varies with the specific microscope and user system. |
| Cotton tip applicator | Pro Advantage | 76200 | |
| DBA2/N (6-12 week old mice) | BALB/c and C57/BL6 mice can also be used. The latter allow for the use of widely available knockout mouse models as well as mouse models in which individual cell types, such as phagocytes, are identified by their expression of fluorescent proteins. | ||
| Double sided tape designed to hold fabric to skin (fashion tape) | local pharmacy or grocery store | Double sided adhesive tape designed for keeping clothing in place over human skin. This is typically available over the counter in pharmacies and variety stores. It is important to use this type of tape as it is designed for gentle adherence to skin. Examples: https://www.amazon.com/Womens-Fashion-Clothing-Transparent-Suitable/dp/B08S3TWR3H/ref=sr_1_40?crid=2UWFL8FMFAKGM&keywords =fashion+tape&qid=1649174406&sprefix= fashion+tape%2Caps%2C70&sr=8-40 https://www.amazon.com/Fearless-Tape-Sensitive-Clothing-Transparent/dp/B07QY8V5XT/ref=sr_1_26?crid=2UWFL8FMFAKGM&keywords =fashion+tape&qid=1649174320&sprefix= fashion+tape%2Caps%2C70&sr=8-26 https://www.amazon.com/Hollywood-Fashion-Secrets-Tape-Floral/dp/B009RX77MK/ref=sr_1_29?crid=2UWFL8FMFAKGM&keywords =fashion+tape&qid=1649174406&sprefix= fashion+tape%2Caps%2C70&sr=8-29 | |
| Dulbecco's phosphate buffered saline | Gibco / Thermo-Fisher | 14190-144 | Must be sterile; open a new container for every experiment |
| Fetal bovine serum | Gibco / Thermo-Fisher | 26140-079 | |
| Gauze pad | Pro Advantage | P157112 | |
| Gel eye lurbicant | local pharmacy or grocery store | ||
| ImageJ or FIJI analysis software | NIH | ImageJ (FIJI) | |
| Isoflurane | Akorn | J119005 | |
| Leica DMi8 (SP8 platform) with Leica 11506375 objective lens | Leica | DMi8 (SP8) | The objective lens (Leica 11506375) used here is a 25x water immersion lens to allow us to have a high NA (0.95) while approximating the refractive index of the ear tissue. The microscope (Leica DMi8 (SP8 platform) has 488 nm and 638 nm diode laser lines and is equipped with filter-free spectral detection with computer controlled adjustable bandwidth for detection of emission light. The stage must have enough clearance to allow the objective to reach the bottom coverslip without hitting the stage. |
| Low-flow anesthesia system or traditional anesthesia vaporizer | Kent Scientific International | SomnoSuite | |
| Nair hair remover lotion | local pharmacy or grocery store | Over the counter depilatory cream | |
| Nourseothricin | Jena Bioscience | AB-101L | |
| pENO1-NEON-NATR pENO1-iRFP-NATR plasmids | Fluorescent protein expression transformation constructs generously given to us by Dr. Robert Wheeler (Seman, et al., 2018, Infection and Immunity; Bergeron, et al., 2017, Infection and Immunity) | ||
| Pressure sensitive laboratory tape | Tape & Label Graphic Systems Inc | 1007910 | |
| RPMI1640 cell culture medium | Gibco / Thermo-Fisher | 11875-093 | |
| Thimble, plastic 15 mL conical tube, or Falcon 5 mL round bottom polystyrene tubes | Falcon | 352196 | To safely hold the animals ear during injectinos |
Referanslar
- Lopes, J. P., Lionakis, M. S. Pathogenesis and virulence of Candida albicans. Virulence. 13 (1), 89-121 (2022).
- Saville, S. P., Lazzell, A. L., Monteagudo, C., Lopez-Ribot, J. L. Engineered control of cell morphology in vivo reveals distinct roles for yeast and filamentous forms of Candida albicans during infection. Eukaryotic Cell. 2 (5), 1053-1060 (2003).
- Arita, G. S., et al. Cell wall associated proteins involved in filamentation with impact on the virulence of Candida albicans. Microbiological Research. 258, 126996(2022).
- Rai, L. S., Wijlick, L. V., Bougnoux, M. E., Bachellier-Bassi, S., d'Enfert, C. Regulators of commensal and pathogenic life-styles of an opportunistic fungus-Candida albicans. Yeast. 38 (4), 243-250 (2021).
- Sudbery, P. E. Growth of Candida albicans hyphae. Nature Reviews Microbiology. 9 (10), 737-748 (2011).
- Basso, V., d'Enfert, C., Znaidi, S., Bachellier-Bassi, S. From genes to networks: The regulatory circuitry controlling candida albicans morphogenesis. Current Topics in Microbiology and Immunology. 422, 61-99 (2019).
- Mancera, E., et al. Evolution of the complex transcription network controlling biofilm formation in Candida species. Elife. 10, 64682(2021).
- Mitra, S., Dolan, K., Foster, T. H., Wellington, M. Imaging morphogenesis of Candida albicans during infection in a live animal. Journal of Biomedical Optics. 15 (1), 010504(2010).
- Wakade, R. S., Huang, M., Mitchell, A. P., Wellington, M., Krysan, D. J. Intravital imaging of Candida albicans identifies differential in vitro and in vivo filamentation phenotypes for transcription factor deletion mutants. mSphere. 6 (3), 0043621(2021).
- Wakade, R. S., Kramara, J., Wellington, M., Krysan, D. J. Candida albicans filamentation does not require the cAMP-PKA pathway in vivo. mBio. 13 (3), 0085122(2022).
- Bergeron, A. C., et al. Candida albicans and Pseudomonas aeruginosa interact to enhance virulence of mucosal infection in transparent zebrafish. Infection and Immunity. 85 (11), 00475(2017).
- Seman, B. G., et al. Yeast and filaments have specialized, independent activities in a zebrafish model of Candida albicans infection. Infection and Immunity. 86 (10), 00415-00418 (2018).
- Centers for Disease Control and Prevention. Biosafety in Microbiological and Biomedical Laboratories (BMBL). 6th edition. , Available from: https://www.cdc.gov/labs/BMBL.html (2020).
- Homann, O. R., Dea, J., Noble, S. M., Johnson, A. D. A phenotypic profile of the Candida albicans regulatory network. Plos Genetics. 5 (12), 1000783(2009).
- Cullen, P. J., Sprague, G. F. The regulation of filamentous growth in yeast. Genetics. 190 (1), 23-49 (2012).
- Herrero, A. B., et al. Control of filament formation in Candida albicans by polyamine levels. Infection and Immunity. 67 (9), 4870-4878 (1999).
- Ahmad Hussin, N., et al. Biotin auxotrophy and biotin enhanced germ tube formation in Candida albicans. Microorganisms. 4 (3), 37(2016).
- Nantel, A., et al. Transcription profiling of Candida albicans cells undergoing the yeast-to-hyphal transition. Molecular Biology of the Cell. 13 (10), 3452-3465 (2002).
- Noble, S. M., Johnson, A. D. Strains and strategies for large-scale gene deletion studies of the diploid human fungal pathogen Candida albicans. Eukaryotic Cell. 4 (2), 298-309 (2005).
- Glazier, V. E. EFG1, Everyone's favorite gene in Candida albicans: A comprehensive literature review. Frontiers in Cellular Infection and Microbiology. 12, 855229(2022).
- Huang, G., Huang, Q., Wei, Y., Wang, Y., Du, H. Multiple roles and diverse regulation of the Ras/cAMP/protein kinase A pathway in Candida albicans. Molecular Microbiology. 111 (1), 6-16 (2019).
- Saville, S. P., Lazzell, A. L., Chaturvedi, A. K., Monteagudo, C., Lopez-Ribot, J. L. Use of a genetically engineered strain to evaluate the pathogenic potential of yeast cell and filamentous forms during Candida albicans systemic infection in immunodeficient mice. Infection and Immunity. 76 (1), 97-102 (2008).
- Brothers, K. M., Newman, Z. R., Wheeler, R. T. Live imaging of disseminated candidiasis in zebrafish reveals role of phagocyte oxidase in limiting filamentous growth. Eukaryotic Cell. 10 (7), 932-944 (2011).
- Brothers, K. M., et al. NADPH oxidase-driven phagocyte recruitment controls Candida albicans filamentous growth and prevents mortality. PLoS Pathogens. 9 (10), 1003634(2013).
- Holmes, H., Kennedy, J. C., Pottier, R., Rossi, R., Weagle, G. A recipe for the preparation of a rodent food that eliminates chlorophyll-based tissue fluorescence. Journal of Photochemistry and Photobiology. B: Biology. 29 (2-3), 199(1995).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır