Method Article
İnsan Kaynaklı Pluripotent Kök Hücre Kaynaklı Kardiyak Sferoidlerin Üretimi, Yüksek Verimli Taraması ve Biyobankacılığı
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Burada, yüksek verimli, çok boyutlu bir formatta kültürlenmiş, insan kaynaklı pluripotent kök hücre kaynaklı kardiyomiyositlerden kardiyak sferoidlerin (CSs) üretilmesi ve kriyoprezervasyonu için bir dizi protokol sunulmaktadır. Bu üç boyutlu model, hastalık modellemesi, yüksek verimli taramalar için sağlam bir platform olarak işlev görür ve kriyoprezervasyondan sonra işlevselliğini korur.
Özet
İnsan kaynaklı pluripotent kök hücre kaynaklı kardiyomiyositler (hiPSC-CM'ler), insan kalp hastalığı modellemesi ve terapötikleri için büyük önem taşımaktadır. Kısa bir süre önce, hiPSC-CM'lerin iki boyutta (2D) büyük ölçüde genişletilmesi için uygun maliyetli bir strateji yayınladık. İki ana sınırlama, hücre olgunlaşmamışlığı ve yüksek verimli tarama (HTS) platformlarında üç boyutlu (3D) düzenleme ve ölçeklenebilirlik eksikliğidir. Bu sınırlamaların üstesinden gelmek için, genleşmiş kardiyomiyositler, 3D kardiyak hücre kültürü ve doku mühendisliği tekniklerinin oluşturulması için ideal bir hücre kaynağı oluşturur. İkincisi, kardiyovasküler alanda büyük bir potansiyele sahiptir ve daha gelişmiş ve fizyolojik olarak ilgili HTS sağlar. Burada, 96 kuyucuklu bir formatta kardiyak sferoidlerin (CSs) üretimi, bakımı ve optik analizi için kolay ölçeklenebilirliğe sahip HTS uyumlu bir iş akışını açıklıyoruz. Bu küçük CS'ler, mevcut in vitro hastalık modellerinde ve / veya 3D doku mühendisliği platformları için üretimde mevcut boşluğu doldurmak için gereklidir. CSs oldukça yapılandırılmış bir morfoloji, boyut ve hücresel kompozisyon sunar. Ayrıca, CSs olarak kültürlenen hiPSC-CM'ler, artan olgunlaşma ve spontan kalsiyum kullanımı ve kontraktil aktivite gibi insan kalbinin çeşitli fonksiyonel özelliklerini gösterir. CSs'nin oluşturulmasından fonksiyonel analize kadar tüm iş akışının otomatikleştirilmesiyle, yüksek verimli (HT) görüntüleme ve kalsiyum işleme analizinin gösterdiği gibi parti içi ve partiler arası tekrarlanabilirliği artırıyoruz. Tanımlanan protokol, kalp hastalıklarının modellenmesine ve tam otomatik bir HTS iş akışında karmaşık bir 3D hücre ortamında tek hücre düzeyinde ilaç / terapötik etkilerin değerlendirilmesine olanak tanır. Ek olarak, çalışma, tüm sferoidlerin uzun süreli korunması ve biyobankacılığı için basit bir prosedürü tanımlamakta ve böylece araştırmacılara yeni nesil fonksiyonel doku depolaması oluşturma fırsatı sunmaktadır. HTS, uzun süreli depolama ile birleştiğinde, ilaç keşfi ve testi, rejeneratif tıp ve kişiselleştirilmiş tedavilerin geliştirilmesi de dahil olmak üzere çok çeşitli alanlarda translasyonel araştırmalara önemli ölçüde katkıda bulunacaktır.
Giriş
İnsan kaynaklı pluripotent kök hücrelerin (hiPSC'ler) keşfi, insan gelişimini ve hastalığı hücresel düzeyde incelemek için benzeri görülmemiş fırsatlar sundu. Son on yılda, gelişimsel dersler kullanılarak, hiPSC'lerin kardiyomiyositlere (CM'ler) etkili bir şekilde farklılaşmasını sağlamak için çeşitli protokoller oluşturulmuştur1,2,3,4. hiPSC kaynaklı kardiyomiyositler (hiPSC-CM'ler), genetik olarak kalıtsal kardiyovasküler hastalıkların (CVD'ler) modellenmesi, yeni ilaçlar için kardiyak güvenliğin test edilmesi ve kardiyak rejeneratif stratejiler 5,6,7,8 için bir kaynak olarak hizmet edebilir. HiPSC'lerin yönlendirilmiş kardiyak farklılaşmasına rağmen, belirsiz CM sayıları kardiyak alanda bir zorluk olmaya devam etmektedir, çünkü olgunlaşmış hiPSC-CM'ler genellikle proliferatif değildir ve birincil insan hücreleri yüksek miktarlarda mevcut değildir.
Son zamanlarda, düşük hücre yoğunluğu kültürü ile eşzamanlı Wnt sinyal aktivasyonunun, hiPSC-CMs 9,10'un büyük bir proliferatif yanıtı (250 kata kadar) ile sonuçlandığını açıkladık. Kültür şişesi formatında seri geçiş yoluyla hiPSC-CM'lerin büyük ölçüde genişletilmesine yönelik bu uygun maliyetli strateji, çok sayıda fonksiyonel hiPSC-CM'nin standardizasyonunu ve kalite kontrolünü kolaylaştırır. Ek olarak, çeşitli bağışçılardan gelen büyük miktarlarda hiPSC-CM'lere olan talebe ayak uydurmak için, hiPSC-CM'lerin biyobankacılığı10 olarak tanımlanmıştır. Bununla birlikte, bu standart kültür yemeklerinde tohumlanan kardiyomiyosit monokatmanları, kalpte bulunan karmaşık 3D yapıyı temsil etmemektedir. Dahası, hiPSC-CM'lerin olgunlaşmamışlığı bir engel olarak kalmıştır, bu nedenle in vivo kardiyovasküler ortamın biyolojik ve fizyolojik fenotipini taklit etmede yetersiz kalmıştır.
HiPSC-CM'lerin kendi kendine organizasyon 11,12, hücre dışı matris (ECM) yeniden şekillenmesi 13, gelişmiş olgunlaşma 14,15,16 ve senkronize kasılma 17,18,19 gibi daha yakın fizyolojik davranışlar gösterdiği yeni 3D in vitro modeller geliştirilmiştir. . İlaç keşfi, ilaç kardiyotoksisite testi, hastalık modellemesi, rejeneratif tedaviler ve hatta ilk klinik çalışmalar20,21,22,23,24 için 3D modeller kullanılmıştır. En çok kullanılan modellerden biri, doku benzeri bir düzenleme ve kardiyak kontraktiliteyi 13,17,25 sergileyen fibrin bazlı mühendislik kalp dokusudur (EHT). Daha önce, genişletilmiş hiPSC-CM'lerden üretilen EHT'lerin, genişlememiş hiPSC-CM'lerden elde edilenlerle karşılaştırılabilir kontraktilite gösterdiğini ve genişleme9'dan sonra ödün vermeyen hücresel işlevsellik gösterdiğini gösterdik. Bununla birlikte, hiPSC-CM'lerden EHT'lerin üretimi iyi kurulmuş olsa da, bir HT değerlendirme platformunun kurulmasıyla ilgili daha fazla gelişme beklenmektedir. Burada, 96 kuyucuklu formatta çok sayıda kendiliğinden toplanan kardiyak sferoidin (CSs) hızlı bir şekilde üretilmesi, yüksek verimli tarama (HTS) amaçları için 3D koşullarda bir iyileşme sağlar.
Genel olarak, CSs'nin 3D hücre kültürü olarak avantajı, yüksek tekrarlanabilirliği ve ölçeklenebilirliğidir. Özellikle, robotik numune işleme ile birleştirilen CSs, CS kültürünü, ilaç tedavisini ve yüksek içerikli analizi standartlaştırabilir ve otomatikleştirebilir20. Burada, optik kalsiyum toplama ve analiz sistemi kullanarak Ca2+ geçici ölçümler yaparak verimli bir şekilde kriyokorunabilen ve kardiyak fonksiyon için taranabilen yüksek saflıkta ve yüksek kaliteli CS'ler üretmek için optimize edilmiş protokolleri açıklıyoruz. Bu model, yüz ila binlerce sferoid17,18 üzerinde yüksek verimli ekranlar gerçekleştirmek için basit ama güçlü bir araç sağlar.
Protokol
NOT: Bu çalışmada kullanılan hiPSC-CM'ler daha önce tarif edilen hiPSC kültürleme ve CM farklılaşma protokolleri26,27'ye göre oluşturulmuştur. İsteğe bağlı olarak, hiPSC-CM'ler, CS protokolüne başlamadan önce yakın zamanda yayınlandığı gibi genişletilebilir ve kriyokorunabilir (bölüm 4)10.
1. Hücre kültürü ortamlarının, çözeltilerinin ve alikotlarının hazırlanması
- Bazal ortam hazırlayın
- Penisilin-streptomisin ve ortamı (RPMI 1640) oda sıcaklığına (RT) dengeleyin ve tamamen çözüldüğünden emin olun. 500 mL orta ve 5 mL kalem/strep karıştırın. 8 haftaya kadar 4 °C'de saklayın; Kullanmadan önce 37 ° C'ye dengeleyin.
- RPMI + B27'yi hazırlama
- B27 takviyesini ve bazal ortamı RT'ye dengeleyin. Bazal ortamın 490 mL'sini ve 50x B27 takviyesinin 10 mL'sini karıştırın. 2 haftaya kadar 4 ° C'de saklayın; Kullanmadan önce 37 ° C'ye dengeleyin.
- hiPSC-CM yeniden kaplama ortamını hazırlama
- RPMI + B27 ortamına Rho ile ilişkili, protein kinaz (ROCK) inhibitörü (2 μM nihai konsantrasyon) ve% 10 nakavt serum replasmanı (KSR) içeren sarmal bobin ekleyin. ROCK inhibitörünü gerektiğinde doğrudan RM ortamına ekleyin. Kültür medyasını bir kez desteklendikten sonra saklamayın.
- CM çözme ortamını hazırlama
- RPMI + B27 ortamına 1:100 konsantrasyonda hücre sağkalım takviyesi (örneğin, Revitacell) ve% 20 KSR ekleyin ve kullanmadan önce 37 ° C'ye dengeleyin.
- Olgunlaşma takviyesi hazırlayın
- Daha önce tarif edilen olgunlaşma ortamı formülü28 şunlardan oluşur: 3 mM glikoz, 10 mM L-laktat, 5 mg / mL B12 vitamini, 0.82 mM biyotin, 5 mM kreatin monohidrat, 2 mM taurin, 2 mM L-karnitin, 0.5 mM askorbik asit, 1x NEAA,% 0.5 (w / v) albümaks, 1x B27 ve% 1 KOSR. Bir tam şişe (500 mL) olgunlaşma takviyesi hazırlamak için, glikozsuz bir şişe DMEM'den 65 mL'yi çıkarın ve 2.7 g glikoz, 5.6 g L-laktat, 0.025 mg B12 vitamini, 1 mg Biotin, 3.73 g kreatin monohidrat, 1.25 g taurin, 1.975 g L-karnitin, 0.7125 g askorbik asit ile takviye edin, 50 mL NEAA, 12.5 g albümaks ve 5 mL penisilin-streptomisin.
- 0,22 μm gözenekli Polietersülfon (PES) membranlı steril tek kullanımlık filtre ünitesinden süzün.
- Aliquot, 45 mL'ye (500 mL olgunlaşma ortamı hazırlamak için) veya 4.5 mL'ye (50 mL olgunlaşma ortamı hazırlamak için) girer. 20 °C'de 6 aya kadar saklayın.
- Olgunlaşma ortamını hazırlama
- B27 takviyesini, nakavt SR'yi, penisilin-streptomisini, olgunlaşma takviyesi28'i ve DMEM glikozsuz ortamını RT'de dengeleyin. DMEM glikoz ortamının 435 mL'sini 10 mL 50x B27 takviyesi, 5 mL penisilin-streptomisin, 5 mL nakavt SR ve 45 mL olgunlaşma takviyesi ile karıştırın. 2 haftaya kadar 4 ° C'de saklayın; Kullanmadan önce 37 °C'de dengeleyin.
- Flor parlak ortam hazırlayın
- RT'de penisilin-streptomisin ve DMEM florobrid ortamını dengeleyin. DMEM florbrite ortamının 500 mL'sini 5 mL penisilin-streptomisin ile karıştırın. 4 °C'de 1 aya kadar saklayın; Kullanmadan önce 37 °C'de dengeleyin.
- İyonik olmayan deterjan çözeltisini hazırlayın
- İyonik olmayan deterjan tozu (örneğin, F-127) ile %20 oranında PBS ile karıştırın. 0,22 μm filtre kullanarak filtreleyin ve 4 °C'de 6 aya kadar saklayın; kullanmadan önce RT'de dengeleyin.
- Kalsiyum boya ortamı hazırlayın
- İyonik olmayan deterjan çözeltisini (%0,04 v/v nihai konsantrasyonu) ve kalsiyum boyasının 0,1x'ini (örneğin, Cal520) flor parlak ortamda karıştırın. 50 mL'lik bir konik tüpte, 10 μL Cal520 ve 20 μL iyonik olmayan deterjan çözeltisi ekleyin. Tamamen eriyene kadar karıştırın. Hücrelere eklemeden önce çözeltiyi karanlıkta tutun.
2. Tamponların hazırlanması
- Geçirgenlik ve blokaj tamponunu hazırlayın: Bu tampon 10 mL PBS, ağırlıkça %5 BSA ve %0,3 v/v Triton-X-100 içerir.
- Akış sitometrisi tamponunu hazırlayın: Bu tampon 50 mL PBS, ağırlıkça% 1 / v BSA ve% 0.3 v / v Triton-X-100 içerir.
- Akış sitometrisi yıkama tamponu: Bu tampon 50 mL PBS ve% 1 ağırlıkça / v BSA içerir.
- Küresel yıkama tamponu (SWB): Bu tampon 1 mL Triton-X-100, 2 mL %10 (DPBS'de w/v) SDS ve 1 L PBS'de 2 g BSA içerir.
NOT: SWB, 4 °C'de 2 haftaya kadar saklanabilir. - Gömme çözeltisini (ES) hazırlayın: 100 mL gömme çözeltisi hazırlamak için, 50 mL gliserol 9.09 mL dH2O, 1 mL Tris tamponu (1 M, pH 8.0) ve 200 μL EDTA (0.5 M) ile karıştırın. 22.7 g fruktoz ekleyin ve çözülene kadar karanlıkta RT'de karıştırın. Berrak olduğunda, 22.2 g fruktoz ekleyin ve eriyene kadar karıştırın. Daha sonra 15 g üre ekleyin ve eriyene kadar karıştırın (karanlıkta 4 ° C'de saklayın).
- PBT (PBS with Tween-20) arabelleğini hazırlayın. Bu arabellek PBS/Ara-20 (%0,1 d/v) içerir. 1 L PBS için 1 mL Tween-20 ekleyin.
3. Küçük moleküllerin hazırlanması
- DMSO'da 50 μL'lik 10 mM alikotlarda tiazivivin (ROCK inhibitörü) tozunu yeniden oluşturur ve 6 aya kadar -20 ° C'de saklayın. Işıktan koruyun.
- DMSO'da Cal-520'nin her biri 10 μL'lik 2,5 mM alikot hazırlayın ve bunları 6 aya kadar -20 ° C'de saklayın. Işıktan koruyun.
4. Kardiyak sferoid üretimi
NOT: Daha büyük miktarlarda CS'ler için, 2 mL hiPSC-CM yeniden kaplama ortamına sahip 6 delikli ultra düşük bağlantı plakasında 1 milyon CM'ye kadar tohumlayın. Bu çalışmada, 96 kuyucuklu bir plakanın kuyusu başına en az 2.500 (2.5k CS) ila 20.000 (20k CS) hiPSC-CM kullanılmıştır.
- 96 kuyucuklu bir plaka için, en az 2 x 106 insan kaynaklı pluripotent kök hücre kaynaklı kardiyomiyositler (hiPSC-CM'ler)10 içeren bir hücre kültürü hazırlayın.
- Kültürlenmiş hiPSC-CM'ler birleşime ulaştığında, her bir kuyucuğa 0.1 mL /cm2 steril kardiyak dekolmanı çözeltisi (örneğin, triple) ekleyin. Plakayı 15 dakika boyunca 37 ° C'de inkübe edin.
- 5 mL'lik bir pipet kullanarak, tek bir hücre süspansiyonu oluşturmak için 2 mL sıcak bazal ortam ile yıkayarak hücreleri mekanik olarak ayırın. Ayrılmayı parlak bir alan mikroskobu ile onaylayın (4x büyütme); hücreler beyaz görünecek ve yuvarlak bir şekle sahip olacaktır.
- Hücre süspansiyonunu 15 mL'lik bir konik tüpe aktarın ve 300 x g'da 3 dakika boyunca santrifüj yapın.
- Süpernatantı aspire edin ve hücreleri 1 mL hiPSC-CM yeniden kaplama ortamında yeniden askıya alın.
- 1.000 μL'lik bir pipet ucu kullanarak, hücre peletini mekanik olarak ayırın. Çözelti üç veya dört karışımdan sonra homojen görünür. Hücreleri sayın. Yeniden kaplama ortamının 100 μL'sinde uygun miktarda hücreyi, her ultra düşük bağlantı yuvarlak-dip 96 kuyusuna aktarın.
- CSs plakasını inkübatörde 24 saat boyunca 70 rpm'de yörüngesel bir çalkalayıcıya yerleştirin. İnkübatör koşullarını 37 °C, %5 CO 2, %21 O2 ve %90 neme ayarlayın.
- Her bir kuyucuktan 50 μL ortam aspire edin ve ilk 48 saat boyunca kuyucuk başına 100 μL RPMI + B27 ortam ekleyin.
NOT: Kazara aspirasyon ve küresel yırtılmayı önlemek için ortamın 50 μL'sini her zaman 96 delikli plakada tutun. - Her bir kuyucuktan 100 μL ortamın aspire edilmesi ve kuyucuk başına olgunlaşma ortamının 100 μL'sini ekleyin. Hücreleri olgunlaşma ortamında tutun ve ortamı her 2-3 günde bir yenileyin.
5. CSs'nin kriyoprezervasyonu
NOT: CS'ler uzun süreli depolama için kriyokorunabilir. CSs, doğrudan 96 delikli bir plakanın kuyucuklarında veya kriyovyallerde CS süspansiyonu olarak kriyokorunabilir.
- Plakayı 10 dakika boyunca buz üzerine yerleştirerek plakayı önceden soğutun.
- Küresel plakayı 70 x g'de 3 dakika boyunca santrifüj yapın.
- Süpernatantı 50 μL kalana kadar çıkarın ve kuyu başına 200 μL buz gibi soğuk hiPSC dondurma ortamı ekleyin.
NOT: CS süspansiyonunu prosedürün tüm süresi boyunca buz üzerinde tutun. Sferoidli 6 kuyucuklu bir plaka durumunda, 500 μL dondurucu bir ortam kriyovalinde bir kuyucuk dondurun. - Plakayı plaka sızdırmazlık filmi ile kapatın.
NOT: 96 delikli plakanın bir polistiren kutuda saklanması gerekir veya mevcut olmadığında, adım 5.5.1'de açıklandığı gibi bir silikon kalıp yapılabilir. - Kuyu plakası ile dondurucu arasında eşit ısı alışverişi sağlamak için, plakayı dikkatlice bir polistiren kutuya veya silikon bir kalıba yerleştirin.
- Silikon kalıbı hazırlamak için: Silikon elastomer kitinin iki bileşenini 10: 1 oranında kuvvetlice karıştırın. Çözeltiyi 15-20 dakika boyunca bir vakum pompası kullanarak kabarcıklarından arındırın. Daha sonra, çözeltiyi kuyu plakasının alt kısmına dökün ve 10 dakika boyunca bir vakum pompası kullanarak kabarcığı giderin. Kalıbı bir fırına yerleştirin ve plakadan soyulmuş yarı esnek bir elastomer elde etmek için 60 ° C'de 8 saat kürleyin.
- Plakayı -80 °C'de polistiren kutuda veya hazırlanan silikon kalıpta en az 4 saat boyunca dondurun.
- Uzun süreli depolama için plakayı bir sıvı azot tankına veya -150 °C dondurucuya aktarın.
6. Kardiyak sferoidlerin çözülmesi
NOT: Hızlı bir çözme işlemi sağlamak için aynı anda birden fazla plakayı çözmeyin.
- 50 mL'lik konik bir tüpte 20 mL'lik 37 °C önceden ısıtılmış bazal ortam hazırlayın.
- Hücre plakasını sıvı azottan CSs ile toplayın ve 15 dakika boyunca inkübatöre yerleştirin. İnkübatör koşullarını 37 °C, %5 CO 2, %21 O2 ve %90 neme ayarlayın.
- Süpernatantı çıkarın ve hücre pelet kalıntıları ve her bir kuyucuğu ılık bir bazal ortamda yeniden askıya alın. Kuyu başına 200 μL orta kullanın.
- 70 x g'de 3 dakika santrifüj.
- 6.3 ve 6.4 numaralı adımları yineleyin.
- Hücre peleti kalana kadar süpernatantı çıkarın ve her bir kuyucuğa 200 μL CM çözme ortamı ekleyin.
- CSs plakasını 24 saat boyunca bir inkübatörde 70 rpm'de yörüngesel bir çalkalayıcıya yerleştirin. İnkübatör koşullarını 37 °C, %5 CO 2, %21 O2 ve %90 neme ayarlayın.
- Her bir kuyucuktan 50 μL ortamın aspire edilmesi ve ilk 48 saat boyunca kuyucuk başına 100 μL RPMI + B27 ortamı eklenmesi.
- Her bir kuyucuktan 100 μL ortamın aspire edilir ve kuyucuk başına 100 μL olgunlaşma ortamı eklenir. Hücreleri olgunlaşma ortamında tutun ve ortamı her 2-3 günde bir yenileyin.
7. Hücre içi Ca2+ geçicilerinin değerlendirilmesi
NOT: CS'ler toplam 3 hafta boyunca kültürdedir; Donmadan 2 hafta önce ve çözülmeden 1 hafta sonra. 'Yeni' kontroller yaşa uygundur.
- 1 haftalık kültürden sonra, çözülmüş CS'ler kalsiyum işleme optik görüntüleme için en uygunudur. Hücrelerden Ca 2 + 'nın alımını ve salınımını değerlendirmek için bir kalsiyum boyası (örneğin,Cal520AM ) kullanın.
- Onlara kuyucuk başına 100 μL kalsiyum boya ortamı ile muamele edin ve inkübatörde 60 dakika boyunca inkübe edin. İnkübatör koşullarını 37 °C, %5 CO 2, %21 O2 ve %90 neme ayarlayın.
NOT: Cal520AM ışığa duyarlıdır. Tüm yükleme prosedürlerini ve deneylerini karanlıkta gerçekleştirin. - Kalsiyum toplama ve analiz sistemini hazırlar.
- Mikroskopa güç vererek çevresel kontrol seçeneğinin açık olduğundan emin olun.
- Arka plan alanını en aza indirmek için kamera ve çerçeve diyafram açıklığı boyutlarını ayarlayın.
NOT: Burada Leica Thunder DMi8 mikroskobu kullanılmıştır; diğer mikroskop sistemleri de 30 kare / saniyenin (fps) üzerinde bir örnekleme hızına izin verene kadar uygulanabilir.
- 10 sn içinde 2-10 zirveden oluşan tutarlı bir akışa sahip bir video kaydedin ve 96 kuyucuklu plaka boyunca tarayın, başlangıçta sola doğru hareket edin, ardından tüm plakayı kaplamak için zikzaklı bir şekilde aşağı doğru hareket edin. 488 nm lazer kullanarak kalsiyum sinyalini ölçün; kalsiyum salınımı sırasında kontrastı parlak yeşil bir sinyalle siyah bir arka plana ayarlayın.
- Ca2+ geçicilerini edindikten sonra, verileri üreticinin talimatlarına göre floresan izleri analiz yazılımı (örneğin, CyteSeer, Vala Sciences) ile analiz edin.
8. Dissosiye kardiyak sferoidlerin akım sitometri analizleri
NOT: Bu çalışmada, çözülme işleminden önce ve sonra CS'lerin yaşayabilirliğini belirlemek için akış sitometrisi kullanılmıştır.
- Küresel hasarı önlemek için CS'leri 15 mL'lik bir konik tüp içinde toplayın ve 70 x g'de 3 dakika boyunca santrifüj yapmak için 5 mL'lik bir pipet kullanın. Süpernatantı aspire edin ve 1 mL PBS ekleyin.
- 200 x g'de 3 dakika santrifüj. Süpernatantı aspire edin ve 1 mL kardiyak dekolmanı çözeltisi (örneğin, triple) ekleyerek CSs'yi ayırın. Tüpü 15 dakika boyunca 37 ° C'de inkübe edin.
- 5 mL'lik bir pipet kullanarak, mikroskop altında gözlemlendiğinde tek hücreler görülene kadar 2 mL bazal ortam ile yıkanarak hücreleri mekanik olarak ayırın.
- 200 x g'de 3 dakika santrifüj.
- Süpernatantı aspire edin ve CM'leri 1x PBS'de 200 μL% 4 paraformaldehit (PFA) çözeltisi ile sabitleyin. RT'de 10 dakika boyunca kuluçkaya yatırın.
- 200 x g'de 3 dakika santrifüj. Süpernatantı aspire edin ve 1 mL PBS ekleyin.
NOT: Duraklatma noktası: Sabit hiPSC-CM'ler 4 °C'de 4 haftaya kadar saklanabilir. - Hücre süspansiyonunu bir FACS tüpüne aktarın ve 200 x g'de 3 dakika boyunca santrifüj yapın. Süpernatantı aspire edin ve geçirgenlik tamponunun50 μL'sinde 1 x 10 5 hücreyi yeniden askıya alın.
- Hücreleri 4 ° C'de 30 dakika boyunca inkübe edin.
- İmmünofloresan akış sitometrisi analizi için, 8.9.1-8.9.4 adımlarını uygulayın.
- α-aktinin antikoru içeren akış sitometri tamponundaki (50 μL) hücreleri 1:300'lük bir seyreltmede yeniden askıya alın. Başka bir FACS tüpünde, akış sitometri tamponundaki (50 μL) 1 x 10 5 hücreyi ilgili izotip kontrolü ile yeniden askıya alın (örneğin, FITC fare IgM, κ izotipi [1:200 seyreltme]). Benzer şekilde, negatif kontrol için50 μL akış sitometri tamponunda 1 x 10 5 hücreyi yeniden askıya alın.
- Hücreleri 4 ° C'de 30 dakika boyunca inkübe edin.
- 2,5 mL akış sitometri tamponu ekleyin ve hücreleri 4 ° C'de 3 dakika boyunca 200 x g'de santrifüj yapın; Supernatant'ı atın ve bu yıkama adımını iki kez tekrarlayın.
- İkincil antikor keçi-anti-fare (1:300 seyreltme) ile hücreleri 50 μL akış sitometri tamponunda yeniden askıya alın.
NOT: İkincil antikor çözeltisi ışığa duyarlı olduğundan tüpü karanlıkta yerleştirin.
- Propidium iyodür (PI) ile canlılık kontrolü için, numune başına 150 μL PI ekleyin (1:1.000) ve 15 dakika boyunca inkübe edin.
NOT: PI çözeltisi ışığa duyarlı olduğundan tüpü karanlıkta yerleştirin. - Kapıları, Ek Şekil 1'de gösterildiği gibi standart geçit stratejisine göre ayarlayın ve hücreleri bir akış sitometresi ile analiz edin.
9. Tüm 3D sferoidlerin immünofloresan boyanması
NOT: Bu protokol, daha önce29 yayınlanmış ve kardiyak sferoidler için ayarlanmış olan immünofloresan etiketleme üzerine tüm organoidlerin yüksek çözünürlüklü 3D görüntülenmesi protokolüne dayanmaktadır. İşlem sırasında, sferoidlerin plastiklere yapışmasını önlemek için tüm pipet uçları ve konik tüpler ağırlıkça% 1 BSA-PBS ile kaplanabilir. Malzemeleri kaplamak için,% 1 BSA-PBS'ye daldırın. 5 mL pipet kullanarak sferoidlere zarar vermemeye dikkat edin ve mekanik bozulmayı önleyin.
- CS'leri 5 mL pipet ile 15 mL kaplı bir tüpte toplayın. Sferoidler gözle görülebilir. Antikor kombinasyonu başına ~ 20-50 sferoid toplayın. 70 x g'de 3 dakika santrifüj yapın ve süpernatanı aspire edin.
- Kaplanmış 1 mL uç kullanarak 1 mL buz gibi soğuk% 4 paraformaldehit (PFA) çözeltisi içindeki sferoidleri 1x PBS'de dikkatlice askıya alın.
- 45 dakika boyunca 4 ° C'de sabitleyin. 20 dakika sonra, kaplanmış 1 mL'lik bir uç kullanarak sferoidleri nazikçe yeniden askıya alın. Bu, tüm sferoidler arasında sabitlemeyi eşitler.
- Tüpe 10 mL buz gibi soğuk PBS ekleyin ve tüpü ters çevirerek yavaşça karıştırın. 4 ° C'de 10 dakika boyunca inkübe edin ve 3 dakika boyunca 70 x g'de aşağı doğru döndürün.
NOT: Bu adımdan itibaren, sabitlemeden sonra CS'ler uca yapışmadığından genellikle uçların ve konik tüplerin kaplanması gerekli değildir. - Peleti buz gibi soğuk SWB'de (kuyu başına 200 μL SWB) yeniden askıya alarak CS'leri bloke edin ve sferoidleri 24 kuyucuklu bir süspansiyon kültür plakasına aktarın.
NOT: Büyük bir peletten gelen CS'ler, farklı boyama işlemleri gerçekleştirmek için birden fazla kuyuya bölünebilir. Antikor kombinasyonu başına ~20-50 CSs kullanın. - En az 15 dakika boyunca 4 ° C'de inkübe edin.
- Referans kuyusu olarak hizmet etmek için boş bir kuyuya 200 μL SWB ekleyin.
NOT: İmmünofloresan boyama için, antikor kullanımını azaltmak için 48 veya 96 delikli plakalar da kullanılabilir. Bununla birlikte, boyama ve yıkama sonuçları, kuyu başına daha küçük hacim nedeniyle azaltılabilir. - Sferoidlerin, plakayı 5 dakika boyunca 45 ° 'lik bir açıyla eğik bırakarak plakanın dibine yerleşmesine izin verin.
- SWB'yi çıkarın ve CS'leri SWB'nin 200 μL'sinde bırakın (minimum 200 μL hacmini tahmin etmek için referans kuyusunu kullanın).
- SWB'nin 200 μL'sini 2x konsantre birincil antikorlarla (örneğin, ɑ-aktinin [1:200] ve Troponin T [1:200]) ekleyin ve sallanırken / sallanırken (yatay çalkalayıcıda 40 rpm) gece boyunca inkübe edin.
- Ertesi gün, her bir kuyucuğa 1 mL SWB ekleyin.
- Sferoidlerin, plakayı 5 dakika boyunca 45 ° 'lik bir açıyla bırakarak plakanın dibine yerleşmesine izin verin.
- SWB'yi çıkarın ve plakada 200 μL bırakın. 1 mL SWB ekleyin ve yavaş sallanma/sallama ile 2 saat boyunca yıkayın.
- 9.12 ve 9.13 adımlarını iki kez daha yineleyin.
- Plakayı 5 dakika boyunca 45°'de eğik bırakarak CS'lerin plakanın altına yerleşmesine izin verin. SWB'yi çıkarın, her bir kuyucukta 200 μL bırakın
- İkincil antikorlar, konjuge antikorlar ve 2x konsantre boyalarla SWB'nin 200 μL'sini ekleyin (örneğin, DAPI [1 μg / mL], fare-AF488 [1:500], tavşan-AF568 [1:500]) ve karanlıkta yavaşça sallanırken / sallanırken gece boyunca 4 ° C'de kuluçkaya yatırın.
- Ertesi gün, 9.12 ve 9.13 adımlarını iki kez daha tekrarlayın.
- CSs'yi dikkatlice 1,5 mL'lik bir tüpe aktarın ve 3 dakika boyunca 70 x g'de aşağı doğru döndürün.
- CS'leri bozmadan pipetleme yaparak SWB'nin mümkün olduğunca çoğunu çıkarın.
- Gömme çözeltisini (ES; RT'de en az 50 μL) ucu kesilmiş 200 μL'lik bir uç kullanarak ekleyin ve kabarcık oluşumunu önlemek için hafifçe yeniden askıya alın ve RT'de 20 dakika boyunca inkübe edin.
- Bu arada, oje veya silikon dolgu macunu içeren bir cam slayt üzerinde kare bir kap oluşturun.
- 200 μL'lik bir ucun ucunu kesin ve ES'deki CS'leri kare kabın ortasına aktarın.
- Üstüne kare bir kapak kapağı yerleştirin. Hava kabarcıklarını azaltmak için, önce kapak kaymasının bir tarafını yerleştirin, ardından yüzeyin altında sıkışmış hava kalmayana kadar kapak kaymasını yavaşça bir taraftan diğerine indirin ve ardından kapak kaymasını serbest bırakın.
- Oje veya silikon dolgu macununa kapatmak için kapak kapağının tüm kenarlarına hafifçe bastırın.
- Slaytı gece boyunca RT'de bırakın. Ertesi gün, slayt görüntüleme için hazırdır.
NOT: ES ile optik temizleme, küçük doku büzülmesine neden olabilir. Ancak bu, CS'lerin genel morfolojisini etkileyemez. Boyama prosedürü, slaytlar 4 ° C'de (en az 1 hafta) veya -20 ° C'de (en az 6 ay boyunca) saklanarak burada duraklatılabilir.
Sonuçlar
Şekil 1A'da gösterilen protokol, daha önce genişletilmiş hiPSC-CM'lerden CS'lerin oluşturulmasını açıklar. CS'ler, ultra düşük ataşmanlı yuvarlak tabanlı plakalarda tohumlama sonrası 1. güne kadar 3D bir yapı kazanır ve 6 haftaya kadar kültürlenebilir (Şekil 1B). İmmünofloresan boyama ile değerlendirildiği gibi, 3 haftalık CS'lerdeki hücrelerin çoğunluğu α-aktinin ve troponin T gibi sarkomerik proteinleri eksprese etti ve düzenli sarkomer organizasyonu sergiledi (Şekil 1C). α-aktininin pozitif hücrelerin nicelleştirilmesi için akım sitometri analizi yapıldı. İmmünofloresan sonuçlarına göre, akış sitometrisi verileri, hem 0. günde (% 76.9 α% 16.6) hem de 3 haftalık CSs'lerde (% 71.1 ±% 22.7) karşılaştırılabilir yüksek seviyelerde ±-aktinin göstermiştir (Şekil 1D), kültürleme sırasında sabit ve oldukça saf bir hücresel kompozisyonu göstermektedir. HiPSC-CM türevli sferoidlerde (gün 42) kavşaklar (GJA1, JPH2 ve PKP2), dezmozomlar (DES) ve mitokondri (ATP5A) için kardiyak genlerin ekspresyonunda 90 gün boyunca 2D'de kültürlenen hiPSC-CM'lere karşı artmış bir ekspresyon vardı (Şekil 1E). Bu genlerin ekspresyonu, hücre-hücre etkileşiminin ve olgunlaşmanın bir işaretidir30.
Daha sonra, CSs'nin fonksiyonel özellikleri, yani vuruş hızı ve Ca2+ kullanımı, farklı zaman noktalarında değerlendirilmiştir (Şekil 2). Yükselme zamanı, pik zaman, bozunma süresi ve kalsiyum geçici süresi (CTD90) gibi kalsiyum geçici parametreleri Şekil 2A,B'de belirtildiği gibi değerlendirildi. Yenen CS'lerin yüzdesi, nesilden sonraki ilk 3 haftada benzerdir, ancak 6. haftada (Wk6) CSs'de önemli ölçüde düşmüştür (Şekil 2C). Dayak hızı, Wk1'e kıyasla Wk3'te önemli ölçüde azaldı ve yenen CS'lerin yüzdesine benzer şekilde, Wk6'da çarpıcı bir şekilde düştü (Şekil 2D). Wk6'da, hem atma hızındaki hem de atan CSs sayısındaki düşüşü açıklayabilen CS bozulması gözlendi. kalsiyum geçici parametrelerinin ölçümü, Wk2'de (Şekil 2E) önemli ölçüde daha yüksek bir tepe değeri gösterirken, Wk3'te Wk1'e kıyasla yükselme süresi, çürüme süresi ve CTD90 önemli ölçüde artmıştır (Şekil 2F-H ). Birlikte ele alındığında, bu sonuçlar hiPSC-CM kaynaklı sferoidlerin nesil sonrası yaklaşık 2. ve 3. haftalarda işlevsel olarak optimal olduğunu göstermektedir.
Şekil 3, küresel boyutun dayak hızı ve kalsiyum kullanımı üzerindeki etkisini göstermektedir. CS'ler, 2.5 x 10 4, 5 x 104, 10 x 10 4 ve 20 x 10 4 hiPSC-CM'lerin 96 kuyucuklu bir plakanın kuyusunda koşul başına toplam 24 CSs/kuyucuk için tohumlanmasıyla oluşturulmuştur (Şekil 3A). Beklendiği gibi, kullanılan hücre sayısı arttıkça küresel boyut artmış, 178 ± 36 μm ile 351 μm ± 65 μm arasında değişmiştir (Şekil 3A, sağ panel). Ca2+ geçicileri 3 haftalık KYS'lerde dört farklı tohumlama yoğunluğunda ölçüldü (Şekil 3B). Beating CSs ölçümleri, daha küçük boyutlu CS'lerin (2.5K- ve 5K-CS'ler) sadece% 50'sinin dövüldüğünü, daha büyük boyutlu döven CS'lerin (10K- ve 20K-CSs) yüzdesinin ise anlamlı derecede daha yüksek olduğunu (yaklaşık% 85) göstermiştir (Şekil 3C). Benzer bir dayak hızı (yaklaşık 28 bpm), 2.5K-CS'lere kıyasla önemli ölçüde daha yüksek olan 5K, 10K- ve 20K-CSs tarafından gösterilmiştir (Şekil 3D). Kalsiyum görüntülerinin tepe değerleri test edilen tüm koşullarda benzerdi (Şekil 3E), ancak yükselme süresi (Şekil 3F), bozunma süresi (Şekil 3G) ve CTD90 (Şekil 3H), daha küçük olanlara (2.5K ve 5K-CSs) kıyasla daha büyük boyutlu CS'lerde (10K ve 20K-CS'ler) anlamlı derecede artmıştır. Birlikte ele alındığında, bu sonuçlar hiPSC-CM türevli sferoidlerin, 10K ve 20K hiPSC-CM'ler / kuyular arasında bir tohumlama yoğunluğu kullanıldığında kalsiyum işleme taraması için en uygun olduğunu göstermektedir.
Daha sonra, kriyoprezervasyonun CS'nin yaşayabilirliği ve işlevi üzerindeki etkisini değerlendirdik. Analizden önce, çözülmüş CS'ler kültürde 1 hafta boyunca muhafaza edildi (Şekil 4A). Hem akış sitometrisi (Şekil 4B) hem de Calcein-(Şekil 4C) hücre canlılığı testleri ile gösterildiği gibi, kriyoprezervasyon, CSs içindeki hücre canlılığını etkilemedi. Ek olarak, çözülmüş CS'ler, taze yaş uyumlu CS'lere kıyasla benzer sarkomerik protein ekspresyon seviyelerini göstermiştir (Şekil 4D). Bu veriler, CS'lerin sonraki kardiyak fonksiyon analizi ve yüksek verimli tarama için verimli bir şekilde kriyokorunabileceğini göstermektedir.
Son olarak, dayak aktivitesi ve Ca2+ kullanımı hem taze hem de kriyokorunmuş CSs'de ölçülmüştür (Şekil 5). Vuruş CSs'sinin yüzdesi, çözülmeden sonra, sırasıyla 2, 5 ve 7 günde farklı zaman noktalarında ölçüldü. Yeni CS'lerin çoğu zamanla dayak aktivitesi gösterirken, kriyokorunmuş CS'lerin dayak aktivitelerini geri kazanmak için 1 haftaya kadar kültürlenmeye ihtiyaçları olduğu açıktır (Şekil 5B). Çözülmüş CS'lerin dayak hızında taze olana karşı önemli bir değişiklik olmadı; ancak bazı dondurulmuş CS'lerde spontan dayak aktivitesi gözlenmedi (Şekil 5C). Dondurulmuş/çözülmüş CS'lerde pik değerler tazeye kıyasla anlamlı derecede azalmış olmasına rağmen (Şekil 5D), dondurulmuş/çözülmüş CS'lerin yükselme süresi, bozunma süresi ve CTD90'ında tazeye kıyasla anlamlı bir değişiklik gözlenmemiştir (Şekil 5E-G). Bu veriler, çözülmeden sonra, çırpma aktivitesini ve Ca2 + geçicisini ölçmeden önce CSs'nin inkübatörde en az 1 hafta iyileşmesine izin vermenin önemli olduğunu göstermektedir.
Birlikte ele alındığında, bu sonuçlar hiPSC-CM türevi sferoidlerin kriyoprezervasyonunun kardiyomiyosit canlılığını, sarkomerik yapıyı ve spontan atma aktivitesi ve kalsiyum kullanımı gibi fonksiyonel özelliklerini koruduğunu göstermektedir. Bu nedenle, hiPSC-CM türevli sferoidler, kardiyak elektrofizyolojiyi in vitro olarak doğru bir şekilde özetlemek için uygun bir modeli temsil eder.
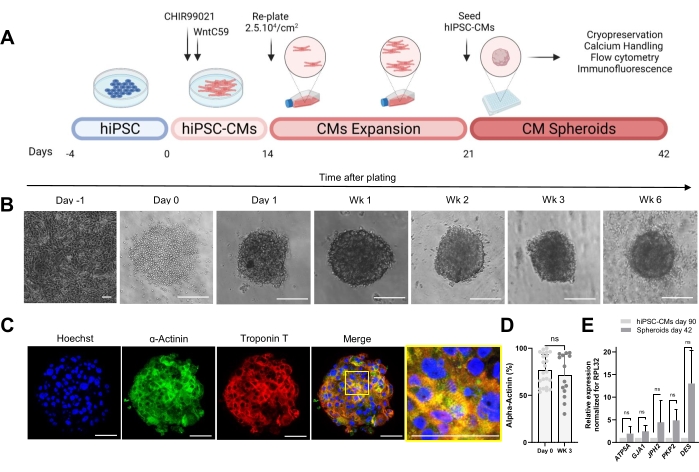
Şekil 1: Kardiyak sferoidlerin üretimi . (A) Wnt tabanlı yönlendirilmiş kardiyak farklılaşmanın şematik gösterimi, daha sonra hiPSC-CM'lerin genişlemesi ve CS'lerin oluşturulması. biorender.com ile oluşturuldu. (B) CS kültürünün farklı zaman noktalarında parlak alan görüntüleri. Ölçek çubuğu, 200 μm. Wk haftayı temsil eder. (C) 3 haftalık CSs'de kardiyak sarkomerik proteinler α-aktin ve troponin T için temsili immünofloresan görüntüleri. İmmünofloresan: Hoechst (mavi), α-aktinin (yeşil) ve troponin T (kırmızı). Ölçek çubuğu, 200 μm. Sağdaki yakınlaştırılmış birleştirilmiş resim, sarkomer organizasyonunu gösterir. Ölçek çubuğu, 50 μm. (D) CSs oluşumundan önce (0. gün) ve 3 hafta sonra α-aktinin pozitif hücrelerin akış sitometrisi nicelleştirilmesi. (n = koşul başına 14-23. (E) RT-qPCR, hücre kavşakları, ara filamentler ve mitokondri ile ilgili farklı kardiyak genlerin ekspresyon seviyelerini belirlemek için 90 gün (2D) boyunca kültürlenmiş hiPSC-CM'ler ve 42 gün boyunca kültürlenmiş sferoid örnekler üzerinde gerçekleştirilir. (n = 1-3 parti). Veriler, eşlenmemiş bir t-testi ile hesaplanan ortalama ± SD. NS (anlamlı olmayan) olarak temsil edilir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
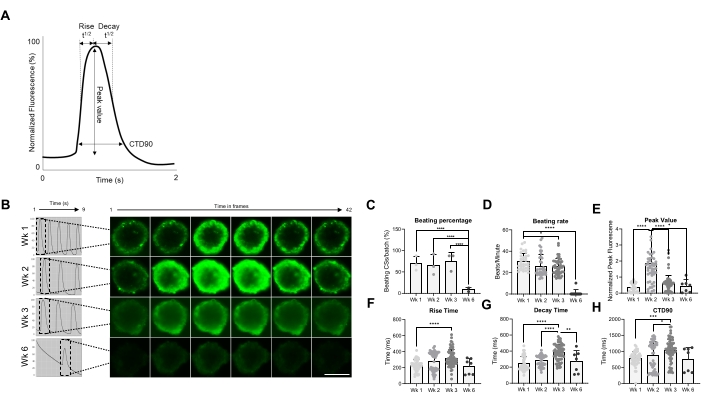
Şekil 2: Üretimden sonraki farklı haftalarda CSs'de dayak hızı ve kalsiyum kullanımı. (A) Cyteseer Software'deki Vala bilimleri analiz algoritması tarafından hesaplanan kalsiyum geçici parametrelerinin örnekleri. (B) Temsili kalsiyum geçici izleri ve CSS'nin üretim sonrası farklı zaman noktalarında (haftalar) hızlandırılmış görüntüleri. Ölçek çubuğu, 200 μm. (C) Spontan dayak aktivitesinin zaman seyri niceliği, dövülen CSs'nin yüzdesi olarak ifade edilir. (D) Kültürleme süresi boyunca CSs'nin dayak hızı. (E-H) Pik değer, yükselme süresi, bozunma süresi ve CTD90 gösteren kalsiyum geçicilerinin miktarı. Biyolojik replikasyonlar = üç, teknik replikalar = sırasıyla 38, 50, 66 ve 7 olan ortalama ± SD'dir. *p < 0,05, ****p < 0,001; tek yönlü ANOVA'nın ardından Tukey'in post hoc çoklu karşılaştırma testi. Kısaltma; CTD = kalsiyum geçici süresi, Wk = hafta, CSs = insan kardiyak sferoidleri. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
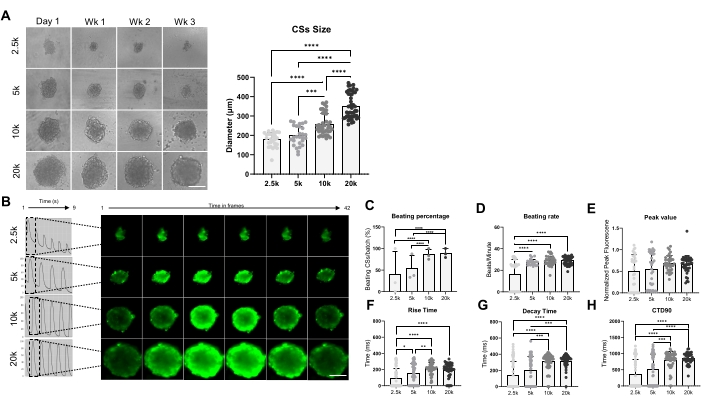
Şekil 3: Farklı hücre tohumlama yoğunlukları kullanılarak üretilen CS'lerde dayak hızı ve kalsiyum işleme. (A) Farklı sayıda hiPSC-CM kullanılarak oluşturulan CS'lerin parlak alan görüntüleme (solda) ve boyut ölçümleri (sağda). Ölçek çubuğu, 200 μm. (B) 2.5K-20K-CSs'nin temsili kalsiyum geçici izleri ve hızlandırılmış görüntüleri. (C,D) 2.5K-20K-CSs'lik vuruş yüzdesi ve yenme oranı. (E-H) 2.5K-20K-CSs'de tepe değeri, yükselme süresi, bozunma süresi ve CTD90. Veriler ortalama ± SD. Biyolojik replikasyonlar = üç, teknik replikalar = 28-39. *p < 0,05, ****p < 0,001; tek yönlü ANOVA'nın ardından Tukey'in post hoc çoklu karşılaştırma testi. Kısaltmalar: CTD = kalsiyum geçici süresi, Wk = hafta, k = x 1.000 hücre, CSs = kardiyak sferoidler. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
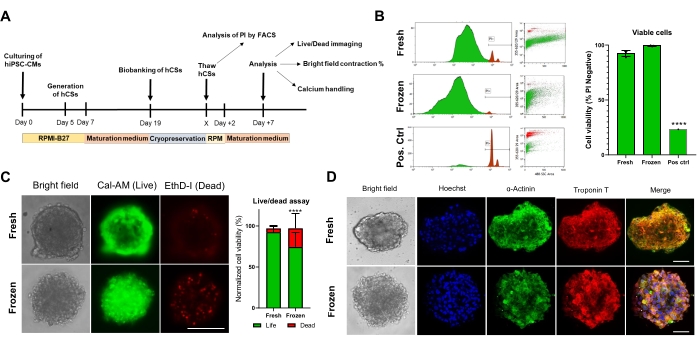
Şekil 4. Kriyoprezervasyonun kardiyak sferoidlerin yaşayabilirliği ve yapısı üzerine etkisi. (A) CS üretiminin, müteakip biyobankacılığın ve çözülmenin şematik gösterimi. (B) Hem taze hem de kriyokorunmuş CS'lerde akış sitometrisi hücre canlılığı testi. Pozitif kontrol olarak, 5 dakika boyunca% 10 Triton-X çözeltisi içeren bir tedavi kullanıldı. (n = koşul başına 4). Veriler ortalama SD ± olarak gösterilir. ****p < 0,001; tek yönlü ANOVA'nın ardından Tukey'in post hoc çoklu karşılaştırma testi. (C) 7 günlük kültürlemeden sonra taze ve çözülmüş CS'lerde Calcein-hücre canlılığı testi (n = koşul başına 15-17, * ***p < 0.001, eşleştirilmiş t-testi ile; ölçek çubuğu, 200 μm). (D) Taze ve çözülmüş CS'lerde α-aktinin ve troponin T ekspresyonu için temsili parlak alan (solda) ve immünofloresan boyama. İmmünofloresan: Hoechst (mavi), α-aktinin (yeşil) ve troponin T (kırmızı). Sağdaki birleştirilmiş resimler, CSs. Ölçek çubuğundaki sarkomer çizgilerini görüntüler, 50 μm. Kısaltmalar: X = seçim çözülen gün, PI = propidium iyodür, Cal-= calcein-, EthD-I = Ethidium Homodimer I. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
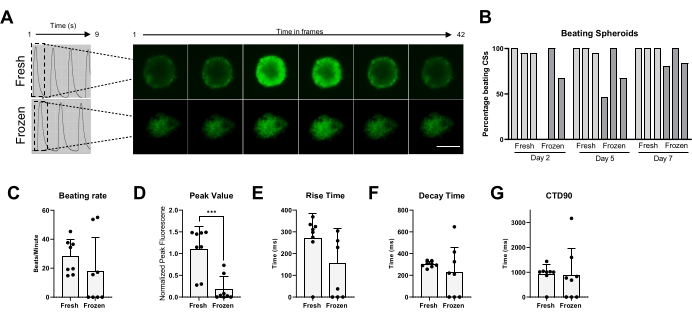
Şekil 5: Taze ve çözülmüş CSs'deki kalsiyum geçicileri. (A) CSs'nin kriyoprezervasyondan önce ve çözülmeden 1 hafta sonra temsili kalsiyum geçici izleri ve hızlandırılmış görüntüleri. (B) Taze ve dondurulmuş/çözülmüş kardiyak sferoidlerin dövülme yüzdesi. Çubuklar tek tek denemeleri temsil eder. (C) Taze ve dondurulmuş/çözülmüş kardiyak sferoidlerin dövülme hızı. (D-G) Kalsiyum geçici parametrelerinin miktarı: tepe değeri, yükselme süresi, bozunma süresi ve CTD90. Veriler ortalama ± SD'dir. *p < 0,05, ****p < 0,001; tek yönlü ANOVA'nın ardından Tukey'in post hoc çoklu karşılaştırma testi. Kısaltma; CTD = kalsiyum geçici süresi, CSs = kardiyak sferoidler. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Ek Şekil 1: Akış sitometrisi analizi için temsili geçit stratejileri. (A) Saf bir popülasyonda negatif kontrol ve izotip kontrolüne karşı α-aktininin pozitif hiPSC-CM'leri için temsili geçiş stratejisi. α-aktininin pozitif analiz edilen hücre sayısı 25 x 105'tir. Kısaltma; SSC = yan saçılma, PI+ = propidium iyodür pozitif. (B) Hem taze, çözülmüş, pozitif kontrol (Triton-X) hem de negatif kontrol (lekesiz) canlılık analizi için temsili geçit stratejisi. Bu Dosyayı indirmek için lütfen tıklayınız.
Tartışmalar
Kardiyak ilaç keşfi, okumaları doğru bir şekilde gerçekleştirmek için yetersiz verim ve fizyolojik sadakate sahip insan dışı hayvan ve hücresel modellere güvenilmesi nedeniyle engellenmektedir. HT enstrümantasyonu ve fizyolojik problarla birlikte hiPSC-CM biyolojisi, insan modellerini kalp hastalığı modellemesinin ve ilaç keşfinin en erken aşamalarına yeniden sokma potansiyeline sahiptir. Optimal bir kalp hastalığı modellemesi ve ilaç tarama platformu için yüksek kaliteli ve fonksiyonel CSs üreten bir 3D kalp dokusu üretim yöntemi geliştirdik. Ek olarak, endüstriyel EV üretimi için 3D biyoreaktör sistemlerinde küresel teknolojiyi birleştirmek, EV tabanlı tedavinin klinik çevirisine yönelik gerekli bir adımı sağlar. Burada açıklanan yöntem birkaç önemli faktöre dayanır ve mevcut protokollerin 9,10,28,29 bir çeşididir. Bu yöntemler şunları içerir: 1) 3D doku yapılarının oluşturulması, 2) taramadan önce optimal hücre sayısı ve zamanlaması, 3) cihazların duyarlılığını ve yüksek verim kapasitesini artırmak ve 4) herhangi bir fonksiyonel analizden önce sferoidleri dondurabilmek. Daha önce açıklanan protokollerin aksine, önerilen protokol günde 1.500 sferoid üretimini ve HTS için uygunluğu açıklamaktadır. Mevcut 96 kuyucuklu kalsiyum görüntüleme sistemlerini veya 24 kuyucuklu çoklanmış mühendislik kalp dokularını kullanarak 10 replikasyon için 6 x 0.5 log dozunun üzerinde yüz bileşiğin geleneksel analizi, yaklaşık 500 milyon ila 3 milyar hiPSC-CM31,32 gerektirir. Önerilen uygulama, kardiyak taramaları geleneksel sistemlere kıyasla daha az maliyetli ve zaman etkili hale getirmektedir, çünkü 96 kuyucuklu plakalar, tarif edilen yönteme kıyasla tohumlama yoğunluğunun sadece% 10'unu gerektirmektedir. Dahası, asılı-damla yöntemi gibi önceki protokollerle karşılaştırıldığında, ultra düşük bağlantı plakalarında kendiliğinden toplanarak sferoidlerin üretilmesi, tek mikro dokuların yüksek kaliteli otomatik görüntülenmesini sağlar33.
Bu küçük 3D model, in vivo kardiyovasküler ortamın biyolojik ve fizyolojik fenotipini taklit eder. Daha önce gösterildiği gibi, kalsiyum geçicileri, 2D tek katmanlı hücre kültürlerine kıyasla 3D kalp dokusu yapılarında çarpıcı bir şekilde artmaktadır34.
Daha sonra, tohumlama yoğunluğunun ve uygun kültürleme süresinin de başarılı bir CS taraması için kritik faktörler olduğunu bulduk. Sferoid başına 10K-20K hiPSC-CM'lerin yoğunlukları ve nesilden sonraki 2-3. haftalar arasındaki tarama optimal iken, çok küçük veya çok eski sferoidler bozulmuş kalsiyum kullanımı göstermektedir (Şekil 2 ve Şekil 3). Bu nedenle, tohumlama yoğunluklarını mümkün olduğunca tutarlı tutmak önemlidir, çünkü boyut fonksiyonel parametreleri etkiler. Ayrıca, bu optik yöntem bir bütün doku olarak canlı 3D kültürler için iyi sonuçlar sağlasa da, zaman alıcı histoloji yöntemlerine güvenmeden (alt) hücresel düzeyde daha büyük sferoidler içinde veri elde etmek zordur. Son zamanlarda, işaretleyicilerin tek hücreli nicelleştirilmesi fırsatı ile tüm 3D sferoidlerin elde edilmesini sağlayan "optik olarak temizleme" kullanan çeşitli yaklaşımlar yayınlanmıştır. Burada, CS hasadından görüntü analizine 3 günlük bir protokol uyarladık, bu da konfokal mikroskopi29 kullanılarak 3D görüntüleme için optimize edilmiştir (Şekil 1C ve Şekil 4D).
Son olarak, 3D kalp dokusu uygulamaları ve ticari uygulamalardaki artışla birlikte, çeşitli donörlerden uzun süreli depolama ve hastaya özgü biyobankacılığa olan talep artmaktadır. Kriyoprezervasyon, zaman içinde birden fazla partiden HTS plakaları üretmek için etkili bir stratejidir. HiPSC-CM'lerin donması daha önce tanımlanmıştır ve diğer kültürlenmiş hücre tiplerine kıyasla farklı değildir 10,35,36. Son zamanlarda, 2D hücreli plakaları dondurmak için yaklaşımlar tanımlanmıştır37. Burada, PSC kriyoprezervasyon kitinin diğer üçüne kıyasla en uygun durum olduğunu (veriler gösterilmemiştir) bulduk ve bu ortamı sferoidlerin verimli bir şekilde dondurulması için kullandık. Kriyoprezervasyondan sonra, canlılık yüksek kalır (Şekil 4B, C), ancak CSs'nin elektrofizyolojik özellikleri etkilenir ve çözülmeden sonra bir kuluçka süresi gereklidir. Gerçekten de, çözülmeden 1 hafta sonra, CSs kendiliğinden atma aktivitesi ve kalsiyum kullanımı gösterdi. Bununla birlikte, taze ve geri kazanılmış hiPSC-CM'lerin her zaman aynı moleküler ve fizyolojik özellikleri göstermediği açıklanmıştır38. Bu sınırlama, ilaca bağlı kardiyak okumaları değerlendirmek için kriyokorunmuş hiPSC-CM'ler kullanıldığında dikkate alınmalıdır. Ayrıca, sferoid başına düşen hücre sayısını ve kalsiyum geçici görüntülemenin optimal zamanlamasını etkili bir şekilde modüle etmemize rağmen, hiPSC türevi kardiyomiyosit hücrelerini endotel hücreleri, fibroblastlar, hücre hücre kavşakları ve kitosan, kollajen IV, fibronektin, matrijel veya laminin gibi hücre dışı matrislerle karıştırarak kardiyak sferoidler geliştirilebilir. in vivo kardiyak ortamı taklit ederek39, 40. Genel olarak, hastalık modelleme ve HT ilaç taraması gibi aşağı akış uygulamaları için uygun olan CS'leri verimli bir şekilde oluşturmak için adım adım bir protokol öneriyoruz.
Açıklamalar
Yazarların açıklayacak hiçbir şeyleri yoktur.
Teşekkürler
Cyteseer yazılım paketi ve otomatik 3D kalsiyum analizinin optimizasyonu için VALA bilimlerine teşekkür ederiz. PLN vakfının (RM) hibe desteğini kabul etmek istiyoruz. P.A.D. ve F.S. CUREPLaN Leducq tarafından desteklenmektedir. J.P.G.S., Avrupa Araştırma Konseyi'nin (ERC) H2020-EVICARE (#725229) tarafından desteklenmektedir. J.W.B., UMC Utrecht Klinik Bursu, Hollanda Kalp Enstitüsü Bursu ve CVON-Dosis genç yetenek bursu tarafından desteklenmektedir; Hollanda Kalp Vakfı (CVON-Dosis 2014-40). N.C., Hollanda Bilimsel Araştırma Örgütü (RegmedXB #024.003.013) ve Marie Skłodowska-Curie Eylemleri (Hibe anlaşması RESCUE #801540) tarafından "Malzeme Güdümlü Rejenerasyon" Yerçekimi Programı tarafından desteklenmektedir. V.S.-P. İttifak Fonu (UMCU, UU, TU/e) tarafından desteklenmektedir. A.V.M., AB tarafından finanse edilen BRAVE projesi tarafından desteklenmektedir (H2020, ID:874827)
Malzemeler
| Name | Company | Catalog Number | Comments |
| 24 wells suspenion plate | Corning | 3738 | |
| 96 wells Ultra-Low Attachment Multiple Well Plate | Corning | CLS3474-24EA | |
| Albumax | Thermo Fisher Scientific | 11020021 | |
| Anti-α-Actinin (Sarcomeric) antibody | Sigma-Aldrich | A7811 | Dilution: 1:200 |
| Anti-Cardiac Troponin T antibody (ab45932) | Abcam | ab45932 | Dilution: 1:200 |
| Ascorbic acid | Sigma-Aldrich | A8960 | |
| B-27 supplement | Thermo Fisher Scientific | 17504-044 | |
| Biotin | Sigma-Aldrich | B4639 | |
| Bovine serum albumin fraction V (BSA) | Roche | 10735086001 | |
| Cal-520, AM | Abcam | ab171868 | |
| Confocal microscope | Leica | DMi8 | |
| Confocal microscope software | Leica | Las X | |
| Conical tubes 15 mL | Greiner Bio-One | 5618-8271 | |
| Creatine monohydrate | Sigma-Aldrich | C3630 | |
| DAPI | Thermo Fisher Scientific | D3571 | Concentration: 1 µg/mL |
| DMEM no glucose | Thermo Fisher Scientific | 11966025 | |
| EDTA | Thermo Fisher Scientific | 15575020 | |
| Fructose | Sigma-Aldrich | 76050771.05 | |
| Glucose | Sigma-Aldrich | G7021 | |
| Glycerol | Boom | 76050771.05 | |
| Goat anti-mouse Alexa Fluor 488 | Invitrogen | A11029 | Dilution: 1:500 |
| Goat anti-rabbit Alexa Fluor 568 | Invitrogen | A11011 | Dilution: 1:500 |
| Horizontal shaker | IKA | 4003000 | |
| Human induced pluripotent stem cell lines | (Stanford Cardiovascular Institute (S-CVI) Biobank) | CVI-273 (control 1) | |
| Human induced pluripotent stem cell lines | Germany | 141 (control 2) 144 (control 3) | |
| Hydrochloric acid (HCl) | Ajax Firechem | 265.2.5L-PL | 10 M stock solution, corrosive |
| Isotype control, FITC mouse IgM κ isotype | BD | 556652 | |
| KnockOut Serum Replacement | Thermo Fisher Scientific | 10828 | Protect from light |
| L-carnitine | Sigma-Aldrich | C0283 | |
| Myocyte calcium and contractility system | Leica | Thunder, DMi8 | |
| Non essential amino acids (NEAA) | Thermo Fisher Scientific | 11140 | |
| Paraformaldehyde solution 4% in 1x PBS, pH 7.0–7.6 | Santa Cruz | SC281692 | Hazardous |
| PBS, pH 7.4 | Thermo Fisher Scientific | 10010023 | |
| Penicillin/streptomycin | Thermo Fisher Scientific | 15140 | |
| PES Membrane Vacuum Filter system | Corning | 431097 | |
| PI/RNase Staining Solution | Invitrogen | F10797 | Dilution: 1:1000 |
| Pluronic F-127 | Sigma-Aldrich | P2443 | |
| PSC Cryopreservation Kit | Thermo Fisher Scientific | A2644601 | |
| RevitaCell | Thermo Fisher Scientific | A2644501 | |
| RPMI 1640 medium | Thermo Fisher Scientific | 11875 | |
| Silicone Elastomer Kit | SYLGARD | 184 | |
| Sodium dodecyl sulfate solution (10%) | Sigma-Aldrich | 71736 | |
| Sodium L-Lactate | Sigma-Aldrich | 71718 | |
| Taurine | Sigma-Aldrich | T0625 | |
| Tris Fisher | Scientific | 11486631 | |
| Triton X-100 | Merck | X100-1L | Hazardous |
| Trypan blue solution, 0.4% | Thermo Fisher Scientific | 15250061 | |
| TrypLE Select Enzyme (10x) | Thermo Fisher Scientific | A1217701 | |
| Tween-20 | Sigma-Aldrich | P1379 | |
| Urea | Sigma-Aldrich | 51456 | |
| Vitamin B12 | Sigma-Aldrich | V6629 | |
| Y-27632 dihydrochloride (Rho-kinase inhibitor) | Tocris | 1254 | Protect from light |
Referanslar
- Burridge, P. W., et al. Chemically defined and small molecule-based generation of human cardiomyocytes. Nature Methods. 11 (8), 855-860 (2014).
- Kattman, S. J., et al. Stage-specific optimization of activin/nodal and BMP signaling promotes cardiac differentiation of mouse and human pluripotent stem cell lines. Cell Stem Cell. 8 (2), 228-240 (2011).
- Lian, X., et al. Robust cardiomyocyte differentiation from human pluripotent stem cells via temporal modulation of canonical Wnt signaling. Proceedings of the National Academy of Sciences. 109 (27), 1848-1857 (2012).
- Paige, S. L., et al. Endogenous Wnt/beta-catenin signaling is required for cardiac differentiation in human embryonic stem cells. PLoS One. 5 (6), 11134 (2010).
- Gintant, G., et al. Use of human induced pluripotent stem cell-derived cardiomyocytes in preclinical cancer drug cardiotoxicity testing: A scientific statement from the American Heart Association. Circulation Research. 125 (10), 75-92 (2019).
- Ahmed, R. E., et al. A brief review of current maturation methods for human induced pluripotent stem cells-derived cardiomyocytes. Frontiers in Cell and Developmental Biology. 19 (8), 178 (2020).
- Liu, C., et al. Generating 3D human cardiac constructs from pluripotent stem cells. EBioMedicine. 76, 103813 (2022).
- Musunuru, K., et al. Induced pluripotent stem cells for cardiovascular disease modeling and precision medicine: A scientific statement from the American Heart Association. Circulation: Genomic and Precision Medicine. 11 (1), 000043 (2018).
- Buikema, J. W., et al. Wnt activation and reduced cell-cell contact synergistically induce massive expansion of functional human iPSC-derived cardiomyocytes. Cell Stem Cell. 27 (1), 50-63 (2020).
- Maas, R. G. C., et al. Massive expansion and cryopreservation of functional human induced pluripotent stem cell-derived cardiomyocytes. Cell STAR Protocols. 2 (1), 100334 (2021).
- Tremblay, C., et al. A new construction technique for tissue-engineered heart valves using the self-assembly method. Tissue Engineering Part C: Methods. 20 (11), 905-915 (2014).
- Lewis-Israeli, Y. R., et al. Self-assembling human heart organoids for the modeling of cardiac development and congenital heart disease. Nature Communications. 12 (1), 5142 (2021).
- Goldfracht, I., et al. Engineered heart tissue models from hiPSC-derived cardiomyocytes and cardiac ECM for disease modeling and drug testing applications. Acta Biomaterialia. 1 (92), 145-159 (2019).
- Fleischer, S., et al. Comprehensive human stem cell differentiation in a 2D and 3D mode to cardiomyocytes for long-term cultivation and multiparametric monitoring on a multimodal microelectrode array setup. Biosensors and Bioelectronics. 126, 624-631 (2019).
- Branco, M. A., et al. Transcriptomic analysis of 3D cardiac differentiation of human induced pluripotent stem cells reveals faster cardiomyocyte maturation compared to 2D culture. Science Reports. 9 (1), 9229 (2019).
- Ergir, E., et al. Generation and maturation of human iPSC-derived cardiac organoids in long term culture. bioRxiv. , (2022).
- Lemoine, M. D., et al. Human iPSC-derived cardiomyocytes cultured in 3D engineered heart tissue show physiological upstroke velocity and sodium current density. Scienctific Reports. 7 (1), 5464 (2017).
- Kofron, C. M., et al. A predictive in vitro risk assessment platform for pro-arrhythmic toxicity using human 3D cardiac microtissues. Science Reports. 11 (1), 10228 (2021).
- Giacomelli, E., et al. Human-iPSC-derived cardiac stromal cells enhance maturation in 3D cardiac microtissues and reveal non-cardiomyocyte contributions to heart disease. Cell Stem Cell. 26 (6), 862-879 (2020).
- Richards, D. J., et al. Human cardiac organoids for the modelling of myocardial infarction and drug cardiotoxicity. Nature Biomedical Engineering. 4 (4), 446-462 (2020).
- Tenreiro, M. F., et al. Next generation of heart regenerative therapies: progress and promise of cardiac tissue engineering. npj Regenerative Medicine. 6 (1), 30 (2021).
- Hansen, A., et al. Development of a drug screening platform based on engineered heart tissue. Circulation Research. 107 (1), 35-44 (2010).
- McDermott-Roe, C., et al. Investigation of a dilated cardiomyopathy-associated variant in BAG3 using genome-edited iPSC-derived cardiomyocytes. Journal of Clinical Investigation Insight. 4 (22), 128799 (2019).
- National Library of Medicine (U.S.). Safety and efficacy of induced pluripotent stem cell-derived engineered human myocardium as biological ventricular assist tissue in terminal heart failure. National Library of Medicine. , (2020).
- Ronaldson-Bouchard, K., et al. Advanced maturation of human cardiac tissue grown from pluripotent stem cells. Nature. 556 (7700), 239-243 (2018).
- Oh, J. G., et al. Generation of ventricular-like HiPSC-derived cardiomyocytes and high-quality cell preparations for calcium handling characterization. Journal of Visualized Experiments. 155, 60135 (2020).
- Lian, X., et al. Directed cardiomyocyte differentiation from human pluripotent stem cells by modulating Wnt/β-catenin signaling under fully defined conditions. Nature Protocols. 8 (1), 162-175 (2013).
- Feyen, D. A. M., et al. Metabolic maturation media improve physiological function of human iPSC-derived cardiomyocytes. Cell Reports. 32 (3), 107925 (2020).
- van Ineveld, R. L., et al. Single-cell resolution three-dimensional imaging of intact organoids. Journal of Visualized Experiments. (160), e60709 (2020).
- Guo, Y., Pu, W. T. Cardiomyocyte maturation: New phase in development. Circulation Research. 126 (8), 1086-1106 (2020).
- Ding, B., et al. Three-dimensional renal organoids from whole kidney cells: Generation, optimization, and potential application in nephrotoxicology in vitro. Cell Transplantation. 29, 963689719897066 (2020).
- Denning, C., et al. Cardiomyocytes from human pluripotent stem cells: From laboratory curiosity to industrial biomedical platform. Biochimica Biophysica Acta. 1863, 1728-1748 (2016).
- Amaral, R. L. F., et al. Comparative analysis of 3D bladder tumor spheroids obtained by forced floating and hanging drop methods for drug screening. Frontiers in Physiology. 8, 605 (2017).
- Daily, N. J., et al. Improving cardiac action potential measurements: 2D and 3D cell culture. Journal of Bioengineering and Biomedical Science. 5 (3), 168 (2015).
- Preininger, M. K., et al. Cryopreservation of human pluripotent stem cell-derived cardiomyocytes: Strategies, challenges, and future directions. Advances in Experimental Medicine and Biology. 951, 123-135 (2016).
- Kim, Y. Y., et al. Cryopreservation of human embryonic stem cells derived-cardiomyocytes induced by BMP2 in serum-free condition. Reproductive Science. 18 (3), 252-360 (2011).
- Daily, M. I., et al. Cryopreservation of primary cultures of mammalian somatic cells in 96-well plates benefits from control of ice nucleation. Cryobiology. 93, 62-69 (2020).
- Zhang, J. Z., et al. Effects of cryopreservation on human induced pluripotent stem cell-derived cardiomyocytes for assessing drug safety response profiles. Stem Cell Reports. 16 (1), 168-181 (2021).
- Yeh, H. -. Y., et al. The calcium-dependent regulation of spheroid formation and cardiomyogenic differentiation for MSCs on chitosan membranes. Biomaterials. 33 (35), 8943-8954 (2012).
- Scalise, M., et al. From spheroids to organoids: The next generation of model systems of human cardiac regeneration in a dish. International Journal of Molecular Sciences. 22 (24), 13180 (2021).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır