Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
3D Hücre Kültürü için Mikro Gözenekli Tavlanmış Partikül İskelelerinde Partikül Fraksiyonunun Kontrol Edilmesi
Bu Makalede
Özet
Granüler iskeleler içindeki partikül fraksiyonundaki değişkenliği en aza indirmek, tekrarlanabilir deneyleri kolaylaştırır. Bu çalışma, in vitro doku mühendisliği uygulamaları için kontrollü parçacık fraksiyonlarına sahip granüler iskeleler üretme yöntemlerini açıklamaktadır.
Özet
Mikrojeller, hem in vitro hücre kültürü hem de in vivo doku onarımı için bir platform görevi gören mikro gözenekli tavlanmış parçacık (MAP) iskelelerinin yapı taşlarıdır. Bu granüler iskelelerde, mikrojeller arasındaki boşluk boşluğunun yarattığı doğuştan gelen gözeneklilik, hücre infiltrasyonu ve göçünü sağlar. Boşluk fraksiyonunu ve parçacık fraksiyonunu kontrol etmek, MAP iskele tasarımı için kritik öneme sahiptir, çünkü gözeneklilik hücreler için biyoaktif bir ipucudur. Küresel mikrojeller, kontrollü boyut ve şekil için mikroakışkan bir cihaz üzerinde üretilebilir ve daha sonra polimer ağının kırılmasını önleyen yöntemler kullanılarak dondurularak kurutulabilir. Rehidrasyon üzerine, liyofilize mikrojeller MAP iskelelerinde kontrollü parçacık fraksiyonlarına yol açar. Mikrojel liyofilizasyonu için bu yöntemlerin uygulanması, parçacık fraksiyonunun makromolekül difüzyonu ve hücre yayılımı üzerindeki etkisini gösteren tekrarlanabilir çalışmalara yol açmıştır. Aşağıdaki protokol, MAP iskelelerinde parçacık fraksiyonunu kontrol etmek için mikrojellerin üretimini, liyofilizasyonunu ve rehidrasyonunu ve ayrıca mikrojellerin in vitro 3D hücre kültürü için biyo-ortogonal çapraz bağlama yoluyla tavlanmasını kapsayacaktır.
Giriş
Mikro gözenekli tavlanmış parçacık (MAP) iskeleleri, mikrojel (μgel) yapı taşlarının toplu, gözenekli bir iskele oluşturmak için birbirine bağlandığı granüler malzemelerin bir alt sınıfıdır. Bu granüler iskelelerin benzersiz mikromimarisi ile, birbirine bağlı küresel mikrojel arasındaki boşluk boşluğunun yarattığı doğuştan gelen gözeneklilik, hızlandırılmış hücre infiltrasyonunu ve göçünü destekler1. MAP iskelelerinin mikrojel yapı taşları, kimyasal modifikasyonlarla hem sentetik hem de doğal polimerlerden imal edilebilir2. Burada açıklanan yöntemler, fonksiyonel norbornen (NB) sapları ile modifiye edilmiş bir hyaluronik asit (HA) omurgasından oluşan mikrojellerin kullanımını özellikle vurgulamaktadır. HA polimeri üzerindeki NB fonksiyonel tutamacı, mikrojeller oluşturmak ve MAP iskeleleri oluşturmak için bunları birbirine bağlamak için tıklama kimyası reaksiyonlarını destekler 3,4. Mikrojelleri birbirine bağlamak için enzimatik1, ışık bazlı5,6 ve katkısız tıklama kimyası 3,7 reaksiyonları gibi çok sayıda şema kullanılmıştır (yani, tavlama). Bu çalışmada, HA-NB mikrojellerini birbirine bağlamak için tetrazin-norbornen ters elektron talebi Diels-Alder konjugasyonu kullanılarak katkısız tıklama kimyası açıklanmaktadır.
MAP iskelelerini imal etmek için, kullanıcılar önce parti sistemlerinde veya mikroakışkan cihazlarda ters emülsiyonlar kullanarak ve ayrıca elektrohidrodinamik püskürtme, litografi veya mekanik parçalanma2 ile mikrojel yapı taşlarını üretirler. Küresel HA-NB mikrojellerinin üretimi iyi tanımlanmış ve daha önce hem toplu emülsiyon2 hem de mikroakışkan damlacık oluşturma teknikleri 8,9,10,11 kullanılarak bildirilmiştir. Bu çalışmada, küresel HA-NB mikrojelleri, dahaönce 8,9,10'da tanımlandığı gibi, kontrollü boyut ve şekil için akış odaklı bir mikroakışkan platform üzerinde üretildi. Saflaştırmadan sonra, mikrojeller sulu bir süspansiyonda bulunur ve sıkışmış bir duruma neden olmak için konsantre edilmelidir. Sıkıştığında, mikrojeller, enjekte edilebilir, boşluk doldurucu malzemeler olarak işlev görmelerini sağlayan kesme inceltme özellikleri sergiler1. Sıkışmış bir durumu indüklemenin bir yöntemi, mikrojelleri liyofilizasyon veya dondurarak kurutma yoluyla kurutmak, daha sonra kurutulmuş ürünü kontrollü bir hacim12'de yeniden hidratlamaktır. Alternatif olarak, fazla tampon, bir süzgeç üzerinde santrifüjleme yoluyla veya tamponun aspirasyon yoluyla veya emici bir malzeme kullanılarak mikrojel peletinden manuel olarak çıkarılmasıyla mikrojel bulamacından uzaklaştırılabilir. Bununla birlikte, mikrojelleri kurutmak için santrifüjleme kullanmak, granüler iskeleler12 yaparken oldukça değişken bir partikül fraksiyonları ve boşluk fraksiyonları aralığı oluşturabilir. Polietilen glikol (PEG) mikrojelleri için %70 IPA13, jelatin metakriloil (GelMa) mikrojelleri için florlu yağlar14 ve HA mikrojelleri için %70 etanol kullanılarak mikrojellerin liyofilize edilmesi için tekniklertanımlanmıştır 12. Bu protokol, kurutma işlemi sırasında orijinal mikrojel özelliklerini korumak için standart bir laboratuvar reaktifi olan %70 etanol kullanarak küresel HA mikrojellerinin dondurularak kurutulması için yöntemleri vurgulamaktadır. Dondurularak kurutulmuş HA mikrojelleri, MAP iskeleleri12'deki son partikül fraksiyonlarını kontrol etmek için kullanıcı tanımlı ağırlık yüzdelerinde tartılabilir ve yeniden hidratlanabilir.
MAP iskele oluşumundaki son adım, toplu, gözenekli bir iskele oluşturmak için mikrojellerin tavlanmasına dayanır1. Doğal hücre dışı matris bileşenlerini kullanarak ve biyo-ortogonal tavlama şemaları kullanarak, MAP iskeleleri hem in vitro hücre kültürü hem de in vivo doku onarımı için biyouyumlu bir platform görevi görür3. Bu yaklaşımlar sayesinde, MAP iskeleleri, doku mühendisliği uygulamalarında kullanılmaları için kullanıcı tanımlı parçacık fraksiyonlarına sahip HA-NB yapı taşlarından imal edilebilir12. Aşağıdaki protokol, HA-NB mikrojellerinin mikroakışkan üretimini ve ardından MAP iskelelerinde parçacık fraksiyonunu kontrol etmek için liyofilizasyon ve rehidrasyon ile tanımlanmaktadır. Son olarak, mikrojellerin tavlanması için adımlar, in vitro 3D hücre kültürü deneyleri için biyo-ortogonal kimya kullanılarak tanımlanmıştır.
Protokol
1. Mikroakışkan cihaz imalatı
- Yumuşak litografi
NOT: Bu protokol, de Wilson ve ark.9'dan akış odaklı bir mikroakışkan cihaz tasarımının cihaz üretimini açıklamaktadır. Bununla birlikte, bu protokol SU-8 gofret üzerindeki herhangi bir cihaz tasarımıyla kullanılabilir. Gofret bir Petri kabına bantlanabilir ve daha sonra PDMS'nin gofret özelliklerine15 yapışmasını önlemek için silanjasyona tabi tutulması gerekir.- Polidimetilsiloksan (PDMS) elastomer bazını kürleme maddesi ile 10:1 oranında karıştırın (bakınız Malzeme Tablosu). Gofreti ~5 mm PDMS ile kaplamak için yaklaşık 100 g hazırlayın. PDMS karışımını gofret üzerine dökün ve yaklaşık 30 dakika boyunca bir kurutucuda gazı boşaltın. Tüm kabarcıklar gittikten sonra, PDMS'yi iyileştirmek için en az 2 saat boyunca 60 ° C'de bir fırına koyun.
- Gofreti çatlatmadan cihazın parametresinin etrafını nazikçe izlemek için bir bıçak kullanın; Ardından, PDMS'yi gofretten dikkatlice soyun. Giriş ve çıkış kanallarını oluşturmak için 1 mm'lik bir biyopsi zımbaları kullanın (bkz.
NOT: Mikroakışkan cihazı delerken nazik olun. Giriş veya çıkış kanallarının etrafındaki yırtılmalar veya yırtılmalar, mikrojel üretimi sırasında sızıntılara neden olabilir. - Özellik tarafındaki cihazdaki tozu temizlemek için bant kullanın. Nemi gidermek için cihazları yerleştirin ve cam slaytları 135 ° C'de bir sıcak plakaya en az 15 dakika boyunca temizleyin.
- Bir duman davlumbazında, yaklaşık 30 saniye boyunca hem cam slaytlarda hem de cihazlarda (özellik tarafı açıkta) yüksekte bir korona plazma tabancası ( Malzeme Tablosuna bakınız) kullanın ve ardından bunları hızlı bir şekilde birbirine bağlayın. Cihaz ile cam slayt arasında iyi bir sızdırmazlık sağlamak için yavaşça basınç uygulayın. Bağı sabitlemek için cihazları gece boyunca 60 °C'lik bir fırına yerleştirin.
2. Norbornen (NB) fonksiyonel saplı hyaluronik asit (HA) mikrojellerinin mikroakışkan üretimi
- HA-NB sentezi
NOT: HA-norbornen (HA-NB) sentezi, Darling ve ark.3'ten, 1:1.5:2.5 HA-tekrar birimlerinin molar eşdeğerleri ile 79 kDa sodyum HA kullanılarak 4-(4,6-dimetoksi-1,3,5-triazin-2-yl)-4-metilmorfolinyum klorür (DMTMM) ila 5-norbornen-2-metilamin (NMA) olarak uyarlanmıştır.- Reaktanları tartın. HA'yı 200 mM MES tamponunda (pH ~6) 20 mg/mL'de bir beherde veya şişede karıştırarak bir karıştırma plakasında çözün. Çözüldükten sonra, DMTMM'yi HA çözeltisine ekleyin ve oda sıcaklığında yaklaşık 20 dakika reaksiyona girmesine izin verin. Örneğin, 1 g HA + 1.09 g DMTMM + 845 μL NMA kullanılabilir.
- NMA'yı HA/DMTMM çözümüne damla damla ekleyin. Buharlaşmayı en aza indirmek ve reaksiyon kabını folyo ile örtmek için reaksiyon kabının açıklığına parafilm ekleyin. Reaksiyonun yaklaşık 24 saat boyunca ilerlemesine izin verirken karıştırmaya devam edin.
- 24 saat sonra, 200 geçirmez etanol soğutun (reaksiyon hacminin yaklaşık 10 katı). Bir karıştırma plakasında, HA-NB'yi çökeltmek için reaksiyonu soğutulmuş etanolün üzerine damla damla aktarın ve 20 dakika boyunca 200-300 rpm'de karıştırmaya devam edin.
- Çözeltiyi 50 mL konik tüplere aktarın ve ardından 10 dakika boyunca 5.000 x g'de santrifüj yapın. Atık olarak atmak için fazla etanol dökün. Bu noktada, HA-NB ürünü konik tüplerde beyaz peletler olmalıdır. Gece boyunca kuruması için HA-NB üzerindeki vakumu bir çözücüde çekin.
- HA-NB'yi 12-14 kDa moleküler ağırlıklı kesilmiş selüloz diyaliz tüpü kullanarak saflaştırın (bkz. HA-NB'yi 2 M NaCl çözeltisinde çözün ve diyaliz tüpüne aktarın. Boruyu bağlayın ve gerekirse kelepçelerle sabitleyin. Doldurulmuş diyaliz tüpünü 5 L ultra saf su içeren bir kovaya aktarın ve HA-NB'yi gece boyunca suya karşı çevirin.
- Ertesi gün, suyu çıkarın ve 30 dakika boyunca 1 M NaCl çözeltisi ile değiştirin. NaCl çözeltisini çıkarın ve ardından suyu günlük olarak değiştirerek 3 gün boyunca ultra saf suya karşı diyaliz yapın.
- Diyalizli ürünü 0,2 μm vakumla çalışan filtre kullanarak filtreleyin ve ardından filtrelenmiş ürünü 50 mL konik tüplere aktarın.
- Kriyojenik bir kaba sıvı azot ekleyin ve HA-NB tüplerini 10 dakika boyunca flaşla dondurun. Ardından, konik tüpleri forseps ile çıkarın ve kapağı hızlı bir şekilde çıkarın ve laboratuvar sınıfı bir doku ile örtün (bkz. Dokuyu lastik bir bantla sabitleyin ve bir liyofilizasyon kabına veya odasına aktarın ( bakınız Malzeme Tablosu) ve liyofilize edin. Liyofilize ürünü -20 °C'de saklayın.
DİKKAT: Sıvı azot tehlikeli bir maddedir. Sıvı azotla çalışırken uygun kişisel koruyucu ekipmanı giyin. - HA-NB'yi D2O'da 10 mg / mL'de çözerek ve proton NMR ile analiz ederek norbornen modifikasyonunu ölçün (Şekil 1A)16.
- İşlevselleştirme miktarını belirlemek için, önceD2O çözücü zirvesini 4,8 PPM'ye kalibre edin. HA metil protonları (δ2.05) için zirveyi entegre edin ve entegrasyonu 3.0'a kalibre edin. Daha sonra, kolye norbornen grupları için zirveleri δ6.33 ve δ6.02'de (vinil protonlar, endo) entegre edin. Ortalama modifikasyon derecesini belirlemek için bu zirvelerin karşılık gelen proton sayısına entegrasyonunu normalleştirin3.
- HA-NB mikrojel öncüsünün hazırlanması
- 50 mM HEPES tamponu (pH 7,5) hazırlayın ve 0,2 μm vakumla çalışan bir filtre kullanarak tamponu steril olarak filtreleyin. HEPES tamponunu kullanarak, ilgili 50 mM lityum fenil (2,4,6,-trimetilbenzoil) fosfin (LAP) foto-başlatıcı ve tris (2-karboksiyetil) fosfin (TCEP) indirgeyici ajan stoklarını hazırlayın. LAP solüsyonunu ışıktan uzak tutun.
- Steril damıtılmış suda ilgili 50 mM di-tiol bağlayıcı ve RGD peptid stoklarını hazırlayarak diğer mikrojel öncü bileşenlerini hazırlayın. HA-NB'yi tartın ve 10 mg/mL'lik bir stok hazırlamak için HEPES tamponunda çözün.
NOT: Kullanıcı tercihine bağlı olarak mikrojellerin dahili çapraz bağlanması için farklı di-tiol bağlayıcılar kullanılabilir. Hem parçalanabilir (yani, MMP-parçalanabilir) hem de parçalanamayan (dithiothreitol veya DTT) bağlayıcı, Malzeme Tablosunda listelenmiştir. RGD peptidi, MAP iskelelerinde hücre yapışmasını teşvik etmek için mikrojel formülasyonuna dahil edilmiştir, ancak bu bileşen çıkarılabilir ve eşit hacimli HEPES tamponu ile değiştirilebilir. - İstenilen son hacme ulaşmak için ekstra HEPES tamponu ekleyerek öncü bileşenleri 9,9 mM LAP, 0,9375 mM TCEP (4 tiol/TCEP), 2,8 mM di-tiol bağlayıcı, 1 mM RGD peptid ve ağırlıkça %3,5 (w/v) HA-NB nihai konsantrasyonlarıyla birleştirin. Pozitif yer değiştirmeli pipet kullanarak öncülü iyice karıştırın.
- Bir P1000 pipet kullanarak tüm karışımı yavaşça yukarı çekin. Ucu 1 mL'lik bir şırınganın ucuna koyun ve ucu pipetten çıkarın. Karışımı şırıngaya yüklemek için şırınga pistonunu çekin ve ardından şırınganın ucuna 0,2 μm'lik bir filtre ekleyin ve yeni bir 1,5 mL mikrosantrifüj tüpüne süzün. Filtreleme sırasında üretilen kabarcıkları gidermek için filtrelenmiş öncü çözeltiyi santrifüj edin.
- Yine, bir P1000 pipet kullanarak, kabarcıklar oluşturmamaya dikkat ederek filtrelenmiş öncülü yavaşça yukarı çekin. Kabarcıklar varsa, yerinden çıkmaları ve üste doğru yüzmeleri için uca hafifçe dokunun.
- Ucu 1 mL'lik bir şırınganın ucuna yerleştirin ve ucu pipetten çıkarın. Şırıngayı dikey tutun ve tüm öncü çözelti şırıngaya girene kadar şırınga pistonunu yavaşça çekin. Şırıngaya künt bir uç iğnesi ekleyin ve öncülü iğnenin ucundan itin. Işıktan uzak tutmak için şırıngayı folyoya sarın.
- Mikrojel sıkıştırma çözeltisinin hazırlanması
- Ağır beyaz mineral yağda% 5 v / v Span-80 hazırlayın ve iyice karıştırın. Kabarcıkları çıkarmak için kurutun. Yüzey aktif madde/yağ karışımını oda sıcaklığında folyoya sarılmış halde tutun. İyice karıştırın ve her kullanımdan önce kurutun.
- Piston ve parmak tutuşu arasındaki mesafe yaklaşık olarak öncü şırınganın mesafesine eşit olana kadar yağ / yüzey aktif madde karışımını (kabarcıkları en aza indirmek) çekmek için 5 mL'lik bir şırınga kullanın. Şırıngaya künt bir iğne ekleyin ve yağı iğnenin ucundan geçirin.
- Mikroakışkan cihaz kurulumu
- 1 mL'lik bir şırıngaya künt bir iğne ekleyin ve sentetik hidrofobik arıtma çözeltisi ile doldurun (bkz. Çözeltiyi, her girişte/çıkışta birikinceye kadar mikroakışkan cihazdan yavaşça akıtın. Çözeltiyi tezgahın üstündeki cihazda yaklaşık 30 dakika kurumaya bırakın ve ardından fazla çözeltiyi çıkarmak için çıkıştaki vakumu çekin. Cihazı masa üstü mikroskop üzerindeki kelepçelerle sabitleyin.
- 15 mL'lik bir konik tüpü folyo ile sarın ve mikrojel toplama kabı olarak hizmet etmek için bir tüp rafına yerleştirin. UV ışık probunu toplama tüpünün açıklığına yerleştirmek için kelepçeli bir halka standı kullanın. UV yoğunluğunu ölçmek için bir UV dedektörü kullanın (bkz. Malzeme Tablosu) ve probu 20 mW/cm2 elde edilene kadar hareket ettirin. UV ışığını daha sonraya kadar kapatın.
- Boruyu, mikroakışkan cihazdan toplama kabına ulaşacak bir uzunlukta kesin. Borunun bir ucunda, 45°'lik bir açı kesin. Borunun açılı ucunu yavaşça çıkış kanalına yerleştirin.
NOT: Boruyu mikroakışkan cihaza yerleştirirken nazik olun. Giriş veya çıkış kanallarının etrafındaki yırtılmalar veya yırtılmalar, mikrojel üretimi sırasında sızıntılara neden olabilir. - Hem öncü hem de yağ fazı şırıngalarını çift şırınga pompasına sabitleyin (bkz. Şırınga uçlarından mikroakışkan cihaza ulaşacak uzunlukta iki boru parçası daha kesin. Her tüpün bir ucunda, 45°'lik bir açı kesin. Boruyu (künt uç) her iki şırınga ucuna dikkatlice sabitleyin.
- 1 mL şırınga için pompa üzerindeki ayarları değiştirin ve yaklaşık öncü hacmi ekleyin. Şırınga pistonlarına hem yağı hem de öncüyü borunun uçlarına itmek için yeterli basınç uygulanana kadar pompayı yavaşça ileri doğru itin ve sistemdeki havayı temizleyin. 2.4.6 adımına geçmeden önce basıncın 5-10 dakika eşitlenmesine izin verin.
- Borunun açılı ucunu, ön girişteki mikrojel öncü çözeltisi ve arka girişteki sıkıştırma yağı ile mikroakışkan cihazın giriş kanallarına yavaşça yerleştirin. Cihazda akış başlayana ve akış odaklama bölgesinde küresel mikrojeller oluşmaya başlayana kadar pompayı küçük artışlarla ileri doğru hareket ettirin. Pompayı 0,4 μL/dak debisiyle çalıştırın ve dengelenene kadar cihazın çalışmasına izin verin. Gerekirse, mikrojel üretimini stabilize etmek için akış hızını küçük artışlarla ±0,1 μL / dak olarak ayarlayın.
- Mikrojel üretimi Şekil 1B'de gösterildiği gibi stabilize olduğunda, toplama tüpünü yeni bir tüple değiştirin ve UV ışığını açın. Mikrojel üretiminin çalışma süresi boyunca kararlı olduğundan emin olmak için çalışmayı periyodik olarak kontrol edin.
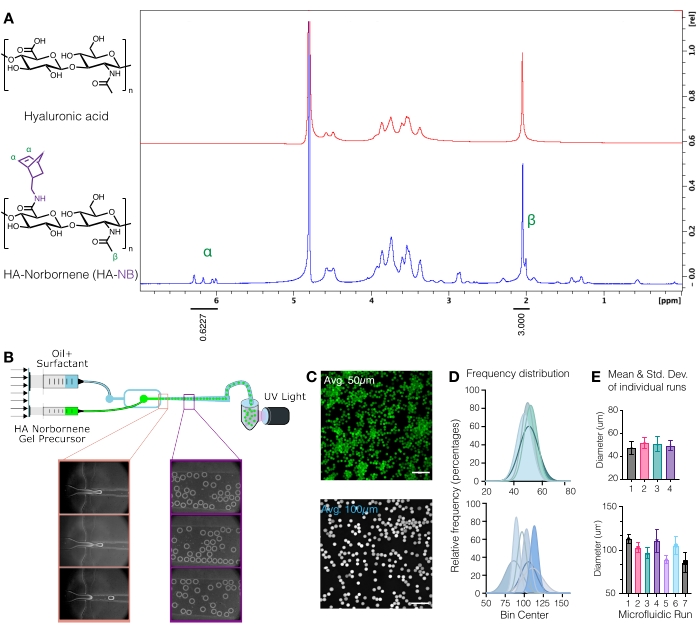
Şekil 1: Norbornen (NB) fonksiyonel saplı hyaluronik asit (HA) mikrojellerinin mikroakışkan üretimi. (A) Haz tekrarlama ünitelerinin yaklaşık% 31'i, döteryum oksitte yapılan proton NMR analizi ile belirlendiği gibi, NB ile başarılı bir şekilde modifiye edilmiştir. 1 adet Kolye norbornenlerinin δ6.33 ve δ6.02'deki (vinil protonlar, endo) ve δ6.26 ve δ6.23 ppm'deki (vinil protonlar, exo) H NMR kaymaları, işlevselleştirmeyi belirlemek için HA metil grubu δ2.05 ppm ile karşılaştırıldı. Anderson ve ark.12'den Elsevier'in izniyle yeniden basılmıştır. (B) HA-NB μgelleri üretmek için kullanılan akış odaklı mikroakışkan cihazın şeması. (C) Konfokal mikroskopiden maksimum yoğunluk projeksiyonları, floresan olarak etiketlenmiş μgelleri görselleştirmek için kullanıldı (ölçek çubuğu = 500 μm). (D) Mikroakışkan kurulumundaki bağımsız çalışmalardan mikrojel çapının frekans dağılımları, kullanılan cihaza bağlı olarak ~ 50 μm veya ~ 100 μm mikrojel boyutu üzerinde kontrol gösterir. (E) Mikrojel çapı, her bağımsız çalışma için ortalama ve standart sapma olarak rapor edilir. Wilson ve ark.9'dan Wiley'nin izniyle yeniden basılmıştır. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
3. Mikrojellerin saflaştırılması ve kurutulması
- Mikrojellerin saflaştırılması
- Mikrojel yıkama tamponunu (300 mM HEPES, 50 mM NaCl, 50 mM CaCl 2) ve%2 (w / v) Pluronik F-127 yüzey aktif madde çözeltisini yıkama tamponunda hazırlayın. 0,2 μm vakumla çalışan filtre kullanarak çözeltileri sterilize edin.
- Mikrojel toplama tüpünü (5.000 x g) 5 dakika boyunca santrifüj edin. Steril bir başlıkta, süpernatant yağ fazını dikkatlice aspire edin. μgels 1: 1'i% 2 Pluronik F-127 yüzey aktif madde çözeltisi ve vorteks ile iyice karıştırmak için birleştirin. 5 dakika boyunca santrifüj (5.000 x g) ve süpernatant yıkama solüsyonunu aspire edin.
- İyice karıştırmak için 4x mikrojel hacminde yıkama tamponu ve vorteks ekleyin. Karışımı 5 dakika boyunca santrifüj (5.000 x g) ve yıkama solüsyonunu aspire edin. Yüzey aktif madde sistemden çıkarılana kadar yıkama tamponu ile 4-8 yıkamayı tamamlayın (yani, kabarcık kalmaz).
- HA-NB mikrojellerinin floresan etiketlemesi
NOT: Floresan olarak etiketlenmiş bir tetrazinin kurum içi sentezi, iyi tanımlanmış ve daha önce bildirilmiş3. serilerde iki baz katalizörlü tiol-Michael ekleme reaksiyonuna dayanır. Bu çalışma için Alexa Fluor-488, norbornen modifiye μgellerin etiketlenmesi için tetrazin ile konjuge edildi. Liyofilize ürün (Alexa Flour 488-Tet), 1 mg / mL'de dimetilformamid içinde çözüldü ve -20 ° C'de saklandı.- μgelleri floresan olarak etiketlemek için, önce steril 1x PBS'de 1 mg / mL stok 1:14'ü seyrelterek Alexa Fluor 488-Tet'in çalışan bir çözeltisini hazırlayın. Steril bir davlumbazda, μgelleri çalışma çözeltisiyle birleştirin (hacimce 2:1).
- Deplasmanlı bir pipet kullanın ve iyice karıştırın. Karışımı oda sıcaklığında 1 saat veya 4 ° C'de gece boyunca inkübe edin.
- Santrifüj (5.000 x g) ve boyama solüsyonunu aspire edin. Reaksiyona girmemiş Alexa Fluor 488-Tet'i çıkarmak için μgelleri 1x PBS (hacimce 1:1) ile iki kez yıkayın.
NOT: Bu noktada, floresan olarak etiketlenmiş μjeller, mikrojel boyutunu ölçmek için konfokal mikroskopta görüntülenebilir (Şekil 1C-E)9. Mikrojel boyutunu ölçme yöntemleri Roosa ve ark.17 tarafından ayrıntılı olarak tanımlanmıştır.
- HA-NB mikrojellerinin kurutulması
- Arıtılmış μjelleri (Şekil 2A) pozitif deplasmanlı pipet kullanarak kriyo-güvenli vidalı kapaklı bir tüpe aktarın. Saflaştırılmış μjellere %50 (v/v) %70 etanol ekleyin ve yer değiştirmeli pipetle iyice karıştırın. 5.000 x g'da 5 dakika santrifüj.
DİKKAT: Etanol oldukça yanıcı bir maddedir.
NOT: Kriyo-güvenli vidalı kapak tüpü, μjeller eklenmeden önce tartılabilir ve daha sonra μjellerin kütlesini belirlemek için liyofilizasyondan sonra tekrar tartılabilir. Bu, 1 mg'dan daha az miktarlar kullanıldığında hatayı en aza indirmek için önerilir. Kullanmadan önce kantarın dahili olarak ayarlandığından veya kalibre edildiğinden emin olun. - Süpernatant sıvıyı aspire edin ve% 70 etanol (% 50 v / v) ile değiştirin (Şekil 2B). Deplasmanlı bir pipetle iyice karıştırın. Gece boyunca 4 ° C'de inkübe edin.
NOT: Mikrojeller, gerekirse uzun süreli depolama için liyofilizasyondan önce 4 °C'de% 70 etanol içinde saklanabilir. Liyofilize mikrojeller Şekil 2C'de gösterilmiştir. Bu adımda kriyofil oluşumu isteniyorsa diğer liyofilizasyon ortamları da kullanılabilir (Şekil 2D). - μgellerin vidalı kapak tüpünün altında olduğundan emin olmak için kısaca santrifüj yapın. Kriyojenik bir kaba sıvı azot ekleyin ve ardından flaş-dondurmak için μjel tüpünü ekleyin.
- 5-10 dakika sonra, μgels tüpünü forseps ile çıkarın. Kapağı hızla çıkarın ve laboratuvar sınıfı bir doku ile örtün. Dokuyu lastik bir bantla sabitleyin ve bir liyofilizasyon kabına veya odasına aktarın.
- Numuneyi, üreticinin talimatlarını izleyerek liyofilizatöre yükleyin. 0.066 Torr ve -63 °C'de liyofilize edin. Liyofilize μgelleri (liyo-μjeller) oda sıcaklığında sıkıca kapatılmış olarak saklayın.
NOT: Liyofilizasyon, tüm sıvı tüpten çıkarıldığında ve kurutulmuş bir ürün kaldığında tamamlanır. Organik çözücüler, yaygın liyofilizasyon sistemlerindeki kauçuk armatürlerin ömrünü azaltabilir.
- Arıtılmış μjelleri (Şekil 2A) pozitif deplasmanlı pipet kullanarak kriyo-güvenli vidalı kapaklı bir tüpe aktarın. Saflaştırılmış μjellere %50 (v/v) %70 etanol ekleyin ve yer değiştirmeli pipetle iyice karıştırın. 5.000 x g'da 5 dakika santrifüj.
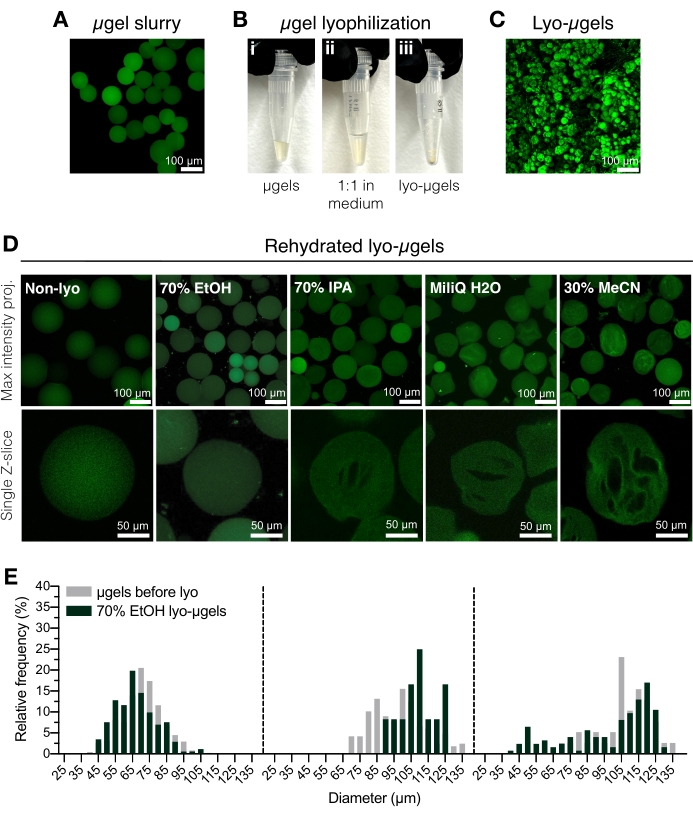
Resim 2: HA-NB mikrojellerinin kurutulması. (A) Sulu çözelti içinde μjellerin maksimum yoğunluk projeksiyonu (ölçek çubuğu = 100 μm). (B) Saflaştırılmış μjeller, tercih edilen liyofilizasyon ortamında hacimce 1: 1 oranında inkübe edilebilir ve liyofilize edilebilir. (C) Kurutulmuş liyo-μjellerin maksimum yoğunluk projeksiyonu (ölçek çubuğu = 100 μm). (D) Mikrojeller liyofilizasyondan sonra yeniden askıya alınır. Liyofilizasyon işlemi boyunca μjellerin orijinal özelliklerini korumak için EtOH (% 70) önerilir; Bununla birlikte, izopropil alkol (IPA), su ve asetonitril (MeCN) gibi diğer ortamlar, kriyogen oluşumunu kolaylaştırmak için birbirinin yerine kullanılabilir (ölçek çubuğu = 100 veya 50 μm). (E) Üç mikrojel popülasyonu için frekans dağılımları olarak gösterilen %70 EtOH'da liyofilizasyondan önce (gri) ve sonra (yeşil) HA-NB mikrojel çapının ölçülmesi. Anderson ve ark.12'den Elsevier'in izniyle yeniden basılmıştır. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
4. MAP iskele imalatı
- Tetrazin bağlayıcı sentezi
NOT: Tetrazin bağlayıcılar, serbest norbornen gruplarını taşıyan μjelleri birbirine bağlamak için kullanılabilir (Şekil 3A). HA-tetrazin (HA-Tet) sentez prosedürü, Zhang ve ark.18'den, 1:1:0.25 HA-tekrar birimlerinin molar eşdeğerleri ile 79 kDa sodyum HA kullanılarak DMTMM'den tetrazin-amine uyarlanmıştır (Şekil 3B)12.- Reaktanları tartın. HA'yı 200 mM MES tamponunda (pH ~6) 20 mg/mL'de bir beherde veya şişede karıştırarak bir karıştırma plakasında çözün. Çözüldükten sonra, DMTMM'yi HA çözeltisine ekleyin ve oda sıcaklığında yaklaşık 20 dakika reaksiyona girmesine izin verin. Örneğin, 100 mg HA + 72.8 mg DMTMM + 14.14 mg tetrazin-amin kullanılabilir.
- Tetrazin-amini 15 mg/mL'de 200 mM MES tamponunda çözün ve HA/DMTMM çözeltisine damla damla ekleyin. HA-Tet reaksiyon kurulumu için Şekil 3C'ye bakınız.
- Buharlaşmayı en aza indirmek ve reaksiyon kabını folyo ile örtmek için reaksiyon kabının açıklığına parafilm ekleyin. Reaksiyonun yaklaşık 24 saat boyunca ilerlemesine izin verirken karıştırmaya devam edin.
- 24 saat sonra, 200 geçirmez etanol soğutun (reaksiyon hacminin yaklaşık 10 katı). Bir karıştırma plakasında, HA-Tet'i çökeltmek için reaksiyonu soğutulmuş etanolün üzerine damla damla aktarın (Şekil 3D) ve 20 dakika boyunca karıştırmaya devam edin.
- Çözeltiyi 50 mL konik tüplere aktarın ve ardından 10 dakika boyunca 5.000 x g'de santrifüj yapın. Atık olarak atmak için fazla etanol dökün. Gece boyunca kuruması için HA-Tet üzerindeki vakumu bir dessicator içinde çekin. Protokolün bu adımındaki kurutulmuş ürünün bir örneği Şekil 3E'de bulunabilir.
- HA-Tet'i diyaliz kullanarak arındırın. HA-Tet'i 2 M NaCl çözeltisinde çözün ve 12-14 kDa moleküler ağırlık kesimi ile selüloz diyaliz borusuna aktarın. Doldurulmuş diyaliz tüpünü 5 L ultra saf su içeren bir kovaya aktarın ve HA-Tet'i gece boyunca suya karşı çevirin.
- Ertesi gün, suyu çıkarın ve 30 dakika boyunca 1 M NaCl çözeltisi ile değiştirin. NaCl çözeltisini çıkarın ve ardından suyu günlük olarak değiştirerek 3 gün boyunca ultra saf suya karşı diyaliz yapın.
- Diyalizli ürünü 0,2 μm vakumla çalışan filtre kullanarak filtreleyin ve ardından filtrelenmiş HA-Tet ürününü 50 mL konik tüplere aktarın.
- Konik tüpleri sıvı azotta 10 dakika boyunca flaşla dondurun ve ardından konik tüpleri forsepsle çıkarın. Kapağı hızla çıkarın ve laboratuvar sınıfı bir doku ile örtün. Dokuyu bir lastik bantla sabitleyin ve bir liyofilizasyon kabına veya odasına aktarın ve liyofilize edin. Liyofilize ürünü (Şekil 3F) -20 °C'de saklayın.
- HA-Tet'i D2O'da 10 mg / mL'de çözerek ve proton NMR ile analiz ederek tetrazin modifikasyonunu ölçün (Şekil 3G)16.
- İşlevselleştirme miktarını belirlemek için, önceD2O çözücü zirvesini 4,8 PPM'ye kalibre edin. HA metil protonları (δ2.05) için zirveyi entegre edin ve entegrasyonu 3.0'a kalibre edin. Daha sonra, kolye tetrazin grupları için pikleri δ8.5 (2H) ve δ7.7 (2H) (aromatik protonlar) olarak entegre edin. Ortalama modifikasyon derecesini belirlemek için bu zirvelerin karşılık gelen proton sayısına entegrasyonunu normalleştirin12.
- Karakterizasyon için MAP iskeleleri oluşturmak üzere liyo-μgelleri birbirine bağlamak
- MAP iskele bileşenlerini hazırlayın (yani, μgels, HA-Tet, rehidrasyon hacmi). Liyo-μgelleri tartın (Şekil 4A) ve 1x PBS'lik nihai MAP hacminin %84'ünde yeniden oluşturun. Mikrojellerin yaklaşık 20 dakika şişmesine izin verin (Şekil 4B, C). Rehidrasyon için kullanılan ağırlık% MAP, kullanıcının nihai parçacık fraksiyonu tercihine göre seçilebilir ( Şekil 4D, E'ye bakınız).
- HA-Tet'i seçilen konsantrasyonda 1x PBS'de çözün (aşağıdaki NOTA bakınız).
NOT: Hem ambalajlama fraksiyonunun (ağırlıkça %MAP ile ) hem de HA-Tet konsantrasyonunun değiştirilmesi, yığın iskele mekanik özelliklerini değiştirecektir. Örneğin, 0,02 mg/mL HA-Tet (tavlama oranı 2,6 mol Tet:mol HA-NB) ile çapraz bağlanmış ağırlıkça %3,4'lük bir MAP iskelesi, yaklaşık 700 Pa kesme depolama modülü12 olan MAP iskeleleri oluşturur. - HA-Tet ve liyo-μjelleri birleştirmek ve iyice karıştırmak için bir yer değiştirme pipeti kullanın. Bu noktada, karışım yer değiştirmeli pipet aracılığıyla cam slaytlara, kuyu plakalarına veya kullanıcının seçtiği bir kaba aktarılabilir. Μjellerin 25 dakika boyunca 37 ° C'de tavlanmasına izin verin ve ardından MAP iskelelerini 1x PBS ile doldurulmuş kuyu plakalarına aktarmak için bir spatula kullanın. MAP iskelelerini karakterizasyona hazır olana kadar 1x PBS'de tutun.
- MAP iskele parçacık fraksiyonunun hesaplanması
- Daha iyi görüntü kalitesi için, MAP iskelesini spatula kullanarak cam bir kapak kapağına aktarın. Görüntü MAP iskeleleri, FITC uyarım ve emisyon için lazer kullanarak konfokal mikroskop üzerinde. Görüntü MAP iskeleleri 20x hedefinde ve 2,5 μm adım boyutunda Z yönünde 250-300 μm çapraz bir Z-yığını elde edin. Görüntünün μm/piksel kalibrasyonunu not edin.
- Z-stack görüntüsünü analiz yazılımına aktarın (bkz. Yeni Yüzeyler Ekle düğmesini seçin. Yalnızca İlgi Çekici Bir Bölgeyi Segmentlere Ayırma kutusunu işaretleyin ve ardından mavi ok düğmesini İleri: İlgi Çekici Bölge'yi seçin.
- Analiz edilen hacmin X-, Y- ve Z-boyutlarını izleyerek bir ilgi alanı tanımlayın. Mavi ok düğmesini seçin İleri: Kaynak Kanal.
NOT: X ve Y boyutları piksel birimi cinsindendir, Z boyutu ise adım sayısıdır. İlgilenilen bölge için önerilen bir Z-yüksekliği en az iki μgel içermelidir. - FITC kanalını seçmek için Kaynak Kanal açılır listesini kullanın. Pürüzsüz'ün yanındaki kutuyu işaretleyin ve 2,50 μm'lik bir yüzey ayrıntısı girin. Eşik altında, Mutlak Yoğunluk'u seçin ve ardından mavi ok düğmesini seçin İleri: Eşik.
- FITC kanalı için önerilen eşik değerini kullanın. İşleme kalitesini değerlendirmek ve gerektiğinde ayarlamak için 3B projeksiyonu döndürün. İleri: Yüzeyleri Sınıflandırma'yı seçin.
NOT: Geri düğmesi, işlemdeki Z boyutu gibi önceki adımları gerektiği gibi düzenlemek için kullanılabilir. - Voksel Sayısı'nın 10.0 olup olmadığını denetleyin ve ardından yeşil çift ok düğmesini seçin Son: Tüm oluşturma adımlarını yürütün ve sihirbazı sonlandırın.
NOT: Hacim oluşturma parametreleri, tüm iskeleleri analiz etmek için aynı ayarların uygulanması için toplu analiz için saklanabilir. - Verileri dışa aktarmak için, İstatistikler sekmesini ve ardından Ayrıntılı sekmesini seçin. Hacim değişkenini seçmek için ikinci açılan kutuyu kullanın. Disket düğmesini seçin Sekme Görüntüsündeki İstatistikleri Dosyaya Aktar ve istendiğinde elektronik tablo dosyası (.xls) olarak kaydedin.
- Dosyayı açın ve ilgilenilen bölgedeki μgellerin toplam hacmini (μm3) belirlemek için Sütun A Birimi'ndeki SUM işlevini kullanın.
- Analiz edilen ilgili bölgenin boyutlarını piksellerden μm'ye dönüştürün. X ve Y boyutlarını dönüştürmek için adım 4.3.1'deki görüntünün μm/piksel kalibrasyonunu kullanın. Z-boyutunu μm'ye dönüştürmek için görüntünün Z boyutunu (adım sayısı) adım boyutuyla çarpın. X-, Y- ve Z-boyutlarını çarparak ilgilenilen bölgenin hacmini (μm3) hesaplayın.
- İskelenin parçacık fraksiyonunu belirlemek için, ilgilenilen bölgedeki μjellerin toplam hacmini (adım 4.3.8'de bulunur) ilgili bölgenin hacmine (adım 4.3.9'da bulunur) bölün.
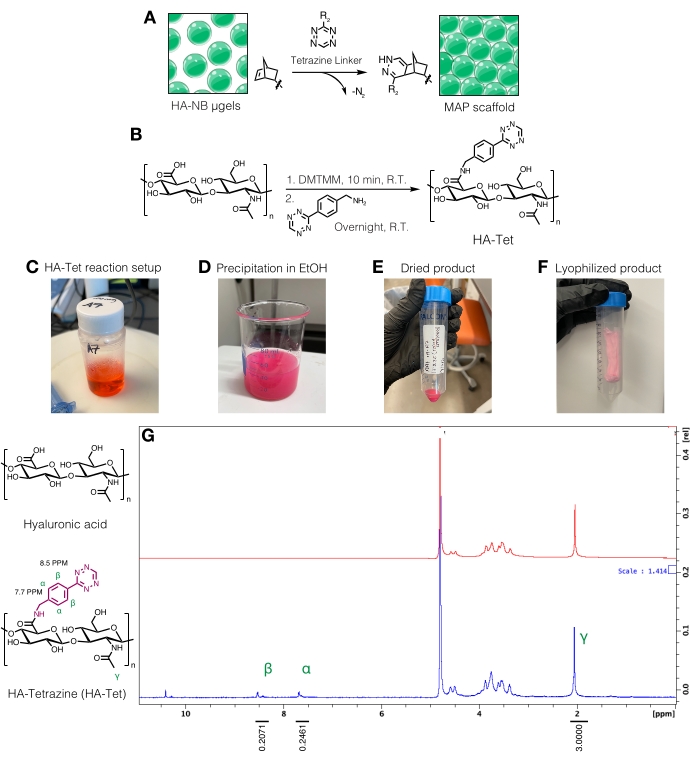
Resim 3: Mikro gözenekli tavlanmış parçacık (MAP) iskelelerinin imalatı için tetrazin bağlayıcı sentezi. (A) HA-NB μgellerinin şematiği, MAP iskeleleri oluşturmak için bir tetrazin bağlayıcı ile birbirine bağlanıyor. (B) HA-TET sentezi için reaksiyon şeması. (C) HA-Tet reaksiyonu kuruldu ve gece boyunca reaksiyona girmesine izin verildi, ardından (D) HA-Tet'in etanol içinde çökelmesi. (E) Saflaştırıldıktan ve kurutulduktan sonra, HA-Tet yeniden sulandırıldı ve (F) kurutulmuş, açık pembe bir ürün elde etmek için liyofilize edildi. (G) Proton NMR analizi, HA tekrar birimlerinin% 11'inin başarılı bir şekilde modifikasyonunu göstermektedir. Anderson ve ark.12'den Elsevier'in izniyle yeniden basılmıştır. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
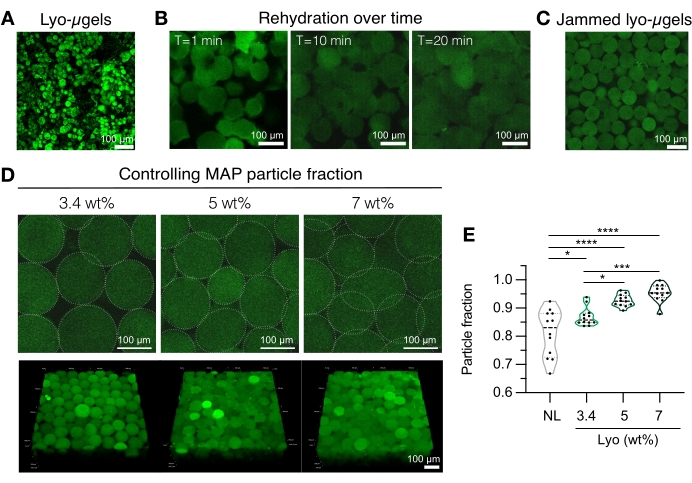
Şekil 4: MAP iskele imalatı için liyofilize mikrojellerin rehidrasyonu. (A) Kurutulmuş liyo-μjellerin maksimum yoğunluk projeksiyonu (ölçek çubuğu = 100 μm). (B) Dondurarak kuruduktan sonra, liyo-μjellerin rehidrasyonunun yaklaşık 20 dakika sürdüğü gösterilmiştir (ölçek çubuğu = 100 μm). (C) Lyo-μgeller, sıkışmış μjeller üretmek için değişen ağırlıkça% MAP'de rehidre edilebilir (ölçek çubuğu = 100 μm). (D) Liyo-μjelleri yeniden sulandırırken ağırlıkça% MAP'nin arttırılması, MAP iskelelerinin tek Z dilimleri ve hacim projeksiyonları (ölçek çubuğu = 100 μm) ile gösterildiği gibi, MAP iskelelerindeki parçacık fraksiyonunu değiştirir. (E) Bu kullanıcı tanımlı ağırlıkça% MAP iskeleleri kullanılarak, benzersiz parçacık fraksiyonları elde edilebilir (NL = liyofilize edilmemiş μgeller). Örneklerde Tukey HSD ile tek yönlü ANOVA uygulandı (n = 3), anlamlılık p < 0.05 (*), p < 0.01 (**), p < 0.005 (***) ve p < 0.001 (****) olarak bildirilmiştir. Anderson ve ark.12'den Elsevier'in izniyle yeniden basılmıştır. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
5.3D harita iskelelerinde hücre kültürü
- Hücre kültürü cihazları hazırlama
- Bu deneyler için özel bir hücre kültürü cihazı oluşturmak üzere (Şekil 5A-C), Ek Kodlama Dosyası 1'de bulunan CAD dosyasını kullanarak negatif bir kalıbı yazdırmak üzere bir 3B yazıcı kullanın.
NOT: Hücre kültürü cihazının boyutları aşağıdaki gibidir: 94,9 mm x 94,9 mm x 4,8 mm ile 2,6 mm toplam kuyu yüksekliği. İç kuyucukların ve dış kuyucukların çapı sırasıyla 4 mm ve 6 mm'dir. - Polidimetilsiloksan (PDMS) elastomer bazını kürleme maddesi ile kütlece 10:1 oranında karıştırın. PDMS karışımını büyük bir plastik Petri kabına dökün ve yaklaşık 30 dakika boyunca veya tüm kabarcıklar kaybolana kadar bir kurutucuda gazı boşaltın.
- Tüm kabarcıklar kaybolduktan sonra, yeni kabarcıkların oluşumunu en aza indirmek için 3D baskılı kalıbı PDMS'ye dikkatlice yerleştirin. PDMS'yi kürlemek için fırına en az 2 saat boyunca 60 °C'de yerleştirin.
- Kültür cihazının parametresinin etrafını nazikçe izlemek için bir bıçak veya tıraş bıçağı kullanın ve ardından kalıbı dikkatlice çıkarın. Herhangi bir PDMS'yi kuyucukların dibinden çıkarmak için 4 mm'lik bir biyopsi punch kullanın. Cihazları cam bir kapak kapağına sığacak şekilde kesin.
NOT: Hücre kültürü cihazları cam slaytlara da bağlanabilir, ancak cam kapaklar numune görüntülemeyi iyileştirir. - Kültür cihazlarının alt tarafındaki tozu temizlemek için bant kullanın. Nemi gidermek için temiz cam kapakları ve kültür cihazlarını (alt tarafı yukarı) 135 °C'de bir sıcak plakaya en az 15 dakika boyunca yerleştirin.
- Bir duman davlumbazında, hem cam kapak kayması hem de cihazın alt tarafında 30 saniye boyunca yüksek bir korona plazma tabancası kullanın ve ardından işlenmiş yüzeyleri hızlı bir şekilde birbirine bağlayın. Kültür cihazı ile cam kapak kayması arasında iyi bir sızdırmazlık sağlamak için yavaşça basınç uygulayın.
- Adım 5.1.6'yı tüm cihazlar için tekrarlayın ve ardından bağı sabitlemek için gece boyunca 60 °C'lik bir fırına yerleştirin. Cihazları in vitro kullanmadan önce sterilize etmek için otoklav yapın.
- Bu deneyler için özel bir hücre kültürü cihazı oluşturmak üzere (Şekil 5A-C), Ek Kodlama Dosyası 1'de bulunan CAD dosyasını kullanarak negatif bir kalıbı yazdırmak üzere bir 3B yazıcı kullanın.
- MAP iskelelerinde hücre kültürü
- MAP iskele bileşenlerini (yani, μgels, HA-Tet, ortam hacmi) istenen parçacık fraksiyonuna göre hazırlayın (Şekil 4D-E'ye bakınız). Liyo-μgelleri steril bir başlıkta tartın ve seçilen ağırlıkça %MAP'ye göre hücre ortamının nihai MAP hacminin %84'ünde yeniden oluşturun. Μgellerin yaklaşık 20 dakika şişmesine izin verin.
NOT: Bu yöntemler, kullanıcının rehidrasyon için liyo-mikrojel ürününü tartmasını gerektirir. Küçük kitleler için (1 mg veya daha az), μjelleri eklemeden ve liyofilize etmeden önce kriyotüpün tartılması ve daha sonra hatayı en aza indirmek için ürünün kütlesini belirlemek için liyofilizasyondan sonra tüpün yeniden tartılması önerilir. - HA-Tet'i hücre ortamında nihai MAP hacminin% 16'sında çözün.
NOT: MAP iskelelerinde tohumlama için hücreleri hazırlamak için aşağıdaki adımlar, kullanılan hücre türüne bağlı olarak değiştirilebilir. Bu protokolde, D1 fare mezenkimal hücreleri, Dulbecco'nun Modifiye Kartal Ortamında (DMEM) % 1 penisilin-streptomisin (pen-strep) ve% 10 fetal sığır serumu (FBS) ile desteklenerek yetiştirilmiştir (bkz. Bu hücreler için standart ader hücre kültürü protokolleri izlenmeli, kültürler doku kültürü ile muamele edilmiş kültür damarlarında 37 ° C'de ve% 5 CO2'de tutulmalıdır. - D1 fare mezenkimal hücreleri% 70 -% 80 akıcılığa ulaştığında, ortamı aspire edin ve hücreleri 1x PBS ile yıkayın. Doku kültürü damarının yüzeyini kaplamak için yeterli hacim% 1 tripsin-EDTA ekleyerek hücreleri kaldırın. 1-3 dakika boyunca 37 ° C'de inkübe edin ve daha sonra% 1 kalem-strep ve% 10 FBS ile desteklenmiş DMEM ortamını tripsin-EDTA'nın hacminin 2 katında ekleyerek tripsinizasyonu söndürün.
- Hücreleri peletlemek için hücre süspansiyonunu oda sıcaklığında 5 dakika boyunca 100 x g'de santrifüj yapın. Süpernatant medyayı aspire edin ve% 1 kalem-strep ve% 10 FBS ile desteklenmiş 1 mL DMEM medyasındaki hücreleri yeniden askıya alın.
- Hücre süspansiyonunun iyi karıştırıldığından emin olun ve ardından 20 μL'yi yeni bir mikrosantrifüj tüpüne aktarın. 20 μL tripan mavisi çözeltisi ekleyin ve iyice karıştırın. Bir hemositometre veya hücre sayma odası slaytlarına sahip otomatik bir hücre sayacı kullanarak hücreleri saymak için bu karışımın 20 μL'sini kullanın.
- 10.000 hücre/μL MAP'nin tohumlanması için gereken hücre sayısını yeni bir mikrosantrifüj tüpüne aktarın. Hücreleri peletlemek için oda sıcaklığında 5 dakika boyunca 100 x g'da santrifüj yapın. Süpernatant ortamı, hücreleri aspire etmeden hücre peletinden dikkatlice aspire edin.
- Migelleri ve çapraz bağlayıcıyı hücre peletine yer değiştirmeli pipetle ekleyin. Deplasmanlı bir pipetle iyice karıştırın ve ardından karışımın 10 μL'sini kuyucuk başına tohumlayın. Kaplama yaparken, karışımı kuyuya eşit olarak dağıtmak için dairesel bir hareketle pipetleyin.
- Kuyucukları doldurmak için hücre ortamı eklemeden önce μjellerin hücre inkübatöründe 37 ° C'de 25 dakika boyunca tavlanmasına izin verin (kuyucuk başına ~ 50 μL ortam). 3B kültürleri 37 ° C'de tutun ve medyayı gerektiği gibi değiştirin. Ortam değiştirirken iskelenin aspire edilmesini önlemek için, pipet ucunu üst kuyucuğun sırtı boyunca stabilize edin.
NOT: Kültür kuyularına sıvı eklerken veya çıkarırken, pipet ucunun ucunu, iskelenin kuyudan bozulma veya aspire edilme olasılığını en aza indirmek için MAP iskelesinin üzerindeki çıkıntının üzerine koyun. - İstenilen zaman noktalarında, ortamı çıkararak ve oda sıcaklığında 30 dakika boyunca kuyucuk başına 50 μL% 4 paraformaldehit ekleyerek numuneleri sabitleyin. Numuneleri 50 μL 1x PBS veya tercih edilen tamponla 3 kat yıkayın. Protokolün bu noktasında, çalışma hacminin yanı sıra başına 50 μL kullanılarak immünofloresan veya floresan boyama için standart yöntemler takip edilebilir.
NOT: Fiksasyon ve hücre boyama için bu yöntemler özellikle floresan lekelerin kullanımını tanımlar; Bununla birlikte, birincil ve / veya ikincil antikor konjugasyonları ile immün boyama, bu iskelelerde ve üreticinin talimatlarını takiben, kuyu başına çalışma hacmi olarak 50 μL kullanılarak gerçekleştirilebilir. - MAP iskelelerindeki görüntü hücreleri, 20x hedefi kullanarak konfokal mikroskop üzerinde bulunur ve 2,5 μm adım boyutunda Z yönünde 200-250 μm arasında geçiş yapan bir Z-yığını elde eder. DAPI (1x PBS'de %0.15 Triton-X'te seyreltilmiş nükleer leke) ve falloidin-647 (1x PBS'de %0.15 Triton-X'te 1:40 seyreltilmiş F-aktin boyası) ile floresan boyama örneği, 3 gün boyunca MAP iskelelerinde kültürlenmiş sabit D1 hücreleri ile Şekil 5E, F'de gösterilmiştir.
NOT: Cam yüzeylerin plazma muamelesi, hücre yapışmasını arttırdığı gösterilen hidrofilisitenin artmasına neden olur. Hücreler muhtemelen hücre kültürü kuyularının dibi boyunca yayılarak gözlemlenecektir, ancak MAP iskelelerinde hücre yanıtını değerlendirmek için hücre sayımlarına veya hücre hacmi nicelleştirmesine dahil edilmemelidir.
- MAP iskele bileşenlerini (yani, μgels, HA-Tet, ortam hacmi) istenen parçacık fraksiyonuna göre hazırlayın (Şekil 4D-E'ye bakınız). Liyo-μgelleri steril bir başlıkta tartın ve seçilen ağırlıkça %MAP'ye göre hücre ortamının nihai MAP hacminin %84'ünde yeniden oluşturun. Μgellerin yaklaşık 20 dakika şişmesine izin verin.
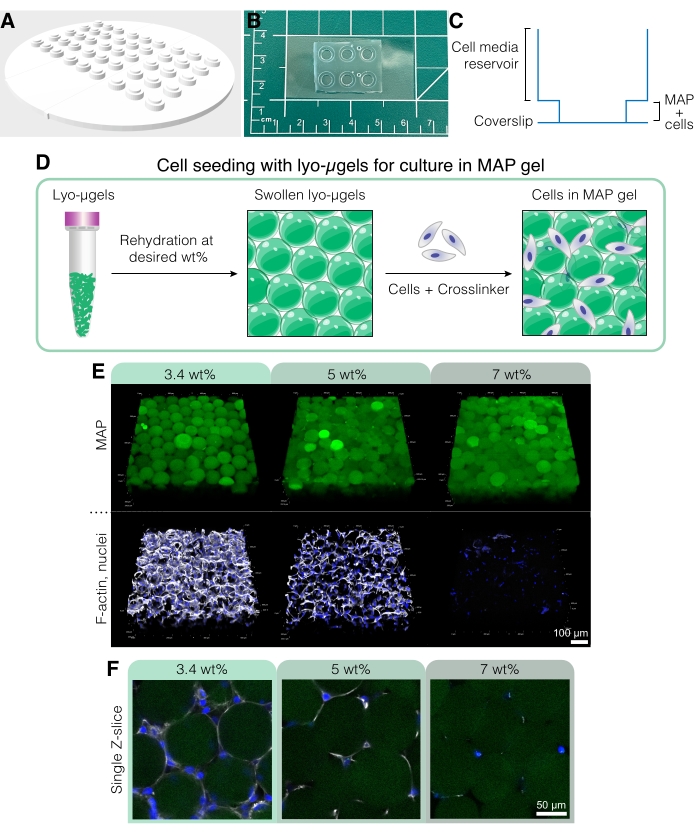
Şekil 5: MAP iskelelerinde hücre kültürü. (A) Hücre kültürü kuyuları oluşturmak için kalıp 3D yazdırılabilir ve PDMS ile dökülebilir. Tüm kalıp 95 mm çapında, büyük kuyucuklar 6 mm çapında ve küçük iç kuyucuklar 4 mm çapındadır. (B) PDMS ile döküldükten sonra, hücre kültürü cihazları, gelişmiş mikroskopi yetenekleri için kapaklara plazma bağlanır. (C) Bir hücre kültürünün enine kesiti, hücre ortamı rezervuarını (~ 50 μL) ve hücrelerle (~ 10 μL) MAP iskelesini tohumlamak için daha küçük bir rezervuarı iyi tasvir eder. (D) MAP iskelelerindeki hücrelerin tohumlama işlemi, ilk önce liyo-μjellerin kullanıcının istediği ağırlıkta% rehidrasyonuna dayanır, ardından μjelleri birbirine bağlamak için hücreler ve çapraz bağlayıcı ile karıştırılır. (E) Hücreler, ağırlıkça %MAP olmak üzere çeşitli MAP iskelelerinde (yeşil) kapsüllenebilir. Temsili görüntüler, MAP iskelelerindeki D1 hücre kültürünün 5. gününden alınmıştır (ölçek çubuğu = 100 μm). (F) Tek Z-dilimleri, farklı ağırlıkça% MAP (ölçek çubuğu = 50 μm) içeren iskelelerde hücre büyümesinde farklılıklar gösterir. Anderson ve ark.12'den Elsevier'in izniyle yeniden basılmıştır. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Sonuçlar
Bu protokolün amacı, biyo-ortogonal çapraz bağlama şemasına sahip mikro gözenekli tavlanmış parçacık (MAP) iskelelerinin yanı sıra 3D hücre kültürü için kontrollü parçacık fraksiyonlarının hazırlanmasını göstermektir. İlk olarak, HA, hem mikrojel oluşumunda hem de MAP iskeleleri oluşturmak için birbirine bağlanmada kullanılmak üzere norbornen kolye grupları ile modifiye edildi. Bu yöntemler kullanılarak, HA tekrar ünitelerinin yaklaşık% 31'i norbornen fonksiyonel tutamağı ile ba?...
Tartışmalar
HA-NB mikrojellerinin mikroakışkan üretiminin, emülsiyon parti üretiminden daha dar bir boyut dağılımına sahip mikrojeller ürettiği gösterilmiştir 3,9. Bu protokolde açıklanan mikrojeller, malzeme bozulmasını desteklemek için MMP-bölünebilir bir çapraz bağlayıcı (Ac-GCRDGPQGIWGQDRCG-NH2) kullanılarak formüle edilmiştir. Bununla birlikte, HA-NB mikrojelleri, parçalanamayan ditiyotreitol (DTT) gibi alternatif bir di-tiol bağ...
Açıklamalar
ARA ve TS bu teknoloji için geçici bir patent başvurusunda bulundu.
Teşekkürler
Yazarlar, Ulusal Sağlık Enstitüleri, Ulusal Nörolojik Bozukluklar ve İnme Enstitüleri (1R01NS112940, 1R01NS079691, R01NS094599) ve Ulusal Alerji ve Bulaşıcı Hastalıklar Enstitüsü'ne (1R01AI152568) teşekkür etmek ister. Bu çalışma kısmen, Ulusal Nanoteknoloji Koordineli Altyapısı'nın (NNCI) bir parçası olarak Ulusal Bilim Vakfı (ödül numarası ECCS-2025064) tarafından desteklenen Kuzey Carolina Araştırma Üçgeni Nanoteknoloji Ağı'nın (RTNN) bir üyesi olan Duke Üniversitesi Paylaşılan Malzemeler Enstrümantasyon Tesisi'nde (SMIF) gerçekleştirildi. Yazarlar, laboratuvarın eski doktora sonrası Dr. Lucas Schirmer'e ve Ethan Nicklow'a, hücre kültürü deneyleri için 3D baskılı cihazın üretilmesindeki yardımları için teşekkür etmek istiyor.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1 mL Luer-Lok syringe sterile, single use, polycarbonate | BD | 309628 | |
| 5 mL Luer-Lok syringe sterile, single use, polycarbonate | BD | 309646 | |
| Alexa Fluor 488 C5 maleimide | Invitrogen | A10254 | For synthesis of fluorescently-labeled tetrazine |
| Alexa Fluor 647 Phalloidin | Invitrogen | A22287 | For staining cell culture samples |
| Aluminum foil | VWR | 89107-726 | |
| Biopsy punch with plunger, 1.0 mm | Integra Miltex | 69031-01 | |
| Biopsy punch, 4 mm | Integra Miltex | 33-34 | |
| Blunt needle, 23 G 0.5", Non-Sterile, Capped | SAI Infusion Technologies | B23-50 | |
| Bottle-top vacuum filter, 0.22 μm | Corning | CLS430521 | |
| Calcium chloride | VWR | 1B1110 | For microgel washing buffer |
| Capillary-piston assemblies for positive-displacement pipettes, 1000 μL max. volume | Rainin | 17008609 | |
| Capillary-piston assemblies for positive-displacement pipettes, 25 μL max. volume | Rainin | 17008605 | |
| Capillary-piston assemblies for positive-displacement pipettes, 250 μL max. volume | Rainin | 17008608 | |
| Countess Cell Counting Chamber Slides | Invitrogen | C10228 | |
| Countess II FL Automated Cell Counter | Invitrogen | AMQAF1000 | |
| Centrifuge tube, 15 mL | CELLTREAT | 667015B | |
| Centrifuge tube, 50 mL | CELLTREAT | 229421 | |
| Chloroform, ACS grade, Glass Bottle | Stellar Scientific | CP-C7304 | For synthesis of fluorescently-labeled tetrazine |
| Corona plasma gun, BD-10A High Frequency Generator | ETP | 11011 | |
| CryoTube Vials, Polypropylene, Internal Thread with Screw Cap | Nunc | 368632 | |
| D1 mouse mesenchymal cells | ATCC | CRL-12424 | Example cell line for culture in MAP gels |
| DAPI | Sigma-Aldrich | D9542 | For staining cell culture samples |
| Deuterium oxide, 99.9 atom% D | Sigma-Aldrich | 151882 | For NMR spectroscopy |
| Dialysis tubing, regenerated cellulose membrane, 12-14 kDa molecular weight cut-off | Spectra/Por | 132703 | For purifying HA-NB and HA-Tet |
| Diethyl ether | VWR | BDH1121-4LPC | For synthesis of fluorescently-labeled tetrazine |
| Dimethylformamide | Sigma-Aldrich | 277056 | For synthesis of fluorescently-labeled tetrazine |
| 4-(4,6-dimethoxy-1,3,5-triazin-2-yl)-4-methylmorpholinium chloride (DMTMM) | TCI-Chemicals | D2919 | For modifying HA |
| Dithiothreitol (DTT) | Thermo Scientific | R0861 | Non-degradable dithiol linker (substitute for MMP-cleavable peptide) |
| Dulbecco's Modified Eagle's Medium (DMEM), high glucose, w/ 4500 mg/L glucose, L-glutamine, sodium pyruvate, and sodium bicarbonate, liquid, sterile-filtered, suitable for cell culture | Sigma-Aldrich | D6429-500ML | For D1 cell culture |
| EMS Paraformaldehyde, Granular | VWR | 100504-162 | For making 4% PFA |
| Ethanol absolute (200 proof) | KOPTEC | 89234-850 | |
| Fetal bovine serum (FBS) | ATCC | 30-2020 | For D1 cell culture |
| Heating Plate | Kopf Instruments | HP-4M | |
| Hemacytometer with coverglass | Daigger Scientific | EF16034F | |
| 2-[4-(2-hydroxyethyl)piperazin-1-yl]ethanesulfonic acid (HEPES) | Sigma-Aldrich | H3375 | |
| Sodium hyaluronate, 79 kDa average molecular weight, produced in bacteria Streptococcus zooepidemicus, pharmaceutical grade, microbial contamination <100 CFU/g, bacterial endotoxins <0.050 IU/mg | Contipro | N/A | 79 kDa average molecular weight was used for HA-Tet synthesis, but these methods could be adapted for other molecular weights. |
| IMARIS Essentials software package | Oxford Instruments | N/A | Microscopy image analysis software |
| Infusion pump, dual syringe | Chemyx | N/A | |
| Kimwipe | Kimberly-Clark | 34120 | |
| Laboratory stand with support lab clamp | Geyer | 212100 | |
| Liquid nitrogen | Airgas | NI 180LT22 | |
| Lithium Phenyl(2,4,6-trimethylbenzoyl)phosphinate | TCI-Chemicals | L0290 | |
| Lyophilizer | Labconco | N/A | Labconco FreeZone 6 plus has been discontinued, but other lab grade console freeze dryers could be used for this protocol. |
| Methyltetrazine-PEG4-maleimide | Kerafast | FCC210 | For synthesis of fluorescently-labeled tetrazine |
| 2-(4-Morpholino)ethane Sulfonic Acid (MES) | Fisher Scientific | BP300-100 | For modifying HA |
| Micro cover glass, 24 x 60 mm No. 1 | VWR | 48393-106 | |
| Microfluidic device SU8 master wafer | FlowJem | Custom design made either in-house in clean room or outsourced | |
| Mineral oil, heavy | Sigma-Aldrich | 330760 | |
| MMP-cleavable dithiol crosslinker peptide (Ac-GCRDGPQGIWGQDRCG-NH2) | GenScript | N/A | |
| 5-Norbornene-2-methylamine | TCI-Chemicals | 95-10-3 | For HA-NB synthesis |
| Packing tape | Scotch | 3M 1426 | |
| Parafilm | Bemis | PM996 | |
| PEG(thiol)2 | JenKem Technology USA | A4001-1 | For synthesis of fluorescently-labeled tetrazine |
| Penicillin-Streptomycin, 10,000 units/mL | Thermo Fisher Scientific | 15140122 | For D1 cell culture |
| Petri dish, polystyrene, disposable, Dia. x H=150 x 15 mm | Corning | 351058 | |
| Pluronic F-127 | Sigma-Aldrich | P2443 | For washing HMPs |
| Phosphate buffered saline (PBS) 1x | Gibco | 10010023 | |
| RainX water repellent glass treatment | Grainger | 465D20 | Synthetic hydrophobic treatment solution for microfluidic device treatment |
| RGD peptide (Ac-RGDSPGERCG-NH2) | GenScript | N/A | |
| Rubber bands | Staples | 112417 | |
| Sodium chloride | Chem-Impex | 30070 | For dialysis |
| Span 80 for synthesis | Sigma-Aldrich | 1338-43-8 | |
| Sylgard 184 Silicone Elastomer | Electron Microscopy Science | 4019862 | polydimethylsiloxane (PDMS) elastomer for making microfluidic devices and tissue culture devices |
| Syringe filter, Whatman Uniflo, 0.2 μm PES, 13 mm diameter | Cytvia | 09-928-066 | |
| Tetraview LCD digital microscope | Celestron | 44347 | |
| Tetrazine-amine HCl salt | Chem-Impex | 35098 | For HA-Tet synthesis |
| Triethylamine | Sigma-Aldrich | 471283 | For synthesis of fluorescently-labeled tetrazine |
| Tris(2-carboxyethyl)phosphine (TCEP) | Millipore Sigma | 51805-45-9 | |
| Triton X-100 | VWR | 97063-864 | |
| Trypan blue solution, 0.4% | Thermo Fisher Scientific | 15250061 | |
| Trypsin EDTA (0.25%), Phenol red | Fisher Scientific | 25-200-056 | For lifting adherent cells to seed in MAP gels |
| Tygon ND-100-80 Non-DEHP Medical Tubing, Needle Gauge=23, Wall Thickness=0.020 in, Internal diameter = 0.020, Outer diameter = 0.060 in | Thomas Scientific | 1204G82 | |
| UV curing system controller, LX500 LED | OmniCure | 010-00369R | |
| UV curing head, LED spot UV | OmniCure | N/A | |
| UV light meter, Traceable | VWR | 61161-386 | |
| Vacuum dessicator | Bel-Art | 08-594-15C | |
| X-Acto Z Series Precision Utility Knife | Elmer's | XZ3601W |
Referanslar
- Griffin, D. R., Weaver, W. M., Scumpia, P. O., Di Carlo, D., Segura, T. Accelerated wound healing by injectable microporous gel scaffolds assembled from annealed building blocks. Nature Materials. 14 (7), 737-744 (2015).
- Daly, A. C., Riley, L., Segura, T., Burdick, J. A. Hydrogel microparticles for biomedical applications. Nature Reviews Materials. 5 (1), 20-43 (2020).
- Darling, N. J., et al. Click by click Microporous Annealed Particle (MAP) scaffolds. Advanced Healthcare Materials. 9 (10), 1901391 (2020).
- Truong, N. F., et al. Microporous annealed particle hydrogel stiffness, void space size, and adhesion properties impact cell proliferation, cell spreading, and gene transfer. Acta Biomaterialia. 94, 160-172 (2020).
- Pfaff, B. N., et al. Selective and improved photoannealing of Microporous Annealed Particle (MAP) scaffolds. ACS Biomaterials Science & Engineering. 7 (2), 422-427 (2021).
- Sideris, E., et al. Particle hydrogels based on hyaluronic acid building blocks. ACS Biomaterials Science & Engineering. 2 (11), 2034-2041 (2016).
- Caldwell, A. S., Campbell, G. T., Shekiro, K. M. T., Anseth, K. S. Clickable microgel scaffolds as platforms for 3D cell encapsulation. Advanced Healthcare Materials. 6 (15), 1700254 (2017).
- Qazi, T. H., et al. Anisotropic rod-shaped particles influence injectable granular hydrogel properties and cell invasion. Advanced Materials. 34 (12), 2109194 (2022).
- Wilson, K. L., et al. Stoichiometric post modification of hydrogel microparticles dictates neural stem cell fate in microporous annealed particle scaffolds. Advanced Materials. 34 (33), 2201921 (2022).
- Muir, V. G., Qazi, T. H., Shan, J., Groll, J., Burdick, J. A. Influence of microgel fabrication technique on granular hydrogel properties. ACS Biomaterials Science & Engineering. 7 (9), 4269-4281 (2021).
- Highley, C. B., Song, K. H., Daly, A. C., Burdick, J. A. Jammed microgel inks for 3D printing applications. Advanced Science. 6 (1), 1801076 (2018).
- Anderson, A. R., Nicklow, E., Segura, T. Particle fraction as a bioactive cue in granular scaffolds. Acta Biomaterialia. 150, 111-127 (2022).
- Pruett, L., Ellis, R., McDermott, M., Roosa, C., Griffin, D. R. Spatially heterogeneous epidermal growth factor release from microporous annealed particle (MAP) hydrogel for improved wound closure. Journal of Materials Chemistry B. 9 (35), 7132-7139 (2021).
- Sheikhi, A., et al. Microengineered emulsion-to-powder technology for the high-fidelity preservation of molecular, colloidal, and bulk properties of hydrogel suspensions. ACS Applied Polymer Materials. 1 (8), 1935-1941 (2019).
- Brower, K., White, A. K., Fordyce, P. M. Multi-step variable height photolithography for valved multilayer microfluidic devices. Journal of Visualized Experiments. (119), e55276 (2017).
- JoVE. Nuclear Magnetic Resonance (NMR) Spectroscopy. JoVE Science Education Database. Organic Chemistry. JoVE. , (2022).
- Roosa, C., et al. Microfluidic synthesis of microgel building blocks for microporous annealed particle scaffold. Journal of Visualized Experiments. (184), e64119 (2022).
- Zhang, H., Dicker, K. T., Xu, X., Jia, X., Fox, J. M. Interfacial bioorthogonal crosslinking. ACS Macro Letters. 3 (8), 727-731 (2014).
- Welzel, P. B., et al. Cryogel micromechanics unraveled by atomic force microscopy-based nanoindentation. Advanced Healthcare Materials. 3 (11), 1849-1853 (2014).
- Plieva, F., Huiting, X., Galaev, I. Y., Bergenståhl, B., Mattiasson, B. Macroporous elastic polyacrylamide gels prepared at subzero temperatures: control of porous structure. Journal of Materials Chemistry. 16 (41), 4065-4073 (2006).
- Rommel, D., et al. Functionalized microgel rods interlinked into soft macroporous structures for 3D cell culture. Advanced Science. 9 (10), 2103554 (2022).
- Kurt, E., Segura, T. Nucleic acid delivery from granular hydrogels. Advanced Healthcare Materials. 11 (3), 2101867 (2021).
- Isaac, A., et al. Microporous bio-orthogonally annealed particle hydrogels for tissue engineering and regenerative medicine. ACS Biomaterials Science & Engineering. 5 (12), 6395-6404 (2019).
- Truong, N. F., Lesher-Pérez, S. C., Kurt, E., Segura, T. Pathways governing polyethylenimine polyplex transfection in Microporous Annealed Particle scaffolds. Bioconjugate Chemistry. 30 (2), 476-486 (2019).
- Koh, J., et al. Enhanced in vivo delivery of stem cells using microporous annealed particle scaffolds. Small. 15 (39), 1903147 (2019).
- Li, F., et al. Cartilage tissue formation through assembly of microgels containing mesenchymal stem cells. Acta Biomaterialia. 77, 48-62 (2018).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır