Method Article
Yaşlı Erişkinlerde Yakıt Kullanımını ve Sirkadiyen Ritimleri Değerlendirmek için Minimal İnvaziv Yöntemlerin Kullanımı
Bu Makalede
Özet
Yakıt kullanımının ve sirkadiyen ritimlerin yaşlanan bireyler üzerindeki sinerjik etkisini değerlendirmek için periferik kan mononükleer hücreleri kullanan yeni ve minimal invaziv bir protokol sunulmuştur.
Özet
Yaşlanma, fiziksel engelliliğe ve kronik hastalık riskine sinerjik ve bağımsız olarak katkıda bulunan çoklu fizyolojik değişikliklerle ilişkilidir. Yaşa bağlı fiziksel özürlülüğün etiyolojisi karmaşık ve çok faktörlü olmasına rağmen, mitokondriyal fonksiyondaki düşüş, birçok yaşlı erişkinde fonksiyonel düşüşün ilerlemesi ile çakışıyor gibi görünmektedir. Yaşlanma ile birlikte mitokondriyal fonksiyonda bir azalma olmasının nedeni belirsizliğini koruyor, ancak ortaya çıkan bilim, hem yakıt metabolizmasının hem de sirkadiyen ritimlerin mitokondriyal fonksiyonu etkileyebileceğini gösteriyor.
Son zamanlarda yapılan çalışmalar, sirkadiyen ritimlerin yaşlanma ile bozulduğunu ve bozulmuş sirkadiyen ritimlerin mitokondriyal fonksiyonu etkileyen ve yaşa bağlı birçok kronik hastalıkla örtüşen patolojik sonuçları olduğunu ortaya koymuştur. Mitokondriyal fonksiyonun doğrudan değerlendirilmesi için mevcut kantitatif yöntemler invazivdir ve tipik olarak bir kas biyopsisi gerektirir, bu da algılanan potansiyel ağrı ve risk seviyeleri göz önüne alındığında, katılımcı alımı ve çalışma uyumu ile ilgili zorluklar yaratabilir. Bu nedenle, yaşlı erişkinlerde hücresel düzeyde mitokondriyal fonksiyondaki değişiklikleri ve sirkadiyen paternleri değerlendirmek için yenilikçi ve nispeten invaziv olmayan bir protokol uyarlanmıştır. Spesifik olarak, diferansiyel substrat mevcudiyeti altında beyaz kan hücrelerinin mitokondriyal biyoenerjetik fonksiyonunu değerlendirmek için gerçek zamanlı bir metabolik akı analizörü kullanılır.
Mitokondriyal biyoenerjetik ve sirkadiyen ritim sonuçları ile çapraz korelasyon için beyaz kan hücrelerinde sirkadiyen saat genlerinin ekspresyonu da analiz edilir. Bu yenilikçi metodolojik yaklaşımların, yaşlı erişkinlerde mitokondriyal substrat tercihini ve sirkadiyen ritimleri incelemek için minimal invaziv yöntemler sağlayarak gelecekteki klinik çalışmalara yardımcı olacağına inanılmaktadır.
Giriş
Geçtiğimiz yüzyıldaki gelişmeler, yaşam beklentisinde ve yaşlanan yetişkinlerin nüfusunda bir artışa yol açmıştır. Geleceğe bakıldığında, Amerika Birleşik Devletleri'nde 65 yaş ve üstü yetişkinlerin yüzdesinin 2020'den 2050'ye kadar %5 artacağı tahmin edilmektedir1. Yaşam beklentisindeki bu artış, sağlık süresinde bir artış anlamına gelmez - bağımsız işlevsellikle ilişkili yaşam süresi. Gerçek şu ki, yaşlanmaya hücresel metabolizmayı ve fizyolojiyi etkileyen, bilişsel ve fiziksel işlevlerde kademeli düşüşlere neden olan sayısız biyolojik değişiklik eşlik eder 2,3. İnsan yaşam beklentisi artmaya devam ettikçe,4 yaşla birlikte fonksiyonel yeteneği ve bağımsızlığı korumaya daha fazla ihtiyaç duyulmaktadır.
Yaşla birlikte fiziksel işlev ve bağımsızlıktaki düşüşün çok faktörlü olduğu uzun zamandır bilinmektedir, ancak sıklıkla kronik hastalığın başlangıcı ve akut tetikleyici olaylarla ilişkilidir5. Tersine, fiziksel performans ve kas özelliklerindeki bu düşüşlerin, tek bir hastalıkla net bir bağlantısı olmayan yaşla birlikte sakatlık gelişimi ile ilişkili olduğu gösterilmiştir6. Kronik hastalık ve fiziksel engelliliğin kesin etiyolojisinin bilinmesindeki zorluklarla birlikte, mitokondriyal fonksiyondaki bozulmaların, yaşlanan yetişkinlerde kronik hastalığın başlangıcı ve ilerlemesi ve fiziksel fonksiyon kaybı ile aynı zamana denk geldiği düşünülmektedir 7,8.
Mitokondri, birçok hücresel süreç için gerekli olan adenozin trifosfatın (ATP) çoğunu sağlar9. Yüksek oksidatif dokular, yeterli enerji üretimi için mitokondriye güvenir; yaşlanma ile oksidatif kapasite ve mitokondriyal ATP sentezi azalır. Bu düşüş kısmen mitokondriyal DNA'daki (mtDNA) oksidatif hasardan kaynaklanmaktadır, bu da mtDNA mutasyonlarının ve delesyonlarının artarak birikmesine neden olur10. MtDNA mutasyonlarının ve delesyonlarının birikmesi, fonksiyonel elektron taşıma zinciri proteinlerinin oluşumunda bir azalmaya neden olur, böylece hücrelerin ATP üretme yeteneğinin azalmasına neden olur. Mitokondriyal fonksiyonda yaşa bağlı düşüş, kalp ve iskelet kası gibi yüksek oksidatif dokularda en belirgindir11. Çalışmalar, yaşlı sıçan örneklerinde gastroknemius kas mitokondrisinin, genç örneklere kıyasla ATP üretiminde ve içeriğinde yaklaşık% 50'lik bir azalma gösterdiğini göstermiştir12. Ayrıca, insan iskelet kasındaki mitokondriyal ATP üretim kapasitesinin yaşamın on yılında yaklaşık %8 oranında azaldığı gösterilmiştir13. Bu bulgular, mitokondriyal fonksiyondaki yaşa bağlı düşüşlerin organizmalarda enerji üretiminin azalmasına katkıda bulunabileceğini düşündürmektedir.
Mitokondriyal aktivitenin önemli bir düzenleyicisinin, peroksizom proliferatörle aktive olan reseptör γ (PPARγ) koaktivatörü-1 (PGC-1α) olduğu düşünülmektedir14. PGC-1α aktivitesindeki bozulma veya bolluğundaki azalma, mitokondriyal oksidatif aktivitenin azalmasına ve sonuç olarak enerji üretiminin bozulmasına neden olur. Ayrıca, mitokondriyal kalitedeki bir düşüş iskelet kası kalitesini etkileyebilir ve daha sonra sarkopeni, dinapepi ve fonksiyonel kapasite düşüşünün gelişmesine veya alevlenmesine yol açabilir15,16. Mitokondriyal fonksiyon ve iskelet kası kalitesinde yaşa bağlı eşzamanlı düşüşe ilişkin kanıtlar, mitokondriyal bozukluk ile fonksiyonel düşüşün patogenezi arasında bir bağlantı olduğunu göstermektedir1, 7. Son zamanlarda, bu, fonksiyonel toplumda yaşayan yaşlı erişkinlerde doğrulanmıştır ve iskelet kası mitokondri metabolizmasındaki azalmaların bu popülasyonda hareketlilik düşüşünü öngördüğünü göstermektedir18. Yaşla birlikte mitokondriyal düşüşe yol açan kesin mekanizma belirsiz olsa da, son kanıtlar sirkadiyen saat ile mitokondriyal fonksiyon arasında karşılıklı bir etkileşimi vurgulamıştır ve bu da mitokondriyal yakıt kullanımı ve biyogenez için sonuçlar doğurmuştur19.
Yakıt kullanımı
Mitokondriyal fonksiyon, yakıt metabolizmasından ve iskelet kası dokusunda hücresel düzeyde kullanılan yakıt türünden etkileniyor gibi görünmektedir11. Yakıtın tükendiği dönemlerde, özellikle insanlarda karbonhidrat tükenmesi, (mitokondriyal) enerji üretimi için yakıt tercihi değişir. Düşük glikoz seviyelerinde, yakıt tercihi glikozdan yağ asitlerine ve asit türevli keton cisimlerine kayar. Bu metabolik anahtar, adipositlerde lipid metabolizmasının yukarı regülasyonu ve ardından kana keton salınımının artması ile işaretlenir4. Ketojenik bir diyetle yakıt kullanımındaki glikozdan ketonlara geçiş, mitokondriyal reaktif oksijen türlerinin üretimi, antioksidan savunma, ATP sentezi ve biyogenez20 üzerinde yararlı bir etkiye sahip gibi görünmektedir.
Karbonhidrattan lipid metabolizmasına metabolik geçiş, çevresel besin mevcudiyetinin düşük olduğu dönemlerde ve glikojen depolarının tükendiği zamanlarda meydana gelir. Bu anahtar başlatıldığında, depolanan trigliseritler, glukoneogenez için bir substrat olan gliserole ve serbest yağ asitlerine parçalanır ve bunlar β-oksidasyon yoluyla asetil koenzim A'ya (asetil CoA) oksitlenmek üzere karaciğere taşınır. Keton cisimleri, esas olarak karaciğerde, üç asetil CoA molekülünün β-hidroksi-β-metilglutaril-CoA'ya iki aşamalı bir yoğunlaştırılmasıyla sentezlenir ve bunlar daha sonra asetoasetat ve 3-βeta hidroksibutirat21 dahil olmak üzere keton cisimlerine işlenir. Bu keton cisimleri vücuttaki dokulara dağıtılır ve en yüksek tüketim kalp, beyin ve iskelet kasında meydana gelir21. Yaşlanma ile birlikte mitokondriyal yağ asidi oksidasyonu bozulur ve böylece metabolik anahtarıetkiler 22. Mitokondriyal yakıt kullanımındaki bozulmaların daha fazla mitokondriyal disfonksiyona yol açtığı ve bunun da yaşa bağlı hastalığa ve fonksiyonel düşüşe katkıda bulunduğu öne sürülmüştür23.
Periferik kan mononükleer hücrelerinin (PBMC'ler) mitokondriyal oksijen tüketimindeki değişiklikler, disfonksiyon ve vaskülarizasyon ile ilişkili paternleri değerlendirmek için incelenmiştir. Hartman ve ark. oksijen tüketimi ile çeşitli aracılı genişleme arasındaki ilişkiyi belirlemeyi amaçlayan bir çalışma yürütmüşler ve bu çalışmanın mitokondriyal disfonksiyon ile vasküler düz kas hücresi disfonksiyonu arasında bir bağlantı olduğunu öne sürdüğü bulunmuştur24. Diğer organlarla ilgili olarak, PBMC'ler, respirometri25 ile belirlendiği gibi, daha yüksek bilişsel ve beyin işlevselliği ile ilişkilendirilmiştir. Bu nedenle, PBMC biyoenerjetik ve solunum kapasitesi, vücuttaki organların veya dokuların fonksiyonel kapasitesini değerlendirmek için potansiyel biyobelirteçler olarak hizmet edebilir.
Sirkadiyen ritim
Mitokondriyal sağlığı etkileyen bir diğer önemli faktör sirkadiyen ritimdir. Sirkadiyen ritimler, çevresel ipuçlarının yokluğunda meydana gelen davranış ve fizyolojide ~ 24 saatlik salınımlardır26. Bu ritimler, sistem ve doku homeostazını desteklemek için öngörücü bir şekilde işlev görür. Sirkadiyen ritimlerin altında yatan mekanizma, sirkadiyen saat27 adı verilen bir transkripsiyon-translasyon geri bildirim döngüsüdür. Sirkadiyen saat mekanizmasının vücuttaki hemen hemen tüm hücrelerde var olduğu son 15 yılda kanıtlanmıştır28. Moleküler saat mekanizması, zamanı korumanın yanı sıra, sirkadiyen saat çıkışı29 olarak adlandırılan günlük bir gen ekspresyonu programına da katkıda bulunur. Saat çıkış genleri her doku tipine özgüdür ve işlevsel olarak hücre metabolizması, otofaji, onarım ve homeostaz için önemli olan yollarla ilişkilidir. Son kanıtlar, mitokondriyal sağlığın sirkadiyen saat fonksiyonuna bağlı olduğunu ve mitokondriyal biyogenez, yakıt kullanımı ve mitofaji30 dahil olmak üzere mitokondriyal fonksiyonu etkilediğini göstermiştir.
Hem klinik öncesi hem de klinik çalışmalarda ortaya çıkan kanıtlar, yaşlanma boyunca sirkadiyen ritimlerde bozukluklar olduğunu göstermiştir31. Bunlar, normal uyku ve uyanıklık döngülerindeki bozulmaları, çekirdek vücut ısısı ritimlerinde azalmış bir genliği vefaz 31'deki değişimlere uyum sağlama yeteneğini içerir. Örneğin bir çalışma, yetişkin ve yaşlı (20+ ay) farelerin sirkadiyen sistemine, ışık programını 6 saat kaydırarak meydan okudu. Eski farelerin aktivite modellerini yeni ışık programı32'ye yeniden sürüklemelerinin daha uzun sürdüğü bulundu. Sirkadiyen davranıştaki değişikliklerle tutarlı olarak, doku saatlerinin analizi, yaşlanan kohortta hem merkezi hem de periferik doku saatlerinin bozulduğunu buldu.
Daha yakın zamanlarda, birkaç grup,33 yaş ile farklı dokularda sirkadiyen saatin ve saat çıktısının transkriptomik analizini gerçekleştirdi. Bu çalışmaların sonuçları, sirkadiyen saat çıktısının yaşla birlikte büyük ölçekli yeniden programlandığını vurgulamaktadır. Bu, çekirdek saatin bir zamanlama işlevini sürdürmesine rağmen, günlük ifade için hedeflenen genlerin büyük ölçüde farklı olduğu anlamına gelir. Örneğin, iki çalışma, 24 saat boyunca her 4 saatte bir insan deneklerden kas biyopsileri toplamıştır, sonuçlar, saat gen ekspresyonunun tepe ve çukurunun gece kemirgenleri ve günlük insanlar arasında tersine çevrildiğini belirlemiştir 34,35,36. Bu, saat geni ekspresyonu yalnızca aktif ve dinlenme fazına (açık ve koyu değil) dayalı olarak karşılaştırıldığında, kaslardaki saat geni ekspresyon modellerinin türler arasında hemen hemen aynı olduğunu gösterir. Saat çıktısındaki yaşa bağlı bu değişikliğin, mitokondriyal fonksiyon, DNA hasarı ve onarımı ve otofaji37 gibi yaşlanmanın bilinen ayırt edici özelliklerini içeren yolların düzenlenmesinde bozulmalara yol açtığı öne sürülmektedir.
Çalışma gerekçesi
Mitokondriyal fonksiyon ile fiziksel fonksiyondaki azalma arasındaki bağlantı iyi kurulmuştur. Bununla birlikte, mitokondriyal disfonksiyonun altında yatan neden bir tartışma konusu olmaya devam etmektedir. Son araştırmalar, hücresel yakıt kullanımının ve sirkadiyen ritimlerin bu süreçte rol oynayabileceğini düşündürmektedir. Bir kas biyopsi örneğinde mitokondriyal oksijen tüketiminin ölçülmesi gibi mitokondriyal fonksiyonu değerlendirmek için geleneksel yöntemler genellikle ağrılı ve invaziv olarak algılanır, bu da özellikle zayıf ve sarkopenik yetişkinler gibi düşük kas kütlesine sahip popülasyonlarda katılımı caydırabilir38.
Bu sınırlamalar göz önüne alındığında, yaşlı erişkinlerde hücresel yakıt kullanımı ve sirkadiyen ritimdeki değişiklikleri değerlendirmek için daha az invaziv bir yönteme ihtiyaç vardır. Bu çalışma, bu popülasyonda yakıt metabolizmasını ve sirkadiyen ritmi değerlendirmek için kullanılabilecek yeni, minimal invaziv bir protokolü değerlendirmeyi amaçlamaktadır. Bu çalışmanın sonuçları, yaşa bağlı değişikliklerin ve tıbbi veya davranışsal müdahalelere verilen yanıtın daha iyi anlaşılmasına katkıda bulunacak ve bu alanda gelecekteki çalışmalar için bir model teşkil edecektir.
Protokol
İnsan katılımcıları içeren prosedürler, araştırma etik komitesi (Florida Etik Politikası 1.0104) ve Florida Üniversitesi Kurumsal İnceleme Kurulu tarafından onaylanmıştır.
1. Mitokondriyal fonksiyon
- Periferik kan mononükleer hücrelerinin (PBMC'ler) izolasyonu
- PBMC'leri özel 8 mL kan alma tüpleri (16 mm x 125 mm; 0.1 M sodyum sitrat antikoagülan veya sodyum heparin antikoagülan içeren) kullanarak toplayın (bkz.
NOT: Kan alma tüpleri, beyaz kan hücrelerinin ayrılmasını arttırmak için bir tiksotropik polyester jel ve bir gradyan ortamından ( Malzeme Tablosuna bakınız) oluşan kan ayırma ortamı içerir. - Canlı sonuçlar elde etmek için 8 mL hücre hazırlama tüplerini toplamayı takiben 2 saat içinde işleyin.
- Kan alma tüplerini kanla doldurduktan sonra (hafifçe ters çevirerek veya bir karıştırıcı üzerinde) karıştırın ve en fazla 2 saat oda sıcaklığında (RT) tutun.
- Kan alma tüplerini RT'de 15 dakika boyunca (veya 30.000 G-dk'ya eşdeğer; 2.000 × g'yi aşmayın) 2.000 × g'da uygun bir açılır rotorda santrifüjleyin.
NOT: Bu tüpler normal bir 15 mL santrifüj tüpünden daha uzundur; Bu nedenle, doğru rotorun kullanılmasına ek dikkat gösterilmelidir. - Plazma tabakasının ~% 80'ini biyolojik olarak tehlikeli bir atık kabına aspire edin ve atın ve hücre tabakasını kan alma tüpünden (bir transfer pipeti kullanarak) 15 mL'lik bir santrifüj tüpünde toplayın.
NOT: 15 mL'lik bir tüp kullanırken, 7 mL hücre tabakası ekleyin ve steril fosfat tamponlu salin (PBS) ile 14 mL'ye doldurun. Hücrelerin PBS'ye oranı 1:1 olmalıdır. Gerekirse birden fazla tüp kullanın. Ters çevirerek hafifçe karıştırın. - RT'de 5 dakika (veya 4.500 G-dk'ya eşdeğer) boyunca 900 × g'da açılır rotorda santrifüjleyin.
- Hücre peletini bozmadan, PBS çözeltisini aspire edin ve biyolojik olarak tehlikeli bir atık kabına atın.
- Hücre peletini 1 mL bazal ortamda (BM; Malzeme Tablosuna bakınız) hafifçe ezerek yeniden süspanse edin. BM'yi toplam 10 mL'ye ekleyin ve ters çevirerek hafifçe karıştırın. Hücre sayımı gerçekleştirin.
- Hücre süspansiyonunu RT'de 5 dakika boyunca 900 × g'da açılır bir rotorda santrifüjleyin.
NOT: Hücreler biyoenerjetik değerlendirme için aynı gün kullanıldığında, adım 1.1.10'a geçin; Hücreler saklanmak üzere dondurulmuşsa, adım 1.1.13'e geçin. - İstenen hücre konsantrasyonunu elde etmek için bir sonraki hücre peletinin yeniden süspansiyonu için tahlil ortamının hacmini hesaplayın (; Malzeme Tablosuna bakınız).
NOT: Örneğin, 50 μL'de 150.000 hücre/kuyu tohumlama yoğunluğu için, hücre süspansiyonunun istenen konsantrasyonu 3 milyon hücre/mL'dir. - Hücre peletini bozmadan, süpernatanı aspire edin ve biyolojik olarak tehlikeli bir atık kabına atın.
- Hücre peletini 1 mL veya daha az'de nazikçe yeniden süspanse edin. İstenen hücre konsantrasyonu için hesaplanan toplam hacme ekleyin. Hücreler artık kaplanmış bir hücre kültürü plakasına ekilmeye hazırdır (Malzeme Tablosuna bakınız).
NOT: Aşağıdaki adımlar, hücreleri depolama için dondurmak içindir (1.1.13-1.1.16) ve aynı gün prosedür için geçerli değildir. - Hücreleri dondurmak için, hücre peletini rahatsız etmeden süpernatanı aspire edin ve biyolojik olarak tehlikeli bir atık kabına atın.
- Hücreleri dondurma ortamında (Malzeme Tablosuna bakınız) istenen konsantrasyonda (5-10 milyon hücre / mL) nazikçe yeniden süspanse edin. Etiketli kriyoviyallerde istenen hacimleri alikot.
- Hücre süspansiyonunu bir dondurma kabı (Malzeme Tablosuna bakın) kullanarak en az 4 saat veya gece boyunca -80 °C'de yavaşça dondurun.
- 4 saat sonra veya ertesi sabah, kriyoviyalleri buhar fazında bulunmaları gereken sıvı nitrojen deposuna aktarın.
- Ölçümden bir gün önce, bir hücre kültürü mikroplakasının kuyu tabanlarını (Malzeme Tablosuna bakınız) hücre yapıştırıcısı ile kaplayın (Malzeme Tablosuna bakınız). Yapıştırıcıyı, üreticinin talimatlarına göre, önerilen 22,4 μg/μL konsantrasyonda, uygun hacimde yapışkan stok çözeltisini 0,1 M sodyum bikarbonat (pH 8.0) içinde seyrelterek hazırlayın. Hücre kültürü mikroplakasının her bir oyuğuna 25 μL yapıştırıcı uygulayın.
- 20 dakika sonra, her kuyucuktan kalan sıvıyı sifonlayın ve kuyuları 200 μL steril, arıtılmış su ile iki kez yıkayın. Plakayı biyogüvenlik kabininde kurumaya bırakın (~2 saat).
- Plakayı alüminyum folyoya sarın veya kapalı bir ikincil kaba koyun ve 4 °C'de buzdolabında saklayın.
- PBMC'leri özel 8 mL kan alma tüpleri (16 mm x 125 mm; 0.1 M sodyum sitrat antikoagülan veya sodyum heparin antikoagülan içeren) kullanarak toplayın (bkz.
- Belirli zamanlı metabolik akı analizörü ile PBMC'lerin biyoenerjetik değerlendirmesi
NOT: Bir akı analizörü ve çok modlu okuyucu kullanarak (bkz. Malzeme Listesi), kuyu başına 150.000 PBMC'lik bir optimal tohumlama yoğunluğu, 2 μM'lik bir nihai birleştirici karbonil siyanür-4 (triflorometoksi) fenilhidrazon (FCCP) konsantrasyonu ve 4 μM'lik bir nihai Hoechst 33342 konsantrasyonu (enjeksiyondan sonra en az 20 dakikalık bir inkübasyon süresi ile) belirlendi.- Sensör kartuşlarını hidrobooster ile nemlendirmek için, yardımcı plakalı sensör kartuşunu kutudan çıkarın ve kartuşu "sensör yukarı" tezgahın üzerine yerleştirin. Yardımcı plakanın her bir kuyucuğuna 200 μL kalibrant pipetleyin (Malzeme Tablosuna bakın) ve hidroboosterı yardımcı plakaya, ardından sensör kartuşuna sıkıca yerleştirin. Sıkışan hava kabarcıklarını inceleyin ve çıkarın ve gece boyunca 37 °C CO2 olmayan bir inkübatöre yerleştirin.
- Akı analizörünü açın ve ardından tahlil analiz yazılımını açın (Malzeme Tablosuna bakın). Sıcaklığı 37 °C'ye ayarlayın. Ayarlanan sıcaklığın dengelenmesine izin vermek için cihazı gece boyunca açık bırakın.
NOT: Aşağıdaki programlama adımları (1.2.4-1.2.10) deneyden bir gün önce veya deney günü yapılabilir - Tahlil analiz yazılımını programlamak için (Malzeme Tablosuna bakınız) dosyası, Substrat Oksidasyon Stres Testi şablonunu açın. Grup Tanımları'na gidin, Enjeksiyon Stratejileri sekmesini açın, İnhibitör + Alt Ox Stres Testini Etomoksir + Sub Ox Stres Testi olarak düzenleyin ve iki enjeksiyon stratejisi daha ekleyin: UK5099 + Sub Ox Stres Testi ve BTPES + Sub Ox Stres Testi. Her enjeksiyon stratejisinde, Enjeksiyon Koşulu penceresinde, Port A için A'ya tıklayın ve ilgili inhibitörün son konsantrasyonunu girin (Etomoksir: 4 μM; UK5099: 2 μM; BTPES: 3 μM).
- B, C ve D bağlantı noktalarına tıklayın ve ilgili nihai konsantrasyonları girin (bağlantı noktası B: oligomisin konsantrasyonu [1.50 μM], bağlantı noktası C: FCCP [2.0 μM]; bağlantı noktası D: Rotenon + Antimisin A [0.5 μM]). D portu için bileşikler penceresine Hoechst 33342, 4 μM ekleyin.
- Ön İşlemler sekmesini açın ve varsa ön tedavileri seçin. Örneğin: Kontrol, Deneysel veya geleneksel (örneğin, Temel ve Takip). Gerekirse altındaki pencereye açıklamalar ekleyin.
- Tahlil Ortamı sekmesini açın ve Ortam açılır menüsünden RPMI Medium, pH 7.4'ü seçin, lot numarasını, ortamı hazırlayan personeli, hazırlama zamanını ve ortama eklenen takviyeleri girin (10 mM glikoz, 2 mM glutamin, 1 mM piruvat; Malzeme Tablosuna bakın).
- Hücre Türü sekmesini açın ve Ad olarak PBMC-Konu Kimliği, Hücre Türü olarak PBMC, Tohumlama yoğunluğu olarak 150000, Kaynak olarak Konu Kimliği, hücreleri hazırlayan personel, hazırlık tarihi ve varsa hücre çözülme gününü girin.
- Grup Oluştur'a tıklayın, Plaka Haritası'na gidin ve 96 kuyulu plakanın kuyularını ilgili gruplara atayın. A1, A12, H1 ve H12 kuyularını arka plan kuyuları olarak atanmış halde tutun.
- Protokol'e gidin, Denge kutusunu işaretleyin (varsayılan ayar) ve aşağıdaki bilgileri girin: Temel: beş ölçüm döngüsü: 3 dakika karıştırma, 0 dakika bekleme ve 3 dakika ölçüm; Ortam veya İnhibitör (Port A): altı ölçüm döngüsü: 3 dakika karıştırma, 0 dakika bekleme ve 3 dakika ölçüm; Oligomisin (Port B): üç ölçüm döngüsü: 3 dakika karıştırma, 0 dakika bekleme ve 3 dakika ölçüm; FCCP (Bağlantı Noktası C): üç ölçüm döngüsü: 3 dakika karıştırma, 0 dakika bekleme ve 3 dakika ölçüm; Rotenon + Antimisin A + Hoechst 33342 (Port D): üç ölçüm döngüsü: 3 dakika karıştırma, 0 dakika bekleme ve 3 dakika ölçüm.
- Biyoenerjetik değerlendirmenin yapıldığı gün, kaplanmış hücre kültürü mikroplakasını buzdolabından alın ve biyogüvenlik kabininde RT'ye kadar ısınmasına izin verin.
- 97 mL önceden ısıtılmış BM ve takviyeleri karıştırarak tahlil ortamı () hazırlayın: 1 mL piruvat (son konsantrasyon: 1 mM), 1 mL glikoz (son konsantrasyon 10 mM) ve 1 mL glutamin (son konsantrasyon: 2 mM). 'yi kullanıma kadar CO37 olmayan bir inkübatörde 2 ° C'ye yerleştirin.
- Hücreleri tohumlamak için, A1, H1, A12 ve H12 (arka plan kuyuları olarak atanmış) hariç her bir oyuğa 150.000 PBMC içeren 50 μL hücre süspansiyonu (1.1.12'den itibaren) ekleyin.
KRİTİK : Optimum tohumlama yoğunluğu daha önce belirlenmiştir. - Hücre plakasını kapağıyla kapatın ve hücrelerin eşit dağılımını kolaylaştırmak için biyogüvenlik kabininde RT'de 60 dakika hücre dinlenmesine izin verin.
KRİTİK : Kuyu boyunca istenen homojen hücre dağılımını sağlamak için hücreleri mikroskop altında görüntüleyin. - Hücre görüntüleme için, ilk hücre inkübasyonundan birkaç saat önce çok modlu okuyucuyu açın ( Malzeme Tablosuna bakın); Görüntüleme yazılımını açmadan önce okuyucunun başlatma protokolünün tamamlanmasını bekleyin (Malzeme Tablosuna bakın). Görüntüleme yazılımını açın ve ön ısıtma sıcaklığını 37 °C'ye ayarlayın.
- Tahlil reaktiflerini hazırlamak için, Tablo 1'de belirtildiği gibi küçük değişikliklerle reaktifleri yeniden oluşturmak için tahlil kitinin talimatlarını izleyin.
KRİTİK : Optimal nihai FCCP ve Hoechst33342 konsantrasyonları daha önce belirlenmiştir. - 60 dakikalık hücre dinlenmesinden sonra, kuyucukları bir hücre kültürü mikroskobu ile inceleyin ve hücre agregasyonları gibi görsel anormallikleri not edin.
- Hücre kültürü plakasını RT'de, mikroplakalar için açılır rotorlu bir santrifüjde 60 × g'da 1 dakika boyunca, minimum hızlanma ve minimum kırılma ile santrifüjleyin; Plakayı çevirin ve 40 × g'da 1 dakika boyunca tekrar santrifüjleyin. Hızlanmayı ve kırmayı minimuma ayarlayın. Hücreleri CO2 olmayan bir inkübatörde 37 ° C'de 25-30 dakika inkübe edin.
NOT: Hücre görüntüleme gerçekleştirildiğinde, hücre plakası bunun yerine önceden ısıtılmış çok modlu okuyucuda inkübe edilir ( Malzeme Tablosuna bakın) ve bu inkübasyon süresi boyunca (ilk hücre inkübasyonu) her oyuğun parlak alan görüntüsü alınır. - Hücre kültürü plakasının barkodunu barkod tarayıcı ile tarayın (Malzeme Tablosuna bakın), Parlak Alan Taramayı Başlat'ı seçin, hücre kültürü plakasını plaka tepsisine yerleştirin ve tepsi geri çekme işlemini başlatın. Tarama için hücre içeren kuyuları seçin ve taramayı başlatın.
- İlk hücre inkübasyonu sırasında, sensör kartuşunun portlarını Tablo 1'de belirtildiği gibi reaktiflerle yükleyin : port (A): 20 μL (kontroller), etomoksir (mitokondriye uzun zincirli yağ asidi taşınmasının inhibitörü), UK 5099 (2-Siyano-3- (1-fenil-1H-indol-3-il) -2-propenoik asit; mitokondriyal piruvat taşıyıcısının inhibitörü) veya BPTES (Bis-2- (5-fenilasetamido-1, 3,4-tiadiiyazol-2-il) etil sülfür; glutamata glutamin dönüşüm inhibitörü); port (B): 22 μL oligomisin (ATP sentaz inhibitörü); bağlantı noktası (C): 25 μL FCCP (birleştirici karbonil siyanür-4 (triflorometoksi) fenilhidrazon); port (D): 27 μL rotenon / antimisin A / Hoechst 33342 (sırasıyla mitokondriyal kompleks I ve III inhibitörleri ve nükleer boya). Sensör kartuşunu 37 °C CO2 olmayan inkübatöre 5 dakika daha geri koyun.
NOT: Bağlantı noktası yüklemesi için üreticinin talimatlarına uyun. - İlk hücre inkübasyonundan sonra ve hücre görüntüleme tamamlandıktan sonra (varsa) hücre kültürü plakasını inkübatörden veya plaka okuyucudan çıkarın ve her bir oyuğa kuyucuk başına 180 μL'lik bir nihai hacme kadar ılık ekleyin. Hücre plakasını 37 ° C'de CO2 olmayan bir inkübatöre 15-25 dakika daha yerleştirin (ikinci hücre inkübasyonu).
- İkinci hücre inkübasyonu sırasında sensör kalibrasyonunu başlatarak metabolik testi başlatın. Sensör kartuşunun kalibrasyonu ile tahlil başlatılmaya hazır olduğunda Testi Çalıştır'a tıklayın. İstendiğinde, sensör kartuşunu 37 °C CO2 olmayan inkübatörden akı analizörü tepsisine aktarın ve kalibrasyonu başlatın. Tahlil analiz yazılımı istemini izleyin ve kalibrasyon tamamlandıktan sonra hücre plakası için yardımcı plakayı değiştirin.
NOT: Kalibrasyon yaklaşık 20 dakika sürer. - Metabolik tahlilden sonra, yazılım istemini izleyin ve sensör kartuşunu ve hücre plakasını cihazdan çıkarın. Sensör kartuşunu hücre plakasından çıkarın ve hücre plakasını kapağıyla kapatın.
- Ön deneylerde Hoechst boya inkübasyon süresi belirlendikten sonra, plakanın barkodunu tarayın ve çok modlu okuyucu ile her hücre içeren kuyunun floresan görüntüsünü elde etmek için yazılım istemlerini izleyin.
NOT: Görüntüleme ve tahlil analiz yazılımı, hücre sayımına veri normalizasyonu için hücre sayımı verilerinin tahlil analizi veri dosyasına aktarılmasına izin veren arayüzlüdür.
2. Sirkadiyen saat gen ekspresyonu
NOT: Katılımcıların PBMC'lerden gelen saat genlerinin ekspresyonu, RNA kan kiti kullanılarak RNA'nın izole edilmesiyle gözden geçirilecektir (bkz.
- Katılımcının kanının 3 mL'sini 6 mL stabilize edici reaktif içeren bir RNA tüpüne doğrudan (Malzeme Tablosuna bakınız) çekin. Tamamen karışması için 10 saniye boyunca girdap.
NOT: Stabilize edici reaktifler katılımcının kan örneği ile iyice karıştırılmazsa, çalışma hatası riski artar. - Stabilize kan örneğinin 1.0 mL'sini 5 mL eritrosit lizis tamponu ile 15 mL'lik bir tüpe aktarın. Buz üzerinde 10-15 dakika inkübe edin. İnkübasyon sırasında tüpü 2x vorteksleyin. Tüpü 4 °C'de 400 × g'da 10 dakika santrifüjleyin.
- Peleti tanımlayın ve parçalanmış kırmızı kan hücreleri içeren süpernatanı dikkatlice dökün. 2 mL eritrosit lizis tamponu ekleyin (Malzeme Tablosuna bakınız), hücreleri yeniden süspanse edin, kısaca girdap yapın ve 4 ° C'de 10 dakika boyunca 400 × g'da santrifüjleyin.
- Süpernatanı dökün ve tüpü emici kağıt üzerinde 1-2 dakika ters çevrilmiş halde bırakın. Bir sonraki adımdan önce tüpün kenarındaki sıvıyı temiz kağıtla kurulayın.
- Dikkatlice 600 μL RNA lizis tamponu ekleyin (Malzeme Tablosuna bakınız). Üreticinin protokolünü takiben, β-merkaptoetanol ekleyin ve peleti yeniden süspanse edin.
- Lizatı doğrudan tek kullanımlık bir hücre lizat homojenizatörüne pipetleyin (Malzeme Tablosuna bakınız), 2 mL'lik bir toplama tüpüne yerleştirilmiş döndürme kolonuna ve homojenize etmek için maksimum hızda 2 dakika santrifüjleyin. Tek kullanımlık hücre lizat homojenizatör spin kolonunu atın ve homojenize lizatı saklayın.
- Homojenize lizata 1 hacim (600 μL) %70 etanol ekleyin ve pipetleme ile karıştırın. Oluşmuş olabilecek herhangi bir çökelti de dahil olmak üzere numuneyi 2 mL'lik bir toplama tüpünde yeni bir döndürme kolonuna dikkatlice pipetleyin, ancak kenarı nemlendirmeyin. >8.000 × g'da 15 saniye santrifüjleyin.
- Sıkma kolonunu ( Malzeme Tablosuna bakınız) yeni bir 2 mL toplama tüpüne aktarın. Sıkma kolonuna 700 μL sıkı yıkama tamponu ( Malzeme Tablosuna bakınız) uygulayın ve yıkamak için >8.000 × g'da 15 saniye santrifüjleyin. Akışı atın.
- Sıkma kolonunu dikkatlice açın ve 500 μL yumuşak yıkama tamponu ekleyin ( Malzeme Tablosuna bakın). Kapağı kapatın ve 3 dakika boyunca tam hızda (20.000 × g) santrifüjleyin.
- Döndürme kolonunu 1.5 mL'lik bir mikrosantrifüj tüpüne aktarın ve 30-50 μL RNaz içermeyen suyu doğrudan silika membranın üzerine pipetleyin. RNA'yı elüte etmek için >8.000 × g'da 1 dakika santrifüjleyin. Bir kez daha tekrarlayın.
NOT: RNA -80 °C'de saklanabilir. - Üreticinin protokolüne göre RNaz içermeyen DNaz setini ( Malzeme Tablosuna bakınız) kullanarak bir kolon üzerinde DNaz işlemi gerçekleştirin.
- Üreticinin protokolüne göre 500 ng toplam RNA ve gerçek zamanlı bir polimeraz zincir reaksiyonu (PCR) sistemi ( Malzeme Tablosuna bakınız) kullanarak cDNA oluşturun. Tüm cDNA örneklerini RNaz içermeyen suda 1:25 oranında seyreltin ve kantitatif ters transkripsiyon PCR (qRT-PCR) gerçekleştirmek için 4 mL kullanın.
- Tablo 2'de gösterilen primerlerin her birinden 10 mM ile qRT-PCR'yi tamamlamak için bir astar ekleme yöntemi ( Malzeme Tablosuna bakınız) kullanın. Gerçek zamanlı bir sistem kullanarak qRT-PCR'yi tamamlayın (Malzeme Tablosuna bakın).
- Rpl26 mRNA seviyelerini kullanarak seçilen genlerin mRNA seviyelerini normalleştirin. Bağıl nicelemeyi hesaplamak için 2-DDCt yöntemini kullanın.
- Belirli bir mRNA'nın ekspresyonunun bir sirkadiyen salınım sergileyip sergilemediğini belirlemek için, bir deneysel koşulda sirkadiyen ritmikliği tespit etmek içinLR_rhythmicity 39 olasılığa dayalı bir test ( p≤ 0.01 kullanarak) kullanın40.
3. Veri analizi planı
NOT: Katılımcıları ilaç kullanımına göre kategorize etmek için bir tıbbi envanter kullanılacaktır43.
- Yaş, cinsiyet, kilo, boy, kan basıncı, kalp atış hızı ve diğer risk faktörlerinin ortak değişkenler olarak dahil edilmesi gereken karma etkili bir doğrusal model kullanın.
- Denek içi veri korelasyonunu açıklamak için rastgele bir etki terimi dahil edilmelidir.
- Model uydurma için, hiyerarşik prensibe sahip geriye doğru değişken seçimi uygulanmalıdır.
- Takılan modelden, takılan modeldeki tüm ortak değişkenler göz önüne alındığında, zaman noktası 1'den zaman noktası 2'ye kadar olan değişiklikleri ölçün.
Sonuçlar
Önerilen protokol, metodoloji için doğrulama görevi gören ön verileri içerir. Protokol, mitokondriyal fonksiyonu ve hücresel yakıt kullanımını incelemek için gerçek zamanlı bir metabolik akı analizörü ve sirkadiyen ritim genlerini analiz etmek için RNA ekstraksiyonu ve qRT-PCR içerir (örneğin, BMAL1, CLOCK, Nfil2, Nr1d1, Dbp, Cry1, Per2).
İlk analizden 10 gün sonra, beş kontrol katılımcısından izole edilmiş insan PBMC'lerinin oksijen tüketim oranı (OCR) Şekil 1'de sunulmaktadır. Veriler, ön ve son değerleri karşılaştırmak için kullanılır ve bir kontrol, etomoksir, UK5099 ve BPTES enjeksiyonunu takiben bazal solunum, akut yanıt, maksimal solunum ve yedek kapasite için ortalama değerleri gösterir. Özellikle, Şekil 1C , etomoksir enjeksiyonunu takiben önemli bir negatif akut yanıt göstermektedir, ancak bazal solunum, maksimal solunum veya yedek kapasite için önemli bir etki gözlenmemiştir.
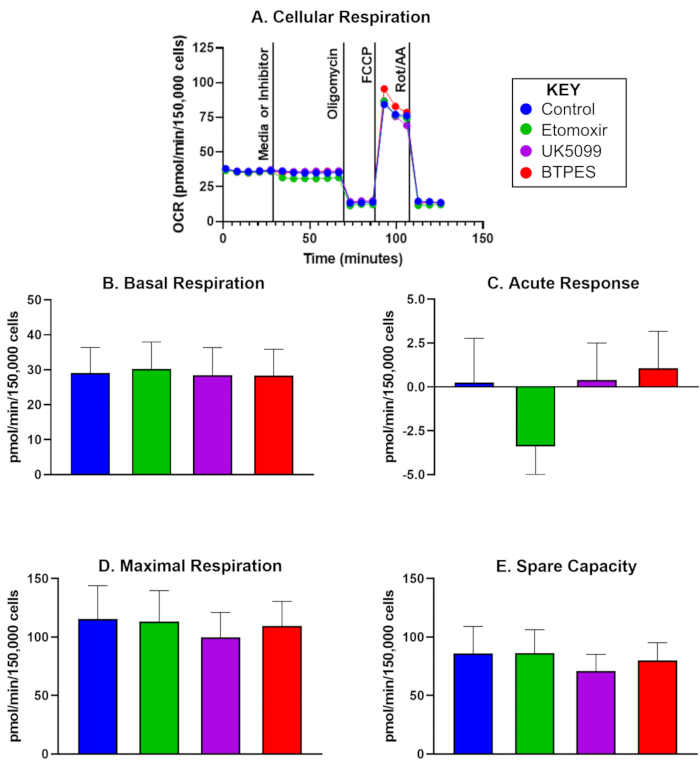
Şekil 1: İzole edilmiş insan periferik kan mononükleer hücrelerinin (PBMC'ler) oksijen tüketimi. (A) Gerçek zamanlı oksijen tüketim oranı (OCR; bir kontrol deneğinden izole edilen PBMC'lerin pmol/(min∙150.000 hücre), bir Akı Analizörü ile ölçülmüş ve substrat oksidasyon testi ile değerlendirilmiştir. Hücreler 150.000 hücre/kuyu yoğunluğunda tohumlandı. İlk enjeksiyon ya medya (kontrol) ya da inhibitördü (etomoksir, UK5099 veya BPTES; ayrıntılar için metne bakın) ve bazal hücresel solunum hızı ölçüldükten sonra gerçekleşti. Mitokondriyal substrat sınırlamasına akut yanıt, inhibitör enjeksiyonu öncesi ve sonrası bazal OCR farkı olarak belirlendi. ATP sentaz inhibitörü olan oligomisin, ATP üretimine bağlı solunumu inhibe eder ve proton sızıntısı solunumu sağlar. Birleştirici olan FCCP, maksimum, bağlanmamış solunumu indükler; rotenon ve antimisin A (sırasıyla kompleks I ve III inhibitörleri) mitokondriyal olmayan solunum hariç hepsini inhibe eder (ayrıntılar için metne bakınız). (B-E) Hücresel solunumun ölçülmesi (n = 5; veriler ortalama ± SD olarak temsil edilir). (B) İnhibitör enjeksiyonundan önce bazal OCR, (C) inhibitöre akut yanıt (inhibitör enjeksiyonundan önce bazal orana göre OCR'deki değişiklik), (D) maksimum OCR ve (E) yedek kapasite (ilk enjeksiyondan sonra maksimal OCR ve bazal OCR arasındaki fark). Etomoksir enjeksiyonuna akut yanıt (C), yüksek enerji talebi (D) sırasında OCR üzerinde gözle görülür bir etki olmaksızın, diğer substrat gruplarına kıyasla, bazal koşullar altında bir enerji substratı olarak yağ asidine OCR'nin daha yüksek bir bağımlılığını düşündürebilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| Bileşik | Bileşiğe (μL) eklendi | Stok (μM) | çalışan stok için stok (μL) | Çalışma stoğu için (μL) | Çalışma stoğu (μM) | Çalışma stoğu (μL) [bağlantı noktası] | Son konsantrasyon (μM) |
| Etomoksir | 700 | 160 | 500 | 1500 | 40 | 20 [bir] | 4 |
| Birleşik Krallık5099 | 700 | 80 | 500 | 1500 | 20 | 20 [bir] | 2 |
| BPTES (Nükleer Santral) | 700 | 120 | 500 | 1500 | 30 | 20 [bir] | 3 |
| oligo (oligo) | 420 | 150 | 300 | 2700 | 15 | 22 [B] | 1.5 |
| FCCP (Coğrafi Bölge) | 720 | 100 | 600 | 2400 | 20 | 25 [C] | 2 |
| Çürük/AA/H | 540 | 50 | 300 | 2700 | 5 | 27 [D] | 0.5 |
Tablo 1: Substrat oksidasyon testi için reaktiflerin hazırlanması ve stok, çalışma ve nihai çözelti konsantrasyonları. Tüm reaktifler, hücre mito stres testinin veya substrat oksidasyon stres test kitlerinin bir parçasıdır. Kısaltmalar: oligo = oligomisin; FCCP = birleştirici karbonil siyanür-4 (triflorometoksi) fenilhidrazon; Rot / AA / H = rotenon / antimisin A / Hoechst 33342. Etomoksir, UK5099, BTPES: sırasıyla yağ asidi, glikoz ve glutamin oksidasyon inhibitörleri.
| Bmal1 | İleri – GCACGACGTTCTTTTCTGT |
| Ters – GCAGAAGCTTTTTCGATCTGCTTTT | |
| Saat | İleri – CGTCTCAGACCCTTCCTCAAC |
| Ters – GTAAATGCTGCCTGGGTGGA | |
| Ağlamak1 | İleri – ACTGCTATTGCCCTGTTGGT |
| Ters – GACAGGCAAATAACGCCTGA | |
| Per1 | İleri – ATTCGGGTTACGAAGCTCCC |
| Ters – GGCAGCCCTTTCATCCACAT | |
| Per2 | İleri – CATGTGCAGTGGAGCAGATTC |
| Ters – GGGGTGGTAGCGGATTTCAT | |
| Rev-erb α | İleri – ACAGATGTCAGCAATGTCGC |
| Ters – CGACCAAACCGAACAGCATC |
Tablo 2: Sirkadiyen saat gen primerleri.
Tartışmalar
Mitokondriyal fonksiyondaki azalma ve sirkadiyen ritmin yaşla birlikte düzenlenmesi, yaşa bağlı hastalıklara katkıda bulunan faktörler olarak giderek daha fazla görülmektedir. Diyet ve fiziksel aktivite gibi yaşam tarzı değişiklikleri yoluyla sirkadiyen ritimleri değiştirmek, sağlıklı yaşlanmayı teşvik etmek ve yaşlanma ile ilişkili hareketlilik düşüşlerini azaltmak için potansiyel bir stratejiyi temsil eder. Bununla birlikte, mitokondriyal fonksiyonu doğrudan değerlendirmek için mevcut yöntemler invazivdir ve genellikle bir kas biyopsisi gerektirir, bu da algılanan ağrı ve riskler nedeniyle katılımcı alımı ve elde tutulması ile ilgili zorluklar yaratabilir.
Sirkadiyen ve metabolik sağlık belirteçlerinin kan alma gibi daha az invaziv yöntemlerle değerlendirilmesi, gelecekteki çalışmalarda terapötik hedeflerin araştırılması ve test edilmesi için değerli sonuçlar sağlayacaktır. Bu minimal invaziv yöntemler, sirkadiyen ritim ve metabolik sağlık arasındaki karmaşık etkileşim ve bunların işlev üzerindeki etkileri hakkında yeni bilgiler sağlayarak alanı büyük ölçüde ilerletme potansiyeline sahiptir. Bu çalışmanın amacı, hücresel enerji metabolizması ile sirkadiyen ritim arasındaki ilişkiyi değerlendirmektir. Özellikle, biyoenerjetik akı analizi, katılımcıların beyaz kan hücrelerinde bir grup sirkadiyen genin gen ekspresyonunun izlenmesinin yanı sıra, çeşitli substrat kullanılabilirlik koşulları altında mitokondriyal fonksiyonu değerlendirmek için kullanılır. Analizin her iki kolunu, biyoenerjetik ve gen ekspresyonunu kullanarak, bu iki temel süreç arasındaki ilişkinin kapsamlı bir şekilde anlaşılması sağlanabilir.
Bu zaman serisi verilerinin sirkadiyen bir perspektiften istatistiksel analizi, sirkadiyen ritimlerin gücü, aralığı ve zamanlaması hakkında fikir verir. Sonuç olarak, gen ekspresyon analizi, hücresel biyoenerjetik ve metabolik ölçümlerin organizma düzeyinde entegrasyonu, insanlarda enerji metabolizması ile sirkadiyen ritimler arasındaki etkileşime ışık tutacak yeni ve yenilikçi bir yaklaşım oluşturmaktadır.
Bir pilot çalışmada, PBMC'lerin OCR'sinde yağ asidi kullanımının sınırlandırılmasına (bir karnitin palmitoil transferaz 1a inhibitörü olan etomoksir enjeksiyonunu takiben) akut bir yanıt tespit ettik. Bu bulgu, bu belirli katılımcı grubundaki PBMC'lerde, bazal solunum sırasında bir enerji substratı olarak yağ asitlerine bağımlılık olabileceğini düşündürmektedir. Bununla birlikte, maksimum solunum etkilenmedi, bu da glikoz ve glutamin gibi alternatif enerji kaynaklarının, yüksek enerji talebi sırasında yağ asitlerinin azalan kullanımını telafi edebileceğini düşündürdü. Gelecekteki çalışmalar, a) PBMC'lerin biyoenerjetik değerlerinin tüm vücut enerjilerini yansıtıp yansıtmadığını ve b) zaman kısıtlı yeme gibi müdahalelerin enerji substrat tercihlerini etkileyip etkilemeyeceğini araştırmalıdır.
PBMC'lerin akı analizi ile ilgili birkaç kritik adım vardır. İlk olarak, deneysel numuneler değerlendirilmeden önce, hücre tohumlama yoğunluğu (kuyu başına hücreler), her bir kuyucuk içinde ve her bir plaka boyunca sürekli bir hücre dağılımı olduğundan emin olarak optimize edilmelidir, nihai FCCP konsantrasyonu, 0, 0.125, 0.25, 0.5, 1.0 ve 2.0 μM konsantrasyonları kullanılarak konsantrasyon test çalışmaları çalıştırılarak optimize edilmelidir, ve varsa, Hoechst 33342 boyaması, üreticinin talimatlarına uyularak optimize edilmelidir. İkincisi, metabolik verilerin hücresel parametrelere normalleştirilmesi, verilerin deneyler arasındaki karşılaştırılabilirliği için kritik öneme sahiptir. Bu protokolde, Hoechst 33342 ile boyanmış hücreler ve bir hücre görüntüleme cihazı kullanılarak akı analizörü testinin tamamlanmasından sonra hücre sayımı anlatılmaktadır. Uygun bir cihaz mevcut değilse, kuyucuk başına toplam hücresel protein veya nükleer DNA içeriği gibi alternatif normalizasyon yöntemleri uygulanabilir. Teklif edilenlere kıyasla protokol içinde kullanılabilecek kayda değer bir değişiklik vardır. Spesifik olarak, protokol, burada önerilen sadece iki kit ile karşılaştırıldığında, üç inhibitörün her biri için ayrı bir test kiti kullanılarak tamamlanabilir (bkz. Malzeme Tablosu).
PBMC'lerin yaşlı erişkinlerde enerji metabolizması ve sirkadiyen ritimler arasındaki etkileşimi incelemek için bir vekil olarak kullanılması, tedaviye verdikleri yanıtın diğer doku ve organlardaki yanıtı doğru bir şekilde yansıtabileceği varsayımıyla sınırlıdır. Bu yaklaşım yeni ve minimal invaziv olmasına rağmen, beyin, karaciğer ve iskelet kası gibi farklı doku ve organların çeşitli koşullar altında farklı reaksiyonlar verebileceğini kabul etmek önemlidir. Klinik öncesi bir çalışma, beslenen ve aç tutulan farelerde saat geni ekspresyonunun değiştiğini, bunun da karaciğer ve kas dokusunda BMAL1 hedef genlerinin kısmi yukarı regülasyonuna, ancak diğerlerinin aşağı regülasyonuna yol açtığını göstermiştir41. Bu periferik dokular ve organlar, metabolik süreçleri yüksek oranda temsil eder ve saat geni ekspresyon mekanizmalarını etkileyen çevresel ipuçlarından etkilenebilir42. Periferik dokular, organlar ve merkezi sirkadiyen saat arasındaki ilişkiyi tam olarak anlamak için daha fazla araştırmaya ihtiyaç vardır.
Diğer bir sınırlama, katılımcıların herhangi bir reçete almak için diskalifiye edilmemesidir, bu da istatistiksel analizde sınırlamalar doğurabilir. Bu sınırlamayı ortadan kaldırmak için, gelecekteki araştırmalarda, ilaç alan yaşlı yetişkinlerin popülasyonlarında doğrulanmış bir tıbbi envanter kullanılacaktır43. Katılımcılar, protokolün veri inceleme bölümünde kaydedilen önerilen ilaçlara göre kategorize edilecektir. 1) fonksiyonel düşüşü hızlandırdığı, 2) fonksiyonel düşüşü yavaşlattığı ve 3) iskelet kası fonksiyonunu etkilediği gösterilen ilaçlar açısından toplam üç kategori vardır.
Son olarak, insan iskelet kası mitokondriyal oksidatif kapasitesi gündüz-gece ritmi sergiler, 06:00 ile 11:00 arasında zirve yapar ve 08:00 ile 11:00 arasında azalır44. Bunun PBMC'lerin mitokondriyal oksidatif yeteneği için geçerli olup olmadığı henüz belli değil. Bununla birlikte, ön veriler PBMC'lerin ve mitokondriyal metabolizmanın ilişkili olduğunu göstermektedir45. Kas biyopsileri ve PBMC'lerdeki değişiklikler hakkındaki bilgilerin o kadar net olmadığı göz önüne alındığında, sonuçlar analiz edilirken dikkatli olunmalıdır. Bu sınırlama göz önüne alındığında, protokolün geçerliliğini ve etkinliğini sağlamaya yardımcı olabilecek değerli bağlam ve içgörü sağlayabileceğinden, bir protokolü değerlendirirken ve geliştirirken bu bilgileri akılda tutmak önemlidir.
Bildiğimiz kadarıyla, bu projede önerilen yöntemlerle yakıt kullanım modellerini veya sirkadiyen ritimleri değerlendiren daha önce hiçbir çalışma yapılmamıştır. Amacımız, mitokondriyal yakıt kullanımı ve sirkadiyen sağlığı belirteçlerinin değişikliklere duyarlılığını incelemektir. Bu çalışma, kas biyopsisinin mümkün olmadığı gelecekteki girişimsel çalışmalarda bir alternatif olarak hizmet edebilecek, oldukça hassas bir biyobelirteç ölçümü için minimal invaziv bir yöntem sunmaktadır.
Açıklamalar
Yazarların açıklanacak herhangi bir çıkar çatışması yoktur.
Teşekkürler
Bu çalışma, Klinik ve Translasyonel Bilim Enstitüsü'nün (NIH / NCRR UL1TR000064) yardımıyla Yaşlı Amerika'nın Bağımsızlık Merkezi (NIH / NIA P30AG028740) tarafından finanse edilmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Agilent Technologies Cell Imaging | Agilent Technologies | Cell image software | |
| Agilent/Seahorse Wave desktop program | Agilent Technologies | 5994-0039EN | Software used to analyse data from the celluar analyser and stress test assay |
| Agilent/Seahorse XFe96 Flux Analyzer | Agilent Technologies | S7800B | Real-time cellular flux analyzer; flux analyser |
| Bar Code Reader | Agilent Technologies | G2615-90007 | |
| Seahorse Wave Desktop Software | Agilent technologies | Data acquisition software; assay analysis; wave program | |
| Seahorse XF 1.0 M Glucose solution | Agilent Technologies | 103577-100 | Supplement to basal medium to make assay medium |
| Seahorse XF 100 mM Pyruvate solution | Agilent Technologies | 103578-100 | Supplement to basal medium to make assay medium |
| Seahorse XF 200 mM Glutamine solution | Agilent Technologies | 103579-100 | Supplement to basal medium to make assay medium |
| Seahorse XF Cell Mito Stress Test | Agilent Technologies | 103015-100 | Mitochondrial bioenergetic function assay |
| Seahorse XF Mito Fuel Flex Test | Agilent Technologies | 103260-100 | Mitochondrial bioenergetic function assay |
| Seahorse XF RPMI Medium | Agilent Technologies | 103576-100 | Basal medium for PBMCs |
| Seahorse XFe96 FluxPak mini | Agilent Technologies | 102601-100 | Sensor cartridges and cell culture microplates |
| Cytation 1 Cell Imaging Multi-Mode Reader | Agilent/BioTek | Multimode reader to image cells | |
| CPT Sodium Heparin Tube, 16 x 125 mm x 8.0 mL | Becton Dickinson | 362753 | Blood collection tubes for isolation of peripheral blood mononuclear cells |
| CellTak Cell and Tissue Adhesive | Corning | 354240 | Cell adherent to coat cell culture microplate |
| Phosphate Buffered Saline | Corning | 21-040-CV | Buffer to wash blood cells |
| Ficoll Paque Plus | Cytiva | GE17-1440-02 | Gradient medium |
| Lunar Prodigy DXA scanner | General Electric | EN 60601-2-7 5.1 | Whole body lean mass and fat/lean tissue mass ratio |
| Freezing container, Nalgene Mr. Frosty | MilliporeSigma | C1562 | Freezing container used to slow-freeze cell suspension |
| Buffer EL. | Qiagen | 79217 | Erythrocyte lysis buffer |
| Buffer RLT | Qiagen | 79216 | RNA lysis buffer |
| Buffer RPE | Qiagen | 1018013 | Mild washing buffer |
| Buffer RW1 | Qiagen | 1053394 | Stringent washing buffer |
| QIAamp DNA Micro Kit | Qiagen | 56304 | DNA preps: QIAamp MinElute Columns, Proteinase K, Carrier RNA, Buffers, Collection Tubes (2 ml) |
| QIAamp RNA Blood Mini Kit | Qiagen | 52304 | RNA blood kit; Used to isolate RNA |
| QIAshredder | Qiagen | 79656 | disposable cell-lysate homogenizers |
| RNase-Free DNase Set | Qiagen | 79254 | Used to perform DNA digest |
| 2-Mercaptoethanol (Reagent) | Thermo Fisher Scientific | MFCD00004890 | |
| 2-mL collection tubes, 100 count | Thermo Fisher Scientific | AM12480 | |
| Fast SYBR Green Master Mix | Thermo Fisher Scientific | 4385612 | Primers are added to this and used to carry out qRT-PCR |
| Microcentrifuge Tubes, 1.5 mL | Thermo Fisher Scientific | 69715 | Used to hold RNA purification filter during RNA purification |
| Narrow p1000 pipette tips | Thermo Fisher Scientific | 02-707-402 | |
| QuantStudio 3 Real-Time PCR System, MiniAmp Plus Thermal Cycler, and 96-Well Plates Package | Thermo Fisher Scientific | A40393 | |
| Tempus Blood RNA Tube | Thermo Fisher Scientific | 4342792 | RNA Tube |
| Tempus Spin RNA Isolation kit | Thermo Fisher Scientific | 4380204 | RNA extraction and isolation |
Referanslar
- UN Department of Economic and Social Affairs. Population Division 2019, World Population Prospects. UN Department of Economic and Social Affairs. , (2019).
- Anton, S., Leeuwenburgh, C. Fasting or caloric restriction for healthy aging. Experimental Gerontology. 48 (10), 1003-1005 (2013).
- Dziechciaż, M., Filip, R. Biological psychological and social determinants of old age: Bio-psycho-social aspects of human aging. Annals of Agricultural and Environmental Medicine. 21 (4), 835-838 (2014).
- Anton, S. D., et al. Flipping the metabolic switch: understanding and applying the health benefits of fasting. Obesity. 26 (2), 254-268 (2018).
- Fried, L. P., Guralnik, J. M. Disability in older adults: evidence regarding significance, etiology, and risk. Journal of the American Geriatrics Society. 45 (1), 92-100 (1997).
- Manini, T. Development of physical disability in older adults. Current Aging Science. 4 (3), 184-191 (2011).
- Chung, H. Y., et al. Molecular inflammation: underpinnings of aging and age-related diseases. Ageing Research Reviews. 8 (1), 18-30 (2009).
- Sun, N., Youle, R. J., Finkel, T. The mitochondrial basis of aging. Molecular Cell. 61 (5), 654-666 (2016).
- Tarasov, A. I., Griffiths, E. J., Rutter, G. A. Regulation of ATP production by mitochondrial Ca2. Cell Calcium. 52 (1), 28-35 (2012).
- Chistiakov, D. A., Sobenin, I. A., Revin, V. V., Orekhov, A. N., Bobryshev, Y. V. Mitochondrial aging and age-related dysfunction of mitochondria. Biomed Research International. 2014, 238463 (2014).
- Boengler, K., Kosiol, M., Mayr, M., Schulz, R., Rohrbach, S. Mitochondria and ageing: role in heart, skeletal muscle and adipose tissue. Journal of Cachexia, Sarcopenia, and Muscle. 8 (3), 349-369 (2017).
- Drew, B., et al. Effects of aging and caloric restriction on mitochondrial energy production in gastrocnemius muscle and heart. American Journal of Physiology Regulatory, Integrative and Comparative Physiology. 284 (2), R474-R480 (2003).
- Short, K. R., et al. Decline in skeletal muscle mitochondrial function with aging in humans. Proceedings of the National Academy of Sciences. 102 (15), 5618-5623 (2005).
- Musci, R. V., Hamilton, K. L., Miller, B. F. Targeting mitochondrial function and proteostasis to mitigate dynapenia. European Journal of Applied Physiology. 118 (1), 1-9 (2018).
- Picca, A., et al. Targeting mitochondrial quality control for treating sarcopenia: lessons from physical exercise. Expert Opinion on Therapeutic Targets. 23 (2), 153-160 (2019).
- Fernandez-Marcos, P. J., Auwerx, J. Regulation of PGC-1α, a nodal regulator of mitochondrial biogenesis. The American Journal of Clinical Nutrition. 93 (4), 884-890 (2011).
- Kim, Y., Triolo, M., Hood, D. A. Impact of aging and exercise on mitochondrial quality control in skeletal muscle. Oxidative Medicine and Cellular Longevity. 2017, 3165396 (2017).
- Wang, H., Hiatt, W. R., Barstow, T. J., Brass, E. P. Relationships between muscle mitochondrial DNA content, mitochondrial enzyme activity and oxidative capacity in man: alterations with disease. European Journal of Applied Physiology and Occupational Physiology. 80 (1), 22-27 (1999).
- Tian, Q., et al. Muscle mitochondrial energetics predicts mobility decline in well-functioning older adults: The baltimore longitudinal study of aging. Aging Cell. 21 (2), e13552 (2022).
- Sardon Puig, L., Valera-Alberni, M., Cantó, C., Pillon, N. J. Circadian rhythms and mitochondria: connecting the dots. Frontiers in Genetics. 9, 452 (2018).
- Gano, L. B., Patel, M., Rho, J. M. Ketogenic diets, mitochondria, and neurological diseases. Journal of Lipid Research. 55 (11), 2211-2228 (2014).
- Liesa, M., Shirihai, O. S. Mitochondrial dynamics in the regulation of nutrient utilization and energy expenditure. Cell Metabolism. 17 (4), 491-506 (2013).
- Lesnefsky, E. J., Chen, Q., Hoppel, C. L. Mitochondrial metabolism in aging heart. Circulation Research. 118 (10), 1593-1611 (2016).
- Hartman, M. L., et al. Relation of mitochondrial oxygen consumption in peripheral blood mononuclear cells to vascular function in type 2 diabetes mellitus. Vascular Medicine. 19 (1), 67-74 (2014).
- Mahapatra, G., et al. Blood-based bioenergetic profiling is related to differences in brain morphology in African Americans with Type 2 diabetes. Clinical Science. 132 (23), 2509-2518 (2018).
- Moore-Ede, M. C. Physiology of the circadian timing system: predictive versus reactive homeostasis. The American Journal of Physiology. 250 (5), R737-R752 (1986).
- Young, M. W. Life's 24-hour clock: molecular control of circadian rhythms in animal cells. Trends in Biochemical Sciences. 25 (12), 601-606 (2000).
- Yoo, S. H., et al. PERIOD2::LUCIFERASE real-time reporting of circadian dynamics reveals persistent circadian oscillations in mouse peripheral tissues. Proceedings of the National Academy of Sciences. 101 (15), 5339-5346 (2004).
- Zhang, R., Lahens, N. F., Ballance, H. I., Hughes, M. E., Hogenesch, J. B. A circadian gene expression atlas in mammals: implications for biology and medicine. Proceedings of the National Academy of Sciences. 111 (45), 16219-16224 (2014).
- de Goede, P., Wefers, J., Brombacher, E. C., Schrauwen, P., Kalsbeek, A. Circadian rhythms in mitochondrial respiration. Journal of Molecular Endocrinology. 60 (3), R115-R130 (2018).
- Hood, S., Amir, S. The aging clock: circadian rhythms and later life. The Journal of Clinical Investigation. 127 (2), 437-446 (2017).
- Sellix, M. T., et al. Aging differentially affects the re-entrainment response of central and peripheral circadian oscillators. The Journal of Neuroscience. 32 (46), 16193-16202 (2012).
- Sato, S., et al. Circadian reprogramming in the liver identifies metabolic pathways of aging. Cell. 170 (4), 664-677 (2017).
- Lundell, L. S., et al. et al. feeding alters lipid and amino acid metabolite rhythmicity without perturbing clock gene expression. Nature Communications. 11 (1), 4643 (2020).
- Perrin, L., et al. Transcriptomic analyses reveal rhythmic and CLOCK-driven pathways in human skeletal muscle. eLife. 7, e34114 (2018).
- Gutierrez-Monreal, M. A., Harmsen, J. -. F., Schrauwen, P., Esser, K. A. Ticking for metabolic health: the skeletal-muscle clocks. Obesity. 28, S46-S54 (2020).
- Wolff, C. A., et al. Defining the age-dependent and tissue-specific circadian transcriptome in male mice. bioRxiv. 42 (1), 111982 (2023).
- Wilson, D., Breen, L., Lord, J. M., Sapey, E. The challenges of muscle biopsy in a community based geriatric population. BMC Research Notes. 11 (1), 830 (2018).
- Ding, H., et al. Likelihood-based tests for detecting circadian rhythmicity and differential circadian patterns in transcriptomic applications. Briefings in Bioinformatics. 22 (6), 224 (2021).
- Ding, Z., Lamb, T. M., Boukhris, A., Porter, R., Bell-Pedersen, D. Circadian clock control of translation initiation factor eIF2α activity requires eIF2γ-dependent recruitment of rhythmic PPP-1 phosphatase in Neurospora crassa. mBio. 12 (3), e00871 (2021).
- Di Francesco, A., Di Germanio, C., Bernier, M., de Cabo, R. A time to fast. Science. 362 (6416), 770-775 (2018).
- Kalfalah, F., et al. Crosstalk of clock gene expression and autophagy in aging. Aging. 8 (9), 1876-1895 (2016).
- Psaty, B. M., et al. Assessing the use of medications in the elderly: methods and initial experience in the cardiovascular health study. Journal of Clinical Epidemiology. 45 (6), 683-692 (1992).
- van Moorsel, D., et al. Demonstration of a day-night rhythm in human skeletal muscle oxidative capacity. Molecular Metabolism. 5 (8), 635-645 (2016).
- Janssen, J. J. E., et al. Extracellular flux analyses reveal differences in mitochondrial PBMC metabolism between high-fit and low-fit females. American Journal of Physiology. Endocrinology and Metabolism. 322 (2), E141-E153 (2022).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır