Method Article
Süper Çözünürlüklü Görüntüleme için Tam Montajlı Drosophila Embriyolarını Fiziksel Olarak Büyütmek için Genişleme Mikroskobunun Kullanılması
Bu Makalede
Özet
Burada, konvansiyonel lazer taramalı konfokal mikroskop kullanılarak süper çözünürlüklü görüntüleme elde etmek için erken Drosophila embriyolarında genişleme mikroskobunun uygulanması için bir protokol sunulmaktadır.
Özet
Gelişimsel biyolojinin beygir gücü, araştırmacıların karmaşık biyolojik numuneler içindeki etiketli moleküllerin üç boyutlu lokalizasyonunu belirlemelerini sağlayan konfokal mikroskoptur. Geleneksel konfokal mikroskoplar, birkaç yüz nanometre uzaklıkta bulunan iki bitişik floresan nokta kaynağının çözülmesine izin verirken, hücre altı biyolojinin daha ince ayrıntılarını gözlemlemek, sinyalleri onlarca nanometre mertebesinde çözme yeteneğini gerektirir. Araştırmacıların bu tür çözünürlük sınırlarından kaçınmasına izin vermek için süper çözünürlüklü mikroskopi için çok sayıda donanım tabanlı yöntem geliştirilmiştir, ancak bu yöntemler tüm araştırmacılar için mevcut olmayan özel mikroskoplar gerektirir. Çözme gücünü artırmak için alternatif bir yöntem, ilk olarak 2015 yılında Boyden grubu tarafından tanımlanan genişleme mikroskobu (ExM) olarak bilinen bir işlemle numunenin kendisini izotropik olarak büyütmektir. ExM kendi başına bir mikroskopi türü değildir, daha ziyade kurucu moleküllerinin göreceli uzamsal organizasyonunu korurken bir numuneyi şişirmek için bir yöntemdir. Genişletilmiş numune daha sonra geleneksel bir konfokal mikroskop kullanılarak etkili bir şekilde artırılmış bir çözünürlükte gözlemlenebilir. Burada, yüzey epitel hücreleri içinde Par-3, miyozin II ve mitokondrinin lokalizasyonunu incelemek için kullanılan tam montajlı Drosophila embriyolarında ExM'nin uygulanması için bir protokol açıklıyoruz. Bu protokol, geleneksel konfokal mikroskopi ile görülemeyen hücre altı detayların saptanmasına izin vererek, numune boyutunda yaklaşık dört kat artış sağlar. Prensip kanıtı olarak, bitişik hücre korteksleri arasındaki farklı miyozin-GFP havuzlarını ayırt etmek için bir anti-GFP antikoru kullanılır ve mitokondriyal ağ mimarisinin ince ayrıntılarını ortaya çıkarmak için endojen biyotinillenmiş molekülleri tespit etmek için floresan etiketli streptavidin kullanılır. Bu protokol, floresan etiketleme için ortak antikorlar ve reaktifler kullanır ve mevcut birçok immünofloresan protokolüyle uyumlu olmalıdır.
Giriş
Hücre ve gelişim biyolojisinde, görmek inanmaktır ve proteinlerin lokalizasyon modellerini doğru bir şekilde belirleme yeteneği birçok deney türü için temeldir. Lazer taramalı konfokal mikroskopi, bozulmamış numuneler içinde floresan etiketli proteinleri üç boyutlu olarak görüntülemek için standart araçtır. Konvansiyonel konfokal mikroskoplar, yaydıkları ışığın dalga boyunun yarısından daha azıyla ayrılan bitişik floresan sinyallerini ayırt edemez (çözemez)1. Başka bir deyişle, iki nokta kaynağı, iki ayrı sinyal olarak çözülmeleri için yanal yönde en az 200-300 nm (eksenel yönde 500-700 nm) ile ayrılmalıdır. Bu teknik engel, kırınım sınırı olarak bilinir ve kırınım sınırının altında uzamsal özelliklere sahip karmaşık hücre altı yapıların (örneğin, aktomiyosin hücre iskeleti veya mitokondriyal ağlar) incelenmesi için temel bir engeldir. Bu nedenle, konvansiyonel konfokal mikroskopların çözme gücünü arttırmaya yönelik teknikler biyolojik topluluğun genel ilgi alanıdır.
Kırınım sınırını aşmak için, onlarca nanometre veyadaha az 1,2,3 mertebesinde çözünürlüğe izin veren ve daha önce yalnızca elektron mikroskobu ile erişilebilen bir biyolojik karmaşıklık dünyasını ortaya çıkaran bir dizi farklı süper çözünürlüklü mikroskopi teknolojisi geliştirilmiştir. Bu donanım tabanlı yöntemlerin bariz avantajlarına rağmen, süper çözünürlüklü mikroskoplar genellikle belirli numune etiketleme gereksinimlerine ve uzun alım sürelerine sahiptir, bu da esnekliklerini sınırlar veya bazı laboratuvarların erişemeyeceği kadar pahalı olabilir. Mikroskop tabanlı süper çözünürlüğe bir alternatif, kendi başına bir mikroskopi türü olmayan, daha ziyade kurucu moleküllerininnispi uzamsal organizasyonunu korurken bir numuneyi şişirmek için bir yöntem olan genişleme mikroskobudur (ExM) 4. İzotropik olarak genişlemiş numuneler daha sonra geleneksel bir floresan konfokal mikroskop kullanılarak etkili bir şekilde artırılmış bir çözünürlükte gözlemlenebilir. ExM ilk olarak 2015 yılında Boyden grubu tarafındantanımlanmıştır 5 ve temel teknik o zamandan beri çeşitli deneylerde kullanılmak üzere uyarlanmıştır 6,7,8. ExM ayrıca, özellikle Drosophila 9,10,11, C. elegans12 ve zebra balığı 13'te tam montajlı embriyolarda kullanılmak üzere uyarlanmıştır ve bu da onu gelişimsel biyologlar için güçlü bir araç haline getirmektedir.
ExM, iki farklı hidrojel kimyasına dayanmaktadır: 1) suya batırıldığında boyutu büyük ölçüde artan şişebilir polielektrolit hidrojeller14 ve 2) izotropik numune genleşmesine izin vermek için son derece küçük polimer aralığına sahip poliakrilamid hidrojeller15. Yayınlanmış birçok ExM protokolü olsa da, bunlar genellikle aşağıdaki adımları paylaşır: numune fiksasyonu, etiketleme, aktivasyon, jelleşme, sindirim ve genişleme4. Fiksasyon koşulları ve floresan etiketleme stratejileri elbette deneyin ve sistemin ihtiyaçlarına göre değişecektir ve bazı protokollerde etiketleme genişlemeden sonra gerçekleşir. Numunedeki hedef moleküller, farklı kimyalar 4 kullanılarak elde edilebilen hidrojele bağlanmak için astarlanmalıdır(aktive edilmelidir). Jelleşme adımları sırasında numune, gelecekteki hidrojelin (sodyum akrilat, akrilamid ve çapraz bağlayıcı bisakrilamid) monomerleri ile doyurulur ve hidrojel daha sonra amonyum persülfat (APS) gibi bir başlatıcı tarafından katalize edilen serbest radikal polimerizasyonu ile oluşturulur ve tetrametilendiamin (TEMED)4 gibi bir hızlandırıcı. Jelleşmeden sonra numune, numunenin şişmeye karşı direncini homojenize etmek ve hidrojel4'ün izotropik genleşmesini sağlamak için enzimatik olarak sindirilir. Son olarak, sindirilmiş hidrojel suya yerleştirilir, bu da orijinal doğrusal boyutunun yaklaşık dört katına kadar genişlemesine nedenolur 4.
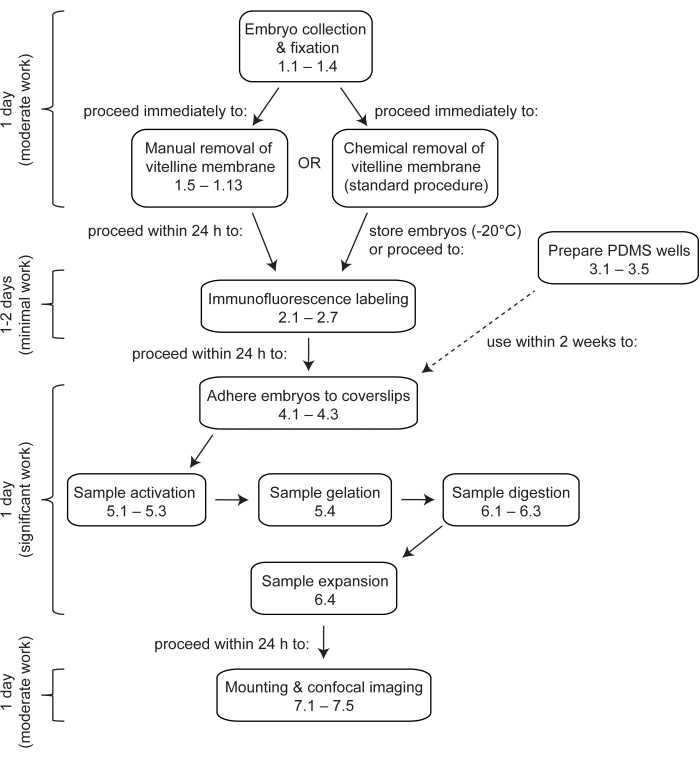
Şekil 1: Drosophila embriyolarında genişleme mikroskobuna genel bakış. ExM, tamamlanması en az 4 gün süren çok adımlı bir protokoldür. Embriyo toplama, fiksasyon ve devitellinizasyon, birden fazla koleksiyondan embriyoların toplanıp toplanmadığına bağlı olarak 1 gün veya daha fazla sürer. İmmünofloresan etiketleme, embriyoların birincil antikorlarla gece boyunca inkübe edilip edilmediğine bağlı olarak 1 gün veya 2 gün sürer. Embriyo aktivasyonu, jelleşme, sindirim ve genişleme tek bir günde gerçekleştirilebilir. Jeller, genişlemeden hemen sonra monte edilebilir ve görüntülenebilir, ancak pratik nedenlerden dolayı genellikle ertesi gün görüntülemeye başlanması arzu edilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Bu protokol, hücre altı protein lokalizasyon modellerini süper çözünürlükte görselleştirmek için tam montajlı erken ila orta evre Drosophila embriyoları16 üzerinde ExM'nin nasıl gerçekleştirileceğini açıklar (Şekil 1). Bu yöntem, protein moleküllerini hidrojel17'ye aktive etmek ve bağlamak için metilakrilik asit N-hidroksisüksinimidil ester (MA-NHS) kimyasını kullanır ve geç evre Drosophila embriyolarında ve dokularında kullanım için daha önce yayınlanmış bir ExM protokolünün bir modifikasyonudur11. Bu protokol, hidrojelleri kalıplamak ve aktivasyon ve jelleşme sırasında çözelti değişimini kolaylaştırmak için polidimetilsiloksan (PDMS) kuyularını kullanır. PDMS kuyularının oluşturulmasını gerektirmeyen alternatif bir yöntem, lamellere tutturulmuş embriyoların bir parça laboratuvar sızdırmazlık filmi22 üzerine oturan monomer çözeltisi damlalarına indirilmesini içerir. Ek olarak, bu protokol, immünofloresan boyama için bir ön koşul olan Drosophila embriyolarını çevreleyen geçirimsiz vitellin membranının manuel olarak çıkarılması için bir yöntemi açıklar. Daha da önemlisi, embriyoların elle soyulması yöntemi, numune etiketlemeden önce yalnızca uygun şekilde hazırlanmış Drosophila embriyolarını seçmek için kullanılabilir, bu da doğru aşama ve oryantasyona sahip genişletilmiş numunelerle sonuçlanma olasılığını büyük ölçüde artırır ve böylece aşağı akış veri toplamayı çok daha verimli hale getirir.
Protokol
Bu protokol, Arkansas Üniversitesi (UARK) Drosophila melanogaster gibi omurgasız hayvanlar üzerinde araştırma yönergelerini takip eder ve UARK Kurumsal Biyogüvenlik Komitesi tarafından onaylanmıştır (protokol #20001).
1. Drosophila embriyo fiksasyonu ve devitellinizasyon
NOT: Adım 1, embriyoyu çevreleyen şeffaf geçirimsiz bir zar olan vitellin membranının manuel olarak çıkarılması için bir prosedürü (elle soyma) açıklar. Daha da önemlisi, elle soyma, ExM protokolünün başlangıcında uygun şekilde evrelenmiş embriyoların seçilmesine izin verir, böylece ExM protokolünün sonunda kullanılabilir bir oryantasyonda embriyo elde etme olasılığını büyük ölçüde artırır. Bununla birlikte, bu ExM protokolü, toplu embriyo toplama ve vitellin membranının metanol bazlı çıkarılması için standart prosedürlerle tamamen uyumludur, bu durumda doğrudan adım 2'ye (immünofloresan etiketleme) atlanabilir.
- Birkaç ince cam iğne hazırlayın veya satın alın. İğne ucunun gerçek boyutları kritik değildir, ancak iğnelerin sabit embriyoların vitellin zarlarını delecek kadar sert ve keskin olduğundan emin olun. Embriyo mikroenjeksiyonları için iğneler hazırlarken, bir mikropipet çektirmesi kullanarak cam kılcal tüplerden (1 mm dış çap, 0.75 mm iç çap) iğneler yapın18; Alternatif olarak, önceden çekilmiş iğneler satın alın.
- Standart Drosophila tekniklerinikullanarak embriyoları toplayın 19 >100 yetişkin Drosophila'yı meyve suyu / agar plakası20 ile kapatılmış havalandırmalı plastik bir kaba yerleştirerek. Uygun aşama16'daki embriyoları zenginleştirmek için zamanlanmış toplama pencerelerini kullanın. Örneğin, gastrulasyon (aşama 6) ve yakınsak ekstansiyon (aşama 7) aşamalarını zenginleştirmek için, meyve suyu plakasını değiştirin, embriyoları 25 ° C'de 2 saat boyunca toplayın, ardından plakayı çıkarın ve ~ 2-4 saat eski embriyolar elde etmek için 25 ° C'de 2 saat daha yaşlandırın.
- Yumurta kabuğu benzeri koryonu embriyolardan çıkarmak için meyve suyu tabaklarının yüzeyini %50 çamaşır suyu ile kaplayın (Tablo 1), embriyoları küçük bir boya fırçası ile çalkalayarak agar yüzeyinden serbest bırakın ve koryonun çözünmesi için 3 dakika bekleyin.
- Dekoryonlu embriyoları bir boya fırçası kullanarak 4 mL heptan (organik üst faz) ve 4 mL fiksasyon tamponu (sulu alt faz; Tablo 1). Formaldehiti taze hazırlanmış veya yeni açılmış bir stoktan taze olarak seyreltin ve embriyoları eklemeden hemen önce 10x PBS ve deiyonize su ile karıştırın.
NOT: Formaldehiti paraformaldehit gücünden veya cam ampullerde %16 EM dereceli formaldehitten hazırlayın. Konsantre formaldehit stokları (örneğin, %37 formaldehit) kullanılabilir, ancak sonuçlar daha az tutarlı olabilir. - Embriyolar, organik ve sulu fazlar arasındaki arayüzde birikecektir. Arayüzde tek bir katman oluşturacak kadar embriyo ekleyin. Bir şişeye çok fazla embriyo eklenirse, bunlar da düzelmez.
- Güçlü bant kullanarak, parıldama şişelerini yanlarında bir masa üstü çalkalayıcı üzerinde hareketsiz hale getirin ve 220 rpm'de 20 dakika çalkalayın. Optimum fiksasyon için, tüm fiksasyon boyunca organik ve sulu fazlar arasında kuvvetli bir emülsiyon sağlayın.
- Sabitleme süresi boyunca, numunelerin her biri için aşağıdakilerden birini hazırlayın.
- Yarısına kadar %3 agar ile doldurulmuş 6 cm'lik plastik bir Petri kabı tabanı alın ve bir tıraş bıçağı veya neşter ile agarda ~5 cm x 3 cm'lik bir dikdörtgen çizin. Meyve suyu/agar tabakları da bu amaçla kullanılabilir.
- Küçük bir laboratuvar spatulası kullanarak agar levhasını çıkarın. Petri kabının tabanını ters çevirin ve tezgahın üzerine koyun. Agar levhasını ters çevrilmiş tabağın üzerine yerleştirin (Şekil 2A).
- Petri kabının kapağını alın ve kuru olduğundan emin olun. Eldiven giyerek, kapağın içine bir parça çift taraflı bant yerleştirin (bant parçası agar levhasından biraz daha büyük olmalıdır; Şekil 2B).
- Şişeleri çalkalayıcıdan çıkarın, tezgahın üzerine dik olarak yerleştirin ve organik ve sulu fazların ayrılmasına izin verin. Düzgün bir şekilde sabitlenmiş embriyolar, iki faz arasındaki arayüzde kalacaktır.
- Sabitlenmiş embriyoları, lateks ampul takılı bir cam Pasteur pipeti kullanarak agar levhasına aktarın. Embriyoların pipetin içine yapışmasını önlemek için, embriyoları pipetin dar boynunda tutmaya çalışın ve embriyoları bir kerede değil, birden fazla küçük parti halinde transfer edin. Tüm embriyolar agar levhasına girdikten sonra, bir P200 pipetleyici kullanarak embriyoların etrafındaki kalan heptanın çoğunu çıkarın. Morfolojiyi olumsuz etkileyebilecek sabit embriyoların kurumasını önlemek için bu adımı mümkün olduğunca çabuk (<3 dakika) gerçekleştirin.
- ~2 cm yükseklikten, embriyoları banda yapıştırmak için çift taraflı bantlı kapağı agar levhasının üzerine bırakın (Şekil 2C). Kapağı agar levhasından yavaşça çıkarın, tezgahın üzerine baş aşağı yerleştirin ve ardından kapaktaki embriyoları kaplayacak kadar PBS-Tween (Tablo 1) ekleyin.
- Dolaylı aydınlatma ile yaklaşık 100x büyütmede bir stereo diseksiyon mikroskobu kullanarak, morfolojik belirteçler kullanarak uygun şekilde evrelenmiş embriyoları tanımlayın. Evre 6 embriyolar için, görünür bir sefalik karık ve istila edilmiş mezoderm gibi belirteçler kullanın; Evre 7 embriyoları için, genişletilmiş bir germ bandı gibi belirteçler kullanın; Evre 11 embriyoları için, tamamen uzatılmış bir germband ve baştan kuyruğa eksen16 boyunca görünür segmentasyon gibi belirteçler kullanın.
- İstenilen embriyoları toplamak için, önce embriyonun ön veya arka ucuna yakın vitellin zarını (embriyonun etrafındaki şeffaf oval bir zar) ince bir cam iğne ile delin; Basınç serbest kaldıkça membran biraz sönecektir. Daha sonra, ince forseps veya metal bir prob kullanarak, diğer ucundaki embriyoyu delikten yavaşça itin; Vitellin membranı çift taraflı banda yapışık kalacaktır. İstenmeyen embriyoları banda yapıştırılmış halde bırakın.
- Yüzen devitellinize embriyoları periyodik olarak bir cam Pasteur pipeti ile toplayın ve bunları 1.5 mL'lik bir mikrofüj tüpüne taşıyın.
- Bu noktada, aşağıdaki adımlardan birini gerçekleştirin.
- Doğrudan immünofloresan etiketleme adımlarına devam edin. Devitellinize embriyolar doğrudan bloke edici çözeltiye gidebilir (adım 2.2). Bir sonraki adıma geçmeden önce embriyoların PBS-Tween veya bloke edici solüsyonda (Tablo 1) 16 saatten daha uzun süre kalmasına izin vermeyin.
- Embriyoları saklamak için metanole taşıyın. PBS-Tween'i mümkün olduğunca çıkarın ve ardından 1 mL metanol ekleyin. Embriyolar yerleştikten sonra, mümkün olduğunca fazla metanol çıkarın ve 1 mL taze metanol ekleyin. Embriyoları −20 °C'de süresiz olarak saklayın. Metanol depolaması ayrıca birden fazla koleksiyondan embriyoların bir araya getirilmesine izin verir.
2. İmmünofloresan etiketleme
NOT: Antikor inkübasyon adımlarının yanı sıra, kesin sıvı miktarları ve süreleri bu bölümde kritik değildir. Durulama veya yıkama yapmak için, embriyoların tüpün dibine çökmesine izin verin, embriyoları emmeden mümkün olduğunca fazla sıvıyı çıkarın ve ardından ~ 1 mL yeni sıvı ekleyin; optimum netlik ve kontrol için lateks ampul ile donatılmış bir cam Pasteur pipeti kullanın. Durulama aşaması için embriyolar sallanmaz, sadece yerleşmesine izin verilir; Yıkama aşaması için, embriyolar belirtilen süre boyunca bir nutatör üzerinde sallanır ve daha sonra yerleşmesine izin verilir.
- Embriyolar metanolde saklanmadıysa, adım 2.2'ye geçin. Embriyolar metanolde saklandıysa, PBS-Tween ile iki kez durulayın ve ardından PBS-Tween ile iki kez 20 dakika yıkayın.
- Embriyoları 1 mL bloke edici solüsyonda 30-60 dakika yıkayın.
- Embriyoları antikor çözeltisi (Tablo 1) içinde seyreltilmiş primer antikorlarla oda sıcaklığında 2 saat veya tercihen gece boyunca 4 °C'de inkübe edin. Primer antikorları korumak için bu adımı mümkün olduğunca küçük bir hacimde (50-300 μL) gerçekleştirin; Bir nutatör üzerinde sallanmak kesinlikle gerekli değildir.
- Tipik bir immünofloresan deneyinde kullanılan primer antikor miktarını ExM için en az %50 artırın. Aşağıdaki birincil antikor konsantrasyonlarını kullanın: Anti-Par-3 kobay poliklonal21 için 1:200 ve anti-GFP tavşan poliklonal için 1:100.
- Birincil antikor solüsyonunu çıkarın (istenirse 4 °C'de tasarruf edin), PBS-Tween ile iki kez durulayın ve ardından PBS-Tween ile dört kez 15 dakika yıkayın.
- Embriyoları, bir nutatör üzerinde oda sıcaklığında 1 saat boyunca 300 μL'lik (antikor çözeltisi içinde seyreltilmiş) bir son hacimde floresan sekonder antikorlarla inkübe edin. Bu adımda floresan etiketli streptavidin eklenebilir. Bu adımdan itibaren, embriyoları mümkün olduğunda aşırı ve uzun süreli ışığa maruz kalmaktan koruyun, örneğin tüpleri opak bir kutu kapağıyla kapatarak veya örnekleri bir çekmecede tutarak.
- Aşağıdaki konsantrasyonları kullanın: Alexa Fluor 488 ile kaynaşmış anti-tavşan IgG keçi poliklonal için 1:500; Alexa Fluor 568 ile kaynaşmış anti-kobay IgG keçi poliklonal için 1:500; ve streptavidin-Alexa Fluor 488 için 1:1000.
- İkincil antikor çözeltisini çıkarın ve atın. Embriyoları PBS-Tween ile iki kez durulayın ve PBS-Tween ile dört kez 15 dakika yıkayın.
- Bu noktada, embriyolar karanlıkta 4 ° C'de saklanabilir, ancak örnekleri mümkün olduğunca çabuk (<24 saat) işleyebilir.
3. PDMS kuyularının hazırlanması
NOT: PDMS kuyuları 2 hafta öncesine kadar yapılabilir.
- Bir inkübatörü veya sıcak plakayı 55 °C'ye ayarlayın ve konik boruları 15 °C'ye döndürebilen bir santrifüj ayarlayın.
- PDMS çözeltisini hazırlamak için (Tablo 1), 50 mL'lik bir konik tüpü bir ölçek üzerinde ikincil bir kaba yerleştirin ve bir şırınga kullanarak tüpe 10 g silikon elastomer baz ekleyin. Ardından, 1 g silikon elastomer kürleme maddesi ekleyin ve karıştırmak için tüpü birkaç kez ters çevirin.
- İkinci bir 50 mL konik tüpe uygun miktarda su ekleyerek bir denge tüpü oluşturun. PDMS çözeltisini 500 x g'da 15 °C'de 3 dakika santrifüjleyin ve ardından ~1 mm derinliğe kadar 10 cm'lik bir Petri kabına dökün. Gerekirse, bir hava hortumu ile çözeltiye hafifçe üfleyerek kabarcıkları çıkarın. PDMS çözeltisinin gece boyunca 55 °C'de katılaşmasına izin verin.
- PDMS levhası bir neşter kullanılarak katılaştıktan sonra, 22 mm x 22 mm'lik bir lamelden biraz daha küçük olan kare alanları puanlayın. Her karenin içinde, ~8 mm genişliğinde bir kare kuyusu çizin ve çıkarın.
- Her kare PDMS'yi 22 mm x 22 mm'lik bir lamel üzerine iyice aktarın ve sıkıca yapıştırın (Şekil 2D). Altı veya daha fazla lamel hazırlamak, görüntü için iyi sayıda genişlemiş embriyo vermelidir.
4. Embriyoların lamellere yapıştırılması
- Her bir oyuğun (~50 μL) içindeki lamel yüzeyini kaplamaya yetecek kadar% 0.1 poli-L-lizin uygulayın ve havada kuruması için 55 ° C'lik bir inkübatöre yerleştirin. Yapışkanlığı artırmak için bu adımı tekrarlayın.
- Tween deterjanını çıkarmak için embriyoları 1x PBS'de bir kez kısaca durulayın ve ardından >10 embriyoyu poli-L-lizin kaplı oyukların her birine aktarın.
- Embriyoların kuyucukların dibine yerleşmesine izin verin. Bir Pasteur pipeti kullanarak yapışan embriyolardan fazla sıvıyı çıkarın. Hemen bir sonraki adıma geçin.
5. Aktivasyon ve jelleşme
NOT: Aktivasyon, numune proteinlerini ve antikorları hidrojele bağlanabilmeleri için değiştirecek olan embriyolara MA-NHS'nin eklenmesini ifade eder. Jelleşme, her bir oyuktaki embriyoların içinde ve çevresinde bir hidrojel oluşumunu ifade eder. Jelleşme sırasında, embriyolara bir monomer çözeltisi nüfuz edilir ve daha sonra hidrojeli oluşturmak için bir jelleşme çözeltisi ile muamele edilir.
- Kuyucukları aktivasyon solüsyonu ile doldurarak embriyoları oda sıcaklığında 1 saat aktive edin (1x PBS'de taze seyreltilmiş 1 mM MA-NHS; Tablo 1). Bu çözümü 1 saat boyunca yaklaşık olarak her 10 dakikada bir değiştirin.
- Embriyoları 1x PBS ile üç kez durulayın. Embriyoları monomer solüsyonunda (Tablo 1) 4 ° C'de 45 dakika inkübe edin.
- Embriyolar monomer solüsyonunda otururken jelleşme solüsyonunu hazırlayın (Tablo 1). ~ 2 mL jelasyon çözeltisinin hazırlanması, PDMS kuyucuklarını 10 cm'lik bir Petri kabının tamamından kaplamak için yeterlidir. Polimerizasyonu başlatacağı ve jelleşmeye başlayacağı için APS'yi en son eklediğinizden emin olun.
- Katalitik oksidanı tozdan taze olarak seyreltin (örn., su içinde %1 TEMPO w/v). 1.960 μL monomer çözeltisini 30 μL %10 TEMED ve 10 μL %1 TEMPO ile birleştirin.
- Tüm jelleşme çözeltisi partisinin bir kerede polimerize olmasını önlemek için, küçük partiler halinde çalışın. Jelleşme solüsyonunu (APS olmadan) bir PCR şeridinin sekiz tüpü arasında 125 μL'lik alikotlara bölün.
- Embriyoları bozmamaya dikkat ederken bir vakum kullanarak monomer çözeltisini üç PDMS kuyusundan çıkarın. Polimerizasyonu başlatmak için jelleşme çözeltisi içeren PCR tüplerinden birine 5 μL APS ekleyin. Polimerize jelleşme çözeltisini kuyucuklar arasında hızla dağıtın (kuyucuk başına ~40 μL). Tüm kuyular ve embriyolar kaplanana kadar bunu tekrarlayın.
- Numunelerin 37 °C'de 1,5-2,5 saat jelleşmesine izin verin. Polimerizasyonu izlemek için hidrojelleri sık sık çalkalayın. Katılaşmış hidrojeller kıpırdamaz. Daha kalın hidrojellerin polimerizasyonu tamamlaması ve katılaşması daha uzun sürecektir.
6. Sindirim ve genişleme
NOT: Daha kalın ve daha büyük jellerin genişlemesi daha uzun sürer ve jellerin merkezinin tamamen genişlemesi birkaç saat sürebilir; Bu, jelin kenarları kesilerek hızlandırılabilir. Jeller genişledikçe, kırılma indisleri suyunkiyle neredeyse aynı olacak ve görülmeleri çok zor hale gelecektir.
- Jelleşme tamamlandıktan sonra, hidrojelleri rahatsız etmemeye çalışırken PDMS kuyucuklarını lamelden soyun. İsterseniz fazla hidrojel malzemeyi kesin.
- Hidrojelleri (hala lamellere bağlı) ayrı ayrı altı oyuklu bir plakanın kuyularına aktarın (Şekil 2E). Hidrojellerin sindirim sırasında hafifçe genişleyebileceğini unutmayın.
- Jelleri 37 °C'de 1 saat boyunca sindirim tamponu (Tablo 1) ile tamamen kapatın. Genel olarak, jelleri 6 oyuklu bir plakada kaplamak için 30 mL sindirim tamponu yeterlidir.
- Sindirimden sonra, her bir hidrojeli ayrı ayrı lamelden kaydırarak 6 cm'lik bir Petri kabına aktarın. Jeli yerinden çıkarmak için ikinci bir lamel kullanmak gerekebilir. Jeli genişletmek için her Petri kabını deiyonize suyla doldurun. Jeller tamamen genleşene kadar suyu 1-2 saat boyunca üç ila dört kez değiştirin (genişlikte yaklaşık dört kat artış bekleyin).
7. Montaj ve görüntüleme
NOT: Genleşmiş hidrojeller neredeyse tamamen sudan oluşur, bu da onları neredeyse şeffaf ve son derece kırılgan hale getirir. Jeller, onları hareket ettirmek ve almak için uzun lameller kullanılarak manipüle edilebilir. Bir seferde yalnızca bir veya iki jeli monte edin ve görüntüleyin, çünkü jeller yavaş yavaş suyu serbest bırakacak ve lamel etrafında kaymaya başlayacaktır.
- Bir Pasteur pipeti kullanarak, kullanıldığında hareket eden jelleri en aza indirmek için Petri kabından mümkün olduğunca fazla suyu alın.
- Her genişletilmiş jeli, alt yüzeydeki embriyolarla birlikte, görüntüleme için büyük bir lamel (örneğin, 24 mm x 40 mm) üzerine manevra yapın.
- Her bir lamel jel ile ters çevrilmiş bir lazer taramalı konfokal mikroskobun objektifi üzerine monte edin. Düşük büyütmeli (5x veya 10x) veya orta büyütmeli (20x) hava hedefli mikroskopta epifloresan veya parlak alan mikroskobu modlarını kullanarak uygun şekilde hazırlanmış ve yönlendirilmiş numuneleri bulun.
- Yüksek çözünürlükte görüntü almak için yüksek büyütmeli (60x, 63x veya 100x) yağa veya suya daldırma objektifine geçin. Embriyoların yüzeyi, görüntülenebilmesi için objektifin odaklama aralığı içinde olmalıdır (63x objektif için lamelden <300 μm).
- Mikroskopta lazer taramalı konfokal modu kullanarak numunelerden veri toplayın. İyi dinamik aralığa sahip doygun olmayan görüntüleri topladığınızdan emin olun ve örnek23 hakkında mümkün olan en yüksek bilgiyi yakalamak için görüntü başına uygun sayıda piksel kullanın.

Şekil 2: Manuel devitellinizasyon ve hidrojellerle çalışma . (A) Bir agar/meyve suyu tabağından bir agar levhasının kesilmesi. (B) 6 cm'lik bir Petri kabının kapağının içine çift taraflı bant yerleştirmek. (C) Embriyoların bantlanmış kapağa yapıştırılması. (D) 22 mm x 22 mm'lik bir lamel üzerine iyi yapıştırılmış kare bir PDMS levhası. (E) 6 oyuklu bir plakanın içinde bir PDMS kuyusu bulunan lamel Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Sonuçlar
Tam montajlı Drosophila embriyolarında ExM'nin genel etkinliğini karakterize etmek için, baştan kuyruğa eksen boyunca embriyo uzunluğu, genişlemiş kontrol embriyolarında genişlemiş embriyolara karşı ölçülmüştür (Şekil 3A-C). Genişletilmemiş kontrol embriyoları, görüntülemeden önce katılaşmış bir montaj ortamı kullanılarak monte edilmeleri dışında, genişletilmiş embriyolarla aynı fiksasyon koşullarına ve immünofloresan etiketleme adımlarına tabi tutuldu. Bireysel genişlememiş embriyolar, 10x objektif kullanıldığında görüş alanının yaklaşık yarısını kapladı (Şekil 3A). Buna karşılık, genişlemiş embriyolar, aynı 10x objektifi kullanırken yaklaşık iki tam görüş alanını kapsıyordu (Şekil 3B). Genişleme derecesinin hem deneyler içinde hem de deneyler arasında nasıl değiştiğini değerlendirmek için, aynı ExM protokolü üç ayrı durumda gerçekleştirildi ve embriyo uzunluğu her bir deneyde üç farklı jelde ölçüldü. Genişlemiş kontrol embriyolarının ortalama baş-kuyruk uzunluğu 398.8 μm idi (standart sapma [SD] = 22.93 μm; n = 74; Şekil 3C). Deney 1, deney 2 ve deney 3 için ortalama embriyo uzunlukları sırasıyla 1,596 μm (SD = 159.9 μm; n = 57), 1,868 μm (SD = 150.5 μm; n = 51) ve 1,954 μm (SD = 120.3 μm; n = 44) idi ve sırasıyla 4.0 kat, 4.7 kat ve 4.9 kat genişleme faktörlerini temsil ediyordu (Şekil 3C). Jeller arasındaki deney içi varyasyon, yaklaşık% 20 olan deneyler arası varyasyondan çok daha az belirgindi. ExM'nin hücre ve embriyo morfolojisi üzerindeki etkilerini değerlendirmek için, apikal hücre zarlarını etiketlemek için adherens bağlantı bileşeni Par-3'e (Bazuka)21 karşı bir antikor kullanıldı ve evre 11 Drosophila embriyolarının gelişmekte olan ağız segmentlerini görüntüledik - karmaşık parçalı bir yapıya sahip bir aşama (Şekil 3D-F). Kontrol örneğinde, maksiller segmentteki hücrelerin ortalama genişliği 4.76 μm idi (SD = 1.053 μm, n = 25; Şekil 3D, F). Aynı 40x objektif ve yakınlaştırma faktörü (1x) kullanılarak görüntülenen genişletilmiş örneklerde, maksiller segmentteki hücrelerin ortalama genişliği 19.10 μm'dir (SD = 3.966 μm, n = 18; Şekil 3E,F), 4.0 katlık bir genişlemeyi temsil eder. Bu nedenle, önceki raporlarla11 tutarlı olarak, tam monteli Drosophila embriyolarını, numune yırtılması veya hücresel veya doku morfolojisinde bariz bozulmalar olmadan ExM kullanarak doğrusal boyutlarda yaklaşık dört kat genişletebildik.
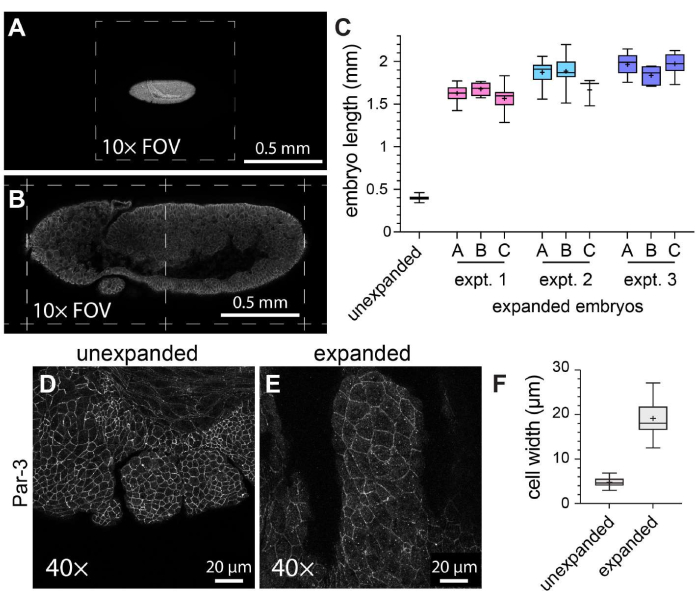
Şekil 3: Drosophila embriyolarının dört kat genişlemesi. (A) Genişletilmemiş ve (B) genişletilmiş Drosophila embriyoları, 1x yakınlaştırmada 10x objektif (0.3 NA) kullanılarak görüntülendi. Tek tek görüş alanları (FOV) kesikli çizgilerle gösterilir. Embriyolar, miyozin hafif zincirinin GFP etiketli bir versiyonunu eksprese etti ve bir anti-GFP antikoru ile boyandı. (C) Embriyo uzunluğunun (baştan kuyruğa eksen boyunca) deney başına üç hidrojelde ve genişletilmemiş kontrollerle karşılaştırıldığında üç ayrı ExM deneyinden ölçülmesi. (D,E) (D) genişletilmemiş ve (E) genişletilmiş evre 11 Drosophila embriyolarından maksiller segmentler, 1x yakınlaştırmada 40x objektif (1.3 NA) kullanılarak görüntülendi. Hücre anahatları (adherens kavşakları) anti Par-3/Bazuka antikoru (beyaz) ile tespit edildi. (F) (D) ve (E)'deki eşdeğer hücre gruplarından hücre genişliğinin (uzun eksen) ölçülmesi. (C) ve (F)'deki kutu grafikleri 25., 50. ve 75. yüzdebirlik aralıkları gösterir; bıyıklar minimum ve maksimum değerleri gösterir; "+" sembolleri ortalamayı gösterir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
ExM'nin tipik kırınım sınırının altındaki hücre altı ayrıntıları çözmek için kullanılabileceğini göstermek için, aktomiyosin hücre iskeleti, yakınsak genişleme geçiren genişlemiş embriyolara karşı genişletilmemiş kontrolde görüntülendi (evre 7). Gastrulasyon ve yakınsak ekstansiyonun doku yeniden şekillenme olayları, motor protein miyozin II24'ün lokalizasyonundaki değişikliklerle büyük ölçüde kontrol edilir. Bununla birlikte, erken Drosophila ektoderminin yoğun bir şekilde paketlenmiş kolumnar epiteliminde, 158x büyütmede (2.5x optik yakınlaştırma ile 63x objektif) görüntülendiğinde bile miyozin II lokalizasyon modelinin birçok ince ayrıntısını gözlemlemek zordur - lazer taramalı konfokal mikroskop için tipik bir maksimum çözünürlük gücü. Örneğin, miyozin II kortikal bir protein olduğu için (doğrudan plazma zarının altında bulunur), hücre-hücre temaslarının her iki tarafında bulunan miyozin II25 havuzları evre 7 embriyolarında çözülemedi ve komşu hücrelerin buluştuğu tek bir çizgi olarak ortaya çıktılar (Şekil 4A). Buna karşılık, genişletilmiş evre 7 embriyolarında, bitişik hücrelerdeki kortikal protein havuzlarını temsil eden hücre-hücre bağlantılarında paralel miyozin II çizgileri gözlenebilir (Şekil 4B). Genişletilmiş örneklerde paralel miyozin II çizgileri arasındaki mesafe 892.7 nm idi (SD = 0.171 nm, n = 12); dörde bölündüğünde, bu, genişlememiş embriyolarda bitişik hücrelerdeki miyozin çizgileri arasında ~ 220 nm'lik tahmini bir mesafe verir, bu gerçekten de Alexa 488 ile tespit edilen bir sinyal için kırınım sınırının hemen altındadır (~ 520 nm / 2 = 260 nm'lik tepe emisyonu).
Ek olarak, ExM'nin gastrulasyon yapan Drosophila embriyolarının yoğun paketlenmiş hücrelerinde mitokondriyal ağ mimarisini çözmek için kullanılıp kullanılamayacağını da test ettik (evre 6). Mitokondriyal fonksiyon, ağ yapısıyla yakından bağlantılıdır (yani, kaynaşmış ve parçalanmış organeller), ancak mitokondriyal ağ organizasyonunun ayrıntılarının, düz ve / veya ince olmayan hücre tiplerinde geleneksel konfokal mikroskopi kullanılarak görselleştirilmesi zordur. Mitokondri doğal olarak biyotinile moleküller açısından zengindir ve bu nedenle mitokondri, floresan etiketli streptavidin26 kullanılarak erken Drosophila embriyosunda etiketlenebilir. Streptavidin Alexa 488 ile etiketlenmiş genişletilmemiş evre 6 embriyolarında, sinyal genellikle örtüşen ve çözülmesi zor olan sitoplazmik punkta olarak ortaya çıktı (Şekil 4C). Buna karşılık, genişletilmiş evre 6 embriyolarında, mitokondriyal ağın çok daha ince detayları görülebiliyordu ve punkta daha kolay çözülebilirdi (Şekil 4D)26,27. Bu sonuçlar, ExM'nin geleneksel olarak mitokondriyal analiz için uygun olmayan hücre tiplerinde mitokondriyal ağ organizasyonunu incelemek için kullanılabileceğini göstermektedir.

Şekil 4: Genişleme mikroskobu ile ortaya çıkan aktomiyosin hücre iskeleti ve mitokondri detayları. Evre 7 (A) genişlememiş ve (B) genişlemiş embriyolarda 2.5x yakınlaştırmada 63x objektif (1.4 NA) ile görüntülenen nöroektoderm (germband) hücrelerinde (A, B) Miyozin II lokalizasyonu. Miyozin II, bir anti-GFP antikoru (kırmızı) ile tespit edilen miyozin II düzenleyici hafif zincirinin (sqh-GFP) transgenik GFP etiketli bir versiyonunu eksprese eden embriyolarda tespit edildi. Bitişik hücrelerde bulunan farklı kortikal miyozin havuzları, genişlemiş embriyoda (beyaz oklar) çözülebilir. (C,D) Nöroektoderm hücrelerindeki mitokondriyal ağlar, evre 6 genişlememiş (C) ve genişletilmiş (D) embriyolarda 2.5x yakınlaştırmada ×63 objektif (1.4 NA) ile görüntülendi. Mitokondri streptavidin-Alexa 488 (yeşil) ile tespit edildi ve hücre ana hatları bir anti-Par-3/Bazuka antikoru (macenta) ile tespit edildi. Deneyler lazer taramalı konfokal mikroskop ile yapıldı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tablo 1: Çözüm tarifleri. Bu protokolde kullanılan çözeltiler için kompozisyon görünüm sırasına göre. Aksi belirtilmedikçe tüm stoklar likittir. Kimyasallar, aksi belirtilmedikçe otoklavlanmış filtrelenmiş suda yeniden süspanse edildi veya seyreltildi. Bu Tabloyu indirmek için lütfen buraya tıklayın.
Tartışmalar
Manuel devitellinizasyon
Çoğu Drosophila embriyo fiksasyon protokolü, sabit embriyoları bir metanol ve heptan emülsiyonu içinde sallayarak vitellin zarının çıkarılmasını içerir, bu da zarların ozmotik rüptür yoluyla patlamasına neden olur26. Metanol bazlı devitellinizasyon (metanol patlatma) birçok uygulama için etkili ve uygun olsa da, manuel devitellinizasyon (elle soyma) bazı önemli avantajlar sunar. İlk olarak, elle soyma, kişinin devitellin yapmak ve toplamak için hassas bir şekilde hazırlanmış embriyoları seçmesine izin vererek, deneyin sonunda kullanılabilir bir oryantasyonda genişletilmiş embriyolar elde etme olasılığını büyük ölçüde artırır. Bu zenginleştirme, hızlı gelişimsel süreçlerin (örneğin, mezoderm istilası veya yakınsak uzantı) belirli yönlerini incelerken kritik öneme sahiptir, bunun için uygun şekilde evrelenmiş embriyolar, sıkı bir şekilde zamanlanmış bir toplama penceresinde bile tüm embriyoların yalnızca yüzde birkaçını temsil edebilir. Tabii ki, birçok uygulama için, zamanlanmış bir toplama penceresinden embriyoların daha geleneksel toplu metanol patlatılması yeterli olacaktır ve elle soyulması ekstra çabaya değmeyebilir. İkincisi, belirli birincil antikorların ve boyaların bağlanması, numunenin daha önce metanole maruz kalmasından olumsuz etkilenir. Bu nedenle, elle soyma, metanol patlatılmış örneklere kıyasla immünofloresan sinyal kalitesinde önemli artışlar sağlayabilir ve bu da onu Drosophila gelişim biyologları için yararlı bir genel teknik haline getirir.
Genişletilmiş tam montajlı Drosophila embriyolarında yüksek çözünürlüklü konfokal mikroskopi
Genişletilmiş numuneler üzerinde yüksek çözünürlüklü konfokal mikroskopi yapmak kavramsal olarak genişletilmemiş numunelerle aynı olsa da, ExM bazı teknik engeller getirmektedir. Özellikle, rastgele olan embriyo oryantasyonu, örneklem büyüklüğü arttıkça daha da önemli hale gelir, çünkü yüksek büyütmeli, yüksek NA objektifler, yalnızca lamel27'ye çok yakın olan örnek bölgelerden gelen ışığı odaklayabilir. Bu nedenle, genellikle sadece jel oluştuğunda lamel bitişiğinde sona eren embriyonun yüzeyindeki veya yakınındaki hücrelere odaklanmak mümkündür. Sonunda doğru oryantasyona sahip örneklerin bulunduğundan emin olmanın en iyi yolu, ExM protokolünü sıkı bir şekilde aşamalı sabit embriyo koleksiyonuyla (örneğin, elle soyularak) başlatmak ve her bir oyuğa birçok embriyo tohumlamaktır (>10). Embriyonun iç kısmındaki hücreleri görselleştirmek için, ışık tabakası mikroskobu28 gibi daha özel görüntüleme kurulumlarının kullanılması gerekebilir. Ek olarak, konfokal iğne deliğini birden fazla havadar üniteden daha büyük bir boyuta açarak görüntü kalitesinin iyileştirilebileceğini bulduk. Tabii ki, artan bir iğne deliği boyutu, maksimum çözünürlüğün azalması pahasına olacaktır, ancak pratikte, iğne deliği boyutundaki küçük artışlar bile sinyal yoğunluğunu önemli ölçüde artırabilir (veriler gösterilmemiştir). Gelecekteki çalışmalar, ExM örneklerinde iğne deliği boyutunu ve etkili çözünürlüğü sistematik olarak ele almalıdır.
Temel ExM'deki varyasyonlar
Burada açıklanan protokol, birçok uygulama için çalışması ve çoğu gelişim biyolojisi laboratuvarında uygulanması kolay olması gereken nispeten basit bir ExM örneğidir. Bununla birlikte, sinyal yoğunluğunu artırmak, daha da fazla genişleme derecesi elde etmek ve proteinlerin yanı sıra nükleik asit moleküllerini tespit etmek için kullanılabilecek ExM 4,5,7'nin temel konseptinde çok sayıda varyasyon vardır. Bu protokolde, embriyolar jelleşme ve genişlemeden önce antikorlarla inkübe edilir. Alternatif olarak, numuneler genişletildikten sonra antikorlarla tedavi edilebilir 6,30, bu da artan epitop erişilebilirliği ve genişleme adımları sırasında bağlı antikor kaybının azalması nedeniyle sinyal yoğunluğunu artırabilir. Ek olarak, hibridizasyon zincir reaksiyonu yöntemi30 kullanılarak genişletilmiş jellerde RNA'nın saptanmasına izin vermek için RNA moleküllerini hidrojele bağlamak için spesifik çapraz bağlayıcı molekülleri kullanılabilir. Son olarak, numuneler, daha da yüksek derecelerde artan çözünürlük elde etmek için yinelemeli genişleme mikroskobu (iExM)31, pan-ExM32 ve genişleme açığa çıkarma (ExR)31'de olduğu gibi birden fazla genişleme turuna tabi tutulabilir.
Açıklamalar
Yazarların beyan edecek herhangi bir çıkar çatışması yoktur.
Teşekkürler
Dr. Jennifer Zallen'e kobay anti-Par-3 primer antikoru sağladığı için teşekkür ederiz. Bu çalışma, Ulusal Sağlık Enstitüleri (NIH) üyelerinden biri olan Ulusal Genel Tıp Bilimleri Enstitüsü'nden (NIGMS) cömert fonlarla (1R15GM143729-01 ve 1P20GM139768-01 5743) ve konfokal mikroskobumuzun satın alınması için kısmi finansman sağlayan Arkansas Biosciences Enstitüsü'nden (ABI) desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| acrylamide | Milipore Sigma | 1490-100ML | |
| ammonium persulfate | VWR | BDH9214-500G | |
| anti-GFP rabbit polyclonal antibody | Torrey Pines BioLabs | TP-401 | |
| anti-guinea pig IgG goat polyclonal antibody, Alexa Fluor 568 | Thermo Fisher Scientific | A-11075 | |
| anti-rabbit IgG goat polyclonal antibody, Alexa Fluor 488 | Thermo Fisher Scientific | A-11008 | |
| bisacrylamide | Research Products International | A11275 | |
| bovine serum albumin (30% solution) | Millipore Sigma | A7284 | |
| conical tubes, 50 mL | fisherscientific | 21008-940 | |
| coverlip glass, square 22 mm | VWR | 48366-227 | |
| coverslip glass, rectangular 40 mm x 24 mm | VWR | 48393-230 | |
| glass capillaries for pulling needles | World Precision Instruments | TW100F-4 | |
| glass microinjection needles (pre-pulled) | World Precision Instruments | TIP10LT | |
| guanidine HCl | VWR | 101970-606 | |
| heptane | VWR | EM-HX0078-1 | |
| latex pipet bulbs | VWR | 82024-554 | |
| methanol | VWR | BDH1135-4LP | |
| methylacylic acid N-hydroxysuccinimidyl ester | VWR | 730300-1G | |
| microfuge tube, 1.5 mL | VWR | 20170-038 | |
| multi-well plate, 6-well | Genesee | 25-100 | |
| paraformaldehyde (16%, EM-grade, methanol-free) | Electron Microscopy Sciences | 509804487 (Fisher) | |
| Pasteur pipet (2 mL, short tip) | VWR | 14673-010 | |
| PDMS kit (Sylgard 184 Kit, base and curing agent) | VWR | 102092-312 | |
| Petri plates | Genesee | 32-107 | |
| phosphate-buffered saline (10x solution) | VWR | 97063-660 | |
| Poly-L-lysine solution (0.1% solution) | VWR | P8920-1ooML | |
| Proteinase K | Thermo Fisher Scientific | E00491 | |
| scintillation vials (30 mL) | VWR | 66022-128 | |
| sodium acrylate | VWR | 101181-226 | |
| sodium azide (powder) | Millipore Sigma | 71289 | make a 1% w/v working stock; acute POISON at this concentration! |
| Streptavidin, Alexa Fluor 488 | Thermo Fisher Scientific | S32354 | |
| TAE (50x) | VWR | 97063-692 | |
| tape (double-sided, 1 inch wide) | Scotch 3M | 665 Scotch double sided 1inch/1296 inches Boxed | |
| TEMED | Thermo Fisher Scientific | PI17919 | |
| TEMPO | VWR | EM8.14681.0005 | catalytic oxidant |
| Tween-20 | VWR | 97063-872 | extremely viscous when pure; make a 10% working stock with water |
| Zeiss LSM 900 | Zeiss | Laser scanning microscope used without AiryScan |
Referanslar
- Klar, T. A., Jakobs, S., Dyba, M., Egner, A., Hell, S. W. Fluorescence microscopy with diffraction resolution barrier broken by stimulated emission. Proceedings of the National Academy of Sciences of the United States of America. 97 (15), 8206-8210 (2000).
- Rust, M. J., Bates, M., Zhuang, X. Sub-diffraction-limit imaging by stochastic optical reconstruction microscopy (STORM). Nature Methods. 3 (10), 793-796 (2006).
- Betzig, E. Imaging intracellular fluorescent proteins at nanometer resolution. Science. 313 (5793), 1642-1645 (2006).
- Wassie, A. T., Zhao, Y., Boyden, E. S. Expansion microscopy: principles and uses in biological research. Nature Methods. 16 (1), 33-41 (2019).
- Chen, F., Tillberg, P. W., Boyden, E. S. Optical imaging. Expansion microscopy. Science. 347 (6221), 543-548 (2015).
- Chen, F., et al. Nanoscale imaging of RNA with expansion microscopy. Nature Methods. 13 (8), 679-684 (2016).
- Tillberg, P. W., et al. Protein-retention expansion microscopy of cells and tissues labeled using standard fluorescent proteins and antibodies. Nature Biotechnology. 34 (9), 987-992 (2016).
- Chang, J. -. B. Iterative expansion microscopy. Nature Methods. 14 (6), 593-599 (2017).
- Cahoon, C. K., et al. Superresolution expansion microscopy reveals the three-dimensional organization of the Drosophila synaptonemal complex. Proceedings of the National Academy of Sciences of the United States of America. 114 (33), 6857-6866 (2017).
- Mosca, T. J., Luginbuhl, D. J., Wang, I. E., Luo, L. Presynaptic LRP4 promotes synapse number and function of excitatory CNS neurons. eLife. 6, e27347 (2017).
- Jiang, N., et al. Superresolution imaging of Drosophila tissues using expansion microscopy. Molecular Biology of the Cell. 29 (12), 1413-1421 (2018).
- Yu, C. -. C. J., et al. Expansion microscopy of C. elegans. eLife. 9, e46249 (2020).
- Freifeld, L., et al. Expansion microscopy of zebrafish for neuroscience and developmental biology studies. Proceedings of the National Academy of Sciences of the United States of America. 114 (50), E10799-E10808 (2017).
- Tanaka, T., et al. Phase transitions in ionic gels. Physical Review Letters. 45 (20), 1636-1639 (1980).
- Hausen, P., Dreyer, C. The use of polyacrylamide as an embedding medium for immunohistochemical studies of embryonic tissues. Stain Technology. 56 (5), 287-293 (1981).
- Campos-Ortega, J. A., Hartenstein, V. . The Embryonic Development of Drosophila melanogaster. , (2013).
- Chozinski, T. J., et al. Expansion microscopy with conventional antibodies and fluorescent proteins. Nature Methods. 13 (6), 485-488 (2016).
- Miller, D. F. B., Holtzman, S. L., Kaufman, T. C. Customized microinjection glass capillary needles for P-element transformations in Drosophila melanogaster. BioTechniques. 33 (2), 366-367 (2002).
- Rothwell, W. F., Sullivan, W. Drosophila embryo dechorionation. CSH Protocols. 2007, (2007).
- Cold Spring Harbor Protocols. . Drosophila apple juice-agar plates. , (2011).
- de Matos Simões, S., et al. Rho-kinase directs bazooka/Par-3 planar polarity during drosophila axis elongation. Developmental Cell. 19 (3), 377-388 (2010).
- Gambarotto, D., et al. Imaging cellular ultrastructures using expansion microscopy (U-ExM). Nature Methods. 16 (1), 71-74 (2019).
- Paré, A. C., Zallen, J. A. Cellular, molecular, and biophysical control of epithelial cell intercalation. Current Topics in Developmental Biology. 136, 167-193 (2020).
- Royou, A., Field, C., Sisson, J. C., Sullivan, W., Karess, R. Reassessing the role and dynamics of nonmuscle myosin II during furrow formation in early Drosophila embryos. Molecular Biology of the Cell. 15 (2), 838-850 (2004).
- Chowdhary, S., Tomer, D., Dubal, D., Sambre, D., Rikhy, R. Analysis of mitochondrial organization and function in the Drosophila blastoderm embryo. Scientific Reports. 7 (1), 5502 (2017).
- Chowdhary, S., Madan, S., Tomer, D., Mavrakis, M., Rikhy, R. Mitochondrial morphology and activity regulate furrow ingression and contractile ring dynamics in Drosophila cellularization. Molecular Biology of the Cell. 31 (21), 2331-2347 (2020).
- Stelzer, E. H. K., et al. Light sheet fluorescence microscopy. Nature Reviews Methods Primers. 1, 73 (2021).
- Ku, T., et al. Multiplexed and scalable super-resolution imaging of three-dimensional protein localization in size-adjustable tissues. Nature Biotechnology. 34 (9), 973-981 (2016).
- Wen, G., et al. A Universal labeling strategy for nucleic acids in expansion microscopy. Journal of the American Chemical Society. 143 (34), 13782-13789 (2021).
- M'Saad, O., Bewersdorf, J. Light microscopy of proteins in their ultrastructural context. Nature Communications. 11 (1), 3850 (2020).
- Sarkar, D. Expansion revealing: Decrowding proteins to unmask invisible brain nanostructures. bioRxiv. , (2020).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır