Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Kollajenlerin yüzey immobilizasyonu ve kollajen bağlama deneyleri için optimize edilmiş yöntemler
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Bu çalışma, tip I ve III kollajeni mikroplakalar üzerine tekrarlanabilir bir şekilde hareketsiz hale getirmek ve ölçmek için optimize edilmiş bir protokol sunar, ardından zamanla çözülen bir floresan yöntemi kullanarak kollajen-bileşik etkileşimlerini incelemek için geliştirilmiş bir in vitro bağlanma test protokolü sunar. Daha sonra adım adım veri analizi ve veri yorumlama sağlanır.
Özet
Fibrozis, çeşitli dokularda yaralanma veya hasara onarıcı bir yanıt olarak ortaya çıkar. Bununla birlikte, aşırı ise, fibroz, yüksek morbidite ve mortalite ile ilişkili doku skarlaşmasına ve organ yetmezliğine yol açabilir. Kollajen, fibrozun önemli bir itici gücüdür ve tip I ve tip III kollajen, birçok fibrotik hastalıkta yer alan birincil tiplerdir. Diğer proteinleri (örneğin, elastin, albümin, fibronektin, vb.) immobilize etmek için kullanılan geleneksel protokollerin aksine, stabil kaplamalar üretmek için farklı kollajen türlerini tekrarlanabilir şekilde immobilize etmek için kapsamlı protokoller kolayca mevcut değildir. Kollajeni immobilize etmek şaşırtıcı derecede zordur çünkü çoklu deneysel koşullar, kollajen tipi, pH, sıcaklık ve kullanılan mikroplaka tipi dahil olmak üzere immobilizasyonun verimliliğini etkileyebilir. Burada, stabil ve tekrarlanabilir jeller/filmler ile sonuçlanan tip I ve III kollajenleri tekrarlanabilir şekilde hareketsiz hale getirmek ve miktarını belirlemek için ayrıntılı bir protokol sağlanmaktadır. Ayrıca, bu çalışma, kollajenler ve aday kollajen bağlayıcı bileşikler (örneğin, öropyum [Eu(III)] taşıyan bir metal şelata konjuge edilmiş bir peptit) arasındaki etkileşimleri araştırmak için in vitro zamana bağlı floresan bağlama çalışmalarının nasıl gerçekleştirileceğini, analiz edileceğini ve yorumlanacağını göstermektedir. Böyle bir yaklaşım, hedefli görüntüleme probları geliştirmek için moleküler görüntüleme alanı, ilaç geliştirme, hücre toksisitesi çalışmaları, hücre proliferasyon çalışmaları ve immünolojik testler dahil olmak üzere çeşitli biyomedikal uygulamalara evrensel olarak uygulanabilir.
Giriş
Doku yaralanmasını takiben doğal yara iyileşme sürecinin bir parçası olarak fibröz bağ dokusunun birikmesi fibroz olarak bilinir. Bununla birlikte, fibröz doku birikimi sonlandırılmazsa ve doku onarımı için gerekenin ötesinde devam ederse, fibroz aşırıhale gelir 1,2. Aşırı fibroz, organ fizyolojisini ve fonksiyonunu bozar ve organ hasarına ve potansiyel olarak organ yetmezliğine yol açabilir 3,4,5. Fibrozisin iki ana itici gücü, hücre dışı matriks (ECM) proteinleri, kollajen tip I ve tipIII 6'dır. Kolajen, insan vücudunun toplam protein içeriğinin yaklaşık üçte birini oluşturan çeşitli organlarda bulunan yapısal bir proteindir1. İnsan genom dizilimi ile tanımlanan 28 farklı kollajen türü vardır ve en bol olanı fibriller kollajenlerdir7. Birincil fibriler kollajen, ECM'ye gerilme mukavemeti ve deformasyona karşı direnç sağlayan tip I kollajendir8. Tip III kollajen, elastikiyet sağlayan ve tip I kollajen ile kolokalize olan yapısal bir bileşendir. Embriyogenez sırasında eksprese edilir ve doğal olarak yetişkin derisinde, kaslarında ve kan damarlarında küçük miktarlarda bulunur9.
İn vivo kollajen sentezi, mRNA'nın çekirdekte kopyalandığı hücre içi bir süreçle başlar ve daha sonra çevrildiği sitoplazmaya hareket eder. Translasyondan sonra, oluşan zincir, pro-kollajenin (kollajenin öncüsü) oluştuğu endoplazmik retikulumda translasyon sonrası modifikasyona uğrar. Pro-kollajen daha sonra hücre dışı boşluğa atılmadan önce son modifikasyon için Golgi aygıtınagider 10. Proteolitik bölünme yoluyla, pro-kollajen tropokollajen'e dönüştürülür. Bu daha sonra ya lizil oksidaz (LOX) enzimi tarafından katalize edilen enzimatik aracılı bir çapraz bağlama yolu yoluyla ya da Maillard reaksiyonu11'i içeren enzimatik aracılı olmayan bir çapraz bağlama yolu yoluyla çapraz bağlanır. Kollajeni hareketsiz hale getirmek için in vitro protokoller esas olarak kollajenin kendi kendine toplanma yeteneğine dayanır. Kollajen, büyük ölçüde tek tek kollajen fibrillerinin çapraz bağlanma derecesine bağlı olançözünürlüğüne bağlı olarak dokulardan ekstrakte edilir 7. Fibriller kollajen asetik asit içinde çözülür ve pH ve sıcaklık ayarlandığında fibriller yeniden oluşabilir12. İn vitro, kollajenin fibrillogenezi iki aşamalı bir süreç olarak görülebilir7. İlk aşama, kollajen liflerinin üçlü sarmal bir yapı oluşturacak şekilde yeniden düzenlenmeden önce dimerler ve trimer fibriller oluşturduğu çekirdeklenme aşamasıdır. İkinci aşama, fibrillerin yanal olarak büyümeye başladığı ve genellikle bulanıklık7'deki değişikliklerle gözlenen karakteristik D-bandı oluşumu ile sonuçlanan büyüme aşamasıdır. Atomik kuvvet mikroskobu (AFM) çalışmaları da tip I ve tip III kollajenin farklı özelliklere sahip olduğunu ortaya koymuştur (Tablo 1)13.
Kollajen ve diğer bileşikler arasındaki bağlanma etkileşimlerini incelemek için, kollajenin mikroplakaların kuyucuklarına tekrarlanabilir bir şekilde hareketsiz hale getirilmesi gerekir. Çözünür kollajeni immobilize etmek için çeşitli protokoller vardır 14,15,16. Kollajen ile önceden kaplanmış ticari olarak temin edilebilen mikroplakalar tipik olarak hücre kültürü için kullanılır. Bununla birlikte, önceden kaplanmış mikroplakalar, oyukların üzerine kaplanmış çok ince bir bilinmeyen miktarda kollajen tabakasına sahiptir, bu da onları in vitro bağlanma testleri için uygun hale getirmez. Kollajeni plaka kuyucuklarına hareketsiz hale getirirken çeşitli zorluklar vardır. En önemli zorluklardan biri, uygun bir mikroplaka tipi seçmektir, çünkü farklı kollajen türleri (örneğin, tip I ve III) farklı kimyasal özelliklere sahiptir ve bu nedenle mikroplakanın malzemesine bağlı olarak daha kararlı ve etkili bir şekilde hareketsiz hale gelir. Fibrilogenez süreci sıcaklık, pH, kollajen stok konsantrasyonu ve tamponun7 iyonik konsantrasyonu dahil olmak üzere birçok faktöre bağlı olduğundan, diğer bir zorluk, immobilizasyon protokolünün deneysel koşullarıdır.
Kollajen (hedef) ve diğer bileşikler (yani, bir hedefleme peptidi) arasındaki etkileşimleri incelemek için, ayrışma sabitini (KD) ölçerek bileşiğin hedefe doğru özgüllüğünü ve seçiciliğini araştırmak için sağlam bir tarama testi geliştirmek de gereklidir. Bir protein (kollajen) ve bir ligand arasında bir bimoleküler kompleksin oluşum dengesinin konumu, büyüklüğü bağlanma afinitesi ile orantılı olan ilişki sabiti Ka cinsinden ifade edilir. Bununla birlikte, en yaygın olarak, biyokimyacılar, Kd = 1/Ka (Kd ve Ka'nın tersidir) olarak tanımlanan bimoleküler kompleksin denge ayrışma sabiti Kd cinsinden afinite ilişkilerini ifade ederler. Kd değeri ne kadar düşükse, protein ve ligand arasındaki bağlanma kuvveti o kadar güçlü olur. Aynı protein için farklı ligandların bağlanma afinitesinikarşılaştırmak için KD kullanmanın avantajı (ve bunun tersi), bir bimoleküler kompleks için Kd birimlerinin mol/L (yani konsantrasyon birimi) olması gerçeğiyle bağlantılıdır. Çoğu deneysel koşul altında, KD değeri,denge 17,18'de hedef üzerindeki mevcut bağlanma bölgelerinin% 50 doygunluğuna yol açan ligand konsantrasyonuna karşılık gelir. Ayrışma sabiti tipik olarak, ligand konsantrasyonunun bir fonksiyonu olarak, işgal edilen bağlanma bölgeleri ile toplam mevcut bağlanma bölgeleri arasındaki oran olarak tanımlanan reseptör fraksiyonel doluluğunun (FO) analiz edilmesiyle ekstrakte edilir. Bu, bağlı ligand miktarını ayırt edebilen ve ölçebilen analitik bir tahlilin mevcut olması koşuluyla yapılabilir.
İn vitro ligand bağlanma deneyleri, optik fotometri, radyoligand yöntemleri, endüktif olarak eşleştirilmiş plazma kütle spektrometresi (ICP-MS) ve yüzey plazmon rezonansı (SPR) dahil olmak üzere çeşitli biyoanalitik yöntemler kullanılarak gerçekleştirilebilir. Fotometrik yöntemler arasında, floresan emisyonuna dayalı olanlar, duyarlılığı artırmak ve testin tespit sınırını iyileştirmek için tipik olarak ligandların veya proteinlerin floroforlarla etiketlenmesini gerektirir. Eu(III) gibi belirli lantanit(III) iyonlarının şelatları, büyük Stokes kaymalarına, dar emisyon bantlarına (iyi bir sinyal-gürültü oranı sağlar), sınırlı fotoağartmaya ve uzun emisyon ömürlerine sahip oldukları için floroforlar kadar çekicidir. Daha da önemlisi, ikinci özellik, arka plan otofloresansını19 ortadan kaldırmak için Eu(III) floroforlarından zamana bağlı floresan (TRF) kullanımını sağlar. Eu (III) bazlı TRF testinin ayrışma ile güçlendirilmiş lantanit floresan immünoassay (DELFIA) versiyonunda, ışıldayan olmayan bir Eu (III) -şelat ile işaretlenmiş ligandlar, reseptör mikroplakalar üzerine hareketsiz hale getirilerek inkübe edilir. Etiketli ligand/reseptör kompleksi, bağlanmamış liganddan ayrılır ve Eu(III) floresansı, Eu(III) kompleksinin asidik bir pH'ta ayrışmasıyla aktive edilir, ardından misel gömülü, yüksek derecede floresan bir Eu(III) kompleksi20 oluşturmak için floresan arttırıcı bir şelatör ile yeniden kompleksleştirme yapılır.
Dekompleksasyon adımı, hızlı dekompleksasyon kinetiği gösteren dietilentriamin pentaasetat (DTPA) gibi şelatörlerle makul bir şekilde elde edilebilir. Bununla birlikte, DOTA (1,4,7,10-tetraazasiklododekan1,4,7,10-tetraasetik asit) ve monoamid türevleri (DO3AAm) gibi belirli makrosiklik şelatörlerle Eu(III) kompleksleri, yüksek termodinamik stabilite ve çok yüksek kinetik inertlik gösterir. Bu durumda, Eu(III) tabanlı TRF21'in yeterli ve tekrarlanabilir aktivasyonunu elde etmek için dekompleksasyon adımları doğru bir şekilde optimize edilmelidir. Lantanit (Ln(III))-DOTA ve Ln(III)-DO3AAm komplekslerinin, manyetik rezonans görüntüleme (MRI) teknikleri ile in vivo moleküler görüntüleme için kontrast madde olarak en yaygın olarak kullanılanlar olduğunu belirtmekte fayda var22. Bu nedenle, Ln (III) tabanlı TRF testi, MRI moleküler problarının amaçlanan biyolojik hedefleri ile bağlanma afinitesini in vitro olarak incelemek için tercih edilen araçtır. Şu anda, tip I ve tip III kollajeni immobilize etmek için kapsamlı ve tekrarlanabilir protokoller ve in vitro bağlayıcı Eu (III) TRF deneylerini gerçekleştirmek için tekrarlanabilir bir boru hattı eksiktir. Bu sınırlamaların üstesinden gelmek için, in vitro bağlanma deneyleri için gerekli olan yeterli konsantrasyonda kollajen ile tip I ve tip III kollajeni kendi kendine birleştirmek ve hareketsiz hale getirmek ve sırasıyla stabil jeller ve filmler oluşturmak için tekrarlanabilir yöntemler geliştirilmiştir. Yüksek derecede inert Eu(III)-DO3Aam tabanlı komplekslerin Eu(III) TRF'si için optimize edilmiş bir protokol sunulmaktadır. Son olarak, immobilize tip I ve tip III kollajene doğru Eu (III) etiketli ligandlarınKD'sini ölçmek için optimize edilmiş bir in vitro mikroplaka Eu (III) TRF testi gösterilmiştir (Şekil 1).
Protokol
NOT: Bu çalışma için kullanılan tüm ürün bilgileri Malzeme Tablosunda sunulmuştur.
1. Kollajen immobilizasyonu
NOT: Çapraz floresanı önlemek için, bağlama tahlili sırasında kullanılan mikroplakadaki her bir oyuğun bitişik oyukların serbest olduğundan emin olun. Protokolün bu bölümünü buz üzerinde gerçekleştirin, çünkü kollajen yükselen sıcaklıklarda ve pH seviyelerinde kendi kendine toplanır. Bu prosedürü bir doku kültürü başlığında ve steril koşullar altında gerçekleştirin, çünkü mikroplakalar daha sonra bir doku kültürü (TC) inkübatöründe inkübe edilir.
- Tip I kollajenin 96 oyuklu mikroplakalar üzerinde immobilizasyonu (Şekil 2)
1. Gün- Buzlu bir silikon tepsi hazırlayın. Tip I kollajen içeren şişeyi, soğuk 10x fosfat tamponlu salini (PBS) ve mikroplakaları buzun üzerine yerleştirin ve her şeye% 70 etanol püskürtün. Malzemeyi TC kaputunun altına yerleştirin.
- Eşit hacimlerde tip I kollajen ve 10x PBS (pH 7.4) kullanarak kollajeni nötralize edin.
- Çözeltiyi birkaç kez ters çevirin ve kabarcık oluşmadığından emin olun.
- 100 μL nötralize kollajeni diğer her bir oyuğa ve mikroplakanın her bir sırasına ekleyin ve kollajeni kuruyana kadar buharlaştırmak için 37 ° C'de 18-20 saat inkübe edin.
2. Gün - Bağlanmamış kollajeni çıkarmak için mikroplakaları 100 μL 1x PBS, pH 7.4 ile iki kez yıkayın.
- Mikroplakaları, daha fazla bağlama deneyi için kullanmadan önce kuruması için 37 ° C'de 2 saat daha inkübatöre aktarın.
- Kollajen tip III'ün 96 oyuklu mikroplakalar üzerinde immobilizasyonu (Şekil 3)
1. Gün- Buzlu bir silikon tepsi hazırlayın. Tip III kollajen içeren şişeyi, soğuk 10x PBS'yi ve mikroplakaları buzun üzerine yerleştirin ve her şeye% 70 etanol püskürtün. Malzemeyi TC kaputunun altına yerleştirin.
- Eşit hacimlerde tip III kollajen ve 10x PBS (pH 7.4) kullanarak kollajeni nötralize edin.
- 70 μL nötralize edilmiş kollajeni mikroplakanın diğer tüm oyuklarına ve diğer her sırasına ekleyin ve kollajeni kuruyana kadar buharlaştırmak için mikroplakayı doku kültürü başlığının altına yerleştirerek 37 ° C'de 2 saat inkübe edin.
2. Gün - Bağlanmamış kollajeni çıkarmak için mikroplakaları 70 μL 1x PBS, pH 7.4 ile iki kez yıkayın.
- Mikroplakaları 37 ° C'de 1 saat boyunca inkübatöre aktarın ve ardından mikroplakaları tezgaha aktarın ve daha sonraki bağlama deneylerinde kullanmadan önce 1 saat kurumasını bekleyin.
2. İmmobilize kollajen jellerinin / filmlerinin stabilitesinin değerlendirilmesi
- PBS ile 1 saat inkübasyon
NOT: Bağlama deneyi sırasında, hareketsiz hale getirilmiş kollajeni ilgilenilen bileşik ile inkübe edin. Elde edilen kollajen jelinin veya filminin stabilitesini araştırmak önemlidir. Bunu yapmak için, üç koşulun stabilitesini ölçün: yıkama yok = inkübasyondan hemen sonra hareketsiz hale getirilmiş kollajeni ölçer; yıkama = plakayı 100 μL PBS ile iki kez yıkadıktan sonra hareketsiz hale getirilen kollajeni ölçer; ve 1 saat PBS taklidi ve yıkama = PBS ile 1 saat inkübe edildikten sonra hareketsiz hale getirilen kollajeni ölçer ve ardından PBS ile iki yıkama yapar. Aşağıda, PBS inkübasyon yöntemi açıklanmıştır.- Kollajen ile kaplanmış oyukların her birine 70 μL PBS (1x) ekleyin ve mikroplakayı oda sıcaklığında 1 saat inkübe edin.
- Bir pipet kullanarak her bir oyuktan fazla sıvıyı aspire edin ve aşağıda açıklanan protein miktar tayini testini gerçekleştirmeden önce PBS (1x) ile iki kez yıkayın.
- Bir bikinkoninik asit testi (BCA) kullanılarak hareketsizleştirilmiş kollajen miktarının ölçülmesi
NOT: Üreticinin talimatlarına uyarak Pierce BCA Protein Test Kitini (Malzeme Tablosu) kullanın. Bu test için ilgili kollajen standartlarını oluşturun. Kollajen I için konsantrasyon aralığı 0-3.000 μg/mL ve kollajen III için 0-750 μg/mL'dir. Toplamda, kollajen başına 11 standart yapın.- Üreticinin talimatlarını izleyerek ihtiyaç duyulan toplam çalışma reaktifi (WR) hacmini hazırlayın.
- Kollajen standartlarının her birinden 25 μL'yi mikroplaka kuyucuklarına (çift olarak) ekleyin. Bu çözümler standart eğriyi çizmek için kullanılır.
- Standartları içeren kuyucukların her birine ve bilinmeyen konsantrasyonlarda kollajen ile kaplanmış kuyucuklara 200 μL çalışma reaktif çözeltisi ekleyin.
- Mikroplakayı 30 saniye boyunca bir plaka çalkalayıcı üzerine yerleştirin. Mikroplakaları kapatın ve 37 °C'de 30 dakika inkübe edin.
- Mikroplakaları çıkarın ve oda sıcaklığında soğumaya bırakın. Bir plaka okuyucu kullanarak absorbansı 560 nm'de ölçün.
- A560'ı (AU) 11 standart çözeltinin konsantrasyonuna (μg/mL) karşı çizerek bir kalibrasyon eğrisi çizin ve kolajen miktarını hesaplamak için kalibrasyon eğrisini kullanın.
3. Evropiyum(III) TRF ligand bağlama deneyi (Şekil 1)
NOT: Kullanılan bileşik, Eu (III) -DO3AAm-CBP olarak adlandırılan tek bir Eu (III) -DO3AAm kompleksi ile etiketlenmiş bir aday kollajen bağlayıcı peptittir (CBP) (Şekil 4).
- Kollajen kaplı plakaların Eu(III)-DO3AAm-CBP bileşiği ile inkübasyonu
- 0.1-15 μM (0.1 μM, 0.5 μM, 1 μM, 3 μM, 5 μM, 7 μM, 10 μM ve 15 μM) arasında değişen konsantrasyonlarda Eu (III) -DO3AAm-CBP bileşiğinin çözeltilerini hazırlayın 1x PBS'de.
- Kollajen kaplı oyuklara (Plaka A) her bir bileşik konsantrasyonundan 75 μL ekleyin. Kollajene bağlanan bileşik miktarını hesaplamak için deneyi üç nüsha halinde gerçekleştirin.
- İkinci bir kaplanmamış plaka (Plaka B) kullanın ve bileşiğin plakaya spesifik olmayan bağlanmasını hesaplamak için boş kuyucuklara her bir bileşikten 75 μL ekleyin. Her konsantrasyon için üçlü kopya kullanın.
- Mikroplakaları oda sıcaklığında 1 saat inkübe edin.
- Bir pipet kullanarak, fazla çözeltiyi her bir oyuktan aspire edin ve atın ve fazla, bağlanmamış bileşiği çıkarmak için kuyucukları iki kez 1x PBS ile yıkayın. Bu adımı hem kollajen kaplı hem de kaplanmamış mikroplakaları kullanarak gerçekleştirin.
- Üçüncü bir kaplanmamış plakaya (Levha C), aynı Eu (III) -DO3AAm-CBP konsantrasyonları aralığından (çift olarak) 10 μL ekleyin. Bir kalibrasyon eğrisi yapmak için çözeltideki Eu(III)-DO3AAm-CBP'den gelen floresan okumasını kullanın.
NOT: Bu plakadaki solüsyonu yıkamayın veya aspire etmeyin.
- Evropiyum(III) ve zamana bağlı floresan (TRF) okumalarının asit ekstraksiyonu
NOT: Lütfen asidik çözelti (AS) ve tamponlama çözeltisi (BS) hacimlerinin hazırlanması ve kalibrasyonu ile ilgili ek bilgilere bakın. Bu çalışmada, optimal bir pH'ı tekrarlanabilir bir şekilde elde etmek için gereken AS ve BS hacimleri sırasıyla 54 μL ve 46 μL idi. Plaka A, plaka B ve plaka C üzerinde aşağıdaki işlemi gerçekleştirin.- Her oyuğa 54 μL asidik çözelti (AS) ekleyin ve plakayı 90 dakika boyunca 37 ° C'de inkübatöre yerleştirin ve buharlaşmayı önlemek için mikroplakaları folyo ile kaplayın. Tekrarlanabilir dekompleksasyon elde etmek için sıcaklık ve inkübasyon süresi dikkatli bir şekilde kontrol edilmelidir.
- Her kuyucuğa 46 μL tamponlama çözeltisi (BS) ekleyin ve plakayı 30 saniye boyunca hafifçe sallayın.
- 100 μL geliştirme solüsyonu (ES) ekleyin ve plakayı 30 saniye sallayın.
- Bir TRF plaka okuyucu kullanarak plakayı okumadan önce 30 dakika bekleyin. Tablo 2'de listelenen parametreleri kullanın.
4. Veri analizi
- Kuyucuklarda hareketsiz hale getirilen kollajen konsantrasyonunun miktarının belirlenmesi
- A560'ın (AU) kalibrasyon eğrisinin 11 standart çözeltinin konsantrasyonuna (μg/mL) karşı denklemini elde edin.
- Kollajen standartlarını içeren kuyucuklardan elde edilen absorbans okumalarını kullanın.
- Yinelenen kuyucuklardan elde edilen ortalama değerleri tablo haline getirin ve standart eğri denklemini elde etmek için bilinen protein (kollajen) konsantrasyonlarına (μg/mL) karşı ortalama absorbansı çizin.
- İmmobilize kollajenin kütlesini (μg) ve konsantrasyonunu (M) hesaplamak için absorbans değerlerini kullanın.
- İmmobilize kollajen içeren üç kuyucuktaki ortalama absorbans değerlerini hesaplayın ve standart sapmayı kaydedin.
- Kollajen kaplı oyuklardan ölçülen absorbansı konserasyona dönüştürmek için kollajen standart eğrisinden (adım 2.2.6) elde edilen standart eğri denklemini kullanın. Bundan yola çıkarak, deney kuyucukları içinde hareketsiz hale getirilen kollajen konsantrasyonunu μg/mL cinsinden hesaplayın.
- Adım 4.1.2.2'de (μg/mL) hesaplanan konsantrasyonu önce gram/litreye ve ardından kollajenin moleküler ağırlığına bağlı olarak molar (M) haline getirin.
- Son olarak, konsantrasyonu kuyuya eklenen kollajen hacmine bölerek her bir oyukta hareketsiz hale getirilen kollajen kütlesini hesaplayın (tip I kollajen için 100 μL ve tip III kollajen için 70 μL).
- A560'ın (AU) kalibrasyon eğrisinin 11 standart çözeltinin konsantrasyonuna (μg/mL) karşı denklemini elde edin.
- Ayrışma sabitinin hesaplanması (Kd) (Şekil 4)
- Floresan okumalarını çıkarın.
- Floresan okumalarını plaka okuyucudan bir elektronik tabloya aktarın.
NOT: Bağlanma tahlillerinde, bir bileşiğin plakaların plastik yüzeyine potansiyel spesifik olmayan bağlanmasını hesaba katmak önemlidir. - Üç farklı plaka için her bir bileşik konsantrasyonundan üçlü ölçümlerin ortalama değerlerini hesaplayın: kaplanmış kuyucuklardan spesifik bağlanma okumaları (Plaka A), kaplanmamış kuyucuklardan spesifik olmayan bağlanma (Plaka B) ve kaplanmamış kuyucuklardaki çözelti içindeki toplam Eu (III) -DO3AAm-CBP (Plaka C).
- Kaplanmamış kuyucukların (Levha B) floresan okumalarını kaplanmış kuyucuklarınkinden (Levha A) çıkararak bağlı bileşik için floresan değerlerini belirleyin.
Denklem 1: Bağlı floresan17'nin belirlenmesi:
Bağlı floresan = Spesifik (kaplanmış kuyular) - Spesifik olmayan (kaplanmamış kuyular) - Çözeltideki (Levha C) Eu(III) etiketli bileşikten elde edilen okumaları kullanarak bir kalibrasyon eğrisi oluşturun. Eu(III) etiketli bileşiğin konsantrasyonuna karşı elde edilen floresan okumalarını çizin. Doğrusal regresyon uyumu gerçekleştirin.
- Floresan okumalarını plaka okuyucudan bir elektronik tabloya aktarın.
- Floresan okumalarını konsantrasyonlara dönüştürün.
- Çözeltideki bileşik konsantrasyonları (adım 4.2.1.4) kullanılarak oluşturulan verilerden standart floresan eğrisini kullanarak bağlı floresan okumalarını (adım 4.2.1.3) konsantrasyona dönüştürün.
NOT: Bir bileşiğin farklı konsantrasyonlarda hareketsiz hale gelen farklı hedef proteinlere bağlanma özelliklerini karşılaştırırken, hedefe bağlı bileşik miktarı (yani bağlı bileşik/protein) hesaplanırken ikincisinin dikkate alınması gerekecektir. - Bağlı bileşiğin konsantrasyonunu, kuyucukta hareketsiz hale getirilen proteinin konsantrasyonuna bölün.
NOT: Bu hesaplama için, kuyucuklar 1 saat boyunca PBS ile inkübe edildikten sonra hesaplanan hareketsizleştirilmiş kollajen konsantrasyonunu kullanın (PBS taklit deneyi olarak adlandırılır; yukarıdaki bölüm 2.1). Bu, inkübasyon aşaması ve yıkama aşaması sırasında nihai floresan sinyaline katkıda bulunmayacak potansiyel kollajen kayıplarını hesaba katmak içindir. - Verileri, x ekseninde (μM) bileşiğin konsantrasyonlarına ve y ekseninde bağlı bileşik/proteinin konsantrasyonlarına sahip bir dağılım grafiği kullanarak çizin.
- Çözeltideki bileşik konsantrasyonları (adım 4.2.1.4) kullanılarak oluşturulan verilerden standart floresan eğrisini kullanarak bağlı floresan okumalarını (adım 4.2.1.3) konsantrasyona dönüştürün.
- Kd değerlerini elde edin.
- Adım 4.2.2.3'te elde edilen verileri iki olası bağlama kinetik modeli kullanarak sığdırın: tek bölgeli bağlama ve tepe eğimli tek bölgeli ciltleme. Her model için denklemler Şekil 6'da gösterilmiştir.
- Verileri sığdırırken en yüksek R-kare değeriyle belirsiz olmayan bir uyum sağlayan modeli seçin.
- Plaka başına konsantrasyon başına her bir floresan okuma seti için aykırı değerleri (s) hariç tutun.
- Nihai Kd değerini hesaplayın ve verileri bağımsız deneylerin ortalama ± standart sapması olarak sunun.
NOT: Sağlam sonuçlar için, her plaka içinde üçlü ölçümler ve farklı mikro plakalarla en az üç bağımsız deney yapın.
- Kesirli doluluk oranını (FO) hesaplayın.
NOT: Denklem 2'den, hedefin konsantrasyonu bilinmemektedir ve bu nedenle, Denklem 3'ten cebir ve Kd kullanılarak, kesirli doluluğu hesaplamak için uygulanabilir bir denklem Denklem 4 şeklinde ortaya çıkar.
Denklem 2: Kesirli doluluktanımı 17:
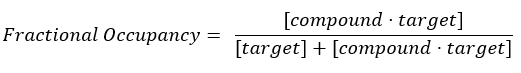
Denklem 3: Bileşiğin denge17'de hedefin %50'sini kapladığı konsantrasyon olan ayrışma sabiti, KD:
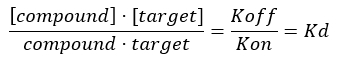
Denklem 4: FO denklemi17'yi hesaplamak için yeniden düzenlenmiş denklem:
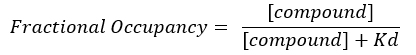
- Her bir plaka için elde edilen bağımsız Kd değerlerini kullanarak FO'yu hesaplayın. Bileşiğin konsantrasyonuna karşı FO'nun sonuçlarını, ortalamasını ve standart sapmalarını çizin.
- FO'yu 0 ile 1 arasında değişen değerlerle veya %0 ile %100 arasında değişen değerlerle yüzde olarak raporlayın.
- Floresan okumalarını çıkarın.
Sonuçlar
Jellerde/filmlerde immobilize edilmiş tip I ve tip III kollajenin stabilitesinin ve konsantrasyonunun değerlendirilmesi
Kuyucuk başına hareketsiz hale getirilen kollajen konsantrasyonunun miktar tayini üç farklı koşul kullanılarak gerçekleştirildi: a) proteinleri immobilize ettikten sonra PBS ile yıkanmadan kuyucuklarda (yıkama yok); b) herhangi bir kaplanmamış proteini uzaklaştırmak için immobilizasyondan sonra bir yıkama adımına sahip kuyucuklar...
Tartışmalar
Bu çalışma, tip I ve tip III kollajenin hareketsiz hale getirilmesi için tekrarlanabilir bir yöntem sunmaktadır. Ayrıca, bir aday ligandın tip I ve III kollajene bağlanma özelliklerini karakterize etmek için in vitro Eu(III) TRF bağlama verilerinin elde edilmesi, analiz edilmesi ve yorumlanması için bir protokol gösterir. Burada sunulan tip I ve tip III kollajenin immobilize edilmesi için protokoller, in vitro13,16
Açıklamalar
Yazarların açıklanacak herhangi bir çıkar çatışması yoktur.
Teşekkürler
Bu çalışmayı destekledikleri için aşağıdaki fon sağlayıcılara minnettarız: (1) Birleşik Krallık Tıbbi Araştırma Konseyi (MR / N013700/1) ve King's College London, MRC Biyomedikal Bilimlerde Doktora Eğitim Ortaklığı üyesi; (2) BHF programı hibesi RG/20/1/34802; (3) BHF Proje hibesi PG/2019/34897; (4) King's BHF Araştırma Mükemmeliyet Merkezi hibesi RE/18/2/34213; (5) ANID Milenyum Bilim Girişimi Programı - ICN2021_004; ve (6) ANID Bazal hibe FB210024.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 10x PBS | Gibco | 14200075 | Use this to make 1x PBS by diluting in water (1:10) |
| 10x PBS | Gibco | 14200075 | Use this to make 1x PBS by diluting in water (1:10) |
| 2M HCL | Made in house and details are in the supporting document | ||
| 2M HCL | Made in house and details are in the supporting document | ||
| 2M Sodium hydroxide +2M Glycine | Made in house and details are in the supporting document | ||
| 2M Sodium hydroxide +2M Glycine | Made in house and details are in the supporting document | ||
| Cell-star 96 well microplate | Greiner Bio-One | 655 160 | |
| Cell-star 96 well microplate | Greiner Bio-One | 655 160 | |
| DELFIA enhacement solution | Perkin Elmer | 1244-104 | |
| DELFIA enhacement solution | Perkin Elmer | 1244-104 | |
| Ice | |||
| Ice | |||
| Infinite 200 PRO NanoQuant microplate reader | TECAN | ||
| Infinite 200 PRO NanoQuant microplate reader | TECAN | ||
| Non-binding (NBS) 96 well microplates | Corning | 3641 | |
| Non-binding (NBS) 96 well microplates | Corning | 3641 | |
| pH electrode Inlab Routine | Mettler Toledo | 51343050 | |
| pH electrode Inlab Routine | Mettler Toledo | 51343050 | |
| pH meter (sevenCompact) | Mettler Toledo | ||
| pH meter (sevenCompact) | Mettler Toledo | ||
| Pierce BCA protein assay kit | Thermofisher | 23227 | |
| Pierce BCA protein assay kit | Thermofisher | 23227 | |
| Tissue culture incubator (37 °C, 5% CO2) | |||
| Type I bovine collagen, 3 mg/mL | Corning | 354231 | |
| Type III human placenta collagen, 0.99 mg/mL | Advanced Biomatrix | 5021 |
Referanslar
- Distler, J. H. W., et al. Review: Frontiers of antifibrotic therapy in systemic sclerosis. Arthritis and Rheumatology. 69 (2), 257-267 (2017).
- Wynn, T. A. Fibrotic disease and the TH1/TH2 paradigm. Nature Reviews Immunology. 4 (8), 583-594 (2004).
- Saha, P., et al. Magnetic resonance T1 relaxation time of venous thrombus is determined by iron processing and predicts susceptibility to lysis. Circulation. 128 (7), 729-736 (2013).
- Mirshahi, M., et al. Defective thrombolysis due to collagen incorporation in fibrin clots. Thrombosis Research. 8, 73-80 (1988).
- Comerota, A. J. The ATTRACT trial: Rationale for early intervention for iliofemoral DVT. Perspectives in Vascular Surgery and Endovascular Therapy. 21 (4), 221-225 (2009).
- Bateman, E. D., Turner-Warwick, M., Adelmann-Grill, B. C. Immunohistochemical study of collagen types in human foetal lung and fibrotic lung disease. Thorax. 36 (9), 645-653 (1981).
- Pawelec, K. M., Best, S. M., Cameron, R. E. Collagen: A network for regenerative medicine. Journal of Materials Chemistry B. 4 (40), 6484-6496 (2016).
- Frantz, C., Stewart, K. M., Weaver, V. M. The extracellular matrix at a glance. Journal of Cell Science. 123 (24), 4195-4200 (2010).
- Copes, F., Pien, N., Van Vlierberghe, S., Boccafoschi, F., Mantovani, D. Collagen-based tissue engineering strategies for vascular medicine. Frontiers in Bioengineering and Biotechnology. 7, 166 (2019).
- Veis, A. The biochemistry of collagen. Annals of Clinical and Laboratory Science. 5 (2), 123-131 (1975).
- Bielajew, B. K., Hu, J. C., Athanasiou, K. A. Collagen: Quantification, biomechanics, and role of minor subtypes in cartilage. Nature Reviews Materials. 5, 730-747 (2020).
- Zhao, Z., et al. Structural and functional plasticity of collagen fibrils. DNA and Cell Biology. 38 (4), 367-373 (2019).
- Eryilmaz, E., Teizer, W., Hwang, W. In vitro analysis of the co-assembly of type-I and type-III collagen. Cellular and Molecular Bioengineering. 10 (1), 41-53 (2017).
- Jagnow, J., Clegg, S. Klebsiella pneumoniae MrkD-mediated biofilm formation on extracellular matrix- and collagen-coated surfaces. Microbiology. 149 (9), 2397-2405 (2003).
- O'Sullivan, D., O'Neill, L., Bourke, P. Direct plasma deposition of collagen on 96-well polystyrene plates for cell culture. ACS Omega. 5 (39), 25069-25076 (2020).
- Caravan, P., et al. Collagen-targeted MRI contrast agent for molecular imaging of fibrosis. Angewandte Chemie - International Edition. 46 (43), 8171-8173 (2007).
- Copeland, R. A. . Enzymes: A Practical Introduction to Structure, Mechanism, and Data Analysis. , (2000).
- Salahudeen, M. S., Nishtala, P. S. An overview of pharmacodynamic modelling, ligand-binding approach and its application in clinical practice. Saudi Pharmaceutical Journal. 25 (2), 165-175 (2017).
- Bünzli, J. C. G., Piguet, C. Taking advantage of luminescent lanthanide ions. Chemical Society Reviews. 34 (12), 1048-1077 (2005).
- Hemmilii, I. Luminescent lanthanide chelates - A way to more sensitive diagnostic methods. Journal of Alloys and Compounds. 225 (1-2), 480-485 (1995).
- De Silva, C. R., Vagner, J., Lynch, R., Gillies, R. J., Hruby, V. J. Optimization of time-resolved fluorescence assay for detection of europium-tetraazacyclododecyltetraacetic acid-labeled ligand-receptor interactions. Analytical Biochemistry. 398 (1), 15-23 (2010).
- Digilio, G., Lacerda, S., Lavin Plaza, B., Phinikaridou, A. Extracellular matrix targeted MRI probes. Analysis & Sensing. 3 (1), (2022).
- Phinikaridou, A., et al. Tropoelastin: A novel marker for plaque progression and instability. Circulation. Cardiovascular imaging. 11 (8), 007303 (2018).
- Guzaeva, T. V., et al. Protein A used in DELFIA for the determination of specific antibodies. Immunology Letters. 35 (3), 285-289 (1993).
- Nasiri, A. H., Nasiri, H. R. Polymerase assays for lead discovery: An overall review of methodologies and approaches. Analytical Biochemistry. 563, 40-50 (2018).
- Capuana, F., et al. Imaging of dysfunctional elastogenesis in atherosclerosis using an improved gadolinium-based tetrameric MRI probe targeted to tropoelastin. Journal of Medicinal Chemistry. 64 (20), 15250-15261 (2021).
- Drescher, D. G., Drescher, M. J., Ramakrishnan, N. A. Surface plasmon resonance (SPR) analysis of binding interactions of proteins in inner-ear sensory epithelia. Methods in Molecular Biology. 493, 323-343 (2009).
- Murali, S., Rustandi, R. R., Zheng, X., Payne, A., Shang, L. Applications of surface plasmon resonance and biolayer interferometry for virus-ligand binding. Viruses. 14 (4), 717 (2022).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır