Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
LC3 İmmünofloresan Kullanılarak İki Farklı Pankreas Hücre Modelinde Otofaji Düzeylerinin Değerlendirilmesi
Bu Makalede
Özet
Bu protokolün amacı, LC3 immünofloresan ve LC3 nokta ölçümü yoluyla pankreas kanseri ve pankreas asinar hücrelerinde otofajik düzeyleri belirlemektir.
Özet
Otofaji, proteinler ve hasarlı organeller de dahil olmak üzere sitoplazmik bileşenleri seçici olarak bozan özel bir katabolik süreçtir. Otofaji, hücrelerin stres uyaranlarına fizyolojik olarak yanıt vermelerini ve böylece hücresel homeostazı korumalarını sağlar. Kanser hücreleri, hipoksi, besin eksikliği veya kemoterapinin neden olduğu hasar gibi olumsuz koşullara uyum sağlamak için otofaji seviyelerini modüle edebilir. Duktal pankreatik adenokarsinom en ölümcül kanser türlerinden biridir. Pankreas kanseri hücreleri, otofaji proteinlerinin transkripsiyonel upregülasyonu ve post-translasyonel aktivasyonu nedeniyle yüksek otofaji aktivitesine sahiptir.
Burada, PANC-1 hücre hattı pankreas insan kanseri hücrelerinin bir modeli olarak kullanıldı ve AR42J pankreas asinar hücre hattı, oldukça farklılaşmış memeli hücrelerinin fizyolojik bir modeli olarak kullanıldı. Bu çalışmada, otofaji aktivasyonunun durumunun bir göstergesi olarak mikrotübül ile ilişkili protein hafif zincir 3'ün (LC3) immünofloresansı kullanılmıştır. LC3, bazal koşullarda, sitoplazmada yaygın bir dağılım paterni gösteren bir otofaji proteinidir (bu durumda LC3-I olarak bilinir). Otofaji indüksiyonu, LC3'ün yeni oluşan otofagozomların yüzeyindeki fosfatidiletanolamine konjugasyonunu tetikler ve otofagozomların oluşumuna ve genişlemesine yardımcı olan zara bağlı bir protein olan LC3-II'yi oluşturur. Etiketli otofajik yapıların sayısını ölçmek için, açık kaynaklı yazılım FIJI, "3D Nesneler Sayacı" aracının yardımıyla kullanıldı.
Hem fizyolojik koşullarda hem de kanser hücrelerinde otofajik seviyelerin ölçülmesi, hipoksi, kemoterapi tedavisi veya belirli proteinlerin yıkılması gibi çeşitli koşullar altında otofajinin modülasyonunu incelememizi sağlar.
Giriş
Makrootofaji (genellikle otofaji olarak adlandırılır), proteinler ve hasarlı organeller 1,2 dahil olmak üzere sitoplazmik bileşenleri seçici olarak parçalayan özel bir katabolik süreçtir. Otofaji, hücrelerin stres uyaranlarına fizyolojik olarak yanıt vermelerini ve böylece hücresel homeostazı korumalarını sağlar3. Otofaji sırasında, çift zarlı bir vezikül oluşur: otofagozom. Otofagozom kargo moleküllerini içerir ve onları bozunma için lizozoma götürür 1,4.
Otofagozomlar, otofajik protein mikrotübül ile ilişkili protein hafif zincir 3 (LC3)5 tarafından dekore edilmiştir. Otofaji indüklenmediğinde, LC3, LC3-I konformasyonundaki sitoplazmada ve çekirdekte yayılır. Öte yandan, otofaji indüklendiğinde, LC3, otofajik yapıların zarında bir fosfatidiletanolamin ile konjuge edilir6. Bu yeni LC3 konformasyonu LC3-II1 olarak bilinir. LC3 konformasyon kayması, hücresel lokalizasyonunda ve dodesil sodyum sülfat-poliakrilamid jel elektroforezinde (SDS-PAGE) migrasyonunda değişikliklere neden olur ve bu da immünofloresan ve batı lekesi 5,7 gibi tekniklerle tespit edilebilir. Bu şekilde, LC3 konjugasyonu, otofajik aktiviteyi ölçmek için kullanılabilecek otofajik süreçte önemli bir olaydır.
Pankreatik asinar hücre, sağlıklı koşullar altında düşük otofaji oranına sahip oldukça farklılaşmış bir hücredir. Bununla birlikte, farklı fizyolojik koşullarda veya farmakolojik stimülasyon altında, otofajiyi aktive edebilirler. Bu nedenle, bu hücre hattındaki otofajik seviyelerin belirlenmesi, farklı farmakolojik veya biyolojik ajanların otofaji üzerindeki potansiyel doğrudan veya dolaylı etkilerini incelemek için yararlıdır 8,9.
Duktal pankreatik adenokarsinom, geç tanısı ve yüksek kemoterapi direnci nedeniyle en ölümcül kanser türlerinden biridir10. Pankreas kanseri hücreleri, otofaji ile ilişkili proteinlerin transkripsiyonel upregülasyonu ve post-translasyonel aktivasyonu nedeniyle yüksek otofaji aktivitesine sahiptir11. Pankreas kanseri hücreleri, hipoksi, besin yoksunluğu veya kemoterapiye bağlı hasar gibi olumsuz koşullara yanıt olarak otofaji seviyelerini ayarlayabilir11. Bu nedenle, pankreas kanseri hücrelerindeki otofaji seviyelerini analiz etmek, değişen ortamlara nasıl adapte olduklarını anlamaya ve otofaji modüle edici tedavilerin etkinliğini değerlendirmeye yardımcı olabilir.
Bu çalışma, iki ayrı pankreas hücresel modelinde LC3 immünofloresansını gerçekleştirmek için bir yöntem göstermektedir. İlk model olan PANC-1 hücreleri, pankreatik duktal adenokarsinom için bir model olarak görev yaptı. Bu hücreler, daha önce otofajiyi indüklediği gösterilen bir kemoterapi ajanı olan gemsitabin ile, özellikle onkojenik Kirsten sıçan sarkom virüsü genini (KRAS) taşıyan pankreas kanseri hücrelerinde12,13 ile tedavi edildi. İkinci model olan AR42J hücreleri, ekzokrin pankreas hücrelerinin daha fizyolojik bir modeli olarak hizmet etti. Bu hücreler, asinar pankreas hücrelerine daha benzer hale gelmek için deksametazon ile farklılaştırıldı14. Bu hücrelerde, otofaji, güçlü bir mTOR inhibitörü olan PP24215 kullanılarak farmakolojik olarak indüklendi. Bu çalışmada, iki farklı pankreas modeli ile tanımlanan protokolün uygulanabilirliğini ve düşük ve yüksek otofaji durumlarını ayırt edebilme yeteneğini gösterdik.
Access restricted. Please log in or start a trial to view this content.
Protokol
1. Hücre hazırlığı
- 12 mm'lik yuvarlak kapakları mutlak etanol içine batırın ve dikey olarak 24 delikli bir plakanın kuyucuklarına yerleştirin.
- Kapağı çıkarın ve çok kuyucuklu plakayı 15 dakika boyunca ultraviyole radyasyona maruz bırakın.
- Kapakları yatay olarak konumlandırın ve Dulbecco'nun Modifiye Kartal Ortamı (DMEM) ile yıkayın.
- Pankreas hücrelerinin düşük geçiş sayısını tohumlayın. Miktar, fiksasyon gününde% 50 -% 75 akıcılık elde etmek için ayarlanmalıdır16.
NOT: 3 gün sonra hücreleri sabitlemek için kuyucuk başına 2,5 × 10 4 PANC-1 veya4 × 104 AR42J hücresinin tohumlanması önerilir. - DMEM'deki hücreleri, %10 fetal sığır serumu, 100 U/mL penisilin ve 100 μg/mL streptomisin içeren hücreleri, %5 karbondioksit (CO2) ile nemlendirilmiş bir atmosfer altında 37 °C'de bir inkübatörde kültüre alın.
NOT: PANC-1 hücreleri için, hücre tohumlaması ile aşağıdaki adımlar arasında hücrelerin 2 gün boyunca inkübe edilmesi önerilir. Bu süreden sonra, hücreler transfekte edilebilir, tedavi edilebilir veya sabitlenebilir. Bu protokol, transfekte olmayan PANC-1 hücrelerinde gemsitabin ile tedaviyi ve transfekte olmayan AR42J hücrelerinde farklılaşma ve PP242 tedavisini örneklemektedir.
2. Hücrelerin tedavisi
- PANC-1 hücreleri için gemsitabin tedavisi
- Tohumlamadan 2 gün sonra DMEM'de 1 μg / μL gemsitabin çözeltisi hazırlayın. 20 μM'lik nihai seyreltme elde etmek için her bir kuyucuğa 1 μg / μL gemsitabin çözeltisinden 2,6 μL ile muamele edin.
- Hücreleri inkübatörde 24 saat boyunca inkübe edin.
- AR42J farklılaşması ve PP242 tedavisi
- DMEM'de 4 μg / mL deksametazon çözeltisi hazırlayın.
- 100 nM'lik nihai bir seyreltme elde etmek için her bir kuyucuğu 4.9 μL 4 μg / mL deksametazon çözeltisi ile tedavi edin.
- Hücreleri inkübatörde 48 saat boyunca inkübe edin.
- Ortamı çıkarın ve 1 μM'lik nihai bir seyreltme elde etmek için her bir kuyucuğa 0,5 μL 1 mM PP242 ile muamele edin.
- Hücreleri inkübatörde 2 saat boyunca inkübe edin.
3. Hücrelerin sabitlenmesi ve geçirgenleştirilmesi
- Soğuk metanol içeren 24 delikli bir plaka ve soğuk fosfat tamponlu salin içeren 6 delikli bir plaka hazırlayın (PBS; 137 mM NaCl, 2,7 mM KCl, 8 mM Na 2 HPO 4, 2 mM KH2PO4). Onları buz üzerinde tutun.
- Her bir kapak parçasını cımbızla alın, PBS'de iki kez yıkayın ve metanol içinde 6 dakika inkübe edin.
4. Hücrelerin bloke edilmesi
- Her bir kapak kapağını PBS'de iki kez yıkayın ve PBS'de% 10 fetal sığır serumunda 1 saat inkübe edin (bloke edici solüsyon).
Not: Bu adımda, iletişim kuralı duraklatılmış olabilir. Kapak fişleri gece boyunca blokaj çözeltisindeki buzdolabında saklanabilir ve protokole ertesi gün devam edilebilir.
5. Kapakların birincil antikor ile inkübe edilmesi
- Blokaj çözeltisinde 1: 1.000'lik bir anti-LC3 çözeltisi hazırlayın ve buz üzerinde tutun.
- Çok kuyucuklu kapağın üzerine bir parça laboratuvar sızdırmazlık filmi yerleştirin.
- Sızdırmazlık filmi üzerine anti-LC3 çözeltisinin kapak kayması başına bir damla (25 μL) yerleştirin.
- Her bir kapak parçasını cımbızla alın ve hücre tarafının çözelti ile temas halinde olmasına dikkat ederek birincil antikor damlasının üzerine yerleştirin.
- Nemli bir kağıt parçasını düz tabanlı bir plastik kutuya yerleştirerek nemli bir oda hazırlayın.
- Çok kuyucuklu plakayı nem odasına yerleştirin, folyo ile örtün ve gece boyunca buzdolabında inkübe edin.
6. Kapakların ikincil antikor ile inkübe edilmesi
- Çok kuyucuklu plakayı nem odasından çıkarın ve kapak kapaklarını tekrar çok kuyucuklu plakaya yerleştirin.
- PBS ile üç yıkama yapın.
- Blokaj çözeltisinde 1:800 seyreltme ile floresan olarak etiketlenmiş bir anti-tavşan çözeltisi hazırlayın ve ışıktan korunan buz üzerinde tutun.
- Çok kuyucuklu kapağın üzerine bir sızdırmazlık filmi parçası yerleştirin.
- Sızdırmazlık filmi üzerine tavşan önleyici çözeltinin kapak kayması başına bir damla (25 μL) yerleştirin.
- Her bir kapak parçasını cımbızla alın ve hücre tarafının çözelti ile temas halinde olmasına dikkat ederek birincil antikor damlasının üzerine yerleştirin.
- Çok kuyucuklu plakayı nem odasında, ışıktan korunan oda sıcaklığında (RT) 2 saat boyunca inkübe edin.
7. Hücrelerin 4′ ,6-diamidino-2-fenilindol (DAPI) ile boyanması
- Çok kuyucuklu plakayı nem odasından çıkarın ve kapak kapaklarını tekrar çok kuyucuklu plakaya yerleştirin.
- PBS ile üç yıkama yapın.
- PBS'de (ışıktan korumalı) 300 nM'lik bir DAPI çözeltisi hazırlayın.
- Her bir kapak fişini DAPI çözeltisi ile 10 dakika boyunca inkübe edin.
- PBS ile üç yıkama yapın. Çok kuyucuklu plakayı ışıktan koruyun.
8. Montaj
- Su ve bir parça kağıt ile iki beher hazırlayın.
- Bir polivinil alkol-Bis (trimetilaluminum)-1,4-diazabicyclo [2.2.2] oktan addukt (PVA-DABCO) çözeltisinin kapak kayması başına bir damla (10 μL) bir slayt üzerine yerleştirin.
NOT: PVA-DABCO, 0,25 M DABCO, %10 W/V PVA, %20 gliserol ve %50 Tris HCl (1,5 M, pH 8,8) ultra saf suda birleştirilerek hazırlanır. - Her bir kapak parçasını cımbızla alın, her su kabında yıkayın, kağıtta kurutun ve PVA-DABCO damlasının üzerine yerleştirin (çözelti ile temas eden hücrelerle).
- Gece boyunca kurumasını bekleyin, ışıktan koruyun.
9. Konfokal mikroskopi görüntüleme ve görüntü yakalama
- Yaklaşık63x17'lik bir hedef kullanarak ters çevrilmiş bir konfokal mikroskopta kapak kaymalarını görselleştirin.
- Etiketli hücrelerin temsili görüntülerini yakalayın.
10. LC3 noktalarının ölçülmesi
- Açmak için ".czi" gibi yakalanan kanalları içeren her görüntü dosyasını ImageJ (FIJI) ekranına sürükleyip bırakın. İletişim kutusunda Tamam'a tıklayın ve Konsol penceresini kapatın.
- Görüntü sekmesinden, Renk > Kanalları Böl'ü seçin.
- LC3 görüntüsü dışındaki kanallara karşılık gelen görüntüleri kapatın.
- Image (Görüntü) sekmesinden Adjust > Color Balance (Renk Dengesi Ayarla) seçeneğini belirleyin
- Hücre hatlarını görselleştirmek için görüntü doygun hale gelene kadar Maksimum kaydırıcıyı sola hareket ettirin.
- Serbest Seçim aracıyla hücre anahattını çizin.
- Renk ayarını sıfırlamak için Sıfırla düğmesine tıklayın.
- Düzenle sekmesinden, seçili öğeyi kesmek için Kes'i seçin.
- Görüntüyü kaydetmeden kapatın.
- Düzenle sekmesinden Yapıştır'ı seçin.
- Analiz menüsünde, 3B Nesneler Sayacı aracını seçin.
- Eşiği ayarlayın. Bu çalışmada verilen örnekte, eşik 2.000 olarak ayarlanmıştır.
- Boyut filtresini ayarlayın. Bu çalışmada 50 ile 500 arasında ayarlanmıştır.
- Nesneler ve Özet kutularının işaretli olduğundan emin olun.
- Tamam'a tıklayın. Noktaların sayısı, Özet'te Algılanan Nesneler olarak açıklanacaktır.
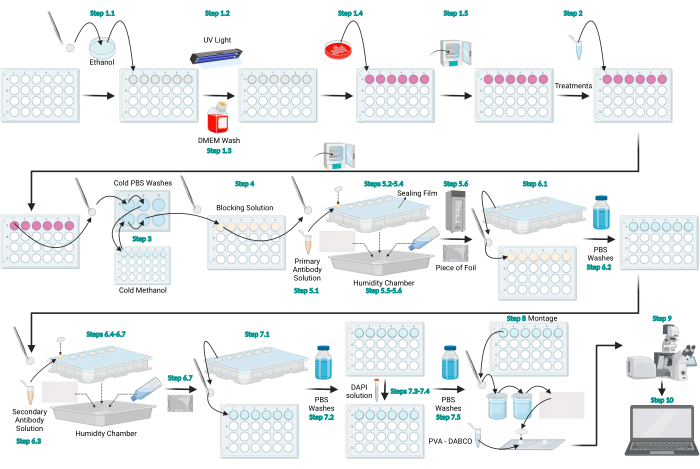
Şekil 1: LC3 immünofloresan protokolünün şematik diyagramı. LC3 immünofloresan için sağlanan genel protokolü temsil eden şematik diyagram. Şekil BioRender.com ile oluşturulmuştur. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
Access restricted. Please log in or start a trial to view this content.
Sonuçlar
Bu protokol, farklı koşullarda otofaji seviyelerini belirlemek için pankreas hücre hatlarında LC3'ün immünofloresansını gerçekleştirir. Bu deneyin sonucu, LC3 ve DAPI'ye karşılık gelen kırmızı ve mavi kanallardan hücresel görüntülerin gizlenmesiydi. LC3 görüntüleri bu proteinin hücresel dağılımını gösterirken, DAPI nükleer lokalizasyonu gösterir. Şekil 2A , LC3'ün immünofloresansının temsili bir görüntüsünü ve bazal veya gemsitabin tedavi koşullar?...
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
Bu protokolde açıklanan yöntem, hücredeki endojen LC3 dağılımının görselleştirilmesine ve farklı koşullar altında otofajik seviyelerin ölçülmesine izin verir. LC3 dağılımını analiz etmek ve otofaji aktivasyonunu belirlemek için kullanılan bir başka benzer yöntem, floresan etiketli LC3 transfeksiyonunu (RFP-LC3 gibi) içerir19. RFP-LC3 transfeksiyonu, fiksasyona ihtiyaç duymama (bu yöntemin canlı hücre görüntüleme20'de uygulanmasına izin ver...
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
Hiçbir çıkar çatışması ilan edilmedi.
Teşekkürler
Bu çalışma, Buenos Aires Üniversitesi (UBACyT 2018-2020 20020170100082BA), Ulusal Bilimsel Araştırma ve Teknoloji Konseyi (CONICET) (PIP 2021-2023 GI− 11220200101549CO; ve PUE 22920170100033) ve Ulusal Bilimsel ve Teknolojik Tanıtım Ajansı (PICT 2019-01664) tarafından desteklenmiştir.
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 10x Phosphate-Buffered Saline (PBS) | Corning | 46-013-CM | |
| 12 mm round coverslips | HDA | CBR_OBJ_6467 | |
| 24 Well- Cell Culture Plate | Sorfa | 220300 | |
| Absolute ethanol | Biopack | 2207.10.00 | |
| Alexa Fluor 594 Donkey anti-rabbit IgG (H+L) | Invitrogen | R37119 | |
| Confocal Laser Scanning Microscope | Zeiss | LSM 800 | |
| Dexamethasone | Sigma Aldrich | D4902 | |
| DMEN | Sartorius | 01-052-1A | |
| Fetal Bovine Serum | NATOCOR | Lintc-634 | |
| Gemcitabina | Eli Lilly | VL7502 | |
| LC3B (D11) XP Rabbit mAb | Cell Signaling Technology | 3868S | |
| Methanol | Anedra | 6197 | |
| Parafilm "M" (Laboratory Sealing Film) | Bemis/Curwood | PM-996 | |
| Pen-Strep Solution | Sartorius | 03-031-1B | |
| PP242 | Santa Cruz Biotechnology | SC-301606 | |
| Trypsin EDTA | Gibco | 11570626 |
Referanslar
- Grasso, D., Renna, F. J., Vaccaro, M. I. Initial steps in mammalian autophagosome biogenesis. Frontiers in Cell and Developmental Biology. 6, 146(2018).
- Galluzzi, L., et al. Molecular definitions of autophagy and related processes. EMBO Journal. 36 (13), 1811-1836 (2017).
- Kitada, M., Koya, D. Autophagy in metabolic disease and ageing. Nature Reviews Endocrinology. 17 (11), 647-661 (2021).
- Ktistakis, N. T., Tooze, S. A. Digesting the expanding mechanisms of autophagy. Trends in Cell Biology. 26 (8), 624-635 (2016).
- Tanida, I., Ueno, T., Kominami, E. LC3 and autophagy. Methods in Molecular Biology. 445, 77-88 (2008).
- Kabeya, Y., et al. LC3, a mammalian homologue of yeast Apg8p, is localized in autophagosome membranes after processing. EMBO Journal. 19 (21), 5720-5728 (2000).
- Mizushima, N., Yoshimori, T. How to interpret LC3 immunoblotting. Autophagy. 3 (6), 542-545 (2007).
- Vanasco, V., et al. Mitochondrial dynamics and VMP1-related selective mitophagy in experimental acute pancreatitis. Frontiers in Cell and Developmental Biology. 9, 640094(2021).
- Williams, J. A. Regulatory mechanisms in pancreas and salivary acini. Annual Review of Physiology. 46, 361-375 (1984).
- Mizrahi, J. D., Surana, R., Valle, J. W., Shroff, R. T. Pancreatic cancer. Lancet. 395 (10242), 2008-2020 (2020).
- Li, J., et al. Regulation and function of autophagy in pancreatic cancer. Autophagy. 17 (11), 3275-3296 (2021).
- Ropolo, A., et al. A novel E2F1-EP300-VMP1 pathway mediates gemcitabine-induced autophagy in pancreatic cancer cells carrying oncogenic KRAS. Frontiers in Endocrinology. 11, 411(2020).
- Pardo, R., et al. Gemcitabine induces the VMP1-mediated autophagy pathway to promote apoptotic death in human pancreatic cancer cells. Pancreatology. 10 (1), 19-26 (2010).
- Logsdon, C. D., Moessner, J., Williams, J. A., Goldfine, I. D. Glucocorticoids increase amylase mRNA levels, secretory organelles, and secretion in pancreatic acinar AR42J cells. Journal of Cell Biology. 100 (4), 1200-1208 (1985).
- Klionsky, D. J., et al. Guidelines for the use and interpretation of assays for monitoring autophagy (4th edition). Autophagy. 17 (1), 1(2021).
- Segeritz, C. -P., Vallier, L. Chapter 9 - Cell culture: Growing cells as model systems in vitro. Basic Science Methods for Clinical Researchers. Jalali, M., Saldanha, F. Y. L., Jalali, M. , Academic Press. Cambridge, MA. 151-172 (2017).
- Elliott, A. D. Confocal microscopy: Principles and modern practices. Current Protocols in Cytometry. 92 (1), 68(2020).
- Grasso, D., et al. a novel selective autophagy pathway mediated by VMP1-USP9x-p62, prevents pancreatic cell death. Journal of Biological Chemistry. 286 (10), 8308-8324 (2011).
- Ropolo, A., et al. The pancreatitis-induced vacuole membrane protein 1 triggers autophagy in mammalian cells. Journal of Biological Chemistry. 282 (51), 37124-37133 (2007).
- Karanasios, E., Stapleton, E., Walker, S. A., Manifava, M., Ktistakis, N. T. Live cell imaging of early autophagy events: Omegasomes and beyond. Journal of Visualized Experiments. (77), e50484(2013).
- Kuma, A., Matsui, M., Mizushima, N. LC3, an autophagosome marker, can be incorporated into protein aggregates independent of autophagy: caution in the interpretation of LC3 localization. Autophagy. 3 (4), 323-328 (2007).
- Zhang, Z., Singh, R., Aschner, M. Methods for the detection of autophagy in mammalian cells. Current Protocols in Toxicology. 69, 1-26 (2016).
- Yoshii, S. R., Mizushima, N. Monitoring and measuring autophagy. International Journal of Molecular Sciences. 18 (9), 1865(2017).
- Betriu, N., Andreeva, A., Semino, C. E. Erlotinib promotes ligand-induced EGFR degradation in 3D but not 2D cultures of pancreatic ductal adenocarcinoma cells. Cancers. 13 (18), 4504(2021).
- Wang, W., Dong, L., Zhao, B., Lu, J., Zhao, Y. E-cadherin is downregulated by microenvironmental changes in pancreatic cancer and induces EMT. Oncology Reports. 40 (3), 1641-1649 (2018).
- Kim, S. K., et al. Phenotypic heterogeneity and plasticity of cancer cell migration in a pancreatic tumor three-dimensional culture model. Cancers. 12 (5), 1305(2020).
- Meng, Y., et al. Cytoplasmic EpCAM over-expression is associated with favorable clinical outcomes in pancreatic cancer patients with Hepatitis B virus negative infection. International Journal of Clinical and Experimental Medicine. 8 (12), 22204-22216 (2015).
- Brock, R., Hamelers, I. H., Jovin, T. M. Comparison of fixation protocols for adherent cultured cells applied to a GFP fusion protein of the epidermal growth factor receptor. Cytometry. 35 (4), 353-362 (1999).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır