Method Article
Kesit Üzerinde Korbağül Işık-Elektron Mikroskobu ile Endojen LC3'ün Ultrastrüktürel Lokalizasyonu
Bu Makalede
Özet
Burada, hücresel üst yapı ile ilgili olarak nadir proteinlerin lokalizasyonunu araştırmak için bir araç olarak endojen, floresan etiketlemeye dayalı optimize edilmiş kesit korelasyonlu ışık-elektron mikroskobu için bir protokol sunuyoruz. Bu yaklaşımın gücü, Bafilomisin tedavisi olmadan aç bırakılmış hücrelerde endojen LC3'ün ultrastrüktürel lokalizasyonu ile gösterilmiştir.
Özet
Otofajik organellerin ultrastrüktürel düzeyde elektron mikroskobu (EM) ile görselleştirilmesi, kimliklerini belirlemek ve otofajik süreci anlamak için önemli olan ayrıntıları ortaya çıkarmak için gereklidir. Bununla birlikte, EM yöntemleri genellikle moleküler bilgiden yoksundur ve EM tarafından elde edilen ultrastrüktürel bilginin spesifik otofaji proteinlerinin floresan mikroskobu tabanlı lokalizasyonu ile korelasyonunu engeller. Ayrıca, değiştirilmemiş hücresel koşullarda otofagozomların nadirliği, yüksek büyütme gerektiren EM tarafından araştırmayı engeller ve bu nedenle sınırlı bir görüş alanı sağlar.
Her iki zorluğa da yanıt olarak, ortak bir otofagozomal belirteç olan LC3'ü EM ultrayapısı ile ilişkilendirmek için floresan etiketlemeye dayalı bir kesit korelasyon ışık-elektron mikroskobu (CLEM) yöntemi uygulandı. Yöntem, diğer ilgili belirteçlerle kombinasyon halinde LC3 etiketlemesi için floresan mikroskobunda hücreleri hızlı bir şekilde taramak için kullanıldı. Daha sonra, seçilen LC3 etiketli noktaların altında yatan ultrastrüktürel özellikler CLEM tarafından tanımlandı. Yöntem, lizozomal asitleşme inhibitörleri eklenmeden aç hücrelere uygulandı.
Bu koşullarda, LC3 ağırlıklı olarak otofagozomlarda ve nadiren LC3'ün hızla bozulduğu otolizozomlarda bulundu. Bu veriler, bu yaklaşımın hem fizibilitesini hem de hassasiyetini göstererek, CLEM'in ilaç tedavileri veya genetik değişiklikler olmaksızın doğal koşullarda LC3 aracılı otofaji hakkında ultrastrüktürel içgörüler sağlamak için kullanılabileceğini göstermektedir. Genel olarak, bu yöntem, ışık mikroskobu ile EM verileri arasında köprü kurarak otofaji proteinlerinin ve diğer kıt antijenlerin ultrastrüktürel lokalizasyon çalışmaları için değerli bir araç sunar.
Giriş
Otofaji, sitoplazmik proteinlerin ve organellerin temizlenmesi ve geri dönüştürülmesi için önemli bir süreçtir. Makro-otofaji süreci (bundan sonra otofaji olarak adlandırılacaktır), hücrelerin lizozomal bozunma için sitoplazmik molekülleri ve organelleri çevrelemesine izin veren çift zarlı organellerin, otofagozomların oluşumunu içerir. Otofaji, çoğu hücrede bazal düzeyde meydana gelir ve açlık veya hücresel stres gibi hücresel koşullara yanıt olarak yukarı doğru düzenlenir. Otofaji ya substrata özgü bir şekilde, bozunma için belirli yapıları veya proteinleri hedefleyerek ya da sitozolün parçalarını kapsayan seçici olmayan bir toplu işlem olarak gerçekleşir. Seçici otofajide, otofagozomlar, Atg8 ailesi proteinlerinin (mikrotübül ile ilişkili proteinler 1A/B hafif zincir 3A/B/C [LC3] ve GABARAP'lar) geri dönüşüm endozomlarından, Golgi'den ve/veya endoplazmik retikulumdan (ER) türetilen zarlara konjugasyonu ile oluşturulur.1. LC3, sitozoldeki otofajik kargoyu doğrudan veya P62/SQSTM gibi seçici otofaji adaptörleri aracılığıyla tanır. Yeni otofajik membranlar daha sonra LC3'e konjuge edilebilir, genişleyebilir ve otofagozom adı verilen kargoyu çevreleyen tamamlanmış bir çift membran oluşturmak için kaynaşabilir. Otofagozom olgunlaşır ve sonunda bir endozom veya lizozom ile birleşir, bundan sonra otofajik kargo ve adaptörler bozulur2.
Otofagozom oluşumu, olgunlaşması ve füzyonu üzerine yapılan çalışmalar genellikle ışık mikroskobu teknolojilerinden yararlanır. LC3'ün floresan mikroskobu genellikle farklı koşullar altında otofagozomların sayısını ve hücresel lokalizasyonunu değerlendirmek için kullanılır. Ayrıca, LC3'ü pH'a duyarlı GFP'ye ve pH'a kararlı RFP'ye tandem prob adı verilen bir probda birleştirerek, GFP floresan kaybının bir fonksiyonu olarak canlı hücrelerde genel otofaji akışıölçülebilir 3. Bu yaklaşımlar, araştırmacıların farklı koşullar altında otofajinin rolünü ve mekanizmasını anlamaları için değerli araçlardır. Bir başka paha biçilmez araç, otofajinin farklı aşamalarında otofajik organellerin üst yapısını ortaya çıkaran elektron mikroskobudur (EM) 4,5,6,7,8. Bugüne kadar, EM, farklı otofajik membranları morfolojiye göre ayırt ederek otofagozom oluşumunun kesin aşamalarını tanımlamak için hala tercih edilen yöntemdir: fagofor (çift zar tamamen kapalı değil), otofagozom (sitozolik kargo etrafında kapalı çift zar) ve otolizozom (iç otofajik zarın [kısmi] kaybı). Bununla birlikte, moleküler bilgi içermeyen morfoloji, yanlış tanımlamaya veya belirsizliğe eğilimli olabilir. Immuno-EM, otofajik organellerin eş zamanlı moleküler karakterizasyonu ve morfolojik sınıflandırması için en kapsamlı yöntemdir. Örneğin, çözülmüş kriyoseksiyonlarda LC3'ün immünogold etiketlemesi, LC3'ün ultrastrüktürel lokalizasyonuna ve LC3 işaretli organellerin kesin olarak tanımlanmasına izin verir9.
EM'nin bir dezavantajı, otofajik membranların ince üst yapısını gözlemlemek ve immüno-EM durumunda, ilgilenilen proteini işaretleyen etiketi bulmak için gereken yüksek büyütme ile birlikte gelen küçük görüş alanıdır. Kıtlıkları ve düşük protein seviyeleri nedeniyle, bu genellikle otofagozomların kantitatif EM analizini engeller. Otofagozomların sayısını artırmak için, hücreler genellikle aç bırakılır ve bir lizozomal asitleşme ve bozunma inhibitörü olan Bafilomisin A1 (BafA1) ile tedavi edilir. BafA1 tedavisi olmadan, bu organellerin kıtlığı nedeniyle EM tarafından otofagozom arayışı zaman alıcıdır. Bu yazıda sunulan yöntem, EM için daha fazla hazırlık yapılmadan önce bir floresan mikroskobunda çözülmüş kriyoseksiyonlar üzerinde endojen LC3'ün floresan etiketlemesi ve görüntülenmesi yoluyla bu konuyu ele almaktadır. Floresan görüntüler daha sonra EM'de LC3 etiketli yapıların aranmasına rehberlik eder. Toplandıktan sonra, EM görüntüleri, hücrenin üst yapısına moleküler bilgi (LC3'ün varlığı) eklemek için floresan görüntülerle ilişkilendirilir. Bu 'kesit üstü CLEM' yöntemi, EM tarafından daha sonra tanımlama ve sınıflandırma için, özellikle işlenmemiş koşullarda LC3 etiketli yapıları bulma yeteneğini büyük ölçüde artırır.
Bu yöntem, değiştirilmemiş (yani BafA1 kullanılmamış) koşullarda otofagozomları bulmak için aç hepatoblastomdan türetilmiş HEPG210 hücrelerine uygulandı. LC311'in yüksek cirosu ile uyumlu olan nispeten az sayıda floresan punkta (90 nm'lik bir bölümde hücre profili başına birden az) bulundu. LC3-puncta'nın bu seyrekliği, CLEM'in değerini vurguladı; EM'de görüntüleme için birkaç floresan punkta içeren bölgeler seçilerek, LC3 pozitif organeller geleneksel immüno-EM'den çok daha etkili bir şekilde bulundu ve karakterize edildi. Bu, LC3 pozitif organellerin çoğunluğunun, otolizozomların daha yaygın olduğu BafA1 ile tedavi edilen hücrelerde elde edilen sonuçların aksine, morfolojileri tarafından tanımlandığı gibi otofagozomlar olduğunu ortaya koydu9. Bu veriler, kesit CLEM ile otofajinin, otofajik akışı inhibe etmeye gerek kalmadan ultrastrüktürel düzeyde çalışılabileceğini göstermektedir.
Protokol
1. Aletlerin ve reaktiflerin hazırlanması
NOT: Gerekli reaktifler, arabellekler ve çözeltiler için, daha fazla bilgi için Ek Dosya 1 veya 12'ye bakın. Bu protokolde kullanılan tüm malzemeler, reaktifler, ekipman ve yazılımlarla ilgili ayrıntılar için Malzeme Tablosuna bakın.
- Fiksatifler
- Fiksatif çözeltiler için bir temel olarak kullanmak üzere Ek Dosya 0.2'de açıklandığı gibi 0.2 M BORULAR, HEPES, EGTA, MgS4 (PHEM) tamponu 1 M fosfat tamponu (PB) veya 1 M BORULAR, HEPES, EGTA,MgS04 (PHEM) tamponu hazırlayın.
NOT: Fiksatifler, biyolojik materyal ile aldehit reaksiyonunun neden olduğu asitleşmeye karşı tampon oluşturmak için rutin olarak 0.1 M PB veya PHEM tamponunda tamponlanır. - Paraformaldehitin (PFA) kalitesi, numunelerin üst yapısının güvenilir bir şekilde sabitlenmesinin anahtarı olduğundan, EM sınıfı PFA kullanın. Bu protokolü takip etmek için, yüksek kaliteli PFA prilllerinden hazırlanmış% 16 stok çözeltileri kullanın (Ek Dosya 1'e bakın).
DİKKAT: Paraformaldehit tehlikeli bir kimyasaldır (tehlike ifadeleri H228, H301, H302, H311, H314, H315, H317, H318, H331, H332, H335, H341, H350). PFA ile çalışırken koruyucu ekipman (eldiven, laboratuvar önlüğü ve koruyucu gözlük) giyin ve kimyasal bir başlıkta çalışın. PFA içeren atıklar, enstitülerin yönergelerine ve düzenlemelerine göre toplanmalı ve bertaraf edilmelidir. - % 4 PFA'lık fiksatif bir çözelti hazırlamak için 10 mL 0.2 M PB, 5 mL% 16 PFA (demineralize su [dH 2 O] içinde) ve 5 mLdH2O'yu birleştirin.
- İsteğe bağlı: Adım 1.1.3'ten fiksatif çözeltiye %0.02-0.5 glutaraldehit (GA) eklenmesi, üst yapının korunmasını iyileştirir, ancak numunenin birçok antikora karşı antijenisitesini azaltır.
NOT: GA sabitlemesi istendiğinde, uygun bir tedarikçiden EM sınıfı GA kullanın.
DİKKAT: Gluteraldehit tehlikeli bir kimyasaldır (tehlike ifadeleri H301, H302, H314, H317, H330, H332, H334, H335, H400, H411). Kimyasal bir başlıkta çalışın ve GA'yı manipüle ederken koruyucu ekipman (eldiven, laboratuvar önlüğü ve koruyucu gözlük) giyin. GA içeren atıklar, enstitülerin yönergelerine ve düzenlemelerine göre toplanmalı ve bertaraf edilmelidir.
- Fiksatif çözeltiler için bir temel olarak kullanmak üzere Ek Dosya 0.2'de açıklandığı gibi 0.2 M BORULAR, HEPES, EGTA, MgS4 (PHEM) tamponu 1 M fosfat tamponu (PB) veya 1 M BORULAR, HEPES, EGTA,MgS04 (PHEM) tamponu hazırlayın.
- Araçlar ve malzemeler
- Metal kalıntılarını gidermek ve pimlere jelatin gömülü hücre blokları monte edildiğinde optimum yapışmayı sağlamak için alüminyum numune tutucu pimlerin yüzeyini çizin ve bunları etanol 3 x 10 dakika sonikleştirin.
- Alüminyum numune tutucu pimleri, numuneleriyle birlikte sıvı nitrojen (LN2) içinde saklamak için uygun bir saklama kabı kullanın.
- Oje kullanarak tahta bir şişin ucuna tek bir saç veya kirpik yapıştırarak bir manipülatör yapın.
- Bir toplama döngüsü oluşturun. 0,3 mm kalınlığında paslanmaz çelik bir teli 3 mm çapında yuvarlak bir çubuğun etrafına bükün ve uçları bir ucunda bir halka oluşturacak şekilde bükün. Bükülmüş uçları bir pipet ucuna yerleştirin. Diğer ucundan tahta bir şiş yerleştirin ve tutkal veya reçine ile yapıştırın.
NOT: Bir toplama döngüsü de ticari olarak temin edilebilir (bkz. - Izgara kurutma halkalarını hazırlamak için, toplama döngüleri yapmak için aynı adımları izleyin: 4 mm'lik bir ilmek halinde paslanmaz çelik bir tel oluşturun ve yapıştırıcı veya reçine ile büyük bir pipet ucuna yapıştırın.
- Izgaraları formvar gibi ince bir destekleyici film kullanarak kaplayın ( Ek Dosya 1'deki protokol). Kullanmadan önce ızgaraları ince bir karbon tabakası ile kaplayın.
NOT: Kullanıma hazır ızgaralar ticari olarak temin edilebilir (bkz. Formvar kaplı ızgaralar, oda sıcaklığında (RT) süresiz olarak saklanabilir; karbon kaplı ızgaralar RT'de birkaç ay saklanabilir. - 13'te olduğu gibi temiz cam slaytlar ve büyük lameller hazırlayın (24 mm x 24 mm, 25 mm genişliğinde cam slaytlar için idealdir).
2. Fiksasyon ve numune hazırlama
- Fiksasyon
- Adım 1.1.3'te hazırlanan fiksatifi kullanın (4 M PB'de% 0.1 PFA). Yapışık hücre hatları için, 6 cm'lik tabaklarda 1-5 × 106 hücre kültürü. Fiksatifi kültür ortamına 1:1 oranında ekleyin ve numuneyi RT'de 5 dakika inkübe edin. Ardından, orta fiksatif karışımı sadece fiksatif ile değiştirin ve RT'de 2 saat inkübe edin.
NOT: Tam hücre sayıları, birleşme ve kültür koşulları, kullanılan model sistemine göre değişebilir. - Numuneleri gece boyunca veya 3-4 haftaya kadar %0,5 PFA'da 0,1 °C'de 0,1 M PB'de saklayın.
NOT: GA fiksasyona eklenebilir (bkz. adım 1.1.4) ve fiksasyon uzunluğu, morfolojinin korunması ile antijeniklik arasında numune ve etiketleme başına farklılık gösteren optimal bir denge bulmak için değiştirilebilir. Daha fazla bilgi için bkz.14.
- Adım 1.1.3'te hazırlanan fiksatifi kullanın (4 M PB'de% 0.1 PFA). Yapışık hücre hatları için, 6 cm'lik tabaklarda 1-5 × 106 hücre kültürü. Fiksatifi kültür ortamına 1:1 oranında ekleyin ve numuneyi RT'de 5 dakika inkübe edin. Ardından, orta fiksatif karışımı sadece fiksatif ile değiştirin ve RT'de 2 saat inkübe edin.
- Örnek ekleme
- Bulaşığı RT'de PBS ile 3x sabit hücrelerle yıkayın. Daha sonra,% 0.15 glisin içeren PBS ile değiştirin ve RT'de 10 dakika inkübe edin.
- 37 °C'ye önceden ısıtılmış PBS'de %0.15 glisin içeren PBS'yi %1 jelatin ile değiştirin ve %1 jelatin içindeki hücreleri kazıyın ve bir mikrosantrifüj tüpüne aktarın. Hücreleri bir mikrosantrifüjde RT'de 1 dakika boyunca 6.000 × g'da peletleyin. Ardından, peleti bozmadan %1 jelatini çıkarın ve 37 °C'ye ısıtılmış %12 jelatin ekleyin. Önceden 37 °C'ye ısıtılmış pipet uçları veya cam Pasteur pipetleri ile hafifçe yukarı ve aşağı pipetleyerek hücre peletini yeniden süspanse edin.
- 37 °C'de 10 dakika inkübe edin; Ardından, hücreleri 1 dakika boyunca 6.000 × g'da pelet haline getirin. Jelatini buz üzerinde 30 dakika katılaştırın.
- Jelatine gömülü hücreleri tüpten çıkarmak için, peleti içeren tüp ucunu tüpün geri kalanından bir jiletle kesin. Daha sonra, ilk kesime dik olarak, tüp ucunu hücre peleti ile ikiye bölün.
- Jelatin gömülü hücre peletini içeren iki tüp ucu yarısını 2.3 M sükroz içinde 4 °C'de 10 dakika inkübe edin. Bu, jelatine gömülü hücre pelet yarımlarının hafifçe büzülmesine ve plastik tüpten çıkmasına neden olur.
NOT: 2.3 M sakarozun çok viskoz ve jelatinin çok yumuşak olmasını önlemek için jelatine gömülü hücre peletleri mümkün olduğunca 4 °C'de veya buz gibi soğuk tutulmalıdır. Sonraki adımlarda jelatin gömülü hücre peletlerinin manipülasyonu sırasında, bir seferde yalnızca bir numune ile çalışın ve diğerlerini buz üzerinde tutun veya soğuk (~4 °C) bir odada çalışın. Jelatine gömülü hücre peletlerinin güneş ışığı, sıcak mikroskop lambaları veya diğer ısı kaynakları ile aşırı ısınmasını önleyin. - Jelatin gömülü hücre peletli tüp yarımlarını 2.3 M sükrozdan çıkarın. Sonra, jelatine gömülü hücre pelet yarımlarını cımbızla plastik tüp yarımlarından çıkarın. Peletleri bir tıraş bıçağıyla uygun boyuttaki (~1 mm3) bloklar halinde manuel olarak kesin. Kesim sırasında konuyu büyütmek için stereo diseksiyon mikroskobu kullanın.
- Jelatin gömülü hücre bloklarını 3-16 saat boyunca 2,3 M sükroz ile demleyin ve 4 °C'de bir rotorda uçtan uca çevirin.
- Alüminyum numune tutucu pim üzerine jelatin gömülü bir hücre bloğu yerleştirin (bkz. adım 1.2.1). Bloğun kenarlarında yeterli miktarda 2,3 M sükroz bırakın, böylece blok ile pim arasında ince bir 'yaka' oluşturur. Bloğun üstünü kaplayan çok fazla 2,3 M sükrozdan kaçının. Çıtçıtlı dondurun ve LN2'de saklayın.
3. Bölümlere ayırma
- Kırpma (ayrıca bkz.12)
- LN2 deposundan jelatin gömülü hücrelerden oluşan bir blok içeren bir iğne alın ve -80 °C'ye ayarlanmış bir kriyomikrotomun içine yerleştirin.
- Yüzeyini düzleştirmek ve ~250 nm kesitler elde etmek için bloğun önünü kesin. 3 mm'lik halkayı toplama çözeltisine (1:1 2.3 M sükroz ve %2 metilselüloz) daldırın, halkayı mikrotomun kriyo odasına yerleştirin ve damlacıkta buz oluşmaya başlayana kadar bekleyin (tipik olarak 5-7 s). Ardından, damlacığı hızlı ama nazikçe onlara doğru bastırarak bölümü hemen alın. Halkayı kriyo odasından çıkarın, damlacık tamamen çözülene kadar bekleyin ve damlacığı bir cam slayt üzerine bastırın.
- Bölümlerin toluidin mavisi boyaması ile hücre oryantasyonunu kontrol edin.
- Bir cam slayt üzerindeki bölümlerin üzerine bir damla toluidin mavisi çözeltisi (Ek Dosya 1'e bakın) koyun ve damlanın kenarları kuruyana kadar 80 ° C'lik bir ısıtma plakasında kurutun.
- Cam sürgüyü ısıtma plakasından çıkarın ve toluidin mavisini dH2O ile nazikçe durulayın ve uygun bir atık kabında toplayın.
- Cam slaytı kurutun ve basit, tezgah üstü ışık mikroskobu ile bölümlerdeki hücre yönünü kontrol edin.
- Bıçak köşesi ile numune blok yüzünün yan tarafına 50-100 μm kesit vererek bloğun kenarlarını kesin. Çıkıntılı ~90 μm x 250 μm dikdörtgen oluşturmak için her iki tarafı kırptıktan sonra numune tutucuyu 375° döndürerek numune blok yüzünün dört tarafını kesin. Önceki adımda belirlenen hücre yönüne göre çıkıntılı alanı seçin.
- Bölümlendirme ve teslim alma
- Kriyomikrotomu -100 °C'ye soğutun. Çıkıntılı dikdörtgenden bir şerit kesit alın, kesitler 70-90 nm kalınlığında ve gümüşi-altın parlaklığında. Uzun (2-5 mm) bir şerit oluşturmak için bir çubuk üzerinde bir saç teli ile bölümleri elmas bıçağın kenarından uzağa yönlendirin (bkz. bölüm 1.2.3).
- Uygun bir şerit oluştuğunda, şeridi almak için bölümlere ayırmayı durdurun. 3 mm'lik toplama halkasını 2,3 M sükroz ve %2 karışık 1:1 metilselüloza batırın, halkayı mikrotomun kriyo odasına yerleştirin ve damlacık donmaya başlayana kadar bekleyin (tipik olarak 5-7 s). Ardından, damlacığı hızlı ama nazikçe onlara doğru bastırarak bölümleri hemen alın. Döngüyü kriyo odasından çıkarın, damlacık tamamen çözülene kadar bekleyin ve damlacığı hazırlanmış bir ızgaraya bastırın (adım 1.2.6).
NOT: Kesitli ızgaralar 4 °C'de birkaç ay saklanabilir.
4. Etiketleme ve ışık mikroskobu
- Etiketleme
- Kesitli ızgaraları (Şekil 1A) kesit tarafı aşağı bakacak şekilde ~1 mL PBS üzerine küçük bir tabakta veya çok kuyulu bir plakada yerleştirin. 37 °C'de 30 dakika inkübe edin.
NOT: Bu adım, hücreler arasındaki jelatini çıkarır; Kesitlerden sonra jelatin gerekli değildir ve kalan protokole müdahale eder. - Izgaraları kesit tarafı aşağı bakacak şekilde parafilm üzerinde ~75 μL damlacıklar üzerinde işleyin (bkz. Şekil 1B). RT'de PBS +% 0.15 glisin yıkamaları (3 x 2 dakika) ile başlayın. Daha sonra, ızgaraları PBS'de% 0.1 sığır serum albümini (BSA)-c +% 0.5 balık derisi jelatini (FSG) ile bloke edici adım olarak RT'de 10 dakika inkübe edin. PBS'de primer antikorları %0.1 BSA-c + %0.5 FSG içinde seyreltin ve ızgaraları bu çözeltinin ~ 10 μL damlacıkları üzerinde RT'de 1 saat inkübe edin (Şekil 1C).
- Izgaraları RT'de PBS 5x'te% 0,1 BSA'da yıkayın. Daha sonra, ikincil antikorları ve 4',6-diamidino-2-fenilindolü (DAPI; 10 μg/mL) PBS'de %0.1 BSA-c + %0.5 FSG içinde seyreltin ve ızgaraları bu çözeltinin ~ 10 μL damlacıkları üzerinde 30+ dakika boyunca inkübe edin RT'de (Şekil 1C). Izgaraları RT'de PBS 5x'te yıkayın.
NOT: İsteğe bağlı olarak, ikincil bir antikor, EM'de ilgilenilen proteinin lokalizasyonu için protein A'ya (PAG) konjuge edilmiş 5, 10, 15 veya 20 nm kolloidal altın parçacıkları ile etiketlenebilir. İstenirse, 4.1.3 adımından sonra ızgaraları RT'de 20 dakika boyunca PAG ile inkübe edin. Birden fazla primer antikorun aynı anda kullanılmasından kaçının ve istenmeyen çapraz reaksiyonları önlemek için PAG'nin farklı türlerin IgG'lerine reaktivitesini not edin. Daha fazla bilgi için bkz.12.
- Kesitli ızgaraları (Şekil 1A) kesit tarafı aşağı bakacak şekilde ~1 mL PBS üzerine küçük bir tabakta veya çok kuyulu bir plakada yerleştirin. 37 °C'de 30 dakika inkübe edin.
- Işık mikroskobu için montaj numuneleri
- Izgaraları RT'de dH 2 O2x 5 dakika içinde% 50 gliserol içine daldırın. Bir cam slayt ile lamel arasındaki ızgaraları% 50 gliserolde, her lamel için bir ızgara olacak şekilde, bölümler lamel bakacak şekilde sandviçleyin (Şekil 1D).
NOT: Izgaralar %50 gliserol içinde 30 dakikadan fazla takılı tutulduğunda etiketlemenin kalitesi bozulabilir. Bu nedenle, bir seferde iki veya üç ızgaranın monte edilmesi ve görüntülenmesi ve diğerlerinin ikincil etiketleme çözümünde bırakılması önerilir.
- Izgaraları RT'de dH 2 O2x 5 dakika içinde% 50 gliserol içine daldırın. Bir cam slayt ile lamel arasındaki ızgaraları% 50 gliserolde, her lamel için bir ızgara olacak şekilde, bölümler lamel bakacak şekilde sandviçleyin (Şekil 1D).
- Işık mikroskobu
- Sıkıştırılmış ızgaralara sahip bir cam slaytı, otomatik bir aşamaya sahip geniş alan mikroskobuna götürün. Yüksek büyütmeli (63x veya 100x) bir yağ objektifi seçin. Bölümler şeridinin (bir parçasının) görüntü kutucuk kümesini oluşturun (Şekil 1E).
NOT: Bazı ikincil antikorlar, özellikle bölümlerdeki kıvrımlar veya yırtıklar etrafında, ızgaralar üzerinde floresan agregalar oluşturabilir. Ek olarak, bazı hücre tipleri ve dokular otofloresan yapılar içerir. Bu tür sorunlar bekleniyorsa, primer antikor ile inkübe edilmemiş bir negatif kontrol ızgarasının dahil edilmesi tavsiye edilir.
- Sıkıştırılmış ızgaralara sahip bir cam slaytı, otomatik bir aşamaya sahip geniş alan mikroskobuna götürün. Yüksek büyütmeli (63x veya 100x) bir yağ objektifi seçin. Bölümler şeridinin (bir parçasının) görüntü kutucuk kümesini oluşturun (Şekil 1E).
- Sökme ve EM kontrast
- Cam lamel sandviçin yan tarafına 10 μL dH2O ekleyin ve cam lamel sandviç arayüzünü doldurmak için kılcal hareketin olmasını bekleyin. Daldırma yağını gliserole karıştırmadan lamel dikkatlice çıkarın. Izgaraları cımbızla alın ve% 50 gliserolü yıkamak için RT'de dH2O 3x'e daldırın.
NOT: Yağ, uranil lekelenmesini engelleyebilir ve EM kontrastını bozabilir. - Izgaranın arkasını tüy bırakmayan kağıt mendille dikkatlice kurulayın.
NOT: Numune ayrıca kolloidal altın parçacıkları ile etiketlenmişse, aşağıdaki adımları gerçekleştirin: ızgarayı bölümleri aşağı bakacak şekilde PBS damlacıklarına yerleştirin ve RT'de 2x yıkayın. RT'de 5 dakika boyunca %1 GA'da sonfix (1.1.4 altındaki uyarı notuna bakın). RT'de PBS 2x'te yıkayın. - Izgaraları kesit tarafı aşağı bakacak şekilde dH2O damlacıklarının üzerine yerleştirin ve RT'de 8x yıkayın.
- EM'de kontrast için bölümleri boyamak için, RT'de 5 dakika boyunca uranil asetat (UA), pH 7 ile inkübe edin (Şekil 1F).
- Izgaraları yerleştirmeden önce, buz üzerindeki metal bir plaka üzerinde parafilm üzerine damlacıklar yerleştirerek UA: metilselüloz, pH 4'ü soğutun. Ardından, ızgaraları buz gibi soğuk UA: metilselüloz, pH 4, 2x ile yıkayın ve buz gibi soğuk UA: metilselüloz, pH 4 ile 10 dakika inkübe edin (Şekil 1F).
DİKKAT: Uranil asetat tehlikeli bir kimyasaldır (tehlike ifadeleri H300, H330, H373, H411). UA gerektiren adımlarda, kimyasal bir başlıkta çalışın ve koruyucu ekipman (laboratuvar önlüğü, eldiven ve koruyucu gözlük) kullanın. UA içeren atıkları enstitülerin yönergelerine ve düzenlemelerine göre toplayın ve bertaraf edin. - Izgaranın altındaki UA: metilselüloz damlacığına bir ızgara kurutma halkası yerleştirerek ve ızgara damlacıktan12 çekilene kadar yavaşça kaldırarak ızgaraları dışarı çıkarın. Fazla UA: metilselülozu, ilmeği ~60 ° açıyla (bölümler aşağı bakacak şekilde) tüy bırakmayan filtre kağıdına (Malzeme Tablosuna bakın) dokundurarak ve daha fazla UA: metilselüloz emilmene kadar kağıt boyunca yavaşça sürükleyerek kurulayın. Ardından, ızgaralı halkayı uygun bir rafa yerleştirin ve RT'de >10 dakika kurumaya bırakın (Şekil 1G).
- Cam lamel sandviçin yan tarafına 10 μL dH2O ekleyin ve cam lamel sandviç arayüzünü doldurmak için kılcal hareketin olmasını bekleyin. Daldırma yağını gliserole karıştırmadan lamel dikkatlice çıkarın. Izgaraları cımbızla alın ve% 50 gliserolü yıkamak için RT'de dH2O 3x'e daldırın.
5. EM
- Transmisyon elektron mikroskobunda (TEM; Şekil 1H). Işık mikroskobu veri kümesindeki yatırım getirisine açıklama ekleyin. Bir bölge seçildikten sonra, TEM'de 20.000x-50.000x büyütmede bir görüntü kutucuk kümesi edinin. Görüntü döşeme kümesini son işleme yazılımındayeniden oluşturun 15,16.
6. Korelasyon ve analiz
- Işık mikroskobu ve EM veri kümesini ImageJ/Fiji17, Icy18'deki ec-CLEM eklentisi veya Photoshop gibi uygun görüntü işleme yazılımına yükleyin. Işık mikroskobu veri kümesini EM kutucuk kümesiyle eşleşecek şekilde kırpın ve döndürün.
- EM'de floresan ve nükleer ana hatlarda DAPI sinyaline dayalı korelasyonu gerçekleştirin (Şekil 1I). Görüntüleri tam olarak üst üste bindirmek için kaydırın ve manuel korelasyonu doğru bir şekilde gerçekleştirin. Yaklaşımı daha kesin hale getirmek için, örneğin Icy'deki ec-CLEM eklentisi veya ImageJ'deki BigWarp eklentisi aracılığıyla, karşılık gelen noktaların manuel seçimi yoluyla görüntüleri ilişkilendirmek için yer işaretine dayalı korelasyon uygulayın. ec-CLEM ile korelasyon için ayrıntılı, adım adım bir protokol mevcuttur19.
NOT: Bu yaklaşım aynı zamanda iki modlu referans problarının20,21 kullanımıyla da iyi çalışır.
- EM'de floresan ve nükleer ana hatlarda DAPI sinyaline dayalı korelasyonu gerçekleştirin (Şekil 1I). Görüntüleri tam olarak üst üste bindirmek için kaydırın ve manuel korelasyonu doğru bir şekilde gerçekleştirin. Yaklaşımı daha kesin hale getirmek için, örneğin Icy'deki ec-CLEM eklentisi veya ImageJ'deki BigWarp eklentisi aracılığıyla, karşılık gelen noktaların manuel seçimi yoluyla görüntüleri ilişkilendirmek için yer işaretine dayalı korelasyon uygulayın. ec-CLEM ile korelasyon için ayrıntılı, adım adım bir protokol mevcuttur19.
- Uygun bir programda (örneğin, ImageJ) floresan sinyaline dayalı ROI'leri seçerek ilişkili görüntüleri analiz edin. Nicel analiz için, etiketli tüm organeller için bir ROI koleksiyonu oluşturun. Ardından, tek tek ROI'lerin karşılık gelen üst yapısını inceleyin ve bunları morfolojik unsurlara göre sınıflandırın.
Sonuçlar
Ultra ince kriyoseksiyonlarda LC3'ün immüno-altın etiketlemesi için optimize edilmiş bir immüno-EM protokolü yakın zamanda De Maziere ve ark.9 tarafından yayınlanmıştır. Bu çalışma, LC3'ün mevcut olduğu, ancak nispeten nadir olduğu ve EM tarafından bulunmasının zor olduğu BafA1'in olmadığı aç koşulları içeriyordu. Nispeten nadir ve düşük eksprese edilen endojen proteinleri görselleştirmek ve bunu EM ultrayapı14 ile ilişkilendirmek için floresan etiketlemenin duyarlılığını kullanan ayrı bir çalışmada kesit üstü bir CLEM yöntemi tanıtıldı. Burada, bu iki yaklaşım, CLEM yaklaşımının bir parçası olarak optimize edilmiş LC3 etiketleme protokolünün kullanılmasıyla birleştirilir.
Nispeten yüksek bazal otofaji22 seviyelerine sahip karaciğer kaynaklı hücreler olan HEPG2 hücreleri,% 4 PFA'da fiksasyondan önce 2 saat boyunca minimum ortamda (Earle'nin dengeli tuz çözeltisi [EBSS]) aç bırakıldı. Bunu, kesit CLEM 14,23 ile son derece uyumlu olan Tokuyasu ultra ince kriyoseksiyon yöntemiyle (bölüm 1-3; bkz. Slot ve Geuze12) numune hazırlama izledi. Çözülmüş kriyoseksiyonlar, fare anti-LC3 primer antikoru9 kullanılarak floresan olarak etiketlendi (protokol bölüm 4 ve Şekil 1). Ek olarak, endo-lizozomları belirtmek için tavşan anti-LAMP1, ardından anti-fare AlexaFluor488 ve anti-tavşan AlexaFluor568 ikincil antikorları kullanıldı. Izgaralar bir lamel ve cam lam arasına sıkıştırıldı ve RT'de geniş alan mikroskobunda (100x 1.47 NA yağ objektifi, sCMOS kamera) görüntülendi.
İnce kesitlerin floresan etiketlemesinin geleneksel tam hücre IF'ye göre bir avantajı, kesitin fiziksel kalınlığı 60-90 nm olduğu için Z'deki artan çözünürlüktür. Bu geliştirilmiş Z çözünürlüğü ile, LC3 ve LAMP1'in ince kesitler üzerindeki floresan etiketlemesi çok az kolokalizasyon ortaya koymaktadır (Şekil 2A). BafA1 gibi lizozomal inhibitörlerle tedavi edilen hücrelerde, lizozomal kapalı LC3 bozulmadan kaldığından yüksek kolokalizasyon meydana gelir9. Tedavi edilmemiş hücrelerde, LC3 enzimatik olarak aktif, LAMP1 pozitif lizozomlarla temas ettiğinde hızla bozunur ve bu nedenle bu koşullarda birlikte lokalizasyon nadirdir. Genel olarak, hücre profili başına birden az LC3 punktum gözlenmiştir. Bu, aç koşullarda bile, otofagozomların devrinin hızlı olduğunu ve otofagozom sayılarını düşük tuttuğunu gösterir. Ayrıca, ışık mikroskobu tarafından sağlanan geniş görüş alanını kullanarak nadir LC3 etiketli yapıları bulmak için CLEM kullanmanın önemini vurgulamaktadır. Ayrıca, floresan etiketlemenin altın etiketlemeye kıyasla daha yüksek hassasiyeti, geleneksel immüno-EM'ye göre daha fazla LC3 pozitif organelin tanımlanmasını sağlayarak karakterizasyonlarına daha fazla yardımcı olur.
Kesit şeridinin tam bir döşeme seti elde edildikten sonra, ızgaralar mikroskoptan alındı ve UA ve döngü çıkış yöntemi kullanılarak EM için sonradan boyandı (protokol adımları 4.4-4.6; Şekil 1F,G). Bu 'loop-out' yöntemi, ızgara üzerinde ince bir UA:metilselüloz tabakasının kalmasını sağlar ve bu da EM'de istenen kontrastı oluşturur. Katmanın kalınlığı, UA: metilselülozun filtre kağıdına lekelenme hızına ve açısına bağlıdır. Döngüyü çok hızlı sürüklemek, ızgarada çok fazla UA: metilselüloz bırakabilir ve EM'deki bölümlerin görünümünü koyulaştırabilir. Çok yavaş sürüklemek çok fazla UA:metilselüloz çekebilir, bu da çok az lekelenmeye ve zayıf morfolojiye neden olur ve ızgaranın döngüden düşme riski taşır. Kuru ızgaralar üzerindeki 'yağ tabakası' renklendirmesi (Şekil 1G), uygun bir UA:metilselüloz tabaka kalınlığını gösterir.
Döngü çıkışı ve kurutmadan sonra, ızgaralar floresan tarafından seçilen ROI'lerde bir TEM'de görüntülendi. IF ve EM veri kümeleri, DAPI sinyalinin EM'de görünen çekirdeklerin ana hatlarına bindirilmesiyle ilişkilendirildi ve her iki modalitenin bilgilerini içeren entegre bir görüntü oluşturuldu.
EM'de IF'de seçilenle aynı alanı bulmak zor olabilir. Bu nedenle, EM'de arama yaparken IF kutucuk kümesinin genel bir görüntüsünü elinizin altında tutmanız önerilir. Kullanıcılar, bölümlerdeki kıvrımlar veya yırtıklar, ızgara çubukları veya çekirdeklerin düzenlenmesi gibi her iki modalitede de tanınabilir özellikler aramalıdır. Numunenin EM'de döndürülmüş ve yansıtılmış görünebileceğini akılda tutmak da önemlidir. Alanları tanımlamak için belirli özelliklere sahip 'bulucu ızgaralar' korelasyonu kolaylaştırmak için kullanılabilir (bkz.
LC3 pozitif organellerin EM ultrastrüktürü ile korelasyonu, farklı punktaların otofajinin farklı aşamalarını temsil ettiğini ortaya koydu (Şekil 2B). Kriyoseksiyonlarda otofagozomal üst yapının korunması zor olsa da, sitoplazmik içerikli ve çift zarlı organeller sıklıkla gözlenmiştir (Şekil 2C, organellerde oklar 1-5; Ek Şekil S1), otofagozomların morfolojik özelliklerini tanımlar. İlginç bir şekilde, oldukça zayıf floresan lekeler EM tarafından LC3 pozitif otolizozomlar olarak tanımlandı (Şekil 2C, organel 6; otofajik içerik * olarak işaretlenmiştir), yoğun içerik ve intraluminal veziküller ile karakterize edilmiştir. Bu, ultra ince kriyoseksiyonların IF'sinde çok küçük miktarlarda LC3'ün görülebildiğini gösterdi ve bozunma ortamına rağmen, bazı LC3'ün kararlı durum otolizozomlarında tespit edilebildiğini gösterdi. Bununla birlikte, LC3 pozitif punktaların çoğunluğu otofagozomları temsil ederken, otolizozomlar çok nadirdi. Bu, esas olarak otofagozomları değil, otolizozomları biriktiren BafA1 ile tedavi edilen hücrelerin tersidir9.
Özetle, bu protokol, floresan mikroskobu ile elde edilen moleküler bilgiyi EM'nin üst yapısına bağlamak için kesit üzerinde bir CLEM yöntemini açıklar. Bu yöntem, immüno-EM'nin duyarlılığını arttırır, çünkü etiketleme için sadece floroforlar kullanılır ve bunlar genellikle EM problarından daha fazla sinyal verir. Yöntem, özellikle ihmal edilebilir arka plan boyaması üzerinde yüksek seviyelerde spesifik floresan elde edilebilen ultra ince kriyoseksiyonların kullanılması için uygundur. Nadir yapıları veya olayları taramak için floresan kullanarak ve seçilen ROI'leri EM ile ilişkilendirerek, EM çalışma süresi ve ilgili maliyetler büyük ölçüde azaltılabilir. Yöntemin duyarlılığı ve fizibilitesi, tedavi edilmemiş, aç bırakılmış hücrelerde LC3'ün görselleştirilmesiyle gösterilir ve LC3'ün bu koşullarda ağırlıklı olarak otofagozomlarla ilişkili olduğunu ve otolizozomlarda çok düşük seviyelerin görülebildiğini gösterir.
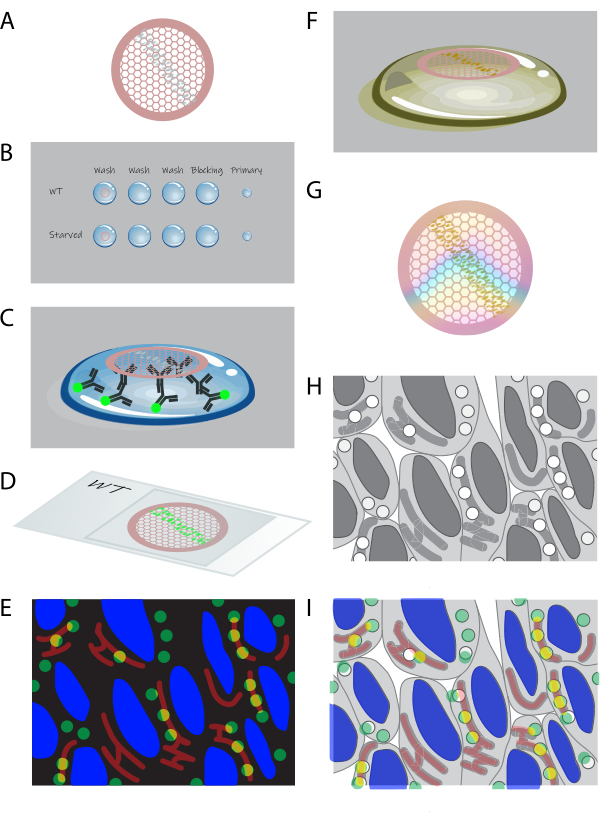
Şekil 1: Kesit CLEM'e şematik genel bakış . (A) Jelatin gömülü hücrelerden kriyoseksiyonlar, formvar kaplı bir bakır ızgara üzerinde toplanır. (B) Izgaralar, uygun çözeltilerin damlacıkları üzerinde bölümlere kadar işlenir. (C) Izgaralar birincil ve floresan ikincil antikorlarla etiketlenmiştir. (D) Izgaralar, %50 gliserolde bir lamel ile cam slayt arasına sıkıştırılır. (E) Floresan görüntüler geniş alan mikroskobunda toplanır. (F) Izgaralar cam slayttan alınır ve EM için uranil boyama ile daha fazla işlenir. (G) Kuruduktan sonra ızgaralar TEM ile görüntülenebilir. (H) Yüksek büyütmeli TEM görüntü döşeme kümesi, floresan verilerinden seçilen bir alandan elde edilir. (I) Floresan mikroskobu ve EM'den alınan görüntüler ilişkilendirilir ve üst üste bindirilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
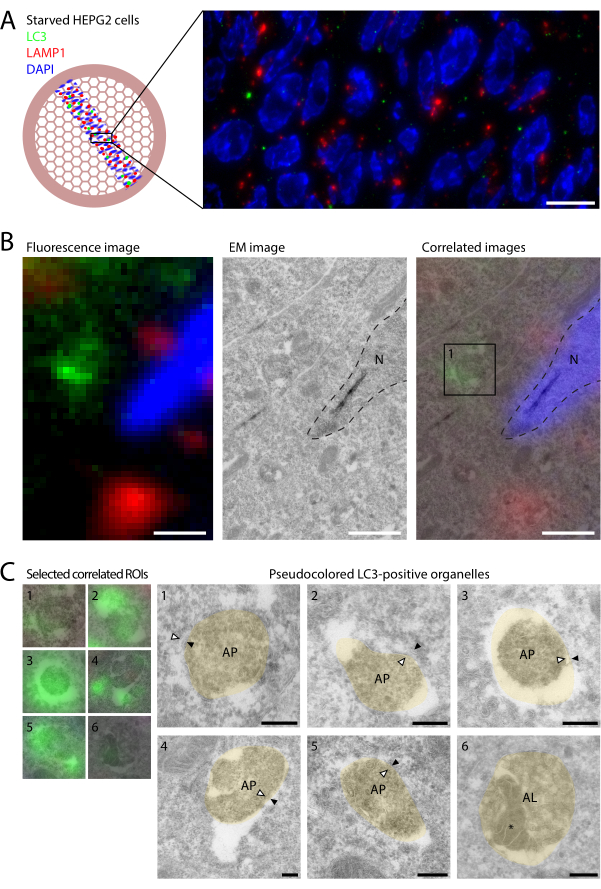
Şekil 2: Aç bırakılmış HEPG2 hücrelerinde LC3 ve LAMP1'in CLEM'i. HEPG2 hücreleri, fiksasyondan önce EBSS'de 2 saat boyunca aç bırakıldı ve 2 saat boyunca% 4 PFA ile (A) Kesitlerde LC3 (yeşil) ve LAMP1'in (kırmızı) görüntülenmesi, nispeten az LC3 punkta ve LAMP1 ile çok az kolokalizasyon ortaya koyuyor. (B) DAPI ve nükleer ana hatlara (kesikli çizgiler, sağ panel) dayalı iki görüntüleme modalitesinin üst üste bindirilmesiyle IF'den (sol panel) elde edilen ultrastrüktürel bilgilere (sol panel) moleküler bilgilerin bağlanması. Kutu 1'de (sağ panel) örneklendiği gibi, ayrı LC3 etiketli bölmelerin üst yapısı C'de gösterilmiştir. (C) LC3-pozitif bölmelerin üst yapısı. CLEM görüntüleri solda ve psödorenkli (bej) EM görüntüleri sağda gösterilmiştir (renklendirilmemiş EM görüntüleri Ek Şekil S1'de gösterilmiştir). İç ve dış otofagozomal membranlar sırasıyla beyaz ve siyah ok uçlarıyla gösterilir. Örnek 6'daki otolizozom içindeki otofajik içerik * ile gösterilir. Ölçek çubukları = 10 μm (A), 1 μm (B), 200 nm (C). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Ek Şekil S1: LC3 pozitif organellerin renksiz EM görüntüleri. (A-F) Şekil 2C'de gösterilen psödorenkli örnekler 1-6'nın renklendirilmemiş EM görüntüleri. Organeller, Şekil 2'de tarif edildiği gibi LC3 floresansı ile seçildi. İç ve dış otofagozomal membranlar sırasıyla beyaz ve siyah ok uçlarıyla gösterilir. Örnek 6'daki otolizozom içindeki otofajik içerik * ile gösterilir. Ölçek çubukları = 200 nm. Kısaltmalar: AL = otolizozom; AP = otofagozom; M = mitokondri. Bu Dosyayı indirmek için lütfen buraya tıklayın.
Ek Dosya 1: Bu çalışmada kullanılan tamponlar ve çözeltiler. Bu ek dosya, bu çalışmada kullanılan tamponları ve çözeltileri yapmak için gereken tarifleri ve protokolleri içerir. Bu Dosyayı indirmek için lütfen buraya tıklayın.
Tartışmalar
Burada sunulan yöntem, kriyoseksiyon tabanlı kesit CLEM'deki son gelişmelerden yararlanır - IF etiketlemesinin yüksek hassasiyeti ve FM ile EM 14,24 arasındaki doğru (<100 nm hata) korelasyon. Bu, kıt, endojen proteinleri floresan olarak etiketleme hassasiyetine ve bunu EM üst yapısına yüksek hassasiyetle yerleştirme yeteneğine sahip bir yöntemle sonuçlanır. Bu nedenle, bu yöntem, eksojen olarak etiketlenmiş proteinlerin (aşırı) ekspresyonu ve daha az hassas EM etiketlerinin kullanılması ihtiyacını ortadan kaldırır. Yöntemin fizibilitesi, lizozomal inhibitörler kullanılmadan, aç hücrelerde endojen LC3 üzerindeki CLEM örnekleri ile gösterilmiştir.
Tokuyasu yöntemi ile elde edilen çözülmüş kriyokesitler, reçine bölümlerinden farklı olarak antikorlar için geçirgen olduklarından, immüno-EM için ideal örneklerdir. Hafif fiksasyon ve kontrast prosedürleri ile birleştiğinde, bu genellikle ayrıntılı üst yapıdan ödün vermeden diğer yöntemlere göre üstün etiketleme verimliliği sağlar ve hücresel membranlarımükemmel bir şekilde görselleştirir 12,25,26. Ayrıca, kriyoseksiyonlar floresan mikroskobu ile oldukça uyumludur ve bu da onları CLEM için değerli substratlar haline getirir. Hem klasik immünogold etiketleme hem de kriyoseksiyonlarda CLEM, hücre altı organizasyonuanlamada ufuk açıcı bilgiler sağlamıştır 14,27,28,29,30.
Şu anda, CLEM'in çözülmüş kriyoseksiyonlar üzerindeki uygulamaları, yaklaşımın kalitesini, uygulanabilirliğini ve doğruluğunu iyileştirensürekli geliştirmeler ve optimizasyonlar 14,20,24,31,32,33,34 sonucunda daha yaygın hale gelmektedir. Şimdi, büyük IF ve EM görüntü döşeme setlerinin doğru korelasyonu ile teknik, floresan etiketli endojen hücresel bileşenlerinüst yapısının taranmasını kolaylaştırır 14,32,33. Bu, altın etiketli yapıların aranmasının tipik olarak yüksek büyütme gerektirdiği ve bu nedenle daha zahmetli ve zaman yoğun olduğu klasik immüno-EM'ye göre bir avantajdır. Bu nedenle, LC3'ün üst yapıya lokalizasyonu CLEM'den büyük ölçüde yararlanır. LC3 pozitif organeller, otofajik klerens bloke edildiğinde (yani, hücreler BafA1 veya pH yükseltici ajanlarla tedavi edildiğinde) yaygındır, oysa otofajik organeller, değiştirilmemiş veya aç bırakılmış hücrelerde hızla temizlenir ve bu da çok düşük kararlı durum seviyelerine neden olur. Bu gibi durumlarda, klasik immüno-EM kullanarak LC3 etiketli organelleri bulmak zor olabilir ve CLEM açık bir avantaj sunar.
Daha önce, LC3-GFP'nin ektopik ekspresyonu veya bir LC3-GFP-RFP tandem probu 35,36,37,38,39 kullanılarak yapılan çalışmalarda reçine kesitleri üzerinde CLEM uygulanmıştır. Bu çalışmalarda, gömme işleminden önce veya doğrudan akrilik reçine bölümlerine40 floresan görüntüleme yapıldı ve numuneler daha sonra EM ile tarandı. Reçine gömmenin çeşitli avantajları vardır; Otofagozomal üst yapı, özellikle malzeme yüksek basınçlı donmuş40 ise, genellikle iyi korunur. Ayrıca, ağır metal lekeli reçine gömülü malzemenin kontrastı genellikle uranil lekeli kriyoseksiyonlardan daha belirgindir. Reçineye gömülü kesitler, dizi tomografisi, FIB-SEM veya seri blok yüzeyli SEM gibi hacimsel EM yöntemleriyle uyumludur, ancak kriyoseksiyonlar uyumlu değildir. Gömmeden önce görüntüleme yapan yaklaşımlarda, canlı hücre görüntüleme, kriyoseksiyonlarda CLEM'de bulunmayan bir seçenek41'dir. Kriyoseksiyonlarda CLEM'in bu alternatiflere göre en önemli avantajı, membran geçirgenliğine veya aşırı ekspresyona gerek kalmadan nadir proteinlerin immüno-lokalizasyonuna izin veren yüksek IF sinyalidir. Bu, potansiyel membran ekstraksiyonunu, aşırı ekspresyon artefaktlarını42 ve deneğin genetik modifikasyonunu önler, bu da IF ve EM'deki geniş alanları ilişkilendirme olasılığı ile birleştiğinde, onu LC3 ve otofajiyi incelemek için mükemmel bir araç haline getirir.
Burada, kesit içi HEPG2 hücrelerine CLEM uygulaması, LC3'ün ağırlıklı olarak otofagozom olarak tanımlanan yapılara lokalize olduğunu ortaya çıkardı. Ek olarak, otolizozomlarda birkaç zayıf floresan nokta bulundu. Bu, BafA19 ile tedavi edilen hücrelerin tam tersidir ve otofagozom lizozomlarla birleştiğinde otofagozomal proteinlerin hızlı bozunmasını yansıtır. Genel olarak, veriler, çözülmüş kriyoseksiyonların CLEM'inin doğal koşullarda LC3 aracılı otofaji hakkında bilgi sağlayabileceğini göstermiştir. Veriler aynı zamanda teknolojinin hassasiyetini de vurgulamaktadır, çünkü LC3 sadece düşük seviyelerde bozulmamış LC3 epitopları içeren otolizozomlarda bile tespit edilmiştir. LC3'ü farklı model ve koşullarda görüntüleyerek bu tekniğin daha fazla uygulanması, otofaji ve LC3 ile ilişkili fagositoz veya ATG8'in tek zarlara konjugasyonu gibi diğer LC3 aracılı biyolojik süreçler hakkındaki anlayışımızı geliştirecektir.
Otofajinin ötesinde, kesit CLEM, hücre bölünmesi, enfeksiyon, dokulardaki nadir hücre tipleri, kinetokorlar, primer kirpikler veya hücre tipine özgü organeller gibi diğer nadir olaylara veya yapılara uygulanabilir. IF tarafından ilgilenilen konu için etkili bir tarama, bu nadirliklerin ultrastrüktürel çalışmasını büyük ölçüde kolaylaştırabilir. Ayrıca, tekniğin proteinleri klasik immüno-EM'den daha hassas bir şekilde lokalize etmek için kullanılabileceğigösterilmiştir 14 . Fiksasyon uzunluğunun ayarlanması, bu hassasiyeti daha da genişletebilir ve çok düşük miktarda bulunan veya zayıf antijenik proteinlerin ultrastrüktürel lokalizasyonuna izin verebilir. Son olarak, kesit CLEM yöntemi, belirli bir proteinin ultrastrüktürel dağılımının daha sağlam bir analizini kolaylaştırarak, kantitatif sayıda organelin hızlı seçimini kolaylaştırır.
Kriyoseksiyonlarda CLEM, kriyoseksiyon için ekipman ve uzmanlık gerektirir. Bu araçlara erişimi olan gruplarda (örneğin, kriyomikrotomlar), kesit içi CLEM'in uygulanması basittir ve yalnızca çoğu laboratuvarın erişebildiği bir kurulum olan otomatik bir geniş alan mikroskobunun kullanılabilirliğini gerektirir. Ayrıca, yöntem dünya çapındaki EM tesislerinde mevcuttur. Kesit üstü CLEM, yerleşik IF ve EM yöntemlerinin uygulanmasını birleştirdiğinden, yöntem kolayca uyarlanır ve örneğin tomografi 20,33,43, sınırlı sayıda bölüm44'ün seri kesit hacmi EM veya süper çözünürlüklü mikroskopi 45 ile birleştirilebilir. Yöntemin bu çok yönlülüğü, çok çeşitli biyolojik sorulara yönelik uygulamaları destekler.
Açıklamalar
Yazarlar herhangi bir çıkar çatışması olmadığını beyan ederler.
Teşekkürler
Utrecht Üniversitesi Tıp Merkezi Moleküler Tıp Merkezi'ndeki meslektaşlarımıza verimli tartışmalar ve geri bildirimler için teşekkür ederiz. Mikroskopi teknolojilerimizde sürekli iyileştirmeler yaptıkları için Klumperman laboratuvarının geçmiş ve şimdiki meslektaşlarına teşekkür ederiz. Bu çalışma için kullanılan EM altyapısı, Hollanda Araştırma Konseyi (NWO) tarafından finanse edilen Büyük Ölçekli Araştırma Altyapısı için Ulusal Yol Haritası (NEMI) araştırma programının bir parçasıdır, proje numarası 184.034.014 JK'dır.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Chemicals and reagents | |||
| Antibody donkey anti-mouse Alexa Fluor 488 | Life Technologies | #A21202 | use 1:250 |
| Antibody donkey anti-rabbit Alexa Fluor 568 | Life Technologies | A#10042 | use 1:250 |
| Antibody mouse anti-LC3 | Cosmo Bio | CTB-LC3-2-IC | use 1:100 |
| Antibody rabbit anti-LAMP1 | Cell Signaling | 9091 | use 1:250 |
| Bovine serum Albumin, fraction V | Sigma-Aldrich | A-9647 | |
| BSA-c | Aurion | 900.099 | |
| BSA-conjugated gold | Cell Microscopy Core, UMC Utrecht | BSAG 5 nm | |
| Water-free Chloroform | Merck | 1.02447.0500 | |
| DAPI | Invitrogen | 10184322 | Use at end concentration of 10 µg/ml |
| EGTA | Sigma-Aldrich | E4378 | |
| Fish-skin Gelatin | Sigma-Aldrich | G7765 | |
| Food-grade gelatin | Merck | G1890 | |
| Formvar, Vinylec E | SPI | 02492-RA | |
| Gluteraldehyde | Serva | 23115.01 | See CAUTION note |
| Glycerol | Boom | MBAK 7044.1000 | |
| Glycine | Merck | 1042010250 | |
| HEPES | Sigma-Aldrich | H3375 | |
| Methylcellulose, 25 centipoises | Sigma-Aldrich | M-6385 | |
| MgSO4 | Riedel-de Haen | 12142 | |
| Na2HPO4 (PB component A) | Merck | 106580-0500 | |
| NaBH4 | Merck | 806373 | |
| NaH2PO4 (PB component B) | Merck | 106346 | |
| NH4OH | Sigma-Aldrich | 221228-0025 | |
| Oxalic acid | Merck | 100495 | |
| Paraformaldehyde prills | Sigma-Aldrich | 441244 | See CAUTION note |
| PIPES | Merck | 110220 | |
| Protein-A conjugated gold | Cell Microscopy Core, UMC Utrecht | PAG 5, 10, 15 or 20 nm | |
| Sucrose D(+) | VWR | 27483294 | |
| Uranyl acetate | SPI | 020624-AB | See CAUTION note |
| Tools and consumables | |||
| Pick-up loop | Electron Microscopy Sciences | 70944 | |
| Filter paper, qualitative, medium-fast | LLG | 6.242 668 | |
| Finder grids | Ted Pella | G100F1 | |
| Grids | Cell Microscopy Core, UMC Utrecht | CU 100 mesh | |
| Microscopes | |||
| Leica Thunder widefield microscope | Leica | Components: 100x, 1.47 NA TIRF objective; Photometrics prime 95B sCMOS camera; LAS X software; | |
| Leica UC7 ultracryomicrotome | Leica | ||
| Tecnai T12 | FEI | Components: Veleta VEL-FEI-TEC12-TEM camera; SerialEM software | |
| Software | |||
| ec-CLEM in icy | open source | Paul-Gilloteaux et al., 2017 | |
| Fiji | open source | Schindelin et al., 2012 | |
| IMOD | open source | Mastronarde et al., 2017 | |
| Photoshop | Adobe | ||
| SerialEM | open source | Mastronarde et al., 2018 |
Referanslar
- Hu, Y., Reggiori, F. Molecular regulation of autophagosome formation. Biochemical Society Transactions. 50 (1), 55-69 (2022).
- Reggiori, F., Ungermann, C. Autophagosome maturation and fusion. Journal of Molecular Biology. 429 (4), 486-496 (2017).
- Kimura, S., Noda, T., Yoshimori, T. Dissection of the autophagosome maturation process by a novel reporter protein, tandem fluorescent-tagged LC3. Autophagy. 3 (5), 452-460 (2007).
- Baba, M., Takeshige, K., Baba, N., Ohsumi, Y. Ultrastructural analysis of the autophagic process in yeast: detection of autophagosomes and their characterization. The Journal of Cell Biology. 124 (6), 903-913 (1994).
- Takeshige, K., Baba, M., Tsuboi, S., Noda, T., Ohsumi, Y. Autophagy in yeast demonstrated with proteinase-deficient mutants and conditions for its induction. The Journal of Cell Biology. 119 (2), 301-311 (1992).
- De Duve, C., Wattiaux, R. Functions of lysosomes. Annual Review of Physiology. 28, 435-492 (1966).
- Arstila, A. U., Trump, B. F. Studies on cellular autophagocytosis. The formation of autophagic vacuoles in the liver after glucagon administration. The American Journal of Pathology. 53 (5), 687-733 (1968).
- Eskelinen, E. L., Reggiori, F., Baba, M., Kovács, A. L., Seglen, P. O. Seeing is believing: The impact of electron microscopy on autophagy research. Autophagy. 7 (9), 935-956 (2011).
- De Mazière, A., et al. An optimized protocol for immuno-electron microscopy of endogenous LC3. Autophagy. 18 (12), 3004-3022 (2022).
- López-Terrada, D., Cheung, S. W., Finegold, M. J., Knowles, B. B. Hep G2 is a hepatoblastoma-derived cell line. Human Pathology. 40 (10), 1512-1515 (2009).
- Tanida, I., Minematsu-Ikeguchi, N., Ueno, T., Kominami, E. Lysosomal turnover, but not a cellular level, of endogenous LC3 is a marker for autophagy. Autophagy. 1 (2), 84-91 (2005).
- Slot, J. W., Geuze, H. J. Cryosectioning and immunolabeling. Nature Protocols. 2 (10), 2480-2491 (2007).
- Waterman-Storer, C. M. Microtubule/organelle motility assays. Current Protocols in Cell Biology. 13 (1), (2001).
- vander Beek, J., de Heus, C., Liv, N., Klumperman, J. Quantitative correlative microscopy reveals the ultrastructural distribution of endogenous endosomal proteins. The Journal of Cell Biology. 221 (1), e202106044 (2022).
- Mastronarde, D. N. Advanced data acquisition from electron microscopes with SerialEM. Microscopy and Microanalysis. 24, 864-865 (2018).
- Mastronarde, D. N., Held, S. R. Automated tilt series alignment and tomographic reconstruction in IMOD. Journal of Structural Biology. 197 (2), 102-113 (2017).
- Schindelin, J., et al. Fiji: An open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Paul-Gilloteaux, P., et al. EC-CLEM: Flexible multidimensional registration software for correlative microscopies. Nature Methods. 14 (2), 102-103 (2017).
- Heiligenstein, X., Paul-Gilloteaux, P., Raposo, G., Salamero, J. eC-CLEM: A multidimension, multimodel software to correlate intermodal images with a focus on light and electron microscopy. Methods in Cell Biology. 140, 335-352 (2017).
- Fermie, J., et al. Bimodal endocytic probe for three-dimensional correlative light and electron microscopy. Cell Reports Methods. 2 (5), 100220 (2022).
- Fokkema, J., et al. Fluorescently labelled silica coated gold nanoparticles as fiducial markers for correlative light and electron microscopy. Scientific Reports. 8 (1), 13625 (2018).
- Czaja, M. J., et al. Functions of autophagy in normal and diseased liver. Autophagy. 9 (8), 1131 (2013).
- Robinson, J. M., Takizawa, T., Pombo, A., Cook, P. R. Correlative fluorescence and electron microscopy on ultrathin cryosections: Bridging the resolution gap. Journal of Histochemistry and Cytochemistry. 49 (7), 803-808 (2001).
- Mohammadian, S., et al. High accuracy, fiducial marker-based image registration of correlative microscopy images. Scientific Reports. 9 (1), 3211 (2019).
- Tokuyasu, K. T. A study of positive staining of ultrathin frozen sections. Journal of Ultrasructure Research. 63 (3), 287-307 (1978).
- Slot, J. W., Geuze, H. J. A new method of preparing gold probes for multiple-labeling cytochemistry. European Journal of Cell Biology. 38 (1), 87-93 (1985).
- Klumperman, J., Raposo, G. The complex ultrastructure of the endolysosomal system. Cold Spring Harbor Perspectives in Biology. 6 (10), a016857 (2014).
- Geuze, H. J., Slot, J. W., Strous, G. J., Lodish, H. F., Schwartz, A. L. Intracellular site of asialoglycoprotein receptor-ligand uncoupling: Double-label immunoelectron microscopy during receptor-mediated endocytosis. Cell. 32 (1), 277-287 (1983).
- Biazik, J., Ylä-Anttila, P., Vihinen, H., Jokitalo, E., Eskelinen, E. L. Ultrastructural relationship of the phagophore with surrounding organelles. Autophagy. 11 (3), 439-451 (2015).
- Fahimi, H. D., Reich, D., Völkl, A., Baumgart, E. Contributions of the immunogold technique to investigation of the biology of peroxisomes. Histochemistry and Cell Biology. 106 (1), 105-114 (1996).
- Vicidomini, G., et al. A novel approach for correlative light electron microscopy analysis. Microscopy Research and Technique. 73 (3), 215-224 (2010).
- Vicidomini, G., et al. High data output and automated 3D correlative light-electron microscopy method. Traffic. 9 (11), 1828-1838 (2008).
- Cortese, K., et al. 3D HDO-CLEM: cellular compartment analysis by correlative light-electron microscopy on cryosection. Methods in Cell Biology. 111, 95-115 (2012).
- van Rijnsoever, C., Oorschot, V., Klumperman, J. Correlative light-electron microscopy (CLEM) combining live-cell imaging and immunolabeling of ultrathin cryosections. Nature Methods. 5 (11), 973-980 (2008).
- Razi, M., Chan, E. Y. W., Tooze, S. A. Early endosomes and endosomal coatomer are required for autophagy. The Journal of Cell Biology. 185 (2), 305-321 (2009).
- Ligeon, L. A., Barois, N., Werkmeister, E., Bongiovanni, A., Lafont, F. Structured illumination microscopy and correlative microscopy to study autophagy. Methods. 75, 61-68 (2015).
- Biazik, J., Vihinen, H., Anwar, T., Jokitalo, E., Eskelinen, E. L. The versatile electron microscope: An ultrastructural overview of autophagy. Methods. 75, 44-53 (2015).
- Gudmundsson, S., Kahlhofer, J., Baylac, N., Kallio, K., Eskelinen, E. L. Correlative light and electron microscopy of autophagosomes. Methods in Molecular Biology. 1880, 199-209 (2019).
- Kriel, J., et al. Correlative light and electron microscopy (CLEM): bringing together the best of both worlds to study neuronal autophagy. Imaging and Quantifying Neuronal Autophagy. 171, 135-147 (2022).
- Largeau, C., Legouis, R. Correlative light and electron microscopy to analyze LC3 proteins in Caenorhabditis elegans embryo. Methods in Molecular Biology. 1880, 281-293 (2019).
- Fermie, J., et al. Single organelle dynamics linked to 3D structure by correlative live-cell imaging and 3D electron microscopy. Traffic. 19 (5), 354-369 (2018).
- Kuma, A., Matsui, M., Mizushima, N. LC3, an autophagosome marker, can be incorporated into protein aggregates independent of autophagy: Caution in the interpretation of LC3 localization. Autophagy. 3 (4), 323-328 (2007).
- Ladinsky, M. S., Howell, K. E. Electron tomography of immunolabeled cryosections. Methods in Cell Biology. 79, 543-558 (2007).
- Oorschot, V., Lindsey, B. W., Kaslin, J., Ramm, G. TEM, SEM, and STEM-based immuno-CLEM workflows offer complementary advantages. Scientific Reports. 11 (1), 899 (2021).
- Franke, C., et al. Correlative single-molecule localization microscopy and electron tomography reveals endosome nanoscale domains. Traffic. 20 (8), 601-617 (2019).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır