İzole Fare Beyni Mikrogliasında İntranükleer Akış Sitometrisi Kullanılarak Global Histon Post Translasyonel Modifikasyonların Miktar Tayini
Bu Makalede
Özet
Bu çalışma, izole beyin mikrogliasında intranükleer akış sitometrisi kullanılarak küresel histon modifikasyonlarının ölçülmesi için bir protokolü açıklamaktadır. Çalışma ayrıca veri toplama için kullanılan mikroglia izolasyon protokolünü de içermektedir.
Özet
Gen ekspresyon kontrolü, kısmen, histon kuyruklarına posttranslasyonel modifikasyonların eklenmesi ve çıkarılması dahil olmak üzere kromatin yapısındaki modifikasyonlarla gerçekleşir. Histon translasyon sonrası modifikasyonlar (HPTM'ler), gen ekspresyonunu veya baskılanmasını kolaylaştırabilir. Örneğin, histon kuyruğu lizin kalıntılarının asetilasyonu, pozitif yükü nötralize eder ve kuyruk ile negatif yüklü DNA arasındaki etkileşimleri azaltır. Histon kuyruk-DNA etkileşimlerindeki azalma, altta yatan DNA'nın erişilebilirliğinin artmasına neden olarak transkripsiyon faktörü erişiminin artmasına izin verir. Asetilasyon işareti ayrıca bromodomain içeren transkripsiyonel aktivatörler için bir tanıma bölgesi görevi görür ve birlikte gelişmiş gen ekspresyonu ile sonuçlanır. Histon işaretleri, hücre farklılaşması sırasında ve farklı hücresel ortamlara ve uyaranlara yanıt olarak dinamik olarak düzenlenebilir. Yeni nesil dizileme yaklaşımları, bireysel histon modifikasyonları için genomik konumları karakterize etmeye başlamış olsa da, aynı anda sadece bir modifikasyon incelenebilir. Yüzlerce farklı HPTM olduğu göz önüne alındığında, daha kapsamlı genom dizileme yaklaşımları gerçekleştirmeden önce histon modifikasyonlarını taramak için kullanılabilecek yüksek verimli, nicel bir küresel HPTM ölçüsü geliştirdik. Bu protokol, global HPTM'leri tespit etmek için akış sitometrisi tabanlı bir yöntemi tanımlar ve kültürdeki hücreler veya in vivo dokulardan izole edilmiş hücreler kullanılarak gerçekleştirilebilir. Bakteri kaynaklı bir bağışıklık uyaranına (lipopolisakkarit) yanıt olarak HPTM'lerdeki küresel kaymaları tespit etmek için testin duyarlılığını göstermek için izole fare beyni mikrogliasından örnek veriler sunuyoruz. Bu protokol, HPTM'lerin hızlı ve kantitatif değerlendirmesine izin verir ve bir antikor tarafından tespit edilebilen herhangi bir transkripsiyonel veya epigenetik düzenleyiciye uygulanabilir.
Giriş
Epigenetik, altta yatan DNA dizisini değiştirmeden gen ekspresyonunu düzenleyen mekanizmaların incelenmesidir. Gen ekspresyonunun epigenetik regülasyonu hücreler içinde dinamiktir ve çeşitli çevresel uyaranlara hızlı ve koordineli tepkilere izin verebilir. Dinamik düzenleme kısmen, DNA1 tarafından sıkıca sarılmış bir oktamer çekirdeğe monte edilmiş histon proteinlerinden (H2A, H2B, H3, H4) oluşan nükleozom seviyesindeki kromatin yapısındaki değişiklikler nedeniyle meydana gelir. Histon proteinleri ve DNA arasındaki etkileşimler, DNA'nın transkripsiyon mekanizmasına erişilebilirliğini kontrol edebilir, bu da sonuçta gen ekspresyonunu ve kromatin biyolojisinin diğer yönlerini kontrol edebilir2. Histon proteinleri, negatif yüklü DNA omurgası ile elektrostatik etkileşimler oluşturan pozitif yüklü kalıntılara sahip yapılandırılmamış kuyruklara sahiptir. Bu etkileşimler, DNA'nın sıkı bir şekilde paketlenmesine ve DNA erişilebilirliğinin azalmasına neden olur. Histon kuyruklarında histon sonrası translasyonel modifikasyonlar (HPTM'ler) olarak adlandırılan kovalent modifikasyonlar, bu etkileşimleri düzenleyebilir 3,4. En iyi karakterize edilmiş HPTM'lerden bazıları, histon kuyrukları ve DNA arasındaki elektrostatik etkileşimlerin afinitesini değiştirebilen, altta yatan DNA'ya farklı erişilebilirlik ve bu HPTM'leri belirli bölgelerde tanıyan transkripsiyon faktörlerinin işe alınmasına neden olan histon kuyruğu asetilasyonu ve metilasyonunu içerir. HPTM'ler, HPTM'leri kaldıran okuyucular, biriktiren yazarlar ve silgiler olarak adlandırılan üç önemli enzim sınıfı tarafından düzenlenir. Bu nedenle, okuyucu, yazıcı veya silgi enzimlerinin işe alınması veya çözülmesi, nihayetinde HPTM'lerin manzarasını değiştirebilir ve kromatinin yapısını ve işlevini yönetebilir, bu da hücresel biyolojiyi ve işlevi anlamak için bunların düzenlenmesini ve okunmasını gerekli kılar 3,4.
Merkezi sinir sistemindeki (CNS) hücreler, çevresel uyaranlara uyum sağlamak için transkriptomlarını değiştirdikleri için epigenetik olarak esnektir. Biriken kanıtlar, DNA metilasyonu, kodlamayan RNA'lar ve HPTM'ler gibi epigenomdaki değişikliklerin hafıza oluşumunda ve sinaptik fonksiyonda önemli bir rol oynadığını göstermektedir5. İlgili okuyucuların, yazarların veya silgilerin manipülasyonu yoluyla HPTM dinamiklerini bozmak, ilişkisel öğrenmeyi ve uzun vadeli güçlendirmeyi engelleyebilir veya geliştirebilir 6,7,8. CNS'nin yerleşik bağışıklık hücresi olan mikroglia, epigenomlarındaki dinamik değişiklikler yoluyla bağışıklık stimülasyonuna yanıt olarak transkriptomlarını hızla düzenler 9,10,11. Çalışmalar, mikroglia'nın epigenomunun ve transkriptomunun, beyin ortamından çıkarıldıktan sonra kültür ortamında sadece birkaç saat sonra değiştiğini gösterdiğinden, yerel beyin ortamlarına bu yüksek düzeyde adaptasyon, onları izole bir bağlamda incelemeyi zorlaştırmaktadır11. Ek olarak, mikroglia beyin hücrelerinin sadece %10'unu oluşturduğundan, tüm doku seviyesindeki değişiklikleri inceleyen ölçümler duyarlılık ve özgüllükten yoksundur12,13. Sonuç olarak, HPTM seviyeleri, ex vivo gibi epigenetik değişiklikleri incelemek için mikroglia'nın hızla izole edilmesi gerekir.
HPTM'leri incelemek için yaygın olarak kullanılan yöntemler arasında kromatin-immünopresipitasyon dizilemesi (ChIP-seq) ve hedefler altında bölünme ve etiketleme dizilimi (CUT & Tag-seq) bulunur4. Bu teknikler bireysel bir HPTM'ye oldukça spesifik olsa ve belirli bir genomik bağlamda HPTM'lerin varlığını bildirebilse de, tek bir deneyde birçok olası HPTM'den yalnızca birini inceleyebilirler11,14 Bu nedenle, önemli bir zaman ve para yatırımı gerektiren bu tür deneylere geçmeden önce, küresel olarak yapılan değişiklikleri inceleyerek daha fazla araştırma için potansiyel olarak ilginç HPTM'lerin listesini daraltmak son derece değerlidir. HPTM seviyeleri. Global HPTM düzeylerini incelemek için iki ana yaklaşım immünohistokimya ve western blot analizidir, ancak her iki yaklaşım da yalnızca yarı kantitatiftir, düşük verimlidir ve çok sayıda doku kesiti veya izole hücre gerektirir 15,16. Böylece, global HPTM düzeylerini hızlı ve tek hücre düzeyinde incelemek için kullanılabilecek son derece hassas, kantitatif bir yöntem geliştirmeyi amaçladık.
Sunulan protokol, intranükleer akış sitometrisi kullanılarak küresel HPTM seviyelerinin hızlı bir şekilde tespit edilmesini sağlar. Kanser hücrelerinde yapılan önceki çalışmalar, küresel düzeylerin klinik bir bakış açısıyla incelenmesinin önemini haklı çıkarmıştır17,18. İlgilenilen spesifik HPTM'lerin genomik konumunu değerlendirmeden önce global düzeyleri bir tarama yöntemi olarak kullanan çalışmalar da yaygındır19,20. Mikroglia için, düşük hücre verimi nedeniyle izolasyonu takiben küresel seviyeleri değerlendirmek zordur; Pan ve arkadaşları, western blot19 ile protein seviyesinin saptanmasını sağlamak için üç hayvandan alınan mikrogliaların bir araya getirildiği izole mikrogliadan küresel HPTM seviyelerini sunar. Protokolümüzü kullanarak, çok daha düşük hücre girdileri ile küresel değişiklikleri tespit edebiliyoruz, hayvan başına birden fazla işaretin taranmasını sağlıyoruz ve numuneleri havuzlama ihtiyacını ortadan kaldırıyoruz.
Burada, izole mikroglialarda kantitatif intranükleer akış sitometrisi yoluyla HPTM seviyelerini hızlı bir şekilde tespit etmek için bir protokol açıklıyoruz. Kısalık uğruna özellikle HPTM miktar tayinine odaklanırken, bu protokol okuyucu, yazar ve silgi enzimlerinin küresel seviyelerini ölçmek için aynı şekilde kullanılabilir. Protokol iki kısımda sunulur: birincisi, mikroglia için izolasyon yöntemi ve ikincisi, HPTM seviyelerini belirlemek için akış sitometrisi tabanlı yöntem. İzolasyon yöntemi, aynı numuneden gen ekspresyonu ve HPTM seviyelerinin değerlendirilmesine izin veren hem RNA izolasyonu hem de HPTM seviyesi değerlendirmesi için kullanılabilecek hücreler verir. Ek olarak, HPTM değerlendirme yöntemi, protokolde belirtildiği gibi diğer hücre tiplerinde de kullanılabilir.
Protokol
Tüm hayvan bakım protokolleri, Kanada Hayvan Bakımı Konseyi yönergelerine uygun olarak British Columbia Üniversitesi Hayvan Bakım Komitesi tarafından onaylanmıştır.
1. Mikroglia izolasyonu için beyin sindirimi
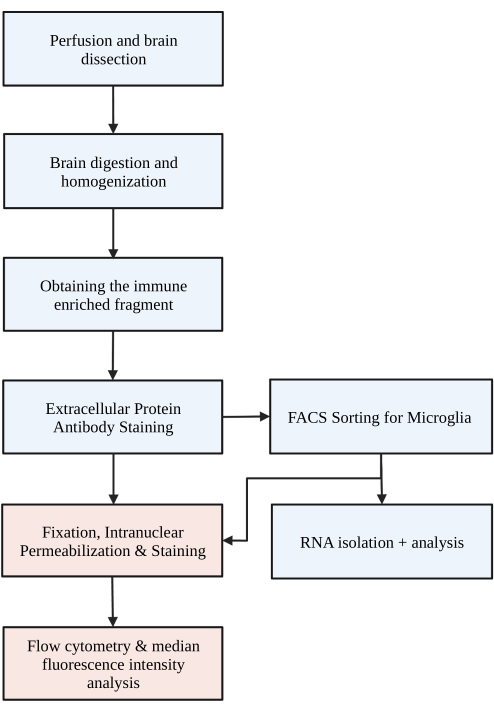
Şekil 1: Protokolün basit akış şeması. Fareler önce HBSS ile transkardiyal olarak perfüze edilir ve beyin diseke edilir. Beyin daha sonra tek bir hücre homojenatı ile sonuçlanmak için kimyasal sindirim ve mekanik bozulma yoluyla ayrışır. Bağışıklıkla zenginleştirilmiş fraksiyon, süreksiz yoğunluk gradyanı yoluyla toplanır, ardından hücreler P2RY12 için boyanır. Boyanmış hücreler ya 1) RNA analizine ya da aşağı akış protein analizine yol açmak için floresan aktif hücre sınıflandırması (FACS) yoluyla sıralanır ve/veya 2) intranükleer proteinler için sabitlenir, geçirgen hale getirilir ve boyanır. Protein seviyesi, akış sitometrisi ile belirlenen ilgili kanaldaki medyan floresan yoğunluğu ile ölçülür. Mavi renkli kutular protokol adımının bir parçasıdır 1) Mikroglia izolasyonu için beyin sindirimi. Kırmızı renkli kutular protokol adımının bir parçasıdır 2) Protein ekspresyon analizi için intranükleer akış boyama. BioRender.com ile oluşturuldu. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
- Reaktiflerin hazırlanması
NOT: HPTM analizi için hem RNA hem de hücreleri toplamak üzere bir ekstraksiyon planlıyorsanız, transkripsiyon ve translasyon inhibitörlerini içerecek modifikasyonlar için bölüm 1.7.1'e bakın. Bununla birlikte, hücreler buz üzerinde tutulduğunda büyük ölçüde hareketsiz olduğu için sadece protein sinyalini değerlendiriyorsanız bu gerekli değildir.- Floresanla aktive edilmiş hücre ayırma (FACS) tamponu (numune başına 20 mL): % 2'lik bir BSA çözeltisi oluşturmak için sığır serum albüminini (BSA) 1x Hanks dengeli tuz çözeltisi (HBSS) içinde çözün. EDTA'yı %2 BSA çözeltisi içinde 1 mM'lik nihai konsantrasyona çözün. Filtre, 0,2 μm'lik bir filtre kullanarak sterilize edin ve kullanımdan önce 1 haftaya kadar 4 °C'de saklayın.
- Sindirim tamponu (numune başına 1 mL): HBSS'de bir papain şişesini, 0.5 mM EDTA ile 1 mM L-sistein içinde 20 U / mL'lik bir nihai konsantrasyona yeniden sulandırın. 37 °C'de en az 10 dakika veya dokuyu sindirmeye hazır olana kadar etkinleştirin. Kullanımdan hemen önce, 200 U / mL'lik bir nihai konsantrasyona kadar aktif papain çözeltisine DNaz I ekleyin. Bunu deney gününde hazırlayın ve saklamayın.
- İzotonik yoğunluk gradyan çözeltisi (numune başına 5.5 mL): Soğuk yoğunluk gradyan ortamına 10x HBSS'yi 1x HBSS'lik bir nihai konsantrasyona ekleyin, bu da 1.117 g/mL'lik bir nihai yoğunlukla sonuçlanır. Kullanmadan önce en az 30 saniye karıştırmak için vorteks. Kullanana kadar buzun üzerine koyun.
- %37 yoğunluk gradyan çözeltisi (numune başına 4 mL): 1.043 g/mL nihai yoğunluk ile %37'lik bir nihai konsantrasyon elde etmek için 1x HBSS'ye izotonik yoğunluk gradyanı ekleyin. Katmanlama sırasında görselleştirme için pembe bir çözelti oluşturmak için her mL %37 yoğunluk gradyanı için 20 μL fenol kırmızısı ekleyin. Kullanmadan önce en az 30 saniye vorteksleyin. Kullanana kadar buzun üzerine koyun.
- %70 yoğunluk gradyan çözeltisi (numune başına 2 mL): 1.082 g/mL'lik bir nihai yoğunluk ile %70'lik bir nihai konsantrasyon elde etmek için 1x HBSS'ye izotonik yoğunluk gradyanı ekleyin. Katmanlama sırasında görselleştirme için mavi bir çözelti oluşturmak için her mL %70 yoğunluklu ortam için 5 μL tripan mavisi ekleyin. Kullanmadan önce en az 30 saniye vorteksleyin. Kullanana kadar buzun üzerine koyun.
- Perfüzyon ve beyin diseksiyonu
NOT: Perfüzyon protokolü, fare torakotomisi, transkardiyal perfüzyon ve beynin çıkarılmasının video tasvirini içeren Posel ve ark.21. Burada yetişkin C57BL/6J erkek ve dişi fareler (10-15 haftalık, 20-30 g) kullanıyoruz, ancak bu protokol herhangi bir fare için torakotomi yapmak için kullanılabilir. Tüm hayvan prosedürleri, deneyler yapılmadan önce kurumsal etik kurul tarafından onaylanmalıdır.- Fare anestezisi: Fareleri% 100 oksijen içinde% 4 İzofluran ile cerrahi anestezi düzlemini geçene kadar uyuşturun, bu bir ayak parmağı tutamıyla veya farenin ayağını sıkıca sıkıştırdıktan sonra refleks eksikliği ile doğrulanabilir. Fareyi sırt üstü yatırın ve dört pençesini plastik bir tepsiye eğik olarak yerleştirilmiş cerrahi diseksiyon tahtasına sıkıca sabitleyin ve burnun izofloran burun konisine sabitlendiğinden emin olun. Transferden sonra, devam etmeden önce hayvanın hala cerrahi anestezi düzlemini geçtiğinden emin olun.
- Fare torakotami: Forseps kullanarak karın derisini tutup kaldırın ve inen aort veya altta yatan herhangi bir organa zarar vermeden ksifosi ortaya çıkarmak için deriden ve karın duvarından sığ bir kesi yapın.
- Ksifos'u forseps ile kavrayın ve diyaframı ve karaciğeri ortaya çıkarmak için göğüs kafesinin altında yanal kesiler yapın. İnce makas kullanarak göğüs kafesinin uzunluğu boyunca diyaframdan ve doku makası kullanarak göğüs kafesinden dikkatli sığ kesimler yapın ve kalbi ve akciğerleri transkardiyal perfüzyon için ortaya çıkarmak için sternumu farenin başının yakınındaki cerrahi istasyona sabitleyin.
- Transkardiyal perfüzyon: Bir peristaltik perfüzyon pompası hazırlayın ve borunun bir ucuna 26.5G'lik bir iğne takın. Borunun bir ucunu soğuk 1x HBSS şişesine sokarak ve boruyu 1x HBSS ile tamamen doldurmak için pompayı açarak boruyu prosedür için hazırlayın.
- Kalbi künt forseps ile tutarken, perfüzyon tüpü takılı 26.5G'lik bir iğnenin ucunu kalbin sol karıncığına sokun ve sağ kulakçıkta küçük bir kesi yapın. Fareyi en az 2-4 mL soğuk 15x HBSS ile ~20-1 mL/dk hızında dikkatlice perfüze etmek için perfüzyon pompasını açın.
NOT: Tam bir perfüzyon genellikle karaciğer kanı temizlemeye başladığında ve kalple aynı renge geldiğinde endikedir. - Beyin çıkarma: Doku diseksiyon makası kullanarak farenin kafasını kesin ve kafa derisinde boyundan buruna orta hat kesisi yapın. Kafatasını ortaya çıkarmak için deri kanatlarını yanlara doğru soyun ve kafatasının kuyruk ucundaki fazla doku ve kemikleri diseksiyon makasıyla çıkarın.
- Makasın bir bıçağını kafatasının altına, keskin tarafı kemiğe bakacak şekilde foramen magnumun içine dikkatlice kaydırın ve orta çizgiyi dikkatlice buruna doğru kesin. Diseksiyon makası kullanarak hem kafatasının tabanında hem de burnun yakınında yanal kesimler yapın. İnce forseps kullanarak, kafatası parçalarını kırmak ve beyni ortaya çıkarmak için kafatasını orta hattan dışa doğru canlandırın. Beyni bir spatula ile nazikçe kaldırın ve diseksiyon leke kağıdına yerleştirin.
- Beyin diseksiyonu: Beyni, buzla dolu kapalı bir Petri kabının üzerine 1x HBSS ile ıslatılmış bir parça diseksiyon leke kağıdına yerleştirin. Beyincik çıkarın ve temiz bir tıraş bıçağı kullanarak beyin yarım kürelerini ikiye bölün.
- Hipokampus ve üst üste binen korteksi sağlam tutarken beyin sapını, striatumu ve beyaz maddeyi her yarım küreden çıkarın. İzole korteks ve hipokampal doku içeren hemisferleri 5 mL soğuk 1x HBSS ile 15 mL'lik bir tüpe aktarın ve buz üzerinde tutun.
NOT: Diseksiyonların mümkün olduğunca çabuk yapılması önemlidir, böylece doku dekapitasyon ile diseke edilen dokunun buz üzerine 1x HBSS'ye son yerleştirilmesi arasında en fazla 2 dakika olacak şekilde soğuk kalır. Mikroglia'yı birden fazla hayvandan izole edersek, beyinler, sindirim vb. için tüm hayvan kohortunu işlemeye devam etmeden önce ~ 1 saat boyunca 1x HBSS'de buz üzerinde saklanabilir.
- Beyin sindirimi ve homojenizasyonu
- Mekanik ve kimyasal ayrışma: Her fareden alınan beyin dokusunu ve 1 mL sindirim tamponunu buz üzerindeki ayrı Petri kaplarına yerleştirin. Temiz bir neşter bıçağı kullanarak beyni küçük parçalara (<1 mm) iyice doğrayın.
- Plastik bir transfer pipetinin ucunu kesin ve kıyılmış beyinlerin her birini buz üzerinde 24 oyuklu bir plaka içinde ayrı kuyucuklara dikkatlice aktarın. Plakayı şeffaf esnek filmle örtün ve 30 dakika buz üzerinde inkübe edin.
NOT: Doğru doğrandığında, beyin dokusu iyi kıyılmış sarımsağı andırır. - Dounce homojenizasyonu: Sindirilmiş beyin solüsyonunu her bir kuyucuktan ayrı ayrı 7 mL cam dounce homojenizatörlere aktarın ve her biri 5 mL soğuk FACS tamponu ile doldurulmuş buz üzerinde homojenizatörler. Tek bir hücre süspansiyonu elde edilene kadar her beyni gevşek havaneli (A) ile yaklaşık 30-40 kez hafifçe vurun. A tokmağı ile çırpındıktan sonra, tek hücreli bir süspansiyon sağlamak için sıkı havaneli (B) ile 3-4 kez hafifçe hafifçe vurun.
NOT: Homojenizatörün altındaki dokunun ezilmesini önlemek için tokmağı 3/4'ünden fazla aşağı itmeyin. Nihai çözelti opak ve sütlü olmalıdır.
NOT: Tek bir deneyde birden fazla beyin sindiriliyorsa, beyin sindiriminin FACS tamponuna aktarılmasını zamanlayın, böylece her numune sadece 30 dakika boyunca sindirim tamponunda kalır. Aşırı sindirim, yüzey proteinlerinin bölünmesine neden olarak aşağı akış antikor bağlanmasını ve sinyalini azaltabilir.
- Bağışıklıkla zenginleştirilmiş fragman elde etmek
- Yoğunluk gradyanının oluşturulması: Homojenatı her beyinden ayrı 15 mL polipropilen tüplere aktarın ve %25 yoğunluk gradyanının nihai konsantrasyonunu elde etmek için her biri için 2.125 mL izotonik yoğunluk gradyanı ekleyin ve FACS tamponu ile 8.5 mL'ye ekleyin. İyice karıştırmak için 15 ml'lik tüpleri 20x yavaşça ters çevirin.
- Dar dereceli bir transfer pipeti kullanarak, temiz katmanlar oluşturmaya çok dikkat ederek her tüpe 4 mL %37 yoğunluk gradyanını nazikçe yerleştirin. Transfer pipetlerini değiştirin ve 2 mL %70 yoğunluk gradyanını nazikçe altına yerleştirin (Şekil 2A). 4 °C'ye soğutulmuş bir santrifüje aktarın ve frenleme rampası sıfıra ayarlandığında 20 dakika boyunca 500 x g'de döndürün.
- Bağışıklıkla zenginleştirilmiş parçanın toplanması: Temiz transfer pipetleri kullanarak, temiz bir transfer pipeti kullanarak miyelini 15 mL'lik tüpteki hacmin üstünden nazikçe aspire edin ve atın. Yoğunluk gradyanının üst parçasını bir transfer pipeti kullanarak 15 mL'lik temiz bir polipropilen tüpe dikkatlice toplayın.
- Bağışıklıkla zenginleştirilmiş fragmanı (%70 ve %37 yoğunluk gradyan katmanlarının birleştiği yerin 1,5 mL üstünde ve 1,5 mL altında) 15 mL'lik yeni bir polipropilen tüpe dikkatlice toplayın (Şekil 2B). Yoğunluk gradyan ortamını seyreltmek için bağışıklıkla zenginleştirilmiş numuneye 10 mL FACS tamponu ekleyin ve iyice karıştırmak için tüpü hafifçe 20x ters çevirin.
NOT: Hücreler tüpün kenarlarına yapışma eğiliminde olduğundan, sıvıyı toplarken pipeti tüpün kenarları boyunca yavaşça dolaştırarak toplama adımları sırasında numunedeki tüm hücrelerin toplandığından emin olun. - Yokuş aşağı rampa freni sıfıra ayarlıyken 15 mL'lik tüpleri 4 °C'lik bir santrifüjde 500 x g'de 10 dakika santrifüjleyerek bağışıklıktan zenginleştirilmiş numunedeki hücreleri peletleyin. Sıkmanın hemen sonunda, süpernatanı dikkatlice çıkarın, 15 mL'lik tüpte yaklaşık 300 μL sıvı bırakın, peleti rahatsız etmemeye dikkat edin (görünmeyebilir).
- Hücrelerin spinde peletlendiğinden emin olmak için süpernatanı başka bir 15 mL'lik tüpte toplayın (yeniden süspanse edilen peletin hücre sayımları ile doğrulama yapıldıktan sonra bu fraksiyonu atın). Hücre peletini bir P1000 pipeti kullanarak 300 μL hacimde yeniden süspanse ettikten sonra, toplam hücre verimini tahmin etmek için hücreleri bir hemasitometre ile sayın.
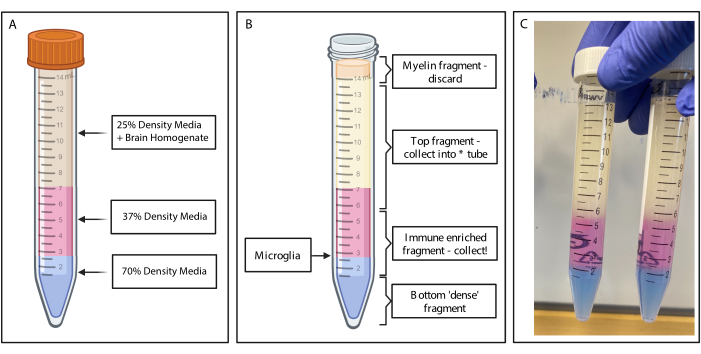
Şekil 2: Süreksiz yoğunluk gradyanı ile bağışıklıkla zenginleştirilmiş fragmanın elde edilmesi. (A) Beyin homojenatı %25 yoğunluklu ortama yapılır, fenol kırmızısı ile pembe renkli 4 mL %37 yoğunluklu orta renkli ve tripan mavisi ile 2 mL %70 yoğunluklu orta renkli mavi altlığa sahiptir. (B) Santrifüjlemeyi takiben, fraksiyonlar ayrılmıştır. Mikroglia, %37 ve %70 yoğunluklu ortam parçalarının arayüzünde durur. Miyelin fragmanı 15 mL'lik tüpün tepesindedir ve atılacaktır. Spinin başarısız olması durumunda üst parça yedek olarak toplanır ve hiçbir hücre kurtarılmaz. Böyle bir durumda, gradyan bu kesir kullanılarak tekrarlanabilir. Bağışıklıkla zenginleştirilmiş fraksiyon aşağı yönde toplanır. Herhangi bir kırmızı kan hücresi içeren alt kısım tüpte kalır ve atılır. (C) Tüm katmanları gösteren örnek şekil. BioRender.com ile oluşturuldu. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
- Hücre dışı antikor boyama
- Engelleme: Hücreleri buz üzerinde yuvarlak tabanlı 96 oyuklu bir plakaya aktarın ve hücreleri peletlemek için frenle 500 x g'da santrifüjleyin. Süpernatanı atmak için plakayı hafifçe vurarak lavabodaki süpernatanı hızla çıkarın ve hücre peletini kuyunun dibinde bozulmadan bırakın.
- Antikorların monositlere veya diğer FcR taşıyan hücrelere spesifik olmayan bağlanmasını önlemek için bir P200 pipeti (son konsantrasyon 10 μg/mL, seyreltme faktörü 1:50) kullanarak anti-fare CD16/32 FC-Reseptör bloke edici reaktif ile hücreleri 50 μL FACS tamponunda yeniden süspanse edin. Buz üzerinde 10 dakika inkübe edin.
- Antikor boyama: P2RY12- Allophycocyanin (APC; seyreltme faktörü 1:50, 1:100 nihai kuyu konsantrasyonu için konsantrasyon 4 μg/mL, konsantrasyon 2 μg/mL) ve menekşe 525 canlı ölü boyama (1:100 nihai kuyu konsantrasyonu için seyreltme faktörü 1:50) içeren 2x ana karışımın uygun hacmini hazırlayın. Hücre süspansiyonuna 50 μL boyama ana karışımı ekleyin (bölüm 1.5.1'de bloke edildikten sonra elde edilir) ve plakayı karanlıkta buz üzerinde 30 dakika inkübe edin.
NOT: Bu protokol için hücrelerin P2RY12 ile boyanmasını öneriyoruz. İlk olarak, P2RY12, belirli hastalık bağlamlarında aşağı regüle edilebilen mikroglia için homeostatik bir belirteçtir. Örneğin, 5XFAD Alzheimer model fareleri, P2RY12 seviyelerini düşürmüştür ve bu da onları tanımlamayı zorlaştırabilir22. İzolasyon için kullanılabilecek alternatif boyalar arasında Tmem119, Cd11b ve CD4523 bulunur. İkinci olarak, konjuge florokrom APC, istenen antikor paneline uyacak şekilde ayarlanabilir. Bununla birlikte, APC veya PE gibi parlak bir florokromun seçilmesi, pozitif ve negatif popülasyonların kolayca ayırt edilebilir olmasını sağlamaya yardımcı olacaktır24. - Boyamadan sonra, hücreleri yıkamak için her bir oyuğa doğrudan 200 μL FACS tamponu ekleyin. Süpernatanı hafifçe vurarak çıkarmak için 4 °C'de 500 x g'de döndürün. Hücreleri bir P200 pipeti ile 200 μL FACS tamponunda yeniden süspanse edin, 4 °C'de 500 x g'da döndürün ve tamponu kuyulardan çıkarmak için plakayı hafifçe vurun.
- Akış kontrollerinin hazırlanması: Boyamadan önce, gerekli akış kontrolleri için adım 1.5.1'de bloke ettikten sonra her numuneden gerekli hacimlerde hücreleri ayırın.
NOT: Kapıları oluşturmak için her deney için akış kontrolleri gereklidir. Akış kontrolleri, ek bir hayvandan veya deney kuyularının her birinin bir kısmından alınabilir. Hücreleri bölerken, yüksek güvenle kapılar oluşturmak için kontrol başına 10.000-30.000 hücre gerektiğinden, kontrol başına yeterli hücre atadığınızdan emin olun.- Üç ilgili akış kontrolü vardır: leke yok, canlı ölü ve P2RY12 izotip kontrolü. Leke kontrolü için herhangi bir antikor eklemeyiniz. P2RY12 izotip kontrolünde, hücreleri canlılık boyası (1:100) ve APC'ye (1:100) konjuge edilmiş bir izotip kontrol antikoru ile tedavi edin.
- Canlı ölü kontrolünü hazırlamak için, hücreleri ayrı bir kuyucuğa alın ve hücre hacminin yarısını 500 μL'lik bir tüpe taşıyın. 500 μL'lik tüpü 5 dakika boyunca -80 ° C dondurucuya koyun, ardından hücreleri öldürmek için 37 ° C inkübatöre 5 dakika yerleştirin. Ölü hücrelerin alikotunu canlı ölü kontrol kuyusuna geri koyun ve ölü hücreleri işaretlemek için menekşe 525 (seyreltme faktörü 1:100) üzerinde bir amin bağlayıcı canlılık boyası ile boyayın.
NOT: Protokol, süpernatantın çıkarılması için bir fiske yöntemiyle plaka boyama için yazılmıştır. Bununla birlikte, bu, süpernatantın dönüşün tamamlanmasından hemen sonra çıkarılmasını gerektirir ve topağı bozmadan süpernatanı hızlı bir şekilde çıkarmak için hareketin yeterli kuvvetle yapılması gerekir. Alternatif olarak, boyama için aşağıdaki modifikasyonlarla 1.5 mL RNAse/DNaz içermeyen tüpler kullanılabilir: Hücreleri 1.5 mL mikrosantrifüj tüpüne aktarın ve 4 °C'de 5 dakika boyunca 800 x g'da pelet yapın. Süpernatantı pipetlerle aspire edin. İpucu: Hız için, P200 uçlu 5 mL'lik bir transfer pipeti, süpernatanı hızlı ve doğru bir şekilde aspire edebilir. Aspirasyon yaparken peleti kontrol edin. Pelet görünmüyorsa, 50 μL süpernatan bırakın ve hesaplamaları buna göre ayarlayın. Antikorları yıkarken, süpernatantın eksik çıkarılmasını hesaba katmak için antikorların seyreltilmesini (200 μL yerine 1000 μL) artırmak için ek FACS ekleyin. Sitometreye bağlı olarak, sıralama için 1,5 mL'lik tüpleri kullanın ve gerekli malzeme miktarını azaltın.
- Mikroglia için FACS sıralaması
- Hazırlık: Her bir kuyucuğu bir P200 pipeti ile 200 μL FACS tamponunda yeniden süspanse edin ve etiketli akış sıralama tüplerine aktarın ve mL başına yaklaşık 5 x 105 olaylık bir konsantrasyon için toplam 500 μL'ye FACS tamponu ekleyin. Analize kadar karanlıkta buz üzerinde saklayın. 1.5 mL RNAse içermeyen tüplerdeki hücreler için bir yastık olarak 100 μL FACS tamponu ekleyerek sıralama sonrası tüpleri hazırlayın.
- Sitometre ayarları: Hücreleri, 100 μm nozül ile ayarlanmış bir akış sitometrisi hücre sıralayıcısında sıralayın. Hücreleri 18-20 psi kullanarak sıralayın.
- Geçitleme: Sitometrede, döküntüleri ayırt etmeye yardımcı olmak için leke kontrolü kullanmayan yan saçılma (SSC) alanı ve ileri saçılma (FSC) yüksekliği kullanarak hücre boyutu için geçit, bir hücre popülasyonunu görselleştirmek için SSC-A'yı bir kütük eksenine yerleştirin ve hücreleri seçmek için yakından kapı (kapı S1; Şekil 3). Herhangi bir çifti çıkarmak için, FSC-H ile FSC-W'yi çizin ve herhangi bir kalıntı ve çifti (kapı S2) kaldırarak hücre popülasyonunun etrafını yakından geçin. P2RY12 izotip kontrolünü kullanarak, APC kanalındaki hücreleri inceleyin ve P2RY12+ hücrelerini belirlemek için otofloresan kapısını ayarlayın. Leke yok ve canlı ölü kontrollerini kullanarak, menekşe 525 nm'de floresan olmayan hücreleri canlı hücreler olarak geçit edin.
- Sıralama: Menekşe 525 nm'ye karşı APC'yi çizin ve P2RY12+ olan ve FMO'lara (MG) göre yaşayan popülasyonu belirleyin. Bu hücreleri etiketli sıralama sonrası tüpüne sıralayın (Şekil 3). Nihai sıralama yüzdesi, toplam olayların yaklaşık %50'sidir ve olay toplam kaybının çoğunluğu S1 kapısında kaldırılan enkazdır (olayların ~%70'i hücrelerdir; Tablo 1).
- RNA izolasyonu ve analizi
- Transkripsiyon ve translasyon inhibitörleri: RNA ekstraksiyonu planlıyorsanız, izolasyonla ilişkili transkriptomik imzalar riskini ortadan kaldırmak için, tampon adımlarına translasyon ve transkripsiyon inhibitörlerini dahil edin. İnhibitör kokteylini Marsh ve ark. aktinomisin D, anizomisin ve triptolid25 dahil.
- İnhibitör hazırlama: İnhibitör stoklarını sulandırın ve aşağıdaki gibi saklayın: Aktinomisin D'yi dimetilsülfoksit (DMSO) içinde 5 mg / mL'ye kadar sulandırın ve -20 ° C'de saklayın. Triptolidi DMSO'da 10 mM'ye kadar sulandırın ve -20 °C'de ışıktan koruyarak saklayın. Anizomisin'i DMSO'da 10 mg / mL'ye sulandırın ve ışıktan koruyarak 4 ° C'de saklayın. Tüm inhibitör stoklarını sulandırıldıktan sonra en fazla 1 ay saklayın.
- Tampon modifikasyonları: Protokoldeki dört farklı tampona aşağıdaki gibi inhibitörler ekleyin: Transkardiyal perfüzyonu gerçekleştirirken, HBSS'yi aktinomisin D (5 μg / mL, stoktan 1:1000) ve triptolid (10 μM, stoktan 1:1000) ile hazırlayın. Perfüzyonu takiben, beyinleri aktinomisin D (5 μg / mL, stoktan 1:1000), triptolid (10 μM, stoktan 1:1000) ve anizomisin (27.1 μg / mL, stoktan 1:368.5) içeren HBSS'de laboratuvara taşıyın. Aktinomisin D (5 μg/mL, stoktan 1:1000), triptolid (10 μM, stoktan 1:1000) ve anizomisin (27.1 μg/mL, stoktan 1:368.5) ile FACS tamponu hazırlayın. Aktinomisin D (5 μg/mL, stoktan 1:1000), triptolid (10 μM, stoktan 1:1000) ve anizomisin (27.1 μg/mL, stoktan 1:368.5) içeren sindirim tamponu hazırlayın. Aktinomisin D (5 μg/mL, stoktan 1:1000), triptolid (10 μM, stoktan 1:1000) ve anizomisin (27,1 μg/mL, stoktan 1:368,5) içeren HBSS ile sıralama sonrası yıkama tamponu hazırlayın.
NOT: İnhibitörleri eklerken, kullanımdan hemen önce eklediğinizden emin olun ve kullanım sırasında hazırlanan tamponları ışıktan koruyun. Stok çözeltilerinin dondurulmasını önleyin.
- Sıralama sonrası yıkamalar: Hücreler, RNA izolasyonuna müdahale edecek FACS tamponunda 1.5 mL RNaz içermeyen tüplere ayrıldığından, hücrelerin yıkanması gerekir. Hücreleri 5 dakika boyunca 4 ° C'de 1000 x g'de döndürün ve yaklaşık 50 μL sıvı bırakarak süpernatanı çıkarın.
- Aktinomisin D (5 μg/mL, stoktan 1:1000), triptolid (10 μM, stoktan 1:1000) ve anizomisin (27.1 μg/mL, stoktan 1:368.5) içeren 200 μL 1x HBSS ekleyin ve iyice karıştırın. Sıkma işlemini tekrarlayın ve 50 μL sıvı bırakarak süpernatanı çıkarın (yıkama 1). 200 μL yıkama sonrası yıkama tamponu ekleyin, iyice karıştırın ve sıkma işlemini tekrarlayın ve 25 μL sıvı bırakarak süpernatanı çıkarın (yıkama 2).
- RNA ekstraksiyonu: Mikroglial hücrelerden RNA izolasyonu için, yüksek ve tutarlı RNA verimleri ve 9'un üzerinde RIN skorları için düşük girdili bir RNA izolasyon kiti kullanın (ürün önerileri için aşağıya ve Malzeme Tablosuna bakın). Hücre peletine, önerilen kit + β-merkaptoetanolden (1:100) 350 μL lizis tamponu ekleyin ve iyice karıştırın.
NOT: Gerekirse, protokol bu noktada askıya alınabilir. Numuneler, RNA ekstraksiyonuna kadar -80 °C'de lizis tamponunda saklanabilir. Depolamadan sonra RNA'yı çıkarıyorsanız, lizatı buz üzerinde çözün ve izolasyon için kite özel talimatlarla devam edin. - Lizatı kolon tabanlı hücre parçalayıcıya aktarın (ürün önerileri için Malzeme Tablosuna bakın) ve 4 dakika boyunca 2 ° C'de maksimum hızda santrifüjleyin. En az 14 μL RNaz içermeyen suda elute edin ve konsantrasyonu uygun şekilde belirleyin. RNA, bu noktadan sonra herhangi bir aşağı akış uygulaması için kullanılabilir.
- Transkripsiyon ve translasyon inhibitörleri: RNA ekstraksiyonu planlıyorsanız, izolasyonla ilişkili transkriptomik imzalar riskini ortadan kaldırmak için, tampon adımlarına translasyon ve transkripsiyon inhibitörlerini dahil edin. İnhibitör kokteylini Marsh ve ark. aktinomisin D, anizomisin ve triptolid25 dahil.
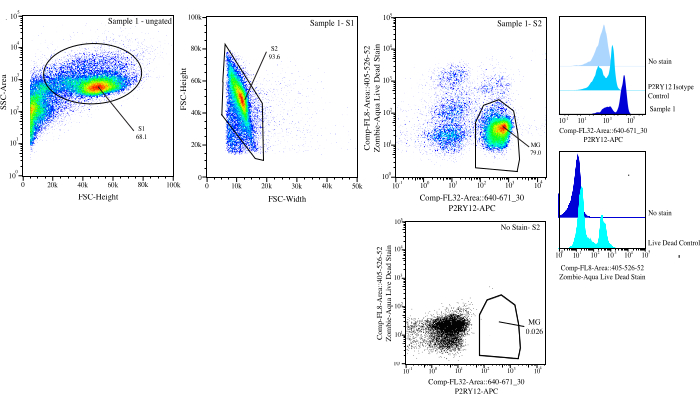
Şekil 3: Akış sıralaması için geçit stratejisi. Olaylar, SSC-A ve FSC-H (S1) üzerinde hücre boyutu için geçitlidir. Daha sonra, hücreler FSC-H ve FSC-W (S2) üzerinde tekiller olacak şekilde kapılanır. Singlet hücreleri, P2RY12-izotip kontrolü kullanılarak Comp-FL8-A::405-526-52 (mor 525 canlı ölü leke) üzerinde negatifse canlı ve Comp-FL32-A::640-671_30 (P2RY12-APC) üzerinde pozitifse P2RY12+ olarak sıralanır. Hücreler MG olarak etiketlenir ve hem canlı hem de P2RY12+ ise sıralanır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| GÜVENLIKLI NÜFUS | Ebeveyn Sıklığı | Toplam Frekans | Saymak |
| S1 | 68.10% | 68.10% | 162186 |
| S2>S1 | 93.59% | 63.70% | 151707 |
| P2Ry12+ (670+) > S2 > S1 | 83.05% | 52.90% | 125986 |
| Canlı (525-) > S2 > S1 | 92.78% | 59.10% | 140752 |
| MG (P2RY12+ Canlı) >S2>S1 | 78.96% | 50.30% | 119794 |
Tablo 1: Geçit yüzdeleri ve beklenen olay numaralarını içeren örnek örnek köken tablosu.
2. Protein ekspresyon analizi için intranükleer akış boyama
NOT: Bu noktada diğer hücre tipleri başlatılabilir, bu protokol HEK293 hücreleri, BV2 mikroglia benzeri hücreler ve insan IPSC'den türetilmiş mikroglia dahil olmak üzere kültürlenmiş hücrelerle test edilir.
- Hücrelerin sabitlenmesi ve boyanması
NOT: Aşağıdaki protokol için, nükleer boyama için optimize edilmiş bir hücre içi boyama kiti kullanın. Görmek Malzeme Tablosu ürün önerileri için.- Bölüm 1.5.2'den 96 oyuklu plakaya (5 x 104- 1 x 106 hücre) hücre dışı boyanmış hücreler. Hücreleri 4 °C'de 500 x g'de 5 dakika döndürün ve FACS tamponunu çıkarmak için hafifçe vurun.
NOT: Medyan seviyelerin yüksek güvenilirliğine sahip veriler elde etmek için, oyuk başına en az 10.000 hücre kullanılmalıdır. Önerilen bir maksimum değer olmasa da, farklı varyasyon katsayılarının (CV) önemli bir etkisi olmadığından emin olmak için deney boyunca hücre sayısını tutarlı tutmak en iyisidir. - Fiksasyon ve geçirgenleştirme: 200 μL 1x fiks konsantresi ekleyin ve hücreleri yeniden süspanse etmek için P200 pipet ile hafifçe karıştırın. Karanlıkta 45-60 dakika inkübe edin. Plakayı oda sıcaklığında (RT) 500 x g'da 5 dakika santrifüjleyin ve süpernatanı atmak için hafifçe vurun.
NOT: Gerekirse, protokol bu noktada askıya alınabilir. Süpernatanı attıktan sonra, bağışıklık hücreleri için uzun süreli depolama tamponunda hücreleri yeniden askıya alın (ürün önerileri için Malzeme Tablosuna bakın). Numuneler 4 °C'de 12-18 saat saklanabilir, ışıktan korunabilir ve tampon buharlaşmasını önlemek için şeffaf filmle kaplanabilir. - Her kuyucuğa 200 μL 1x geçirgenlik tamponu ekleyin ve karıştırmak için bir P200 ile pipetleyin. RT'de 500 x g'de 5 dakika santrifüj plakası ve süpernatanı atmak için hafifçe vurun. Geçirgenleştirme tamponunu toplam 3 kez yıkayın.
- Akış kontrollerinin hazırlanması: Gerekli akış kontrolleri için her numuneden hücre hacmini bölün (kontrol kuyusu başına 10.000-30.000 hücre yeterlidir).
- Leke kontrolünü hazırlamak için, lekesiz hücreleri sıralamadan veya boyanmamış hücrelerden herhangi bir antikor almayacak ayrı bir kuyucuğa sabitleyin.
- Floresan eksi bir (FMO) kontrolünü hazırlamak için, o kanaldaki antikor hariç, paneldeki antikorların her biri için alikot hücreleri.
- İlgili kanallar için, geçit için FMO'ya izotip kontrol antikorunu ekleyin. Örneğin, P2RY12-APC ve H3K27Ac-AlexaFluor568 içeren bir panelde iki FMOS olmalıdır: (1) sadece H3K27Ac-AlexaFluor568 ve P2RY12 izotip kontrol antikoru içeren APC-FMO ve (2) sadece P2RY12-APC ve izotip kontrol primeri ve 568 sekonder içeren 568-FMO.
NOT: Bu protokol, tek bir HPTM'yi test etmek için sunulmuştur, ancak farklı floroforlara konjuge edilmiş birçok HPTM içeren paneller oluşturulabilir.
- Primer antikor boyama: Her oyuğa uygun primer antikor konsantrasyonu ile 50 μL 1x geçirgenlik tamponu ekleyin. Karanlıkta RT'de 30 dakika inkübe edin. 2x'i 200 μL 1x geçirgenlik tamponu ile yıkayın.
NOT: Her HPTM için kullanılan antikor konsantrasyonu Malzeme Tablosunda yer almaktadır. Konsantrasyon, dramatik bir artışa neden olacak bir uyarıcı ile muamele edilen kültürlenmiş hücreler üzerindeki antikorların farklı konsantrasyonlarının test edilmesiyle belirlenir, ör., asetilasyon işaretleri için bir HDAC inhibitörü ve hem tedavi edilmemiş hem de tedavi edilmiş hücrelerin tespit aralığında olduğundan emin olun (izotip kontrolünün üstünde ve sitometrenin maksimum tespit aralığının altında). HPTM'ler için optimal antikor konsantrasyonu, florofor kanalında 5 x 104 ile 1 x 105 arasında bir ortalama medyan floresan yoğunluğuna sahip olmalıdır. - İkincil antikor boyama: RT'de 10 dakika boyunca% 2 normal eşek serumu (NDS) ile 200 μL 1x geçirgenlik tamponu ile bloklayın. RT'de 500 x g'de 5 dakika döndürün ve süpernatanı çıkarmak için hafifçe vurun.
- % 2 NDS ve uygun ikincil antikor konsantrasyonu ile 50 μL 1x geçirgenleştirme tamponu ekleyin ve karanlıkta RT'de 30 dakika inkübe edin. Seyreltmek için kuyucuklara 200 μL 1x geçirgenlik tamponu ekleyin, plakayı RT'de 500 x g'de 5 dakika santrifüjleyin ve süpernatanı atmak için hafifçe vurun. Hücreleri 200 μL 1x geçirgenlik tamponu ile 2x yıkayın.
NOT: Gerekirse, bu noktada protokolü askıya alın. P200 pipeti ile bağışıklık hücreleri için 200 μL uzun süreli depolama tamponunda hücreleri yeniden süspanse edin (öneriler için Malzeme Tablosuna bakın) ve ışıktan korunarak 12-24 saat boyunca 4 ° C'de saklayın. - Akış sitometrisi için hazırlanma: RT'de 500 x g'de 5 dakika santrifüj plakası ve süpernatanı atmak için hafifçe vurun. Akış sitometrisi için bir P200 pipeti kullanarak hücreleri 200 μL FACS tamponunda yeniden süspanse edin. Sitometreye taşımak için şeffaf film ile kapatın.
- Bölüm 1.5.2'den 96 oyuklu plakaya (5 x 104- 1 x 106 hücre) hücre dışı boyanmış hücreler. Hücreleri 4 °C'de 500 x g'de 5 dakika döndürün ve FACS tamponunu çıkarmak için hafifçe vurun.
- Akış sitometrisi
- Önerilen antikor panelini analiz etmek için, sitometrenin mor (405 nm), mavi (488 nm), sarı (561 nm) ve kırmızı (633 nm) dahil olmak üzere en az dört lazerle donatıldığından emin olun. Sitometre, FITC (mavi-525 nm), KRO (mor-525 nm), PE (sarı-585 nm) ve APC'yi (kırmızı-660 nm) tespit etmek için filtrelere ihtiyaç duyar. Seçilen sitometreye bağlı olarak ek antikorlar ekleyin.
- Kalibrasyon ve standardizasyon: Her deneyin başlangıcında, gökkuşağı floresan boncuklarını çalıştırın ve boncuk tepe noktaları önceki deneyler için çalıştırılan hedef değerlerle karşılaştırılabilir olana kadar fotoçoğaltıcı tüp (PMT) voltajını ayarlayın. Bu standardizasyon yöntemi, zaman içinde ekipman sürüklenmesinin yerleştirilmesine izin verir.
- Kompanzasyon: Deney için PMT voltajı ve kazancı ayarlandıktan sonra, antikor paneli için kompanzasyon matrisini oluşturmak için antikor yakalanan kompanzasyon boncuklarını kullanın. Bu hesaplama, floroforların diğer kanallardaki sinyal değişikliklerine katkıda bulunmamasını sağlayacaktır. Bu, çoklu antikorları çoğaltırken giderek daha gerekli hale gelir.
- Boyut geçidi: Bir nokta grafiğinde, SSC-A'yı günlükte ve FSC-H'yi doğrusal olarak çizin. Enkazı kapatın ve S1 kapısını kullanarak hücre boyutunu seçin. FSC-W ve FSC-H nokta grafiğindeki tekli hücreleri seçin ve S2 olarak geçin. (Şekil 4).
- Florofor kapılarının oluşturulması: Her bir florofor kanalı için ilgili FMO'yu kullanarak, tek parametreli histogramlar kullanarak her kanalda pozitif sinyalin ne olduğunu belirlemek için kapıları oluşturun (Şekil 4).
- Numunelerin ölçülmesi: Belirlenen geçit stratejisini kullanarak numuneleri dikkatlice kaydedin. P2RY12+ sinyalini kullanarak mikrogliayı tanımlayın, yalnızca mikroglia için ilgili kanallardaki proteinin ekspresyonunu belirleyin.
- Akış sitometrisi veri analizi
- Analiz kapılarının oluşturulması: Analiz yazılımı kullanıcı arayüzünde sitometre için yukarıdaki adımları kullanarak, analiz için kayıt için kullanılan kapıların aynısını kullanın.
- Akış sitometrisi analiz yazılımını kullanarak MFI değerlerini elde edin (öneriler için Malzeme Tablosuna bakın): Akış analizi için sitometre geçit stratejisini özetleyin. İstatistik ekle işlevini kullanarak, telafi edilen kanal yüksekliğinde ilgilenilen popülasyon için medyan seçin (örneğin, 568+). İstatistiksel analize devam etmek için tablo düzenleyiciyi kullanarak, ilgili kanalların medyan floresan yoğunluğu (MFI) değerlerini bir elektronik tabloya aktarın (Tablo 2).
NOT: Ek Dosya S1 , lipopolisakkarit (LPS) ve fosfat tamponlu salin (PBS) enjekte edilen farelerden örnek veriler ve geçit stratejisi ve MFI değerlerini içeren örnek bir analiz dosyası içerir. - MFI değerlerinin protein kat değişimine göre analiz edilmesi: MFI değerlerini elde ettikten sonra, MFI'nin kontrol veya işlenmemiş popülasyona göre kat değişimini hesaplayın (Denklem 1). MFI kat değişimi, protein seviyelerindeki kat değişikliğini yansıtır. Katlama değişim değerlerini kullanarak, ifadedeki değişikliği değerlendirin ve bir t-testi veya ANOVA kullanarak istatistiksel anlamlılığı hesaplayın.
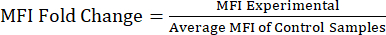 Denklem 1
Denklem 1
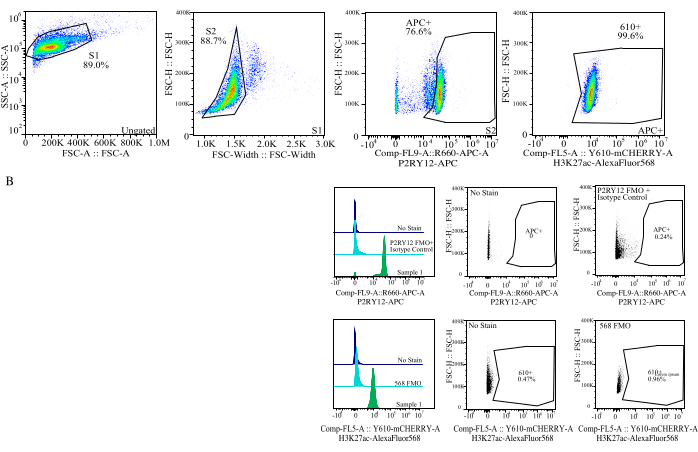
Şekil 4: Protein MFI değerlendirmesi için geçit stratejisi. Olaylar ilk olarak SSC-A ve FSC-H (S1) üzerinde hücre boyutu için geçitlenir. Hücreler daha sonra FSC-H ve FSC-W (S2) üzerindeki tekiller için kapılanır. Singlet hücreler daha sonra P2RY12-APC sinyali (APC+) ile mikroglia olarak tanımlanır ve bir izotip kontrol antikoru içeren bir APC-FMO kontrolünde floresansa dayalı olarak kurulan kapı ile tanımlanır. Hücreler daha sonra Comp-FL5-A::Y610-mCherry üzerinde H3K27Ac-AlexaFluor568 sinyali için geçitlenir. 610+ hücrenin floresan yoğunluğu, protein ekspresyonu için bir vekil olarak belirlenir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Temsili Sonuçlar
Yetişkin fareler transkardiyal olarak perfüze edildi ve mikroglia izolasyonu için sakfiye edildi. Mikroglia buz üzerinde izole edildi ve P2RY12-APC ve violet 525 canlı ölü antikorları ile boyandı. P2RY12 pozitif, violet 525 canlı ölü lekesi için negatif olduğu belirlenen hücreler canlı mikroglia olarak sınıflandırıldı. Diseke bir fare beyninden ortalama mikroglia verimi 1.28 x 105 ± 0.05 idi (ortalama ± standart hata ortalaması (SEM), N = 100). Dişi (1.25 x 105 ± 0.09 [ortalama ± SEM, N=46]) ve erkek (1.32 x 105 ± 0.07 [ortalama ± SEM, N=54]) farelerden mikroglia verimi açısından bir fark yoktur (t(98)=0.6365, p=0.526). Belirli beyin bölgelerinden izole edilirken, fare kortekslerinden ortalama mikroglia verimi 8.3 x 104 ± 0.08 (ortalama ± SEM, N = 15) ve fare hipokampusundan 4.1 x 104 ± 0.02'dir (ortalama ± SEM, N = 16). Beklendiği gibi, her beyin bölgesinden mikroglia veriminde önemli bir fark vardır (F(2, 128)=25.25, P<0.0001). Mikroglia izolasyonunu takiben, düşük girdili bir RNA izolasyon kiti kullanılarak izole edilen hücrelerden RNA ekstrakte edildi. Tutarlı bir şekilde RNA bütünlük skoru (RIN) 9.0'ın üzerindeydi (9.62 ± 0.05) ve hücre başına ortalama RNA verimi 0.25 ± 0.01 pg idi (ortalama ± SEM, N = 32; Ek Dosya S2).
Yetişkin farelere, kurban edilmeden 24 saat önce intraperitoneal olarak 1 mg / kg lipopolisakkarit (LPS) enjekte edildi. Fareler, HBSS ile transkardiyal olarak perfüze edildi ve mikroglia, tarif edilen protokole göre tüm beyinden izole edildi (Şekil 5A). Her leke için, her bir antikor paneline 20.000-30.000 hücre tahsis edildi. Histon 3 lizin 27 asetilasyonunun (H3K27Ac) global seviyeleri, akış sitometrisi ile izole mikrogliada değerlendirildi. Erkek ve dişi fareler için, MFI cinsiyet içinde normalleştirildiğinde LPS tedavisi H3K27Ac'de artışa neden oldu (t (6) = 9.676, p < 0.0001; Şekil 5B). Boyanmış hücreler için histogramlar incelendiğinde, popülasyonlar benzer varyasyonlarla normal olarak dağılmış olarak kalır; bununla birlikte, hücreler MFI'de artışa neden olan artan floresansa kaymıştır (Şekil 5C). Aynı tedavide H3K9Ac incelendiğinde de benzer bir artış vardır (t(6)=7.299, p=0.0003; Şekil 5D,E), ancak LPS'nin H3K9Ac sinyalinin PBS'sine göre kat değişimi, H3K27Ac sinyalinden daha azdır.
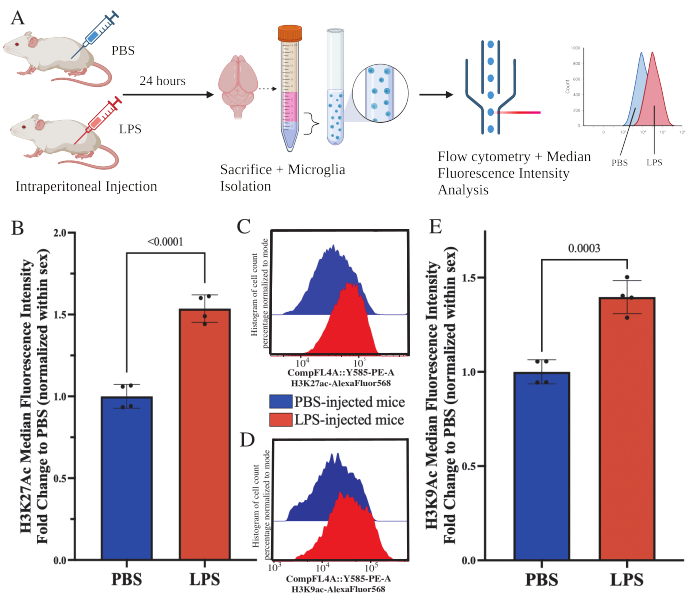
Şekil 5: İzole mikrogliadaki histon asetilasyonundaki global değişiklikler. (A) Fareler, kurban edilmeden 24 saat önce intraperitoneal olarak fosfat tamponlu salin (PBS) veya 1 mg / kg lipopolisakkarit (LPS) enjekte edilir. Mikroglia, immün kuvvetle zenginleştirilmiş fraksiyondan toplanır ve akış sitometrisi ve global histon translasyon sonrası modifikasyon değerlendirmesi için sabitlenir. Medyan floresan yoğunluğu, protein ekspresyonu için bir vekil olarak değerlendirilir. BioRender.com ile oluşturuldu. (B) LPS tedavisine yanıt olarak küresel H3K27Ac seviyeleri artmıştır. Deney ve cinsiyet içinde normalleştirilmiş PBS'ye katlama değişikliği. Eşlenmemiş iki kuyruklu t-testi, t(6)=9.676, p<0.0001. Çubuk grafik, ortalama ± SEM'i gösterir. N = 8 hayvan; 2 bağımsız deneyde koşul başına 2. (C) H3K27Ac floresan yoğunluğunun kaymasını gösteren örnek histogramlar. Modal, PBS enjekte edilen ve LPS enjekte edilen farelerden alınan histogramları gösterir. (D) H3K9Ac floresan yoğunluğunun kaymasını gösteren örnek histogramlar. Modal, PBS enjekte edilen ve LPS enjekte edilen farelerden alınan histogramları gösterir. (E) LPS tedavisine yanıt olarak küresel H3K9Ac seviyeleri artmıştır. Deney ve cinsiyet içinde normalleştirilmiş PBS'ye katlama değişikliği. Eşlenmemiş iki kuyruklu t-testi, t(6)=7.299, p=0.0003. Çubuk grafik, ortalama ± SEM'i gösterir. N = 8 hayvan; 2 bağımsız deneyde koşul başına 2. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Açıklanan yöntemin, global histon modifikasyon ölçümü için daha önce kullanılan diğer yöntemlerle karşılaştırılabilir olduğunu doğrulamak için, karşılaştırmalı bir araç olarak immunoblot'u kullanmayı amaçladık. Bununla birlikte, izole edilmiş mikrogliadan elde edilen verim, makul bir değerlendirme sağlamak için çok düşüktür. Bu nedenle, hücre içi akış sitometrisi yöntemini Western blot (WB) ile karşılaştırmak için kültürlenmiş BV2 hücreleri kullandık. BV2 hücreleri, 37 ° C,% 5 CO2'de tam ortamda (DMEMF12,% 10 FBS, 1x penisilin / streptamisin ve 1x L-glutamin) büyütüldü. Hücreler% 0.25 tripsin-EDTA ile pasajlandı ve 250.000 hücre / kuyu yoğunluğunda kaplandı ve indirgenmiş serum ortamında (DMEM F12,% 2 FBS, 1x penisilin / streptamisin ve 1x L-glutamin) muamele edildi ve 37 ° C'de,% 5 CO2'de 12 saat iyileşmeye bırakıldı. Hücreler, yukarıda tarif edildiği gibi fiksasyondan veya bir WB lizis tamponu ile lizisten önce 24 saat boyunca 25 ng / mL LPS ile muamele edildi. H3K27Ac'nin sinyali, WB için bir yükleme kontrolü olarak kullanılan GAPDH ile her iki yöntemle de gerçekleştirildi. Her grup için PBS kontrolüne kıyasla normalleştirilmiş floresan yoğunluğunun analizi belirlendi (Şekil 6A). WB ile normalize H3K27Ac sinyalindeki değişiklik incelendiğinde, eşlenmemiş t-testi ile anlamlı olduğu belirlenenH2Okontrolüne göre LPS ile tedavi edilen durumda 1.527 kat artış vardı (t=3.024, df=5; p=0.0293). Akış sitometrisi kullanılarak değişiklik incelendiğinde, LPS ile tedavi edilen durumda anlamlı olduğu belirlenen 1.482 kat artış vardı (t = 7.843, df = 10; p<0.0001). Yöntemlerin karşılaştırılmasında 2 yönlü varyans analizi (F(1,15)=45.21,p<0.0001) tedavinin anlamlı bir etkisinin olduğu, ancak yöntemin (F(1,15)=0.05545, p=0.8697) veya etkileşimin (F(1,15)=0.02785, p=0.8697) anlamlı bir etkisinin olmadığı belirlendi. Ek olarak, 2 yönlü ANOVA'nın LPS tedavisinin (F(1,7)=0.02170,p=0.8870), yöntemin (F(1,7)=0.01191, p=0.9162) veya etkileşimin (F(1,7=0.01191, p=0.9162; Şekil 6B). Bu veriler için örnek lekeler ve histogram kaymaları da gösterilmiştir (Şekil 6C,D).
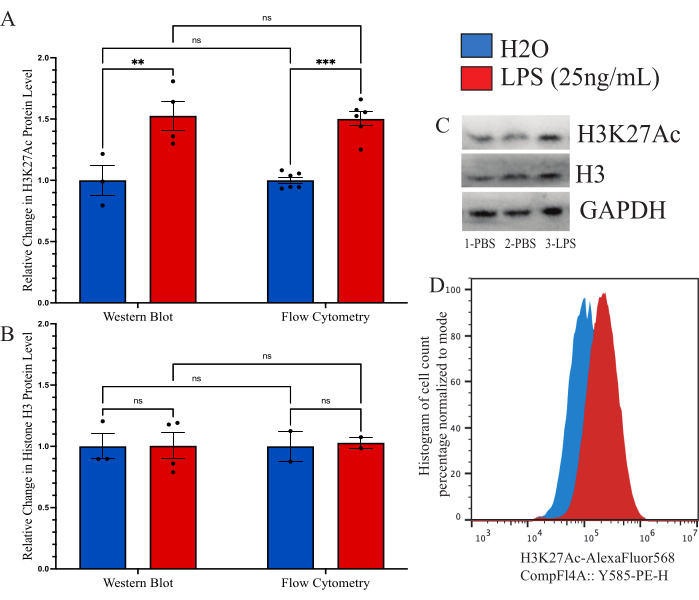
Şekil 6: Akış sitometrisi ve western blot arasındaki global histon modifikasyon değişikliğinin nicelleştirilmesi için yöntem karşılaştırması. (A) BV2 hücreleri, analizden önce 24 saat boyunca 25 ng / mL lipopolisakkarit (LPS) veyaH2Oile muamele edilir. H3K27Ac'nin floresan yoğunluğu, hem akış sitometrisi hem de western blot için araç kontrolü, fosfat tamponlu salin (PBS) kat değişikliği olarak tasvir edilir. 2 yönlü varyans analizi (F(1,15)=45.21, p<0.0001) anlamlı etki gösterirken, yöntem (F(1,15)=0.05545, p=0.8697) veya etkileşim (F(1,15)=0.02785, p=0.8697) anlamlı etki göstermedi. Kalıntılar için Tukey'in çoklu hipotez testi düzeltmesi uygulanmıştır. * 0.0332, ** 0.0021 sunar. (B) Histon H3 için floresan yoğunluğu, hem akış sitometrisi hem de western blot için PBS'ye kat değişikliği olarak tasvir edilir. 2 yönlü varyans analizi, LPS tedavisinin (F(1,7)=0.02170, p=0.8870) veya yöntemin (F(1,7)=0.01191, p=0.9162) veya etkileşimin (F(1,7=0.01191, p=0.9162) anlamlı bir etkisini göstermedi. (C) Örnek lekeler ve (D) akış sitometrisi kaymaları tasvir edilmiştir. Histogram boyutu, mod floresan yoğunluğunda bulunan hücre sayısına bağlı olarak yüzde olarak normalleştirilir. Çubuk grafik, ortalama SEM'i gösterir. n=2 bağımsız deney, deney başına koşul başına 2. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Hep birlikte, bu sonuçlar, bu tekniğin izole mikrogliadaki küresel HPTM seviyelerini kantitatif olarak değerlendirmek için kullanılabileceğini göstermektedir. Ek olarak, yöntemin önceki tekniklerle karşılaştırılabilir olduğu, ancak çok daha düşük hücre girdileri gerektirdiği gösterilmiştir. Ek olarak, gösterilmemiş olsa da, uygun kompanzasyonla, mevcut teknik, farklı HPTM'leri değerlendiren aynı panelde birden fazla antikorla kullanılabilir.
Ek dosya S1: Örnek analiz dosyaları. Bu dosya, bir wsp analiz dosyası ve lekesiz, P2RY12FMO, 568FMO, iki PBS ile tedavi edilmiş hayvan ve H3K27Ac ile boyanmış iki LPS ile muamele edilmiş hayvan dahil olmak üzere 7 fcs dosyası içerir. Bu dosyanın amacı, başarılı bir deneyin nasıl göründüğünü gösterebilecek bir deney üzerindeki analizi ve geçitleri göstermektir. Bu Dosyayı indirmek için lütfen buraya tıklayın.
Ek Dosya S2: İzolasyon verileri. Dahil edilen dosya, açıklanan protokolden mikroglia ve RNA verimini içeren mikroglia sıralaması sonrası ilgili verileri içerir. Bu Dosyayı indirmek için lütfen buraya tıklayın.
| GÜVENLIKLI NÜFUS | Ebeveyn Sıklığı | Toplam Frekans | Saymak |
| S1 | 89.00% | 89.00% | 25672 |
| S2>S1 | 88.73% | 78.97% | 22779 |
| APC+ > S2 > S1 | 76.61% | 60.50% | 17452 |
| 610+ > APC+ > S2 > S1 | 99.56% | 60.24% | 17376 |
Tablo 2: Örnek örnek soy tablosu, doğru protein tespiti için gereken yüzdeyi ve olay sayılarını gösterir.
Tartışmalar
Sunulan protokol, akış sitometrisi yoluyla küresel HPTM seviyelerinin kantitatif değerlendirmesini sağlar. Bu protokol yeni bir yöntem sunarken, önceki çalışmalar benzer bir yaklaşım kullanarak proteinlerin kantitatif değerlendirmesini yapmıştır26. HPTM'lerin global düzeylerini değerlendirmek için kullanılan önceki yöntemler arasında immünohistokimya ve western blot 16,17,19,20 bulunmaktadır. Sunulan akış sitometrisi tabanlı yöntem kolayca ölçülebilir bir yöntem iken, western blot ve immünohistokimya yarı kantitatiftir ve daha düşük verime sahiptir. Western blot, hücre lizisine dayanır ve bu nedenle hem protein normalizasyonu hem de deneysel koşul27 tarafından değişmediği varsayılan bir yükleme kontrol proteini gerektirir. İmmünohistokimya yarı kantitatif ve çok düşük verimlidir, çünkü tek bir hücre düzeyinde inceleme yapmadan protein miktarını kantitatif olarak değerlendirmek zordur16. Benzer şekilde, izole edilmiş mikroglia için, western blot çok daha büyük protein girdisi gerektirdiğinden, sınırlı verim nedeniyle akış sitometrisi yöntemini kullanmanın bir faydası vardır19. Düşük hücre sayısı gereksinimleri, aynı hayvandan birden fazla boyama panelinin çalıştırılmasına izin verir.
Bununla birlikte, diğer herhangi bir yöntemde olduğu gibi, tüm antikorlar bir akış sitometrisi ortamında iyi çalışmadığından, antikor maliyeti ve kullanılabilirliği dahil olmak üzere bu tekniğin sınırlamaları vardır. Ek olarak, immünoblot ile karşılaştırıldığında, gerekli antikor konsantrasyonu çok daha yüksektir. Çoğullama, aynı hücre panelinde birden fazla antikorun kullanılmasına izin verirken, hücreler analizden sonra antikordan sıyrılamaz, böylece hücre kullanımını antikor türü başına bir tane ile sınırlandırır. Bu, aynı lekenin tekrar tekrar kullanılabileceği immünoblottan farklıdır. Bununla birlikte, antikorların mevcudiyetine ve bir sitometredeki tespit kanallarının sayısına bağlı olarak, aynı anda bir düzine kadar işareti incelemek mümkün olacaktır.
Mevcut yöntem, spesifik genomik konumu değil, yalnızca küresel protein ekspresyon seviyelerini yakalar ve küresel seviyelerdeki değişiklikler, bireysel genomik lokuslardaki değişiklikleri yansıtmayabilir. Benzer şekilde, küresel seviyelerde bir değişiklik olmaması, hiçbir genomik lokusun değişime uğramadığı anlamına gelmeyebilir, sadece küresel değişikliklerin tedaviler arasında hiçbir fark olmadığı anlamına gelir. Bu nedenle, bu tekniğin, genomik analiz için ilgilenilen HPTM'leri tanımlamak için bir ekran olarak kullanılması amaçlanmıştır. Ek olarak, bu yöntem, kontrol için bir kat değişikliği olarak değerlendirildiği durumlar dışında, farklı protein işaretleri arasında karşılaştırmaya izin vermez. Bu nedenle, protein tayini için ELISA gibi standart eğri tabanlı bir yöntemle karşılaştırıldığında bu sınırlıdır.
Sunulan protokol, canlı beyin mikrogliasını izole etmek için bir strateji sunmaktadır. Bu protokol, mikroglia izolasyonu için P2RY12 protein ekspresyonuna dayanır. Bununla birlikte, P2RY12, mikroglia'da homeostatik bir belirteçtir ve 5XFAD22 gibi hastalık modellerinde aşağı regüle edilebilir. Bu nedenle, bir hastalık modeli hayvanı kullanırken, mikroglia23'ün izolasyonuna yardımcı olmak için TMEM119, CD11b veya CD45 gibi diğer işaretleyici proteinleri seçtiğinizden emin olun. Benzer şekilde, bu protokolü hipokampus ve/veya korteksten izolasyon olarak sunuyoruz. Bu protokol, mikroglia'yı beyaz madde bölgeleri de dahil olmak üzere diğer beyin bölgelerinden izole etmek için çalışacaktır, ancak ilgilenilen bölgelerin büyüklüğüne bağlı olarak yeterli mikroglia elde etmek için birden fazla hayvan gerekebilir.
Sunulan protokol, canlı, beyin mikrogliasını sağlam bir şekilde izole edebilir, ancak izolasyon aşamasında, yanlış yapıldığında hücre verimini azaltabilecek aşağıda açıklanan birkaç adım vardır.
Bu protokol için perfüzyonlar, bağışıklıkla zenginleştirilmiş fragmanda daha yüksek bir mikroglia yüzdesi ile sonuçlanır ve bu da ayıklayıcıdaki süreyi azaltır. Bununla birlikte, perfüzyon gerekli değildir ve gerekirse diğer ötenazi yöntemleri kullanılabilir.
Mikroglia izolasyonu sırasında miyelin tamamen uzaklaştırılmalıdır. Akış sitometreleri, hücrelerin dar borulardan hızlı bir şekilde geçebilmesine dayanır. Viskozitesi ve topaklanma eğilimi nedeniyle miyelin, sitometrelerde sorunlara neden olur ve genellikle hem ekipmana zarar verebilecek hem de numuneyi tahrip edebilecek tıkanmalara neden olarak verimi büyük ölçüde azaltır. Aşağı akışta sorun yaşamamak için bağışıklıkla zenginleştirilmiş parçaların toplanması sırasında tüm miyelini çıkarmaya dikkat edin.
Tüp boyamaya karşı plaka boyama: Bu protokolde, 1.5 mL'lik tüplerde veya 96 oyuklu bir plakada hücreleri boyamak için iki seçenek tanımladık. Her birinin kullanım durumu denemeye bağlıdır; Bununla birlikte, genel olarak, tüp boyama, yanlış yapılırsa hareket hücre kaybı riski taşıdığından, verimi etkileme riski plaka boyamadan daha düşüktür. Her tüp için süpernatanı aspire etmek zaman alıcı olduğu için plaka boyama çok daha hızlıdır. Sabitlemeden önce (sıralama vb. için), verimi en üst düzeye çıkarmak ve kayıp riskini azaltmak için tüp boyama kullanın. Bununla birlikte, HPTM analizi için, hücreler intranükleer boyama için sabitlendikten sonra, pelet daha kararlıdır ve fiske ile kayıp riski azalır.
Süreksiz yoğunluk gradyanının oluşturulması: Katmanlamayı oluştururken, bağışıklıkla zenginleştirilmiş fraksiyonu elde etmek için katmanların uygun şekilde ayarlanması esastır. Katmanlar bozulursa veya karışırsa ve bulanık görünürse, hücreler istenen yerlerine göre sıralanmayacak ve bağışıklıkla zenginleştirilmiş hücre fraksiyonunun elde edilmesinde zorluk yaşanacaktır. Bu meydana gelirse, miyelini çıkarmak için yoğunluk ortamıyla döndürün ve ardından kalan tüm fraksiyonları toplayın, 3 mL FACS tamponu ile 1 mL yoğunluk ortamına seyreltin ve iyice karıştırın (bu, birden fazla tüp gerektirecektir). Fren 0 açıkken 10 dakika boyunca 500 x g'de döndürün. Süpernatanı atın, sadece ~ 300 μL çözelti bırakın. Tüm numuneyi toplayın ve boyayın. Bu, azaltılmış sıralama yüzdeleri ve sitometrede daha fazla zaman harcanmasına neden olacaktır, ancak verim yine de karşılaştırılabilir olabilir.
İzolasyon yöntemini kullanırken, aynı fare beyninden RNA ve HPTM değerlendirmesi için hücre toplayabilmek faydalıdır. Bu durumda, canlı mikrogliaları sıraladıktan sonra, hücreler RNA değerlendirmesine bir kısım tahsis etmek için bölünebilir (iyi bir RNA verimi elde etmek için minimum giriş sayısı 75.000 hücredir) ve daha ileri akış sitometrisi analizi için bir kısım (MFI'nin iyi belirlenmesi için kuyu başına minimum 10.000 hücre). Bu durumda, akış sitometresi sıralaması gereklidir. Bununla birlikte, hücreleri yalnızca HPTM analizi için kullanmayı planlarken, sıralama gerekli değildir ve bağışıklık fraksiyonu P2RY12 antikoru ve HPTM antikoru ile boyanabilir. Sitometre üzerindeki geçit daha sonra, mikroglia içindeki yalnızca HPTM sinyalini analiz etmek için akış sıralamasında olduğu gibi P2RY12+ mikroglia için ayarlanabilir. Sıralamayı ortadan kaldırmak, protokolün daha hızlı ve daha uygun maliyetli olmasını sağlar. Ek olarak, kültürlenmiş hücrelerden HPTM'ler değerlendiriliyorsa, boyama protokolünden başlamak yeterlidir ve Şekil 6'da gösterildiği gibi hücre marker antikorları gerekmez. HPTM değerlendirme protokolü, kültürlenmiş, birincil ve IPSC'den türetilmiş hücreler dahil olmak üzere birçok hücre tipi için kullanılabilir.
Son olarak, mikroglia'nın izolasyon aşağı akışında sadece iki potansiyel kullanımını sunmuş olsak da, ChIP, CUT & Tag ve CUT & RUN gibi epigenetik teknikler de dahil olmak üzere birçok başka kullanım vardır. Spesifik lokuslardaki değişikliklerin karakterize edilmesinin ilgi çekici olduğu genomik epigenetik teknikler söz konusu olduğunda, profillenen herhangi bir mikroglial epigenetik modifikasyonun, enzimatik sindirim gibi izolasyon prosedüründeki herhangi bir adımdan kaynaklanan teknik eserler olmadığından emin olmak için deneylere uyarlanmış kromatin işaretlerinin11 yazarları ve silgileri için spesifik inhibitörler seçin. Kantitatif akış sitometrisi kullanmak gibi epigenetik işaretlerin global seviyelerindeki değişiklikleri değerlendirirken, prosedüre bağlı herhangi bir değişikliğin global düzeyde tespit edilecek kadar büyük olması beklenmez.
Genel olarak, tartışılan yöntemler, akış sitometrisi ile küresel histon modifikasyon seviyelerini ve diğer epigenetik değişiklikleri ölçmek için yeni, tek hücreli bir yöntem sağlar. Bu yöntemin, in vivo LPS'ye yanıt olarak mikrogliadaki arttırıcı belirteç H3K27ac'deki küresel değişiklikleri tespit etmek için yeterince duyarlı olduğunu gösterdik. Bu, LPS28'e yanıt veren güçlendiricilerin dramatik bir şekilde yeniden şekillendiğini gösteren LPS stimülasyonunu takiben H3K27ac'nin önceki ChIP dizilimi ile tutarlıdır. Bu yöntemin uygulamaları, gelişim ve hastalıktaki farklı beyin hücresi tiplerinde küresel epigenetik değişikliklerin incelenmesine izin verecektir.
Açıklamalar
Yazarların açıklayacak hiçbir şeyi yok.
Teşekkürler
Şekil 5'teki immünoblota yardım ettiği için Yanyang Bai'ye teşekkürler. Bu çalışma Kanada Sağlık Araştırmaları Enstitüleri [CRC-RS 950-232402 - AC] tarafından desteklenmiştir; Kanada Doğa Bilimleri ve Mühendislik Araştırma Konseyi [RGPIN-2019-04450, DGECR-2019-00069 - AC]; İskoç Riti Yardım Vakfı [21103'ten AC'ye] ve Beyin Kanada Vakfı'ndan [AWD-023132'den AC'ye]; British Columbia Üniversitesi Aborijin Yüksek Lisans Bursu (6481'den MT'ye); Britanya Kolumbiyası Yüksek Lisans Bursu (6768'den MT'ye); Kanada Açık Sinirbilim Platformu Öğrenci Akademik Ödülü (10901'den JK'ya); British Columbia Üniversitesi Dört Yıllık Doktora Bursu (6569'dan JK'ya). Fon sağlayıcıların çalışma tasarımı, veri toplama ve analizi, yayınlama kararı veya makalenin hazırlanmasında hiçbir rolü yoktu.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 0.5M EDTA | Invitrogen | AM9260G | |
| 15 mL Falcon Centrifuge Tubes, Polypropylene, Sterile | Falcon | 352196 | |
| 24-well Clear Not Treated Plates | Costar | 3738 | |
| 2-Mercaptoethanol | Gibco | 21985023 | |
| 96 Well Clear Polystyrene Microplate, clear round bottom, non treated surface | Corning | 3788 | |
| Acetyl Histone 3 K9 (C5B11) | Cell Signalling Technology | 9649S | Dilution: 1:100 |
| Acetyl Histone H4 K8 (2594) | Cell Signalling Technology | 2594S | Dilution: 1:100 |
| Acetyl-Histone H3 K27 (D5E4) | Cell Signalling Technology | 8173S | Dilution: 1:100 |
| Acetyl-Histone H3 Lys27 (MA523516) | Invitrogen | MA523516 | Dilution: 1:100 |
| Actinomycin D | New England Biolabs | 15021S | |
| Anisomycin | New England Biolabs | 2222S | |
| Anti-Histone H3 (tri methyl K4) | Abcam | ab213224 | Dilution: 1:100 |
| Anti-Lactyl-Histone H4 (Lys 12) Rabbit mAb | PTM Biolabs | PTM-1411RM | Dilution: 1:250 |
| Anti-L-Lactyllysine Rabbit pAb | PRM Biolabs | PTM-1401RM | Dilution: 1:250 |
| Apc anti-P2RY12 Antibody, Clone: S16007D | BioLegend | 848006 | |
| BSA | Tocris | 5217 | |
| Cyto-Last Buffer | BioLegend | 422501 | |
| dimethylsulfoxide, sterile | Cell Signalling Technology | 12611S | |
| DNAse I | STEMCELL Technologies | 07900 | |
| Donkey Anti Mouse AlexaFluor488 | Jackson ImmunoResearch | 715-546-150 | Dilution: 1:500 |
| Donkey Anti Rabbit AlexaFluor488 | ABclonal | AS035 | Dilution: 1:500 |
| Donkey Anti Rabbit AlexaFluor568 | Invitrogen | A10042 | Dilution: 1:500 |
| Donkey Anti Rabbit Brilliant Violet 421 | BioLegend | 406410 | Dilution: 1:500 |
| Fisherbrand Disposable Graduated Transfer Pipettes | Fisherbrand | 13-711-9AM | |
| Fisherbrand Disposable PES Filter Unit, 250mL | Fisherbrand | FB12566502 | |
| H3K18ac Polyclonal Antibody | Invitrogen | 720095 | Dilution: 1:100 |
| HBSS (10X), no calcium, no magnesium, no phenol red | Gibco | 14185052 | |
| HBSS, no calcium, no magnesium, no phenol red | Gibco | 14175103 | |
| Histone 3 Trimethyl K27 (ab6002) | Abcam | ab6002 | Dilution: 1:100 |
| KONTES Dounce Tissue Grinders 125mm 7mL | VWR | 885300-0007 | |
| Lactyl-Histone H3 (Lys 18) Rabbit mAb | PTM BIolabs | PTM-1406RM | Dilution: 1:250 |
| Lipopolysacharide | Sigma-Aldrich | L5418 | |
| Normal Donkey Serum | Jackson ImmunoResearch | 017-000-121 | |
| OneComp eBeads Compensation Beads | Invitrogen | 01-1111-41 | |
| PDS Kit, Papain Vial - Worthington Biochemical | Cedarlane | LK003178 | |
| Percoll | Sigma-Aldrich | GE17-0891-02 | |
| Phenol Red | VWR | RC57004 | |
| QIAshredder | Qiagen | 79656 | |
| Rainbow Fluorescent Particles, 1 peak (3.0-3.4 uM - Mid Range Intensity | BioLegend | 422905 | |
| RNase-free Microfuge Tubes, 1.5 mL | Invitrogen | AM12400 | |
| Rneasy Plus Micro Kit | Qiagen | 74034 | |
| Round Bottom Polypropylene Tubes with Caps, 5 mL | Corning | 352063 | |
| Triptolide | New England Biolabs | 97539 | |
| True Nuclear Transcription Factor Buffer Set | BioLegend | 424401 | |
| TruStain FcX PLUS (anti-mouse CD16/32) Antibody | BioLegend | 156604 | |
| Trypan Blue | VWR | 97063-702 | |
| Zombie Aqua Fixable Viability Kit | BioLegend | 423102 |
Referanslar
- Miller, J. L., Grant, P. A. The Role of DNA Methylation and Histone Modifications in Transcriptional Regulation in Humans. Epigenetics: Development and Disease. 61, 289-317 (2013).
- Kouzarides, T. Chromatin Modifications and Their Function. Cell. 128 (4), 693-705 (2007).
- Bannister, A. J., Kouzarides, T. Regulation of chromatin by histone modifications. Cell Research. 21 (3), 381-395 (2011).
- Barski, A., et al. High-resolution profiling of histone methylations in the human genome. Cell. 129 (4), 823-837 (2007).
- Vogel Ciernia, A., LaSalle, J. The landscape of DNA methylation amid a perfect storm of autism aetiologies. Nature Reviews. Neuroscience. 17 (7), 411-423 (2016).
- Keiser, A. A., et al. Systemic HDAC3 inhibition ameliorates impairments in synaptic plasticity caused by simulated galactic cosmic radiation exposure in male mice. Neurobiology of Learning and Memory. 178, 107367 (2021).
- McQuown, S. C., et al. HDAC3 is a critical negative regulator of long-term memory formation. The Journal of Neuroscience: The Official Journal of the Society for Neuroscience. 31 (2), 764-774 (2011).
- Barrett, R. M., et al. Hippocampal Focal Knockout of CBP Affects Specific Histone Modifications, Long-Term Potentiation, and Long-Term Memory. Neuropsychopharmacology. 36 (8), 1545-1556 (2011).
- Datta, M., et al. Histone Deacetylases 1 and 2 Regulate Microglia Function during Development, Homeostasis, and Neurodegeneration in a Context-Dependent Manner. Immunity. 48 (3), 514.e6-529.e6 (2018).
- Belhocine, S., et al. Context-dependent transcriptional regulation of microglial proliferation. Glia. 70 (3), 572-589 (2022).
- Gosselin, D., et al. An environment-dependent transcriptional network specifies human microglia identity. Science (New York, N.Y.). 356 (6344), eaal3222 (2017).
- Kettenmann, H., Hanisch, U. -. K., Noda, M., Verkhratsky, A. Physiology of Microglia. Physiological Reviews. 91 (2), 461-553 (2011).
- Sullivan, O., Ciernia, A. V. Work hard, play hard: how sexually differentiated microglia work to shape social play and reproductive behavior. Frontiers in Behavioral Neuroscience. 16, 989011 (2022).
- Das, P. M., Ramachandran, K., vanWert, J., Singal, R. Chromatin immunoprecipitation assay. BioTechniques. 37 (6), 961-969 (2004).
- Mahmood, T., Yang, P. C. Western blot: technique, theory, and trouble shooting. North American Journal of Medical Sciences. 4 (9), 429-434 (2012).
- Crowe, A., Yue, W. Semi-quantitative Determination of Protein Expression Using Immunohistochemistry Staining and Analysis: An Integrated Protocol. BIO-PROTOCOL. 9 (24), (2019).
- Seligson, D. B., et al. Global histone modification patterns predict risk of prostate cancer recurrence. Nature. 435 (7046), 1262-1266 (2005).
- Liu, B., et al. Global Histone Modification Patterns as Prognostic Markers to Classify Glioma Patients. Cancer Epidemiology, Biomarkers & Prevention. 19 (11), 2888-2896 (2010).
- Pan, R. Y., et al. Positive feedback regulation of microglial glucose metabolism by histone H4 lysine 12 lactylation in Alzheimer's disease. Cell Metabolism. 34 (4), 634.e6-648.e6 (2022).
- Zhang, D., et al. Metabolic regulation of gene expression by histone lactylation. Nature. 574 (7779), 575-580 (2019).
- Pösel, C., Möller, K., Boltze, J., Wagner, D. C., Weise, G. Isolation and Flow Cytometric Analysis of Immune Cells from the Ischemic Mouse Brain. Journal of Visualized Experiments. (108), 53658 (2016).
- Oblak, A. L., et al. Comprehensive Evaluation of the 5XFAD Mouse Model for Preclinical Testing Applications: A MODEL-AD Study. Frontiers in Aging Neuroscience. 13, 713726 (2021).
- Bohlen, C. J., Bennett, F. C., Bennett, M. L. Isolation and Culture of Microglia. Current Protocols in Immunology. 125 (1), e70 (2019).
- McKinnon, K. M. Multiparameter Conventional Flow Cytometry. Flow Cytometry Protocols. 1678, 139-150 (2018).
- Marsh, S. E., et al. Dissection of artifactual and confounding glial signatures by single-cell sequencing of mouse and human brain. Nature Neuroscience. 25 (3), 306-316 (2022).
- Wang, L., Gaigalas, A. K., Marti, G., Abbasi, F., Hoffman, R. A. Toward quantitative fluorescence measurements with multicolor flow cytometry. Cytometry Part A. 73A (4), 279-288 (2008).
- Rumbaugh, G., Miller, C. A. Epigenetic changes in the brain: measuring global histone modifications. Methods in Molecular Biology (Clifton, N.J). 670, 263-274 (2011).
- Xavier, A. M., et al. Systematic delineation of signaling and epigenomic mechanisms underlying microglia inflammatory activity in acute and chronic brain pathologies. BioRvix. , (2022).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır