Method Article
Monoklonal Antikor Güvenliğinin Tahmini için Sitokin Salınım Testlerinin Sağlamlığını Doğrulamak için Referans Reaktiflerin Kullanılması
Bu Makalede
Özet
Sitokin salınım testi referans reaktiflerinin kullanılması, immünoterapötik monoklonal antikorların daha tekrarlanabilir ve standardize edilmiş in vitro güvenlik profillerine izin verir. Burada, bazı terapötik monoklonal antikorların güvenliğini tahmin etmek için sitokin salınım testlerinin bir referans reaktif paneliyle birlikte nasıl kullanılabileceğini açıklıyoruz.
Özet
Spesifik bağışıklık hücrelerini doğrudan uyarmak veya bağışıklık sisteminin endojen bir düzenleyicisini bloke ederek veya aktive ederek dolaylı olarak bağışıklık tepkisini arttırmak için tasarlanmış yeni immünostimülatör antikor ilaçları, sitokin salınım sendromu (CRS) gibi bağışıklık ile ilişkili ciddi advers olaylara neden olma potansiyeline sahiptir. Bu nedenle, bu tür ilaçların güvenlik profilini, ilk insan dozu uygulamasından önce in vivo ve in vitro deneylerin bir kombinasyonu ile değerlendirmek çok önemlidir. Önerilen antikor terapötiğinin insan bağışıklık hücreleri (periferik kan mononükleer hücreleri (PBMC'ler), tam kan veya başka türlü) ile birlikte kültürlendiği ve üretilen inflamatuar sitokin miktarının ölçüldüğü sitokin salınım testleri (CRA'lar), tehlike tanımlaması için kritik öneme sahiptir. Bununla birlikte, farklı kontrol antikorları kullanan farklı laboratuvarlar, CRA'ların uyumunu tehdit edebilir ve klinik olarak ilgili kontrollerin (TGN1412 gibi) elde edilmesi zor olabilir, bu da laboratuvarlar arasında karşılaştırılması zor olan daha az doğru veya güvenilir sonuçlara veya verilere yol açabilir. Pozitif ve negatif kontrollerin bir CRA'ya dahil edilmesi, sonuçların doğruluğunu ve güvenilirliğini sağlayabilir. Ulusal Biyolojik Standartlar ve Kontrol Enstitüsü (NIBSC), çeşitli laboratuvarlar ve tahlil yöntemlerinde sonuçları uyumlu hale getirmek için çeşitli CRA platformlarında kullanılması amaçlanan bir liyofilize antikor kontrolleri paneli üretmiştir. Üç farklı pozitif kontrol antikoru, hastalarda doza bağımlı CRS'yi indüklediği bilinen anti-CD52, anti-CD3 ve anti-CD28 süperagonisti (SA) içerir. Her antikor, izotip uyumlu bir negatif kontrol antikoru ile sağlanır. Bu referans reaktifler panelinin daha önce laboratuvarlar arası iyi bir tekrarlanabilirliğe sahip olduğu ve çeşitli CRA platformlarından gelen güvenlik verilerinin güvenilirliğini ve sağlamlığını artırmak için uygun kontroller olduğu gösterilmiştir.
Giriş
İndüklenmiş sitokin salınımı, bazı immünomodülatör monoklonal antikorların (mAbs) beklenen ve istenen bir etkisi olabilir. Bununla birlikte, proinflamatuar sitokinlerin beklenmedik salınımı, ateş, yorgunluk ve hatta çoklu organ yetmezliği ile karakterize hastalarda sitokin salınım sendromuna (CRS) neden olabilir1. Bu nedenle, yeni immünostimülatör mAb'lerin, bir sitokin salınım testinde (CRA) sitokinlerin salınımını ölçerek CRS'ye neden olma potansiyelleri açısından in vitro olarak test edilmesi çok önemlidir.
TGN1412, ko-stimülatör reseptör CD282'yi çapraz bağlayarak T-lenfositleri aktive edebilen bir CD28 süperagonisti (CD28SA) olarak işlev görerek B hücreli kronik lenfositik lösemi için potansiyel bir tedavi olarak geliştirilen bir monoklonal antikordur. 2006 yılında, bir klinik çalışmada TGN1412 uygulanan altı sağlıklı gönüllü, ilacı aldıktan sonraki saatler içinde CRS de dahil olmak üzere ciddi yan etki yaşadı1. Bu, denemenin durdurulmasına ve TGN1412 daha fazla geliştirmeden çekilmesine yol açtı. Yan etki olarak CRS'ye neden olduğu bilinen diğer antikorlar arasında anti-CD52 mAb, Campath-1H3 ve anti-CD3 mAb, Muromonab (OKT3) 4 bulunur. Hastalarda doza bağlı CRS'yi indükleme yetenekleri göz önüne alındığında, TGN1412, OKT3 ve Campath-1H, bir CRA'dan sağlam ve güvenilir sonuçlar elde etmek için uygun pozitif kontrol antikorlarıdır. Ancak, bu kontrol antikorları, yüksek maliyetler veya kısıtlı bulunabilirlik nedeniyle daha önce kolayca elde edilemiyordu.
Bununla birlikte, bu üç antikorun 5,6,7 izotip uyumlu negatif kontrollerin yanı sıra yeniden üretilmiş bir liyofilize referans paneli, yakın zamanda Ulusal Biyolojik Standartlar ve Kontrol Enstitüsü (NIBSC) tarafından kullanıma sunulmuştur. Bu referans reaktif panelinin daha önce laboratuvarlar arası iyi tekrarlanabilirliğe8 sahip olduğu gösterilmiştir ve bu nedenle çeşitli CRA platformlarından gelen güvenlik verilerinin güvenilirliğini ve sağlamlığını artırmak için uygun bir kontroldür. Bu nedenle, bu protokolün bu reaktiflerle birlikte kullanılmasının ardındaki mantık, bu reaktiflerin uluslararası bir ortak çalışmada doğrulanmış olması avantajıyla CRA uyumunu geliştirmektir8.
Burada, antikor kaynaklı CRS'yi tahmin etmek için bu referans reaktifler panelinin katı faz (SP) PBMC CRA ve sulu faz (AQ) tam kan (WB) CRA'da en iyi nasıl kullanılacağını açıklıyoruz. Bu CRA formatlarının her ikisi de antikor sunum modu (katı faz için dolaylı, sulu faz için doğrudan) ve farklı yanıtlayıcı hücre gruplarını hedef almaları nedeniyle tamamlayıcıdır. Aynı protokol, seyreltilmiş tam kan (dWB) veya endotelyal: PBMC ko-kültürleri ile kullanım için uyarlanabilir.
Protokol
Aşağıdaki protokol, NIBSC araştırma etik komitesinin yönergelerini takip eder. Yürürlükteki yönetmeliklere ve yönergelere uygun olarak, sağlıklı donör veya hastaların yazılı bilgilendirilmiş onayını alın. Protokolün tüm hazırlık adımlarını bir laminer akış hücre kültürü başlığında gerçekleştirmek için steril teknikler kullanın. Tüm reaktifler ve ekipmanlarla ilgili ayrıntılar için Malzeme Tablosuna bakın.
1. Katı faz (SP) testi için mAb ile kaplanmış plakaların hazırlanması
- Referans reaktif ampullerinin içeriğini 1 mL steril damıtılmış su ile sulandırın. Antikor çözeltisini karıştırmadan ve steril kapaklı bir tüpe aktarmadan önce rehidrasyon için 5-10 dakika bekleyin.
- 1 mL suda sulandırıldıktan sonra, aşağıdaki rekombinant antikorların stok konsantrasyonu 200 μg/mL olacaktır: anti-CD3 (15/162), anti-CD52 (15/178), anti-CD52 için IgG1K izotip kontrolü (15/198), anti CD3 için IgG2a izotip kontrolü (15/218), anti-CD28SA için IgG4 izotip kontrolü (15/232).
- 1 mL suda sulandırıldıktan sonra, anti-CD28SA (15/144) stok konsantrasyonu 100 μg/mL olacaktır. 7 güne kadar kısa süreli saklama için, sulandırılmış malzemeyi steril kapaklı bir tüpte 4 °C'ye aktarın.
- Sulandırılmış antikorları ve test antikorlarını steril PBS'de 10 μg / mL'ye seyreltin ve steril TC ile muamele edilmemiş U-tabanlı polipropilen 96 oyuklu mikrotitre plakanın kuyucuklarını 100 μL seyreltilmiş antikor çözeltisi (1 μg / kuyu) ile kaplayın ve gece boyunca 4 ° C'de inkübe edin.
NOT: Protein adsorpsiyonu için polipropilen plakaların kullanılması önemlidir, çünkü bunlar standart reaktiflerin9 doğrulanmasında kullanılmıştır.
2. PBMC'lerin Hazırlanması
- Heparinize / heparin içeren tüplere en az 30 mL periferik tam kan (WB) toplayın ve sodyum heparin ile uygun karışımı sağlamak için birkaç kez ters çevirin.
- Daha sonra sulu faz tam kan testinin hazırlanmasında kullanılmak üzere ayrı bir tüpte 15 mL WB aktarın (adım 3.1)
- Kalan 15 mL kanı PBS veya serumsuz RPMI-1640 ortamı ile 1: 1 hacim oranında seyreltin ve seyreltilmiş kanı 50 mL'lik bir tüpte 15 mL yoğunluk gradyan ortamının (örn. lenforep, Ficoll-Hypaque) üzerine nazikçe katmanlayın.
- Tüpü 500 x g'da oda sıcaklığında 20 dakika boyunca frensiz ve kanı farklı bileşenlerine ayırmak için düşük ivmeli bir açılır rotorda santrifüjleyin.
- Santrifüjlemeden sonra, yoğunluk gradyanı, bir plazma üst tabakası olarak ayrılacak, ardından PBMC'leri içeren ince bir buffy kaplama tabakası ve kırmızı kan hücreleri (RBC'ler) ve nötrofiller ve eozinofiller dahil olmak üzere polimorfonükleer granülositleri içeren bir alt tabaka izleyecektir. PBMC'leri doğrudan üst plazma katmanından PBMC'lere bir pipet sokarak dikkatlice hasat edin. Alternatif olarak, hücrelerin toplanmasından önce üst katmanı çıkarın.
- Buffy kaplamayı 10 mL PBS veya serumsuz RPMI-1640 ortamında nazikçe yeniden süspanse edin. Hücreleri peletlemek için tüpü 500 x g'da 10 dakika boyunca tekrar santrifüjleyin. Süpernatanı çıkarın ve atın.
- Yıkama adımı 2.6'yı tekrarlayın. ve peleti %10 FCS ile 2 mL RPMI'de yeniden süspanse edin (tam RPMI-1640, cRPMI)
- Bir hemositometre kullanarak hücreleri sayın10.
- PBMC'leri cRPMI'de 1 x 106 hücre / mL konsantrasyona ayarlayın.
3. Sulu faz (AQ) tam kan (WB) sitokin salınım testinin hazırlanması
- 96 oyuklu U-tabanlı polistiren plakanın kuyularına 190 μL WB ekleyin. Halihazırda 100 μg / mL'de değilse, tüm tedavi antikorlarını ve referans reaktiflerini PBS'de 100 μg / mL'ye önceden seyreltin.
- %95 WB'de 5 μg/mL antikorluk bir nihai antikor konsantrasyonu vermek için 190 μL WB'ye 10 μL seyreltilmiş antikor ekleyin.
- Plakayı 37 ° C'de nemlendirilmiş bir inkübatörde 48 saat inkübe edin.
4. Katı faz (SP) PBMC sitokin salınım testinin hazırlanması
- Çok kanallı bir pipetle, kaplanmış plakalardan (adım 1'de açıklanmıştır) antikor çözeltisini çıkarın ve atın, bir reaktif rezervuarını PBS ile doldurun ve bağlanmamış mAb'leri çıkarmak için plakayı 3x 200 μL PBS ile yıkayın.
- Her bir oyuklu adımdan 2.8 μL hücre süspansiyonu ekleyin. Plakayı 37 ° C,% 5 CO2'de nemlendirilmiş bir inkübatörde 48 saat inkübe edin.
5. Süpernatan veya plazma toplanması
- Kontrol ve test mAbs ile 48 saat inkübasyondan sonra, plakaları 5 dakika boyunca 400 x g'da santrifüjleyin ve hücre peletini rahatsız etmemeye dikkat ederek hücre şartlandırılmış ortamı veya plazmayı toplayın. Toplanan süpernatanı veya plazmayı -20 °C'de dondurun.
NOT: Plazmayı toplarken kırmızı kan hücresi peletini rahatsız etmediğinizden emin olun.
6. Süpernatan veya plazmadaki sitokinlerin miktar tayininin yapılması
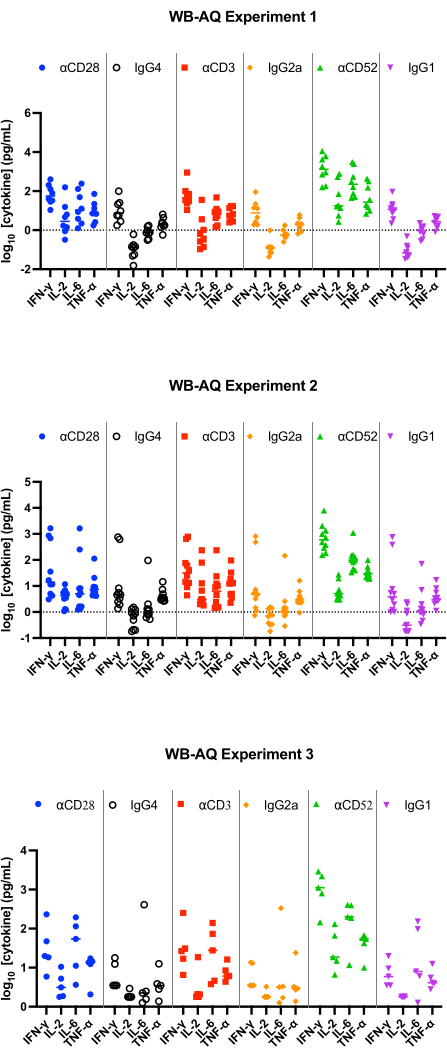
- Toplanan süpernatan veya plazmayı kullanarak, tercih edilen multipleks seçeneğini kullanarak IFN-γ, IL-2, TNF-α ve IL-6 konsantrasyonlarının sitokin analizini yapın. Sitometrik boncuk testi kullanılarak multipleks sitokin analizinin örnek bir yöntemi daha önce yayınlanmıştır11.
NOT: Temsili sonuçların oluşturulmasında kullanılan multipleks kiti için lütfen Malzeme Tablosuna bakın.
Sonuçlar
SP testinin sonuçları, 48 saatte tüm pozitif kontrol antikorlarından pg / mL aralığında IL-2, IFN-γ, IL-6 ve TNF-α12'nin salındığını göstermeli ve eşleşen izotip kontrollerinden istatistiksel olarak anlamlı derecede büyük olmalıdır. Temsili sonuçlarımız, pozitif kontrol antikorlarının, αCD28, αCD3 ve αCD28SA'nın, PBMC SP testinde çalıştırıldığında, eşleşen izotip kontrollerine kıyasla önemli ölçüde yüksek seviyelerde IFN-γ, IL-6 ve TNF-α indüklediğini göstermektedir (Şekil 1). Bu test aynı zamanda, eşleşen izotipine (859.0) kıyasla αCD28SA ile stimülasyondan IL-2 salınımının yüksek kat değişimi ile karakterize edilir. αCD3 ve αCD52, hala IL-2 ekspresyonunu indüklerken, αCD28SA'dan daha düşük kat değişikliklerine neden olur (sırasıyla αCD3 ve αCD52 için 6.2 ve 3.3, Şekil 2).
WB AQ testinde (Şekil 3), saptanabilir sitokinlerin seviyesi PBMC SP testinden belirgin şekilde daha düşüktür, ancak αCD52 antikoru tarafından stimülasyona karşı daha büyük bir duyarlılık ile karakterize edilir (Şekil 2 ve Şekil 3) IL-2, IFN-γ ve IL-6'nın 100'ün üzerinde ortalama kat değişiklikleri.
Gelecekteki ilk insan dozunun, ilgili izotip kontrollerine kıyasla sitokin salınımında beklenmedik önemli artışlara neden olmaması beklenebilecek bir test antikoru. Bununla birlikte, yeni bir terapötik mAb'nin gelişimini durdurmak yerine, bir CRA'da olumlu bir sonuç, risk / fayda yönetiminin bir parçası olarak düşünülmelidir13. Yeni bir CRA platformu geliştirirken, platformun tekrarlanabilirliğini sağlamak için tahlil farklı bir donör seti kullanılarak tekrarlanmalıdır. Bağışçılar14 arasındaki yanıtın değişkenliğini hesaba katmak için de önem verilmelidir ve bu nedenle iyi güçlü bir deney önerilir15. Yanıtların genişliğini anlamak ve donör yanıtlarında gözlemlenebilecek değişkenliğin tam bir temsilini elde etmek için, tahlil ideal olarak tekrarlanan deneylerde terapötik tahlillere ek olarak birden fazla bireysel donör ile yapılmalıdır.

Şekil 1: PBMC-SP deneyinden sitokin salınımı. PBMC-SP sitokin salınım testlerinden elde edilen IFN-γ, IL-2, IL-6 ve TNF-α salınımının temsili sonuçları (her biri deney başına 5-8 donör içeren 3 bağımsız deney; n = 8, n = 10, n = 5 [yukarıdan aşağıya]) referans reaktif antikorları kullanılırken 48 saat sonra. Kısaltmalar: PBMC = periferik kan mononükleer hücreleri; SP = katı faz; IFN-γ = interferon-gama; IL-2 = interlökin 2; IL-6 = interlökin 6; TNF-α = tümör nekroz faktörü alfa. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
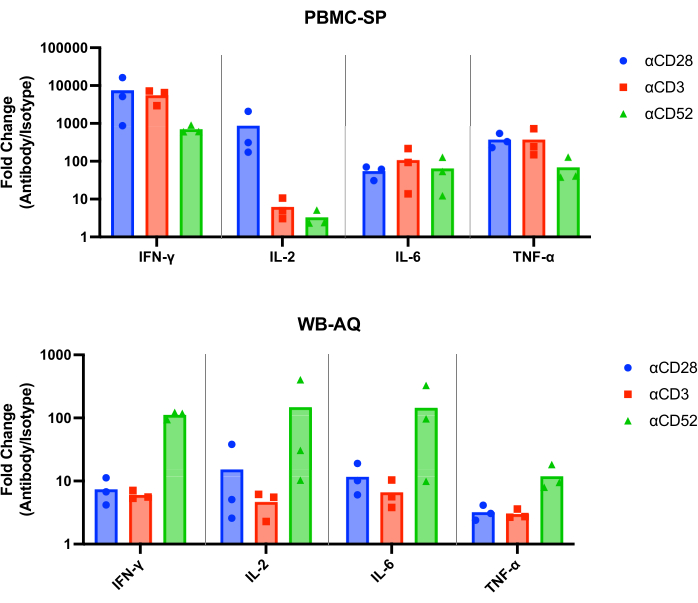
Şekil 2: PBMC-SP ve WB-AQ deneylerinden sitokin kıvrım değişimi artışı. 48 saat sonra PBMC-SP ve WB-AQ sitokin salınım testlerinden elde edilen, CRS ile indüklenen antikor referans reaktiflerinin IFN-γ, IL-2, IL-6 ve TNF-α salınımının, eşleşen izotip kontrollerine göre kat değişimi. Kısaltmalar: PBMC = periferik kan mononükleer hücreleri; SP = katı faz; WB = tam kan; AQ = sulu (faz); IFN-γ = interferon-gama; IL-2 = interlökin 2; IL-6 = interlökin 6; TNF-α = tümör nekroz faktörü alfa; CRS = sitokin salınım sendromu. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Şekil 3: WB-AQ deneyinden sitokin salınımı. WB-AQ sitokin salım testlerinden elde edilen IFN-γ, IL-2, IL-6 ve TNF-α salınımının temsili sonuçları (her biri deney başına 5-8 donör içeren 3 bağımsız deney; n = 8, n = 10, n = 5 [yukarıdan aşağıya]) referans reaktif antikorları kullanılırken 48 saat sonra. Kısaltmalar: WB = tam kan; AQ = sulu (faz); IFN-γ = interferon-gama; IL-2 = interlökin 2; IL-6 = interlökin 6; TNF-α = tümör nekroz faktörü alfa. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Burada, pozitif ve negatif kontroller için bir referans reaktifler paneli kullanılarak, antikor kaplı bir plakadan veya çözelti içinde antikor ile antikor aracılı stimülasyonu takiben PBMC'lerden ve WB'den sitokin salınımını ölçme yöntemleri açıklanmaktadır. Bu tahlillerin her birinin kendi ilişkili güçlü ve zayıf yönleri vardır. Lenfositler, monositler ve granülositler gibi çeşitli bağışıklık hücrelerinin oranı CRA'lar için kullanılan iki deneysel matriste farklı olduğu için PBMC ve WB testleri tamamlayıcıdır. Bir WB testinin, PBMC monokültürünün aksine in vivo durumu daha iyi temsil edebilmesine rağmen, eski platformun TGN1412 ve OKT3'ten kaynaklanan T hücresi aracılı CRS riskini daha az tahmin ettiğini gözlemlemek ilginçtir315; IL-2 aracılı T hücresi genişlemesini inhibe eden RBC'ler üzerindeki glikoforin A'nın bir sonucu16. Bununla birlikte, anti-CD52'den kaynaklanan CRS riskinin tahmini, nötrofillerin varlığına bağlı olarak WB CRA'da bozulmadan kalır (PBMC izolasyonu için kullanılan adım 2'de açıklanan geleneksel yoğunluk gradyan yöntemleri sırasında kaybolur).
CRA'nın formatı (SP veya AQ sunumu), CRS'nin spesifik mekanizmasının tespiti için kritik öneme sahiptir. Örneğin, mAb'nin insan lenfositlerine17,18 sulu faz sunumu, TGN1412 klinik öncesi in vitro güvenlik testleri sırasında kullanılan, muhtemelen lokalize hücre reseptörü kümelenmesi ve katılımı19 eksikliği ve bunun sonucunda sulu fazda antikorun aracılık ettiği T hücresi aktivasyonu nedeniyle CRS riskini tanımlayamadı. Aslında, TGN1412 aracılı CRS, burada sunulduğu gibi Fc-gama reseptörü (FcγR) çapraz bağlanmasını yapay olarak kopyalayan SP formatında veya CD32 + bağışıklık hücreleri (B hücreleri20 ve monositler21 gibi) ile yüksek yoğunlukta ve Fc etkileşiminde PBMC ön kültüründe temasa bağlı hazırlama ile doğru bir şekilde tespit edilebilir.
Bu platformlara ek olarak, CRA'yı daha karmaşık ko-kültür sistemleriyle gerçekleştirmenin başka yolları da vardır. Bu yöntemlerde tarif edilenlere alternatif bir CRA örneği, PBMC'leri otolog kan büyümesi endotel hücreleri (BOEC'ler) ile birlikte kültürlemektir22. Bu test, 2015 yılında, kafa karıştırıcı doku uyumsuzluğunu ortadan kaldırarak, o zamanki geleneksel karışık donör HUVEC: PBMC testinde bir gelişme olarak tanımlandı. Anti-CD28SA CRS'ye WB testinden daha iyi duyarlılık gösterir ve ayrıca in vivo olarak bulunan endotel hücreleri ve lökositlerin kombinasyonunu taklit ederek PBMC monokültür testinin sınırlamasının üstesinden gelir, ancak özel hücre kültürü teknikleri gerektiren daha uzun prosedürel adımlar pahasına22.
Ayrıca, bu protokol özellikle IFN-γ, IL-2, IL-6 ve TNF-α salınımına odaklanırken, MHRA'daki meslektaşları daha önce IL-12 ve bu ayardaki diğerlerinebakmışlardır 23. IL-12 üretimi, bu pozitif kontrol CRS antikorları tarafından arttırılır, ancak özellikle hassas değildir ve bu nedenle belki de bu modalitede CRS'nin büyük bir öngörücüsü değildir. Diğerlerinin yanı sıra IL-15 gibi bazı sitokinler hiçbir zaman test edilmemiştir, ancak protokolümüzde değerlendirilen 4 sitokin potansiyel KRS riskinin iyi bir göstergesidir. Tabii ki, test edilen modaliteye ve antikorlara bağlı olarak diğer sitokinler de değerlendirilebilir.
Bu gözlemler bir araya getirildiğinde, referans reaktiflerin kullanımının yeni antikorların CRS riskini belirlemeye yardımcı olabilmesine rağmen, CRS potansiyelini tanımlayamayabilecek optimal olmayan bir CRA platformundan kaçınmak için dikkatli olunması gerektiğini belirtmenin önemini vurgulamaktadır. En önemlisi, bir terapötiğin tahmin edilen etki mekanizması, Fc bölgesi veya antijen eksprese eden hücreler üzerindeki varsayımsal etkisi yoluyla , tahlilin biyolojisi ile eşleşmelidir. Bu nedenle, bu makalede tartışılan test terapötik ve referans reaktiflerinin etki mekanizmasındaki farklılıklar, test antikoru için ilgili bir CRA'nın referans reaktiflerin biyolojisi ile uyumsuz olabileceği şekilde potansiyel bir sınırlama oluşturabilse de, tahlil, tehlike tanımlaması için sağlam, güvenilir bir platform sağlar. Bununla birlikte, çeşitli etki mekanizmalarını ve bağışıklık hücresi alt kümelerini kapsayan çeşitli CRA formatlarından elde edilen sonuçlar, güvenlik değerlendirme verilerine en iyi şekilde güvenmek için gerekli olabilir.
Açıklamalar
EM daha önce İlaç ve Sağlık Ürünleri Düzenleme Kurumu (MHRA) tarafından istihdam edildi. Kalan yazarların herhangi bir çıkar çatışması yoktur.
Teşekkürler
Bu çalışma Ulusal Biyolojik Standartlar ve Kontrol Enstitüsü tarafından finanse edildi. Makaleyi gözden geçirdiği ve yararlı yorum ve önerileri için Sandra Diebold'a teşekkür ederiz. Videoyu çektiği için Ka Seng Ieong'a da müteşekkiriz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1.5 ml Microcentrifuge Tubes, Natural (Sterile) | Starlab | S1615-5510 | |
| Fetal Bovine Serum, qualified, heat inactivated | ThermoFisher | 10500064 | |
| Heparinized tubes | ThermoFisher | 12967676 | |
| Heracell 150i CO2 Incubator | ThermoFisher | 16406639 | |
| MESO QuickPlex SQ 120 Human Proinflammatory Panel 1 V-PLEX kit | Meso Scale Discovery | K15049 | |
| MESO QuickPlex SQ 120MM | Meso Scale Discovery | AI1AA-0 | |
| Neubauer Improved Haemocytometer Counting Chamber | Hawksley | AS1000 | |
| Panel of lyophilized recombinant antibody controls for Cytokine Release Assays | NISBC | 19/156 | |
| PBS | ThermoFisher | 10010023 | |
| Polypropylene 96-well microtiter plate | Corning | 3879 | |
| Polystyrene 96-well microtiter plate | Corning | 3799 | |
| RPMI 1640 | ThermoFisher | 11875093 | |
| Sorvall ST 40 Centrifuge | ThermoFisher | 75004525 | |
| Sterile water | ThermoFisher | 15230162 |
Referanslar
- Suntharalingam, G., et al. Cytokine storm in a phase 1 trial of the anti-CD28 monoclonal antibody TGN1412. The New England Journal of Medicine. 355 (10), 1018-1028 (2006).
- Hünig, T. The storm has cleared: lessons from the CD28 superagonist TGN1412 trial. Nature Reviews Immunology. 12 (5), 317-318 (2012).
- Wing, M. G., et al. Mechanism of first-dose cytokine-release syndrome by CAMPATH 1-H: involvement of CD16 (FcgammaRIII) and CD11a/CD18 (LFA-1) on NK cells. Journal of Clinical Investigation. 98 (12), 2819-2826 (1996).
- Gaston, R. S., et al. OKT3 first-dose reaction: Association with T cell subsets and cytokine release. Kidney International. 39 (1), 141-148 (1991).
- Riechmann, L., Clark, M., Waldmann, H., Winter, G. Reshaping human antibodies for therapy. Nature. 332 (6162), 323-327 (1988).
- Kung, P., Goldstein, G., Reinherz, E. L., Schlossman, S. F. Monoclonal antibodies defining distinctive human T cell surface antigens. Science. 206 (4416), 347-349 (1979).
- Ball, C., et al. Antibody C region influences TGN1412-like functional activity in vitro. Journal of Immunology. 189 (12), 5831-5840 (2012).
- Vessillier, S., et al. Development of the first reference antibody panel for qualification and validation of cytokine release assay platforms - Report of an international collaborative study. Cytokine: X. 2 (4), 100042(2020).
- Findlay, L., et al. Improved in vitro methods to predict the in vivo toxicity in man of therapeutic monoclonal antibodies including TGN1412. Journal of Immunological Methods. 352 (1-2), 1-12 (2010).
- oVE Science Education Database. Science Education Database. Basic Methods in Cellular and Molecular Biology. Using a Hemacytometer to Count Cells. Journal of Visualized Experiments. , (2023).
- Lehmann, J. S., Zhao, A., Sun, B., Jiang, W., Ji, S. Multiplex Cytokine Profiling of Stimulated Mouse Splenocytes Using a Cytometric Bead-based Immunoassay Platform. Journal of Visualized Experiments. (129), e56440(2017).
- Murthy, H., Iqbal, M., Chavez, J. C., Kharfan-Dabaja, M. A. Cytokine Release Syndrome: Current Perspectives. Immunotargets Therapy. 8, 43-52 (2019).
- Vidal, J. M., et al. In vitro cytokine release assays for predicting cytokine release syndrome: the current state-of-the-science. Report of a European Medicines Agency Workshop. Cytokine. 51 (2), 213-215 (2010).
- Grimaldi, C., et al. Cytokine release: A workshop proceedings on the state-of-the-science, current challenges and future directions. Cytokine. 85, 101-108 (2016).
- Vessillier, S., et al. Cytokine release assays for the prediction of therapeutic mAb safety in first-in man trials - Whole blood cytokine release assays are poorly predictive for TGN1412 cytokine storm. Journal of Immunological Methods. 424, 43-52 (2015).
- Chu, J. W. K., Sharom, F. J. Glycophorin A interacts with interleukin-2 and inhibits interleukin-2-dependent T-lymphocyte proliferation. Cellular Immunology. 145 (2), 223-239 (1992).
- Stebbings, R., Eastwood, D., Poole, S., Thorpe, R. After TGN1412: recent developments in cytokine release assays. Journal of Immunotoxicology. 10 (1), 75-82 (2013).
- Hanke, T. Lessons from TGN1412. Lancet. 368 (9547), author reply 1570 1569-1570 (2006).
- Stebbings, R., et al. #34;Cytokine storm" in the phase I trial of monoclonal antibody TGN1412: better understanding the causes to improve preclinical testing of immunotherapeutics. Journal of Immunology. 179 (5), 3325-3331 (2007).
- Bartholomaeus, P., et al. Cell contact-dependent priming and Fc interaction with CD32+ immune cells contribute to the TGN1412-triggered cytokine response. Journal of Immunology. 192 (5), 2091-2098 (2014).
- Hussain, K., et al. Upregulation of FcγRIIb on monocytes is necessary to promote the superagonist activity of TGN1412. Blood. 125 (1), 102-110 (2015).
- Reed, D. M., et al. An autologous endothelial cell:peripheral blood mononuclear cell assay that detects cytokine storm responses to biologics. The FASEB Journal. 29 (6), 2595-2602 (2015).
- Eastwood, D., et al. Severity of the TGN1412 trial disaster cytokine storm correlated with IL-2 release. British Journal of Clinical Pharmacology. 76 (2), 299-315 (2013).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır