İn Vivo Üç Boyutlu Floresan Mikroskobu Kullanılarak Zebra Balığı Larvalarının Tüm Beyin Görüntülemesi
Bu Makalede
Özet
Burada, larva zebra balıklarının üç boyutlu floresan mikroskobu kullanılarak in vivo tüm beyin görüntülemesi için bir protokol sunulmaktadır. Deneysel prosedür numune hazırlama, görüntü toplama ve görselleştirmeyi içerir.
Özet
Omurgalı model bir hayvan olarak, larva zebra balığı nörobilimde yaygın olarak kullanılmaktadır ve tüm beyin aktivitesini hücresel çözünürlükte izlemek için eşsiz bir fırsat sunmaktadır. Burada, numune hazırlama ve immobilizasyon, numune gömme, görüntü toplama ve görüntüleme sonrası görselleştirme dahil olmak üzere üç boyutlu floresan mikroskobu kullanarak larva zebra balıklarının tüm beyin görüntülemesini gerçekleştirmek için optimize edilmiş bir protokol sunuyoruz. Mevcut protokol, larva zebra balığı beyninin yapısının ve nöronal aktivitesinin, konfokal mikroskopi ve özel olarak tasarlanmış floresan mikroskobu kullanılarak 1 saatten fazla bir süre hücresel çözünürlükte in vivo görüntülenmesini sağlar. Protokoldeki kritik adımlar da tartışılmaktadır, numune montajı ve konumlandırma, agaroz jelinde kabarcık oluşumunu ve tozu önleme ve agaroz jelinin eksik katılaşması ve balığın felç edilmesinden kaynaklanan görüntülerde hareketten kaçınma dahil olmak üzere. Protokol birden fazla ayarda doğrulanmış ve onaylanmıştır. Bu protokol, larva zebra balıklarının diğer organlarını görüntülemek için kolayca uyarlanabilir.
Giriş
Zebra balığı (Danio rerio), larva aşamasındaki optik şeffaflığı, hızlı gelişimi, düşük bakım maliyeti ve çeşitli genetik araçların mevcudiyeti nedeniyle sinirbilimde model bir omurgalı hayvan olarak yaygın bir şekilde benimsenmiştir 1,2,3,4. Özellikle, larvaların optik şeffaflığı, biyolojik olayların genetik olarak kodlanmış floresan muhabirleri ile birleştiğinde 5,6,7,8,9, hem nöronal aktiviteyi hem de yapıyı tüm beyin düzeyinde görüntülemek için eşsiz bir fırsat sunar 10,11,12,13,14 . Bununla birlikte, hücresel çözünürlüğü destekleyen bir mikroskopla bile, elde edilen görüntüler bilgiyi mutlaka tek hücre düzeyinde tutmaz; Optik görüntü kalitesi, numune montajı için kullanılan agaroz jelinin getirdiği sapma nedeniyle bozulabilir, balıklar bir açıyla monte edilebilir, böylece ilgilenilen bölgeler mikroskopun görüş alanı içinde tam olarak yer almaz ve balıklar kayıt sırasında hareket edebilir, görüntülerde hareket artefaktlarına neden olabilir veya görüntülerden doğru sinyal ekstraksiyonunu engelleyebilir.
Bu nedenle, minimum parazit ve hareketle yüksek kaliteli görüntü verileri elde etmek için etkili ve tekrarlanabilir bir protokole ihtiyaç vardır. Ne yazık ki, larva zebra balıklarının bütün bir beynini in vivo 15,16,17,18,19 olarak görüntülemek için halka açık protokoller, prosedürü sadece kısaca açıklamakta, agaroz katılaşma, hassas montaj teknikleri ve forseps kullanarak numune konumlandırma gibi ayrıntıların önemli kısımlarını her deneyciye bırakmaktadır. Ayrıca agaroz konsantrasyonu ve immobilizasyon yöntemleri 10,11,14,15,16,17,18,19'daki tutarsızlıklar görüntüleme işlemi sırasında balık hareketinden kaynaklanan zorluklara yol açabilmektedir.
Burada, larva zebra balıklarının üç boyutlu floresan mikroskobu kullanılarak tüm beyin görüntülemesi için ayrıntılı bir protokol sağlanmıştır. Şekil 1 , protokole grafiksel bir genel bakış sunmaktadır: numune hazırlama ve immobilizasyon, numune gömme, görüntü toplama ve görüntüleme sonrası görselleştirme. Larva zebra balığı beyninin in vivo yapısal ve fonksiyonel görüntülemesi, ticari bir konfokal mikroskop ve özel olarak tasarlanmış bir floresan mikroskobu kullanılarak gösterilmiştir. Bu protokol, deneysel ihtiyaçlara ve tasarıma bağlı olarak belirli duyusal uyaranlar veya davranış bağlamları ile beyin görüntüleme için uygulayıcılar tarafından uyarlanabilir.
Protokol
Tüm zebra balığı deneyleri, KAIST'in Kurumsal Hayvan Bakımı ve Kullanımı Komitesi (IACUC) (KA2021-125) tarafından onaylanmıştır. Kalsiyum göstergesi GCaMP7a'nın pan-nöronal ekspresyonuna sahip toplam 12 yetişkin zebra balığı [Tg(huc:GAL4); Üreme için bir casper [mitfa(w2/w2);mpv17(a9/a9)] arka plan üzerinde Tg(UAS:GCaMP7a)] kullanılmıştır. Bu grup, yaşları 3 ila 12 ay arasında değişen sekiz kadın ve dört erkekten oluşuyordu. Larva zebra balıkları üzerinde döllenmeden 3-4 gün sonra (d.p.f.), cinsiyetlerinin belirlenemediği bir aşamada görüntüleme deneyleri yapıldı.
1. Zebra balığı numune hazırlama
- Tg (huc: GAL4) gibi istenen bir transgenik çizgideki yetişkin balıkları yetiştirdikten sonra embriyoları toplayın; Tg(UAS:GCaMP7a)20,21,22, yumurta suyuyla doldurulmuş bir Petri kabında (bkz. Embriyoları 28 ° C'de bir inkübatöre yerleştirin ve 3-4 d.p.f. larvaları23,24,25'e yükseltin.
- Zebra balığı arka planı albino değilse, pigmentasyon oluşumunu engellemek için, embriyoları döllenmeden 24 saat sonra (h.p.f.) 200 μM 1-fenil 2-tiyoüre içeren yumurta suyuyla doldurulmuş Petri kabına aktarın (PTU; bakınız Malzeme Tablosu)25,26. Her 24 saatte bir, balıkları 200 μM PTU içeren taze yumurta suyuyla yeni bir kaba aktarın.
NOT: Zebra balığı standart koşullar altında 28 °C'de ve 14:10 saat ışık:karanlık döngüsünde muhafaza edilir. PTU tedavisinin larva zebra balıklarının davranışlarını ve tiroid fonksiyonlarını etkilediği bilinmektedir27,28. Bu nedenle, PTU'yu dikkatli kullanmak ve herhangi bir deneyde potansiyel kafa karıştırıcı faktörleri dikkatlice kontrol etmek önemlidir.
- Zebra balığı arka planı albino değilse, pigmentasyon oluşumunu engellemek için, embriyoları döllenmeden 24 saat sonra (h.p.f.) 200 μM 1-fenil 2-tiyoüre içeren yumurta suyuyla doldurulmuş Petri kabına aktarın (PTU; bakınız Malzeme Tablosu)25,26. Her 24 saatte bir, balıkları 200 μM PTU içeren taze yumurta suyuyla yeni bir kaba aktarın.
- İlgilenilen floresan proteinleri (örneğin, pan-nöronal GCaMP7a) ifade eden numuneyi bulmak için, numuneyi bir epi-floresan mikroskobu altında tarayın ve parlak bir ifadeye sahip bir örnek seçin.
- Seçilen 3-4 d.p.f. zebra balığı örneğini yumurta suyu ile doldurulmuş Petri kabında hazırlayın (Şekil 2A).
NOT: Spontan nöronal aktiviteyi kaydetmek için, 80-100 hp arasındaki örneklerin kullanılması önerilir, çünkü spontan aktivite seviyesi 80 bgf'den önce düşüktür ve pigmentasyon gelişimi, bir casper arka planda bile, 100 hpf sonra görüntü kalitesini düşürebilir. - 10 mL yumurta suyuna 2,5 mg/mL stok çözeltisinden 1 mL ekleyerek 0,25 mg/mL pankuronyum bromür çözeltisi14,19,29,30,31 hazırlayın (bkz. Pankuronyum bromür çözeltisini 1.5 mL mikrosantrifüj tüplerine aliquot.
- Önceden taranmış numuneyi bir transfer pipeti kullanarak Petri kabına aktarın.
NOT: Numune ile birlikte minimum miktarda yumurta suyu taşımaya çalışın. - Pankuronyum bromür çözeltisinin 0.1 mL'sini felç için Petri kabına aktarın.
NOT: Pankuronyum bromür, larva zebra balığı32'de nöral aktivite üzerinde potansiyel bir sönümleme etkisine sahiptir. Pankuronyum bromüre maruz kalma konsantrasyonunu ve süresini dikkatlice düşünmek önemlidir.
2. %2 (WT/Vol) Agaroz Jeli Preparatı
- Bir ısı bloğunu açın ve hedef sıcaklığı 37 ° C'ye ayarlayın. Ünitenin ayarlanan sıcaklıkta ısınmasını ve dengelenmesini bekleyin.
- 0.2 g düşük erime noktalı agaroz tozunu ( Malzeme Tablosuna bakınız) 10 mL yumurta suyunda çözün.
- Agaroz çözeltisini bir mikrodalgada ısıtın ve agaroz tamamen çözülene kadar sallayarak ve vorteksleyerek karıştırın.
- Agaroz jelini 1.5 mL mikrosantrifüj tüplerine aliquot edin ve mikrosantrifüj tüplerini ısı bloğunda saklayın (Şekil 2B).
NOT: Agaroz jelindeki kabarcıkların kaybolup kaybolmadığını kontrol edin.
3. Numune montajı ve konumlandırma
- Larva hareketinin durduğunu doğrulamak ve kalp atışını kontrol ederek numunenin sağlığını görsel olarak değerlendirmek için numuneyi stereomikroskop altında kontrol edin (Şekil 2C). Kalp atışı çok yavaşsa, numuneyi atın.
NOT: Görüntülenen balığın kalp atışı çok yavaşsa (örneğin, dakikada 60 atımın altında), uzun süreli görüntüleme yapmak mümkün olmayabilir. Balığın sağlığını değerlendirmek için, kalp atış hızı aynı Petri kabındaki diğer balıklarla karşılaştırılarak görsel olarak kontrol edilebilir. Bu, görüntülenen balığın görüntüleme prosedürü için yeterince sağlıklı ve stabil olmasını sağlamaya yardımcı olacaktır. - Transfer pipetini kullanarak, 1,5 mL mikrosantrifüj tüpündeki agaroz jelinin içine tek bir larva zebra balığı yerleştirin (Şekil 2D).
NOT: Numuneyi aktardıktan sonra pipeti attığınızdan emin olun. - 1-2 mm'lik bir kat yapmak için agaroz jelini Petri kabına dökün. Transfer pipetini kullanarak numuneyi mikrosantrifüj tüplerindeki Petri kabına aktarın, böylece larva çanağın ortasına yerleştirilir.
NOT: Agaroz jelinde toz ve kabarcıklar varsa, transfer pipetini kullanarak bunları çıkarın. - Numuneyi istenen yönde baş ve kuyruk düz olacak şekilde konumlandırmak için forseps kullanın (Şekil 2E).
- Forseps kullanarak numuneyi her iki göz de düz olacak şekilde döndürün (Şekil 2F).
NOT: Hizalama prosedürleri (pozisyon ve rotasyon) agaroz jeli katılaşmaya başlamadan önce tamamlanmalıdır. - Hizalamadan sonra, agaroz jeli katılaşana kadar bekleyin (Şekil 2G, H).
NOT: Agaroz jelinin katılaşması için bekleme süresi, jelin hacmine ve boyutuna bağlı olarak 5-10 dakika arasında değişebilir. - Agaroz jelinin katılaşmasından sonra, Petri kabını yumurta suyuyla doldurun ve Petri kabını gömülü numune ile mikroskop aşamasına yerleştirin (Şekil 2I).
4. Görüntü alma
- Mikroskop sistemini açın (örneğin, lazerler, konfokal denetleyiciler, mikroskop ve bilgisayar; bkz.
- Düşük büyütmeli bir objektif lens seçin ve örneği görüş alanının merkezine yerleştirin.
- Uygun büyütme oranına sahip suya daldırma veya suya daldırma objektif lens seçin (örneğin, 16x 0,8 sayısal diyafram açıklığı (NA) suya daldırma lensi ; bkz. Görüş alanında ince ayarlamalar yapın.
- Görüntü yakalama yazılımını kullanarak görüntüleme parametrelerini (ör. görüntü boyutu, lazer gücü, pozlama süresi, kare sayısı) ayarlayın.
NOT: Belirli ihtiyaçlar için mümkün olan en iyi sonuçları elde etmek için görüntüleme parametrelerini ayarlayın (temsili sonuçlar bölümündeki görüntü alma kurulumuna bakın). Görüntü doygunsa, lazer gücünü azaltın. - Sahneyi hareket ettirerek numunenin beynini bulun ve odak düzlemlerini manuel olarak yukarı ve aşağı değiştirerek yazılımdaki canlı görüntü modunu kullanarak kalınlığını belirleyin. Ses düzeyinin alt ve üst sınırlarını ayarlayın.
NOT: Tüm beynin hem yanal hem de eksenel yönler boyunca görüş alanında bulunduğundan emin olun. - Mikroskobun eksenel çözünürlüğünü göz önünde bulundurarak bir z-adım boyutu ayarlayın.
NOT: Larva zebra balığı beynini görüntülemek için en uygun z-adım boyutu, görüntüleme yöntemine ve mikroskobun çözünürlüğüne bağlıdır. Örnek olarak, ışık tabakasının kalınlığı ve hücre gövdelerinin ortalama çapı10 dikkate alınarak 5 μm'lik bir z-adım boyutu kullanılmıştır. - Ayarlanan görüş alanı için görüntü alma işlemine devam edin.
- Volumetrik yapısal görüntüleme için, odak düzlemlerini değiştirerek ve sırayla her z düzleminin 2 boyutlu görüntülerini elde ederek tüm beynin 3 boyutlu görüntüsünü (x, y, z) elde edin.
- Tek bir z-düzleminin fonksiyonel görüntülenmesi için, beynin nöronal aktivitesinin belirli bir derinlikteki zaman serisi görüntülerini (x, y, t) elde edin.
- Volumetrik fonksiyonel görüntüleme için, sırayla 3 boyutlu görüntüler elde ederek tüm beyindeki nöronal aktivitenin 4 boyutlu görüntüsünü (x, y, z, t) elde edin.
NOT: Bilgisayarın kullanılabilir bellek boyutunu göz önünde bulundurarak kare sayısını ayarlayın. Pankuronyum bromürün etkisinin süresi nedeniyle 1 saatten az bir edinim süresi önerilir.
- Görüntüleri aldıktan sonra, sonuçları kaydedin ve görüntü analizi için görüntüleme parametrelerini (örneğin, piksel boyutu, z adımlı boyut, kare hızı, lazer gücü) kaydedin.
- Görüntüleri veri işleme ve görüntü analizi için uygun bir biçimde dışa aktarın.
NOT: Görüntülerin etiketli görüntü dosyası (TIF) biçiminde dışa aktarılması önerilir. TIF, kayıpsız görüntü sıkıştırmayı destekler ve çoğu görüntü işleme yazılımı ve programlama dili ile uyumludur. Ayrıca, TIF biçimi, alma parametreleri, görüntü çözünürlüğü ve verilerin yorumlanmasına ve tekrarlanabilirliğine yardımcı olabilecek diğer ilgili bilgiler gibi meta verilerin dahil edilmesini destekler.
5. Napari kullanarak görselleştirmeler için kurulum
NOT: napari, grafik işlem birimi (GPU) tabanlı işleme33 ile Python ortamında açık kaynaklı çok boyutlu bir resim görüntüleyicidir. Napari animasyon eklentisi, programlı bir film oluşturulmasını sağlar. Açık kaynaklı bir görüntü işleme programı olan Fiji'nin kullanılması, filtreleme ve geometrik dönüşüm gibi genel amaçlı görüntü işleme için önerilir (bkz. napari kullanarak görselleştirme için kullanılan kaynak kodu GitHub'da (https://github.com/NICALab/Zebrafish-brain-visualization) kullanılabilir.
- napari ve napari animasyonunu pip veya conda kullanarak yükleyin. Yüklemeden sonra yeni bir jupyter not defteri dosyası oluşturun.
NOT: Python için etkileşimli bir araç olan jupyter notebook ile çalıştırmak, Python betiği üzerinde önerilir. - napari ve napari animasyonunu içe aktarın.
6. Napari kullanarak yapıları görselleştirme
- Görüntüleri görselleştirmek ve işlenmiş zebra balığı beyninin filmlerini oluşturmak için, 3B görüntüyü (x, y, z) yükleyin ve napari penceresini açın. Napari animasyon eklentisini bağlayın (Şekil 3A).
- Katman denetimlerinde voksel boyutu, renk haritası ve kontrast sınırları gibi parametreleri ayarlayın.
- Tuvaldeki görüntüleyici ayarlarını (ör. perspektif, açılar) düzenleyin.
- İşlenen görüntüyü yakalamak için, animasyon sihirbazındaki yakala düğmesine basın.
- İşlenen birimin filmlerini oluşturmak için, görüntüleyici ayarlarını değiştirin ve anahtar kareler ekleyin (Şekil 3B).
- Anahtar kareleri ekledikten sonra, animasyon sihirbazında anahtar kareler arasındaki kare sayısını (adımları) ayarlayın. İşlenen animasyonu kaydedin.
7. Napari kullanarak nöronal aktiviteyi görüntü işleme ve görselleştirme
NOT : Nöronal aktivitenin zaman serisi görüntülerini statik bir arka plan ve aktivitenin üst üste bindirilmiş görüntüleri olarak görselleştirmek için, ham görüntülere bir ayrışma algoritması uygulanmalıdır. BEAR24 adlı bir ayrıştırma algoritmasının MATLAB uygulamasını kullanın. BEAR'ın MATLAB sürümü GitHub'da (https://github.com/NICALab/BEAR) mevcuttur.
- Statik arka planı ve nöronal aktiviteyi ayrıştırmak için, ham zaman serisi görüntülerine (x,y,t veya x,y,z,t) BEAR uygulayın. Ayrıştırmadan sonra, arka plan ve nöronal aktivitenin görüntülerini TIF dosyaları olarak kaydedin (Şekil 3C).
- Arka plan ve nöronal aktivite görüntülerini yükleyin ve napari penceresini açın. Napari animasyon eklentisini bağlayın.
- Arka plan görüntüleri için gri bir renk haritası ve nöronal aktivite görüntüleri için sıcak bir renk haritası kullanın (Şekil 3C).
- Katman denetimlerinde opaklık ve kontrast sınırları gibi parametreleri ayarlayın.
- Nöronal aktivite filmleri oluşturmak için, görüntüleyici ayarlarını değiştirin ve animasyonu oluşturmak için anahtar kareler ekleyin.
- Anahtar kareleri ekledikten sonra, animasyon sihirbazında anahtar kareler arasındaki kare sayısını (adımları) ayarlayın. İşlenen animasyonu kaydedin.
Sonuçlar
Larva zebra balığı beyinlerinin kalsiyum indikatörü pan-nöronal GCaMP7a (Tg(huc:GAL4) eksprese eden yapısı ve nöronal aktivitesi; Tg(UAS:GCaMP7a))20,21,22 bir casper ile (mitfa(w2/w2);mpv17(a9/a9))34 arka plan 3-4 d.p.f.'de görüntülendi. açıklanan protokol izlenerek.
Volumetrik yapısal görüntüleme için, numune 16x 0.8 NA suya daldırma objektif lensi ile donatılmış ticari bir nokta taramalı konfokal mikroskopi sistemi kullanılarak görüntülendi. Hem yapısal hem de fonksiyonel görüntüleme için 488 nm uyarma lazeri kullanıldı. Kare hızı, görüntü çözünürlüğü, piksel boyutu ve eksenel adım boyutu sırasıyla 0,25 Hz, 2048 x 2048, 0,34 μm ve 1,225 μm idi. Görüntü yakalama yaklaşık 1 saat 20 dakika sürdü. Elde edilen görüntünün hacimsel görüş alanı, ön beyin, orta beyin ve arka beynin beyin bölgelerini kapsıyordu (Şekil 4A). 4 d.p.f. larva zebra balığının tüm beynindeki medulla oblongata, serebellar plak, optik tektum, habenula ve dorsal telensefalonun nöronal hücre cisimleri konfokal mikroskopi görüntülerinde açıkça görülebiliyordu (Şekil 4B). Konfokal mikroskopi görüntülerinin 3 boyutlu gösterimi, yukarıda belirtilen protokol izlenerek napari27 kullanılarak gerçekleştirilmiştir (Şekil 4C ve Video 1).
2-D'de fonksiyonel görüntüleme için, numune 16x 0.8 NA suya daldırma objektif lensi ile donatılmış aynı konfokal mikroskopi sistemi kullanılarak görüntülendi. Kare hızı, görüntü çözünürlüğü ve piksel boyutu sırasıyla 2 Hz, 512 x 256 ve 1,5 μm idi. Nöronal hücre cisimleri hem arka planda hem de üst üste binen nöronal aktivitede açıkça görülebiliyordu (Şekil 5A, B).
3-D fonksiyonel görüntüleme için, 1.040 μm × 400 μm × 235 μm görüş alanı ve sırasıyla 1.7 μm ve 5.4 μm yanal ve eksenel çözünürlüklerle bütün bir larva zebra balığı beyninin nöronal aktivitesini in vivo olarak görüntüleyebilen özel olarak tasarlanmış bir 3-D mikroskopi sistemi18 kullanıldı. Görüntüleme hızı saniyede 4.2 hacme kadar çıktı. Yapısal görüntüleme verilerinin oluşturulmasına benzer şekilde, napari tüm beyin kalsiyum görüntüleme verilerinin 3 boyutlu olarak oluşturulması için kullanılmıştır (Şekil 5C ve Video 2).
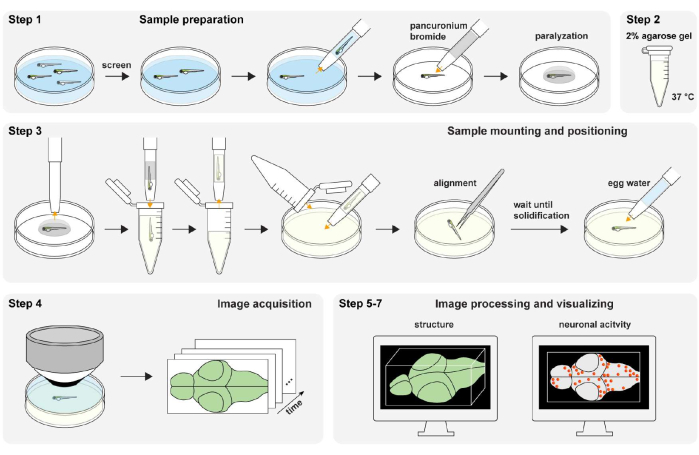
Şekil 1: Deneysel prosedüre genel bakış. Zebra balığı numunesi hazırlama ve felç etme (adım 1). % 2 (wt / vol) agaroz jeli preparatı (adım 2). Numune montajı ve konumlandırma (adım 3). Görüntü alma (adım 4). Görüntü işleme ve görselleştirme yapısı ve nöronal aktivite (adım 5-7). Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.

Şekil 2: Tüm beyin görüntülemesini hazırlamak için deneysel prosedür . (A) Yumurta suyuyla doldurulmuş bir Petri kabında pan-nöronal GCaMP7a'yı ifade eden taranmış zebra balığı örneği. (B) Numune montajı ve konumlandırması için gerekli ekipman ve malzeme. (1) 37 ° C'de ısı bloğu; (2) %2 (ağırlık/hacim) agaroz jeli; (3) 1.5 mL mikrosantrifüj tüpü; (4) yumurta suyu; (5) 0.25 mg/mL pankuronyum bromür çözeltisi; (6) Petri kabı; (7) forseps; (8) transfer pipeti. (C) Felçli numunenin stereomikroskop görüntüsü. Siyah ok, numunenin kalbini gösterir. (D) 1,5 mL mikrosantrifüj tüpündeki numune bir pipet kullanılarak aktarılır. İç kısım, kutulu alanın genişletilmiş bir görünümünü gösterir. (E) Numune (siyah ok) forseps kullanılarak Petri kabının ortasına yerleştirilir. (F) Numune forseps kullanılarak hizalanır. (G) Yanlış hizalanmış gömülü numune örneği. (H) Hizalanmış gömülü numune örneği. (I) Numune, görüntü elde etmek için objektif lensin altındaki bir mikroskop aşamasına yerleştirilir. Ölçek çubuğu: 500 μm. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
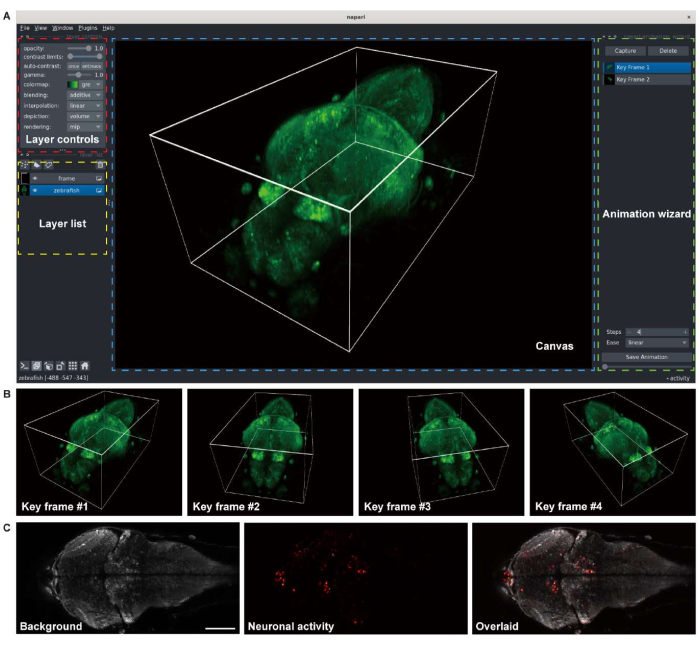
Şekil 3: Larva zebra balığı beyin görüntülerinin görselleştirilmesi. (A) Pan-nöronal GCaMP7a'yı ifade eden larva zebra balığı (4 d.p.f) beyninin konfokal mikroskopi görüntüsünün 3 boyutlu olarak oluşturulması. Python ortamında açık kaynaklı çok boyutlu bir resim görüntüleyici olan napari, oluşturma için kullanıldı. Napari penceresi katman denetimlerinden (kırmızı kutu), katman listesinden (sarı kutu), tuvalden (mavi kutu) ve animasyon sihirbazından (yeşil kutu) oluşur. (B) Bir animasyonun oluşturulması için birden fazla görüntüleyici ayarına sahip anahtar kareler eklenir. (C) Larva zebra balığı beynindeki nöronal aktivitenin 2 boyutlu hızlandırılmış görüntülemesinin konfokal mikroskopi görüntüsü. Görüntü arka plana (solda) ve nöronal aktiviteye (ortada) ayrıştırılır, daha sonra üst üste bindirilir (sağda). Ölçek çubuğu: 100 μm. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
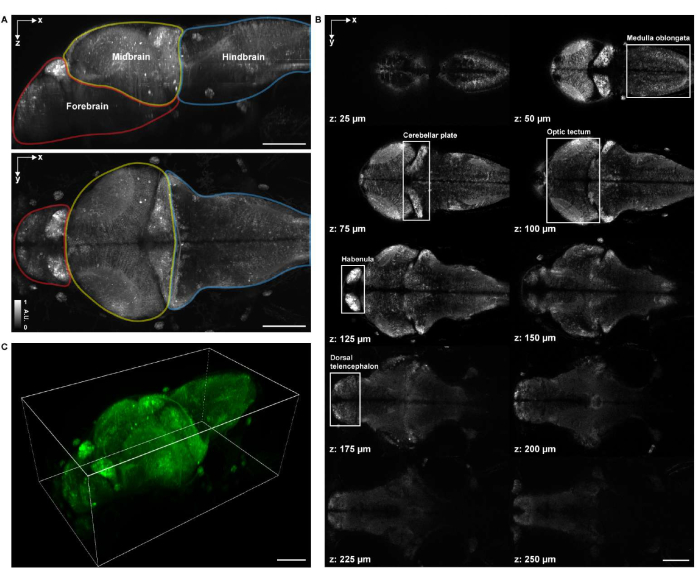
Şekil 4: Larva zebra balığı beyninin görüntüleme yapısı. (A) Pan-nöronal GCaMP7a'yı ifade eden larva zebra balığı (4 d.p.f.) beyninin konfokal mikroskopi görüntüsünün maksimum yoğunluk projeksiyonu (MIP). Üst: yanal MIP. Alt: eksenel MIP. Her sınır ön beyni (kırmızı), orta beyni (sarı) ve arka beyni (mavi) içerir. (B) Beynin hacimsel görüntüsünden birden fazla derinlikte toplam 10 eksenel dilim (z = 25 μm, 50 μm, 75 μm, 100 μm, 125 μm, 150 μm, 175 μm, 200 μm, 225 μm, 250 μm, yukarıdan aşağıya doğru yukarı doğru sayılır; z = 0 μm beynin üst yüzeyini gösterir). Her beyaz kutu beynin bölgesini temsil eder (medulla oblongata, serebellar plaka, optik tektum, habenula ve dorsal telensefalon). (C) Napari kullanılarak oluşturulan tüm beyin. Ölçek çubuğu: 100 μm. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
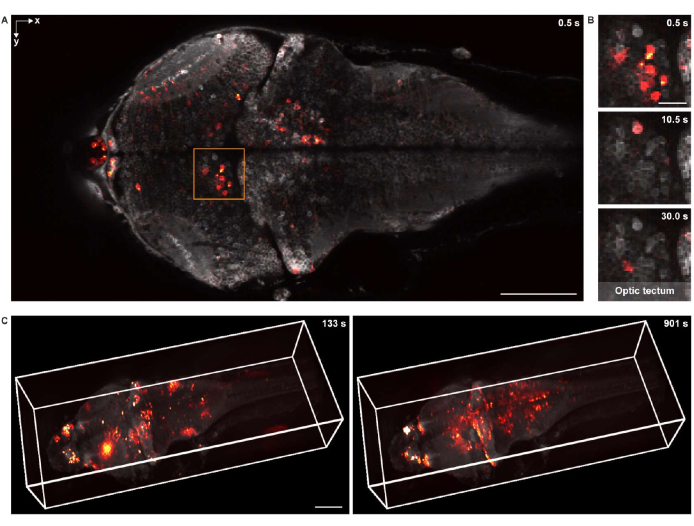
Şekil 5: Bir larva zebra balığı beyninin nöronal aktivitesinin görüntülenmesi. (A) Pan-nöronal GCaMP7a'yı ifade eden larva zebra balığı (4 d.p.f.) beynindeki nöronal aktivitenin konfokal mikroskopi görüntüsü. Ölçek çubuğu: 100 μm. (B) A'daki kutulu alanın genişletilmiş görünümü, optik tektumdaki nöronal aktiviteyi birden fazla zaman noktasında gösterir. Ölçek çubuğu: 20 μm. (C) Özel olarak tasarlanmış bir mikroskop kullanılarak elde edilen larva zebra balığı beynindeki tüm beyin nöronal aktivitesinin 3 boyutlu gösterimi (sol: t = 133 s; sağ: t = 901 s). Nöronal aktivite statik arka plan üzerine bindirilir. Ölçek çubuğu: 100 μm. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
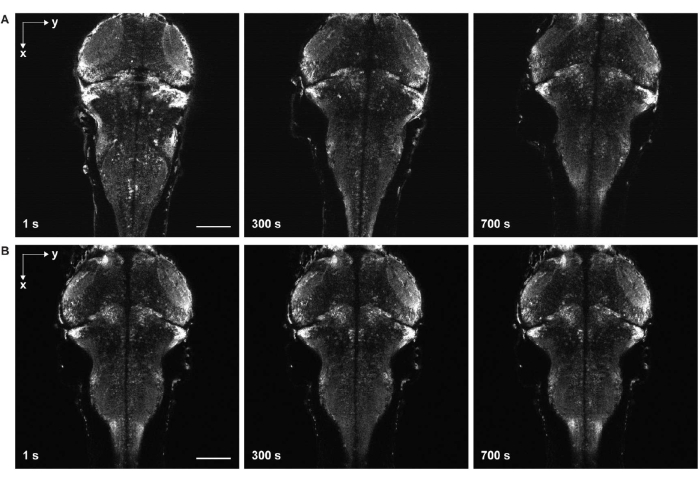
Şekil 6: Numune sürüklenmeli ve sürüklenmesiz hızlandırılmış görüntüleme. (A) Larva zebra balığı beyninin, örnek sürüklenme ile pan-nöronal GCaMP7a'yı eksprese eden hızlandırılmış görüntülemesi. Agaroz jelinin katılaşmasından önce numuneye yumurta suyu ilave edildi (adım 3.6-3.7). Balıklar yanal ve eksenel yönlerde hareket etti. (B) Larva zebra balığı beyninin örnek sürüklenmesi olmadan hızlandırılmış görüntülenmesi. Agaroz jelinin katılaşmasından sonra numuneye yumurta suyu ilave edildi (adım 3.6-3.7). Ölçek çubuğu: 100 μm. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
Video 1: Pan-nöronal GCaMP7a'yı ifade eden larva zebra balığı (4 d.p.f.) beyninin tüm beyin yapısının 3 boyutlu gösterimi. Bu Videoyu indirmek için lütfen buraya tıklayın.
Video 2: Pan-nöronal GCaMP7a'yı ifade eden larva zebra balığı (4 d.p.f.) beyninde tüm beyin nöronal aktivitesinin 3 boyutlu gösterimi. Bu Videoyu indirmek için lütfen buraya tıklayın.
Tartışmalar
Mevcut protokol, larva zebra balıklarının uzun bir süre boyunca (örneğin, 1 saatten uzun) in vivo tüm beyin görüntülemesini ve elde edilen yapısal ve fonksiyonel görüntüleme verilerinin görselleştirilmesini sağlar.
En kritik adımlar numune montajı ve konumlandırmadır. Numune gömme sırasında, kabarcık oluşumunu önlemek ve agaroz jelinde tozdan kaçınmak çok önemlidir. Jel hava kabarcıkları ve toz içeriyorsa, görüntü kalitesi ciddi şekilde bozulabilir. Forseps kullanarak numuneyi konumlandırırken, numunenin hem yatay hem de dikey olarak düz olmasını sağlamak önemlidir. Aksi takdirde, ilgilenilen bölgeler mikroskobun görüş alanı içinde yer alamayabilir. Ek olarak, bu konumlandırma, yüzeyine zarar vermemek için agaroz jelinin katılaşmasından önce kısa bir süre içinde yapılmalıdır, çünkü bu hasar görüntü kalitesini tehlikeye atar.
Bir diğer önemli zorluk, agaroz jelinin eksik katılaşmasından (Şekil 6) ve zebra balıklarının felç olmasından kaynaklanan görüntülerde hareketten kaçınmaktır. Agorse jelinin tamamen katılaşmasından önce numuneye yumurta suyu eklendiğinde, balıklar hem yanal hem de eksenel olarak yavaşça hareket eder ve zaman serisi görüntülerinde numune sürüklenmesi olarak kendini gösterir (Şekil 6A). Paralitik dozu yetersizse veya etki süresi sona ererse, numune hareket etmeye çalışabilir, bu da hızlandırılmış görüntülerde hızlı seğirme olarak görünür.
Hareket artefaktları olmadan yüksek kaliteli görüntüler elde etmek için yukarıda belirtilen adımların önemine rağmen, kamuya açık protokoller 15,16,17,18,19, bu ayrıntılardan yoksun olarak deneysel prosedüre sadece kısa bir genel bakış sunmaktadır. Örneğin, immobilizasyon protokolleri11 olmadan elde edilen görüntüler, aşağı akış görüntü analizini zorlaştıran önemli hareket artefaktlarından muzdariptir. Agaroz jeli katılaşması ve numune felci gibi temel bileşenleri entegre ederek, protokolümüz hareket artefaktlarını en aza indirirken elde edilen görüntülerin kalitesindeki tutarlılığı önemli ölçüde artırır.
Özetle, larva zebra balığı beyninin in vivo görüntülenmesi için optimize edilmiş ve tekrarlanabilir bir deneysel prosedür açıklanmaktadır. Beyin aktivitesinin ve yapısının in vivo görüntülenmesi için bu protokolün geçerliliği ve tekrarlanabilirliği birçok ortamda doğrulanmıştır 14,18,29,30,31. Mevcut iş akışı, larva zebra balıklarının tüm beyin görüntülemesine odaklanmıştır, ancak larva zebra balıklarının diğer organlarını görüntülemek için kolayca uygulanabilir35,36.
Açıklamalar
Yazarlar çıkar çatışması olmadığını beyan ederler.
Teşekkürler
Kalsiyum görüntüleme için kullanılan zebra balığı hatları, Kore'deki Zebra Balığı Hastalık Modelleme Merkezi (ZCDM) tarafından sağlanmıştır. Bu araştırma Kore Ulusal Araştırma Vakfı (2020R1C1C1009869, NRF2021R1A4A102159411, RS-2023-00209473) tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1.5 mL microcentrifuge tube | SciLab | SL.Tub3513 | To aliquot agarose gel and pancuronium bromide solution |
| 15 mL Falcon tubes | Falcon | 352096 | To prepare agarose gel and pancuronium bromide solution |
| 16× 0.8NA water dipping objective lens | Nikon | CFI75 LWD 16×W | Objective lens for whole-brain imaging |
| 1-phenyl 2-thiourea (PTU) | Sigma-Aldrich | P7629-10G | 200 μM of 1-phenyl 2-thiourea (PTU) |
| 50 mL Falcon tubes | Falcon | 352070 | To prepare egg water |
| Disposable transfer pipette | SciLab | SL.Pip3032 | To transfer zebrafish larvae |
| Egg water | N/A | N/A | 0.6 g sea salt in 10 L deionized water |
| Forceps | Karl Hammacher GmbH | HSO 010-10 | Forceps used for sample positioning |
| Low melting point agarose | Thermo Scientific | R0801 | 2% (wt/vol) agarose gel |
| Napari | Napari | N/A | To visualize microscopy images in 3-D |
| NIS-Elements C | Nikon | N/A | Imaging software for confocal microscope |
| Pancuronium bromide | Sigma-Aldrich | P1918-10MG | 0.25 mg/mL of pancuronium bromide solution |
| Petri dish, 35 mm | SPL Life Sciences | 11035 | Petri dish used for sample embedding |
| Petri dish, 55 mm | SPL Life Sciences | 11050 | To prepare zebrafish larvae after screening |
| Point-scanning confocal microscopy system (C2 Plus) | Nikon | N/A | Confocal microscope for whole-brain imaging |
| Sea salt | Sigma-Aldrich | S9883-500G | Sea salt used for preparing egg water |
Referanslar
- Choi, T. -. Y., Choi, T. -. I., Lee, Y. -. R., Choe, S. -. K., Kim, C. -. H. Zebrafish as an animal model for biomedical research. Experimental & Molecular Medicine. 53 (3), 310-317 (2021).
- Ahrens, M. B., et al. Brain-wide neuronal dynamics during motor adaptation in zebrafish. Nature. 485 (7399), 471-477 (2012).
- Panier, T., et al. Fast functional imaging of multiple brain regions in intact zebrafish larvae using selective plane illumination microscopy. Frontiers in Neural Circuits. 7, 65 (2013).
- Bianco, I. H., Kampff, A. R., Engert, F. Prey capture behavior evoked by simple visual stimuli in larval zebrafish. Frontiers in Systems Neuroscience. 5, 101 (2011).
- Akerboom, J., et al. Optimization of a GCaMP calcium indicator for neural activity imaging. Journal of Neuroscience. 32 (40), 13819-13840 (2012).
- Chen, T. -. W., et al. Ultrasensitive fluorescent proteins for imaging neuronal activity. Nature. 499 (7458), 295-300 (2013).
- Piatkevich, K. D., et al. A robotic multidimensional directed evolution approach applied to fluorescent voltage reporters. Nature Chemical Biology. 14 (4), 352-360 (2018).
- Tian, L., et al. Imaging neural activity in worms, flies and mice with improved GCaMP calcium indicators. Nature Methods. 6 (12), 875-881 (2009).
- Looger, L., et al. Fast and sensitive GCaMP calcium indicators for imaging neural populations. Biorxiv. , (2021).
- Ahrens, M. B., Orger, M. B., Robson, D. N., Li, J. M., Keller, P. J. Whole-brain functional imaging at cellular resolution using light-sheet microscopy. Nature Methods. 10 (5), 413-420 (2013).
- Prevedel, R., et al. Simultaneous whole-animal 3D imaging of neuronal activity using light-field microscopy. Nature Methods. 11 (7), 727-730 (2014).
- Chhetri, R. K., et al. Whole-animal functional and developmental imaging with isotropic spatial resolution. Nature Methods. 12 (12), 1171-1178 (2015).
- Ahrens, M. B., Engert, F. Large-scale imaging in small brains. Current Opinion in Neurobiology. 32, 78-86 (2015).
- Yoon, Y. -. G., et al. Sparse decomposition light-field microscopy for high speed imaging of neuronal activity. Optica. 7 (10), 1457-1468 (2020).
- Randlett, O., et al. Whole-brain activity mapping onto a zebrafish brain atlas. Nature Methods. 12 (11), 1039-1046 (2015).
- Cong, L., et al. Rapid whole brain imaging of neural activity in freely behaving larval zebrafish (Danio rerio). eLife. 6, e28158 (2017).
- Bruzzone, M., et al. Whole brain functional recordings at cellular resolution in zebrafish larvae with 3D scanning multiphoton microscopy. Scientific Reports. 11 (1), 11048 (2021).
- Cho, E. -. S., Han, S., Lee, K. -. H., Kim, C. -. H., Yoon, Y. -. G. 3DM: deep decomposition and deconvolution microscopy for rapid neural activity imaging. Optics Express. 29 (20), 32700-32711 (2021).
- Zhang, Z., et al. Imaging volumetric dynamics at high speed in mouse and zebrafish brain with confocal light field microscopy. NatureBiotechnology. 39 (1), 74-83 (2021).
- Muto, A., Ohkura, M., Abe, G., Nakai, J., Kawakami, K. Real-time visualization of neuronal activity during perception. Current Biology. 23 (4), 307-311 (2013).
- Köster, R. W., Fraser, S. E. Tracing transgene expression in living zebrafish embryos. Developmental Biology. 233 (2), 329-346 (2001).
- Park, H. C., et al. Analysis of upstream elements in the HuC promoter leads to the establishment of transgenic zebrafish with fluorescent neurons. Developmental Biology. 227 (2), 279-293 (2000).
- Avdesh, A., et al. Regular care and maintenance of a zebrafish (Danio rerio) laboratory: an introduction. Journal of Visualized Experiments. (69), e4196 (2012).
- Westerfield, M. . The zebrafish book. A guide for the laboratory use of zebrafish (Danio rerio). 4th edition. , (2000).
- Morsch, M., et al. Triggering cell stress and death using conventional UV laser confocal microscopy. Journal of Visualized Experiments. (120), e54983 (2017).
- Antinucci, P., Hindges, R. A crystal-clear zebrafish for in vivo imaging. Scientific Reports. 6, 29490 (2016).
- Parker, M. O., Brock, A. J., Millington, M. E., Brennan, C. H. Behavioral phenotyping of casper mutant and 1-pheny-2-thiourea treated adult zebrafish. Zebrafish. 10 (4), 466-471 (2013).
- Elsalini, O. A., Rohr, K. B. Phenylthiourea disrupts thyroid function in developing zebrafish. Development Genes and Evolution. 212 (12), 593-598 (2003).
- Han, S., Cho, E. -. S., Park, I., Shin, K., Yoon, Y. -. G. Efficient neural network approximation of robust PCA for automated analysis of calcium imaging data. Medical Image Computing and Computer Assisted Intervention. , 595-604 (2021).
- Shin, C., et al. Three-dimensional fluorescence microscopy through virtual refocusing using a recursive light propagation network. Medical Image Analysis. 82, 102600 (2022).
- Eom, M., et al. Statistically unbiased prediction enables accurate denoising of voltage imaging data. bioRxiv. , (2022).
- Johnston, L., et al. Electrophysiological recording in the brain of intact adult zebrafish. Journal of Visualized Experiments. (81), e51065 (2013).
- Sofroniew, N., et al. napari: a multi-dimensional image viewer for Python. Zenodo. , 3555620 (2022).
- White, R. M., et al. Transparent adult zebrafish as a tool for in vivo transplantation analysis. Cell Stem Cell. 2 (2), 183-189 (2008).
- Mickoleit, M., et al. High-resolution reconstruction of the beating zebrafish heart. Nature Methods. 11 (9), 919-922 (2014).
- Voleti, V., et al. Real-time volumetric microscopy of in vivo dynamics and large-scale samples with SCAPE 2.0. Nature Methods. 16 (10), 1054-1062 (2019).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır