Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Nötrofil fonksiyonuna hızlı bir genel bakış için bir dizi tarama tekniği
Bu Makalede
Özet
Bu protokol, farklı sinyal yollarından gelen fonksiyonları kapsamak için bir tarama yöntemi olarak kullanılacak bir dizi nötrofil fonksiyonel tahlil içerir. Protokol, hücre canlılığının, saflığının, reaktif oksijen türlerinin üretiminin, gerçek zamanlı göçün, fagositozun ve nötrofil hücre dışı tuzakların bir ön önerisinin ilk ve basit bir değerlendirmesini içerir.
Özet
Nötrofiller, doğuştan gelen bağışıklık tepkisinde ilk savunma hatlarından biri olarak bilinir ve kemotaksis, ters göç, fagositoz, sitotoksik enzimlerin ve metabolitlerin degranülasyonu ve DNA'nın nötrofil hücre dışı tuzaklar (NET'ler) olarak salınması gibi birçok özel hücresel işlevi yerine getirebilir. Nötrofiller sadece kendilerini sıkı bir şekilde düzenlemekle kalmaz, aynı zamanda bağışıklık sisteminin diğer bileşenlerinin düzenlenmesine de katılırlar. Taze nötrofiller terminal olarak farklılaştığından, kısa ömürlü olduğundan ve bireyler arasında oldukça değişken olduğundan, toplanan örneklerden en iyi şekilde yararlanmak önemlidir. Araştırmacıların, değerlendirilen belirli koşullardan etkilenebilecek birçok nötrofil fonksiyonuna genel bir bakışı değerlendirmek için genellikle tarama testleri yapmaları gerekir. Bu ihtiyacı karşılamak için normal yoğunluktaki nötrofillerin tek bir izolasyon sürecini takip eden bir dizi test geliştirildi ve hız, kapsamlılık, maliyet ve doğruluk arasında bir denge arandı. Sonuçlar, derinlemesine takip çalışmalarına akıl yürütmek ve rehberlik etmek için kullanılabilir. Bu prosedür ortalama 4 saat içinde gerçekleştirilebilir ve hücre canlılığının, reaktif oksijen türlerinin (ROS) üretiminin, gerçek zamanlı göçün ve cam slaytlar üzerinde mayanın fagositozunun değerlendirilmesini içerir ve omik çalışmalar gibi daha ayrıntılı yaklaşımlar için yeterli hücre bırakır. Ayrıca, prosedür, ışık mikroskobu ile gözlenen hızlı panoptik boyamadan sonra, bu şekilde daha fazla çabanın faydalı olup olmayacağını belirtmek için yeterli olsa da, spesifik belirteçlerin eksikliği ile NET'lerin bir ön önerisini kolayca gözlemlemenin bir yolunu içerir. Test edilen fonksiyonların çeşitliliği, testler arasındaki ortak noktaları birleştirerek analiz süresini ve masraflarını azaltır. Prosedür NeutroFun Screen olarak adlandırıldı ve sınırlamaları olmasına rağmen, yukarıda belirtilen faktörleri dengeler. Ayrıca, bu çalışmanın amacı kesin bir test seti değil, her laboratuvarın kaynaklarına ve taleplerine göre kolayca ayarlanabilen bir kılavuzdur.
Giriş
Nötrofiller, insan kanında en bol bulunan doğuştan gelen bağışıklık hücreleridir ve enfeksiyon ve iltihaplanmada önemli bir rol oynadıkları bilinmektedir ve doku hasarıbölgesine ilk ulaşan ilk müdahale ekipleridir 1. Son yıllarda, nötrofillerin çeşitli hastalıklarda ve homeostazı desteklemede oynadığı önemli rol giderek daha fazla kabul görmektedir2. Nötrofiller sadece kendilerini sıkı bir şekilde düzenlemekle kalmaz, aynı zamanda bağışıklık sisteminin diğer bileşenlerinin düzenlenmesine de katılırlar 3,4,5. Bu nedenle, nötrofillerin ve kemotaksis, ters göç6, fagositoz7, solunum patlaması8 ve nötrofil hücre dışı tuzakların (NET'ler) salınması7 gibi birçok olağandışı hücresel fonksiyonlarının araştırılması, analiz edilen belirli koşullar tarafından tetiklenen potansiyel nötrofil fonksiyonel, morfolojik veya moleküler değişikliklerin değerlendirilmesinin gerekli olduğu çok sayıda araştırma bağlamında zorunludur.
Yeni izole edilmiş nötrofiller terminal olarak farklılaşır, kısa ömürlüdür, oldukça dinamiktir ve kolayca aktive olur9. Bununla birlikte, nötrofil yanıtlarını etkilemeyen verimli bir depolama yöntemi henüz elde edilememiştir, bu da kesintisiz olması gereken çoklu tahlillerin gerçekleştirilmesini zorlaştırmaktadır. Ayrıca, sitometri ve/veya floresan boyama gerektiren tahlillere dayanan daha önce açıklanan fonksiyonel analizler10,11, nötrofilin geniş ve ilk değerlendirmesine ihtiyaç duyulduğunda uygun bir seçim olmayabilir.
Bu sorunları ele almak için bu protokol, hücre canlılığının, reaktif oksijen türlerinin (ROS) üretiminin, gerçek zamanlı göçün ve fagositozun değerlendirilmesi de dahil olmak üzere tek bir izolasyon sürecini takiben gerçekleştirilebilecek bir dizi testi açıklar. NeutroFun Screen adı verilen bu prosedür, degranülasyon hariç önde gelen efektör aktivitelerini kapsayacak şekilde tasarlanmıştır ve 1 saatlik aktivasyon dahil olmak üzere ortalama 4 saatlik bir sürede tamamlanabilir. Ek olarak, kalan hücreler omik çalışmaları gibi daha ayrıntılı yaklaşımlar için kullanılabilir. Bu yöntemin avantajı, hız, kapsamlılık, maliyet ve doğruluk arasındaki dengede yatmaktadır.
Ayrıca, NET'lerin bir ön önerisini kolayca gözlemlemenin bir yolu vardır, belirli belirteçler olmadan, ancak bu yönde daha fazla çabanın yararlı olup olmayacağını belirtmek için yeterlidir. Test edilen fonksiyonların çeşitliliği, testler arasındaki ortak noktaları birleştirmeyi, analiz süresini ve masraflarını azaltmayı amaçlar. Bu yöntemin temel amacı, nötrofilin tepkisine genel bir bakışa izin veren hız, kapsamlılık, maliyet ve doğrulukla ilgili dengeli, işlevsel bir analiz sağlamak ve yeni uyaranların normal yoğunluklu nötrofiller üzerindeki etkilerini araştırmada yararlı bir ilk adım haline getirmektir.
Protokol
Tüm deneyler, Brasilia Üniversitesi'ndeki kurumsal inceleme kurulu tarafından belirlenen etik yönergeleri sıkı bir şekilde takip etti (süreç 13364819.0.0000.5558) ve örnekler, bağışçı anonimliğini sağlamak için kodlarla tanımlandı. Hücreler, bilgilendirilmiş onam belgesini imzalayan ve aşağıdaki uygunluk kriterlerini karşılayan 18-35 yaşları arasındaki normal sağlıklı erkek donörlerden elde edildi: sigara içmeyenler / gazeteler, kronik sağlık sorunları yok ve son 14 gün içinde inflamatuar durum öyküsü yok.
1. Kan alma
- Heparinlemek için 0.3 mL 5.000 IU / mL heparini (Malzeme Tablosuna bakınız) steril 20 mL'lik bir şırıngaya aseptik olarak yerleştirin.
- Delinme bölgesinin yaklaşık 4 inç yukarısında bir venöz turnike uygulayın ve venipunktur için medyan kübital veya sefalik veni tanımlayın.
NOT: Toplam turnike süresinin 1 dakikayı geçmemesine dikkat edin. - Delinme bölgesini %70 alkolle temizleyin ve damar delme işlemini gerçekleştirin.
- Kanı ve heparini düzgün bir şekilde karıştırmak için kanı topladıktan sonra şırıngayı üç veya dört kez hafifçe ters çevirin.
2. Nötrofil izolasyonu
NOT: Polimorfonükleer lökositler (PMN'ler), daha önce tarif edildiği gibi11 bazı değişikliklerle kalan kırmızı kan hücrelerinin (RBC) hipotonik lizizini takiben yoğunluk gradyan santrifüjlemesi yoluyla izole edilir. Bu yöntem, tarama testlerini gerçekleştirmek için zorunlu değildir ve seçilen yöntem% >97'lik bir canlılık, PMN'lerin% <3'ünün hazırlanması veya aktivasyonu ile sonuçlandığı ve tüm testler için yeterli hücre sağladığı sürece değiştirilebilir. Hücre aktivasyonunu önlemek için bu adımların aseptik koşullar altında gerçekleştirilmesi ve endotoksin içermeyen solüsyonların kullanılması zorunludur.
- 50 mL'lik konik tüplerde %60 ve %70 ayırma ortamının (ticari olarak temin edilebilir; Malzeme Tablosuna bakınız) 12 mL dilüsyonları yapın.
- 5 mL'lik bir pipet kullanarak, %70 seyreltme üzerine %60 seyreltme seferinde 4 mL ekleyerek gradyanı aşağıdan yukarıya hazırlayın. Arayüzün karışmasını önlemek için bunu nazikçe yapın.
- Yoğunluk gradyanının üzerine dikkatlice 12 mL heparinize kan katmanlayın. Oda sıcaklığında 15 dakika boyunca 200 x g'da santrifüjleyin.
NOT: Bu adımdan itibaren, PMN aktivasyonuna kadar, kullanılan tüm reaktifler ve tüpler buzla dolu bir soğutucuda tutulmalıdır. - Plazma / mononükleer hücre tabakasını atın, ardından eritrosit peletinin üzerindeki tabakayı, her birinde yaklaşık 7,5 mL olan iki adet 15 mL'lik konik tüpe yavaşça aktarın. Tüp hacmini Hank'in dengeli tuz çözeltisi ile tamamlayın (HBSS; Malzeme Tablosuna bakınız).
- 19 °C'de 5 dakika boyunca 300 x g'da santrifüjleyin.
- Hücre peletini HBSS ile yıkayın.
- Tüpü dökerek süpernatanı atın ve peleti 7 mL HBSS'de yavaşça yeniden süspanse edin.
- Tüm ayırma ortamını çıkarmak için 300 x g'da 19 °C'de 5 dakika santrifüjleyin.
- Kalan RBC'lerin hipotonik lizizini gerçekleştirin.
- Süpernatanı atın ve peletleri tek bir tüpte birleştirin.
- RBC / PMN peletini 3 mL sterilH2Oiçinde yeniden süspanse edin ve ozmolariteyi eski haline getirmek için 25 saniye içinde 3 mL HBSS (2x) ekleyin. Ardından, 19 °C'de 5 dakika boyunca 300 x g'da santrifüjleyin.
- Beyaz, eritrosit içermeyen bir pelet için 2.8.1 ve 2.8.2 adımlarını tekrarlayın.
NOT: Nötrofillerin RBC yıkım ürünleri ile temasını en aza indirmek için süpernatan mümkün olan en kısa sürede çıkarılmalıdır. Alternatif olarak, ikinci hipotonik lizis, kalan RBC tabakasının nazikçe yeniden süspanse edilmesi ve kalan RBC'ler PMN peletinin üzerinde çökeleceğinden, tüm süpernatanın çıkarılmasıyla değiştirilebilir.
- Tüpü dökerek süpernatanı atın, kalan tampondaki PMN'leri yavaşça yeniden süspanse edin ve buz gibi soğuk bir mikrotüpe aktarın.
NOT: Yeniden askıya alınan hücreleri bir mikropipetle aktarırken hacme açıklama eklediğinizden emin olun. - Hücre süspansiyonunun 3 x 1 μL'sini temiz bir cam slayta (her biri 1 μL'lik üç oyuk) aktarın ve morfoloji ve saflık değerlendirmesi için hızlı panoptik ile boyayın (Malzeme Tablosuna bakınız)12.
- Hızlı panoptik ile boyamak için, slaytı beş kez panoptik fiksatif n° 1'e, altı kez eozin n° 2'ye ve iki kez hematoksilen n° 3'e daldırın ve her daldırma 1 saniye sürer.
- Cam sürgüyü damıtılmış suyla nazikçe yıkayın.
- Süzülmesine ve kurumasına izin verin.
- Mikroskop altında gözlemleyin ve her kuyucukta 300 rastgele hücre sayın, böylece nötrofilleri diğer granülositlerden ayırt edin.
- 1 μL hücre süspansiyonunu 49 μL% 0.2 tripan mavisi boyasına13 aktarın ve ölü ve canlı hücreler arasında ayrım yapan bir Neubauer odası kullanarak hücreleri sayın.
- Kalsiyum ve magnezyum ile desteklenmiş %50 otolog plazma ve %50 HBSS çözeltisi kullanarak hücre konsantrasyonunu 6.667 hücre/μL'ye ayarlayın. 6.667 hücre/μL süspansiyonu, negatif kontrol de dahil olmak üzere test edilecek koşullara karşılık gelen mikrotüpler arasında eşit olarak bölün.
NOT: Model organizmada dolaşımdaki nötrofillere benzer herhangi bir hücre konsantrasyonu kullanılabilir, ancak tekrarlanabilirlik için tüm deneylerde aynı hücre konsantrasyonunun kullanılması önemlidir.
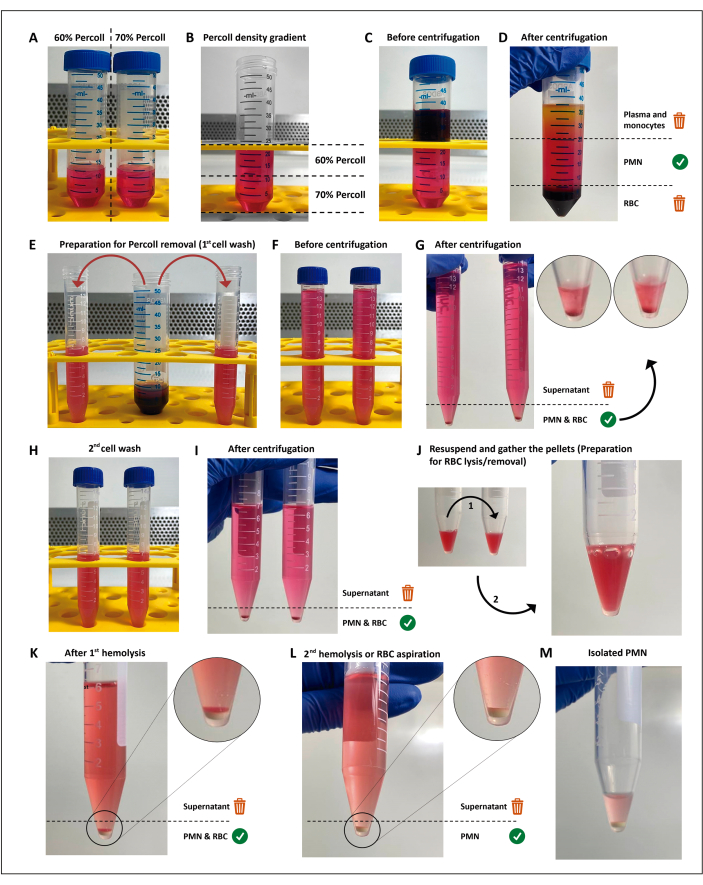
Resim 1: Nötrofil izolasyon protokolü. Ayırma ortamının (percoll) (A) iki konsantrasyonu istiflenir (B), daha sonra kan, ayırma gradyanının (C) üzerine katmanlanır. Santrifüjlemeden sonra PMN, iki adet 15 mL'lik tüpe (E) bölünmüş merkezi katmandadır (D). Hücre süspansiyonu HBSS'de iki kez yıkanır ve ortamı çıkarmak için santrifüjlenir (GI), daha sonra hücreler yeniden süspanse edilir ve artık RBC'ler iki tur hipotonik lizise (JM) gönderilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
3. Nötrofil aktivasyonu için hazırlık
- 1.5 mL'lik mikrotüplerde, nihai hücre konsantrasyonu 6.600 hücre / μL olacak şekilde her koşul için bir aktivasyon sistemi hazırlayın. Örneğin, 100 nM fMLP'nin (N-formil-metiyonil-lösil-fenilalanin; bkz. Malzeme Tablosu) etkilerini test etmek için, 6.667 hücre/μL süspansiyonun 495 μL'sine 5 μL 10 μM fMLP ekleyin. Negatif (uyarılmamış) kontrol için, Ca2 + ve Mg2 + içeren HBSS ekleyin.
NOT: Bu metodolojiyi göstermek için, uyaranların aşağıdaki nihai konsantrasyonları kullanılmıştır: 100 nM fMLP, 16 μM fallaxin, doğal olarak oluşan bir antimikrobiyal peptit14 ve 100 nM PMA (forbol 12-miristat 13-asetat) (bkz. - Dönmeden 37 °C'de inkübe edin.
NOT: Fonksiyonel tahliller için tüm alikotlar, bundan sonra aktivasyon sistemi olarak anılacak olan bu hücre süspansiyonundan alınır.
4. ROS üretimini değerlendirmek için nitrotetrazolyum mavi klorür (NBT) testi
- NBT çalışma çözümünün hazırlanması: Her deneysel koşul için, aşağıdaki adımları kullanarak 6 mM'lik bir NBT ( Malzeme Tablosuna bakınız) çalışma çözümü hazırlayın:
- 0.0005 g NBT'yi 10 μL dimetil sülfoksit (DMSO) içinde çözün ve en az 15 dakika vorteksleyin.
- 90 μL HBSS Ca2 + Mg2 + ekleyin ve 2 dakikaya kadar girdap yapın.
NOT: NBT ile ilgili tüm adımlar karanlıkta gerçekleştirilmelidir.
- NBT slayt testi gerçekleştirin.
- 20 dakikalık hücre aktivasyonundan sonra, hücre süspansiyonunu yavaşça karıştırın ve 2 μL PMN'yi dikkatlice temiz bir cam slayta aktarın. 37 °C'de nemlendirilmiş bir odada 20 dakika inkübe edin.
NOT: Hücre süspansiyonunu kızağın üzerine çok fazla yaymayın; Aksi takdirde inkübasyondan önce kuruyabilir. - Hücrelerin üzerine 1 μL NBT çalışma solüsyonu ekleyin ve ışıktan korunarak 20 dakika daha inkübe edin.
- Slaytı sıcak hava ile kurutun ve her bir kuyucuğa 1 dakika boyunca bir damla metanol ile sabitleyin. 1 dakika boyunca% 0.03 safranin ile boyayın ( Malzeme Tablosuna bakınız).
- Cam sürgüyü damıtılmış suyla nazikçe yıkayın.
- Slaytın kurumasını bekleyin ve mikroskop altında gözlemleyin.
- Her kuyucukta 100 rastgele hücre sayın, nötrofilleri formazan birikintileri olan ve olmayan ayırt edin.
- 20 dakikalık hücre aktivasyonundan sonra, hücre süspansiyonunu yavaşça karıştırın ve 2 μL PMN'yi dikkatlice temiz bir cam slayta aktarın. 37 °C'de nemlendirilmiş bir odada 20 dakika inkübe edin.
- NBT spektrofotometri testi gerçekleştirin.
- 40 dakikalık hücre aktivasyonundan sonra, hücre süspansiyonunu yavaşça karıştırın ve aktivasyon sisteminden 90 μL PMN'yi temiz bir mikrotüpe aktarın. Ardından, 6 mM NBT çözeltisinden 20 μL'yi dikkatlice ekleyin. Karanlıkta 37 °C'de 20 dakika inkübe edin.
- 100 μL %10 Sodyum dodesil sülfat (SDS; Malzeme Tablosuna bakınız) ve girdap ekleyin.
- % 60'lık bir genlikte bir uç-sonicator kullanarak, her biri 15 s aralıklarla 15 s'lik beş döngü kullanarak sonikate. 5 dakika boyunca 12.000 x g'da santrifüjleyin.
- Süpernatantın 60 μL'sini şeffaf tabanlı 96 oyuklu bir plakaya aktarın ve formazan ürününün emilimini 570 nm'de ölçün.
5. Fagositoz testi
- Aşağıda açıklandığı gibi her koşul için 33.000 maya/μL süspansiyon hazırlayın:
- 200 μL HBSS Ca2 + Mg2 + 'ya yaklaşık 0.75 mg kuru maya (Saccharomyces cerevisiae; Malzeme Tablosuna bakınız) ekleyin ve bir termomikserde 100 ° C'de 500 rpm ile en az 15 dakika inkübe edin.
- Karışımı vorteksleyerek homojenize edin ve 5 μL maya süspansiyonunu 45 μL %0.2 tripan mavisi boyaya aktarın. Bir Neubauer odası kullanarak mayaları sayın.
- HBSS Ca2 + Mg2 + kullanarak ilk süspansiyonun konsantrasyonunu 33.000 maya hücresi / μL'ye ayarlayın. Süspansiyonu kullanana kadar buz üzerinde tutun.
- 20 dakikalık hücre aktivasyonundan sonra, hücre süspansiyonunu yavaşça karıştırın ve aktivasyon sisteminin 5 μL'sini yeni bir steril mikrotüp içinde 33.000 maya / μL Saccharomyces cerevisiae süspansiyonunun 5 μL'sine aktarın.
NOT: Nötrofil/maya oranı 1:5'tir (PMN:maya). - Hemen 6 μL PMN/maya süspansiyonunu temiz bir cam lamın (her biri 2 μL) üç kuyucuğuna aktarın ve slaydı nemlendirilmiş bir odada 40 dakika inkübe edin.
NOT: Hücre süspansiyonunu kızağın üzerine çok fazla yaymayın; Aksi takdirde, inkübasyondan önce kuruyabilir. - Slaytı sıcak hava altında kurutun ve yukarıdaki adım 2.9'da açıklandığı gibi hızlı panoptik ile boyayın.
NOT: Hızlı panoptik boyamanın üçüncü adımı, lamın mikroskopi analizi için kritik öneme sahiptir. Bu adımda lamı ≥3 saniye boyamak, mayayı nötrofil nükleer loblarından ayırt etmek zor olacağından, analiz için uygun olmayabilir. - Slaytları mikroskop altında gözlemleyin, her kuyucuğun 100 rastgele nötrofilini sayın ve fagositoz için PMN'ler pozitif ve negatif arasında ayrım yapın.
NOT: PMN hücresel zarı içinde veya onunla doğrudan temas halinde olan en az bir maya partikülü, fagositoz için bir PMN pozitif olduğunu gösterir. Maya / nötrofil oranıyla ilgileniyorsanız, yutulan maya parçacıklarının sayısını da sayın.
6. Gerçek zamanlı PMN kemotaksis testi
NOT: Migrasyon testi, aşağıdaki uyarlamalarla önceki15'te açıklanan protokole benzer şekilde gerçekleştirilir:
- Empedans tabanlı gerçek zamanlı hücre analizörü (RTCA) plakasının alt odasına 160 μL kemoatraktan (örneğin, fMLP, IL-8, C5 veya LTB4; Malzeme Tablosuna bakınız) ekleyerek kemotaktik gradyanı hazırlayın. Negatif kontroller ve boşluklar için 160 μL HBSS Ca2 + Mg2 + ekleyin.
- Üst bölmeyi takın ve 25 μL HBSS Ca2 + Mg2 + ekleyin. Kemotaktik gradyanı oluşturmak için oda sıcaklığında en az 1 saat inkübe edin.
- 60 dakikalık hücre aktivasyonundan sonra, hücre süspansiyonunu yavaşça karıştırın ve üst bölmeye 60 μL hücre süspansiyonu yerleştirin. Boşluğa 60 μL HBSS Ca2 + Mg2 + ekleyin.
- RTCA plakasını yerleştirin ve RTCA yazılımını 2 saat boyunca her 60 saniyede bir hücre indeksini (CI) ölçecek şekilde programlayın.
NOT: RTCA plakaları, daha önce açıklandığı gibi yeniden kullanım için yıkanabilir16. Özetle, RTCA odalarını ve elektrotlarını üç kez fosfat buferred salin (PBS) ile, ardından iki kez tip I ultra saf su ile yıkayın. Alt ve üst hazneyi %0.25 tripsin 0.53 mM etilendiamintetraasetik asit (EDTA) ile 40 dakika inkübe edin. Üç kez ultra saf suyla yıkayın.
7. NET müstehcen tahlil
- 10 dakikalık hücre aktivasyonundan sonra, hücre süspansiyonunu nazikçe karıştırın ve değerlendirilmekte olan her aktivasyon sisteminden 4 μL PMN'yi temiz bir cam slaytın iki kuyucuğuna bölünerek aktarın. Nemlendirilmiş bir odada 37 °C'de 30 dakika inkübe edin.
- Kuyucuklardan birine 1 μL DNAse I ekleyin ve 37 ° C'de (ıslak bir odada) 20 dakika inkübe edin.
- Slaytı kurutun ve daha önce "nötrofil izolasyonu" bölümünün 2.9 adımında açıklandığı gibi hızlı panoptik ile boyayın.
- Slaytları mikroskop altında değerlendirin.
NOT: Web benzeri yapıların varlığı ile karakterize edilen NET sürümünün herhangi bir belirtisini arayın. Tanımlandıktan sonra, DNAse I tedavisinin bu tür yapıları kaldırıp kaldıramayacağını doğrulayın. Bu test, varlıklarını doğrulamak için ek testler gerektiğinden, NET oluşumunu düşündürür.
Sonuçlar
Bu çalışmada kullanılan yoğunluğa dayalı izolasyon yöntemi (Şekil 1), önerilen deneyler için kriterleri karşılamıştır. Bu yöntemden elde edilen nötrofil parametreleri, canlılık ≥%98, saflık ≥%94 ve hücre verimi ≥1.5 x 107 olup, tarama testleri ile aktivasyon saptanmamıştır. PMN'lerin izolasyonunda iki önemli adım, antikoagülasyon ve RBC'nin uzaklaştırılmasıdır. Antikoagüle kan tüpünü veya şırıngayı yoğunluk gradyanı üzerine katmanl...
Tartışmalar
Nötrofiller, kısa ömürlü ve henüz dondurularak saklanamayan oldukça dinamik ve duyarlı hücrelerdir19, bu da biyolojilerinin araştırılmasını zorlaştırır. Bu nedenle, canlı, zenginleştirilmiş ve dinlenen nötrofiller elde etmek için dikkatli adımlar atmak önemlidir11,20. Bu çalışma, nazik ve minimal manipülasyonun yanı sıra aktivasyon adımına kadar düşük sıcaklıkların kullanımını vurgulayan yoğunluğa...
Açıklamalar
Yazarlar herhangi bir çıkar çatışması beyan etmezler.
Teşekkürler
Yazarlar aşağıdaki finansman kuruluşlarını kabul eder: FAPDF, CNPq, CAPES, UnB, FINEP ve FINATEC.
Malzemeler
| Name | Company | Catalog Number | Comments |
| CIM-Plate 16 | Agilent | 5665825001 | |
| CLARIOstar Plate Reader | BMG LABTECH | US Patent Number 9,733,124 Product details: MARS Data Analysis Software | |
| Dimethyl sulfoxide | Dinâmica | 1582 | |
| DNAse I | Sigma - Aldrich | DN 25 | |
| Ethylenediaminetetraacetic acid disodium salt dihydrate | Sigma - Aldrich | E5134 | |
| Fast panoptic stain | Laborclin | 620529 | |
| Glass slide | Exacta | 7102 | |
| Hank’s Balanced Salt Solution with calcium, with magnesium, without phenol red. | Sigma - Aldrich | 55037C | |
| Hank’s Balanced Salt Solution without calcium chloride, magnesium sulfate and sodium bicarbonate. | Sigma - Aldrich | H4641 | |
| Heparin | Blau | 7896014655229 | |
| Laminar flow cabinet | Veco | VLFS-12 | |
| Microscope | Zeiss | 415501-0101-002 | Product details: Primostar 1 |
| Mixing Block | BIOER | MB-102 | |
| Neubauer improved bright-lined | New Optik | 1110000 | |
| N-formyl-methionyl-leucyl-phenylalanine | Sigma - Aldrich | F3506 | |
| Nitroblue tetrazolium | Neon | CAS 298-83-9 | |
| Percoll | Cytiva | 17089101 | separation media |
| Phorbol 12-myristate 13-acetate | Sigma - Aldrich | P8139 | |
| Phosphate buffered saline tablet | Sigma - Aldrich | P4417 | |
| ROTOFIX 32 A | Hettich | 1206 | |
| Saccharomyces cerevisiae | Fleischmann | ||
| Safranin | Sigma - Aldrich | 50240 | |
| Sodium dodecyl sulfate | Cytiva | 17-1313-01 | |
| Sonicator | Qsonica | Q125 | |
| Trypan blue solution | Vetec | C.I. 23850 | |
| Vortex Genie 2 | Scientific Industries, Inc. | 0K-0500-902 | |
| xCELLigence Real-Time Cell Analysis (RTCA) DP (dual purpose) | Agilent | 380601050 | Product details: RTCA system composed of detection hardware, cell plates and software |
Referanslar
- Nauseef, W. M., Borregaard, N. Neutrophils at work. Nature Immunology. 15 (7), 602-611 (2014).
- Groeneweg, L., Hidalgo, A. Emerging roles of infiltrating granulocytes and monocytes in homeostasis. Cellular and Molecular Life Sciences. 77 (19), 3823-3830 (2020).
- Rosales, C., Lowell, C. A., Schnoor, M., Uribe-Querol, E. Neutrophils: their role in innate and adaptive immunity 2017. Journal of Immunology Research. 2017, 9748345 (2017).
- Castro, M., et al. Proteome analysis of resting human neutrophils. Protein & Peptide Letters. 13 (5), 481-487 (2006).
- Li, Y., et al. The regulatory roles of neutrophils in adaptive immunity. Cell Communication and Signaling. 17, 147 (2019).
- de Oliveira, S., Rosowski, E. E., Huttenlocher, A. Neutrophil migration in infection and wound repair: going forward in reverse. Nature Reviews Immunology. 16 (6), 378-391 (2016).
- Burn, G. L., Foti, A., Marsman, G., Patel, D. F., Zychlinsky, A. The neutrophil. Immunity. 54 (7), 1377-1391 (2021).
- El-Benna, J., et al. Priming of the neutrophil respiratory burst: role in host defense and inflammation. Immunological Reviews. 273 (1), 180-193 (2016).
- Castro, M. S., Cilli, E. M., Fontes, W. Combinatorial synthesis and directed evolution applied to the production of alpha-helix forming antimicrobial peptides analogues. Current Protein & Peptide Science. 7 (6), 473-478 (2006).
- Mihaila, A. C., et al. Transcriptional profiling and functional analysis of N1/N2 neutrophils reveal an immunomodulatory effect of S100A9-blockade on the pro-inflammatory N1 subpopulation. Frontiers in Immunology. 12, 708770 (2021).
- Kuhns, D. B., Priel, D. A. L., Chu, J., Zarember, K. A. Isolation and functional analysis of human neutrophils. Current Protocols in Immunology. 111 (1), 7-23 (2015).
- Paulíková, E., Kociková, A., Sabol, M. Modification of a panoptic method of staining isolated cells. Bratislavske Lekarske Listy. 94 (12), 638-640 (1993).
- Strober, W. Trypan blue exclusion test of cell viability. Current Protocols in Immunology. 111 (1), 1-3 (2015).
- Libério, M. S., et al. Anti-proliferative and cytotoxic activity of pentadactylin isolated from Leptodactylus labyrinthicus on melanoma cells. Amino Acids. 40 (1), 51-59 (2011).
- Cano, P. M., Vargas, A., Lavoie, J. P. A real-time assay for neutrophil chemotaxis. BioTechniques. 60 (5), 245-251 (2016).
- Stefanowicz-Hajduk, J., Adamska, A., Bartoszewski, R., Ochocka, J. R. Reuse of E-plate cell sensor arrays in the xCELLigence Real-Time Cell Analyzer. BioTechniques. 61 (3), 117-122 (2016).
- Björkstén, B., Nyström, K., Lindqvist, B. The nitroblue tetrazolium (NBT) test in endemic benign (epidemic) nephropathy. Acta Medica Scandinavica. 199 (1-6), 147-150 (1976).
- Aquino, E., et al. Proteomic analysis of neutrophil priming by PAF. Protein & Peptide Letters. 23 (2), 142-151 (2016).
- Blanter, M., Gouwy, M., Struyf, S. Studying neutrophil function in vitro: cell models and environmental factors. Journal of Inflammation Research. 14, 141-162 (2021).
- Hsu, A. Y., Peng, Z., Luo, H., Loison, F. Isolation of human neutrophils from whole blood and buffy coats. Journal of Visualized Experiments. (175), e62837 (2021).
- Moghadam, Z. M., Henneke, P., Kolter, J. From flies to men: ROS and the NADPH oxidase in phagocytes. Frontiers in Cell and Developmental Biology. 9, 628991 (2021).
- Pattan, S. S., Bhat, K. G., Pattar, G. D., Kuntagi, M. Comparison of three different techniques for isolation of neutrophils from blood and their utility in performing nitroblue tetrazolium test. International Journal of Basic and Applied Physiology. 8 (1), 41 (2019).
- Gooty, J. R., Shashirekha, A., Guntakala, V. R., Palaparthi, R. Estimation of phagocytic activity of polymorphonuclear leukocytes in chronic and aggressive periodontitis patients with nitroblue tetrazolium test. Journal of Indian Society of Periodontology. 23 (4), 316 (2019).
- Langer, S., et al. Clinical and laboratory profiles of 17 cases of chronic granulomatous disease in north India. Indian Journal of Hematology and Blood Transfusion. 37 (1), 45-51 (2021).
- Oualha, R., et al. Infection of human neutrophils with Leishmania infantum or Leishmania major strains triggers activation and differential cytokines release. Frontiers in Cellular and Infection Microbiology. 9, 153 (2019).
- Zilinskas, J., Zekonis, J., Zekonis, G., Valantiejiene, A., Periokaite, R. The reduction of nitroblue tetrazolium by total blood in periodontitis patients and the aged. Stomatologijal. 9 (4), 105-108 (2007).
- Benov, L. Improved formazan dissolution for bacterial MTT assay. Microbiology Spectrum. 9 (3), e01637 (2021).
- Chen, Y., Junger, W. G. Measurement of oxidative burst in neutrophils. Methods in Molecular Biology. 844, 115-124 (2012).
- Richardson, M. P., Ayliffe, M. J., Helbert, M., Davies, E. G. A simple flow cytometry assay using dihydrorhodamine for the measurement of the neutrophil respiratory burst in whole blood: comparison with the quantitative nitrobluetetrazolium test. Journal of Immunological Methods. 219 (1-2), 187-193 (1998).
- Jancinová, V., et al. The combined luminol/isoluminol chemiluminescence method for differentiating between extracellular and intracellular oxidant production by neutrophils. Redox Report. 11 (3), 110-116 (2006).
- Nosál, R., et al. Pharmacological intervention with oxidative burst in human neutrophils. Interdisciplinary Toxicology. 10 (2), 56-60 (2017).
- Mol, S., et al. Efficient neutrophil activation requires two simultaneous activating stimuli. International Journal of Molecular Sciences. 22 (18), 10106 (2021).
- Schneider, L., et al. Flow cytometry evaluation of CD14/CD16 monocyte subpopulations in systemic sclerosis patients: a cross sectional controlled study. Advances in Rheumatology. 61 (1), 27 (2021).
- Akin, E., Pelen, N. N., Tiryaki, I. U., Yalcin, F. Parameter identification for gompertz and logistic dynamic equations. PLoS One. 15 (4), e0230582 (2020).
- Guy, J. B., et al. Evaluation of the cell invasion and migration process: A comparison of the video microscope-based scratch wound assay and the boyden chamber assay. Journal of Visualized Experiments. (129), e56337 (2017).
- Brinkmann, V., et al. Neutrophil extracellular traps kill bacteria. Science. 303 (5663), 1532-1535 (2004).
- de Bont, C. M., Koopman, W. J. H., Boelens, W. C., Pruijn, G. J. M. Stimulus-dependent chromatin dynamics, citrullination, calcium signalling and ROS production during NET formation. Biochimica et Biophysica Acta. Molecular Cell Research. 1865, 1621-1629 (2018).
- Masuda, S., et al. Measurement of NET formation in vitro and in vivo by flow cytometry. Cytometry Part A. 91 (8), 822-829 (2017).
- Zharkova, O., et al. A flow cytometry-based assay for high-throughput detection and quantification of neutrophil extracellular traps in mixed cell populations. Cytometry Part A. 95 (3), 268-278 (2019).
- Hosseinnejad, A., et al. DNase I functional microgels for neutrophil extracellular trap disruption. Biomaterials Science. 10 (1), 85-99 (2022).
- Chrysanthopoulou, A., et al. Neutrophil extracellular traps promote differentiation and function of fibroblasts. The Journal of Pathology. 233 (3), 294-307 (2014).
- Tong, M., Abrahams, V. M. Visualization and quantification of neutrophil extracellular traps. Methods in Molecular Biology. 2255, 87-95 (2021).
- Santana, C. J. C., et al. Biological properties of a novel multifunctional host defense peptide from the skin secretion of the chaco tree frog, boana raniceps. Biomolecules. 10 (5), 790 (2020).
- Murphy, M. P., et al. Guidelines for measuring reactive oxygen species and oxidative damage in cells and in vivo. Nature Metabolism. 4 (6), 651-662 (2022).
- Boero, E., et al. Use of flow cytometry to evaluate phagocytosis of staphylococcus aureus by human neutrophils. Frontiers in Immunology. 12, 635825 (2021).
- Karsten, C. B., et al. A versatile high-throughput assay to characterize antibody-mediated neutrophil phagocytosis. Journal of Immunological Methods. 471, 46-56 (2019).
- Smirnov, A., Solga, M. D., Lannigan, J., Criss, A. K. Using imaging flow cytometry to quantify neutrophil phagocytosis. Methods in Molecular Biology. 2087, 127-140 (2020).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır