Sıçan Bağırsak Organoidlerinin Üretimi ve Manipülasyonu
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Burada, sıçan bağırsak organoidleri üretmek ve bunları birkaç aşağı akış uygulamasında kullanmak için bir protokol sunuyoruz. Sıçanlar genellikle tercih edilen bir klinik öncesi modeldir ve sağlam bağırsak organoid sistemi, in vivo çalışmalara eşlik edecek bir in vitro sistem ihtiyacını karşılar.
Özet
Fizyoloji ve hücre kaderi kararlarını değerlendirmek için organoidleri kullanırken, in vivo bağlamları yakından özetleyen bir model kullanmak önemlidir. Buna göre, hasta kaynaklı organoidler hastalık modellemesi, ilaç keşfi ve kişiselleştirilmiş tedavi taraması için kullanılır. Fare bağırsak organoidleri, hem bağırsak fonksiyonu/fizyolojisi hem de kök hücre dinamiği/kader kararlarının yönlerini anlamak için yaygın olarak kullanılır. Bununla birlikte, birçok hastalık bağlamında, sıçanlar, hastalık patofizyolojisi açısından insanlara daha fazla fizyolojik benzerlikleri nedeniyle bir model olarak farelere göre sıklıkla tercih edilir. Sıçan modeli, in vivo olarak mevcut olan genetik araçların eksikliği ile sınırlandırılmıştır ve sıçan bağırsak organoidlerinin kırılgan olduğu ve uzun vadede kültürlenmesinin zor olduğu kanıtlanmıştır. Burada, duodenum ve jejunumdan sağlam bir şekilde sıçan bağırsak organoidleri üretmek için daha önce yayınlanmış protokoller üzerine inşa ediyoruz. Fonksiyonel şişme deneyleri, tüm montaj boyama, 2D enteroid tek tabakaların oluşturulması ve lentiviral transdüksiyon dahil olmak üzere sıçan bağırsak organoidlerini kullanan çeşitli aşağı akış uygulamalarına genel bir bakış sunuyoruz. Sıçan organoid modeli, insanlarla fizyolojik alaka düzeyini koruyan, hızlı bir şekilde genetik olarak manipüle edilebilen ve insan bağırsak organoidlerinin tedarikinde yer alan engeller olmadan kolayca elde edilebilen bir in vitro model için alanın ihtiyacına pratik bir çözüm sunar.
Giriş
İnsan ince bağırsak epitel mimarisi ve hücresel bileşimi karmaşıktır ve fizyolojik işlevlerini yansıtır. İnce bağırsağın birincil rolü, lümeninden geçen gıdalardanbesinleri emmektir 1. Bu işlevi en üst düzeye çıkarmak için, bağırsak yüzeyi, emici yüzey alanını artıran villus adı verilen parmak benzeri çıkıntılar ve kök hücreleri barındıran ve izole eden kript adı verilen fincan benzeri istilalar halinde düzenlenir. Epitel içinde, farklı işlevleri yerine getirmek için çeşitli özel emici ve salgı hücre tipleri üretilir1. Bu karmaşıklık nedeniyle, bağırsak gibi dokuları yüksek pasajla dönüştürülmüş ölümsüzleştirilmiş hücre dizilerinde modellemek zor olmuştur. Bununla birlikte, kök hücrelerin, özellikle yetişkin kök hücrelerin ve bunların farklılaşma mekanizmalarının incelenmesi, 3D bağırsak organoid kültürlerinin geliştirilmesine izin vermiştir. Organoid modellerin kullanımı, kısmen bazı mimari bileşenlerin yeniden özetlenmesi ve sağlam bağırsakta bulunan hücre tipi heterojenliği nedeniyle alanı dönüştürmüştür. Bağırsak organoidleri, aktif kök hücre popülasyonunun korunması nedeniyle in vitro olarak uzun süreli kültürlenebilir2.
Bağırsak organoidleri, kök hücre biyolojisi, hücre fizyolojisi, genetik hastalık ve beslenmeyi incelemek için hızla uyarlanabilir bir modelhaline gelmiştir 3,4 ve ayrıca yeni ilaç dağıtım yöntemleri geliştirmek için bir araç5. Ek olarak, hastadan elde edilen organoidler, diğerlerinin yanı sıra hastalık modellemesi, ilaç keşfi ve kişiselleştirilmiş tedavi taraması için kullanılmaktadır 6,7,8,9. Bununla birlikte, insan bağırsak organoidleri hala zorluklar sunmaktadır. Doku mevcudiyeti, Kurumsal İnceleme Kurulu onayı için gereklilikler ve etik konular, insan örneklerinin yaygın kullanımını sınırlamaktadır. Ek olarak, bağırsak kriptlerinden üretilen insan bağırsak organoidleri, farklılaşmamış kök hücrelerin korunması veya olgun hücre tiplerinin farklılaşmasını indüklemek için iki farklı kültür koşulu gerektirir10. Bu, kök hücrelerin ve olgun farklılaşmış hücre tiplerinin aynı anda mevcut olduğu ve sürekli olarak üretildiği/sürdürüldüğü in vivo ile çelişir1. Öte yandan, daha az karmaşık bir büyüme faktörleri kokteyli içinde yetiştirilen fare bağırsak organoidleri, ortam bileşiminde bu geçişi gerektirmez ve kök hücreleri ve farklılaşmış hücreleri aynı ortam bağlamında koruyabilir 2,11. Bununla birlikte, insanlarla karşılaştırıldığında fare bağırsağındaki temel farklılıklar, fare organoidlerini birçok durumda optimal olmayan bir model haline getirebilir. Genel olarak, atlar, domuzlar, koyunlar, inekler, köpekler ve kediler dahil olmak üzere daha büyük memelilerden elde edilen birçok bağırsak organoidi, insan bağırsak organoidlerinin kültür koşullarından ziyade fare bağırsak organoidleri ile daha yakından hizalanmış kültür koşullarında başarılı bir şekilde üretilmiştir12. Fare ve insan organoidleri arasındaki büyüme faktörü koşullarındaki farklılıklar muhtemelen kök hücre niş bileşimindeki farklılıkları ve kök hücrenin hayatta kalması, çoğalması ve bakımı için farklı gereksinimleri yansıtmaktadır. Bu nedenle, 1) insan bağırsak hücre bileşimine çok benzeyen, 2) insan bağırsak organoidlerininki gibi büyüme faktörü gereksinimleri olan kök hücreler içeren ve 3) farklılaşmamış ve farklılaşmış bölmeleri sürekli olarak koruyabilen, kolay erişilebilir bir model organoid sisteme ihtiyaç vardır. İdeal olarak, sistem yaygın olarak kullanılan bir klinik öncesi hayvan modelinden olacaktır, öyle ki in vivo ve in vitro deneyler ilişkilendirilebilir ve birlikte kullanılabilir.
Sıçanlar, özellikle bağırsak geçirgenliği14 ile ilgili olarak, insanlara çok benzer bağırsak fizyolojisi ve biyokimyası nedeniyle bağırsak fizyolojisi ve farmakoloji çalışmaları için yaygın olarak kullanılan bir klinik öncesi modeldir13. Farelere kıyasla nispeten daha büyük boyutları, onları cerrahi prosedürlere daha uygun hale getirir. Bazen domuzlar da dahil olmak üzere büyük hayvan modelleri kullanılırken, sıçanlar daha uygun fiyatlı bir modeldir, hayvancılık için daha az alan gerektirir ve ticari olarak kolayca temin edilebilen standart suşlara sahiptir15. Sıçan modellerini kullanmanın bir dezavantajı, in vivo çalışmalar için genetik araç setinin farelere kıyasla iyi gelişmemiş olması ve nakavtlar, nakavtlar ve transgenikler dahil olmak üzere yeni sıçan hatlarının üretilmesinin genellikle maliyet engelleyici olmasıdır. Sağlam bir sıçan bağırsak organoid modelinin geliştirilmesi ve optimizasyonu, genetik manipülasyona, farmakolojik tedavilere ve insanlarla temel fizyolojik alaka düzeyini koruyan erişilebilir bir modelde daha yüksek verimli çalışmalara izin verecektir. Bununla birlikte, bir kemirgen organoid modelinin diğerine karşı avantajları, incelenen belirli sürece veya gene büyük ölçüde bağlıdır; İnsanlarda bulunan bazı genler farelerde psödogen olabilir, ancak sıçanlarda olmayabilir16,17. Ek olarak, türe özgü hücre alt tipleri, tek hücreli RNAseq18,19,20 tarafından giderek daha fazla ortaya çıkarılmaktadır. Son olarak, sıçan ve fare bağırsak hastalığı modelleri genellikle fenotiplerde önemli farklılıklar gösterir21,22, öyle ki, insanlarda görülen semptomları ve hastalık sürecini daha yakından özetleyen model, aşağı akış çalışması için seçilmelidir. Bir sıçan bağırsak organoid modelinin oluşturulması, araştırmacılara kendi koşullarına en uygun model sistemini seçmede ek esneklik ve seçenek sağlar. Burada, sıçan bağırsak organoidlerinin üretimi için mevcut protokoller23,24 genişletilmiştir ve duodenum veya jejunumdan sıçan bağırsak organoidlerinin üretimi ve bakımı için bir protokol özetlenmiştir. Ek olarak, lentiviral enfeksiyon, tüm mount boyama ve forskolin şişme testleri dahil olmak üzere çeşitli aşağı akış uygulamaları açıklanmaktadır.
Protokol
NOT: Tüm hücre kültürü, bir doku kültürü başlığında uygun aseptik teknik kullanılarak işlenmelidir. Bu çalışmadaki tüm hayvan çalışmaları, Yale'in Kurumsal Hayvan Bakımı ve Kullanımı Komitesi (IACUC) tarafından onaylanmıştır.
1. Hücre kültürü reaktiflerinin hazırlanması
- Üreticinin talimatlarına göre R-spondin 1 şartlandırılmış ortamı hazırlayın. Üreticinin talimatlarına uyarak Wnt3a koşullu ortamı hazırlayın. AdDMEM+'ı Tablo 1'de açıklandığı gibi hazırlayın.
- 100 μM'lik bir stok hazırlamak için gastrini steril dH2O'da yeniden süspanse edin. Aliquot ve -80 °C'de saklayın. 100 mM'lik bir stok hazırlamak için N-asetilsisteini steril suda yeniden süspanse edin. Ayıkotlayın ve -20 °C'de 1 aya kadar saklayın.
- 250 μg / mL'lik bir stok hazırlamak için fosfat tamponlu salin (PBS) +% 0.1 sığır serum albümini (BSA) içinde rekombinant insan Noggin'i yeniden süspanse edin. Aliquot ve -80 °C'de saklayın. 100 μg/mL'lik bir stok hazırlamak için PBS +% 0.1 BSA'da rekombinant fare epidermal büyüme faktörünü (EGF) yeniden askıya alın. Aliquot ve -80 °C'de saklayın.
- 100 μg / mL'lik bir stok hazırlamak için rekombinant insan IGF-1'i PBS +% 0.1 BSA'da seyreltin. Aliquot ve -80 °C'de saklayın. 100 μg/mL'lik bir stok hazırlamak için rekombinant insan FGF-2'yi 5 mM Tris, pH 7.6'da yeniden süspanse edin. Aliquot ve -80 °C'de saklayın.
NOT: Tüm büyüme faktörleri için, PBS +% 0.1 BSA'da kültür ortamındaki nihai konsantrasyonun 100 katına kadar bir ara seyreltme kullanın. -20 °C'de saklayın.
2. Sıçan ince bağırsak organoidlerinin kurulması
NOT: Bu protokol, sıçan bağırsak organoidleri için daha önce yayınlanmış iki protokoldendeğiştirilmiştir 23,24.
- Sıçan bağırsak organoid ortamını (rIOM) Tablo 2'ye göre hazırlayın ve 37 ° C'de bir su banyosu ayarlayın. Bu tam besiyeri, 4 °C'de 5 gün boyunca stabildir.
- PBS'de 15 mL'lik konik bir tüpte 10 mL 3 mL etilendiamintetraasetik asit (EDTA) hazırlayın ve buz üzerinde tutun. 250 μL hücre dışı matris ekstraktını (EME) buz üzerinde çözdürün.
- Su ad libitum'a erişimi olan bir fareyi gece boyunca oruç tutun.Sıçanı IACUC onaylı protokole göre ötenazi yapın. Bu protokolde, yetişkin erkek Sprague Dawley sıçanları (~ 200 g ağırlığında) CO2 inhalasyonu yoluyla ötenazi yapıldı (Malzeme Tablosu). Servikal çıkık sekonder ötanazi yöntemi olarak kullanıldı.
- Diseksiyon için steril otoklavlanmış forseps ve diseksiyon makası kullanın. Ötenazi yapılan sıçanı ventral tarafı yukarı bakacak şekilde diseksiyon yüzeyine yerleştirin. Cilt tabakasını forseps ile sıkıştırın; Aşağıdaki kesiler yüzey seviyesinde yapılmalıdır, bu nedenle sadece bu cilt tabakasını keser ve iç organlara zarar verecek kadar derin değildir.
- Karın boşluğunu açmak için, büyük, keskin diseksiyon makası kullanarak, karnın ortasında büyük, uzunlamasına, yüzey seviyesinde bir kesikte cilt tabakasını kesin. Ardından, bu kesimden yola çıkarak, her iki tarafta birer tane olmak üzere iki kısa yatay kesim yapın. Karın boşluğunu ortaya çıkarmak için cildi soymak için forseps kullanın. Bağırsaklara hazır erişim ile karın boşluğundaki iç organları tamamen ortaya çıkarmak için periton zarını kesin.
- Makas ve forseps kullanarak mideyi bulun ve sarımsı bir segment olarak görünen duodenumun yaklaşık 2-3 cm distalini tanımlayın. Proksimal jejunum, duodenum ve jejunum arasında bir dönüm noktası görevi gören Treitz ligamentinin yaklaşık 4-5 cm distalinde bulunur.
- İzole edilmiş bağırsak parçasını 10 cm'lik bir Petri kabına yerleştirin. Mezenterin istenen bağırsak bölümünü mümkün olduğunca temizleyin. Lümen içeriği temizlenene kadar 10 mL buz gibi soğuk PBS ile yıkayın. Bir kağıt havlu üzerinde bağırsak segmentini ~ 2 cm uzunluğunda parçalar halinde kesin. Epiteli ortaya çıkarmak için her bağırsak parçasını uzunlamasına açın.
- Bir cam mikroskop lamı kullanarak, villusları çıkarmak için açıkta kalan lümen yüzeyini kazıyın. Bağırsak parçalarını buz üzerinde hazırlanan EDTA çözeltisine yerleştirin. 4 rpm'ye ayarlanmış bir tüp tabanca üzerinde 30 dakika boyunca 10 °C'de döndürün.
- Diseksiyon mikroskobunda, konik tüpün içeriğini 10 cm'lik bir Petri kabına dökün. İlave ~5 mL buz gibi PBS ekleyin.
- İnce forseps kullanarak bir bağırsak segmentini tutun ve kuvvetlice sallayın. Epitelin PBS'ye salındığını görmek mümkün olacaktır. İlk başta, PBS öncelikle villus içerecektir.
- Sallamaya devam edin. Villus içeren PBS'yi periyodik olarak atın ve bağırsak parçalarına 10 mL taze buz gibi soğuk PBS ekleyin. Parçaları sallamaya devam edin ve villuslar artık PBS'ye salınmayana kadar bu yıkama adımını tekrarlayın, bunun yerine PBS öncelikle kriptler içerir. Hücre canlılığından ödün vermemek için kript izolasyonu için 15 dakikayı aşmayın.
- Kalan bağırsak parçalarını atın. Bağırsak kriptleri için Petri kabında kalan PBS'yi zenginleştirin. Bir doku kültürü başlığında, PBS içeren kriptleri toplayın ve 70 μm'lik bir hücre süzgecinden süzün (Malzeme Tablosu).
- 250 x g'da 5 dakika santrifüjleyin. Süpernatanı çıkarın ve peleti 5 mL AdDMEM+ içinde yeniden süspanse edin. 5 dakika boyunca 250 x g'da tekrar santrifüjleyin.
NOT: Döner kova rotorlu bir santrifüj kullanılması tavsiye edilir. - Peletle birlikte ~50 μL ortam bırakarak süpernatanı çıkarın. Kalan ortamda peleti yeniden süspanse edin ve buz üzerinde EME'nin alikotuna ekleyin. Kriptoları EME boyunca eşit şekilde asmak için hafifçe yukarı ve aşağı pipetleyin. Baloncuk sokmaktan kaçının.
- 50 μL EME kubbelerini 35 mm'lik bir doku kültürü kabına yerleştirin ve 37 °C,% 5CO2 doku kültürü inkübatöründe 20 dakika inkübe edin.
- 10 μM Y27632 ve 10 μM CHIR99021 içeren 2 mL rIOM (Tablo 2) ekleyin (Tablo 3). Geçtikten sonra Y27632 ve CHIR99021 kesilebilir.
- rIOM'u 2-3 günde bir değiştirin. Gerektiğinde, genellikle 3-7 gün arasında, başlangıçtaki organoid sayısına, boyutuna ve büyüme hızına bağlı olarak geçiş.
3. Sıçan bağırsak organoidlerini geçiren
- 250 μL'lik bir EME alikotunu buz üzerinde çözdürün ve rIOM'yi 37 °C'ye ısıtın.
- Ortamı organoidler içeren 35 mm'lik bir plakadan aspire edin ve organoidleri EME kubbelerinden hemen serbest bırakmak için 1 mL ayrışma reaktifi ekleyin.
- Parçalanmış organoidler içeren ayrışma reaktifini hemen 15 mL'lik konik bir tüpe aktarın. Kültür plakasını 2 mL AdDMEM+ ile yıkayın ve parçalanmış organoidler içeren 15 mL konik tüpe ekleyin.
- Bir cam Pasteur pipeti ile organoidleri parçalamak için 15-20 kez hafifçe yukarı ve aşağı pipetleyin. 350 x g'da 2 dakika santrifüjleyin.
- Konik tüpün altından EME'ye ~ 50 μL çözelti ekleyin. Karıştırmak için hafifçe yukarı ve aşağı pipetleyin. Baloncuk yapmaktan kaçının.
- 50 μL EME kubbelerini 35 mm'lik bir tabağa yerleştirin ve 37 °C,% 5 CO2 doku kültürü inkübatöründe 20 dakika inkübe edin.
- 10 μM Y27632 ve 10 μM CHIR99021 ile 2 mL rIOM ekleyin. Büyüme ortamını 2-3 günde bir değiştirin. Ortam değiştirilirken Y27632 ve CHIR99021 atlanabilir.
4. Sıçan bağırsak organoidlerinin dondurularak saklanması ve çözülmesi
- Sıçan bağırsak organoidlerinin dondurularak saklanması
NOT: Kriyoprezervasyon protokolü, insan ve fare organoidleri25 için önceki bir protokolden değiştirilmiştir. Donmadan önce, organoidlerin birincil kültürde en az iki pasajı olmalıdır. Dondurucu rezervasyondan önce organoidlerin büyük sferoidler veya hafif tomurcuklanmış organoidler noktasına kadar büyütülmesi tavsiye edilir, çünkü bu, çözülme sonrası daha yüksek canlı organoid verimi ile sonuçlanacaktır. Bu, R-spondin şartlandırılmış ortamı% 15'e çıkarılarak ve / veya organoid kültüre 10 mM nikotinamid (Tablo 3) eklenerek gerçekleştirilebilir.- Bir mikroskop kullanarak, 35 mm'lik tabaktaki organoidlerin sayısını sayın. Kriyoviyalleri, her bir kriyoviyalde 200 organoid eklenecek şekilde etiketleyin.
- RIOM'u 35 mm'lik çanaktan çıkarın. 2 mL soğuk doku kültürü dereceli PBS ile değiştirin.
- Bir P1000 ucu kullanarak, EME kubbelerini kültür kabının altından yukarı ve aşağı pipetleyerek PBS'ye bırakın. EME'yi parçalamak ve organoidleri serbest bırakmak için ~20 kez yukarı ve aşağı pipetlemeye devam edin. Organoidleri ve PBS'yi 15 mL'lik konik bir tüpte toplayın.
- Kültür kabına 2 mL soğuk PBS ekleyin ve kalan organoidleri PBS'ye bırakmak için yukarı ve aşağı pipetleyin. PBS'yi 15 mL'lik konik tüpe aktarın.
- Organoidleri 5 dakika boyunca 290 x g'da santrifüjleyerek pelet haline getirin. Organoid peleti bozmadan süpernatanı çıkarın ve atın.
- Peletleri 5 mL soğuk AdDMEM+ içinde hafifçe yeniden süspanse ederek yıkayın. 200 x g'da 4 dakika santrifüjleyin. Süpernatanı dikkatlice çıkarın ve atın.
- Organoid peletini 200 organoid başına 1 mL soğuk dondurma ortamında yeniden süspanse edin. Etiketli kriyoviyal başına donma ortamında 1 mL organoid alikot. Kriyovialleri dondurucu bir kaba koyun.
- Organoidleri 24 saat boyunca -80 °C'de dondurucu bir kapta saklayın, ardından kriyoviyalleri uzun süreli depolama için sıvı nitrojene aktarın.
- Sıçan bağırsak organoidlerinin çözülmesi
NOT: Bu protokol, insan ve fare bağırsak organoidlerinin çözülmesi için önceki bir protokolden değiştirilmiştir26.- 250 μL'lik bir EME alikotunu buz üzerinde çözdürün. % 15 R-spondin şartlandırılmış ortam, 10 μM Y27632 ve 10 μM CHIR99021 ile desteklenmiş rIOM hazırlayın. 37 °C'de ılık.
- Oda sıcaklığında 15 mL'lik konik bir tüpe 2 mL buz çözme ortamı (Tablo 3) ekleyin.
- Şişeyi neredeyse tamamen çözülene kadar 37 ° C'lik bir su banyosuna yerleştirerek sıvı nitrojenden bir organoid şişesini alın ve çözün.
- Şişeye 1 mL buz çözme ortamı ekleyin ve tüm içeriği buz çözme ortamı içeren konik tüpe aktarın. Şişeyi 1 mL buz çözme ortamı ile iki kez yıkayın ve konik boruya aktarın.
- 200 x g'da 5 dakika santrifüjleyin. Organoidlerle birlikte ~ 50 μL ortam bırakarak ortamı aspire edin. Organoid içeren ortamı 250 μL EME'ye aktarın.
- Kabarcıklardan kaçınarak yukarı ve aşağı pipetleyerek organoidleri EME boyunca eşit olarak dağıtın. Altı adet 50 μL'lik kubbeyi 35 mm'lik bir doku kültürü kabına pipetleyin.
- EME'nin polimerize olmasını sağlamak için doku kültürü inkübatöründe 15-20 dakika inkübe edin. Hazırlanan rIOM'den 2 mL yemeğe ekleyin.
- 2 gün sonra medyayı rIOM ile değiştirin. Y27632 ve CHIR99021 kullanımı askıya alınabilir. Çözüldükten sonraki ilk geçişte organoid büyüme yavaş olabilir. Deneylere başlamadan önce çözüldükten sonra organoidlerin iki kez geçirilmesi tavsiye edilir.
5. 3D organoidlerden sıçan bağırsağı 2D tek katmanlarının üretilmesi
NOT: Aşağıdaki protokol, ~300 bağırsak organoidi/kubbe içeren 50 μL'lik (35 mm çanak) altı kubbeden başlayarak, EME ile kaplanmış 48 oyuklu bir plakanın 24 kuyusunu oluşturmak için gereken hacimleri açıklar (ölçek: bir kubbe dört kuyucuk oluşturur), ancak gerektiğinde yukarı veya aşağı ölçeklendirilebilir. Yazıldığı gibi, bu protokol 4-5 gün içinde ~%80 birleşme sağlar. Daha yüksek birleşmede, hücreler tekrar 3D organoid yapılar kazanmaya başlar. Düşük birleşmede (% ≤40), hücreler tek tabaka olarak kalır ve ~ 14 gün boyunca yaşayabilir. Çalışmanın amacı 2D tek katmanlar kullanmaksa, bir kubbe 24 oyuklu bir plakadan sekiz kuyu oluşturacak şekilde ölçeği küçültün. Kuyucuklar ayrıca tek katmanlar oluşturmak için kollajen I ile kaplanabilir.
- Kaplanmış yüzeylerin hazırlanması
- Plakayı EME ile kaplamak için EME 1:20 oranında soğuk AdDMEM+ ile seyreltin (Tablo 1). Kollajen ile kaplamak için, kollajen I'i üreticinin talimatlarına göre hazırlayın. AdDMEM + 'da 5 mg / mL kollajen I'i 100 μg / mL'ye (bu durumda 1:50) seyreltin.
- Kuyu yüzeyini tamamen kaplamak için plakayı 200 μL seyreltilmiş EME veya kollajen ile kaplayın. Bir doku kültürü inkübatöründe 37 ° C'de 1-2 saat inkübe edin. Sıçan bağırsak organoid ortamını Tablo 2'e göre 2D tek katmanlı kültür ( rIOM4D) için hazırlayın.
- Tek katmanların oluşturulması
- Ortamı organoidler içeren 35 mm'lik bir plakadan aspire edin. 1 mL PBS ekleyin.
- P1000 ucu ile çizerek kuyulardaki EME'yi bozun. Tüm EME'yi gevşetmek için yaklaşık 20 kez yukarı ve aşağı pipetleyin. Her şeyi 15 mL'lik konik bir tüpe aktarın.
- Ek organoidleri geri kazanmak ve aynı 15 mL konik tüpe aktarmak için 35 mm'lik plakaya 1 mL PBS ekleyin.
- 2 dakika boyunca 350 x g'da santrifüjleyin ve EME kalıntısı da dahil olmak üzere süpernatanı aspire edin. Organoid peletine 1 mL tripsin çözeltisi ekleyin ve 37 °C'de 2 dakika inkübe edin.
- Bir P1000 ucu kullanarak 10 kez yukarı ve aşağı pipetleyin ve tripsini nötralize etmek için 2 mL AdDMEM+ ekleyin.
- 350 x g'da 5 dakika santrifüjleyin. Süpernatanı aspire edin ve 4.8 mL rIOM2D ekleyin (Tablo 4). Hücre peletini yeniden süspanse edin.
- Organoidleri yerleştirmeden önce, oyuklardan AdDMEM + 'daki fazla EME veya kolajeni alın. Ardından, rIOM2D'de 200 μL organoid ve önceden kaplanmış her bir kuyucuğa 10 μM Y27632 ekleyin.
- 4-16 saat sonra, ortamı toplayın ve 1,000 x g'de 1 dakika boyunca santrifüjleyin. Süpernatanı yeni bir 15 mL konik tüpe aktarın ve peleti atın.
- Her bir kuyucuğu 300 μL PBS ile yıkayın ve her bir kuyucuğa 200 μL santrifüjlenmiş rIOM2D ekleyin. rIOM2D'yi her 2-3 günde bir değiştirin ve Y27632'nin kullanımını askıya alın.
- 2D tek katmanlardan 3D organoidlerin yeniden şekillendirilmesi
NOT: EME üzerinde yetiştirilen tek katmanlar 3D organoidleri yeniden biçimlendirmek için indüklenebilirken, kollajen I üzerinde yetiştirilen tek tabakalar verimli bir şekilde 3D organoidlere geri dönmez. Genellikle, tek tabakalardan üretilen 2-3 oyuklu organoidler, 5. günde 50 μL'lik bir EME kubbesi yapmak için kullanılabilir.- EME 1:4'ü rIOM2D'de seyreltin. Tek katmanlar ~%80 birleşmeye ulaştığında, ortamı dikkatlice aspire edin ve tek katmanlar içeren oyuklara 100 μL seyreltilmiş EME ekleyin.
- 37 °C'de, %5CO2'de doku kültürü inkübatöründe 20 dakika inkübe edin. Daha sonra 100 μL rIOM2D ekleyin ve doku kültürü inkübatörüne geri dönün. 3D organoidler, seyreltilmiş EME eklendikten sonraki 5 gün içinde üretilecektir.
- Küçük organoidler yeniden oluştuktan sonra (~ 5. gün), rIOM'u hazırlayın. EME'yi bozmak için yukarı ve aşağı pipetleyerek tüm kuyu içeriğini toplayın ve 15 mL'lik konik bir tüpe aktarın.
- 350 x g'da 2 dakika santrifüjleyin. Süpernatan ve EME kalıntısını aspire edin.
- 1 mL soğuk AdDMEM+ ekleyin ve 350 x g'da 2 dakika santrifüjleyin. ~50 μL ortam bırakarak süpernatanı çıkarın.
- 50 μL ortam ve organoidleri 250 μL'lik bir EME alikotuna aktarın. Organoidleri EME boyunca dağıtmak için yukarı ve aşağı pipetleyin.
- 50 μL EME kubbelerini 35 mm'lik bir tabağa pipetleyin ve bir doku kültürü inkübatöründe 20 dakika inkübe edin.
- 2 mL rIOM artı 10 μM Y27632 ekleyin. Büyüme ortamını 2-3 günde bir değiştirin. Medyayı değiştirirken, Y27632 atlanabilir.
6. Genetik manipülasyon
- 2D tek katmanların geçici transfeksiyonu
DİKKAT: 48 oyuklu bir plakada bölüm 5.1'i izleyerek sıçan bağırsağı epitel tek katmanlarını hazırlayın. Transfeksiyon %70-80 birleşimde yapılmalıdır. Transfekte etmeden önce kuyucuklardaki ortamı daima 200 μL taze rIOM2D ile değiştirin. Plazmit DNA'nın 260/280 nm ve 260/230 nm absorbans oranlarını hesaplayın; İyi transfeksiyon sonuçları elde etmek için bunlar 1.8'in üzerinde olmalıdır.
NOT: Transfeksiyon verimliliğini hesaplamak için bir plazmit kontrolü kullanın. Kolaylık için bir floresan proteini kodlayan bir plazmit önerilir. Bu protokolde pLJM1-EGFP27 kullanılmıştır.- 1 mg / mL 20 kDa polietilenimin (PEI; Tablo 3). Her kuyucuk için, tüp A (0.6 μg plazmit + 50 μL indirgenmiş serum ortamı) ve tüp B (1.8 μL PEI + 50 μL indirgenmiş serum ortamı) hazırlayın. DNA:PEI oranını 1:3 olarak koruyun.
- Her iki tüpü de 30 saniye boyunca vorteksleyin. Tüp A ve tüp B'yi birleştirin ve 30 saniye boyunca tekrar girdap yapın. Gerekirse, döndürmek için bir santrifüj kullanın. Oda sıcaklığında 20 dakika inkübe edin.
- DNA/PEI kompleksini yavaşça damla damla 2D tek katmana ekleyin. Karıştırmak için plakayı hafifçe döndürün. 37 °C'de inkübe edin,% 5 CO2. İfade genellikle 24 saat sonra tespit edilebilir.
NOT: 3D organoid yapılara geri dönmek gerekirse, seyreltilmiş EME eklemek için transfeksiyondan sonra 48 saat bekleyin.
- Sıçan bağırsak organoidlerinin lentiviral transdüksiyonu
NOT: Lentivirüslerle çalışmadan önce, kurumdan uygun yetkilendirme ve uzmanlık eğitimi alın. Lentivirüsleri kullanırken daima uygun kişisel koruyucu ekipman (KKD) kullanın. Burada ana hatlarıyla belirtilmemiş olsa da, yüksek kaliteli, konsantre lentivirüs, organoidlerin başarılı bir şekilde enfeksiyonu için gereklidir. Bu protokol boş pLJM1-EGFP vektörü kullandı27 çözünür GFP'yi ifade etmek için. Bu protokol daha önce yayınlanmış bir protokolden değiştirilmiştir28. Transdüksiyon verimliliği, viral partiküllerin kalitesine ve konsantrasyonuna, organoidlerin küçük hücre kümelerine verimli bir şekilde ayrışmasına ve eksprese edilen gene bağlıdır. Enfeksiyondan 5 gün sonra hesaplandığında, seçimden önceki ortalama transdüksiyon etkinliği %19.4 (± %6.5 standart sapma) idi.- Lentiviral enfeksiyondan 2 gün önce, transdüksiyon yapılacak her lentivirüs için 24 oyuklu bir plakanın iki yoğun kuyusundan geçmeyi planlayın (bölüm 3). 24 oyuklu bir plakanın her bir kuyucuğu, bir adet 50 μL'lik EME kubbesini barındırabilir.
- EME katılaştıktan sonra, 10 mM nikotinamid, 10 μM Y27632 ve 2.5 μM CHIR99021 ile desteklenmiş 0.5 mL rIOM ekleyin. Bu, lentiviral transdüksiyonun etkinliği için uygun olan büyük sferoid morfolojileri indükler. Kaplamadan sonraki 2 gün içinde, sıçan organoidleri büyük sferoidler olmalıdır. Önemli bir farklılaşma (yani tomurcuklanma) gözlenirse, organoidleri yeniden geçirin.
- Konsantre virüsü buz üzerinde çözün. Tablo 3'e göre taze transdüksiyon ortamı hazırlayın.
- Bir P1000 ucu kullanarak, EME kubbelerini hücre kültürü kabının altından yukarı ve aşağı pipetleyerek ortama bırakın. EME'yi parçalamak ve organoidleri serbest bırakmak için 20 kez yukarı ve aşağı pipetlemeye devam edin.
- Organoidleri ve ortamı 15 mL'lik konik bir tüpe pipetleyin. Organoidlerin aynı genotipe sahip olması ve aynı soydan olması koşuluyla tüm kuyular bir araya getirilebilir.
- Her kuyuyu 1 mL soğuk AdDMEM+ ile iki kez yıkayın. AdDMEM+'ı toplayın ve aynı 15 mL'lik konik tüpe aktarın.
- Bir cam Pasteur pipeti kullanarak, sıçan organoidlerini mekanik olarak bozun. Amaç küçük çok hücreli hücre kümeleri olduğu için bu kritik bir adımdır. ~30 kez yukarı ve aşağı pipetleyin. 4x objektif kullanarak mikroskop altında bozulmanın verimliliğini kontrol edin. Hücre süspansiyonu esas olarak az sayıda organoid kalan hücre kümelerinden oluşana kadar bu işleme devam edin.
NOT: Alternatif olarak, organoidler oda sıcaklığında 5 dakika boyunca 200 x g'de santrifüjlenebilir, süpernatant dikkatlice çıkarılabilir ve doku kültürü inkübatöründe 37 ° C'ye önceden ısıtılmış geleneksel tripsin / EDTA'nın yerini alan 1 mL rekombinant enzim içinde yeniden süspanse edilebilir. Organoidleri, ayrışmayı teşvik etmek için düzenli girdap ile 37 ° C'lik bir su banyosunda 2 dakika boyunca tripsin replasmanında inkübe edin. Tripsin replasmanı ile uzun süreli inkübasyondan kaçının, çünkü bu hücre ölümünü teşvik edebilir. 4x objektif kullanarak mikroskop altında bozulmanın verimliliğini düzenli olarak kontrol edin. Süspansiyon, birkaç hücre kültürüne sahip esas olarak tek hücrelerden oluştuğunda, 4 mL AdDMEM+ ekleyerek tripsin replasmanını seyreltin ve aşağıdaki adıma geçin. - Hücre kümelerini içeren 15 mL'lik konik tüpü 200 x g'da 4 °C'de 5 dakika döndürün. Hücre peletini rahatsız etmemeye dikkat ederek süpernatanı dikkatlice çıkarın ve atın.
- Hücre kümelerini, enfekte edilecek kuyucuk başına 230 μL transdüksiyon ortamında yeniden süspanse edin. Enfeksiyon için, her lentivirüs için 48 oyuklu bir plakadan bir kuyu kullanın.
- Plaka: 230 μL hücre süspansiyonu, etiketli 48 oyuklu bir plakanın her bir oyuğuna. Her oyuğa 20 μL konsantre virüs ekleyin. Her bir oyukta virüs / hücre çözeltisini karıştırmak için bir P1000 ucu kullanın ve plakayı şeffaf bir filmle kapatın.
- Spinokülasyon gerçekleştirin: plakayı 32 ° C'de 1 saat boyunca 600 x g'da santrifüjleyin. Plakanın mührünü açın ve 37 °C'de, %5CO2'de 6 saat inkübe edin.
- 37 °C inkübatörde 24 oyuklu bir plakayı önceden ısıtın.
- İnkübasyondan sonra, her birini yukarı ve aşağı pipetleyin ve içeriği etiketli 1,5 mL'lik bir tüpe aktarın. Her bir kuyuyu 750 μL AdDMEM+ ile yıkayın ve tüpe aktarın. Tüpleri 600 x g'da 4 °C'de 5 dakika döndürün.
- Tüpleri santrifüjden çıkarın ve buz üzerinde saklayın. Süpernatanı dikkatlice çıkarmak ve uygun şekilde atmak için bir P1000 ucu kullanın.
- EME'deki hücre peletini yeniden süspanse edin ve 50 μL'lik kubbeleri önceden ısıtılmış 24 oyuklu plakaya yerleştirin. EME polimerize olana kadar 37 ° C'de 15-20 dakika inkübe edin.
- Her kuyucuğa, 10 mM nikotinamid, 10 μM Y27632 ve 2.5 μM CHIR99021 ile desteklenmiş 500 μL rIOM ekleyin.
- Enfeksiyondan 1 gün sonra ortamı rIOM artı 10 μM Y27632 ile değiştirin. Medyayı 2-3 günde bir değiştirin. Seçim yapılacaksa, enfeksiyondan 48-72 saat sonra seçimi ekleyin. Puromisin seçimi için 2 μg/mL puromisin kullanın.
7. İmmünofloresan organoidlerin bütün montaj boyaması
- Ortamı aspire edin ve bir hücre kültürü kabındaki organoidlere PBS-Tween 20'de (PBS-T) (Tablo 3) %4 paraformaldehit (PFA) ekleyin. Oda sıcaklığında 10 dakika inkübe edin.
- Yukarı ve aşağı pipetleyerek organoidleri EME'den serbest bırakın. Organoidleri 0.75 mL'lik bir tüpte toplayın. Organoidler birkaç dakika içinde yerçekimi ile tüpün dibine yerleşecektir. Gerekirse, 1 dakika boyunca 100 x g'da santrifüjleyin.
- Bir transfer pipeti kullanarak PFA'yı çıkarın ve PBS-T'deki organoidleri yeniden süspanse edin. Organoidlerin tüpün dibine yerleşmesine izin verin. PBS-T'yi çıkarın ve 200 μL blok çözeltisinde yeniden süspanse edin (Tablo 3).
- Oda sıcaklığında bir külbütör veya nutatör üzerinde 45 dakika inkübe edin. Organoidler topaklanabilir ve tüpün dibine yerleşebilir. Çözelti boyunca yeniden süspanse etmek ve dağıtmak için tüpü periyodik olarak parmakla hafifçe vurun.
- Organoidlerin tüpün dibine yerleşmesine izin verin. Gerekirse, 1 dakika boyunca 100 x g'da santrifüjleyin. Blok çözümünü kaldırın.
- 100 μL blok çözeltisi içinde seyreltilmiş birincil antikor ekleyin. Oda sıcaklığında bir somunlama mikserinde 24 rpm'de 45 dakika inkübe edin. Antikor konsantrasyonları, kullanılan antikora bağlı olarak değişir.
NOT: Bu adım, birincil antikora bağlı olarak 4 °C'de bir geceye kadar uzatılabilir. - Organoidlerin tüpün dibine yerleşmesine izin verin. Gerekirse, 1 dakika boyunca 100 x g'da santrifüjleyin.
- Bir transfer pipeti kullanarak PBS-T'de beş kez yıkayın. Oda sıcaklığında 24 rpm'de nutasyon mikserinde 5 dakika inkübe edin. Bu adımı iki kez tekrarlayın.
- 100 μL blok çözeltisi içinde seyreltilmiş 1:200 ve 50 μg/mL 4',6-diamidino-2-fenilindol (DAPI) ile seyreltilmiş ikincil antikor ekleyin. Oda sıcaklığında bir somun mikserinde 24 rpm'de 30 dakika inkübe edin.
- Organoidlerin tüpün dibine yerleşmesine izin verin. Gerekirse, 1 dakika boyunca 100 x g'da santrifüjleyin. İkincil antikoru çıkarın. Bir transfer pipeti kullanarak PBS-T'de beş kez yıkayın.
- Oda sıcaklığında 24 rpm'de bir somun mikserinde 5 dakika inkübe edin. Yıkama adımını iki kez tekrarlayın.
- Organoidler yıkanırken, sıvılaştırmak için bir dizi VALAP sızdırmazlık maddesini (Tablo 3) 40-50 °C'de ısıtın. Bir boya fırçası kullanarak, yaklaşık bir lamel büyüklüğünde bir mikroskop lamı üzerine ince bir VALAP karesi boyayın. 22 mm x 22 mm No. 1.5 lamel kullanın.
- Makas kullanarak P200 pipet ucunun ucunu kesin. Organoidleri slayttaki VALAP kuyusuna aktarın. Bir mendil kullanarak PBS-T'yi dikkatlice uzaklaştırın. Organoidlerin kurumasına izin vermeyin.
- VALAP'ı bir antifade montaj ortamı ile iyice doldurun (Tablo 3). ~22 mm x 22 mm'lik bir kare için bu 100-150 μL antifade gerektirecektir.
- Organoidler kümelenebilir; Gerekirse organoidleri yeniden dağıtmak için antifadeyi bir pipet ucuyla döndürün. Hava kabarcıklarını önleyerek 22 mm x 22 mm No. 1.5 lamel ile monte edin. Kenarlara ince bir VALAP tabakası boyayarak lameli kapatın.
NOT: Ters mikroskoplar için, organoidler 35 mm'lik cam tabanlı bir çanağa da monte edilebilir.
8. Sıçan bağırsak organoidlerinin forskolin kaynaklı şişmesi
- Organoidleri rIOM'de geçtikten sonra 3-5 gün büyütün. Aynı bölgenin kolayca yeniden görüntülenebilmesini sağlamak için organoidlerin 24 oyuklu bir plakada yetiştirilmesi tavsiye edilir. Forskolin (T0) ilavesinden önce görüntüleri yakalayın.
- Forskolin (Tablo 3) doğrudan organoid ortama 10 μM'lik bir nihai konsantrasyona ekleyin. Kontrol kuyucuklarına aynı hacimde dimetil sülfoksit (DMSO) ekleyin.
- Her 15-30 dakikada bir düzenli aralıklarla kontrol ve forskolin ile tedavi edilmiş kuyuları görüntüleyin. Görüntüleme yapılmadığında, organoidleri inkübatörde tutun veya inkübasyonlu kontrollü bir görüntüleme sistemi kullanın. Maksimum şişlik 120 dakika gözlenmelidir.
- Elde edilen görüntülerden bağıl şişmeyi hesaplamak için standart protokolleri izleyin29.
Temsili Sonuçlar
Sıçan duodenal ve jejunal organoidleri, bölüm 2'de özetlenen protokol kullanılarak üretildi. Kript izolasyon adımları sırasında villusların PBS'den verimli bir şekilde tükenmesi çok önemlidir. EME'de kriptlerle çok fazla villus kaplanırsa, tüm kültürün ölümüne ve organoid bir hattın kurulamamasına neden olabilir. Bu nedenle, kriptleri bir diseksiyon kapsamı altında izole etmek yararlıdır, bu da villar tükenmesinin görsel olarak doğrulanmasına izin verir. Şekil 1 , temsili villar parçalarını ve kriptleri göstermektedir (Şekil 1A). Villuslara kıyasla önemli ölçüde daha küçük kript boyutuna dikkat edin (Şekil 1B). Kaplamadan sonra, kriptler önümüzdeki birkaç gün içinde sferoidlere genişleyecek ve 4-7. günlerde tomurcuklanmaya ve farklılaşmaya başlayacaktır (Şekil 2). Organoidler yoğun bir şekilde tomurcuklanmış bir aşamaya ulaştığında, geçilmeleri gerekir. Geçiş sırasında, organoid sayılarının genişletilebilmesi için organoidleri kript tomurcuklarını ayıracak kadar parçalamak önemlidir (Şekil 3B).
Dondurulduktan sonra organoidlerin başarılı bir şekilde geri kazanılması, büyük ölçüde donduruldukları duruma bağlıdır. Yüksek oranda çoğalan farklılaşmamış bir durumdaki organoidler en yüksek verimlilikle iyileşir. Bu nedenle, tomurcuklanmaları ve farklılaşmaları yerine küresel ve kistik olmalarını sağlamanızı öneririz. Bunu başarmak için, ortamdaki Wnt ligandı R-spondin miktarını artırarak ve çeşitli kültür sistemlerinde organoid oluşumunu ve hücre sağkalımını desteklediği gösterilen ortama nikotinamid dahil edilerek Wnt hiperaktive edilebilir30,31. Şekil 3A, çözülmeden sadece 2 gün sonra sağlıklı bir organoid kültürü göstermektedir. Çözdürme sırasında BSA'nın medyaya dahil edilmesi, fare bağırsak organoidlerinden daha hassas olduğu kanıtlanmış olan sıçan bağırsak organoid kültürlerinin hayatta kalmasına da yardımcı olmuştur.
3D organoid kültür, normal bağırsak mimarisinin bir kısmını özetlediği için sıklıkla tercih edilirken, canlı görüntüleme, transfeksiyonlar ve lentiviral transdüksiyonlar dahil olmak üzere diğer yaklaşımları teknik olarak daha zor hale getirir. 3D organoidlerden(Şekil 4) üretilen 2D tek katmanların kullanılması, plazmitlerin daha yüksek verimlilikle kullanılmasına izin verir. 3D bağırsak organoidleri geleneksel olarak geçici transfeksiyonlara dirençli olsa da, EGFP'yi kodlayan plazmitler, lipid bazlı transfeksiyon yöntemleri kullanılarak başarılı bir şekilde tanıtılabilir. PEI kullanan en uygun maliyetli yaklaşım adım 6.1'de özetlenmiştir (Şekil 5), ancak elektroporasyon ve ticari olarak temin edilebilen transfeksiyon reaktifleri de karşılaştırılabilir sonuçlar vermiştir (veriler gösterilmemiştir). Gelecekteki çalışmalar, bu yaklaşımların CRISPR yapılarını tek katmanlara sokmak için kullanılıp kullanılamayacağına odaklanacaktır.
Transfeksiyondan sonra 2D tek katmanlardan 3D organoidleri yeniden düzenleyebilmek önemliydi, böylece kriptlerin 3D mimari bileşenleri ile geçilebilir bir hat olarak korunabilirlerdi. İlginç bir şekilde, EME üzerine kaplanmış 2D tek tabakalar, EME hücrelerin tepesine geri eklendiğinde kolayca küçük sferoidlere dönüşürken, bir kollajen I substratı 3D yapıların yeniden oluşumu için yeterli değildi (Şekil 6).
Geçici transfeksiyonlar birçok çalışma için yararlı olsa da, kararlı çizgilerin oluşumu genellikle daha faydalıdır ve lentivirüsün hücrelere girmesini gerektirir. Sıçan bağırsak organoidleri, daha önce yayınlanmış protokoller değiştirilerek lentivirüs ile enfekte edildi (Şekil 7). Protokoldeki önemli bir adım, organoidlerin küçük kümelere veya hücre kümelerine parçalanmasıdır. Kültürler verimli bir şekilde bozulmazsa ve organoidler bozulmadan kalırsa, lentiviral parçacıklar hücrelere girmeyecektir. Enfeksiyondan sonra organoidler iyileşmeli ve yeniden büyümelidir. Burada özetlenen protokol, seçimden önce hücrelerin %10-48'i (ortalama: %19.4 ± %6.5) oranında viral partiküllerin alınmasına izin verir.
Organoidlerin tüm montaj boyaması, EME kalıntısının tam olarak çıkarılmaması veya eksik antikor penetrasyonu nedeniyle zor olabilir. Burada özetlenen protokol, organoidlerin sağlam bir şekilde boyanmasına izin verir. Organoidlerin konfokal mikroskopta görselleştirilmesi, lamelden çok uzaktalarsa da zor olabilir. VALAP kullanılarak, organoidlerin lamel tarafından ezilmeyeceği, ancak görüntüleme kolaylığı için yine de lamel yakınına yerleşmesine izin verilecek şekilde belirli bir yüksekliğe sahip bir kuyu oluşturulur. F-aktini etiketlemek için apikal anyon kanalı, kistik fibrozis transmembran iletkenlik regülatörü (CFTR) ve falloidine karşı temsili boyama Şekil 8'de gösterilmektedir.
Son olarak, organoidlerin fonksiyonel tahlillerde faydası vardır. Kistik fibroz hastalarından hasta kaynaklı organoidler, CFTR fonksiyonunu taramak için kullanılmıştır, çünkü cAMP agonisti forskolin ile tedavi, güçlü CFTR aracılı sıvı sekresyonunu indükleyerek organoid şişmeye neden olur 29,33-37. Bu çalışmanın bir amacı, in vivo klinik öncesi çalışmalara paralel olarak kullanılabilecek bir organoid modeli tanımlamak ve geliştirmekti. Bu nedenle, sıçan bağırsak organoidlerinin forskolin ile indüklenen şişmeye maruz kalıp kalmadığını belirlemeyi amaçladık. Gerçekten de, forskolin tedavisinden sonraki 30 dakika içinde, sıçan organoidleri, 120 dakika boyunca gözlenen maksimum etki ile şişti (Şekil 9).
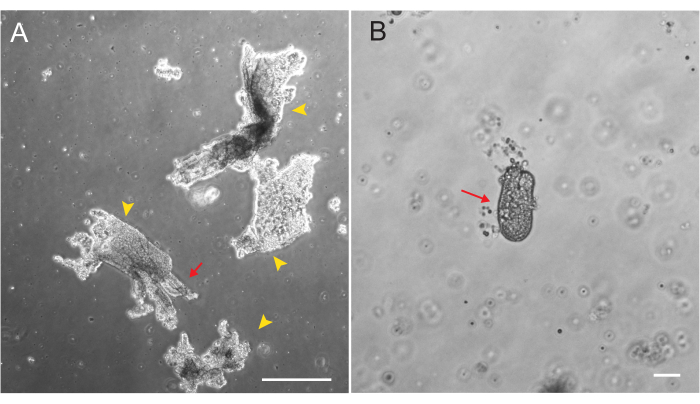
Şekil 1: Epitelyal izolasyon sırasında villar fragmanlar ve kriptler. (A) Kript izolasyon protokolü sırasında EDTA çözeltisindeki villar fragmanlarının temsili görüntüsü. Sarı ok uçları villar parçalarını işaretler. Kırmızı oklar, bir villar parçasına bağlı kriptleri gösterir. Göreli boyutlardaki farka dikkat edin. (B) Morfolojinin görselleştirilebilmesi için tek bir kriptin daha yüksek büyütmeli görüntüsü (kırmızı ok). Ölçek çubukları: 100 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
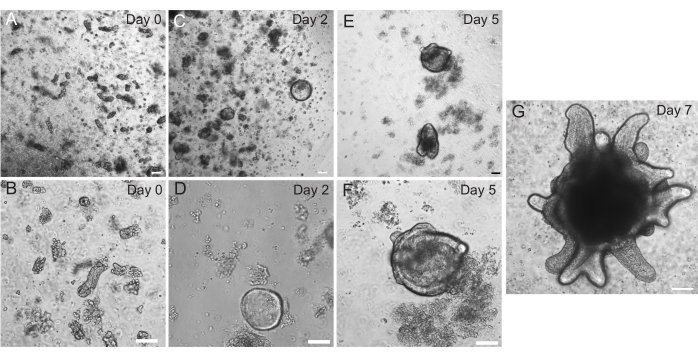
Şekil 2: Sıçan bağırsağı organoid ilerlemesi. Sıçan jejunum kriptleri izolasyondan hemen sonra EME'de kaplandı (A,B). 2 gün içinde kriptler sferoid (C,D) haline geldi. 5. Günde, 7. Günde (G) detaylanan ve büyüyen kript tomurcuklarını (E,F) başlatmaya başladılar. Ölçek çubukları: 100 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
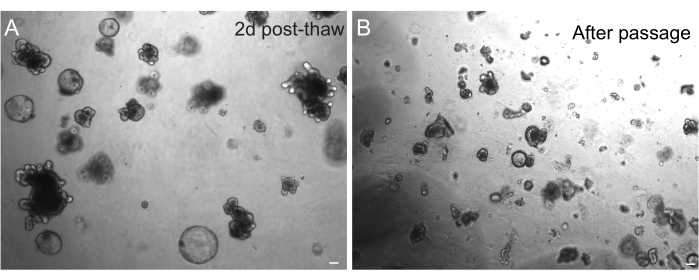
Şekil 3: Çözülme ve pasajdan sonra organoidler. (A) Sıçan jejunal organoidleri, kriyoprezervasyondan sonra belirtilen protokoller izlenerek çözüldü. Çözülmeden sadece 2 gün sonra hem sferoidlerin hem de tomurcuklanmış organoidlerin varlığına dikkat edin. (B) Belirtilen protokolü takiben geçtikten hemen sonra A'da gösterilen aynı organoid çizgi. A ve B'deki yapılar arasındaki göreli boyut farkına ve B'deki tek kript benzeri alanların varlığına dikkat edin. Ölçek çubukları: 100 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
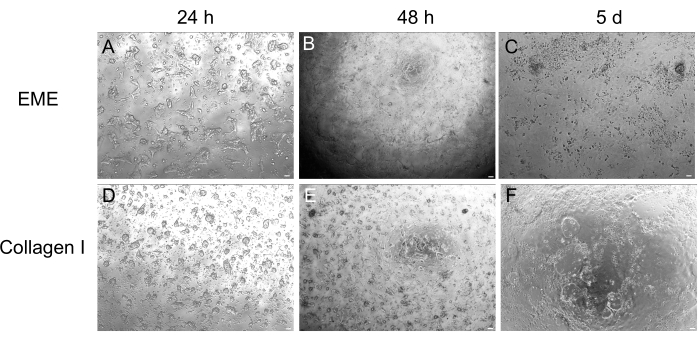
Şekil 4: 3D organoidlerden 2D tek tabaka oluşumu. (A-C) EME'de 2D tek tabakalı ilerleme. (D-F) Kollajen I üzerinde 2 boyutlu tek tabakalı ilerleme. 5. günde, her koşul ~% 80 izdiham verdi. Ölçek çubukları: 100 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
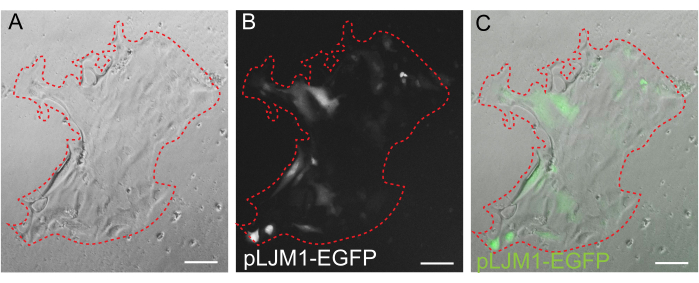
Şekil 5: 2D tek katmanın geçici transfeksiyonu. PEI kullanılarak pLJM1-EGFP plazmidi ile geçici olarak transfekte edilen EME üzerinde büyütülen bir 2D tek tabakanın temsili görüntüsü. (A) Parlak alan, (B) floresan (GFP), (C) kaplama. Noktalı kırmızı çizgi, tek katmanlı sınırı işaretler. Ölçek çubukları: 100 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
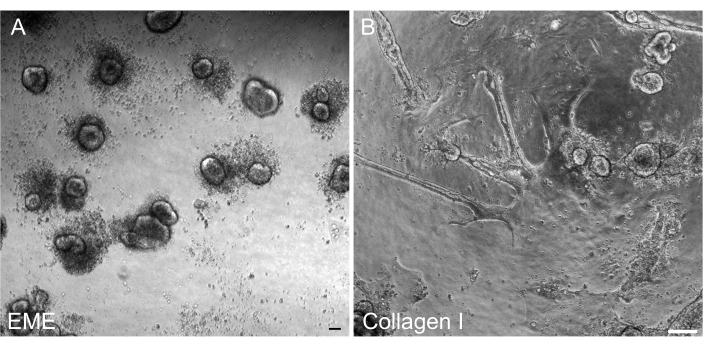
Şekil 6: EME'de 2D tek tabakalardan 3D organoidlerin reformu. (A) EME üzerinde yetiştirilen 2D tek tabakalardan 3D organoidlerin oluşumu. Organoidler, tek tabakanın apikal yüzeyine EME eklendikten 5 gün sonra verimli bir şekilde oluşur. Küçük 3D sferoidleri çevreleyen ölü hücrelerin bolluğuna dikkat edin. (B) Kollajen I'den 5 gün sonra 2D tek tabakaların kalıcılığı, kollajen I üzerinde büyütülen 2D tek tabakaların apikal yüzeyine eklendi. Ölçek çubukları: 100 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
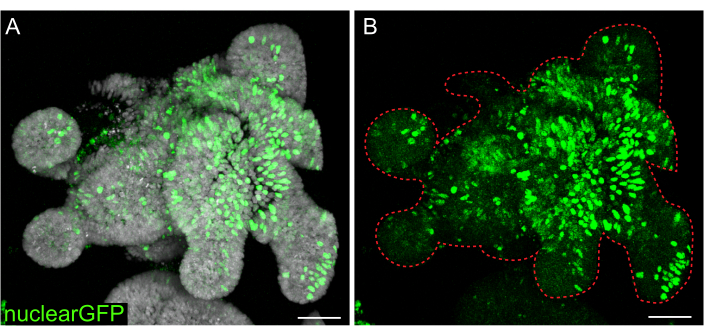
Şekil 7: 3D organoidlerin lentiviral enfeksiyonu. Sıçan jejunum organoidleri, belirtilen protokol kullanılarak nükleer GFP lentiviral partikülleri ile enfekte edildi. 5 gün boyunca iyileşme ve büyümeden sonra, organoidler sabitlendi ve DAPI ile boyandı. (A) DAPI: gri; nükleerGFP: yeşil. (B) nükleerGFP: yeşil. Noktalı kırmızı çizgi organoid sınırı işaretler. Ölçek çubukları: 50 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
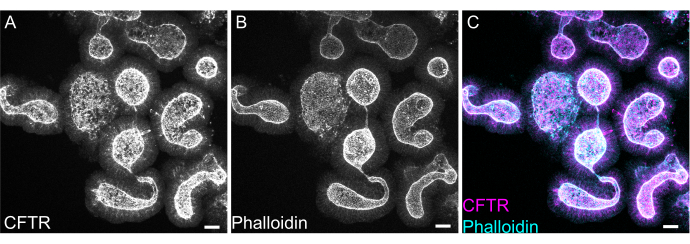
Şekil 8: Sıçan bağırsak organoidlerinin tam montaj immünofloresansı. (A) CFTR, (B) falloidin ve (C) sıçan jejunal organoidlerinin tüm mount immünofloresansını birleştirdi. Organoidlerde CFTR boyamanın apikal zenginleşmesine dikkat edin (A'da gri, C'de macenta). Phalloidin, F-aktini işaretler ve apikal fırça sınırını belirgin bir şekilde işaretler (B'de gri, C'de camgöbeği). Ölçek çubukları: 25 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
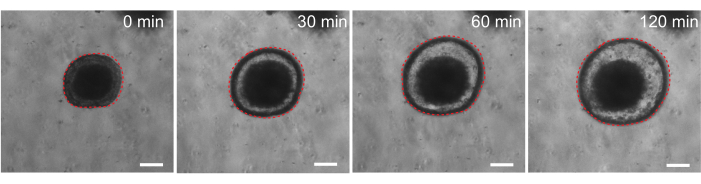
Şekil 9: Sıçan bağırsak organoidleri forskolin stimülasyonu üzerine şişer. cAMP agonisti forskolin ilavesinden sonra sıçan bağırsak organoid şişmesinin temsili zaman seyri. 0 dakikalık süre, 10 μM forskolin ilavesinden hemen önceki zaman noktasını temsil eder. Görüntüler aynı organoidi 30 dakikalık zaman aralıklarında göstermektedir. Forskolin ilavesinden 120 dakika sonra maksimal şişlik gözlendi. Noktalı kırmızı çizgi, organoid sınırın ana hatlarını çizer. Organoid lümenin ortasındaki koyu renkli madde ölü hücrelerden oluşur. Ölçek çubukları: 100 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tablo 1: AdDMEM+ tarifi. Burada gösterilen yöntemler boyunca temel ortam olan standart AdDMEM+ ortamını yapmak için malzemeler. Bu Tabloyu indirmek için lütfen buraya tıklayın.
Tablo 2: Sıçan bağırsak organoid ortamı (rIOM) tarifi. Rekombinant proteinler için çözücü ve saklama koşulları dahil olmak üzere standart sıçan bağırsak organoid ortamının ayrıntılı tarifi. Bu Tabloyu indirmek için lütfen buraya tıklayın.
Tablo 3: Çözümler. Protokol boyunca kullanılan diğer çözümleri yapmak için tarifler ve talimatlar. Bu Tabloyu indirmek için lütfen buraya tıklayın.
Tablo 4. 2D tek katmanlı kültür (rIOM2D) için sıçan bağırsak organoid ortamı. Tek tabakaların 2D büyümesi için optimize edilmiş organoid kültür ortamının değiştirilmiş tarifi. Bu Tabloyu indirmek için lütfen buraya tıklayın.
Tartışmalar
Bir sıçan bağırsak organoid modelinin geliştirilmesi, in vivo organda bulunan önemli fonksiyonel özellikleri korur ve klinik öncesi testler, ilaç taraması ve fonksiyonel tahliller için umut verici bir araçtır. Bu in vitro model, daha büyük bağırsak boyutları, insanlarla paylaşılan fizyolojik yönleri ve bazı durumlarda daha iyi hastalık modelleri olmaları nedeniyle sıçanların sıklıkla tercih edilen bir model olduğu in vivo klinik öncesi gastroenteroloji çalışmalarına paralel olarak kullanılabilir38. Burada, sıçan bağırsak kriptlerinin izolasyonu, sıçan bağırsak organoidlerinin üretimi ve uzun süreli kültürünün yanı sıra fonksiyonel forskolin şişme deneyleri, tüm montaj immünofloresansı, 2D tek tabakalı kültür ve lentiviral genetik manipülasyon dahil olmak üzere aşağı akış uygulamaları için sağlam bir adım adım protokol özetlenmiştir. Sıçan bağırsak organoidlerinin, fare modellerinin patofizyolojisinin uygun olmadığı birçok hastalık bağlamında ilgili olması muhtemeldir ve fare bağırsak organoidlerine kıyasla insan bağırsak fizyolojisi için daha iyi bir model sağlayabilir.
Geçilebilen ve genişletilebilen uzun ömürlü organoid kültürler oluşturmak için, bağırsak epitelyal proliferasyonunu sürdürmek için gerekli olan temel büyüme faktörlerini belirlemek esastır. Fare organoidleri çoğunlukla EGF, R-spondin ve Noggin'in basit bir kokteylinde yetiştirilir, ancak Noggin'in bağırsak organoid kültürü için gerekli olmadığı bildirilmiştir39. Şartlandırılmış ortam, rekombinant büyüme faktörlerinin yerini alabilir ve en yaygın kullanılan hücre hatları, Wnt3a, Rspondin-3 ve Noggin39, L-Wnt3a ve HA-Rspondin1-Fc 293T hücrelerini40 salgılayan L-WRN'dir. L-WRN koşullu ortam, yalnızca fare bağırsağı39 organoid büyümesini değil, aynı zamanda köpekler, kediler, tavuklar, atlar, inekler, koyunlar ve domuzlar dahil olmak üzere çeşitli çiftlik hayvanlarından ve refakatçi hayvanlardan bağırsak organoidlerinin büyümesini desteklemek için yeterlidir12. Bununla birlikte, insan bağırsak organoidleri, genişleme büyüme fazları (yani, küçükten büyük sferoidlere ilerleme) ve farklılaşma fazları (yani, farklılaşmış hücre tiplerinin üretimi ve olgunlaşması) için farklı ortam formülasyonları gerektirdiğinden, büyüme faktörü gereksinimlerinde çok farklıdır10. Sıçan bağırsak organoidlerinin ortam gereksinimleri, insan bağırsak organoidleri için genişleme büyüme ortamınınkileri yakından yansıtır, ancak özellikle sıçan organoidleri, bu ortam ortamında hem büyüme hem de farklılaşma yeteneğine sahiptir ve kültür gereksinimlerini önemli ölçüde basitleştirir. İlk girişimlerimiz L-WRN ile koşullandırılmış ortamda sıçan bağırsak organoidlerinin kurulmasına ve büyütülmesine odaklanırken, uzun süreli kültür zayıftı ve sıçan bağırsak organoid hatları sağlamlık eksikliğinden muzdaripti (veriler gösterilmemiştir). Bunun nedeni, L-WRN hücre hatlarının R-spondin 3'ü salgılamak üzere tasarlanmış olması, burada önerilen 293T-Rspo1 hücre hattının ise R-spondin 1'i salgılamak üzere tasarlanmış olması olabilir. Sıçan ve insan organoidlerinin R-spondin 1'i tercih etmesi mümkündür, bu da potansiyel olarak L-WRN şartlandırılmış ortamdaki sıçan organoid hatlarının başarısızlığını açıklar.
İn vivo ortamı en yakından özetlemek gerekirse, kök hücrenin hayatta kalmasına, sürdürülmesine ve çoğalmasına izin veren ve hücresel döngüyü ve eşzamanlı farklılaşma olaylarını ayrı hücre tiplerine koruyabilen organoid kültür koşullarının geliştirilmesi önemlidir. Bu nedenle, şartlandırılmış ortamdaki rekombinant proteinlerin ve/veya proteinlerin konsantrasyonlarının, bu mükemmel dengeyi sağlamak için sıkı bir şekilde titre edilmesi ve kontrol edilmesi gerekir. Özellikle, bağırsak organoid kültürlerinin kaybını önlemek için optimal Wnt seviyeleri gereklidir. Şartlandırılmış ortamda çok az Wnt, büyümeyi destekleyemeyecek, kök hücre kaybına ve ardından organoid ölüme yol açacaktır; Wnt'nin aşırı aktivasyonu, organoidlerin kistik ve farklılaşmamış olmasına neden olur10. Burada ayrıntılı olarak açıklanmamakla birlikte, her bir L-Wnt3a ve 293T-Rspo1 koşullu ortam partisinin, bir Topflash hücre hattı41 gibi bir Wnt muhabir lusiferaz testi kullanılarak test edilmesi şiddetle tavsiye edilir. Önceki çalışmalar, optimal bir L-Wnt3a ortamı partisinin, %1 L-Wnt3a 10'a kıyasla, %12,5'te15 kat sinyal artışı ve %50'de 300 kat sinyal artışı ile sonuçlanması gerektiğini açıklamıştır. Sıçan organoidleri, kültür gereksinimlerine, özellikle Wnt aktivasyon seviyelerine fare organoidlerinden daha duyarlı olduğundan, bu ek kalite kontrol adımları, sıçan organoid kültürlerinin sağlamlığını ve güvenilirliğini kolaylaştırmaya büyük ölçüde yardımcı olur. Noggin şartlandırılmış ortamda Bmp aktivitesini ve nispi Noggin konsantrasyonlarını test etmek için benzer bir raportör hattı mevcut olmadığından, Noggin seviyelerini hassas bir şekilde kontrol etmek için mümkün olduğunda rekombinant Noggin kullanılması tavsiye edilir. Fare bağırsak organoidleri Noggin39'un yokluğunda büyütülebilir ve korunabilirken, sıçan bağırsak organoid kültürleri için bu denenmemiştir.
Hücre kültürü gereksinimlerinin ötesinde, bir sıçan organoid hattının başarılı bir şekilde kurulması, kript izolasyonu sırasında farklılaşmış villusların verimli bir şekilde tükenmesine kritik olarak bağlıdır. Yüksek düzeyde villar kontaminasyon, muhtemelen ölmekte olan hücrelerden gelen sinyaller veya temel faktörlerin sekestrasyonu nedeniyle kript ölümüne neden olur. Bu farklılaşmış villusları epitelyal preparatlardan kesin ve tutarlı bir şekilde tüketmek için, bir stereoskop yardımıyla epitel izolasyonlarının yapılması önerilir. Serbest bırakılan epitelin görsel muayenesi, PBS'nin ne zaman atılacağı ve değiştirileceği konusunda net bir ipucu sağlar (Şekil 1). Yeterli villus tükeninceye kadar kriptler toplanmamalıdır. Villar hücreler terminal olarak farklılaşır ve kültürde organoid üretemezler. Ek olarak, sıçan bağırsak organoidlerinin daha sonra geçirilmesi ve bunların herhangi bir aşağı akış uygulaması için kullanılması hassas bakım gerektirir. Ayrışma reaktiflerinde daha uzun süre (10 dakika) inkübasyon, önemli hücre ölümüne ve organoid hattının kaybına neden olur.
Burada, sıçan organoidlerinden bağırsak tek katmanları oluşturmak için basit ve hızlı bir protokol açıklanmaktadır. EME ve kollajen I substratlarının epitel üzerinde farklı etkileri vardır ve bu etkilerden çalışmanın amacına bağlı olarak yararlanılabilir. EME, tek hücrelerin hızlı ve verimli bir şekilde yapışmasına ve hücre projeksiyonlarının oluşumuna izin verir. Buna karşılık, yüzeyin kollajen I ile kaplanması bu işlemleri geciktirir. Tek tabakalar yaklaşık% 80 birleşmeye ulaştığında, EME'de büyüyen hücreler tekrar 3D organoid yapılar üretmeye başlar. Bununla birlikte, sürekli büyüme için yeterli fiziksel ve kimyasal destekten yoksundurlar. Organoid duruma geri dönüş, EME'deki tek katmanları %50-80'lik bir birleşmede tutarak önlenebilir. Tek tabakaların apikal yüzeyine seyreltilmiş EME ilavesi, de novo organoidlerin hızlı bir şekilde geri kazanılmasını ve oluşumunu teşvik ederek daha hızlı ve kolay bir şekilde yakınsama bölgeleri oluşturur. Bir kollajen I yüzeyinde, hücreler tek tip bir tek tabaka oluşturabilir ve küçük kümeler oluşturabilir. Bununla birlikte, tek tabakaların üzerine kollajen I ilavesi, organoid oluşumunu indüklemek için yeterli değildir. Yeni ortaya çıkan organoidin üstesinden gelmesi için daha güçlü bir mekanik direnç olacağından, tek katmanlı yüzeye eklenirken EME seyreltilmelidir. Bununla birlikte, bu seyreltilmiş EME, büyük organoidlerin sağlam oluşumuna izin vermez. Yüzeyden doğal olarak ayrılan herhangi bir de novo tarafından üretilen sıçan organoidleri derhal çıkarılmalı ve seyreltilmemiş EME'ye aktarılmalıdır, böylece yapısal destek ve büyüme geri yüklenebilir. Bu adımdaki organoidlerin küçük boyutu nedeniyle, sağlam bir büyüme sağlanana kadar organoidlerin geçişi önerilmez. EME'nin neden organoidlerin reformasyonunu destekleyebildiğinin altında yatan biyolojik önem, ancak kollajen I'in bunu yapıp yapamayacağı açık değildir. Bununla birlikte, 3D kollajende yetiştirilen hücrelerin tomurcuklanmış organoidler42,43 oluşturamayacağına veya uzun süreli bakımı destekleyemediğine dair raporlar vardır. Ticari olarak temin edilebilen EME ürünleri, başta laminin ve kollajen IV44 olmak üzere hücre dışı proteinlerin heterojen karışımlarıdır. Bu nedenle, proteinlerin farklı bileşimi ve bir epitel hücresinin farklı hücresel kompleksler kullanarak hücre dışı matris ile etkileşime girme yeteneği, EME'de yeniden şekillenmeye izin verebilir, ancak kollajen I'de değil. Kollajen I'den türetilen tek katmanların organoid oluşumunu ve büyümesini desteklemek için EME'ye konulup konulamayacağı test edilmemiştir.
Sıçan bağırsak organoid modelinin genetik manipülasyonu burada açıklanmıştır ve 3D organoidlerin lentiviral transdüksiyonu ve 2D tek tabakaların geçici transfeksiyonu için protokoller özetlenmiştir. Lentiviral organoid transdüksiyonun düşük verimliliğinin üstesinden gelmek için, 2D tek tabakaların geçici transfeksiyonu için bir protokol geliştirilmiştir. Tek katmanların düz morfolojisi ve açıkta kalan apikal alanları, virüslere ve DNA içeren komplekslere daha kolay erişim sağlar. Bu tekniğin doğrulanması için pLJM1-EGFP vektörünü kullanan bir EGFP raportörünün ifadesi kullanıldı. GFP raportör ekspresyonu 24 saat sonra gözlendi ve tek tabakalarda 5-6 gün boyunca korundu. Tek tabakaların lentiviral transdüksiyonuna odaklanan gelecekteki çalışmaların, 3D organoid transdüksiyonundan daha yüksek verimliliğe sahip olması muhtemeldir. Yukarıdaki protokolleri kullanarak, kararlı çizgilerin oluşturulmasını kolaylaştırmak için enfekte olmuş 2D tek katmanlardan 3D organoidler yeniden oluşturulabilir. Dikkatli bir şekilde, sıçan bağırsak organoidleri hatları bir yıldan fazla bir süre boyunca başarılı bir şekilde korunabilir, birçok pasajda stabil kalabilir, dondurularak saklanabilir, başarılı bir şekilde çözülebilir ve lentiviral transdüksiyon kullanılarak genetik olarak modifiye edilebilir, böylece erişilebilir ve izlenebilir bir in vitro bağırsak organoid modeline olan ihtiyacı ele alır.
Açıklamalar
Hiç kimse.
Teşekkürler
Sumigray ve Ameen laboratuvarlarının üyelerine düşünceli tartışmaları için teşekkür ederiz. Bu çalışma, Charles H. Hood Vakfı Çocuk Sağlığı Hibesi ve Kistik Fibrozis Vakfı hibesi (004741P222) tarafından KS'ye ve Ulusal Sağlık Enstitüleri Ulusal Diyabet ve Sindirim ve Böbrek Hastalıkları Enstitüsü tarafından 2R01DK077065-12 ödül numarası altında NA'ya desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 3-D Culture Matrix Rat Collagen I | Cultrex/R&D Systems | 3447-020-01 | |
| 70 µm cell strainer | Corning/Falcon | 352350 | |
| Advanced DMEM/F12 | Gibco/Thermo Fisher | 12634010 | |
| Amphotericin B | Sigma Aldrich | A2942-20ML | |
| B-27 Supplement (50X), serum free | Thermo Fisher | 17504044 | |
| CHIR99021 | Cayman Chemical | 13122 | |
| CryoStor | Stem Cell Technologies | 100-1061 | |
| Cultrex HA-Rspondin1-Fc 293T cells | R & D Systems | 3710-001-01 | |
| DAPI (4',6-Diamidino-2-Phenylindole, Dihydrochloride) | Molecular Probes/Thermo Fisher | D1306 | |
| FBS | Gibco/Thermo Fisher | 16-000-044 | |
| Gastrin I (human) | Sigma Aldrich | G9145 | |
| Gentle Cell Dissociation Reagent | Stem Cell Technologies | 100-0485 | |
| Glutamax | Thermo Fisher | 35-050-061 | |
| Growth factor-reduced Matrigel, phenol red-free | Corning | 356231 | |
| HEPES | AmericanBio | AB06021 | |
| Lanolin | Beantown Chemical | 144255-250G | |
| L-glutamine | Gibco/Thermo Fisher | A2916801 | |
| L-Wnt3a cells | ATCC | CRL-2647 | |
| N-2 Supplement (100X) | Thermo Fisher | 17502-048 | |
| N-acetylcysteine | Sigma Aldrich | A9165-5G | |
| Nicotinamide | Sigma Aldrich | N0636 | |
| Opti-MEM I Reduced Serum Medium | Gibco/Thermo Fisher | 31985070 | |
| Paraffin | Fisher Scientific | P31-500 | |
| Parafilm | Sigma Aldrich | P7793 | transparent film |
| PBS | Thermo Fisher | 10010023 | |
| Penicillin/Streptomycin | Gibco/Thermo Fisher | 15140122 | |
| pLJM1-EGFP | Addgene | 19319 | |
| Polybrene | Millipore | TR-1003-G | |
| Polyethylenimine hydrochloride (PEI) | Sigma Aldrich | 764965 | |
| p-phenylenediamine | Acros Organics/Thermo Fisher | 417481000 | |
| Puromycin | VWR | J593-25mg | |
| Recombinant human FGF2 protein | Peprotech | 100-18B-250ug | |
| Recombinant human IGF-1 protein | Biolegend | B356441 | |
| Recombinant human Noggin protein | R & D Systems | 6057-NG-100 | |
| Recombinant mouse EGF protein | Thermo Fisher | PMG8041 | |
| Sprague Dawley rat | Charles River Laboratories | Strain 001 | |
| Triton X-100 | American Bioanalytical | AB02025-00500 | |
| TrypLE Express Enzyme | Gibco/Thermo Fisher | 12604013 | |
| Y27632 dihydrochloride | Sigma Aldrich | Y0503 |
Referanslar
- Beumer, J., Clevers, H. Cell fate specification and differentiation in the adult mammalian intestine. Nature Reviews. Molecular Cell BiologyI. 22 (1), 39-53 (2021).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-265 (2009).
- Yin, Y. -. B., de Jonge, H. R., Wu, X., Yin, Y. -. L. Enteroids for nutritional studies. Molecular Nutrition & Food Research. 63 (16), 1801143 (2019).
- Cai, T., et al. Effects of six common dietary nutrients on murine intestinal organoid growth. PLoS One. 13 (2), e0191517 (2018).
- Davoudi, Z., et al. Gut Organoid as a new platform to study alginate and chitosan mediated PLGA nanoparticles for drug delivery. Marine Drugs. 19 (5), 282 (2021).
- Vlachogiannis, G., et al. Patient-derived organoids model treatment response of metastatic gastrointestinal cancers. Science. 359 (6378), 920-926 (2018).
- Yin, Y. B., de Jonge, H. R., Wu, X., Yin, Y. L. Mini-gut: a promising model for drug development. Drug Discovery Today. 24 (9), 1784-1794 (2019).
- Zietek, T., et al. Organoids to study intestinal nutrient transport, drug uptake and metabolism - update to the human model and expansion of applications. Frontiers in Bioengineering and Biotechnology. 8, 577656 (2020).
- Gunther, C., Winner, B., Neurath, M. F., Stappenbeck, T. S. Organoids in gastrointestinal diseases: from experimental models to clinical translation. Gut. 71 (9), 1892-1908 (2022).
- Pleguezuelos-Manzano, C., et al. Establishment and culture of human intestinal organoids derived from adult stem cells. Current Protocols in Immunology. 130 (1), 106 (2020).
- Zhao, Z., et al. Organoids. Nature Reviews Methods Primers. 2 (1), 94 (2022).
- Powell, R. H., Behnke, M. S. WRN conditioned media is sufficient for in vitro propagation of intestinal organoids from large farm and small companion animals. Biology Open. 6 (5), 698-705 (2017).
- Fagerholm, U., Johansson, M., Lennernas, H. Comparison between permeability coefficients in rat and human jejunum. Pharmaceutical Research. 13 (9), 1336-1342 (1996).
- Dubbelboer, I. R., Dahlgren, D., Sjogren, E., Lennernas, H. Rat intestinal drug permeability: A status report and summary of repeated determinations. European Journal of Pharmaceutics and Biopharmaceutics. 142, 364-376 (2019).
- Bryda, E. C. The Mighty Mouse: the impact of rodents on advances in biomedical research. Missouri Medicine. 110 (3), 207-211 (2013).
- Zhang, Z., Carriero, N., Gerstein, M. Comparative analysis of processed pseudogenes in the mouse and human genomes. Trends in Genetics. 20 (2), 62-67 (2004).
- Lambracht-Washington, D., Fischer Lindahl, K. Active MHC class Ib genes in rat are pseudogenes in the mouse. Immunogenetics. 56 (2), 118-121 (2004).
- Busslinger, G. A., et al. Human gastrointestinal epithelia of the esophagus, stomach, and duodenum resolved at single-cell resolution. Cell Reports. 34 (10), 108819 (2021).
- Burclaff, J., et al. A proximal-to-distal survey of healthy adult human small intestine and colon epithelium by single-cell transcriptomics. Cellular and Molecular Gastroenterology and Hepatology. 13 (5), 1554-1589 (2022).
- Haber, A. L., et al. A single-cell survey of the small intestinal epithelium. Nature. 551 (7680), 333-339 (2017).
- Olivier, A. K., Gibson-Corley, K. N., Meyerholz, D. K. Animal models of gastrointestinal and liver diseases. Animal models of cystic fibrosis: gastrointestinal, pancreatic, and hepatobiliary disease and pathophysiology. American Journal of Physiology. Gastrointestinal and Liver Physiology. 308 (6), G459-G471 (2015).
- Lu, P., et al. Animal models of gastrointestinal and liver diseases. Animal models of necrotizing enterocolitis: pathophysiology, translational relevance, and challenges. American Journal of Physiology. Gastrointestinal and Liver Physiology. 306 (11), G917-G928 (2014).
- Fujii, M., et al. Human intestinal organoids maintain self-renewal capacity and cellular diversity in niche-inspired culture condition. Cell Stem Cell. 23 (6), 787-793 (2018).
- Hedrich, W. D., et al. Development and characterization of rat duodenal organoids for ADME and toxicology applications. Toxicology. 446, 152614 (2020).
- How to Cryopreserve Intestinal Organoids. STEMCELL Available from: https://www.stemcell.com/technical-resources/area-of-interest/organoid-research/intestinal-research/tech-tips-protocols/how-to-cryopreserve-intestinal-organoids.html (2023)
- How to Thaw Intestinal Organoids. STEMCELL Available from: https://www.stemcell.com/technical-resources/educational-materials/protocols/how-to-thaw-intestinal-organoids.html (2023)
- Sancak, Y., et al. The Rag GTPases bind raptor and mediate amino acid signaling to mTORC1. Science. 320 (5882), 1496-1501 (2008).
- Van Lidth de Jeude, J. F., Vermeulen, J. L., Montenegro-Miranda, P. S., Vanden Brink, G. R., Heijmans, J. A protocol for lentiviral transduction and downstream analysis of intestinal organoids. Journal of Visualized Experiments. (98), e52531 (2015).
- Boj, S. F., et al. Forskolin-induced swelling in intestinal organoids: an in vitro assay for assessing drug response in cystic fibrosis patients. Journal of Visualized Experiments. (120), e55159 (2017).
- Regent, F., et al. Nicotinamide promotes formation of retinal organoids from human pluripotent stem cells via enhanced neural cell fate commitment. Frontiers in Cellular Neuroscience. 16, 878351 (2022).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett's epithelium. Gastroenterology. 141 (5), 1762-1772 (2011).
- Breau, K. A., et al. Efficient transgenesis and homology-directed gene targeting in monolayers of primary human small intestinal and colonic epithelial stem cells. Stem Cell Reports. 17 (6), 1493-1506 (2022).
- Berkers, G., et al. Rectal organoids enable personalized treatment of cystic fibrosis. Cell Reports. 26 (7), 1701-1708 (2019).
- deWinter-de Groot, K. M., et al. Forskolin-induced swelling of intestinal organoids correlates with disease severity in adults with cystic fibrosis and homozygous F508del mutations. Journal of Cystic Fibrosis. 19 (4), 614-619 (2020).
- Dekkers, J. F., vander Ent, C. K., Beekman, J. M. Novel opportunities for CFTR-targeting drug development using organoids. Rare Diseases. 1, 27112 (2013).
- Dekkers, J. F., et al. A functional CFTR assay using primary cystic fibrosis intestinal organoids. Nature Medicine. 19 (7), 939-945 (2013).
- van Mourik, P., Beekman, J. M., vander Ent, C. K. Intestinal organoids to model cystic fibrosis. European Respiratory Journal. 54 (1), 1802379 (2019).
- Tong, T., et al. Transport of artificial virus-like nanocarriers through intestinal monolayers via microfold cells. Nanoscale. 12 (30), 16339-16347 (2020).
- Miyoshi, H., Stappenbeck, T. S. In vitro expansion and genetic modification of gastrointestinal stem cells in spheroid culture. Nature Protocols. 8 (12), 2471-2482 (2013).
- Ootani, A., et al. Sustained in vitro intestinal epithelial culture within a Wnt-dependent stem cell niche. Nature Medicine. 15 (6), 701-706 (2009).
- Xu, Q., et al. Vascular development in the retina and inner ear: control by Norrin and Frizzled-4, a high-affinity ligand-receptor pair. Cell. 116 (6), 883-895 (2004).
- Jabaji, Z., et al. Type I collagen as an extracellular matrix for the in vitro growth of human small intestinal epithelium. PLoS One. 9 (9), e107814 (2014).
- Sachs, N., Tsukamoto, Y., Kujala, P., Peters, P. J., Clevers, H. Intestinal epithelial organoids fuse to form self-organizing tubes in floating collagen gels. Development. 144 (6), 1107-1112 (2017).
- Aisenbrey, E. A., Murphy, W. L. Synthetic alternatives to Matrigel. Nature Reviews Materials. 5 (7), 539-551 (2020).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır