Bir Parkinson Hastalığı Modelinde Mitokondriyal Morfolojinin Histolojik İncelemesi
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Bu çalışma, fare beyin dokusunda immün boyama ve görüntü analizine dayalı olarak mitokondri morfolojisini analiz etmek için bir yöntem sunmaktadır. Ayrıca, bunun Parkinson hastalığı modellerinde protein agregasyonunun neden olduğu mitokondriyal morfolojideki değişiklikleri nasıl tespit etmesine izin verdiğini de açıklar.
Özet
Mitokondri, hücrelerin enerji metabolizmasında merkezi bir rol oynar ve işlevleri, yüksek enerji talepleri nedeniyle nöronlar için özellikle önemlidir. Bu nedenle, mitokondriyal disfonksiyon, Parkinson hastalığı da dahil olmak üzere çeşitli nörolojik bozuklukların patolojik bir özelliğidir. Mitokondriyal ağın şekli ve organizasyonu oldukça plastiktir, bu da hücrenin çevresel ipuçlarına ve ihtiyaçlara cevap vermesini sağlar ve mitokondrinin yapısı da sağlıklarıyla sıkı sıkıya bağlantılıdır. Burada, mitokondriyal protein VDAC1'in immün boyanmasına ve ardından görüntü analizine dayalı olarak mitokondriyal morfolojiyi yerinde incelemek için bir protokol sunuyoruz. Bu araç, nörodejeneratif bozuklukların incelenmesi için özellikle yararlı olabilir, çünkü mitokondriyal sayımlardaki ince farklılıkları ve Parkinson hastalığının patolojisinde yoğun olarak yer alan agregasyona eğilimli bir protein olan α-sinüklein agregatlarının neden olduğu şekli tespit edebilir. Bu yöntem, pS129 lezyonlarını barındıran substantia nigra pars compacta dopaminerjik nöronların, önceden oluşturulmuş bir fibril intrakraniyal enjeksiyon Parkinson modelinde sağlıklı komşu nöronlarına kıyasla mitokondriyal parçalanma (azaltılmış En Boy Oranları, AR tarafından önerildiği gibi) gösterdiğini bildirmeye izin verir.
Giriş
Merkezi sinir sistemi ATP için yoğun bir talebe sahiptir: nöronlar, iyonik gradyanları, nörotransmitter sentezini, sinaptik vezikül mobilizasyonunu, salınımını ve geri dönüşümünü desteklemek ve yerel protein translasyonunu ve bozulmasını sağlamak için ATP'yi kullanır. Beyin tarafından kullanılan ATP'nin %95'inden fazlası mitokondritarafından üretilir 1. Bu nedenle, mitokondriyal disfonksiyonun nöronlar için özellikle zararlı olması şaşırtıcı değildir. Aslında, mitokondriyal fonksiyon bozuklukları, Parkinson Hastalığı (PD) ve Alzheimer Hastalığı (AD) gibi nörodejeneratif durumlar da dahil olmak üzere çeşitli nörolojik hastalıklarda önemli bir rol oynamaktadır2,3.
Çoklu genler, Parkin 4,5,6, PTEN kaynaklı kinaz 1 (PINK1)7,8 ve DJ-19 gibi mitokondriyal fonksiyon ve homeostaz ile ilgili PD kodlayan proteinlerle kesin olarak bağlantılıdır. PH'de mitokondriyal disfonksiyonun rolüne dair daha fazla kanıt, mitokondriyal elektron taşıma zincirinin Kompleks I inhibitörleri (Rotenon ve MPTP gibi) ile yapılan tedavilerin PD'nin çeşitli yönlerini in vitro ve in vivo10'un çeşitli yönlerini özetlemesidir. Bununla birlikte, birçok patolojik sürecin mitokondriyal eksikliklerle birlikte PH'de nöronal kayba neden olabileceğini belirtmek önemlidir: oksidatif stres, değişmiş kalsiyum homeostazı, ubikitin-proteazom ve otofaji-lizozomal sistemlerin başarısızlığı ve protein agregasyonu en çok çalışılanlar arasındadır (11,12,13 ve).
Mitokondri şekil olarak heterojendir: bireysel birimlere ek olarak, genellikle genişletilmiş retiküler ve tübüler ağlar olarak bulunurlar. Mitokondrinin yapısı ve hücresel konumu, işlevleri için kritik öneme sahiptir14; Aslında, mitokondriyal ağlar son derece dinamiktir, hücrelerin ihtiyaçlarını karşılamak ve çevresel ipuçlarına cevap vermek için sık sık fisyon, füzyon ve mitofaji süreçlerinden geçer15,16. Ek olarak, mitokondrinin morfolojisi sağlık durumlarıyla yakından bağlantılıdır. Örneğin, insan optik atrofisinde, mitokondriyal aktiviteyi azaltan genetik mutasyonlar anormal, ince ve hiperfüzyon mitokondriyeyol açar 17. Öte yandan, çeşitli insan hastalıkları, mitokondriyal fonksiyon üzerinde zararlı etkileri olan mitokondriyal parçalanma veya aşırı mitokondriyal füzyon dahil olmak üzere anormal mitokondriyal morfoloji sunar (18'de gözden geçirilmiştir). PH bağlamında, biz ve diğerleri daha önce anormal mitokondriyal şeklin α-sinüklein agregatlarına yanıt olarak işlev bozukluğu ile ilişkili olduğunu gösterdik19. Mitokondriyal morfoloji, hem PD hem de diğer hastalıklar bağlamında in vitro olarak kapsamlı bir şekilde çalışılmış olsa da20,21,22, in vivo kesitlerden mitokondriyal morfolojinin değerlendirilmesi için protokoller eksiktir. Bu, PD gibi hastalıklar bağlamında mitokondrinin in vivo çalışmasını transgenik hayvanlara23 veya hücresel çözünürlük sağlayamayan orta beyin ekstraktlarının değerlendirilmesine büyük ölçüde bağımlı hale getirir.
Burada, mitokondriyal protein VDAC124'ün immün boyanmasına ve ardından parafine gömülü doku kesitlerinde görüntü analizine dayalı olarak, fonksiyonel durumlarının ve sağlıklarının bir göstergesi olarak mitokondriyal morfolojiyi yerinde incelemek için bir protokol sunulmaktadır. Bu protokolün sonuçlarını in vitro ve in vivo PD modellerinde de gösteriyoruz: SNCA'yı (Sinüklein Alfa) aşırı eksprese eden nöroblastom hücreleri ve α-sinüklein Önceden Oluşturulmuş Fibrillerin (PFF'ler) intrakraniyal enjeksiyonuna maruz kalan farelerden alınan beyin dokusu. α-sinüklein (hücrelerde) veya fosfoSer129-α-sinüklein pS129'a (fare beyinlerinde) karşı bir antikorla birlikte immün boyama, agrega protein patolojisine sahip hücreleri tanımlamamıza izin verdi (sırasıyla aşırı eksprese edilmiş α-sinüklein ve α-sinüklein fibrilleri) örneklerde, negatif hücreler aynı örneklerde patolojik olmayan bir kontrol görevi görürken. Bu analiz ve burada açıklanan veriler sayesinde, SNCA'yı aşırı eksprese eden veya pS129 lezyonları sunan hücrelerde mitokondrinin parçalanmasını gösteren azaltılmış bir en-boy oranı gözlendi.
Protokol
Bu bölümde açıklanan tüm prosedürler, Bask Ülkesi Üniversitesi Referans M20/2022/212, Bask Ülkesi Hükümeti, İspanyol Hükümeti ve Avrupa Birliği tarafından sağlanan etik çerçeveye göre gerçekleştirilmiştir.
1. SNCA-aşırı eksprese eden SH-SY5Y hücrelerinde mitokondriyal morfoloji analizi
NOT: Burada, in situ elde edilen sonuçlar için bir karşılaştırma görevi görecek olan çalışma için in vitro materyalin üretiminin kısa bir açıklaması verilmiştir. Tüm uygun görüntüleme ve analiz kurulumlarının yerinde olmasını sağlayacağından, mitokondriyal morfoloji için in vivo bir deney başlatmadan önce bu tür bir analizin yapılması önerilir.
- Hücresel bağlanmayı artırmak ve düz optik tabanlı 96 oyuklu plakalarda hücresel yapışmayı kolaylaştırmak için, pipetleme yoluyla DMEM F12'ye 25 μL/oyuklu kaplama matrisi 1:1000 ekleyin (bkz. Plakaları 37 °C ve% 5 CO2'de 1 saat inkübe edin.
- Neubauer odasını kullanarak SH-SY5Y'yi sayın. Kaplama matrisini pipetleyerek çıkarın ve kaplanmış 96 oyuklu plaka üzerinde 10.000 hücre/kuyucuk 50 μL/kuyu içinde %10 FBS, 2 mM glutamin ve penisilin/streptomisin ile takviye edilmiş DMEM F-12 tohumlayın (bkz.
- Hücreleri 37 ° C'de ve% 5 CO2'de 24 saat inkübe edin.
- Her kuyucuk için 250 ng pcDNA3.1 insan vahşi tip SNCA, 0.250 μL transfeksiyon reaktifi, 0.250 L transfeksiyon adjuvanı ve 50 μL'ye kadar transfeksiyon ortamının bir karışımını hazırlayın (bkz. Deneydeki toplam kuyu sayısını göz önünde bulundurarak bir ana çözelti hazırlayın.
- Manuel pipetleme ile kültür ortamını çıkarın ve pipetleme ile adım 1.4'te hazırlanan çözeltiden 50 μL/kuyucuk ekleyin. 37 °C'de inkübe edin,% 5 CO2.
- transfeksiyondan sonra, transfeksiyon ortamını pipetleyerek çıkarın ve PBS'ye 25 μL/kuyucuk %4 paraformaldehit (PFA) ekleyin.
DİKKAT: Paraformaldehit toksik bir fiksatiftir; uygun KKD kullanın. - Oda sıcaklığında (RT) 5 dakika inkübe edin. Sabitleme solüsyonunu pipetleyerek çıkarın ve 50 μL/kuyucuk PBS ekleyerek bir kez yıkayın. PBS'yi pipetleyerek çıkarın.
- %0,05 Tween (TBS-T) ve %10 normal eşek serumu (NDS, bkz. Malzeme Tablosu) ile 25 μL/kuyu TBS pipetleyin. Spesifik olmayan herhangi bir sinyali engellemek için RT'de 1 saat inkübe edin.
- Analiz edilecek kuyucuk sayısına göre TBS-T'de Mouse-anti-TOMM20 antikoru 1:100 ile birlikte Tavşan-anti-α-sinüklein antikoru MJFR1 1:1000 çözeltisini hazırlayın (Malzeme Tablosuna bakınız).
- Pipetleme yoluyla adım 1.8'deki bloke edici çözeltiyi çıkarın ve adım 1.9'da hazırlanan primer antikor karışımından 25 μL/kuyucuk ekleyin. Gece boyunca 4 °C'de inkübe edin.
- Birincil antikor solüsyonunu çıkarın ve pipetleme ile 50 μL/kuyucuk TBS-T ekleyip çıkararak üç kez yıkayın.
- Analiz edilecek kuyucuk sayısına göre TBS-T'de kırmızı ikincil antikor anti-Tavşan 1:1000 ile birlikte yeşil ikincil antikor anti-Mouse 1:1000 solüsyonu hazırlayın (Malzeme Tablosuna bakınız).
- PBS'yi adım 1.11'de açıklanan son yıkamadan aspire ettikten sonra, bir pipet kullanarak ikincil antikor karışımından 25 μL / kuyu ekleyin ve plakayı RT'de 1 saat inkübe edin.
- İkincil antikor çözeltisini pipetleme ile çıkarın ve TBS-T'ye 25 μL/kuyucuk 2 g/mL DAPI ekleyin. Plakayı RT'de 5 dakika inkübe edin.
- DAPI çözeltisini bir pipet kullanarak çıkarın ve bir pipetle 50 μL/kuyu TBS-T ekleyip çıkararak üç kez yıkayın.
- 80 μL/kuyu PBS'yi %0,02 sodyum azid ile pipetleyin ve plakayı 4 °C'de saklayın.
DİKKAT: Sodyum azid toksiktir; uygun KKD kullanın. - Yüksek içerikli otomatik floresan mikroskobu veya 60x objektifle donatılmış eşdeğer konfokal görüntüleme sistemi kullanarak görüntü yakalayın (bkz.
- 3.15-3.21 adımlarını izleyerek Fiji kullanarak tek hücrelerin TOMM20 sinyalinin analizini gerçekleştirin. Apoptoz, nekroz veya mitoz geçiren hücrelerden kaçının.
NOT: Bunu yapmak için, hücre büzülmesi, zar kanaması, hücre ayrılması, nükleer yoğunlaşma, DNA parçalanması ve tek bir düzlemde hizalanmış kalın iplikler halinde organize edilmiş yoğunlaştırılmış nükleer kromatin gibi mikroskop altında görülebilen apoptoz, nekroz veya mitozun morfolojik özelliklerini gösteren hücreleri analizden hariç tutuyoruz.
2. Farelerde PFF'lerin ve PFF intrakraniyal enjeksiyonlarının oluşumu
NOT: Enjeksiyon materyalinin üretimi ve intrakraniyal enjeksiyon işlemi burada sunulmaktadır. Bu protokol Luk ve ark.25'ten uyarlanmıştır.
- PFF'leri elde etmek için, 0.5 mL α-Syn (5 mg / mL; Peptit, Malzeme Tablosuna bakınız) 37 ° C'de ve 250 rpm'de bir çalkalayıcı üzerinde 7 gün boyunca α-sinüklein agregasyonunu indüklemek için.
- Toplanan α-sinükleini% 20 genlik ve 0.25 döngü görevinde, optimal parçalanma elde edilene ve numunelerin transmisyon elektron mikroskobu ile negatif boyanmasıyla gözlemlenene kadar sonikleştirin.
- Striatal PFF enjeksiyonları için erkek ve dişi vahşi tip C57Bl / 6 fareleri (3 aylık) hazırlamak için, Meloksikam / Metacam'ı (5 mg / kg) deri altından salin solüsyonunda uygulayın. Ayrıca hayvan başına iki adet 0.5 mL deri altı enjeksiyon yoluyla 1 mL steril salin solüsyonu uygulayın. Bu tedaviler dehidrasyonu, iltihabı ve ağrıyı önler.
- Bir indüksiyon odasında% 4 izofluran ve 0.7 L / dakO2 ile anesteziyi indükleyin. Pedal tepkisi eksikliği ile anestezi derinliğini kontrol edin.
- Fare kafasının üst kısmını tıraş edin ve hayvanı bir ısı matı üzerindeki stereotaktik aparatın çerçevesine yavaşça yerleştirin.
- Tüm enjeksiyon işlemi boyunca bir yüz maskesi aracılığıyla hayvan inhalasyon anestezisi (0.7 L / dak O2'de% 1 -% 2 İzofluran) sağlayarak anestezik düzlemi koruyun.
- Hayvanı stereotaktik çerçeveye yerleştirin. Çalışma alanını üç tur alternatif klorheksidin ovma ve %70 etanol ile dezenfekte edin. Marcaine / Bupivakain'i lokal olarak (yaklaşık 100 μL)% 0.25'lik bir subkutan infiltrasyon olarak uygulayın.
- Kafatasını ortaya çıkarmak için deride 0,5 cm'lik bir kesi yapın ve beyin yüzeyini ortaya çıkarmak için kafatasına 1 mm çapında bir delik açın, Bregma'dan aşağıdaki koordinatlarda: - 0,5 mm ön-arka, +/− 2,5 mm mediolateral.
- 32-G Hamilton şırınga ile 100 nl / dak'lık bir akış hızında Bregma'dan adım 2.8'de belirtilen koordinatlara ve -2.7 mm dorsoventral (üst beyinden) stereotaktik uygulama yoluyla adım 2.2'de elde edilen 1.5 L PFF'yi enjekte edin. Enjeksiyondan 5 dakika sonra şırıngayı geri çekin.
- Sütür (boyut: 4-0, 45 cm, Malzeme Tablosuna bakınız) yarayı gerektiği gibi üç ila beş dikişle ve her birini 2 çift düğüm ve ardından tek bir düğümle yapıştırın. Anestezik inhalasyonu durdurun ve fareyi çerçeveden çıkarın.
- Fareyi ev kafesine geri koymadan önce uygun bir kurtarma kafesinde iyileşmeye bırakın.
- Takip eden hafta boyunca günlük postoperatif kontroller yapın. Herhangi bir hayvanın ağrısı, sıkıntısı veya rahatsızlığı, her 24 saatte bir adım 2.3'te belirtildiği gibi Meloksikam / Metacam ile dozlanmalıdır.
- Üç ay sonra, intraperitoneal enjeksiyon yoluyla salin çözeltisine 300 μL 200 mg / mL sodyum pentobarbital enjekte edin. Ağrı refleksi kaybolduğunda, göğüste bir kesi (2-3 cm) yapın ve kalbi ortaya çıkarmak için kaburgaları kaldırın.
- 23 G'lık bir kelebek iğneye bağlı 50 mL'lik bir şırınga kullanılarak PBS'de birbiri ardına 10 mL PBS ve 35 mL% 4 paraformaldehit ile transkardiyal olarak perfüz.
- Beyni çıkarın ve 4 ° C'de 24 saat daha için% 4 PFA'da postfix'i çıkarın. PFA işleminden sonra 4 °C'de% 70 etanol içinde saklayın.
- Beyni uygun plastik gömme kutularına koyun ( Malzeme Tablosuna bakınız) ve RT'de 1 saat boyunca% 95 etanol içinde inkübe edin Taze% 95 etanolde adımı tekrarlayın ve 1 saat boyunca tekrar inkübe edin.
- Beyinleri RT'de 1 saat boyunca %100 etanole aktarın Taze %100 etanolde adımı tekrarlayın ve 1 saat tekrar inkübe edin.
- Beyinleri RT'de 1 saat boyunca ksilen veya ksilen ikamesine aktarın Taze çözeltide tekrarlayın ve 1 saat boyunca tekrar inkübe edin.
- Ksilen veya ksilen ikamesini çıkarın ve numuneyi 1 saat boyunca ılık parafin içinde inkübe edin. Parafini değiştirin ve bir saat daha inkübe edin.
- Beyni ılık parafinli gömme kutularına monte edin ve gece boyunca kurumasını bekleyin. Bir mikrotom kullanarak 5 μm'lik bölümler hazırlayın ( Malzeme Tablosuna bakın) ve bunları cam slaytlara monte edin.
3. PFF enjekte edilen farelerden parafine gömülü beyin dilimleri üzerinde immünohistokimya ile mitokondriyal morfoloji analizi
- On kez ksilen ikamesine batırarak slaytları mumdan arındırın. Slaytları ksilen ikamesinde 2 dakika inkübe edin. Ksilen ikamesine tekrar on kez batırın.
NOT: Bu adım, parafini çıkarmak ve numunelerin rehidrasyonunu sağlamak için gereklidir. - Rehidrasyon: Adım 3.1'de açıklanan prosedürü aşağıdaki solüsyonlarla tekrarlayın:% 100 EtOH,% 95 EtOH,% 70 EtOH ve sırayla ddH2O ile iki kez.
- Aşağıdaki adımları izleyerek antijen alımı ve immün boyama gerçekleştirin.
- Numuneleri ddH2O ile mikrodalgaya uygun bir kaba aktararak başlayın.
- 100x sitrat tamponu pH 6'yı ısıtın (Malzeme Tablosuna bakın) 4 °C'de saklayın (deterjanlar çökelmiş olabilir) ve 350 mL taze 1x sitrat tamponu hazırlayın. Ardından sitrat tamponunu kapaklı uygun bir plastik kaba dökün.
- Slaytları sitrat tampon kabına koyun (KRİTİK : slaytların tampon seviyesinin altında olup olmadığını kontrol edin) ve kapağı kapatın.
DİKKAT: Kapağın tamamen KAPALI OLMADIĞINDAN emin olun, aksi takdirde kap mikrodalgada patlayabilir. - 700 W'ta mikrodalga: 4 dk + 5 dk dinlenme, 1,5 dk + 5 dk dinlenme. Sitrat tamponunu doldurun ve tekrar mikrodalgada 1,5 dk + 5 dk dinlenme, 1,5 dk + 5 dk dinlenme, 1,5 dk + 5 dk dinlenme.
- Numuneleri sitrat tamponunda buz üzerinde 20 dakika soğutun. Numuneyi ddH2O ile yıkayın.
NOT: Antijen alımı, spesifik antikor gereksinimlerine göre değişebilir.
- Numune slaytlarını dokuya dokunmadan kağıt havluyla kurulayın. Doku parçalarının etrafına pap kalemle dikdörtgenler çizin (bkz.
- Tüm slaytları bir slayt bağışıklık boyama kutusuna aktarın ve TBS +% 0.05 TWEEN (TBS-T) ile birkaç kez nazikçe yıkayın. TBS-T damlalarının pap-pen dikdörtgenlerinin içinde kaldığını kontrol edin.
- Kağıt havluya dokunarak TBS-T'yi numunelerden çıkarın. Her dikdörtgene (dokuya dokunmadan) 50 μL bloke edici bir çözelti (TBS-T'de% 10 NDS) ekleyin ve RT'de 1 saat inkübe edin.
NOT: Hacimler dokunun boyutuna göre değişebilir; Şunlardan emin olmaya çalışın: (1) PAP ile kaleme alınan alan numuneler arasında benzerdir ve (2) alan seçilen tampon hacmi tarafından tamamen kaplıdır. - Bir kağıt havluya vurarak blokaj solüsyonunu numunelerden çıkarın. TBS-T'de aşağıdaki birincil antikor karışımından 50 μL / dikdörtgen pipetleyin: anti-Tirozin Hidroksilaz 1: 250, anti-VDAC1 1: 100 ve anti-pSer129 α-sinüklein EP1536Y 1:2000 ile birlikte (bkz.
- Gece boyunca 4 °C'de inkübe edin.
- TBS-T'yi slaytlara pipetleyerek yıkayın ve kağıt havluya vurarak çıkarın. Üç kez tekrarlayın.
- 50 μL/dikdörtgen ikincil antikor karışımını pipetleyerek ekleyin: TBS-T'de yeşil ikincil anti-Tavuk, kırmızı ikincil anti-Fare ve uzak kırmızı ikincil anti-Tavşan 1:1000 (Malzeme Tablosuna bakınız). Karanlıkta 37 °C'de 1 saat inkübe edin.
- Adım 3.13'te açıklandığı gibi TBS-T ile üç kez yıkayın.
- TBS-T'de DAPI 2 μg/mL ile 1 dakika inkübe edin. Kağıt havluya dokunarak DAPI solüsyonunu çıkarın. Adım 3.13'te açıklandığı gibi TBS-T ile üç kez yıkayın.
- Üzerine bir cam lamel monte edinamp2 damla/slayt montaj reaktifi kullanarak (Malzeme Tablosuna bakın). Kabarcıkları gidermek için lamel hafifçe bastırın ve numuneleri RT'de 1 saat kurumaya bırakın. Daha sonra karanlıkta 4 °C'de saklayın.
- 60x yağ objektifi veya konfokal teknoloji ile donatılmış yapılandırılmış aydınlatmalı floresan görüntüleme sistemini kullanarak farklı alanlarda en az 50 hücreyi görüntüleyin.
- Aşağıdaki adımlarda gösterildiği gibi Fiji kullanarak tek hücrelerin VDAC1 sinyalinin analizini gerçekleştirin.
- İlk olarak, pozitif veya negatif hücrenin etrafına (uygun şekilde) bir kontur çizerek ve "Kırp" işlevini kullanarak ilgilenilen bölgeyi (ROI) seçin ve izole edin. ROI seçiminde yanlılığı önlemek için, analizle ilgisi olmayan bir işaretleyicinin (yani mitokondriyal bir işaretleyicinin değil) floresan sinyalini dikkate alarak seçin.
- İsteğe bağlı: Görüntü aşırı pikselliyse, daha yüksek bir kenar tanımı elde etmek için "düzgün" işlevini kullanın.
NOT: Düzgünleştirme işlevi bir görüntüye uygulanırsa, lütfen bunu sonraki tüm görüntülere uygulayın. - İsteğe bağlı: Arka planı azaltmak için "Convolve" işlevini (Çekirdek modu, İşlem > Filtreleri'nde) kullanın.
NOT: Bu isteğe bağlıdır ve bölümlerin daha ince yapısı nedeniyle 5 m'lik bölümler kullanıldığında genellikle gerekli değildir. - "Ölçümü ayarla" işlevinde şekil tanımlayıcılarını etkinleştirin ve eşik seçeneklerini sınırlayın (bunların analiz yoluyla etkinleştirildiğinden emin olun).
- "Ayarla" menüsünde eşik fonksiyonunu seçin ve eşik seviyesini ayarlayın. Aynı numunenin tüm hücreleri için eşik ayarları korunmalıdır.
- Arka plan piksellerini atarken, bu makalenin temsili görüntülerinde gösterildiği gibi mitokondriyal ağın yeterli şekilde görselleştirilmesini sağlamaya çalışın.
- Analiz sekmesindeki Parçacıkları analiz et aracını kullanın. Mitokondriyi yakalamak için uygun bir boyut ayarlayın. Bu örnekte, boyut: 25-Sonsuz, etkinleştir: Piksel birimleri ve şunu seçin: Göster: Sonucu görselleştirmek için maskeler komutları kullanılmıştır. Fiji, sayıları, En Boy Oranını (AR) ve diğer şekil parametrelerini yeni bir panelde hesaplayacak ve görüntüleyecektir.
- Verilerin istatistiksel analizini uygun şekilde gerçekleştirin. Bu deneyde, D'Agostino ve Pearson normallik testleri ile normallik testi sonrası deney grupları arasında Fiji tarafından hesaplanan ortalama En Boy Oranı (AR) ve Sayımlar arasındaki farkı analiz etmek için t-testi kullanılmıştır.
Temsili Sonuçlar
Dokudaki mitokondriyal morfolojinin yerinde değerlendirilmesi için uygun görüntüleme ve analiz koşullarının mevcut olduğundan emin olmak için, mitokondriyal morfolojinin bilinen bir modülatörüne yanıt olarak mitokondriyal morfolojinin in vitro araştırılması önerilir (Bölüm 1). Örnek olarak, SNCA, daha önce tarif edildiği gibi mitokondriyal morfolojide değişiklikleri indüklemek için SH-SY5Y hücrelerinde genetik olarak aşırı eksprese edildi26. Mitokondriyal morfolojiyi kötüleştirmek için bir kontrol olarak kullanılabilecek diğer hakaretler, açlık veya MPP + gibi mitokondriyal aktivite inhibitörlerinin kullanımı olacaktır. Hücreler, SNCA+ (AS+) ve SNCA- (AS-) hücrelerini ayırmak için α-sinüklein (AS) için transfekte edildi ve boyandı. Ayrıca mitokondriyal hücre ağını görselleştirmek için TOMM2027 ile boyandılar. Bu analizi mümkün olduğunca 5 μm'lik bir doku kesitininkine benzer hale getirmek için, çoklu düzlemlerin maksimum projeksiyonunun aksine bir konfokal düzlem analiz edildi. TOMM20'nin bir konfokal düzleminin morfolojik analizi, SNCA aşırı ekspresyonuna yanıt olarak hem toplam mitokondri sayısının hem de en boy oranının veya AR'nin (organelin uzaması ile ilişkili olan) azaldığını ortaya koydu (Şekil 1).
Yukarıdaki protokol bölümünde açıklandığı gibi, PFF'ler enjekte edilen hayvanlardan alınan 5 μm parafine gömülü fare beyni kesitlerinde mitokondriyal protein VDAC1 için immün boyama gerçekleştirildi. PH'de dejenerasyona uğrayan Substantia nigra pars compacta (SNc) dopaminerjik nöronları, anti-tirozin hidroksilaz (TH) ile birlikte immün boyama ile ortaya çıkarıldı ve ventral tegmental alandan ve substantia nigra pars lateralis'ten bölgesel olarak ayrıldı. Öte yandan, anti-fosfoSer129-α-sinüklein (pS129) boyama, pS129 lezyonlarını barındıran hücreleri sağlıklı hücrelerden ayırt etmemizi sağladı (pS129+'a karşı pS129-). Üç farklı hayvanın SNc görüntüleri alındı ve TH-pozitif nöronların VDAC1 boyamasının müteakip görüntü analizi, pS129 lezyonlarını taşıyan nöronlar ve bunlardan yoksun nöronlar arasında hem mitokondriyal sayı sayılarında hem de en-boy oranında bir azalma olduğunu ortaya koydu (Şekil 2). Bu sonuçlar, pS129 lezyonlarını barındıran nöronların mitokondriyal morfolojisinin, pS129 lezyonları olmayan hücrelere kıyasla bozulduğunu göstermektedir.
Bu özel deney, AR'de bir azalma gösterirken, böylece mitokondriyal morfolojinin kötüleştiğini gösteren küresel sayımlarda bir azalma ile birlikte mitokondri uzamasında bir azalmayı vurgularken, verilerin yorumlanması deneye bağlı olmalıdır. Örneğin, AR ve sayımlardaki bir azalma, mitokondriyal içerikte ve parçalanmada küresel bir azalmaya işaret edebilirken, AR'de bir azalma, ancak küresel sayımlarda bir artış, mitokondriyal parçalanma fenotipine işaret edecektir. Bu nedenle, verilerin her iki ölçü bağlamında yorumlanması önemlidir.
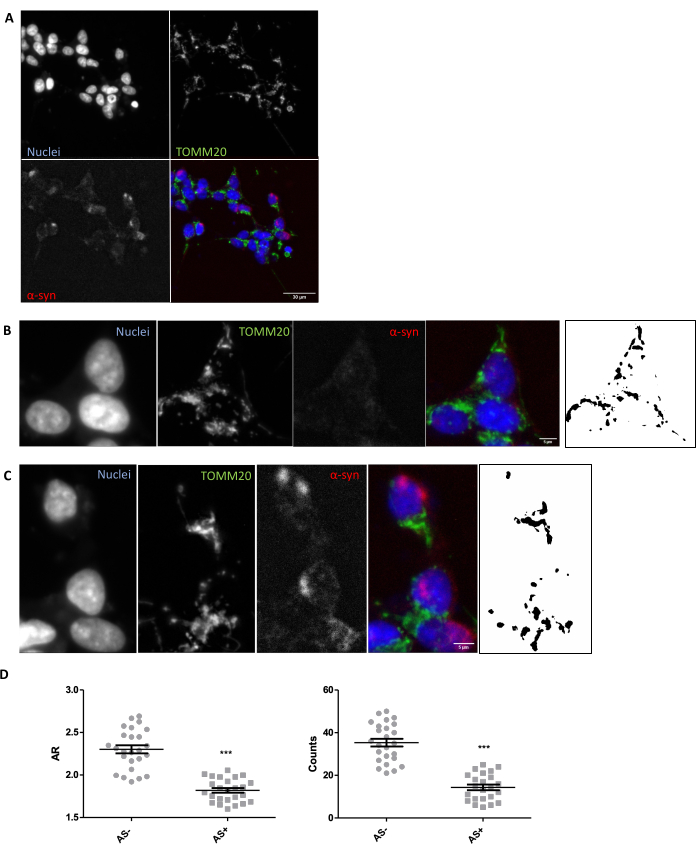
Şekil 1: SNCA-aşırı eksprese eden bir in vitro modelde mitokondriyal morfoloji. SNCA-aşırı eksprese eden ve aşırı eksprese etmeyen (sırasıyla AS+ ve AS-) hücrelerde (A) TOMM20 (yeşil), α-sinüklein (AS, kırmızı) ve DAPI (mavi) için birlikte immün boyama. Bir AS hücresinin (B) ve bir AS+ hücresinin (C) ayrıntısı. (B) ve (C) panellerindeki siyah beyaz görüntüler, Protokol bölümünde açıklanan Fiji işlevi uygulandıktan sonra TOMM20 sinyalinin maskelerini temsil eder. Bu maske, ortaya çıkan yapıların şeklinin ölçülmesini sağlar. AS ve AS+ hücrelerinin (koşul başına N = 25 hücre) mitokondriyal sayıları ve En Boy Oranı (AR) değerleri ölçüldü ve ortalama ± SEM değerlerinin yanı sıra bireysel değerler olarak temsil edildi; **p değeri < 0.05 t-testi (D). Normallik, D'Agostino ve Pearson normallik testleri ile değerlendirildi. Ölçek çubukları: A, 30 μm; B,C, 5 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
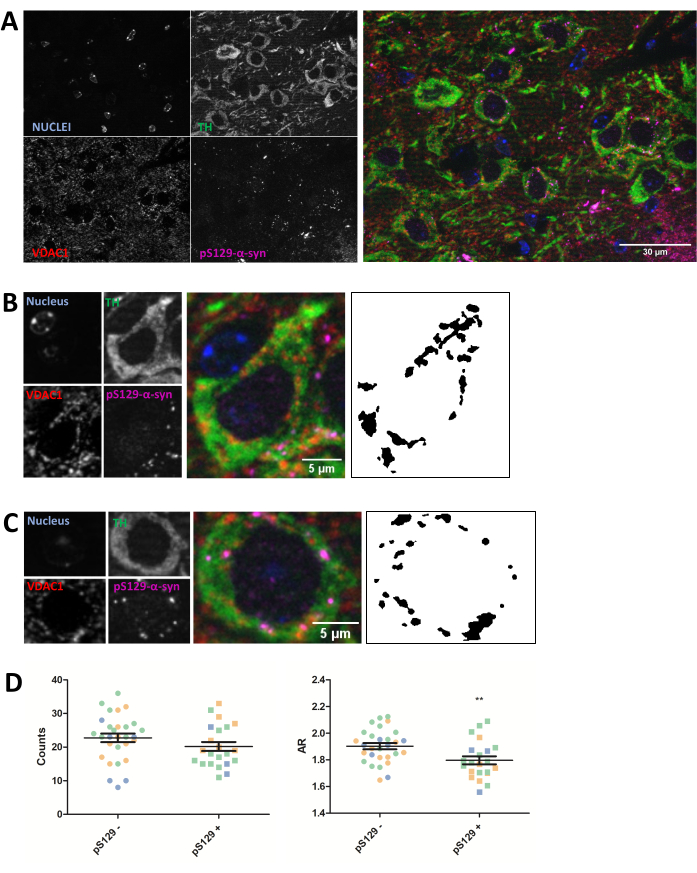
Şekil 2: Mitokondriyal morfoloji, pS129 lezyonlarını barındıran nöronlarda etkilenir. PFF enjekte edilen farelerin (A) SNc'sinin TH (yeşil), VDAC1 (kırmızı), fosfoS129-α-sinüklein (macenta) ve DAPI (mavi) için birlikte immün boyama. Bir fosfoS129-α-sinüklein-negatif (pS129-) dopaminerjik nöronun (B) ve bir fosfoS129-α-sinüklein-pozitif (pS129+) dopaminerjik nöronun (C) detayı. (B) ve (C) panellerindeki siyah beyaz görüntüler, Protokol bölümünde açıklanan Fiji işlevi uygulandıktan sonra TOMM20 sinyalinin maskelerini temsil eder. Bu maske, ortaya çıkan yapıların şeklinin ölçülmesini sağlar. Negatif ve pozitif hücreler, tek tek grafikli değerlerin (mavi, yeşil ve turuncu) farklı renkleriyle gösterildiği gibi üç farklı hayvandan alınan örneklerde sayıldı. Dopaminerjik nöronlarda pS129- (N = 29) ve pS129 + (N = 22) 'nin mitokondriyal sayıları ve AR nicelemesi, bireysel hücre değerlerinin yanı sıra ortalama ± SEM olarak temsil edildi; **p değeri < 0.05 t-testi (D). Normallik, D'Agostino ve Pearson normallik testleri ile değerlendirildi. Ölçek çubukları: A, 30 μm; B,C, 5 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Genel olarak, bu çalışma, görüntü analizi ile birlikte immün boyamanın mitokondriyal morfolojiyi analiz etmek için güvenilir bir yöntem olduğunu göstermektedir. Aslında, hem hücre kültüründe hem de dokuda mitokondri sayısının yanı sıra en boy oranı gibi bazı morfolojik parametrelerin ölçülmesine izin verir. Mitokondri sayısı, numunelerin fisyon ve füzyon mekanizmalarının fonksiyonel durumu ile doğrudan bağlantılıdır, oysa AR değeri organelin uzamasına bağlıdır. Bu yöntem, değişen mitokondriyal morfoloji, dinamikler ve fonksiyonların iyi bilinen patolojik mekanizmalar olduğu PD modellerinde mitokondriyal anormalliklerin hızlı değerlendirilmesi için özellikle değerli olabilir28,29. α-sinüklein de PH'de önemli bir rol oynar: aslında, α-sinüklein, PD hastalarının ölüm sonrası teşhisi için kullanılan sitoplazmatik fibriler agregatlar olan Lewy Cisimciklerinin bileşenlerinden biridir30. Ayrıca, SNCA genindeki mutasyonlar hem tanıdık hem de sporadik PD'li hastalarda bulunmuştur (31'de gözden geçirilmiştir). Ser129'da α-sinükleinin fosforilasyonunun, PFF hakaretinden sonra ortaya çıkan ve çeşitli toksik etkiler ortaya çıkaran Lewy-Body benzeri patolojiyi etiketlediği yaygın olarak gösterilmiştir32,26.
Burada sunulan aracı kullanarak, hem aşırı eksprese edilmiş hem de kümelenmiş α-sinüklein (sırasıyla α-sinüklein boyaması olan hücreler ve fosfoSer129α-sinüklein pozitif lezyonlar taşıyan nöronlar) varlığı α nda mitokondriyal sayı ve AR değerlerinde bir azalma tespit edebildik. Bu sonuçlar, doğrudan α-sinüklein-mitokondri etkileşimlerinin PD26,33 34'te mitokondriyal fonksiyon ve homeostaz üzerinde nasıl toksik etkiler ürettiğini gösteren önceki raporlarla uyumludur. Gerçekten de, α-sinüklein mutasyonlarına sahip farelerin artmış mitokondriyal DNA hasarı35 ve mitofaji36,37 sergilediği bildirilmiştir. Ayrıca, artan α-sinüklein seviyelerinin mitokondriyal fisyon/parçalanmayı teşvik ettiği, mitokondri içinde reaktif oksijen türlerini indüklediği ve hücre hatlarında mitokondriyal protein ekspresyonunu düzensizleştirdiği ve α-sinükleini aşırı eksprese eden fare modellerinde mitokondriyal protein ekspresyonunu düzensizleştirdiğiaçıklanmıştır 26,38,39.
Bu aracın büyük ölçüde çalışma için kullanılan antikorlara bağlı olduğunu vurgulamak önemlidir; Uygun hücre altı kompartmanı tespit etmek için kullanılan antikor boyasının dikkatli morfolojik değerlendirmesi şarttır. Bu teknik 5 μm'lik kesitlere dayandığından ve bu nedenle mitokondriyal yapıların analizi için tek odak düzlemleri gerektirdiğinden, bir fenotipin yokluğu bir fenotipin varlığını dışlamaz, çünkü mitokondriyal morfolojideki ince farklılıkların bu yöntemle tespit edilememesi mümkündür.
Bu çalışma ve diğerleri daha önce mitokondriyal morfolojiyi in vivo40 olarak değerlendirmek için benzer yaklaşımlar kullanmış olsa da, bu değerlendirme için araştırma topluluğunun erişimine açılacak ayrıntılı bir protokole ihtiyaç vardır. Bu çalışmanın önemi, mitokondriyal morfolojik anormallikleri değerlendirmek ve potansiyel patolojiyi belirlemek için bu yöntemi çeşitli in vivo hastalık modellerine uygulamanın mümkün olmasıdır, bu da sonunda bu tür bozuklukların tedavisi için kurşun bileşiklerinin taranmasını kolaylaştırabilir. Bu analiz şu anda parafine gömülü doku ile sınırlı olsa da, yöntemin avantajı, terminal doku toplanmasından sonra herhangi bir hastalık modeline uygulanabilmesi ve bu da onu çok yönlü bir araç haline getirmesidir.
Açıklamalar
Herhangi bir çıkar çatışması olmadığını bildirmek istiyoruz.
Teşekkürler
Bu çalışmanın fon sağlayıcılarına, özellikle Ikerbasque, İspanya Bilim ve Yenilik Bakanlığı, Michael J Fox Vakfı, IBRO ve Achucarro Bask Sinirbilim Merkezi'ne teşekkür etmek istiyoruz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 32 G Hamilton syringe | Hamilton | 7632-01 | |
| 4',6-diamidino-2-fenilindol, dihidrocloruro (DAPI) | Invitrogen | D1306 | |
| 4/0 USP 45 cm suture | SSa90 pga | 32345n-36u | |
| Alexa fluor 488/594-Donkey anti-Mouse | Invitrogen | A21202; A21203 | green/red dye-Donkey anti-Mouse |
| Alexa fluor 594/647-Donkey anti-Rabbit | Invitrogen | A21207 A31573 | red/far red dye-Donkey anti-Rabbit |
| AlexaFluor 488-Donkey anti-Chicken | Jackson ImmunoResearch | 703-545-155 | green dye-Donkey anti-Chicken |
| Anti-PSer129 α-synuclein EP1536Y (Rabbit) antibody | Abcam | ab51253 | |
| Anti-TOM 20 (Mouse) antibody | Santa Cruz | sc-17764 | |
| Anti-Tyrosine Hydroxylase (Chicken) antibody | Abcam | ab76442 | |
| Anti-VDAC1 (Mouse) antibody | Santa Cruz | sc-390996 | |
| Anti-α-synuclein antibody MJFR1 (Rabbit) | Abcam | ab138501 | |
| Citrate buffer 100X stock: 120mM citrate buffer, 5% Tween in water (pH 6) | Home-made | ||
| Disposable base mold for tissue embedding | Fisher | 22-363-553 | Plastic embedding boxes |
| D-MEM F12 | Gibco | A321331020 | |
| EVOS M7000 Imaging System | ThermoFisher Scientific | High-content automated fluorescence microscope | |
| Fetal Bovine Serum | Gibco | 10270106 | |
| Flat optical bottom 96 well plates | Greiner | 675090 | |
| FluorSave Reagent | Millipore | 345789-20ML | Mounting reagent |
| Glutamine 200 mM | Gibco | 25030-024 | |
| ImmEdge Hydrophobic Barrier Pen | Vector Laboratories | H-4000 | PAP-pen |
| Lipofectamine and Plus Reagent | Invitrogen | 11668-019; 11514-015 | Transfection reagent and transfection adjuvant |
| Matrigel | Corning | 354230 | Coating matrix |
| Microtome | ThermoFisher Scientific | ||
| Normal Donkey Serum | Gibco | PCN5000 | |
| Opti-MEM | Gibco | 31985070 | Transfection medium |
| PCDNA4 plasmid (backbone) | Addgene | 41036 | |
| Penicillin/Streptomycin solution | Gibco | 15140-122 | |
| SH-SY5Y cells/well | ATCC | HTB-11 | |
| Xylene substitute | Labbox | 22L36504 | |
| Zeiss Axio Imager Apotome 2 | Carl Zeiss | Structured illumination fluorescence imaging system | |
| α-synuclein peptide | rpeptide | S-1010-2 |
Referanslar
- Yang, Y., Lu, B. Mitochondrial morphogenesis, distribution, and parkinson disease. Journal of Neuropathology and Experimental Neurology. 68 (9), 953-963 (2009).
- Schapira, A. H. Mitochondria in the aetiology and pathogenesis of Parkinson's disease. The Lancet Neurology. 7 (1), 97-109 (2008).
- Swerdlow, R. H. Mitochondria and mitochondrial cascades in alzheimer's disease. Journal of Alzheimer's Disease. 62 (3), 1403-1416 (2018).
- Hedrich, K., et al. type, and origin of Parkin mutations: Review and case studies. Movement Disorders. 19 (10), 1146-1157 (2004).
- Kahle, P. J., Haass, C. How does parkin ligate ubiquitin to Parkinson's disease. EMBO reports. 5 (7), 681-685 (2004).
- Dawson, T. M., Dawson, V. L. The role of parkin in familial and sporadic Parkinson's disease. Movement Disorders. 25, S32-S39 (2010).
- Pickrell, A. M., Youle, R. J. The Roles of PINK1, Parkin, and Mitochondrial Fidelity in Parkinson's Disease. Neuron. 85 (2), 257-273 (2015).
- Zhi, L., et al. Loss of PINK1 causes age-dependent decrease of dopamine release and mitochondrial dysfunction. Neurobiology of Aging. 75, 1-10 (2019).
- Bonifati, V., et al. DJ-1(PARK7), a novel gene for autosomal recessive, early onset parkinsonism. Neurological Sciences. 24 (3), 159-160 (2003).
- Chia, S. J., Tan, E. -. K., Chao, Y. -. X. Historical Perspective: Models of Parkinson's Disease. International Journal of Molecular Sciences. 21 (7), 2464 (2020).
- Wilson, D. M., Cookson, M. R., Den Bosch, L. V. a. n., Zetterberg, H., Holtzman, D. M., Dewachter, I. Hallmarks of neurodegenerative diseases. Cell. 186 (4), 693-714 (2023).
- Moore, D. J., West, A. B., Dawson, V. L., Dawson, T. M. Molecular pathophysiology of Parkinson's disease. Annual Review of Neuroscience. 28 (1), 57-87 (2005).
- Olanow, C. W., Tatton, W. G. Etiology and pathogenesis of Parkinson's disease. Annual Review of Neuroscience. 22 (1), 123-144 (1999).
- Nunnari, J., Suomalainen, A. Mitochondria: In sickness and in health. Cell. 148 (6), 1145-1159 (2012).
- Okamoto, K., Shaw, J. M. Mitochondrial Morphology and Dynamics in Yeast and Multicellular Eukaryotes. Annual Review of Genetics. 39 (1), 503-536 (2005).
- Malpartida, A. B., Williamson, M., Narendra, D. P., Wade-Martins, R., Ryan, B. J. Mitochondrial Dysfunction and Mitophagy in Parkinson's Disease: From Mechanism to Therapy. Trends in Biochemical Sciences. 46 (4), 329-343 (2021).
- Zou, W., et al. Nanoscopic quantification of sub-mitochondrial morphology, mitophagy and mitochondrial dynamics in living cells derived from patients with mitochondrial diseases. Journal of Nanobiotechnology. 19 (1), 136 (2021).
- Navaratnarajah, T., Anand, R., Reichert, A. S., Distelmaier, F. The relevance of mitochondrial morphology for human disease. The International Journal of Biochemistry & Cell Biology. 134, 105951 (2021).
- Zambon, F., et al. Cellular α-synuclein pathology is associated with bioenergetic dysfunction in Parkinson's iPSC-derived dopamine neurons. Human Molecular Genetics. 28 (12), 2001-2013 (2019).
- Cherubini, M., Lopez-Molina, L., Gines, S. Mitochondrial fission in Huntington's disease mouse striatum disrupts ER-mitochondria contacts leading to disturbances in Ca2+ efflux and Reactive Oxygen Species (ROS) homeostasis. Neurobiology of Disease. 136, 104741 (2020).
- Parihar, M. S., Parihar, A., Fujita, M., Hashimoto, M., Ghafourifar, P. Alpha-synuclein overexpression and aggregation exacerbates impairment of mitochondrial functions by augmenting oxidative stress in human neuroblastoma cells. The International Journal of Biochemistry & Cell Biology. 41 (10), 2015-2024 (2009).
- Wiemerslage, L., Lee, D. Quantification of mitochondrial morphology in neurites of dopaminergic neurons using multiple parameters. Journal of Neuroscience Methods. 262, 56-65 (2016).
- Liu, Y. -. T., et al. Mt-Keima detects PINK1-PRKN mitophagy in vivo with greater sensitivity than mito-QC. Autophagy. 17 (11), 3753-3762 (2021).
- Shoshan-Barmatz, V., Shteinfer-Kuzmine, A., Verma, A. VDAC1 at the intersection of cell metabolism, apoptosis, and diseases. Biomolecules. 10 (11), 1485 (2020).
- Luk, K. C., et al. Pathological α-Synuclein transmission initiates parkinson-like neurodegeneration in nontransgenic mice. Science. 338 (6109), 949-953 (2012).
- Ryan, B. J., et al. REST protects dopaminergic neurons from mitochondrial and α-synuclein oligomer pathology in an alpha synuclein overexpressing BAC-transgenic mouse model. The Journal of Neuroscience. 41 (16), 3731-3746 (2021).
- Yamamoto, H., et al. Dual role of the receptor Tom20 in specificity and efficiency of protein import into mitochondria. Proceedings of the National Academy of Sciences. 108 (1), 91-96 (2011).
- Exner, N., Lutz, A. K., Haass, C., Winklhofer, K. F. Mitochondrial dysfunction in Parkinson's disease: molecular mechanisms and pathophysiological consequences. The EMBO Journal. 31 (14), 3038-3062 (2012).
- Grünewald, A., Kumar, K. R., Sue, C. M. New insights into the complex role of mitochondria in Parkinson's disease. Progress in Neurobiology. 177, 73-93 (2019).
- Baba, M., et al. Aggregation of alpha-synuclein in Lewy bodies of sporadic Parkinson's disease and dementia with Lewy bodies. The American journal of pathology. 152 (4), 879-884 (1998).
- Vázquez-Vélez, G. E., Zoghbi, H. Y. Parkinson's disease genetics and pathophysiology. Annual Review of Neuroscience. 44 (1), 87-108 (2021).
- Mahul-Mellier, A. -. L., et al. The process of Lewy body formation, rather than simply α-synuclein fibrillization, is one of the major drivers of neurodegeneration. Proceedings of the National Academy of Sciences. 117 (9), 4971-4982 (2020).
- Ganguly, U., et al. Interaction of α-synuclein and Parkin in iron toxicity on SH-SY5Y cells: implications in the pathogenesis of Parkinson's disease. Biochemical Journal. 477 (6), 1109-1122 (2020).
- Ganjam, G. K., et al. Mitochondrial damage by α-synuclein causes cell death in human dopaminergic neurons. Cell Death & Disease. 10 (11), 865 (2019).
- Martin, L. J., et al. Parkinson's Disease α-synuclein transgenic mice develop neuronal mitochondrial degeneration and cell death. The Journal of Neuroscience. 26 (1), 41-50 (2006).
- Choubey, V., et al. Mutant A53T α-Synuclein induces neuronal death by increasing mitochondrial autophagy. Journal of Biological Chemistry. 286 (12), 10814-10824 (2011).
- Chen, L., Xie, Z., Turkson, S., Zhuang, X. A53T Human α-synuclein overexpression in transgenic mice induces pervasive mitochondria macroautophagy defects preceding dopamine neuron degeneration. The Journal of Neuroscience. 35 (3), 890-905 (2015).
- Kamp, F., et al. Inhibition of mitochondrial fusion by α-synuclein is rescued by PINK1, Parkin and DJ-1. The EMBO Journal. 29 (20), 3571-3589 (2010).
- Nakamura, K., et al. Direct membrane association drives mitochondrial fission by the parkinson disease-associated protein α-synuclein. Journal of Biological Chemistry. 286 (23), 20710-20726 (2011).
- Park, J., et al. Abnormal mitochondria in a non-human primate model of MPTP-induced Parkinson's disease: Drp1 and CDK5/p25 signaling. Experimental Neurobiology. 28 (3), 414-424 (2019).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır