Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Lifespan Machine'i kullanarak yüksek verimli davranışsal yaşlanma ve ömür testleri
Bu Makalede
Özet
Görüntüleme platformu "The Lifespan Machine", büyük popülasyonların yaşam boyu gözlemini otomatikleştirir. Yaşam süresi, stres direnci, patogenez ve davranışsal yaşlanma testlerini gerçekleştirmek için gereken adımları gösteriyoruz. Verilerin kalitesi ve kapsamı, araştırmacıların biyolojik ve çevresel varyasyonların varlığına rağmen yaşlanmaya yönelik müdahaleleri incelemelerine olanak tanır.
Özet
Sabit bir ortamda tutulan genetik olarak özdeş hayvanlar, incelenen tüm organizmalarda korunan yaşlanmanın genetik olmayan, stokastik büyük bir yönünü yansıtan geniş bir yaşam dağılımı sergiler. Bu stokastik bileşen, yaşlanmayı anlamak ve yaşam süresini uzatan veya sağlığı iyileştiren başarılı müdahaleleri belirlemek için araştırmacıların aynı anda büyük deney hayvanı popülasyonlarını izlemesi gerektiği anlamına gelir. Geleneksel manuel ölüm puanlaması, büyük ölçekli hipotez testi için gereken verimi ve ölçeği sınırlayarak, yüksek verimli yaşam süresi tahlilleri için otomatik yöntemlerin geliştirilmesine yol açar. Lifespan Machine (LSM), nematodların ömür boyu izlenmesi için modifiye edilmiş düz yataklı tarayıcıları özel görüntü işleme ve veri doğrulama yazılımıyla birleştiren yüksek verimli bir görüntüleme platformudur. Platform, büyük hayvan popülasyonlarından daha önce görülmemiş bir ölçekte ve deneyimli araştırmacılar tarafından gerçekleştirilen manuel tahlillere eşit istatistiksel bir hassasiyet ve doğrulukta yüksek oranda zamansal olarak çözülmüş yaşam süresi verileri üreterek büyük bir teknik ilerleme teşkil ediyor. Son zamanlarda, LSM, yaşlanma sırasında gözlenen davranışsal ve morfolojik değişiklikleri ölçmek ve bunları yaşam süresiyle ilişkilendirmek için daha da geliştirilmiştir. Burada, LSM kullanarak otomatik bir yaşam süresi denemesinin nasıl planlanacağını, çalıştırılacağını ve analiz edileceğini açıklıyoruz. Davranışsal verilerin ve yüksek kaliteli hayatta kalma eğrilerinin başarılı bir şekilde toplanması için gereken kritik adımları daha da vurguluyoruz.
Giriş
Yaşlanma, bir organizmanın fizyolojik işlevinde bir azalma ile karakterize edilen karmaşık, çok yönlü bir süreçtir ve bu da zamanla hastalık ve ölüm riskinde bir artışa yol açar1. Doğumdan veya yetişkinliğin başlangıcından ölüme kadar geçen süre olarak ölçülen yaşam süresi, yaşlanmanın kesin bir sonucunu2 ve popülasyonlar arasındaki nispi yaşlanma oranını ölçmek için dolaylı ancak titiz bir şekilde nicel bir vekilsağlar 3. Yaşlanma çalışmaları, bir müdahaleye maruz kalan bir popülasyon ile maruz kalmayan bir kontrol grubu arasındaki sonuçları karşılaştırmak için klinik çalışmalara benzer şekilde genellikle doğru yaşam süresi ölçümlerine bağlıdır. Ne yazık ki, tekrarlanabilirlik sorunları, bazen istatistiksel olarak yetersiz deneyler4 ve çoğu zaman yaşam süresi tahlillerinin ortamdaki ince değişikliklere karşı doğal duyarlılığı nedeniyle yaşlanma araştırmalarınahakimdir 5. Sağlam deneyler, büyük popülasyonların birden çok kopyasını gerektirir ve bu süreç özellikle otomasyon6 tarafından sunulan deneysel ölçeklenebilirlikten yararlanır.
Yaşam boyu tahlillerin titiz talepleri, yaşlanma sürecinin kendisinin öngörülemezliğinden kaynaklanmaktadır. Aynı ortamlarda barındırılan izogenik bireyler, farklı ölüm zamanları ve fizyolojik düşüş oranları7 sergilerler, bu da yaşam süresinin yüksek derecede stokastiklikiçerdiğini düşündürür 7,8. Bu nedenle, ortalama veya maksimum yaşam süresindeki değişiklikler gibi yaşlanma sürecindeki nicel değişiklikleri ölçmek ve bireysel değişkenlikten kaynaklanan önyargıların üstesinden gelmek için büyük popülasyonlar gereklidir. Ek olarak, yüksek verimli yaşam süresi tahlilleri için bir kapasite, hayatta kalma eğrisi şekilleri ve yaşlanma dinamiklerinin modelleri ile ilgili çalışmaları desteklemek için çok önemlidir9.
Nematod Caenorhabditis elegans, kısa ömrü, genetik izlenebilirliği ve hızlı üretim süresi nedeniyle yaşlanma araştırmaları için paha biçilmez bir modeldir ve bu da yüksek verimli yaşlanma ve yaşam süresi deneyleri için uygunluğunun altını çizer. Geleneksel olarak, C'deki ömür. Elegans, zaman içinde yaklaşık 50-100 hayvandan oluşan senkronize, küçük bir popülasyonu katı ortamda takip ederek ve bireysel ölümlerin zamanını yazarak ölçülmüştür. Hayvanlar yaşlandıkça ve hareket kabiliyetini kaybettikçe, ölüm zamanlarını manuel olarak puanlamak, hayvanları ayrı ayrı dürtmeyi ve baş veya kuyruğun küçük hareketlerini kontrol etmeyi gerektirir. Bu genellikle sıkıcı ve zahmetli bir süreçtir, ancak hızlandırmak için çaba sarf edilmiştir 10,11,12. Daha da önemlisi, yavaş deneysel boru hatları, yaşlanma ve test edilen müdahalelerin etkinliği konusundaki anlayışımızdaki ilerlemeyi engellemektedir.
Kantitatif veriler için yaşlanma araştırmalarının taleplerini karşılamak için, mikroakışkan odalardan düz yataklı tarayıcılara kadar dikkate değer bir dizi yaklaşım da dahil olmak üzere veri toplamayı otomatikleştirmek için birçok teknoloji geliştirilmiştir 13,14,15,16,17,18. LSM, kullanıcıların otomatik analizleri doğrulamasına, düzeltmesine ve iyileştirmesine olanak tanıyan kapsamlı bir yazılım paketi ile birlikte dikkatli ekipman kalibrasyon protokollerinin geliştirilmesiyle elde edilen son derece hassas ve doğru kullanım ömrü verilerinin toplanması için kapsamlı optimizasyonuyla diğer yöntemlerden farklıdır13. Yazılım, prensip olarak, çeşitli görüntüleme yöntemlerine uygulanabilse de, pratikte çoğu kullanıcı, kullanım ömrü üzerindeki büyük etkileri nedeniyle kritik öneme sahip faktörler olan ortam sıcaklığı ve nemi üzerinde ince ayarlı kontrole izin verecek şekilde modifiye edilmiş düz yataklı tarayıcılar kullanır19. LSM, çevresel koşullara ve genotipe bağlı olarak günlerden aylara kadar değişen aralıklarla her 20 dakikada bir nematodların görüntülerini alır. Üretilen veriler, manuel tahlillerden elde edilen verilere kıyasla çok daha yüksek zamansal çözünürlüğe sahiptir ve toplanan görüntüler, kullanım ömrü boyunca nematod konumunun kalıcı bir görsel kaydını sağlar. Makine öğrenimi yöntemleri kullanılarak, ölüm süreleri her bireye otomatik olarak atanır. Bu sonuçlar, "Worm Browser" adı verilen bir istemci yazılımı kullanılarak hızlı ve manuel olarak doğrulanabilir. Donanım ve yazılımının bir sonucu olarak, LSM, azaltılmış iş yükü ve daha yüksek ölçeklenebilirlik avantajı ile deneyimli araştırmacıların elindeki manuel ölüm puanlamasından istatistiksel olarak ayırt edilemeyen hayatta kalma eğrileri üretebilir13.
LSM'nin en son sürümü, nematodun yaşamı boyunca morfolojik ve davranışsal verileri toplayarak ve her bireyin ömrü ile birlikte raporlayarak davranışsal yaşlanmanın incelenmesine de olanak tanır. Özellikle, LSM, her bir hayvanın güçlü hareket bırakma zamanını (VMC) yakalar, bu genellikle bir bireyin yaşam süresinden farklı olarak "sağlık süresini" ölçmek için kullanılan bir dönüm noktasıdır. LSM, yaşam süresi ve davranışsal yaşlanma verilerini aynı anda toplayarak, yaşlanmanın farklı fenotipik sonuçları üzerinde farklı etkileri olabilecek müdahalelerin incelenmesini destekler20. Vücut hareketi veya faringeal pompalama21, doku bütünlüğü22 ve hareket hızı veya uyaran kaynaklı dönme17 gibi davranışsal yaşlanmayı incelemek için çeşitli makroskopik olarak gözlemlenebilir fenotipler kullanılabilir. Farklı yaşlanma fenotipleri arasındaki karşılaştırmalar, yaşlanma süreçlerinin nedensel yapısının analizlerini destekleyebilir. Örneğin, VMC ve yaşam süresi arasındaki karşılaştırma son zamanlarda C. elegans23'te iki farklı yaşlanma sürecini karakterize etmek için kullanılmıştır.
Başlangıçta C. elegans'ın ömrünü ölçmek için geliştirilmiş olsa da, LSM, C de dahil olmak üzere bir dizi nematod türünden hayatta kalma ve davranışsal verilerin toplanmasını destekler. briggsae, C. tropikal, C. japonica, C. brenneri ve P. Pasifik23. Teknoloji, biyolojik ve çevresel müdahalelerin yaşam süresi, stres direnci ve patojen direnci üzerindeki etkisinin incelenmesini kolaylaştırır ve RNA girişiminin hedefli tahlilleri veya oksin ile indüklenebilir protein bozunma sistemleri gibi deneysel araçlarla birleştirilebilir. Bugüne kadar bilimsel literatürde çok çeşitli uygulamalar için kullanılmıştır 6,24,25,26,27,28,29,30.
Burada, deney düzeneğinin ilk aşamalarından elde edilen hayatta kalma eğrilerinin çıktısına kadar, agar plakaları kullanarak bir Yaşam Süresi Makinesi deneyi gerçekleştirmek için adım adım bir protokolün ana hatlarını çiziyoruz. LSM'nin ayırt edici bir özelliği, çabanın yüksek oranda önden yüklemeli olmasıdır, yani araştırmacının zamanının çoğu deney kurulumu sırasında ve küçük bir dereceye kadar görüntü sonrası elde etme sırasında harcanır. Veri toplama, deneyin tüm süresi boyunca tamamen otomatiktir ve araştırmacının "eller serbest" bir deneyim yaşamasını sağlar. Burada açıklanan adımlar, birçok farklı sağkalım testi türü arasında ortak tutulur - aynı deney düzeneği yaşam süresi, termotolerans, oksidatif stres ve patogenez testleri için gerçekleştirilir. Temsili sonuçlar bölümünde, analiz hattının etkinliğini göstermek ve görüntü analizi sırasındaki en önemli adımları vurgulamak için yakın zamanda yayınlanan bir makaleden elde edilen verilerin bir alt kümesini tartışıyoruz23.
Protokol
1. Yazılım ve donanım gereksinimleri
- Düz yataklı tarayıcılar: Prensip olarak, LSM çeşitli görüntüleme cihazları kullanılarak uygulanabilir. Tarayıcı değişiklikleri ve odaklama için ayrıntılı talimatlar başka bir yerde mevcuttur13. LSM donanımı Ek Şekil 1'de gösterilmiştir.
- Veri analizi araçları: LSM yazılımının birbiriyle etkileşim halinde olan üç bileşeni vardır: Linux tabanlı bir tarayıcı kontrol yazılım paketi, web tarayıcısı tabanlı bir meta veri yönetim paketi ve bir Windows ve Linux istemci görüntü analizi yazılım paketi. GitHub deposunda (https://github.com/nstroustrup/lifespan) yayımlanan yazılım araçlarını yükleme yönergelerine bakın.
- Veri görselleştirme ve doğrulama yazılımı: Deneyleri planlamak, görüntü analizini doğrulamak, nematod hareketinin manuel açıklamasını gerçekleştirmek ve hayatta kalma verilerinin çıktısını almak için bir istemci programı olan Worm Browser'ı kullanın. Windows 7, Windows 8 ve Windows 10'da Solucan Tarayıcısı için ikili yürütülebilir dosyalar sağlanır ve Solucan Tarayıcısı Linux veya Apple iOS'taki kaynak kodundan derlenir. Yukarıda belirtilen GitHub deposunda bir kurulum kılavuzu mevcuttur.
Ek Şekil 1: Kullanım Ömrü Makine donanımı. Kauçuk bir paspas üzerinde kesilmiş 16 açıklığa bakacak şekilde yerleştirilmiş yüklü plakaları göstermek için açık kapaklı bir düz yataklı tarayıcı ünitesi. Kauçuk paspas, bir cam tarayıcının yüzeyine yerleştirilir. Görüntü analizi sırasında sorun yaşamamak için plakaların yanlarına koşullar için etiketler yazılır. Cihazın ("1") numarası ve/veya adı ("Jabba") ile işaretleme bandı, birden fazla tarayıcı cihazla çalışırken numune konumunun daha sonra doğrulanmasını kolaylaştırır. LSM donanım bileşenleri hakkında daha fazla ayrıntı başka bir yerde bulunur13. Bu Dosyayı indirmek için lütfen buraya tıklayın.
2. Deneme gününden önce kurulum yapın
- İnkübatörün sıcaklık kalibrasyonu: Çevre sıcaklığı, C'nin önemli bir belirleyicisidir. Elegans Ömrü19. Doğru sonuçlar elde etmek için, deney boyunca sabit tutulan, dikkatlice kalibre edilmiş bir sıcaklıkta görüntü alımı gerçekleştirin. Bunu başarmak için, deneyin başlamasından birkaç gün önce, çalışma sırasında her tarayıcının yüzeyinin sıcaklığını ölçün ve kalibre edin. 31 başka bir yerde açıklandığı gibi yüksek hassasiyetli termokupllar kullanın (Malzeme Tablosuna bakın).
- Tarayıcı plakası düzeni: Deneye başlamadan önce, her tarayıcı için kültür plakalarının en uygun düzenini planlayın.
NOT: Bunun amacı, tarayıcılar arasındaki ve her tarayıcının yüzeyindeki sıcaklık değişiminden kaynaklanan kafa karıştırıcı faktörlerin ortaya çıkmasını önlemektir. Tarayıcılar, ortalama yüzey sıcaklıklarında ince bir şekilde farklılık gösterir ve ayrıca yüzeyleri boyunca ince sıcaklık sapmaları sergiler31.- Tarayıcı plakası konumu: Sonraki veri analizinde bu termal etkileri kontrol etmek için, tarayıcı konumuyla ilgili biyolojik ortak değişkenleri rastgele hale getirin ve plaka konumunu tüm tarayıcılarda standartlaştırın.
- Tarayıcılardaki örnek sayısı: 16 kauçuk paspas düzenini kullanırken ( Malzeme Tablosuna bakın), her tarayıcıya koşul başına dört plaka yerleştirin ve toplamda en az dört tarayıcı yerleştirin. Bu, her koşulun birden fazla tarayıcıya dağıtılmasını sağlar, böylece tarayıcı sıcaklığının kafa karıştırıcı etkileri veri analizi sırasında tanımlanabilir ve ortadan kaldırılabilir13. Bu analizi daha basit hale getirmek için, her tarayıcıya paylaşılan bir referans koşulu (örneğin, vahşi tip numuneler) ekleyin.
NOT: Genel olarak, tarayıcı fanlarının yerleştirilmesi nedeniyle, kauçuk paspasın sağ üst köşesindeki plakalar kurumaya daha yatkındır. Gerekirse bu konumu boş bırakın.
- Plakalar ve numune hazırlama
- Kültür plakalarının dökülmesi: Tarayıcı kültür plakalarının optimum şekilde kurutulması için ( Malzeme Tablosuna bakın), nematodları yüklemeden 4 gün önce agar ortamı dökün. Tarayıcı odağı, plakalara farklı hacimlerde agar eklenmesine izin verecek şekilde ayarlanabilir olsa da, standart plaka hacmi 8 mL'dir.
NOT: Özellikle büyük deneyler için plakaları peristaltik bir pompa ile dökmek faydalı olabilir. - Plakaların tohumlanması: Bakteri çiminin uygun şekilde kurumasını ve büyümesini sağlamak için deney başlamadan en az 2 gün önce plakaları istenen bakteri kültürü ile tohumlayın. Tipik olarak, 200 μL bakteri kültürü, birkaç hafta boyunca 40 nematodları besleyecek bir çim oluşturmak için yeterlidir.
NOT: Görüntüleme için tipik olarak kullanılan plakalar, standart kültür Petri kaplarından daha sıkı bir şekilde kapatılmıştır; Bu nedenle, plakaların bir laboratuvar davlumbazının içinde, genellikle yaklaşık 1 saat veya uygun şekilde kuruyana kadar tohumlanması ve kurutulması tavsiye edilir.
- Kültür plakalarının dökülmesi: Tarayıcı kültür plakalarının optimum şekilde kurutulması için ( Malzeme Tablosuna bakın), nematodları yüklemeden 4 gün önce agar ortamı dökün. Tarayıcı odağı, plakalara farklı hacimlerde agar eklenmesine izin verecek şekilde ayarlanabilir olsa da, standart plaka hacmi 8 mL'dir.
- Nematod kullanımı
- Popülasyon büyüklüğü: Tek bir tabakta güvenilir bir şekilde görüntülenebilen nematod sayısı, genotipe, nematodların kaplanma yaşına ve her tabağa eklenen yiyecek miktarına bağlıdır. Erken yetişkinlikte başlayan yaşam boyu deneyler için, plaka başına yaklaşık 40 hayvan yükleyin. Bu sayı yeterli yiyecek sağlar ve kalabalığı önler.
- Büyüyen büyük popülasyonlar: Popülasyon genişlemesi ve senkronizasyonuna hazırlanmak için, seçilen senkronizasyon yöntemine uygun bir nematod popülasyonu ile başlayın (aşağıya bakın). Yabani tip N2 hayvanlar için yetişkinliğin 2. günü olan maksimum yumurta üretim yaşlarında hayvanlar üzerinde senkronizasyon gerçekleştirmeyi hedefleyin32.
NOT: Hayvanları yetişkinliklerinin ikinci gününde kullanarak popülasyonları senkronize etmenin bir başka nedeni, anne yaşını popülasyon heterojenliğine katkıda bulunan bir faktör olarak kaldırmaktır. C'deki anne yaşı. Elegans'ın döllerde birden fazla uygunluk özelliğini etkilediği gösterilmiştir ve 2. gün vahşi tip hayvanlar "en yüksek kalitede" döl33'ü üretir. - Yaş senkronizasyonu gerçekleştirme: Doğru sonuçlar elde etmek için hayvanların yaşını mümkün olduğunca hassas bir şekilde senkronize edin. Bu protokolde, modifiye edilmiş bir hipoklorit tedavisi34 kullanılarak yaş senkronizasyonu gerçekleştirilir. Diğer yöntemler, yumurta bırakma, L1 larva tutuklaması veya L4 larvalarını manuel olarak toplama ile senkronizasyonu içerebilir.
NOT: Hipoklorit tedavisi ile yaş senkronizasyonu için, her yetişkin hermafroditten üç ila dört yumurta elde etmeyi bekleyin. - Dölsüz popülasyonların korunması: Nematodları geç L4 evrelerinde 5-floro-2'-deoksiüridine (FUdR)35 maruz bırakarak dölsüz popülasyonları koruyun.
NOT: Düşük dozlarda FuDR, germ hattında makroskopik olarak gözle görülür değişiklikler üretmeden veya oosit üretim hızını değiştirmeden embriyoların gelişmesi için öldürücüdür. Diğer yöntemler arasında sıcaklık steril mutantların kullanılması, sterilize edici RNAi yapılarının kullanılması veya nematodların görüntüleme için plakalara aktarılması için üreme sonrası yaşlanmaya kadar beklemesi yer alır. - Popülasyonların aktarılması: Binlerce hayvanı plakalar arasında aktarırken, platin/iridyum teli içeren standart protokol zahmetli hale gelir. Nematodların sıvı süspansiyonunu içeren yöntemler, transferleri kolaylaştırır ve daha verimli hale getirir. Nematodları M9 + Mg tamponu (Na2HPO4 42.27 mM, KH2PO4 22.05 mM, NaCl 85.56 mM, MgS4 1 mM) ile toplayın, nematodlar yerçekimi ile çöktüğünde toplam hacmi azaltın ve ardından nematodları görüntüleme için kullanılan plakalara hızla aktarın.
NOT: Nematodların sıvı süspansiyon yoluyla aktarılması, her bir plakaya aktarılan hayvan sayısında değişikliğe neden olabilir. Deneysel değişkenliği önlemek için her plakadaki nematod sayısıyla tutarlı olmaya çalışın. - Müdahalelerin uygulanması: Bir deney sırasında görüntü alımını durdurmak ve yeniden başlatmak, görüntü analizini karmaşıklaştırır (tartışmaya bakın). Bu nedenle, LSM deneylerine ancak gerekli tüm nematod işlemleri tamamlandıktan sonra başlayın.
- Kauçuk paspasların sterilize edilmesi: Çok sayıda paspası aynı anda alüminyum folyoya ayrı ayrı sararak otoklavlayın.
NOT: Mantar veya bakteriyel kirleticilerin birikmesini önlemek için kauçuk paspaslar kullanımlar arasında sterilize edilmelidir. Tipik olarak kullanılan çoğu kauçuk türü, agresif etanol işlemiyle bozunur.
3. Deneme gününde kurulum yapın
- Plaka desteği ve tarayıcı camı hazırlığı: Plaka kullanımını basitleştirmek için, Petri kaplarını doğrudan tarayıcı yüzeyine yüklemeyin, bunun yerine cam bölmelerle desteklenen kauçuk paspaslar kullanarak yerinde tutun (Malzeme Tablosuna bakın). Popülasyonlar bu camdan görüntülenir, bu nedenle camı temiz tutun ve buğu önleyici, hidrofobik ve sterilize edici kaplama ile işlemden geçirin ( Malzeme Tablosuna bakın).
- Plakaları inkübatöre yüklemeden önce, plaka destek camının her iki tarafındaki yüzeyini buğu önleyici cam temizleyici ile temizleyin.
- Plakaları destek camlarına yerleştirmeden önce, camın kauçuk paspasla temas edecek tarafında buğulanmayı en aza indirmek için koruyucu bir hidrofobik cam işlemi uygulayın ( Malzeme Tablosuna bakın). Bu tedaviyi iyice yayın ve bir sonraki adıma geçmeden önce 5-10 dakika camda bırakın. Kalıntıları gidermek için uygulamadan sonra kuvvetlice temizleyin.
- Kauçuk mat ile temas edecek camın yüzeyini dezenfekte etmek için% 70 etanol uygulayın. 1 dakika veya 2 dakika bekletin ve ardından bir bez veya kağıt havluyla çıkarın.
- Plakaların tarayıcılara yüklenmesi
- İlk olarak, otoklavlanmış kauçuk paspasları işlenmiş plaka destek camının üzerine yerleştirin.
- Yüklü nematodlarla görüntüleme için kullanılan plakaların kapağını çıkarın ve cam yüzeye bakan kauçuk paspas yerlerine yerleştirin. Kauçuk paspasın tüm plakaların etrafına sıkıca kapatıldığından emin olun, örneğinample, üstüne başka bir cam levha ekleyerek ve düz durmasını sağlayarak veya her bir plakanın üstüne vurarak (gevşek plakalar hafifçe hareket eder ve cama çarparak ses çıkarır, sıkıca sabitlenmiş plakalar dokunulduğunda hareket etmez).
NOT: Her bir plaka destek camı tabakasını, plaka içeriği ve amaçlanan tarayıcı hakkında bilgi içeren işaretleme bandı ile ayrı ayrı etiketlemek yararlıdır. Bu veriler, deneyden sonra plaka konumlarıyla ilgili olası belirsizlikleri çözmek için kullanılabilir. - Plakaları tarayıcılara yüklemeden önce, plaka yükleme sırasında deneycinin parmaklarını korumak için tarayıcı fanlarının fişini çekin.
- Plakaları ve onları destekleyen cam levhayı yavaşça tarayıcının yüzeyine kaydırın.
NOT: Paspasın plaka destek camı boyunca kaymasına neden olabileceğinden, doğrudan kauçuk paspasa basınç uygulamaktan kaçının. Paspaslar kaydığında, plakalar genellikle paspastan gevşer. - Tarayıcı fanlarını yeniden etkinleştirin ve ön ve yan fanlara güç verildiğini görsel olarak onaylayın. Tarayıcılar kapalıysa, bu noktada açın.
4. Ön görüntü alımı
NOT: Görüntü alımı sırasındaki tüm yazılım tabanlı adımları özetleyen kapsamlı bir akış şeması Şekil 1'de gösterilmektedir.
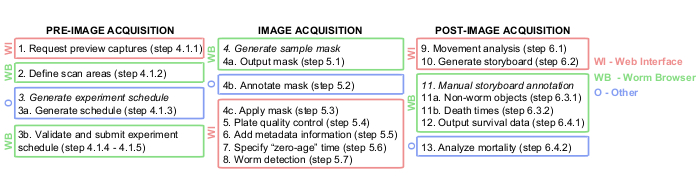
Şekil 1: Lifespan Machine görüntü analizi ardışık düzenine grafiksel genel bakış. Görüntü alma öncesi, sırası ve sonrası adımlar büyük ölçüde web arayüzünde (WI, kırmızı) ve Solucan Tarayıcısında (WB, yeşil) gerçekleştirilir. Adım 3a'daki TXT belgeleri, adım 4b'deki Photoshop veya eşdeğeri ve adım 13'teki JMP veya eşdeğeri gibi bazı adımlar diğer platformlarda (O, mavi renkte) gerçekleştirilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
- Görüntü alma kurulumu: Görüntü alımını yapılandırmak için deney zamanlamasını ve her tarayıcıdaki plakaların konumunu belirten bir dosya oluşturun.
NOT: Bu dosya, denemenin başlığı, görüntü yakalama sıklığı ve denemenin toplam süresi gibi önemli meta verileri içerir. Genellikle, bu dosya oluşturulmaz de novo ancak bunun yerine, her deneme için önceki denemelerden gelen deneme dosyaları şablon olarak yeniden kullanılır. Kullanıcının ilk denemesi için bir şablon dosyası sağlanır (Ek Dosya 1).- Önizleme yakalamaları iste: Her tarayıcıdaki tüm plakaların konumunu sağlayın. Bu süreci hızlandırmak için çeşitli araçlar sağlanmıştır. İlk olarak, "Önizleme yakalama" adı verilen tüm tarayıcı yüzeyinin bir görüntüsünü elde etmek için tarayıcıyı kullanın. Önizleme yakalama görüntülerinin, görüntülenecek her bir plakanın tüm yüzeyini çizgiler veya plaka kenarlarının kırpılması olmadan net bir şekilde gösterdiğinden emin olun (Şekil 2A).
- Web arayüzünü kullanarak ana sayfanın Görüntü Alma bölümünü bulun ve Yakalama Aygıtları ve Görüntü Sunucuları adlı bağlantıyı takip edin. Bu sayfada, Görüntü Yakalama ve İşleme Sunucuları kutusunda Yeni Cihazları (yani tarayıcıları) Ara işaretli düğmeye tıklayın. Sunucunun yanındaki [log] bağlantısına tıklayarak sunucunun tarayıcıları algılamadaki ilerlemesini izleyin.
NOT: Bu adımı gerçekleştirmeden önce istenen tarayıcıların "açık" olduğundan ve sunucuya takılı olduğundan emin olun. - Web arabiriminin aynı sayfasında, sunucuya bağlı her tarayıcının Görüntü Yakalama Aygıtları kutusunda göründüğünden emin olun. Cihaz başarıyla algılanırsa, "Mevcut durum" altındaki "Eksik" etiketi artık görüntülenmez. Yeni yüklenen plakaları içeren her tarayıcıya karşılık gelen onay kutusunu seçin.
- Görüntü Yakalama Aygıtları bölümünün alt kısmında, Önizleme Yakalama İste düğmesine tıklayın. 1 dakika veya 2 dakika içinde tarayıcılar yanmalı ve taramaya başlamalıdır.
NOT: Cam destek levhalarının başlangıç konumu, tüm plakaları görüntülenebilir aralığa getirmek için genellikle ayarlanmalıdır. Konumlar, önizleme yakalama görüntülerini inceleyerek ve plaka konumunda ayarlamalar yaparak ve yeni önizleme yakalama görüntülerini yeniden çekerek düzeltilebilir. Taramalar çok yavaş ilerliyorsa (bir yakalama taraması için birkaç dakika) veya önizleme yakalama görüntüleri uzun beyaz çizgiler içeriyorsa, bu, bir plakanın, kauçuk paspasın veya başka bir nesnenin tarayıcının kalibrasyon bölgesinde ışığı engellediğinin bir işaretidir (tarayıcı yüzeyinde beyaz oklarla gösterilir). Tüm nesneler, yalnızca cam destek camı bu bölgeyi kaplayacak şekilde yeniden konumlandırılmalıdır.
- Web arayüzünü kullanarak ana sayfanın Görüntü Alma bölümünü bulun ve Yakalama Aygıtları ve Görüntü Sunucuları adlı bağlantıyı takip edin. Bu sayfada, Görüntü Yakalama ve İşleme Sunucuları kutusunda Yeni Cihazları (yani tarayıcıları) Ara işaretli düğmeye tıklayın. Sunucunun yanındaki [log] bağlantısına tıklayarak sunucunun tarayıcıları algılamadaki ilerlemesini izleyin.
- Tarama alanlarını tanımlayın: Önizleme yakalama görüntülerini analiz etmek için Solucan Tarayıcı'daki sonraki adımları izleyin ve bunları, veri analizi için her bir plakanın konumunu belirtmek için kullanılan tek bir bileşik görüntüde birleştirin. Ortaya çıkan görüntünün Şekil 2B'ye benzer göründüğünden emin olun.
- İlk olarak, Solucan Tarayıcısını kullanarak, Dosya > Görüntü Aç menü seçeneğini seçerek her önizleme yakalama görüntüsünü açın ve istediğiniz görüntüyü seçin.
- Her görüntüde, plakalı bölgelerin sütunlarını seçmek için tıklayın (kauçuk paspasın 16 plaka konumu varsa, 4 sütun seçin).
NOT: Tarama bölgeleri, daha geniş bölgeler için tarayıcı yakalama daha yavaş olduğundan ve nematod hareketi nedeniyle bulanık görüntülere neden olduğundan, uzun sütunlar (geniş satırlar değil) olarak belirtilmelidir. - Tüm görüntüler tanımlandıktan sonra, Görüntü Alma > Tarama alanlarını tanımla > Seçilen tarama alanlarını diske kaydet menü öğesini seçip istediğiniz konumu seçerek bölge özelliklerini diske aktarın.
- Deneme zamanlamasını oluşturun:
- Ek Dosya 1'in formatını izleyerek, deney adını, tarayıcılardaki her sütunun fiziksel konumlarını (adım 4.1.2.3'te oluşturulan tarama alanları dosyasından kopyalanır), deneyin toplam süresini ve görüntü yakalama sıklığını içeren bir dosya oluşturun ve bunu hem TXT hem de XML dosyası olarak kaydedin.
- Ardından, Worm Browser'da Görüntü Edinme > Deney Programını Gönder'e tıklayın ve oluşturulan XML dosyasını seçin. Solucan Tarayıcısı, zamanlamanın bir özetinin çıktısını alıp almayacağını veya denemeyi çalıştırıp çalıştırmayacağını soracaktır. Özet dosyası oluştur'a tıklayın.
- Özet dosyasını doğrulayın: Deney programını gönderdikten sonra, Solucan Tarayıcısı programın bir özetini çıkaracaktır. Bu özet ekranda gösterilir ve diske yazılır. Okuyun ve zamanlanmış yakalamaların tarihlerinin yanı sıra tarayıcıların konumunu, adını ve sayısını doğrulayın.
- Deneme zamanlamasını gönderin: Özet dosyasından memnun kaldığınızda, Görüntü Alma > Deney Zamanlamasını Gönder menü seçeneğini belirleyerek deney zamanlaması için XML dosyasını Solucan Tarayıcısına yeniden yükleyin. Solucan Tarayıcısı ikinci kez zamanlamanın bir özetinin çıktısını mı yoksa denemeyi mi çalıştıracağını sorar. Bu sefer tıklayın Çalıştır! .
NOT: Denemeyi gönderdikten birkaç dakika sonra, denemenin başarıyla gönderildiğini ve taramaların tüm tarayıcılar tarafından toplandığını doğrulamak için web arayüzünü kullanmak akıllıca olacaktır. Özellikle büyük deneylerde ilk birkaç taramanın kaçırılması olağandır. - Deneyleri web arayüzünde düzenleyin: Meşgul bir tarayıcı kümesi, birçok farklı kullanıcı tarafından toplanan yüzlerce deneysel veri kümesi üretebilir. Bu listeyi düzenlemek için, denemeleri ayrı gruplara atayın (örneğin, denemeden sorumlu kullanıcının adına karşılık gelir).
- Yeni bir grup oluşturun veya mevcut bir grubu değiştirin: Görüntü Edinme adlı kutunun altındaki Deneme Gruplarını Yönet'e tıklayarak web arayüzünde yeni gruplar oluşturun. Karşınıza çıkacak olan yeni sayfada, Yeni Grup Oluştur'a istediğiniz adı ekleyin ve Oluştur'a tıklayın. Var olan bir grubun adını değiştirmek için, aynı kutuda, Varolan Grubu Değiştir'in yanında istediğiniz grubu seçin ve ardından Değiştir'i seçin.
- Denemeleri bir gruba atama: Belirli bir gruba yeni denemeler atamak için web arayüzüne gidin ve varsayılan olarak deneme listesinin altındaki Grup Yok grubuna atanacak olan istediğiniz denemeyi bulun. Deneme bölümünün sağ tarafında Düzenle yazan bağlantıyı tıklayın ve kullanılacak grubun adını seçmek için açılır listeyi kullanın. Ardından Kaydet'i seçin.
- Denemeyi iptal etme:
NOT: LSM, deney programında son taramalar belirtilene kadar bağımsız olarak çalışmaya devam edecektir. Deneysel bir zamanlama tamamlandıktan sonra, LSM varsayılan olarak taramaları toplamaya devam eder, ancak otomatik tarama adı verilen bir işlemde görüntü verilerini hemen atar. Bu otomatik taramalar, tarayıcıların kapanmasını ve soğumasını önlemek ve aynı alanda (ancak farklı bir deneyden) çalışan diğer deneylerin diğer tarayıcıların kapatılmasından etkilenmemesi için standart bir sıcaklık profilini korumak için gerçekleştirilir.- Otomatik taramaları durdurun: Web arayüzünde devam eden bir denemeden otomatik taramaları durdurmak için, istediğiniz denemenin yanındaki Düzenle'ye tıklayın, ardından Bekleyen Taramaları İptal Et'e tıklayın ve Zamanlanmış Yakalamaları İptal Et'i seçin.
- Önizleme yakalamaları iste: Her tarayıcıdaki tüm plakaların konumunu sağlayın. Bu süreci hızlandırmak için çeşitli araçlar sağlanmıştır. İlk olarak, "Önizleme yakalama" adı verilen tüm tarayıcı yüzeyinin bir görüntüsünü elde etmek için tarayıcıyı kullanın. Önizleme yakalama görüntülerinin, görüntülenecek her bir plakanın tüm yüzeyini çizgiler veya plaka kenarlarının kırpılması olmadan net bir şekilde gösterdiğinden emin olun (Şekil 2A).
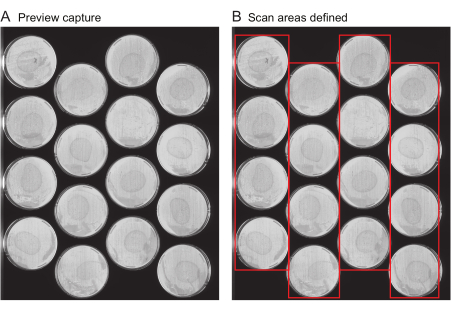
Şekil 2: Önizleme yakalama görüntüsü ve tarama alanı seçimi. (A) Denemedeki her tarayıcı için bir önizleme yakalama görüntüsü oluşturulur. (B) Tarama hızını artıran ve çok geniş tarama alanlarının bir sonucu olarak solucan hareket bulanıklığını önleyen her seferinde bir sıra plaka seçimi (kırmızı kutular). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
5. Görüntü edinme
NOT: Aşağıdaki adımlar hem deneme çalışırken hem de tamamlandıktan sonra gerçekleştirilebilir.
- Deneyin maske dosyasının çıktısını alın: Tarayıcılardan alınan ham görüntü verileri, işlenmesi gerekmeyen birçok alan içerir (plakaların dışındaki alanlar). Analizi her bir plakaya ayrı ayrı odaklamak için, her bir plakanın her tarayıcıda kapladığı alanı belirten bir "maske" oluşturulur. Tarayıcılar tarafından toplanan görüntülerin üzerine her bir plakanın konumunu bir kaplama olarak çizerek bu maskeyi oluşturun.
- Solucan Tarayıcısı'nı kullanarak Dosya > Geçerli Denemeyi Seç'i seçerek istediğiniz denemeyi seçin ve ardından deneme adına tıklayın.
- Yine Worm Browser'da Image Acquisition > Define Sample Masks > Generate Experiment Mask Composite'i seçin ve maskeyi istediğiniz konuma kaydedin. Ortaya çıkan dosyanın Şekil 3A'ya benzer göründüğünden emin olun.

Şekil 3: Örnek maskeler kullanılarak her tarayıcı için plaka konumlarının belirlenmesi. Şekil 1'de gösterilen kolon seçimleri içindeki plakaların bağımsız analizini sağlamak için, bir görüntü maskesi kompoziti oluşturularak tek tek plakalar tanımlanmalıdır. (A) Tarayıcıların taramalarının bir görüntüsü, bir görüntü işleme yazılımıyla açılır (taranan bir seçimin üzerindeki tarayıcının adını "han" ve sütunların her birine atıfta bulunan "a-d" harfini not edin). (B) Maske kompozitindeki her bir plakanın konumunu işaretlemek için maske oluşturmanın bireysel adımları, arka planın siyah olarak ayarlanmasını, (C) arka planın genişletilmesi ve ardından küçültülmesiyle seçilmemiş plakaların pürüzlü kenarlarının ve kenarlarının kaldırılmasını ve (D) ön plan plakalarının seçilmesini ve alanların tamamen beyaz piksellerle doldurulmasını gerektirir. (E) LSM'nin taranan satırlardaki tek tek plakaları tanıması için, bir satırdaki her beyaz bölge, genellikle artan parlaklıkta farklı bir gri tonuyla doldurulur. (F) Bu aşamada, maske kaydedilir (Photoshop'ta oluşturulmuşsa, katman belirtilmemiş LZW sıkıştırması). Maske daha sonra Solucan Tarayıcısı tarafından taranır ve maskenin yazılım tarafından görselleştirilmesi oluşturulur. Doğru bir maske görselleştirmesi, ortada küçük bir çarpı işareti ve her satır için farklı bir renk ile plaka başına tanımlanmış bir kare göstermelidir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
- Deneyin maskesine açıklama ekleyin: Görüntüdeki her bir plakanın konumunu işaretlemek için önceki adımda oluşturulan dosyayı bir görüntü işleme programıyla (Photoshop veya GIMP gibi) açın. Photoshop kullanarak tüm maske düzenleme adımlarına genel bir bakış aşağıda açıklanmıştır.
- Photoshop'ta, tolerans sıfıra ayarlı, bitişik seçeneği seçili ve kenar yumuşatma seçili değilken Dolgu aracını seçin. Tamamen siyaha ayarlamak için gri arka plana tıklayın. Ortaya çıkan görüntünün Şekil 3B'ye benzer göründüğünden emin olun.
- Kenar yumuşatma kapalı, tolerans sıfır ve bitişik seçenek seçili olarak siyah arka planı seçmek için sihirli değnek aracını kullanın. Kenarları yumuşatmak için, Seç > Değiştir > Genişlet'e tıklayarak seçilen arka planı 30 piksel genişletin. Ardından, > Sözleşmesini Seç > Değiştir'de seçimi 20 piksel küçültün. Ortaya çıkan görüntünün Şekil 3C'ye benzer göründüğünden emin olun.
- Düzgünleştirilmiş arka planı tamamen siyah piksellerle doldurun (örneğin, Dolgu aracı toleransını 255 olarak ayarlayıp seçili bölgeyi doldurarak). Ardından, seçimi tersine çevirmek için Ters > Seç'e tıklayın ve ön planı seçin. Örneğin, dolgu aracı toleransını 255 olarak ayarlayarak ve bölgeyi beyazla doldurarak yeni bölgeyi tamamen beyaz piksellerle doldurun. Ortaya çıkan görüntünün Şekil 3B'ye benzer göründüğünden emin olun.
- Her plakayı tek bir bölge içinde ayırmak için, parlaklığı artırarak her satırı farklı bir gri gradyanla doldurun. Bu, Dolgu aracıyla ve ardından tolerans 0 olarak ayarlanarak istenen rengi seçerek yapılabilir. Ortaya çıkan görüntünün Şekil 3E'ye benzer göründüğünden emin olun. "Katmanlar" belirtilmemiş bir LZW sıkıştırmasında kaydedin.
NOT: Plakaların sırası, belirtilen bölgelerin rengine göre belirlenir. Plakaları 1-4 arasında yukarıdan aşağıya doğru adlandırmak için, her satır için parlaklığı artırma bölümünde renkleri belirtin. - Solucan Tarayıcı'da, Görüntü Alma > Örnek Maskeleri Tanımla'yı > Deney Maskesi Kompozitinde Çizilen Plaka Konumlarını Analiz Et'i seçin ve önceki adımda oluşturulan dosyayı seçin. Yazılımın gönderilen maskeyi analiz etmesi birkaç dakika sürecektir.
- Solucan Tarayıcısı bir maske görselleştirmesi görüntüler. Maskeyi dosyadaki olası hatalara karşı inceleyin. Her plaka sırasının farklı bir renkle doldurulduğundan ve renkli bir dikdörtgenle çevrelendiğinden emin olun. Ortaya çıkan görüntünün Şekil 3F'ye benzer göründüğünden emin olun.
NOT: Tek bir plaka iki veya daha fazla daire gösteriyorsa veya iki daire aynı rengi paylaşıyorsa, maske dosyasını düzeltmek için adım 5.2'ye geri dönün ve Solucan Tarayıcı'ya yeniden yükleyin. - Maske görselleştirmesinin doğru olduğunu doğruladıktan sonra, Solucan Tarayıcı'da Görüntü Alma > Örnek Maskeleri Tanımla'yı > Analiz Edilen Deney Maskesi Bileşimi'ni Kümeye Gönder'i seçin. Görüntü analizi sunucusu şimdi deneydeki tüm plakaların konumunu analiz edecektir.
- Maskeyi uygulayın: LSM, ham görüntü verilerini ayrı plakalara bölmek için maskeler kullanır. Bu işlemi başlatmak için web arabirimini kullanarak bir maske uygulama işi zamanlayın.
- İşi göndermeden önce, tüm tarayıcıların maskedeki bölgeleri tanımladığını doğrulayın. Web arayüzünün ana sayfasına gidin, denemenin adını ve Görüntü Analizi adlı sütunu bulun ve Analizi Çalıştır'a tıklayın. Deneme Örnekleri altındaki tüm cihazların tanımlanmış bölgelere sahip olduğunu doğrulayın.
- Maskeyi uygulamak için aynı arayüzde Tüm Örnekler için Yeni İş'e tıklayın. Tek Tek Görüntüler için İş Planla adlı kutuda, Maske Uygula kutusunu ve ardından İşi Kaydet'i seçin.
NOT: Maske, halihazırda çekilmiş olan tüm görüntülere ve gelecekte yakalanacak tüm görüntülere uygulanacaktır.
- Plaka kalite kontrolünü gerçekleştirin:
NOT: Kirlenme, kuruma veya buğulanmadan muzdarip plakalar, görüntü analizinin bu aşamasında sansürlenir. Kirlenmiş, kurumuş, buğulanmış ve optimal plakaların bir örneği Şekil 4'te gösterilmektedir. Sansürlemenin diğer nedenleri arasında açlık, boş tabaklar veya steril popülasyonlardaki larvalar yer alır. Geçersiz plakalar genellikle makinenin nematodlar olarak yorumlamayı amaçladığı karmaşık şekiller içerecektir. Görüntü analizinin sonraki adımlarında uzun işlem sürelerini önlemek için bu adımda geçersiz plakaların hariç tutulması önemlidir.- Web arayüzünü kullanarak, istediğiniz deneyi ve Plaka Bilgilerine Açıklama Ekle adlı sütunu bulup Resme Göre'yi seçerek sansürlenecek kalıpları hariç tutun.
- Plakaları incelemek için Resimleri görüntüle'ye tıklayın.
NOT: Görüntüleri görüntüleme adımı düzgün çalışmıyorsa, Linux sunucusu düzgün yapılandırılmamış olabilir. Bunun nasıl yapılacağına ilişkin talimatlar, yukarıda belirtilen GitHub deposundaki yazılım yükleme kılavuzunda mevcuttur. - Plakaları hariç tutmak için, Sansür kutusunu işaretleyin, açılır kutuda Sansürlenme Nedeni adlı bir seçenek belirleyin ve ardından her sayfa için Kaydet'e tıklayın.
- Meta veri bilgisi ekleme: Meta veriler, bir deneydeki her bir plakanın içeriğini tanımlar. Bu bilgiler daha sonra oluşturulan tüm istatistiksel veri dosyalarına dahil edilir.
- Suş, genotip, sıcaklık, yiyecek vb. ile ilgili meta veri bilgileri eklemek için web arayüzünün ana sayfasına gidin, istediğiniz deneyi ve Plaka Bilgilerine Açıklama Ekle adlı sütunu bulun ve Konuma Göre'yi seçin.
- Etiketleri girin ve sol alt köşedeki Cihazlara Kaydet'e tıklayarak meta verilerin kaydedileceği tarayıcıları seçin.
- Tüm etiketleri tekrar girmek zorunda kalmadan farklı tarayıcılar arasında meta verileri yeniden kullanmak için sağ üst köşedeki Cihazdan Yükle'ye gidin, meta verilerin yeniden kullanılacağı tarayıcıyı seçin ve Cihazdan Yükle'ye tıklayın.
- "Sıfır yaş" zamanını belirtin: Varsayılan olarak, LSM zamanı UNIX döneminin başlangıcına göre ölçer. Bu nadiren uygundur, bu nedenle bir referans zamanının belirtilmesi gerekir (örneğin, tüm bireylerin yumurtadan çıktığı veya yetişkinliğe ulaştığı tarih).
- Sıfır yaş süresi bilgilerini belirtmek için web arayüzünün ana sayfasına gidin, istediğiniz denemeyi ve Görüntü Analizi adlı sütunu bulun ve Analizi Çalıştır'ı seçin.
- Görüntülenen yeni sayfada, Tüm Bölgeler için Yeni İş'i seçin. Bölge Bilgilerini Güncelle adlı kutuda, Hayvanların 0 Yaşına Sahip Olduğu Saat'i seçin, bilgileri ekleyin ve ardından Seçili Alanları Güncelle'ye tıklayın.
NOT: Tüm hayvanlar aynı sıfır yaş süresini paylaşmıyorsa, bunun yerine Belirli Hayvan Türleri için Yeni İş'i seçin ve her grup için yukarıdaki adımları tekrarlayın.
- Solucan tespitini planlayın: LSM, plaka üzerindeki konumuna bağlı olarak her nematodun tespitini otomatikleştirebilir.
- Her görüntü için nematodların otomatik olarak algılanmasını başlatmak için web arayüzünün ana sayfasına gidin, istediğiniz deneyi ve Görüntü Analizi adlı sütunu bulun ve Analizi Çalıştır'ı seçin.
- Karşınıza çıkacak olan yeni sayfada, Tüm Bölgeler için Yeni İş'e tıklayın, ardından Bireysel Görüntüler için İş Planla adlı kutuya tıklayın ve Medyan Filtresi > Eşik > Solucan Algılama > İşi Kaydet kutularını seçin. Bu işler, yakalanan tüm geçmiş ve gelecek görüntülere uygulanacaktır.
NOT: Bir işi yalnızca belirli bir tür veya koşul için planlamak için, bunun yerine Belirli Hayvan Türleri için İşler'e tıklayın. Nesne sınıflandırması, LSM'nin uzun süreli depolama dizininin Modeller alt klasöründe depolanan dosyalar olarak belirtilen SVM modelleri kullanılarak gerçekleştirilir. LSM için V2.0 nematod algılama parametre kümeleri GitHub deposundan indirilebilir.
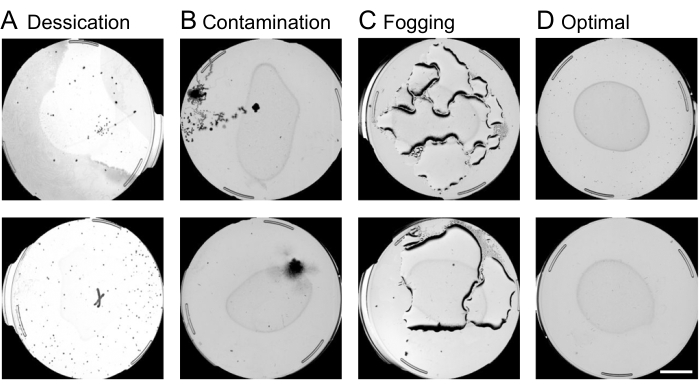
Şekil 4: Web arayüzünü kullanarak plaka kalite kontrolü. Solucan hareketi analizinden önce web arayüzündeki optimal olmayan plakaların sansürlenmesi, görüntü işleme hattını hızlandırmak için çok önemlidir. Çıkarılmaya tabi plakaların örnekleri, (A) kuruma, (B) kontaminasyon veya (C) buğulanma koşullarını içerir. (D) Daha fazla analize dahil edilecek en uygun plakalar. 10 mm'lik bir ölçek çubuğu, önizleme yakalama görüntüsünün üzerine bindirilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
6. Görüntü elde etme sonrası
NOT: Solucan tespiti tamamlandıktan sonra, deneyden toplanan tüm veriler, her bir bireyi yaşamları boyunca izlemek ve tüm bireylerin ölüm zamanlarını belirlemek için zaman içinde toplanmalıdır. Deneydeki tüm hayvanlar ölene ve tüm solucan algılama işleri tamamlanana kadar bekleyin ve ardından aşağıdaki adımları gerçekleştirin:
- Hareket analizini planlayın:
- Hareket analizi, ölüm sürelerini tahmin etmek için zaman içindeki tüm deneysel verileri bütünleştirir. Bu işi başlatmak için web arayüzünün ana sayfasına gidin ve Görüntü Analizi adlı sütunda istediğiniz deneyi bulun. Analizi Çalıştır bağlantısını seçin.
- Görünen yeni sayfada, Tüm Bölgeler için Yeni İş bağlantısına tıklayın ve açılır menüden Tüm Bölge için Bir İş Planlayın, Solucan Hareketini Analiz Et'i seçin ve İşi Kaydet düğmesine tıklayın.
- LSM görüntü alma sunucusu, tüm plakalardaki hareketi otomatik olarak analiz etmeye başlayacaktır.
NOT: Hareket analizi en büyük iştir. Modern bir çok çekirdekli işlemcide, 1 aylık bir kullanım ömrü deneyinden elde edilen her bir plakanın analizi 20 dakika veya daha fazla sürebilir.
- Bir film şeridi oluşturun: Hareket analizi tamamlandıktan sonra, LSM film şeridi, kullanıcıların otomatik sonuçları manuel olarak doğrulamasına ve yazılımın nematod morfolojisi ve davranışı hakkında doğru varsayımlarda bulunduğundan emin olmasına olanak tanır.
- Web arayüzünün ana sayfasında, istediğiniz denemeyi ve Görüntü Analizi adlı sütunu bulun ve Analizi Çalıştır'ı seçin. Görüntülenen yeni sayfada, Yeni Deneme İşi'ne tıklayın. Ardından, Tüm Bölge İçin İş Planla bölümünde Hayvan Görsel Taslağı Oluştur'u seçin ve İşi Kaydet'e tıklayın.
- LSM film şeridini oluşturmayı bitirdikten sonra Solucan Tarayıcısı'na gidin ve istediğiniz denemeyi seçin. Ana menüye geri dönün, Doğrulama'yı seçin > Her Solucanın Ölümünden Hemen Sonra Tüm Deneye > Gözatın.
- Solucan Tarayıcısındaki storyboard'lara açıklama ekleyin: Solucan Tarayıcısındaki tipik bir film şeridi şöyle görünmelidir Şekil 5.
- "Solucan olmayan" nesnelere açıklama ekleme
NOT: Hareket sırasında algılanan her nesne, tahmini ölüm süresine göre sıralanmış olarak film şeridinde gösterilir. Kullanıcı aksini belirtmedikçe, her nesne ortaya çıkan hayatta kalma eğrilerine dahil edilecektir. LSM nesne sınıflandırması, tespit edilmemiş nematodların sayısını en aza indirmek için bir değiş tokuş olarak, yüksek bir yanlış pozitif oranına sahip olacak şekilde kasıtlı olarak kalibre edilmiştir. Solucan olmayan nesnelerin hariç tutulması, yüksek kaliteli hayatta kalma eğrileri elde etmek için önemlidir (temsili sonuçlara bakınız). Film şeridinin ilk ve son sayfalarında tipik olarak çok sayıda solucan olmayan nesne bulunur ve bunlar toplu olarak hızlı bir şekilde manuel olarak hariç tutulabilir.- Film şeridinde solucan olmayan nesneleri dışlamak için, nesnenin görüntüsüne bir kez sağ tıklayın. Hariç tutulan nesne artık beyaz bir kutuyla çevrelenecektir. Birçok nesneyi aynı anda dışlamak için, kontrol tuşunu basılı tutun ve herhangi bir nesneye bir kez sağ tıklayın, film şeridi sayfasındaki tüm nesneler hariç tutulacaktır.
- Bir nesneyi analizden çıkardıktan sonra, bu nesne tekrar iki kez sağ tıklanarak yeniden dahil edilebilir.
- Film şeridi ek açıklaması sırasında yapılan ek açıklamaları kaydetmek için Kaydet düğmesine tıklayın. Açıklama eklerken ilerlemeyi sık sık kaydetmeniz önerilir.
- Ölüm zamanlarına açıklama ekleyin:
NOT: Kullanıcı müdahalesi olmadan, LSM çoğu popülasyon için ölüm sürelerini doğru bir şekilde tahmin eder. Bununla birlikte, her deneyden rastgele bir birey alt kümesini manuel olarak doğrulayarak otomatik sonuçların doğruluğunu rutin olarak onaylamanız önerilir. Otomatik analizdeki herhangi bir hata bu gruplarda kümelenme eğiliminde olduğundan, en kısa ve en uzun ömürlü bireylere daha fazla dikkat edilmelidir.- Film şeridindeki herhangi bir nesneye bir kez sol tıklayarak o nesneyle ilgili ayrıntılı, zaman serisi bilgilerini görüntüleyen yeni bir pencere açın. Bu pencere, deney boyunca nesneden toplanan tüm görüntülerin incelenmesine ve ayrıca nesnenin hareket dinamiklerinin ve morfolojisinin ölçülmesine olanak tanır. Aynı arayüzü kullanarak ölüm zamanlarına manuel olarak açıklama ekleyin. Ölüm zamanı açıklaması için arayüz Şekil 6'da gösterilmiştir.
- Ölüm zamanlarına manuel olarak açıklama eklemek için, ölüm zamanına karşılık gelen noktada alt çubuğa sol tıklayın. Zaman dilimleri arasında hareket etmek için klavyenin boşluk çubuğunu ve sağ veya sol oklarını kullanın veya istediğiniz zaman diliminde doğrudan çubuğa tıklayın.
NOT: Görselleştirme, x ekseni işaretleme süresine sahip yatay bir çubuk grafik gibi, hayvanların zaman içindeki hareket durumunu temsil eder. Pembe/mor bölüm, nesnenin kuvvetli bir şekilde hareket ettiği süreyi, sarı zayıf hareketi, kırmızı hareket etmeyen hayvanları ve yeşil, ölümle ilişkili genişleme dönemini gösterir. Nematodlar, ölümle ilişkili karakteristik morfolojik olaylar gösterir: genellikle ölümden önce meydana gelen kademeli bir vücut kasılması, ardından ölüm sırasında veya hemen sonrasında hızlı bir vücut genişlemesi (Şekil 6B). Toz veya gölgeler gibi solucan olmayan nesneler, bu dinamikleri vücut boyutunda göstermezler ve bunun yerine, tipik olarak zaman içinde boyut ve yoğunlukta doğrusal, kademeli bir değişiklik izlerler. Bu farklı vücut büyüklüğü dinamikleri, hızlı sınıflandırma ve manuel dışlama için hızlı ve basit bir yöntem sağlar. - Analiz yaklaşımına bağlı olarak, ölüm zamanı ya hareketin durma zamanı (hareket görselleştirmesinde kırmızı çubuğun başlangıcı) ya da ölümle ilişkili genişleme zamanı (hareket görselleştirmesindeki yeşil çubuk) olarak düşünülebilir. Kasılma ve genişleme olaylarına manuel olarak açıklama eklemek için, istediğiniz zaman diliminde alt çubuğa sağ tıklayın.
- Bazı temel ölüm verileri görselleştirmeleri, Worm Browser istemcisinde yerel olarak sağlanır. Film şeridinde bulunan her popülasyon için hayatta kalma eğrileri ve ölüm zamanı teşhisi gösterilmektedir (Şekil 7). Sol taraftaki hayatta kalma eğrilerine ve film şeridinin sağ tarafındaki her birey için şiddetli hareket durdurma zamanını (VMC) ölüm zamanıyla karşılaştıran dağılım grafiğine bakın.
NOT: Bu sonuçları, belirli suşlar, tarayıcılar veya plakalar gibi koşullar için alt çubukta alt ayar yaparak farklı deneysel parametrelere göre gruplandırmak mümkündür. Bireysel solucanlar, VMC'ye karşı ölüm zamanı grafiğindeki tek tek noktalara sol tıklanarak ölüm zamanlarına göre seçilebilir.
- "Solucan olmayan" nesnelere açıklama ekleme
- Mortalite verilerinin diske yazılması: LSM, mortalite verilerini CSV dosyaları biçiminde üretir. Çıktısı alınan hayatta kalma eğrilerini çizin ve bunları R, SAS, STATA veya JMP gibi herhangi bir istatistiksel yazılımda analiz edin.
- Bu dosyaları oluşturmak için Solucan Tarayıcı'da deneyi seçin ve menüde Veri Dosyaları, Ölüm Zamanları'nı seçin ve ardından Geçerli Deney için Ölüm Süreleri Oluştur'a tıklayın. LSM, denemenin hayatta kalma verilerini içeren bir çıktı dosyası oluşturur ve bu dosya sonuçlar dizinine kaydedilir.
- Film şeridinde elle ek açıklamalar gerçekleştirildiyse, Solucan Tarayıcı'da elle ek açıklamaların nasıl işleneceğini soran bir istem görünecektir. Çıktısı alınan ölüm zamanları dosyasına elle ek açıklamalar eklemek için "Hemen"e tıklayın.
NOT: Mortalite veri dosyaları, imageserver.ini dosyasında belirtilen sonuçlar dizinine yazılır. Çeşitli dosyalar yazılır, ancak en yaygın kullanılan sürüm, film şeridi kullanılarak yapılan tüm manuel açıklamaları içeren "survival_simple/survival=machine_hand" sürümüdür. - Tercih edilen istatistik yazılımında mortalite verilerini analiz edin.
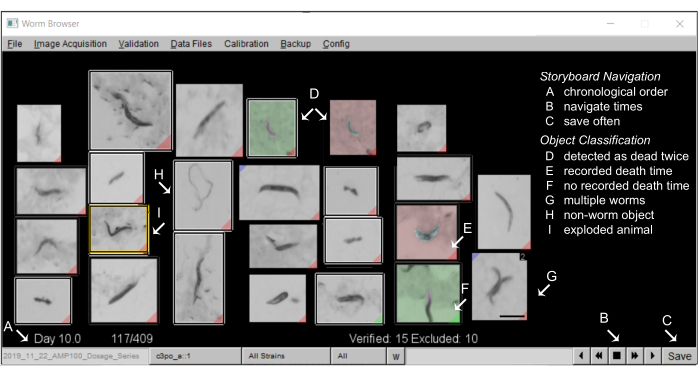
Şekil 5: Solucan Tarayıcı'daki hayvan film şeridi. (A) Tüm sabit solucanlar, makine açıklamalı ölüm zamanının kronolojik sırasına göre gösterilir. Film şeridinde gezinmek için sağ alt köşedeki (B) düğmelerine basın ve (C) ek açıklamaları sık sık kaydedin. (D) Gri olmayan bir arka plana sahip görüntüler, iki solucan birbirine yakın öldüğünde veya ölü solucanlar yoldan geçen bir solucan tarafından hareket ettirildiğinde ve böylece iki kez ölü olarak algılandığında meydana gelebilecek iki solucan ölüm olayını (erken ölüm yeşil, daha sonra ölüm kırmızı olarak) tasvir eder. (E) Bir görüntünün alt köşesindeki kırmızı bir etiket, tespit edilen bir ölüm zamanı olan solucanları tanımlar; (F) yeşil bir etiket, bir nesnenin ölüm zamanını kaydedecek kadar uzun süre hareketsiz kalmadığını gösterir. (G) Aynı karedeki birden fazla solucan, shift tuşuna basılarak ve sol tıklanarak işaretlenebilir. (H) Solucan olmayan nesneler sağ tıklatılarak analizin dışında tutulur. (I) Patlamış solucanlar, ilgili resme tıklanarak (elle bir açıklama penceresi açılır) ve shift tuşuna basılarak ve "hayvan patladı" mesajı görünene kadar sağ tıklanarak analizden sansürlenir. 0,5 mm'lik bir ölçek çubuğu ve etiketler, Solucan Tarayıcı penceresinin ekran görüntüsünün üzerine bindirilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
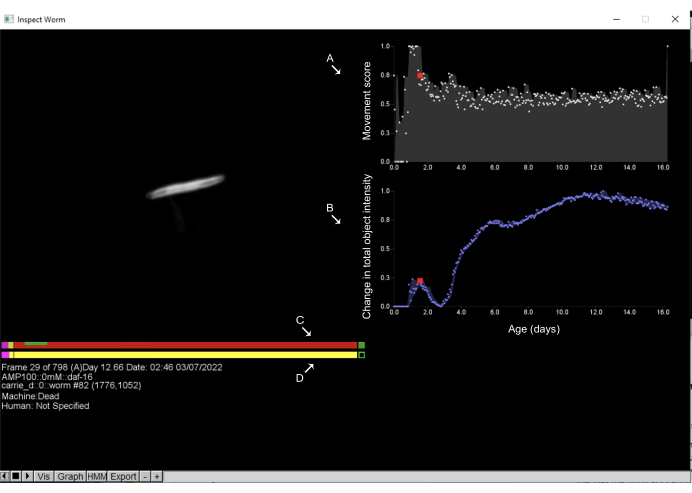
Şekil 6: Worm Browser'da nesneleri inceleme ve ölüm zamanlarının açıklamaları. Worm Browser film şeridindeki herhangi bir nesneye sol tıklamak yeni bir arayüz açar ve kullanıcının nesnenin hareket dinamiklerini incelemesine olanak tanır. Sağ tarafta, nesne hareketini ölçen (A) hareket puanı görüntülenir; Bu, ardışık gözlemler arasındaki piksel yoğunluklarındaki değişiklikle tahmin edilir. Ek olarak, sağ tarafta, (B) nesne boyutundaki değişiklikleri ölçen toplam nesne yoğunluğundaki değişiklik görüntülenir. Sol tarafta, üst çubuk (C) makinenin ölüm zamanı tahminini gösterirken, alt çubuk (D) insan el açıklamasıdır. Çubukların herhangi bir noktasına tıklamak ve boşluk tuşuna basmak, kullanıcının solucanın görüntülendiği zaman dilimleri arasında hareket etmesini sağlar. Bu çubuklarda pembe, şiddetli harekette geçirilen zamanı, kırmızı ölümde geçirilen zamanı ve sarı aradaki her şeyi temsil eder. Ölüm zamanından sonra genişleme ve büzülmede geçen süre yeşil renkle gösterilmiştir. Etiketler, bir Solucan Tarayıcısı penceresinin ekran görüntüsüne bindirilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
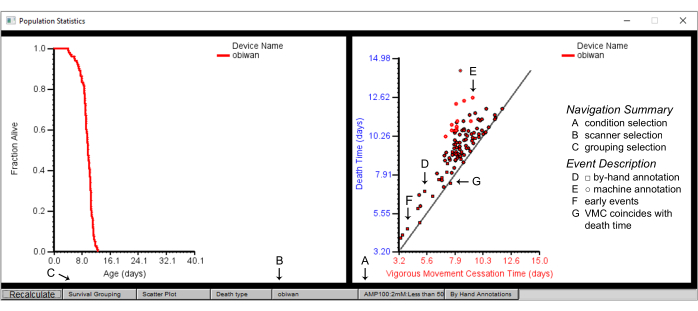
Şekil 7: Solucan Tarayıcısındaki nüfus özeti istatistikleri. Tarayıcı cihazı "obiwan" için popülasyon istatistikleri, hayatta kalma grafiği (sol panel) ve ölüm süresine karşı şiddetli hareket durdurma (VMC) süresinin dağılım grafiği (sağ panel). Çizilenler, (A) bir koşulun, (B) bir tarayıcıdan elde edilen ve önce (C) suşa göre hayatta kalma gruplaması seçilerek elde edilen ayrıntılardır. (D) Dağılım grafiğindeki kare şekiller elle açıklamalı olayları gösterirken, (E) dairesel şekiller makine açıklamalı olayları gösterir. (F) Erken meydana gelen ölüm olayları veya (G) şiddetli hareketin durma zamanının ölüm zamanına denk geldiği durumlar için genellikle elle açıklama gereklidir. Etiketler, bir Solucan Tarayıcısı penceresinin ekran görüntüsüne bindirilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Sonuçlar
Yaşam süresi deneylerinde deneysel tekrarlanabilirlik zordur ve yeterli istatistiksel çözünürlük elde etmek için hem sıkı bir şekilde kontrol edilen deneysel koşulları hem de büyük popülasyonları gerektirir 4,36. LSM, yüksek zamansal çözünürlüğe sahip sabit bir ortamda büyük hayvan popülasyonlarını araştırmak için benzersiz bir şekilde uygundur. LSM'nin kapasitesini göstermek, analizin önemli adımlarını vurgulamak ve araştı...
Tartışmalar
Burada, Lifespan Machine'in en son sürümünü kullanarak bir deney yapmak için ayrıntılı, erişilebilir bir protokol sunuyoruz. İyi çözülmüş hayatta kalma eğrileri elde etmek için kritik adımın, görüntü sonrası elde etme sırasında solucan olmayan nesnelerin manuel olarak dışlanması olduğunu gösterdik. Manuel ölüm zamanı açıklaması, hayatta kalma eğrilerinin genel şekli üzerinde küçük bir etkiye sahiptir ve tam otomatik ölüm zamanı tahmininin manuel açıklama olmadan bile verimli...
Açıklamalar
Yazarlar herhangi bir çıkar çatışması olmadığını beyan ederler.
Teşekkürler
Julian Ceron ve Jeremy Vicencio'ya (IDIBELL Barcelona) rpb-2(cer135) alelini ürettikleri için teşekkür ederiz. Bu proje, Avrupa Birliği'nin Horizon 2020 araştırma ve yenilik programı (Hibe Sözleşmesi No. 852201) kapsamında Avrupa Araştırma Konseyi (ERC), İspanya Ekonomi, Sanayi ve Rekabet Edebilirlik Bakanlığı (MEIC) tarafından EMBL ortaklığına, Centro de Excelencia Severo Ochoa (CEX2020-001049-S, MCIN/AEI /10.13039/501100011033), CERCA Programı/Generalitat de Catalunya, MEIC Excelencia ödülü BFU2017-88615-P, ve Glenn Tıbbi Araştırma Vakfı'ndan bir ödül.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1-Naphtaleneacetic acid (Auxin) | Sigma | N0640 | Solubilize Auxin in 1M potassium hydroxide and add into molten agar |
| 5-fluoro-2-deoxyuridine (FUDR) | Sigma | F0503 | 27.5 μg/mL of FUDR was used to eliminate progeny from populations on UV-inactivated bacteria |
| Glass cleaner | Kristal-M | QB-KRISTAL-M125ml | |
| Hydrophobic anti-fog glass treatment | Rain-X Scheibenreiniger | C. 059140 | |
| Rubber matt | Local crafstman | Cut on a high-strength EPDM rubber sheet stock | |
| Scanner glass | Local hardware supplier | 9" x 11.5" inch glass sheet | |
| Scanner plates | Life Sciences | 351006 | 50 mm x 9 mm, polystyrene petri dish |
| USB Reference Thermometer | USB Brando | ULIFE055500 | For calibrating temperature of scanners |
Referanslar
- Harman, D. The aging process: Major risk factor for disease and death. Proceedings of the National Academy of Sciences of the United States of America. 88 (12), 5360-5363 (1991).
- Vaupel, J. W. Biodemography of human ageing. Nature. 464 (7288), 536-542 (2010).
- Mair, W., Goymer, P., Pletcher, S. D., Partridge, L. Demography of dietary restriction and death in Drosophila. Science. 301 (5640), 1731-1733 (2003).
- Petrascheck, M., Miller, D. L. Computational analysis of lifespan experiment reproducibility. Frontiers in Genetics. 8, 92 (2017).
- Lucanic, M., et al. Impact of genetic background and experimental reproducibility on identifying chemical compounds with robust longevity effects. Nature Communications. 8 (1), 14256 (2017).
- Banse, S. A., et al. Automated lifespan determination across Caenorhabditis strains and species reveals assay-specific effects of chemical interventions. Geroscience. 41 (6), 945-960 (2019).
- Herndon, L. A., et al. Stochastic and genetic factors influence tissue-specific decline in ageing C. elegans. Nature. 419 (6909), 808-814 (2002).
- Kirkwood, T. B., et al. What accounts for the wide variation in life span of genetically identical organisms reared in a constant environment. Mechanisms of Ageing and Development. 126 (3), 439-443 (2005).
- Stroustrup, N., et al. The temporal scaling of Caenorhabditis elegans ageing. Nature. 530 (7588), 103-107 (2016).
- Hamilton, B., et al. A systematic RNAi screen for longevity genes in C. elegans. Genes & Development. 19 (13), 1544-1555 (2005).
- Lee, S. S., et al. A systematic RNAi screen identifies a critical role for mitochondria in C. elegans longevity. Nature Genetics. 33 (1), 40-48 (2003).
- Cornwell, A. B., Llop, J. R., Salzman, P., Thakar, J., Samuelson, A. V. The replica set method: A high-throughput approach to quantitatively measure Caenorhabditis elegans lifespan. Journal of Visualized Experiments. (136), e57819 (2018).
- Stroustrup, N., et al. The Caenorhabditis elegans lifespan machine. Nature Methods. 10 (7), 665-670 (2013).
- Xian, B., et al. WormFarm: A quantitative control and measurement device toward automated Caenorhabditis elegans aging analysis. Aging Cell. 12 (3), 398-409 (2013).
- Churgin, M. A., et al. Longitudinal imaging of Caenorhabditis elegans in a microfabricated device reveals variation in behavioral decline during aging. Elife. 6, 26652 (2017).
- Hulme, S. E., et al. Lifespan-on-a-chip: Microfluidic chambers for performing lifelong observation of C. elegans. Lab on a Chip. 10 (5), 589-597 (2010).
- Kerr, R. A., Roux, A. E., Goudeau, J. F., Kenyon, C. The C. elegans observatory: High-throughput exploration of behavioral aging. Frontiers in Aging. 3, 932696 (2022).
- Javer, A., Ripoll-Sánchez, L., Brown, A. E. Powerful and interpretable behavioural features for quantitative phenotyping of Caenorhabditis elegans. Philosophical Transactions of the Royal Society B: Biological Sciences. 373 (1758), 20170375 (2018).
- Miller, H., et al. Genetic interaction with temperature is an important determinant of nematode longevity. Aging Cell. 16 (6), 1425-1429 (2017).
- Bansal, A., Zhu, L. J., Yen, K., Tissenbaum, H. A. Uncoupling lifespan and healthspan in Caenorhabditis elegans longevity mutants. Proceedings of the National Academy of Sciences of the United States of America. 112 (3), E277-E286 (2015).
- Huang, C., Xiong, C., Kornfeld, K. Measurements of age-related changes of physiological processes that predict lifespan of Caenorhabditis elegans. Proceedings of the National Academy of Sciences of the United States of America. 101 (21), 8084-8089 (2004).
- Garigan, D., et al. Genetic analysis of tissue aging in Caenorhabditis elegans: A role for heat-shock factor and bacterial proliferation. Genetics. 161 (3), 1101-1112 (2002).
- Oswal, N., Martin, O. M., Stroustrup, S., Bruckner, M. A. M., Stroustrup, N. A hierarchical process model links behavioral aging and lifespan in C. elegans. PLoS Computational Biology. 18 (9), 1010415 (2022).
- Sen, I., et al. DAF-16/FOXO requires protein phosphatase 4 to initiate transcription of stress resistance and longevity promoting genes. Nature Communications. 11 (1), 138 (2020).
- Schiffer, J. A., et al. et al.Caenorhabditis elegans processes sensory information to choose between freeloading and self-defense strategies. Elife. 9, 56186 (2020).
- Bazopoulou, D., et al. Developmental ROS individualizes organismal stress resistance and lifespan. Nature. 576 (7786), 301-305 (2019).
- Guerrero-Rubio, M. A., Hernández-García, S., García-Carmona, F., Gandía-Herrero, F. Extension of life-span using a RNAi model and in vivo antioxidant effect of Opuntia fruit extracts and pure betalains in Caenorhabditis elegans. Food Chemistry. 274, 840-847 (2019).
- Janssens, G. E., et al. Transcriptomics-based screening identifies pharmacological inhibition of Hsp90 as a means to defer aging. Cell Reports. 27 (2), 467-480 (2019).
- Kasimatis, K. R., Moerdyk-Schauwecker, M. J., Phillips, P. C. Auxin-mediated sterility induction system for longevity and mating studies in Caenorhabditis elegans. G3: Genes, Genomes, Genetics. 8 (8), 2655-2662 (2018).
- Lin, X. -. X., et al. DAF-16/FOXO and HLH-30/TFEB function as combinatorial transcription factors to promote stress resistance and longevity. Nature Communications. 9 (1), 4400 (2018).
- Stroustrup, N., et al. The temporal scaling of Caenorhabditis elegans ageing. Nature. 530 (7588), 103-107 (2016).
- Byerly, L., Cassada, R., Russell, R. The life cycle of the nematode Caenorhabditis elegans: I. Wild-type growth and reproduction. Developmental Biology. 51 (1), 23-33 (1976).
- Perez, M. F., Francesconi, M., Hidalgo-Carcedo, C., Lehner, B. Maternal age generates phenotypic variation in Caenorhabditis elegans. Nature. 552 (7683), 106-109 (2017).
- Wilkinson, D. S., Taylor, R. C., Dillin, A. Analysis of aging in Caenorhabditis elegans. Methods in Cell Biology. 107, 353-381 (2012).
- Hosono, R. Sterilization and growth inhibition of Caenorhabditis elegans by 5-fluorodeoxyuridine. Experimental Gerontology. 13 (5), 369-373 (1978).
- Lithgow, G. J., Driscoll, M., Phillips, P. A long journey to reproducible results. Nature. 548 (7668), 387-388 (2017).
- Zhang, L., Ward, J. D., Cheng, Z., Dernburg, A. F. The auxin-inducible degradation (AID) system enables versatile conditional protein depletion in C. elegans. Development. 142 (24), 4374-4384 (2015).
- Baeriswyl, S., et al. Modulation of aging profiles in isogenic populations of Caenorhabditis elegans by bacteria causing different extrinsic mortality rates. Biogerontology. 11 (1), 53 (2010).
- Banse, S. A., Blue, B. W., Robinson, K. J., Jarrett, C. M., Phillips, P. C. The Stress-Chip: A microfluidic platform for stress analysis in Caenorhabditis elegans. PLoS One. 14 (5), e0216283 (2019).
- Banse, S. A., et al. Automated lifespan determination across Caenorhabditis strains and species reveals assay-specific effects of chemical interventions. Geroscience. 41 (6), 945-960 (2019).
- Swindell, W. R. Accelerated failure time models provide a useful statistical framework for aging research. Experimental Gerontology. 44 (3), 190-200 (2009).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır