Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
İnsan Spermatozoasında Mitokondriyal Fonksiyonu Değerlendirmek için Yüksek Çözünürlüklü Respirometri
Bu Makalede
Erratum Notice
Özet
Sperm mitokondriyal fonksiyonunun yüksek çözünürlüklü respirometri ile analizi, kapalı bir oda sisteminde serbestçe hareket eden spermatozoanın oksijen tüketiminin ölçülmesine izin verir. Teknik, sperm mitokondriyal özellikleri ve bütünlüğü hakkında bilgi sağlayan insan spermatozoasında solunumu ölçmek için uygulanabilir.
Özet
Semen kalitesi genellikle tanımlayıcı ve genellikle sonuçsuz olan rutin semen analizi ile incelenir. Erkek kısırlığı, değişmiş sperm mitokondriyal aktivitesi ile ilişkilidir, bu nedenle sperm mitokondriyal fonksiyonunun ölçümü, sperm kalitesinin bir göstergesidir. Yüksek çözünürlüklü respirometri, kapalı odacıklı bir sistemdeki hücrelerin veya dokuların oksijen tüketimini ölçme yöntemidir. Bu teknik, insan spermindeki solunumu ölçmek için uygulanabilir ve sperm mitokondrisinin kalitesi ve bütünlüğü hakkında bilgi sağlar. Yüksek çözünürlüklü respirometri, hücrelerin serbestçe hareket etmesine izin verir, bu da sperm durumunda a priori bir avantajdır. Bu teknik, sağlam veya geçirgen spermatozoa ile uygulanabilir ve bozulmamış sperm mitokondriyal fonksiyonunun ve bireysel solunum zinciri komplekslerinin aktivitesinin incelenmesine izin verir. Yüksek çözünürlüklü oksigraf cihazı, oksijen tüketimini hesaplamak için hassas yazılımla birlikte oksijen konsantrasyonunu ölçmek için sensörler kullanır. Veriler, oksijen tüketim oranlarına göre solunum endekslerini hesaplamak için kullanılır. Sonuç olarak, endeksler iki oksijen tüketim oranının oranlarıdır ve hücre sayısına veya protein kütlesine dahili olarak normalleştirilir. Solunum indeksleri, sperm mitokondriyal fonksiyonunun ve işlev bozukluğunun bir göstergesidir.
Giriş
Erkek kısırlığının, çiftlerde tüm kısırlık vakalarının %40-50'sini oluşturduğu tahmin edilmektedir1. Konvansiyonel semen analizi, erkek doğurganlığının belirlenmesinde çok önemli bir rol oynar; Bununla birlikte, infertil erkeklerin yaklaşık% 15'i normal sperm parametrelerine sahiptir2. Ek olarak, rutin semen analizi, sperm fonksiyonu hakkında sınırlı bilgi sağlar ve ince sperm kusurlarını yansıtmaz3.
Sperm mitokondrileri, kamçının etrafında sarmal bir kılıf olarak düzenlendikleri için özel bir yapıya sahiptir. Mitokondriyal kılıf, intermitokondriyal bağlayıcılarla bağlanan ve dış mitokondriyal zar 4,5 üzerinde sıralı protein düzenlemeleri ile hücre iskeletine tutturulmuş değişken sayıda mitokondri içerir. Bu yapı, sperm mitokondrisini izole etmeyi özellikle zorlaştırır. Bu nedenle, sperm mitokondriyal fonksiyonu ile ilgili çoğu çalışmada in situ analizler veya demembranated sperm6 kullanılır.
Sperm mitokondriyal yapısı ve işlevi sürekli olarak erkek kısırlığı ile ilişkilendirilmiştir 7,8,9,10,11, bu organellerin yapı ve işlevinin analizinin sperm analizine dahil edilmek için iyi bir aday olabileceğini düşündürmektedir.
Mitokondri, özellikle oksidatif fosforilasyon (OXPHOS) yoluyla adenozin trifosfat (ATP) üretmek için oksijen kullanarak hücresel enerji metabolizmasında önemli bir rol oynar. Özellikle spermatozoada, ATP'nin kaynağı (glikoliz ve OXPHOS) tartışmalıdır ve verilerin çoğu tartışmalıdır ve farklı deneysel yaklaşımlara bağlıdır 4,12,13. Oksimetre ile solunum ölçümleri, hücrenin mitokondriyal solunum kapasitesi, mitokondriyal bütünlüğü ve enerji metabolizması hakkında önemli bilgiler sunar14,15,16. Geleneksel olarak, bu teknik, 50 yıldan fazla bir süredir mitokondriyal solunumu ölçmek için kullanılan bir alet olan Clark oksijen elektrodu kullanılarak gerçekleştirilmiştir17,18. Ek olarak, sperm mitokondriyal oksijen tüketimi, klasik Clark oksijen elektrodu 19,20,21 kullanılarak analiz edilmiştir. Oksigraf (Oroboros) kullanan yüksek çözünürlüklü respirometri (HRR), klasik respirometri cihazlarının kullanımına göre daha yüksek hassasiyet sağlar22. Oksigraflar, enjeksiyon portlarına sahip iki odadan oluşur ve her odada bir polarografik oksijen sensörü bulunur. Bu teknikle doku slaytlarını, hücreleri ve izole mitokondriyal süspansiyonları analiz etmek mümkündür. Numune haznede sürekli olarak karıştırılır ve deney sırasında oksijen tüketimi ölçülür ve oksijen oranları özel bir yazılım kullanılarak hesaplanır. Odalar, geleneksel oksijen elektrot cihazlarına göre bir avantaj olan oksijen sızıntısının azaldığını gösterir14,23.
Diğer hücrelerde olduğu gibi, spermatozoa durumunda, HRR ekipmanının duyarlılığı geleneksel respirometriden daha yüksektir, yani HRR ekipmanının sınırlı sayıda bozulmamış veya geçirgen sperm hücresinin analizi için kullanılabileceği anlamına gelir. HRR ile sperm mitokondriyal fonksiyonunu değerlendirmek için iki ana strateji vardır: (a) glikoz gibi substratlar içeren bir ortamda solunum fonksiyonunun yeniden üretilmesini içeren bozulmamış hücrelerde oksijen tüketiminin ölçülmesi veya (b) her bir fonksiyonu ayrı ayrı izlemek için spesifik substratların eklenmesiyle OXPHOS komplekslerinden birini kullanarak geçirgen hücrelerde oksijen tüketimini ölçmek.
Bu çalışmada, insan sperm hücrelerinde mitokondriyal solunumu belirlemek için HRR'nin kullanımını tanımladık.
Protokol
Deneyler, Facultad de Medicina de la Universidad de la República, Montevideo, Uruguay Etik Komitesi tarafından onaylandı.
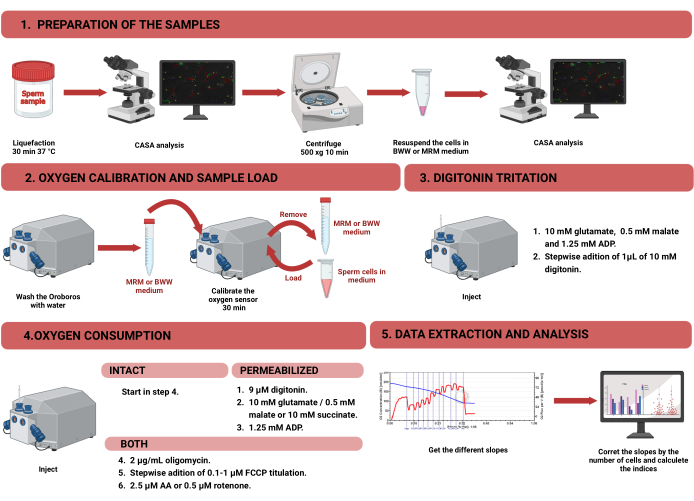
Şekil 1: Bozulmamış ve geçirgen insan sperminde mitokondriyal fonksiyonu değerlendirmek için yüksek çözünürlüklü respirometri için iş akışı. Protokol dört farklı adıma bölünmüştür: 1) numunenin hazırlanması, 2) Oroboros cihazında oksijen kalibrasyonu, 3) bozulmamış ve geçirgen hücreler için oksijen tüketimi ölçümü ve 4) ekipmandan veri çıkarma ve analiz. Kısaltmalar: CASA = bilgisayar destekli sperm analizi; BWW = Biggers Whitten Whittingham orta; MRM = mitokondriyal solunum ortamı; ADP = adenozin difosfat; FCCP = karbonil siyanür -p- triflorometoksifenilhidrazon; AA = antimisin A. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
NOT: HRR kullanarak sperm hücrelerinde oksijen tüketimini ölçmek için iş akışı Şekil 1'de gösterilmektedir. Protokolde kullanılan malzemeler, ekipman ve reaktifler hakkındaki bilgiler Malzeme Tablosunda sunulmaktadır.
1. Numune hazırlama
- Numune koleksiyonu
- Steril bir plastik kapta önerilen 3 günlük yoksunluktan sonra mastürbasyon yoluyla yeni boşalmış insan spermi toplayın. Numuneleri hemen laboratuvara taşıyın.
- Numuneleri tamamen sıvılaştırmak için oda sıcaklığında (RT) 30-60 dakika inkübe edin24.
- Sıvılaştırmadan sonra, deney başlayana kadar numuneleri 37 °C'de saklayın.
- Bilgisayar destekli sperm analizi (CASA) ile sperm değerlendirmesi
- Numuneyi karıştırın ve önceden ısıtılmış bir sperm sayma odasına 7 μL yükleyin.
- Odayı doğrudan ışık mikroskobunun önceden ısıtılmış (37 °C) aşamasına yerleştirin.
- Bilgisayarlı sperm analiz yazılımını açın ve motilite ve konsantrasyon modülüne girin ( Mot'a tıklayın).
- İnsan sperm koşullarına karşılık gelen konfigürasyonu seçin.
NOT: Konfigürasyon, haznenin tipine ve derinliğine, ayrıca numune türlerine ve CASA sistemine uyarlanmalıdır. - Analiz düğmesine tıklayarak oda başına 10 farklı alanı rastgele analiz edin.
- Numune konsantrasyonunu ve hareketliliğini elde etmek için Sonuçlar'a tıklayın.
- Hücre hazırlığı
NOT: HRR kalibre edilmemişse, hücreleri hazırlamadan önce 2.1-2.2 adımlarıyla başlayın (adım 1.3). Sperm hücreleri besiyerinde yeniden süspanse edildiğinde oksijen tüketiminin hemen ölçülmesi önemlidir.- Numuneleri RT'de 10 dakika boyunca 400 x g'da santrifüjleyin.
- Seminal plazmayı çıkarın ve bozulmamış hücrelerle yapılan deneyler için 2 mL Biggers Whitten Whittingham (BWW) veya geçirgen hücrelerle yapılan çalışmalar için mitokondriyal solunum ortamı (MRM) içinde spermatozoayı yeniden süspanse edin. Ortamın kompozisyonları Tablo 1'de gösterilmektedir.
- Sperm konsantrasyonu çalışmaları için adım 1.2'de açıklanan adımları tekrarlayın.
2. Yüksek çözünürlüklü respirometri: OXPHOS analizi
NOT: HRR, son derece hassas oksigrafları (Oksigraf-2 K; Oroboros Instruments GmbH, Innsbruck, Avusturya) yazılımlı (DatLab, sürüm 4.2; Oroboros Instruments GmbH). Deneysel veriler, zamana karşı oksijen konsantrasyonu (O2/106 hücrenin pmol'ü · min−1 olarak) ve bu verilerin gerçek zamanlı dönüşümleri olarak görüntülenir ve deneycinin solunumunu izlemesine olanak tanır (oksijen tüketimi, oksijen akışı) deney devam ederken biyolojik ve biyokimyasal örnekler. HRR, hareketliliği sperm kalitesi ve doğurganlık potansiyeli ile ilişkili olan sperm için özellikle yararlı olan canlı ve hareketli hücrelerin solunumunu takip etmek için kullanılabilir. Laboratuvar, iki odacıklı bir HRR Oroboros Oxygraph2-k, Oroboros Instruments kullanmaktadır. Bu protokolde açıklanan adımlar, her iki 2 mL oda için bağımsız olarak gerçekleştirilmelidir.
- Ekipman hazırlığı
- HRR'yi açın ve veri toplama ve analiz için respirometri yazılımına (DatLab) bağlayın.
- Oksigraf odasındaki %70 etanolüddH2Oile değiştirin. Haznedeki manyetik karıştırma çubuğu ile 750 rpm'de sürekli karıştırın. 10 dakika bekletin ve daha sonra çift damıtılmış (dd)H2O'yuaspire edin.
- Hazneyi her seferinde 5 dakika boyunca ddH2O ile üç kez yıkayın.
NOT: Bu adım, kalan etanolü odalardan çıkarmak için gereklidir. Sperm hücreleri etanole karşı çok hassastır. Bu adım atlanırsa kayıt tehlikeye girebilir.
- Oksijen sensörlerinin kalibrasyonu
NOT: Kalibrasyon prosedürü, cihaza bağlı olarak biraz değişir. Polarografik oksijen sensörünün hava kalibrasyonunu üretici tarafından açıklandığı gibigerçekleştirin 25. Bu bölümde kalibrasyon protokolü kısaca anlatılmıştır.- ddH 2 O'yu çıkarın ve hücre hazırlığı için kullanılan aynı ortamdan2mL'yi hazneye pipetleyin. Tıpaları bir hava değişim balonu bırakarak yerleştirin.
NOT: İhtiyaç duyulan ortamın tam hacmini belirlemek için haznenin hacmini bilmek önemlidir. - Ortamı karıştırma çubuğu ile 750 rpm'de 30 °C'de en az 37 dakika karıştırarak sensör membranının performansını izlemek için oksijen kalibrasyon değerlerini kaydedin ( Düzen > 01 Kalibrasyon Exp. Gr3-Temp'e tıklayın). Belirtilen diğer ayarları kullanın: sensör için kazanç: 2; polarizasyon voltajı: 800 mV; veri kayıt aralığı: 2,0 sn.
NOT: Polarografik sensörden kararlı bir sinyal ile ±2 pmol∙s−1∙mL−1 içinde düzeltilmemiş bir O 2 eğimi (kırmızı çizgi) elde edilmesi beklenir. - Oksijen konsantrasyonundaki değişimin (Y1 O2 Konsantrasyonu, mavi çizgi) sabit olduğu bir alan seçmek için farenin sol düğmesini ve shift tuşunu basılı tutarken fareyi sürükleyin.
- O2 Kalibrasyonu penceresini açın (O2 Kalibrasyonu > Oksigraf'a tıklayın). Hava Kalibrasyonu'nda, seçilen işareti adım 2.2.3'te seçilen bölgeyle değiştirin. Kalibre Et ve Panoya Kopyala'ya tıklayarak bitirin.
- Kaydı durdurun ve Oxygraph > Tamam Kontrolü > Kaydet ve Bağlantıyı Kes'e tıklayarak kaydedin.
NOT: Bu veri kümesi, günün tüm deneylerinde kullanılabilmesi için kaydedilmelidir. Kalibrasyon, her ortam için günde yalnızca bir kez gerçekleştirilir.
- ddH 2 O'yu çıkarın ve hücre hazırlığı için kullanılan aynı ortamdan2mL'yi hazneye pipetleyin. Tıpaları bir hava değişim balonu bırakarak yerleştirin.
- Digitonin geçirgenlik titrasyonu
- Hazneyi açın ve içindeki ortamı aspire edin.
- Hazneye en az 24 x 10 6 ve en fazla 70 x 106 sperm hücresi 2 mL MRM'nin son hacmine yükleyin.
NOT: Deney sonunda oksijen tüketimini ayarlamak için haznedeki hücre sayısını ölçmek önemlidir. Önerilenden daha az sayıda hücre ölçülemez. - Tıpaları sonuna kadar iterek hazneyi kapatın ve üstte kalan sıvıyı aspire edin. Deneyi kalibrasyonla aynı ayarlarla başlatın: karıştırma hızı: 750 rpm; sıcaklık: 37 °C; sensör için kazanç: 2; polarizasyon voltajı: 800 mV; ve veri kayıt aralığı: 2,0 sn.
- Kalibrasyonu yüklemek için alt köşedeki Pos Calib kutusuna çift tıklayın. Adım 2.2'de gerçekleştirilen kalibrasyonu açın ( Oksigraf > O2 Kalibrasyonu > Dosyadan Kopyala'ya tıklayın) ve Kalibre Et ve Panoya Kopyala'ya tıklayın.
NOT: POS Calib kutusu sarıdan yeşile dönecektir. Veriler, hacim başına düzeltilmiş oksijen akışı grafiklerinde görüntülenir (Düzen 05 Hacim Başına Akı düzeltilmemiş). Oxygraph > Layout'ta farklı düzenler mevcuttur. - 5 μL 0.5 M adenosin difosfat (ADP), 10 μL 2 M glutamat ve 2.5 μL 0.4 M malat ekleyin (son konsantrasyonlar: 1.25 mM, 10 mM ve 0.5 mM). Sinyal stabilize olana kadar oksijen tüketimini ölçün.
NOT: Hassas Hamilton mikro şırıngaları, durdurucudaki yükleme portundan enjeksiyon için kullanılır. Çapraz kontaminasyonu önlemek için ilaç başına bir şırınga kullanın. Kaydolmak için F4'e tıklayın ve bir tedavi eklendiğinde oksijen kaydında işaretleyin.
NOT: Substratlar ultra saf suda hazırlanır ve −20 °C'de 3 ay saklanır. - Oksijen tüketimi maksimum seviyeye ulaşana kadar ardışık adımlarla 1 μL 10 mM digitonin ekleyerek tritatlayın.
NOT: Aynı hazne aynı gün içinde iki deney için kullanılıyorsa, su, %70 etanol ve %100 etanol ile iyice yıkama esastır.
NOT: Digitonin ultra saf suda hazırlanır ve −20 °C'de 3 ay saklanır.
- Sağlam ve geçirgen sperm hücreleri için rutin solunum değerlendirme protokolü (kompleks I veya kompleks II)
- Hazneyi açın ve içindeki ortamı aspire edin.
- Hazneye en az 24 x 10 6 ve en fazla 70 x 106 sperm hücresi 2 mL BWW (bozulmamış hücre analizi) veya MRM (geçirgen hücre analizi) nihai hacminde yükleyin.
- Deneyi, kalibrasyonla aynı ayarlarla başlatın (bu, adım 2.3.3'te açıklanmıştır).
- Adım 2.2'de gerçekleştirilen kalibrasyonu adım 2.3.4'te açıklandığı gibi yükleyin.
- Kararlı bir sinyal elde edilene kadar hücrelerin solunumunu en az 5 dakika kaydedin. Bu ölçüm, sağlam hücrelerde bazal solunuma karşılık gelir.
- Deney sağlam hücrelerle yapılıyorsa, adım 2.4.9'a geçin. Geçirgen hücreler için 4.5 μL 10 mM digitonin enjekte edin (son konsantrasyon: 22.5 μM). Hücreleri 5 dakika geçirgenleştirin.
- Substratları ekleyin: kompleks I için 10 μL 2 M glutamat ve 2.5 μL 0.4 M malat (nihai konsantrasyonlar: sırasıyla 10 mM ve 0.5 mM) veya kompleks II için 20 μL 1 M süksinat (son konsantrasyon: 10 mM). Sinyal artana ve stabilize olana kadar oksijen tüketimini ölçün. Bu, ADP yokluğunda bazal kompleks I veya bazal kompleks II destekli solunum anlamına gelen durum 4'tür.
NOT: Substratlar ultra saf suda hazırlanır ve −20 °C'de 3 ay saklanır. - 5 μL 0.5 M ADP enjekte edin (son konsantrasyon: 1.25 mM). Sinyal artana ve stabilize olana kadar oksijen tüketimini ölçün. ADP'nin eklenmesi, kompleks I veya kompleks II (geçirgen hücrelerde durum 3) yoluyla maksimum oksijen tüketimine karşılık gelen sinyali arttırır.
- Bir ATP sentetaz inhibitörü olan 1 μL 4 mg / mL oligomisin (son konsantrasyon: 2 μg / mL) ekleyin. Sinyal azalana ve stabilize olana kadar oksijen tüketimini ölçün.
NOT: Oligomisin etanol içinde hazırlanır ve −20 °C'de 3 ay saklanır. - Maksimum bağlanmamış solunum hızına ulaşılana kadar art arda adımlarla 1 μL 0,1 mM karbonil siyanür-P-triflorometoksi-fenilhidrazon (FCCP) ekleyerek titre edin. Sinyal artana ve stabilize olana kadar oksijen tüketimini ölçün.
NOT: FCCP etanol içinde hazırlanır ve −20 °C'de 3 ay saklanır. - FCCP'nin nihai konsantrasyonu numuneye bağlıdır. Oksijen tüketimi azalmaya başladığında ilacı enjekte etmeyi bırakın.
- Son olarak, 1 μL 5 mM antimisin A (2.5 μM nihai konsantrasyon) enjekte edin. Bu, mitokondriyal ve artık oksijen tüketimi (mitokondriyal olmayan solunum) arasında ayrım yapmak için karmaşık bir III inhibitörüdür. Kompleks I'in analizi için, AA yerine bu kompleksin bir inhibitörü olan 1 μL 1 mM rotenon (0.5 μM nihai konsantrasyon) ekleyin. Sinyal azalana ve stabilize olana kadar oksijen tüketimini ölçün.
NOT: İlaçlar etanol içinde hazırlanır ve −20 °C'de 3 ay saklanır.
3. Veri çıkarma ve analiz
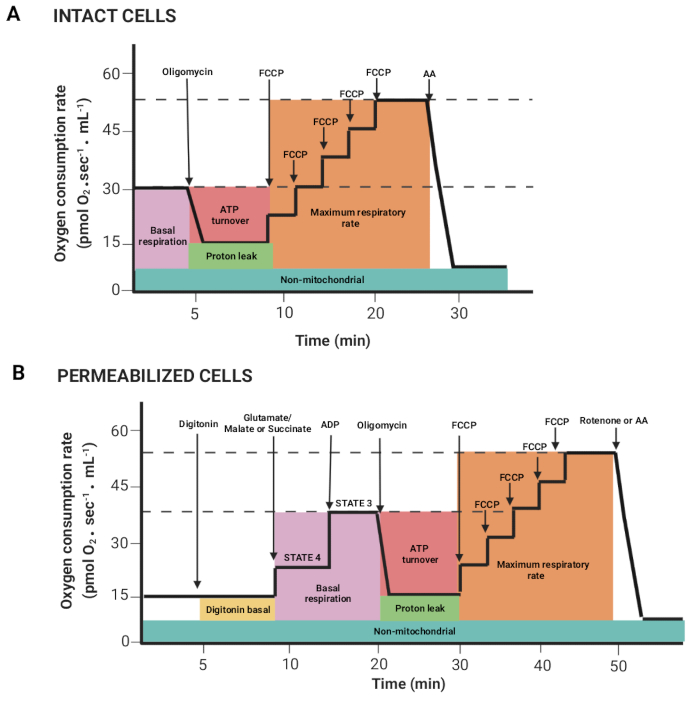
Şekil 2: Yüksek çözünürlüklü bir respirometri deneyinden solunum parametrelerinin elde edilmesi. (A,B) Şekil 1'de açıklandığı gibi, sırasıyla bozulmamış ve geçirgen hücreler için elde edilen grafiklerin şematik gösterimleri. Bu parametreler daha önce15 olarak tanımlanmıştır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
- Bir substrat veya inhibitörün enjeksiyonundan sonra hacim başına oksijen akışının ilişkili olduğu bölgeleri (Y2 O2 eğimi, kırmızı çizgi) seçmek için farenin sol düğmesine ve shift tuşuna basarak fareyi sürükleyin. Şekil 2 , daha önce açıklanan kayıttan elde edilen farklı parametreleri göstermektedir15.
NOT: Parametreler deneye bağlıdır; hepsi şu şekildedir: sağlam hücrelerde bazal solunum ve glutamat/malat veya süksinat varlığında solunum (durum 4), ADP (durum 3), oligomisin (proton kaçağı), FCCP (maksimum solunum hızı), rotenon/AA (mitokondriyal olmayan solunum). Geçirgen hücrelerde, bazal solunum durum 3'e karşılık gelir. - İstatistikler > İşaretler pencerelerine tıklayın ve verileri dışa aktarın.
- 1 milyon sperm hücresi başına elde edilen verileri normalleştirin. Eğimlerin birimleri pmolO2·s−1·mL−1·10−6 hücredir.
- İndeksleri hesaplamadan önce mitokondriyal olmayan oksijen tüketimini tüm değerlerden çıkarın.
- Daha önce açıklanan çeşitli denklemleri kullanarak endeksleri hesaplayın15:

Sonuçlar
Sperm hücrelerinde optimal digitonin konsantrasyonunun belirlenmesi
Bu protokolde, insan sperm hücrelerinde OXPHOS'taki gerçek zamanlı değişiklikleri izlemek için HRR kullanımını sunuyoruz. Yöntem, bozulmamış veya digitonin geçirgenmiş spermleri analiz etmek için kullanılabildiğinden, öncelikle sperm hücrelerini geçirgenleştirmek için gerekli olan digitonin konsantrasyonunun standardizasyonunu sunuyoruz (Şekil 3).
Digito...
Tartışmalar
HRR kritik olarak birkaç adıma bağlıdır: (a) ekipman bakımı, (b) oksijen sensörlerinin doğru kalibrasyonu, (c) bağlayıcı çözücü titrasyonu26 ve son olarak (d) mitokondriyal fonksiyonu temsil eden indekslerin yeterli kullanımı. Ekipman bakımı çok önemlidir. Polarografik oksijen sensörünün membranlarının düzenli olarak değiştirilmesi ve enstrümantal arka planın düzeltilmesi önerilir. Spermatozoanın odalardan toplanmasından sonra, özellikle aletlerin çeşitli dok...
Açıklamalar
Yazarların açıklayacak hiçbir şeyi yok.
Teşekkürler
Fertilab Androloji kliniğine, özellikle José María Montes ve Andrea Torrents'e bağışçılara erişmemize izin verdikleri için teşekkür ederiz. Finansman: A.C., Universidad de la República'dan (CSIC_2018, Espacio Interdisciplinario_2021) alınan hibelerle desteklenmektedir. Programa de Desarrollo de Ciencias Básicas'tan (PEDECIBA, Uruguay) ek finansman sağlandı. PI ve RS, Universidad de la República tarafından desteklenmektedir (I+D, CSIC 2014; I+D, CSIC 2016, Iniciación a la Investigación, CSIC 2019 ve FMV_1_2017_1_136490 ANII- Uruguay). PI, POS_FMV_2018_1_1007814 ve CAP-UDELAR 2020 tarafından desteklenmektedir. Rakamlar Biorender.com kullanılarak gösterilmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Acid free- Bovine serum albumine | Sigma Aldrich | A8806 | |
| Adenosine 5'-diphosphate monopotassium salt dihydrate | Sigma Aldrich | A5285 | |
| Animycin A from streptomyces sp. | Sigma Aldrich | A8674 | |
| Calcium chloride | Sigma Aldrich | C4901 | |
| carbonyl cyanide-P- trifluoromethoxy-phenylhydrazone | Sigma Aldrich | C2920 | |
| DatLab sofware version 4,2 | Oroboros Instruments GmbH | N/A | |
| D-glucose | Sigma Aldrich | G7021 | |
| Digitonin | Sigma Aldrich | D141 | |
| EGTA | Sigma Aldrich | E4378 | |
| HEPES | Sigma Aldrich | H3375 | |
| L glutamic acid | Sigma Aldrich | G1251 | |
| L malic acid | Sigma Aldrich | M1000 | |
| Magnesium sulphate | Sigma Aldrich | M7506 | |
| Microliter Syringes | Hamilton | 87900 or 80400 | |
| Microscope camera | Basler | acA780-75gc | |
| Microscope Eclipse E200 with phase contrast 10X Ph+ | Nikon | N/A | |
| Monopotassium phosphate | Sigma Aldrich | P5655 | |
| MOPS | Sigma Aldrich | M1254 | |
| Oligomycin A | Sigma Aldrich | 75351 | |
| Oxygraph-2 K | Oroboros Instruments GmbH | N/A | |
| Potassium chloride | Sigma Aldrich | P3911 | |
| Power O2k-Respirometer | Oroboros Intruments | 10033-01 | |
| Rotenone | Sigma Aldrich | R8875 | |
| Saccharose | Sigma Aldrich | S0389 | |
| Sodium bicarbonate | Sigma Aldrich | S5761 | |
| Sodium lactate | Sigma Aldrich | L7022 | |
| Sodium pyruvate | Sigma Aldrich | P2256 | |
| Sperm class analyzer 6.3.0.59 Evolution-SCA Research | Microptic | N/A | |
| Sperm Counting Chamber DRM-600 | Millennium Sciences CELL-VU | N/A | |
| Succinate disodium salt | Sigma Aldrich | W327700 |
Referanslar
- Agarwal, A., Mulgund, A., Hamada, A., Chyatte, M. R. A unique view on male infertility around the globe. Reproductive Biology and Endocrinology. 13, 37 (2015).
- Guzick, D. S., et al. Sperm morphology, motility, and concentration in fertile and infertile men. The New England Journal of Medicine. 345 (19), 1388-1393 (2001).
- Wang, C., Swerdloff, R. S. Limitations of semen analysis as a test of male fertility and anticipated needs from newer tests. Fertility and Sterility. 102 (6), 1502-1507 (2014).
- Amaral, A. Energy metabolism in mammalian sperm motility. WIREs Mechanisms of Disease. 14 (5), e1569 (2022).
- Leung, M. R., et al. In-cell structures of conserved supramolecular protein arrays at the mitochondria-cytoskeleton interface in mammalian sperm. Proceedings of the National Academy of Sciences of the United States of America. 118 (45), e2110996118 (2021).
- Moraes, C. R., Meyers, S. The sperm mitochondrion: Organelle of many functions. Animal Reproduction Science. 194, 71-80 (2018).
- Cassina, A., et al. Defective human sperm cells are associated with mitochondrial dysfunction and oxidant production. Biology of Reproduction. 93 (5), 119 (2015).
- Marchetti, C., Obert, G., Deffosez, A., Formstecher, P., Marchetti, P. Study of mitochondrial membrane potential, reactive oxygen species, DNA fragmentation and cell viability by flow cytometry in human sperm. Human Reproduction. 17 (5), 1257-1265 (2002).
- Amaral, A., Lourenço, B., Marques, M., Ramalho-Santos, J. Mitochondria functionality and sperm quality. Reproduction. 146 (5), R163-R174 (2013).
- Durairajanayagam, D., Singh, D., Agarwal, A., Henkel, R. Causes and consequences of sperm mitochondrial dysfunction. Andrologia. 53 (1), e13666 (2021).
- Uribe, P., et al. Use of the fluorescent dye tetramethylrhodamine methyl ester perchlorate for mitochondrial membrane potential assessment in human spermatozoa. Andrologia. 49 (9), e12753 (2017).
- Storey, B. T. Mammalian sperm metabolism: Oxygen and sugar, friend and foe. The International Journal of Developmental Biology. 52 (5-6), 427-437 (2008).
- Tourmente, M., Sansegundo, E., Rial, E., Roldan, E. R. S. Capacitation promotes a shift in energy metabolism in murine sperm. Frontiers in Cell and Developmental Biology. 10, 950979 (2022).
- Gnaiger, E., Dykens, J. A., Will, Y. Chapter 12 - Polarographic oxygen sensors, the oxygraph, and high-resolution respirometry to assess mitochondrial function. Drug-Induced Mitochondrial Dysfunction. , 325-352 (2008).
- Brand, M. D., Nicholls, D. G. Assessing mitochondrial dysfunction in cells. Biochemical Journal. 435 (2), 297-312 (2011).
- Awadhpersad, R., Jackson, C. B. High-resolution respirometry to assess bioenergetics in cells and tissues using chamber- and plate-based respirometers. Journal of Visualized Experiments: JoVE. (176), e63000 (2021).
- Chance, B., Williams, G. R. A simple and rapid assay of oxidative phosphorylation. Nature. 175 (4469), 1120-1121 (1955).
- Li, Z., Graham, B. H. Measurement of mitochondrial oxygen consumption using a Clark electrode. Methods in Molecular Biology. 837, 63-72 (2012).
- Stendardi, A., et al. Evaluation of mitochondrial respiratory efficiency during in vitro capacitation of human spermatozoa. International Journal of Andrology. 34 (3), 247-255 (2011).
- Ferramosca, A., Focarelli, R., Piomboni, P., Coppola, L., Zara, V. Oxygen uptake by mitochondria in demembranated human spermatozoa: A reliable tool for the evaluation of sperm respiratory efficiency. International Journal of Andrology. 31 (3), 337-345 (2008).
- Ferramosca, A., et al. Modulation of human sperm mitochondrial respiration efficiency by plant polyphenols. Antioxidants. 10 (2), 217 (2021).
- Gnaiger, E., Steinlechner-Maran, R., Méndez, G., Eberl, T., Margreiter, R. Control of mitochondrial and cellular respiration by oxygen. Journal of Bioenergetics and Biomembranes. 27 (6), 583-596 (1995).
- . O2k Quality Control 1: Polarographic oxygen sensors and accuracy of calibration Available from: https://www.bioblst.at/images/archive/7/77/20210819114548%21MiPNet06.03_POS-Calibration-SOP.pdf (2020)
- WHO Laboratory Manual for the Examination and Processing of Human Semen. World Health Organization Available from: https://www.who.int/publications/i/item/9789240030787 (2010)
- . O2k-protocols SOP: O2k quality control 1 Available from: https://www.bioblast.at/images/9/9c/MiPNet06.03_POS-Calibration-SOP_DatLab8.pdf (2021)
- Gnaiger, E. . Mitochondrial Pathways and Respiratory Control. , (2012).
- Steinlechner-Maran, R., Eberl, T., Kunc, M., Margreiter, R., Gnaiger, E. Oxygen dependence of respiration in coupled and uncoupled endothelial cells. The American Journal of Physiology. 271, C2053-C2061 (1996).
- Holt, W. V., Van Look, K. J. W. Concepts in sperm heterogeneity, sperm selection and sperm competition as biological foundations for laboratory tests of semen quality. Reproduction. 127 (5), 527-535 (2004).
- Sousa, A. P., et al. Not all sperm are equal: Functional mitochondria characterize a subpopulation of human sperm with better fertilization potential. PloS One. 6 (3), e18112 (2011).
- Moscatelli, N., et al. Single-cell-based evaluation of sperm progressive motility via fluorescent assessment of mitochondria membrane potential. Scientific Reports. 7, 17931 (2017).
- Ferreira, J. J., et al. Increased mitochondrial activity upon CatSper channel activation is required for mouse sperm capacitation. Redox Biology. 48, 102176 (2021).
- Irigoyen, P., et al. Mitochondrial metabolism determines the functional status of human sperm and correlates with semen parameters. Frontiers in Cell and Developmental Biology. 10, 926684 (2022).
Erratum
Formal Correction: Erratum: High-Resolution Respirometry to Assess Mitochondrial Function in Human Spermatozoa
Posted by JoVE Editors on 9/26/2023. Citeable Link.
An erratum was issued for: High-Resolution Respirometry to Assess Mitochondrial Function in Human Spermatozoa. The Protocol and Representative Result sections were updated.
Step 2.4.12 of the Protocol was updated from:
Finally, inject 1 µL of 5 mM antimycin A (2.5 µM final concentration). This is a complex II inhibitor to discriminate between the mitochondrial and residual oxygen consumption (non-mitochondrial respiration). For the analysis of complex I, add 1 µL of 1 mM rotenone (0.5 µM final concentration), an inhibitor of this complex, instead of AA. Measure the oxygen consumption until the signal decreases and stabilizes.
to:
Finally, inject 1 µL of 5 mM antimycin A (2.5 µM final concentration). This is a complex III inhibitor to discriminate between the mitochondrial and residual oxygen consumption (non-mitochondrial respiration). For the analysis of complex I, add 1 µL of 1 mM rotenone (0.5 µM final concentration), an inhibitor of this complex, instead of AA. Measure the oxygen consumption until the signal decreases and stabilizes.
Figure 3 in the Representative Results section was updated from:
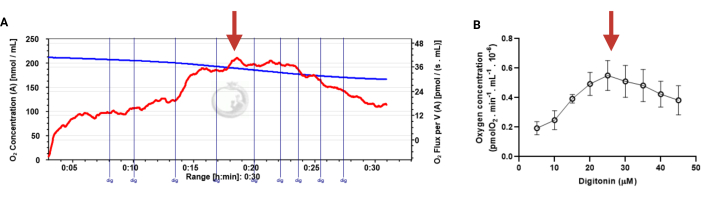
Figure 3: Determination of the optimal concentration of digitonin for the permeabilization of human sperm cells. The respiration rates were measured at 37 °C in MRM medium with glutamate, malate, and adenosine diphosphate. (A) Representative respiratory trace. The blue line is the O2 concentration, and the red line represents the O2 flow per volume correlated. (B) Mitochondria respiration rate means ± standard error, n = 4. The red arrow represents the optimal concentration. Abbreviation: dig = digitonin. Please click here to view a larger version of this figure.
to:
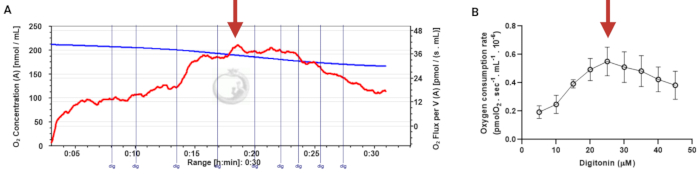
Figure 3: Determination of the optimal concentration of digitonin for the permeabilization of human sperm cells. The respiration rates were measured at 37 °C in MRM medium with glutamate, malate, and adenosine diphosphate. (A) Representative respiratory trace. The blue line is the O2 concentration, and the red line represents the O2 flow per volume correlated. (B) Mitochondria respiration rate means ± standard error, n = 4. The red arrow represents the optimal concentration. Abbreviation: dig = digitonin. Please click here to view a larger version of this figure.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır