Mikrobilgisayarlı Tomografi Anjiyografi Kullanan Farelerde Başarılı Ortotopik Karaciğer Nakli
Bu Makalede
Özet
Bu protokolde, farelerde başarılı bir ortotopik karaciğer transplantasyonu (OLT) modelinin uygulanmasını tartışıyoruz. Ek olarak, bir farede başarılı OLT'den sonra allogreft açıklığını daha fazla analiz etmek için adjuvanlar, özellikle mikrobilgisayarlı tomografi (mikroBT) taramaları kullanılarak tartışılmaktadır.
Özet
Mikrobilgisayarlı tomografi (mikroBT) anjiyografi araştırmacılar için paha biçilmez bir kaynaktır. Bu teknolojideki yeni gelişmeler, mikro damar sisteminin yüksek kaliteli görüntülerinin elde edilmesini sağlamıştır ve organ nakli alanında yüksek kaliteli araçlardır. Farelerde yapılan bu ortotopik karaciğer nakli (OLT) modelinde, mikroCT, allogreft anastomozunu gerçek zamanlı olarak değerlendirme fırsatı verir ve çalışma hayvanlarını feda etmek zorunda kalmama avantajına sahiptir. Kontrast seçimi ve görüntü elde etme ayarları, araştırmacılara paha biçilmez bilgiler veren yüksek çözünürlüklü bir görüntü oluşturur. Bu, prosedürün teknik yönlerinin değerlendirilmesine ve uzun bir süre boyunca farklı terapötiklerin potansiyel olarak değerlendirilmesine izin verir. Bu protokolde, farelerde bir OLT modelini adım adım detaylandırıyoruz ve son olarak araştırmacılara katı organ transplantasyonunun derinlemesine analizinde yardımcı olan yüksek kaliteli görüntüler verebilen bir mikroCT protokolünü açıklıyoruz. Bir farede karaciğer nakli için adım adım bir kılavuz sunuyoruz ve ayrıca mikroBT anjiyografi ile greftin açıklığını değerlendirmek için bir protokolü kısaca tartışıyoruz.
Giriş
Transplantasyon, son dönem karaciğer hastalığı için tek etkili tedavidir. İnkar edilemez bir şekilde, karaciğer naklinin yararı mükemmeldir ve bekleme listesinde 11.6 yıla karşılık 3.1 yıllık medyan sağkalım1. Bununla birlikte, karaciğer transplantasyonunun geniş uygulamasını sınırlayan ve en önemlisi uygun, yüksek kaliteli donör organların eksikliğini içeren önemli kısıtlamalar vardır. Bu nedenle, donör organ havuzunun genişletilmesi, günümüzde uygun olmadığı düşünülen allogreftlerin kullanımına izin veren ve transplantasyon için güvenlik marjını artıran yenilikçi stratejiler gerektirecektir. Bu nedenle, karaciğer transplantasyonuna erişimi iyileştirmek için küçük hayvanlarda klinik öncesi çalışmalar yapmak zorunludur.
Transplantasyon araştırmaları için özellikle önemli olan in vivo transplantasyon modelleridir. Fare ortotopik karaciğer transplantasyonu (OLT) yaklaşık 30 yıldır kullanılmaktadır2 ve immün yanıtların karakterizasyonu, iskemi-reperfüzyon hasarı, akut rejeksiyon, yeni ajanların terapötik etkileri ve uzun süreli sağkalım dahil olmak üzere transplantasyonun birçok yönünü incelemek için hayati önem taşımaktadır 3,4,5,6,7 . Transplantasyonu incelemek için farelerin kullanılması, spesifik moleküler yolların transplantasyon sonuçları üzerindeki etkisini incelemek için transgenik fare hatlarının kullanılmasına izin verdiği için hayati önem taşır. Fare karaciğer transplantasyonunun yerleşik protokolleri daha önce iyi tanımlanmıştır 8,9.
Supra ve infra hepatik inferior vena kava (IVC), portal ven (PV) ve koledok (CBD) için birden fazla anastomoz yöntemi mevcuttur. Tipik olarak el anastomozuna veya murin akciğer transplantasyonunabenzer modifiye edilmiş bir vasküler manşet tekniğine dayanırlar 10,11,12. Alıcı farelerin uzun süreli çalışması ve hayatta kalmasının yanı sıra sürekli bir fare karaciğer nakli programının geliştirilmesinde önemli bir adım, bu kritik anastomozları değerlendirme yeteneğidir. Karaciğer allogreft açıklığını değerlendirmek için görüntüleme yöntemleri genellikle klinik ortamda ultrason ve bilgisayarlı tomografiye (BT) dayanır13,14. BT, ultrasona göre belirgin bir avantaja sahiptir, çünkü her anastomozu içerecek şekilde tüm karın manzarası sunabilir, ancak bu görünümleri ultrason ile elde etmek küçük hayvanlarda özellikle zor olabilir. Hayvan çalışmalarını ve bu yaralanma ve hastalık modellerinden toplayabileceğimiz bilgileri geliştirmek amacıyla doğru mikroCT geliştirmeye önemli araştırmalar ve kaynaklar ayrılmıştır15,16. Burada ortotopik fare karaciğer transplantasyonu için bir protokol tanımlanmıştır (Şekil 1) ve anastomozların allogreft açıklığı ve dayanıklılığını değerlendirmek için mikroBT için bir protokol kısaca tanımlanmıştır.
Protokol
Erkek C57BL / 6J fareleri (30 g vücut ağırlığı), Nationwide Çocuk Hastanesi Hayvan Tesisi'nde patojen içermeyen koşullar altında barındırıldı. Tüm prosedürler, NIH ve Ulusal Araştırma Konseyi'nin Laboratuvar Hayvanlarının İnsani Bakımı ve Kullanımı Kılavuzu'na göre ve Nationwide Çocuk Hastanesi Kurumsal Hayvan Bakımı ve Kullanımı Komitesi'nin (IACUC Protokolü AR17-00045) onayı ile insancıl bir şekilde gerçekleştirildi. Bu protokolde kullanılan tüm malzemeler, aletler ve ekipmanlarla ilgili ayrıntılar için Malzeme Tablosuna bakın.
1. Transplantasyon cerrahisi için ilk kurulum
- Cerrahi cihazları kurun.
- Cerrahi izleme cihazları (yani kalp atış hızı izleme cihazı, nabız öküzü, modüler monitör sistemi) ve anestezi makineleri kurun.
- Varsa, cerrahi ısıtma tahtasını 42 °C'ye getirin.
- İzofluran evaporatörünü ısıtmak için havalandırma ve anestezi makinelerinin açık olduğundan emin olun. Anestezi haznesini 30 mL sıvı izofluran ile doldurun ve ventilatör makinesinin oksijene bağlı olduğundan emin olun.
NOT: Bu protokolde hayvanı entübe etmiyoruz; Oksijenasyon için sadece bir burun konisi kullanın.
- Alıcı ve donör farelerin vücut ağırlığını kaydedin.
- Yüksek güçlü cerrahi mikroskobu açın ve yüksekliği ve odağı cerrahın tercihlerine göre ayarlayın. Kalan cerrahi cihazların açık olduğundan emin olun (yani elektrokoter cihazı).
- Cerrahi aletlerin yanı sıra 10-0 naylon cerrahi bağları hazırlayın ve yerleştirin (Şekil 2).
NOT: Tüm cerrahi aletler 121 °C'de 30 dakika süreyle otoklavlanmıştır. Ek olarak, cerrahi aletlerin farklı konfigürasyonları eşit derecede etkili olabilir. - Portal ven (PV) ve koledok (CBD) stentleri için manşetleri hazırlayın (Şekil 3). Anjiyokateteri ve PE10'u yüksek güçlü mikroskop altında steril bir yüzeye yerleştirin. #11 cerrahi bıçak kullanarak, manşet gövdesinin üst kısmında yaklaşık 0,75 mm'lik bir çıkıntı ile 1,5 mm uzunluğunda bir manşet oluşturmak için anjiyokateteri kesin; polietilen boruyu (PE10) 2,5 mm uzunluğa kadar kesin. Manşetleri ve stenti kullanıma hazır olana kadar steril tuzlu suda saklayın.
NOT: Bu transplantasyon modeli, PV rekonstrüksiyonu için manşetler yapmak için 20 G'lik bir anjiyokateter ve CBD'nin rekonstrüksiyonu için bir polietilen boru 10 (PE10) kullanır. Diğer tüm anastomozlar elle dikilir. - Çözümler hazırlayın. 0.5 mL histidin-triptofan-ketoglutarat (HTK) çözeltisinde 100 U'da verilecek bir heparin enjeksiyonu hazırlayın. Salin, heparin-salin, PBS ve HTK koruma solüsyonunu buz üzerinde saklayın.
2. Donör fare alımı
- Donör fareyi bir izofluran inhalasyon odasına yerleştirerek anesteziyi indükleyin. İzofluran konsantrasyonunun 2 mL / dak oksijen akışı ile yaklaşık% 2,5 olduğundan emin olun. Cerrahi anestezi düzleminin gelişmesi için 5 dakika bekleyin. Uygun anestezi seviyesini sağlamak için, bir reaksiyon ortaya çıkarmak için fareyi parmaklarınızla sıkıştırın; Reaksiyon eksikliği, uygun anestezi seviyesinin karşılandığını gösterir.
- Elektronik makas kullanarak farenin karnını tıraş edin ve fareyi ısıtma tahtası üzerinde sırtüstü pozisyonda yerleştirin. Karnı povidon-iyot, daha sonra% 70 etanol ile temizleyin. Kuruluğu önlemek için farelerin gözlerinin altına oftalmik merhem yerleştirin.
- Fareyi yüksek güçlü mikroskobun altına yerleştirin ve 2 mL/dk oksijen akışı ile %2 konsantrasyonda izofluran inhalasyonu kullanarak fareyi anestezi altında tutun.
- Ksifoid işleminden kasık simfizine kadar bir makasla (cerrah tercihi) orta hat laparotomi yapın. Ardından, kaburgalardan daha düşük bir 'çapraz benzeri' desen oluşturmak için ek bir enine kesi yapın. Sivrisinek hemostatik forseps kullanarak, karın içeriğinin yeterli maruziyetini sağlamak için ksifoid işlemini geri çekin.
NOT: Forseps cerrahın tercihine bağlı olarak sabitlenebilir. - Bağırsakları boşaltın ve ıslak bir gazlı bezle karın boşluğunun sol tarafına yerleştirin. Tüm bağ eklerini indirerek karaciğeri harekete geçirin.
- Uygun hepatik arteri (pHA) ortaya çıkarın. Eğri forseps kullanarak damarı iskeletleştirin ve 10-0 naylon sütür ile bağlayın.
- Keskin ve künt diseksiyonun bir kombinasyonunu kullanarak CBD'nin tüm uzunluğunu inceleyin. Gelecekte kullanmak üzere yeterli bir uzunluk (karaciğerin alt sınırından ~ 1 cm) vermek için pankreasın üst sınırına mümkün olduğunca yakın bir duktotomi (CBD stenti için yeterince büyük) gerçekleştirin. Safra kanalı stentini ince forseps ile CBD'ye yerleştirin ve 10-0 naylon sütürle sabitleyin. CBD'nin distal yönünü 10-0 naylon sütür kullanarak bağlayın (Şekil 4).
- Islak bir gazlı bez süngeri kullanarak sağ hepatik lobu ksifoide doğru geri çekin ve IVC'yi açığa çıkarın. İnfra-hepatik IVC'yi (IHIVC) retroperitondan uzaklaştırın ve elde taşınan bir koter cihazı kullanarak sağ adrenal veni koterize edin (bkz.
- Sağ renal arter ve veni diseke edin ve sırasıyla 7-0 ve 10-0 naylon ile bağlayın. Sağ renal ven ve arteri ve kalan ligamentöz ekleri kesin. Son olarak, sağ böbreği çıkarın.
NOT: Bu, nihayet IHIVC'yi keserken daha iyi pozlama elde etmek için yapılır. - 100 U heparin çözeltisi ile 0,5 mL soğuk HTK'yı 30 G'lik bir iğne ile PV'ye enjekte edin. Heparinin sistematik olarak dağılması için 1 dakika bekleyin. Portal veni splenik ven ve superior-mezenterik venin hemen üstünden kesin.
- Donör karaciğeri perfüze etmek için IHIVC'ye 30 G'lik bir iğne ile soğuk HTK koruma solüsyonunu heparin ile yavaşça enjekte edin. PV'den gelen sıvı berraklaştığında çözeltiyi enjekte etmeyi bırakın. Enjeksiyon tamamlandıktan sonra, IHIVC'ye sağ böbrek damarının hemen üstüne bir mikro kelepçe yerleştirin ve kelepçenin hemen altından kesin. Bu adım tamamlandıktan sonra, ventilatörü kapatın ve hayvan ötenazi yapıldığı için izofluranı durdurun.
- CBD'yi daha önce adım 2.7'e yerleştirilen stentin distalini kesin. Ek olarak, kistik kanalı tanımlayın ve kanalı 10-0 Naylon sütür ile bağlayın. Daha sonra, safra kesesinin kubbesini bir çift forseps ile kavrayın ve keskin ve künt diseksiyon kombinasyonunu kullanarak safra kesesi fossasından serbest bırakın. Safra kesesi yeterince mobilize edildikten sonra, bir çift yaylı makas kullanarak, daha önce yerleştirilen dikişin üzerindeki kistik kanalı keserek kolesistektomiyi tamamlayın.
- Supra-hepatik IVC'yi (SHIVC) ortaya çıkarmak için karaciğeri inferiordan geri çekin. Alıcı hayvanda anastomoz için yeterli uzunluk sağlamaya özellikle dikkat ederek SHIVC'yi kesin.
- Karaciğere serbest ek bağ eklerini inceleyin ve donör karaciğeri ex-vivo olarak verin ve organı soğuk tuzlu su içeren bir kaba koyun.
3. Karaciğer allogreftinin arka masa hazırlığı
- Buzu yalıtımlı bir kaba koyun ve buz yatağına bir Petri kabı yerleştirin. Petri kabını soğuk tuzlu su ile doldurun. Karaciğer allogreftini, viseral yüzey açığa çıkacak şekilde tabağa yerleştirin.
- PV'yi önceden seçilen manşetten geçirin ve damarı iç endotel yüzeyi açığa çıkacak şekilde açın. Manşeti 10-0 naylon dikişle sabitleyin. En iyi sonuçlar için dikişin manşetin olukları içinde olduğundan emin olun (Şekil 5).
- SHIVC'yi ortaya çıkarmak için karaciğer allogreftini ayarlayın ve iki 8-0 yerleştirin Alıcı hayvanda nihai anastomoz için sırasıyla saat 3' ve 9 yönünde naylon askı dikişleri. IHIVC'yi ortaya çıkarmak için karaciğer allogreftini tekrar ayarlayın ve iki 8-0 yerleştirin Alıcı hayvanda nihai anastomoz için sırasıyla saat 3' ve 9 yönünde naylon askı dikişleri.
4. Alıcı işlemi
NOT: Bu steril bir işlem olduğundan, eldiven ve uygun kişisel koruyucu ekipman kullanın ve antibiyotik uygulayın. Ameliyat sırasında preoperatif analjezi olarak 0.1 mg / kg Buprenorfin subkutan olarak uygulayın.
- pHA'yı donör operasyonunda olduğu gibi ortaya çıkarın; Daha önce tarif edilen abdominal insizyon yerine sadece orta hat laparotomi kullanın.
- Karaciğeri harekete geçirin ve tüm bağ bağlantılarını kesin. Ek olarak, sol frenik ve paraözofageal damarları 10-0 naylon sütür ile bağlayın.
- Karaciğeri inferiordan geri çekin ve SHIVC'yi retroperitondan serbest bırakın. Daha sonra, karaciğeri üstün bir şekilde geri çekin ve IHIVC'yi retroperitondan serbest bırakın. Daha önce tarif edilenle aynı tekniği kullanarak küçük köprüleme damarlarını ve lomber damarları gerektiği gibi koterize edin.
- Sağ adrenal veni elde tutulan koter ile koterize edin ve karaciğer hilumunu ortaya çıkarın. pHA'yı 10-0 naylon sütür ile bağlayın. Daha sonra, CBD'yi PV'den serbest bırakın ve CBD anastomozu için yeterli bir uzunluk sağlamak için CBD'yi CBD'nin çatallanmasına yakın 7-0 sütür ile bağlayın.
- İnfra-hepatik IVC'yi klemplemek için bir mikro kelepçe kullanın ve PV'yi 7-0 sütürle geçici olarak bağlayın. An-hepatik fazı başlatın. İzofluran inhalasyonunu durdurun.
NOT: Portal ven ve IVC klemplendikten sonra, hepatik venöz dönüş anhepatik aşamada tamamen bloke edilir. İnhale anestezik izofluran karaciğer tarafından metabolize edilir; bu nedenle, birikme kardiyopulmoner kollapsa yol açabileceğinden solunması anlık olarak durdurulur. - Doğal karaciğerin PV'si aracılığıyla, organı yıkamak için 30 G'lik bir iğne ile 0.5 mL heparin-salin enjekte edin.
- Anastomoz için yeterli uzunlukta kalacak şekilde SHIVC ve IHIVC'ye mikrovasküler klempleri mümkün olduğunca proksimal ve distal olarak yerleştirin. Doğal SHIVC, IHIVC, PV (önceden yerleştirilmiş dikişe yakın) ve alıcının doğal karaciğerine kalan ligamentöz ekleri kesin ve doğal karaciğeri ex vivo olarak verin.
NOT: IHIVC klempi sağ böbrek damarının üzerinde olmalıdır. - Donör karaciğer allogreftini karın boşluğunun içine yerleştirin ve PV'yi ortaya çıkarmak için donör allogreftin hilusunu geri çekin. Hava embolisini önlemek için damarları havadan arındırmak için 30 G'lik bir iğne kullanarak hem donörü hem de doğal PV'yi 0,5 mL heparin salin ile yıkayın. Daha sonra, daha önce yapılmış donör PV manşonunu alıcı karaciğer PV'nin lümenine yerleştirin ve gerekirse anastomoza yardımcı olmak için kalan dikişleri yerleştirin (8-0 sütür). Anastomozu 7-0 sütür ile sabitleyin (Şekil 6).
- Tahtayı 180° döndürün. Donör ve doğal SHIVC ile 10-0 naylon sütür ile elle dikilmiş bir anastomoz gerçekleştirin. Arka duvar anastomozunu tamamladıktan sonra, hava embolisini önlemek için havasını boşaltmak için 0.5 mL heparin salin ile yıkayın. Üst duvarın tam anastomozu (Şekil 7).
- Önce PV'nin ligasyon sütürünü çıkarın; daha sonra reperfüzyonu başlatmak için vasküler klempleri SHIVC'den çıkarın. An-hepatik fazı sonlandırın ve izofluran inhalasyonunu yeniden başlatın. IHIVC'yi yeniden yapılandırmak için SHIVC anastomozunda olduğu gibi 10-0 naylon sütür ile elle dikiş anastomozu gerçekleştirin. Rekonstrüksiyonu tamamladıktan sonra, yeniden perfüze etmek için mikro kelepçeyi doğal ve verici IHIVC'den çıkarın (Şekil 8).
- CBD anastomozunu, daha önce yerleştirilmiş sütürün yakınında alıcı CBD üzerinde bir duktotomi oluşturarak gerçekleştirin. Stent'i donör CBD'ye alıcı CBD lümenine yerleştirin ve anastomozu 10-0 sütürle sabitleyin (Şekil 9).
- Karın boşluğunu 1 mL tuzlu su ile yıkayın; Hemostazı kontrol edin ve kalan kanayan damarları koterize edin. Karın kesisini 6-0 dikiş kullanarak iki kat halinde kapatın.
- Hayvanı iyileşmesi için ılık bir kuluçka makinesine (42 °C) koyun ve bilinci yerine gelene ve yeterli aktiviteye ulaşana kadar hayvanı gözetimsiz bırakmayın. Ameliyattan sonra deri altına 0.1 mg / kg buprenorfin uygulayın ve ameliyattan sonraki 48 saat boyunca her 8 ila 12 saatte bir uygulamaya devam edin. Ek olarak, ameliyattan sonraki 7 güne kadar alıcı hayvanın su şişesinden carprofen (400 mL suda çözülmüş 0.2 mL) uygulayın. Alıcı hayvanı 4-5 saat gözlemleyin ve tamamen iyileştikten sonra, diğer hayvanlarla birlikte olmak güvenli olduğu için onu barınma yerine geri koyun.
NOT: Ağrı kesici ilaçlar ve antibiyotikler yerel hayvan etik kurulu tavsiyelerine göre uygulanabilir.
5. Fare mikroCT anjiyografi görüntüleme
- Fareyi önceden belirlenmiş çalışma aralığı için gözlemledikten sonra, mikroCT anjiyografi kullanarak allogreftin açıklığını değerlendirmek için fareyi hazırlayın.
- İzofluran evaporatörünü ısıtmak için havalandırma ve anestezi makinelerinin açık olduğundan emin olun. Anestezi rezervuarını 30 mL sıvı izofluran ile doldurun ve ventilatör makinesinin oksijene bağlı olduğundan emin olun. MikroCT tarayıcıyı açın ve tüm yazılımların düzgün çalıştığından emin olun.
- MikroCT tarayıcı sisteminde edinme yazılımını başlatın.
- MikroCT ünitesinin monitöründe, Sistemi başlat'a tıklayın ve CT tarama modunu seçin.
- Yatağı çıkarın; Fare yatağını takın ve kilitleyin.
- Kurtarma kafesi için ısıtma tahtasını 42 °C'ye getirin.
- 1 mL'lik bir şırıngayı 100 μL CT kontrast maddesi ile doldurun. Gelecekteki intravenöz kontrast uygulaması için 30 gauge iğne takın. Şırıngada hava kabarcığı olmadığından emin olun.
- Kuyruk damarı kısıtlama sistemine bir fare yerleştirin. Fare tamamen emniyet sisteminin içine girdikten sonra, sistemin kapısını kapatın, kuyruğun dikey olarak düşmesine izin verin ve bir alkol solüsyonuyla (% 70 etanol) dikkatlice silin.
NOT: Kuyruk damarının kanülasyonundaki başarı, hayvanın kuyruğunu eldivenli bir elde birkaç dakika tutarak ısıtarak artırılabilir. - Kuyruğu distal yöne doğru kavrayın ve iki parmağınızı (işaret parmağı ve orta) planlanan enjeksiyon bölgesine yakın kuyruğun etrafına yerleştirin. Kuyruğun distal yönünü (enjeksiyon bölgesinin altında) başparmak ve yüzük parmağı arasına yerleştirin.
- Her iki parmak grubuyla hafifçe baskı uygulayın ve şırınga ve iğnenin kuyruğa paralel olduğundan emin olarak sığ bir derinlik kullanarak iğneyi damara sokun. İşaret parmağının proksimal kuyruktaki basıncını serbest bırakırken, BT kontrast maddesini intravenöz olarak uygulayın. Damarın çökmesine neden olabileceğinden şırınga ile aspirasyondan kaçının.
NOT: İğne damar içinde uygun şekilde konumlandırılmışsa enjeksiyon sırasında herhangi bir direnç hissedilmemelidir. Direnç varsa, iğneyi çıkarın ve orijinal enjeksiyon bölgesinin üzerine tekrar yerleştirin. Damarın kanülasyonu iki denemeden sonra bile başarısız olursa, iğneyi değiştirin. - Kontrastı başarılı bir şekilde enjekte ettikten ve iğneyi çıkardıktan sonra, kanamayı durdurmak için steril gazlı bez kullanarak enjeksiyon bölgesine hafif bir kompresyon uygulayın.
- Fareyi izofluran inhalasyon odasına aktarın ve 2 mL/dk oksijen akışı ile konsantrasyonu %2,5'e ayarlayın ve 3-4 dakika bekleyin. Bir anestezi düzlemi oluşturulduktan sonra, fareyi hızlı bir şekilde mikroCT tarayıcı yatağına aktarın ve tarayıcı masasına yüzüstü pozisyonda yerleştirin (Şekil 10).
- Hayvanın gözlerini uygun miktarda oftalmik merhem ile örtün. Burun konisini hayvanın üzerine uygun şekilde yerleştirin ve havanın ve izofluranın burun konisinden düzgün bir şekilde aktığından emin olun. Daha önce açıklanan anestezi parametrelerinin aynısını kullanın (adım 5.12). Görüntüleme sırasında hayvanın vücut ısısını sürekli olarak izlemek için bir rektal sıcaklık probu yağlayın ve yerleştirin.
- Fare ile temas edecek şekilde bir solunum cihazı yerleştirin.
- Sol, sağ ön ve sol arka bacaklara bir EKG pedi takmak için bant kullanın. EKG pedi ile cilt arasındaki sinyali iyileştirmek için ultrason jeli kullanın.
- Monitörde uygun QRS komplekslerinin görüldüğünden emin olmak için bilgisayar yazılımındaki EKG ve solunum sinyalini kontrol edin. Bunu yapmak için, Kaynak Kurulumu Sekmesindeki Mantık Kablosu'nu kontrol edin ve en net EKG eğrisini sunan kabloyu seçin.
NOT: Mantık uçları, sağ, sol göğüs ve alt bacağa bağlı üç EKG pedine karşılık gelir. Her ipucu bir EKG eğrisini temsil eder. - Uygun sinyal yüksekliği için Kazancı ayarlayın, genellikle 4 veya 8 iyidir. Çift kapıyı seçin. Ekran Kurulumu sekmesi altında, net bir sinyal görünümü için ekran ayarlarını yapın: EKG ve RESP'nin yanındaki kutuları işaretleyin ve her birini 500'e ayarlayın. Tetik Kurulumu sekmesi altında, Kanal A, Kanal B ve DualTrig'in işaretli olduğunu onaylayın.
- Aşağıdaki parametrelerin de ayarlandığından emin olun: Eşik: sinyal bu değerin altına düştüğünde; değeri 2.500 olarak ayarlayın; Histerezis: yeni bir tetikleme döngüsünün başladığı bir yazılım tetikleme noktası oluşturmak için sinyalin histerezisi geçtiğinden emin olun; değeri 300 olarak ayarlayın; Gecikme: tetikleyici gönderilmeden önce bekleyin; değeri 100 olarak ayarlayın; Engelle: bu süre zarfında sinyal üretilemez, değeri 200 olarak ayarlayın.
- EKG eşiğinin histerezis değerinin altında ve ekrandaki sT segmentinin tepe noktasının üzerinde olduğundan emin olun.
- Hayvanı tarayıcıya ilerletin ve Resmi güncelle'ye basın. Sonraki mikroCT görüntüsü için uygun görüş alanını ve anatomik tarama kapsamını seçmek için hayvanın bir X-ışını izci görüntüsünü elde edin.
- Aşağıdaki parametreleri kullanarak mikroCT anjiyografi görüntü alımı gerçekleştirin: Büyütmeler: Ultra odak, Tarama açısı: Tam (360) tarama, Enerji: Tek, Tarama Modu: Geçitli, Ayarlar: Varsayılan (tam 360° döndürme, X-ışını tüpü varsayılan ayarları 0,33 mA ve 55 kV, adım başına 0,750° derece, adım başına 1 projeksiyon, 1 x 1 gruplama ve 40 ms pozlama süresi; çift geçit, kalp ve solunum kapısı anlamına gelir) (Şekil 11).
- Taramanın tamamlanmasından sonra, hayvanı önceden ısıtılmış bir kurtarma kafesine aktarın. Hayvan tamamen iyileştikten sonra, onu birincil kafesine geri aktarın.
- Sistem yazılımını kullanarak mikroCT görüntülerini yeniden oluşturun. Görüntüyü yükledikten sonra, mavi çubukları anatomik ilgi alanını kapsayacak şekilde ayarlayın; Hacmi küçültmek ve fareyle mümkün olduğunca sınırlı hale getirmek için bir dilimin önizlemesini görüntüleyin (bu aşama, yeniden oluşturulan görüntünün boyutunu küçültmeye yardımcı olur).
- Görüntü sınırını optimize etmek için ilgilenilen anahat hacmini açın. 40 μm voksel boyutunu, Hann projeksiyon filtresini ve Gauss hacim filtresini (80 μm) seçin. İleri Düzey | Görüntü tabanlı geçit ve tetik pencerelerini ve fazı sırasıyla 0,5 ve 0,6'ya ayarlayın, kardiyak geçit için 10 faz seçin ve ardından ses rekonstrüksiyon düğmesine basın.
Temsili Sonuçlar
Cerrah olmayan, anatomiye aşina olmayan veya radyolojik sonuçları yorumlamaktan rahatsız olan araştırmacılar için, uygun görüntü analizi, uygun eğitime sahip personel tarafından yapılmalıdır. Bir farede OLT'nin başarısı yukarıdaki protokolde gösterilmiştir. Ayrıca, çalışma metriklerini geliştirmek ve bir naklin başarısı için gerçek zamanlı geri bildirim sağlamak ve ayrıca nekropsi ihtiyacını ortadan kaldırmak için, doğru ve net görüntüler sağlamak için bir mikroCT anjiyografi taraması kullanılabilir. Temsili resimler bu yazıda yer almaktadır (Şekil 11). İn vivo başarısız anastomozun temsili görüntüleri Şekil 12'de görülebilir.
Hepatik anatomi ve damar sistemine aşina olanlar, IVC'nin patentli venöz anastomozlarını görebilirler. Bazı durumlarda, portal ven manşeti nedeniyle bu modelde kolayca yapılan portal ven de görüntülenebilir. Açık anastomozların görüntülenmesi operasyonun teknik başarısını gösterir. Ek olarak, bu görüntülerin 3D rekonstrüksiyonu, araştırmacılara ek bilgi ve vasküler anatominin daha ayrıntılı bir görüntüsünü sağlayabilir. Yukarıdaki modeli kullanarak, OLT fare kohortundaki mortalite ~% 40-45'tir.

Şekil 1: Ortotopik karaciğer nakline genel bakış. (A) Dört farklı anastomozu gösteren grafik çizim: i) suprahepatik IVC anastomozu, ii) infrahepatik IVC anastomozu, iii) portal ven anastomozu, iv) koledok anastomozu. Her ok, damar veya kanalın kesilmesi gereken yer-supra-hepatik IVC (protokol adımı 2.13), infra-hepatik IVC (protokol adımı 2.11), portal ven (protokol adımı 2.10) ve ortak safra kanalı (protokol adımı 2.7) için göreceli bir konumu gösterir. (B) Anastomozların in vivo diyagramı. Ölçek çubuğu = 2 mm. Kısaltma: IVC = inferior vena kava. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
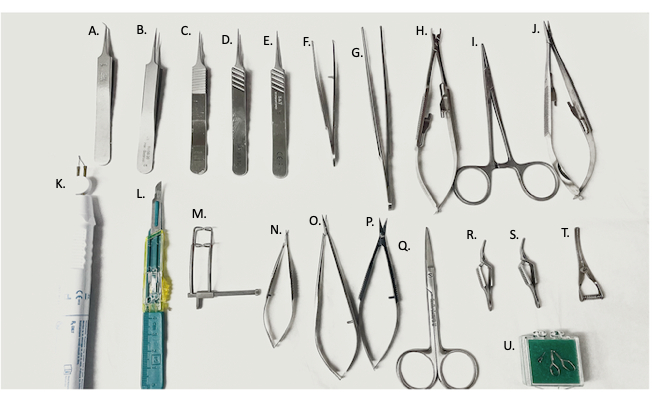
Şekil 2: Ameliyatta kullanılan cerrahi aletler. (A) 45° ince forseps, (B-E) ince forseps, (F) kavisli iğne tutucu/forseps, (G) düz forseps, (H) vasküler klemp uygulayıcı, (I) kanama durdurucu, (J) iğne tutucu, (K) elektro-koter cihazı, (L) #11 bıçak, (M) abdominal ekartör, (N,O) mikro makas, (P) ince makas, (Q) cerrahi makaslar, (R,S) Yaşargil klempleri, (T) bulldog ven klempleri, (U) mikro-vasküler klemp. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 3: Portal ven manşeti ve safra kanalı stent. Kullanımdan önce stentlerin ve manşetlerin ex vivo görüntüsü. Ölçek çubuğu = 3,5 mm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
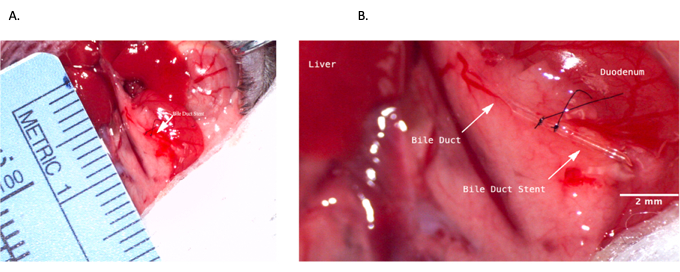
Şekil 4: Donör operasyonu sırasında ortak safra kanalı stentlemesi. (A) Safra kanalı stentinin koledok kanalına sokulması. (B) Safra kanalı içine sabitlenmiş safra kanalı stent. Ölçek çubuğu = 2 mm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
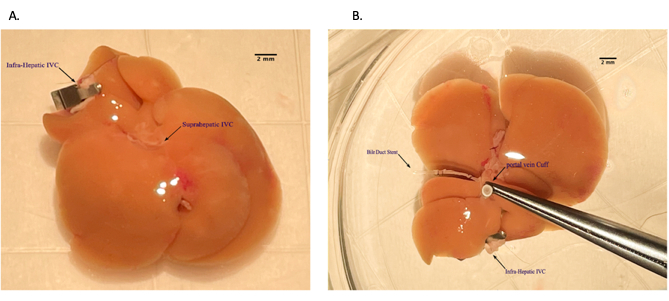
Şekil 5: Karaciğer allogreftinin arka masa hazırlığı sırasında portal ven manşetinin yerleştirilmesi. (A) Portal venin venöz manşetten geçirilmesi. (B) Manşetin üzerinde damar tıkanıklığı. Ölçek çubuğu = 2 mm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
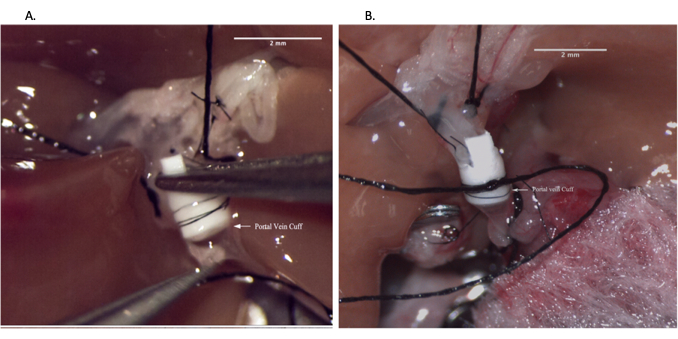
Şekil 6: Alıcı operasyonu sırasında portal ven anastomozu. (A) Alıcı portal venine ven manşetinin yerleştirilmesi. (B) Dikişle sabitlenmiş portal ven anastomozu. Ölçek çubuğu = 2 mm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
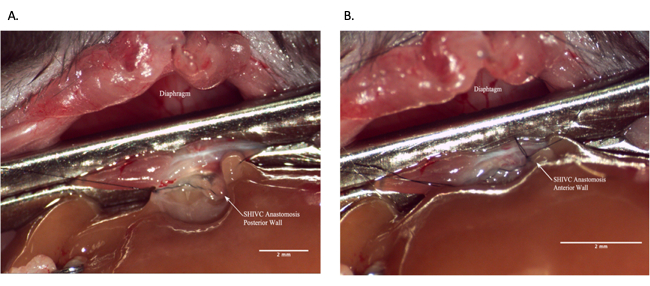
Şekil 7: Alıcı operasyonu sırasında suprahepatik IVC anastomozu. (A) Anastomozun arka duvarı tamamlanmıştır. (B) Tamamlanmış SHIVC anastomozu. Ölçek çubuğu = 2 mm. Kısaltmalar: IVC = inferior vena kava; SHIVC = suprahepatik IVC. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
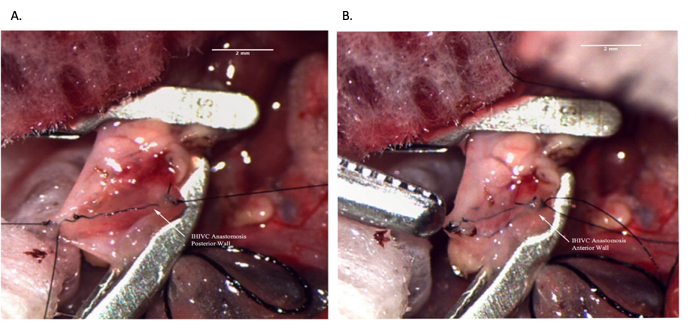
Şekil 8: Alıcı operasyonu sırasında infrahepatik IVC anastomozu. (A) Anastomozun arka duvarı tamamlanmıştır. (B) Tamamlanmış IHIVC anastomozu. Ölçek çubuğu = 2 mm. Kısaltmalar: IVC = inferior vena kava; IHIVC = infrahepatik IVC. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
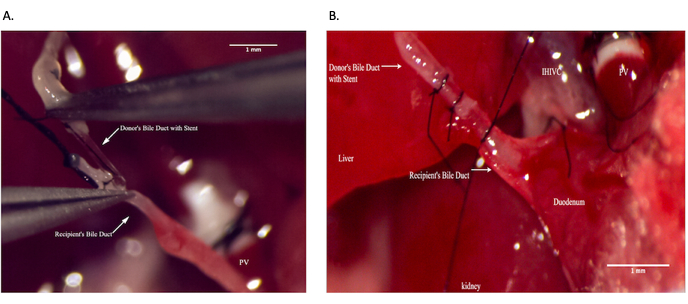
Şekil 9: Alıcı operasyonu sırasında koledok anastomozu. (A) Safra kanalı stentinin alıcı koledok kanalına yerleştirilmesi. (B) Safra kanalı anastomozunun güvence altına alınması. Ölçek çubuğu = 1 mm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 10: Fare mikroBT anjiyografi hayvan preparatı. (A) Kontrast uygulamak için fare kuyruğu damar enjeksiyonu. (B) Fare mikroCT makinesinden geçiriliyor. Kısaltma: mikroCT = mikrobilgisayarlı tomografi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
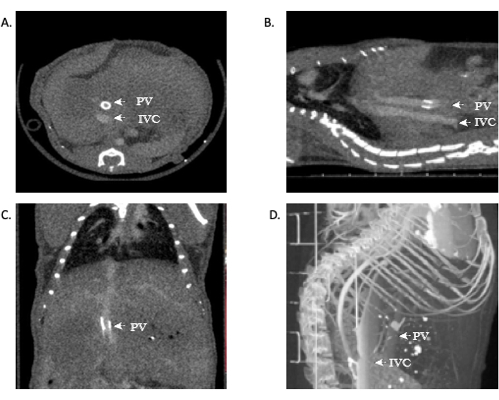
Şekil 11: Allogreft açıklığının mikroBT anjiyografisini gösteren temsili görüntüler. (A,B) Kontrast IVC boyunca görülebilir, bu da suprahepatik ve infrahepatik anastomozların açıklığını gösterir. (C) Portal damardaki kontrast, yine açıklığı gösterir. (D) Vaskülatürün 3D rekonstrüksiyonu. Kısaltmalar: mikroCT = mikrobilgisayarlı tomografi; IVC = inferior vena kava; PV = portal damar. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
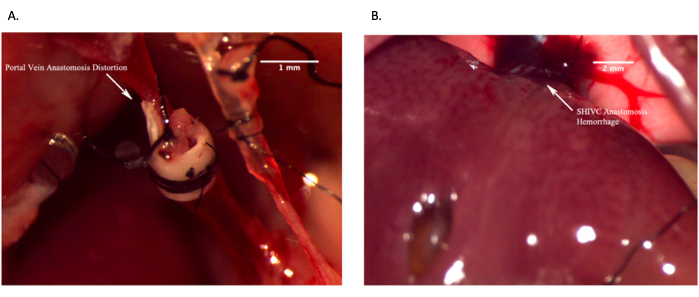
Şekil 12: Başarısız in vivo anastomozları gösteren temsili görüntüler. (A) Kan akışının olmamasına neden olan damarın bozulması nedeniyle başarısız portal ven anastomozu. (B) Aşırı kanama nedeniyle başarısız suprahepatik IVC anastomozu. Ölçek çubuğu = 2 mm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Kemirgenlerde OLT literatürde iyi tanımlanmıştır 2,8. Bu teknik olarak zorlu prosedürü gerçekleştirmek için, genellikle birkaç yıllık mikro cerrahi (veya genel olarak cerrahi) gereklidir, çünkü bu, sağlam bir anatomi anlayışı ve teknik yetenek gerektirir. Bu modeli geliştirirken, hepsi anastomozlar etrafında dönen birkaç teknik sorunla karşılaştık. Özellikle PV anastomozunda, anastomoz için damarı stabilize etmek genellikle zordur. Bir veya iki dikiş yerleştirmenin (cerrah tercihi) manşet yerleşimlerini kolaylaştırmaya yardımcı olduğunu bulduk. Daha fazla kalış sütürü yerleştirilmesinin ameliyat süresini uzattığına dikkat edilmelidir.
Ek olarak, SHIVC karın boşluğunun derinliklerindedir ve yeterli pozlama sağlamak için bir kelepçe yerleştirmek zordur. Fare kısıtlamasında mümkün olduğunca gevşetilirse, bunun damarın esnekliğine katkıda bulunacağını bulduk. Nihayetinde, uygulama ile uygun yerleşimi belirlemek cerraha kalmış olacaktır. Ayrıca, CBD anastomozu ile kanal yine çok hassastır. Kanalı stabilize etmek için kalıcı dikişler yerleştirmek zor olabilir ve muhtemelen küçük bir gazlı bez üzerine yerleştirmek stabilizasyonuna yardımcı olacaktır. Son olarak, tüm küçük memeliler anestezi süresi açısından benzersiz bir şekilde hassas olduğundan, ameliyatın mümkün olduğunca çabuk yapılması önemlidir. İdeal ameliyat süreleri aşağıdaki gibidir: 1) donör operasyonu, 45-60 dakika; 2) arka masa hazırlığı, 15 dk; 3) alıcı operasyonu, 60-80 dk. Uygulama, boşa harcanan hareketi azaltmaya yardımcı olacaktır.
Hayvan modelleri ilerledikçe, çalışma müdahalelerinin başarısını değerlendirme yeteneği de gelişmiştir. MikroBT ilk olarak 1990'ların sonlarında sıçanlarda vaskülatür üzerine çalışmalar yapmak için kullanıldı17. Kemirgenlerde doğru ve net mikroBT anjiyografi çalışmaları yapmanın birçok zorluğu vardır. Bununla birlikte, zorlukların çoğu, bu memelilerin kısa kalp ve solunum döngülerinden kaynaklanmaktadır. Bu, hareket artefaktlarını sınırlamak için kısa pozlamaların yanı sıra daha yüksek foton akıcılık oranları kullanılarak aşılır18. Genel olarak, kardiyak geçit kullanımının yanı sıra solunum hızını azaltmak için izofluran konsantrasyonlarının ayarlanmasının en net görüntüleri ürettiğini bulduk. Ayrıca, belirli fazlar için kemirgenlere özgü kontrast zamanlamasının kullanılmasının da bulduk: hepatik arteriyel faz, portal-venöz faz ve gecikmiş faz da görselleştirmeyi iyileştirmiştir19. ExiTron nano 12000 kontrast kullanımının çeşitli avantajları vardır ve genel görüntü kalitesini iyileştirebilir. Karaciğerde20 ve kanda21 en güçlü kontrast artışını sunar. Diğer bir avantaj, kontrastın ilk enjeksiyondan sonra 120 saate kadar karaciğerde mevcut olmasıdır, bu da tekrarlanan taramalar gerekiyorsa daha az kontrast gerektiğinden ilişkili karaciğer toksisitesini azaltabilir20.
Ayrıca, taramalar izofluran ile yatıştırılmış fare ile yapıldığından, fizyolojideki bu değişiklikle kontrast artışı değişmez20. Bu görüntüleme tekniklerini ve ExiTron kontrastını kullanarak, OLT'de başarılı anastomozların net bir şekilde değerlendirilmesi mümkündür. MikroBT, in-vivo allogreftlerin uzun bir süre boyunca noninvaziv değerlendirmesine izin verir. Bu protokol, vasküler anastomozları değerlendirmek için safiye edilmesi gereken hayvan sayısını azaltır ve birkaç hafta boyunca terapötikleri ve bunların damar sistemi üzerindeki etkilerini inceleme fırsatı verir.
Sınırlama
Tekniğini mükemmelleştirmek için OLT modelinin birden fazla revizyonu meydana gelmiş olsa da, mikroCT kullanılarak anastomozların görselleştirilmesinin hala devam eden bir süreç olduğu belirtilmelidir. Ayrıca, fare OLT, transplantasyon tıbbına benzersiz bir bakış açısı sunar. Ancak bu fareleri 1 haftadan sonra hayatta tutmak zor olduğu için kapsayıcı bir model değildir. Klinik öncesi deneyleri daha da doğrulamak için ek nakil modelleri de kullanılmalıdır.
Sonuç
MikroBT'deki gelişmeler son on yılda hızla ilerledi ve araştırmacılara hayvan modelleri ve transplantasyon alanında paha biçilmez yeni araçlar sağladı. Gelecekte, daha ayrıntılı 3D görüntüleme, araştırma ve keşif hakkında daha fazla bilgi sunacaktır.
Açıklamalar
Yazarların beyan edecek herhangi bir çıkar çatışması yoktur.
Teşekkürler
SMB, Ulusal Diyabet ve Sindirim ve Böbrek Hastalıkları Enstitüsü (NIDDK) hibe R01DK1234750 tarafından desteklenmektedir. BAW, Ulusal Sağlık Enstitüleri, Ulusal Kalp, Akciğer ve Kan Enstitüsü hibe R01HL143000 tarafından desteklenmektedir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| #11 Blade | Fisher Scientific | 3120030 | |
| 4-0 silk suture | Surgical Specialties Corp. | SP116 | |
| 6-0 nylon suture | AD Surgical | S-N618R13 | |
| 7-0 nylon suture | AD Surgical | S-N718SP13 | |
| 8-0 nylon suture | AD Surgical | XXS-N807T6 | |
| 10-0 nylon suture | AD Surgical | M-N510R19-B | |
| 20 G Angiocath | Boundtree | 602032D | |
| 30 G Needle | Med Needles | BD-305106 | |
| Baytril (enrofloxacin) Antibacterial Tablets | Elanco | NA | |
| Bovie Chang-A-Tip High Temp Cauterizer | USA Medical and Surgical Supplies | BM-DEL1 | |
| Bulldog Vein Clamp 1 1/8 | Ambler Surgical USA | 18-181 | |
| C57BL/6J mice | Jackson Labs | ||
| Castroviejo Micro Dissecting Spring Scissors | Roboz Surgical Store | RS-5668 | |
| Dumont #5 - Fine Forceps | Fine Science tools | 11254-20 | |
| Dumont #5 Forceps | Fine Science tools | 11252-50 | |
| Dumont Medical #5/45 Forceps - Angled 45° | Fine Science tools | 11253-25 | |
| ExiTron nano 12000 | Miltenyi Biotec | 130 - 095 - 698 | CT contrast agent |
| Forceps | Fine Science tools | 11027-12 | |
| Halsted-Mosquito Hemostat | Roboz Surgical | RS-7112 | |
| heparin | Fresnius Lab, Lake Zurich, IL | C504701 | |
| histidine-trypotophan-ketoglutarate | University Pharmacy | NA | |
| Insulated Container | YETI | ROADIE 24 HARD COOLER | https://www.yeti.com/coolers/hard-coolers/roadie/10022350000.html |
| Isoflurane | Piramal Critical Care | NDC 66794-017-25 | |
| ketamine | Hikma Pharmaceuticals PLC | NDC 0413-9505-10 | |
| Mirco Serrefines | Fine Science tools | 18055-05 | |
| Mouse Rectal Temperature Probe | WPI Inc | NA | |
| NEEDLE HOLDER/FORCEPS straight | Micrins | MI1540 | |
| PE10 Tubing | Fisher Scientific | BD 427400 | |
| perfadex | XVIVO Perfusion AB | REF99450 | |
| PhysioSuite | Kent Scientific | PS-MSTAT-RT | |
| Puralube Ophthalmic Ointment | Dechra | NA | |
| saline | PP Pharmaceuticals LLC | NDC 63323-186-10 | |
| Scissors | Fine Science tools | 14090-11 | |
| Small Mouse Restraint – 1” inner diameter | Pro Lab Corp | MH-100 | |
| SomnoSuite Small Animal Anesthesia System | Kent scientific | SS-MVG-Module | |
| Surgical microscope | Leica | M500-N w/ OHS | |
| U-CTHR | MI Labs | NA | CT Scanner software |
| Vannas-Tubingen Spring Scissors | Fine Science Tools | 15008-08 | |
| xylazine | Korn Pharmaceuticals Corp | NDC 59399-110-20 | |
| Yasagil clamp | Aesculap | FT351T | |
| Yasagil clamp | Aesculap | FT261T | |
| Yasagil clamp applicator | Aesculap | FT484T |
Referanslar
- Rana, A., et al. Survival benefit of solid-organ transplant in the United States. JAMA Surgery. 150 (3), 252-259 (2015).
- Qian, S. G., Fung, J. J., Demetris, A. V., Ildstad, S. T., Starzl, T. E. Orthotopic liver transplantation in the mouse. Transplantation. 52 (3), 562-564 (1991).
- Nakano, R., et al. Dendritic cell-mediated regulation of liver ischemia-reperfusion injury and liver transplant rejection. Frontiers in Immunology. 12, 705465 (2021).
- Nakamura, K., et al. Antibiotic pretreatment alleviates liver transplant damage in mice and humans. Journal of Clinical Investigation. 129 (8), 3420-3434 (2019).
- Lee, S. K., et al. Patient-derived Avatar mouse model to predict the liver immune homeostasis of long-term stable liver transplant patients. Frontiers in Immunology. 13, 817006 (2022).
- Li, S. P., et al. Characterization and proteomic analyses of proinflammatory cytokines in a mouse model of liver transplant rejection. Oxidative Medicine and Cellular Longevity. 2022, 5188584 (2022).
- Huang, D. R., Wu, Z. J., Zhu, Y. Modified arterialization of orthotopic liver transplantation in a mouse model. Hepatobiliary Pancreatic Disease International. 9 (3), 264-268 (2010).
- Yokota, S., et al. Orthotopic mouse liver transplantation to study liver biology and allograft tolerance. Nature Protocols. 11 (7), 1163-1174 (2016).
- Chen, X. C., et al. Reduced complications after arterial reconnection in a rat model of orthotopic liver transplantation. Journal of Visual Experiments. (165), e60628 (2020).
- Nelson, K., et al. Method of isolated ex vivo lung perfusion in a rat model: lessons learned from developing a rat EVLP program. Journal of Visual Experiments. (96), e52309 (2015).
- Nelson, K., et al. Animal models of ex vivo lung perfusion as a platform for transplantation research. World Journal of Experimental Medicine. 4 (2), 7-15 (2014).
- Lee, Y. G., et al. A rat lung transplantation model of warm ischemia/reperfusion injury: optimizations to improve outcomes. Journal of Visual Experiments. (176), e62445 (2021).
- Di Martino, M., et al. Imaging follow-up after liver transplantation. British Journal of Radiology. 89 (1064), 20151025 (2016).
- Vardar, B. U., Dupuis, C. S., Goldstein, A. J., Vardar, Z., Kim, Y. H. Ultrasonographic evaluation of patients with abnormal liver function tests in the emergency department. Ultrasonography. 41 (2), 243-262 (2022).
- Marx, J. Imaging. Animal models: live and in color. Science. 302 (5652), 1880-1882 (2003).
- Maehara, N. Experimental microcomputed tomography study of the 3D microangioarchitecture of tumors. European Radiology. 13 (7), 1559-1565 (2003).
- Garcia-Sanz, A., Rodriguez-Barbero, A., Bentley, M. D., Ritman, E. L., Romero, J. C. Three-dimensional microcomputed tomography of renal vasculature in rats. Hypertension. 31, 440-444 (1998).
- Badea, C., Hedlund, L. W., Johnson, G. A. Micro-CT with respiratory and cardiac gating. Medical Physics. 31 (12), 3324-3329 (2004).
- Ma, G., et al. Assessment of hemodynamics in a rat model of liver cirrhosis with precancerous lesions using multislice spiral CT perfusion imaging. BioMed Research International. 2013, 813174 (2013).
- Mannheim, J. G., et al. Comparison of small animal CT contrast agents. Contrast Media and Molecular Imaging. 11 (4), 272-284 (2016).
- Rothe, J. H., et al. Time course of contrast enhancement by micro-CT with dedicated contrast agents in normal mice and mice with hepatocellular carcinoma: comparison of one iodinated and two nanoparticle-based agents. Academic Radiology. 22 (2), 169-178 (2015).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır