Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
SARS-CoV-2 Virüsünü Ters Transkripsiyon Döngü Aracılı İzotermal Amplifikasyon ile Tespit Etme
Bu Makalede
Özet
Burada, ters transkripsiyon döngü aracılı izotermal amplifikasyon (RT-LAMP) ile insan örneklerinde SARS-CoV-2 virüsünü tespit etme yöntemini standartlaştırmak ve uygulamak için eksiksiz bir protokol sunuyoruz. 60 dakika içinde yapılan bu yöntem, düşük maliyetle ve ucuz ekipman kullanılarak herhangi bir laboratuvara veya bakım noktasına uyarlanabilir.
Özet
Şiddetli akut solunum sendromu koronavirüs 2 (SARS-CoV-2) virüsü insan sağlığını önemli ölçüde etkiledi. Modern toplum için bir tehdit olmaya devam ediyor çünkü birçok insan enfeksiyon sonucu ölüyor. Hastalık, altın standart gerçek zamanlı polimeraz zincir reaksiyonu (RT-PCR) gibi serolojik ve moleküler testler kullanılarak teşhis edilir. Sonuncusunun çeşitli dezavantajları vardır çünkü özel altyapı, maliyetli ekipman ve eğitimli personel gerektirir. Burada, insan örneklerinde ters transkripsiyon döngü aracılı izotermal amplifikasyon (RT-LAMP) kullanarak SARS-CoV-2 virüsünü tespit etmek için gerekli adımları özetleyen bir protokol sunuyoruz. Protokol, in silico primerlerin tasarlanması, reaktiflerin hazırlanması, amplifikasyon ve görselleştirme için talimatlar içerir. Standartlaştırıldıktan sonra, bu yöntem 60 dakika içinde düşük maliyetle ve ucuz ekipman kullanılarak herhangi bir laboratuvara veya bakım noktasına kolayca uygulanabilir ve uyarlanabilir. Farklı patojenleri tespit etmek için uyarlanabilir. Bu nedenle, zamanında epidemiyolojik sürveyans yapmak için sahada ve sağlık merkezlerinde potansiyel olarak kullanılabilir.
Giriş
Şiddetli akut solunum sendromu koronavirüs 2 (SARS-CoV-2), 2019 koronavirüs hastalığına (COVID-19) neden olur. Dünya Sağlık Örgütü, 30 Ocak 2020'de uluslararası endişe verici bir halk sağlığı acil durumu ve 11 Mart 2020'de bir pandemi ilan etti. Pandemi, bu makalenin yazıldığı tarih itibariyle 760 milyondan fazla vaka ve 6,87 milyon ölümle sonuçlandı1.
Bu virüsün etkisi, bulaşıcı hastalık tespiti ve kontrolünü iyileştirmek için daha iyi, daha doğru, daha hızlı ve daha yaygın olarak kullanılabilen gözetim araçlarına olan ihtiyacı vurgulamıştır 2,3. Pandemi sırasında, SARS-CoV-2 tanı testleri nükleik asit, antikorlar ve proteinlerin tespit edilmesine dayanıyordu, ancak nükleik asidin RT-PCR tespiti altın standarttır4. Bununla birlikte, RT-PCR'nin bazı sınırlamaları vardır; Moleküler biyoloji konusunda eğitim almış özel ekipman, altyapı ve personel gerektirir ve uygulamasını özel laboratuvarlarla sınırlar. Ayrıca, numunelerin laboratuvara taşınması için gereken süre dahil olmak üzere zaman alıcıdır (4-6 saat),bu da 5 gün sürebilir. Bu kısıtlamalar, verimli numune işlemeyi ve acil durum planlaması ve epidemiyolojik yönetim için gerekli bilgilerin elde edilmesini engeller.
Ters transkripsiyon döngü aracılı izotermal amplifikasyonun (RT-LAMP), RT-PCR'ye göre çeşitli avantajları vardır, bu da onu, özellikle kaynak kısıtlı ortamlarda gelecekteki bakım noktası tanı testlerini (POCT) tasarlamak için çekici bir strateji haline getirir6. Birincisi, büyük ölçüde spesifiktir, çünkü DNA veya RNA7,8 olsun, hedef dizideki altı ila sekiz alanı tanıyan dört ila altı primer kullanır. İkincisi, sabit bir sıcaklıkta çalıştığı için, amplifikasyonu oluşturmak için gerçek zamanlı termal döngüleyiciler gibi karmaşık ekipmanlara ihtiyaç duymaz ve onu çalıştırmak için yüksek eğitimli personel gerektirmez. Üçüncüsü, reaksiyon süresi çok kısadır (~ 60 dakika) ve çok özel olmayan reaktifler kullanılır, bu da onu uygun maliyetli bir araç haline getirir6. Yukarıda belirtilenler ve COVID-19 pandemisinin neden olduğu sağlık acil durumu göz önüne alındığında, bu teknik, herhangi bir araştırma laboratuvarında hızlı, ucuz ve uygulanması kolay alternatif bir tanı yöntemi olarak görülebilir9.
SARS-CoV-2'yi bir termodöngüleyici ve bir su banyosu kullanarak kolorimetrik yöntemlerle tespit etmek için bir RT-LAMP'nin standartlaştırılması ve uygulanmasına ilişkin protokol bu makalede açıklanmaktadır (Şekil 1). Kritik noktalar, sınırlamaları ve bunları ilerletmek için alternatifler tartışılmaktadır.
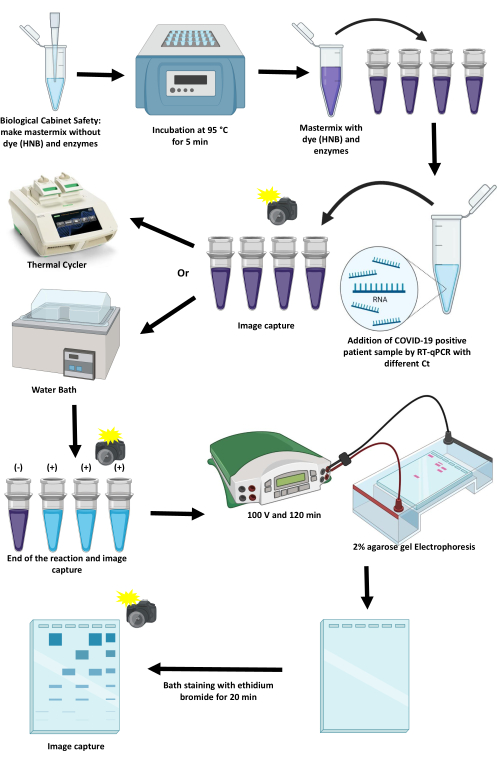
Şekil 1: RT-LAMP tekniği kullanılarak SARS-CoV-2'yi yükseltmek için protokolün şeması. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Protokol
Kullanılan örnekler, Fundación Valle del Lili Üniversite hastanesinin klinik laboratuvarı tarafından sağlandı ve RT-qPCR tekniği kullanılarak COVID-19 testi pozitif çıkan hastalardan alınan saflaştırılmış RNA'ya karşılık geldi. Tüm hastalar araştırma için bilgilendirilmiş onam verdi ve bu çalışma Fundación Valle del Lili Üniversitesi hastanesinden insan çalışmaları için biyoetik komitesi tarafından onaylandı.
1. RT-LAMP astar tasarımı ve hazırlanması
NOT: LAMP astarları, New England BioLabs (NEB) LAMP, Primer Explorer ve LAMP tahlil çok yönlü analizi (LAVA) dahil olmak üzere çeşitli platformlarla kullanılabilir. Ancak bu protokol için NEB LAMP aracı kullanıldı. Primer tasarımı, NextStrain veri tabanı10'dan elde edilen SARS-CoV-2 genomları kullanılarak yapılabilir. Tablo 1 , bu protokolde kullanılan astar setini göstermektedir.
- LAMP için astar tasarımı
- Viral genom dizileri elde edin.
- Konsensüs sırasını elde etmek için dizi hizalamaları gerçekleştirin.
- NEB LAMP astar tasarım aracı platformu11'e gidin ve hızlı kılavuzdaki talimatları izleyin. Bu araç, primer explorer V5 ile aynı sonuçları verir, ancak çıktısında çok daha kullanıcı dostudur. Astar tasarımı için kılavuz olarak astar gezgini kullanım kılavuzlarını kullanın.
- Primer setinin termodinamik değerlendirmesi
- Elde edilen astarlar üzerinde termodinamik bir analiz yapmak için Primer-Dimer12 aracını kullanın.
- Astar dizilerini alete yerleştirin. Ardından, Multipleks Analizi ve Dimer Yapı Raporu seçeneğini seçin.
- ΔG'si -5'ten az olmayan astar setlerini seçin.
- Tasarlanan primerlerin özgüllük değerlendirmesi
- Her bir astarı analiz etmek için BLAST13'teki Nükleotid koleksiyonu (nt/nt) veritabanını kullanın.
- İlk BLAST analizini gerçekleştirmek için, Refseq_rna Veri Tabanını seçin ve aramayı Orthocoronavirinae alt familyasına ait cins grubuyla filtreleyin. Bunlar Alfakoronavirüs (taksi:693996), Gamakoronavirüs (taksi:694013) ve Deltakoronavirüs (taksi:1159901). Ek olarak, diziyi H1N1 alt tipi (taksi:114727), İnfluenza A virüsü (taksi:11320) ve İnfluenza B virüsü (taksi:11520) olarak birlikte dolaşan diğer virüslere karşı değerlendirin.
- İkinci BLAST analizini gerçekleştirmek için Betacoronavirus GenBank'ı seçin ve aramayı Coronaviridae (taxid:11118) ve SARS (taxid:694009) ile filtreleyin. Bu gruplar, yarasalarda bulunan genomlar, Betacoronavirus (taksi:694002) dahil olmak üzere tanımlanmış tüm SARS Coronavirus genomlarının dizilerini içerir.
- Bu protokol için, primerlerin hedef genom olan SARS-CoV-2 dışındaki genomlarla hizalanmadığından emin olun.
- Astar hazırlama
- Tüp açma sırasında kayıpları önlemek için iyofilize primerleri içeren şişeleri bir mikrosantrifüj (10.000 x g, oda sıcaklığında [RT]) ile döndürün.
- İyofilize tozu %0.1 dietil pirokarbonat (DEPC) su veya nükleaz içermeyen su içinde 100 μM'lik nihai konsantrasyona kadar yeniden sulandırın (Tablo 2) ve yukarı ve aşağı pipetleyerek iyice çözün. Daha sonra, tüpün altındaki tüm primer çözeltilerini toplamak için bir mikrosantrifüjde maksimum hızda (10.000 x g, RT'de 1 dakika) döndürün.
- 10x astar karışımını, Tablo 2'de belirtildiği gibi ileri iç astar (FIP), geri iç astar (BIP), ileri dış astar (F3), geri dış astar (B3), geriye doğru döngü (LB) ve döngü ileri (LF) astarları ile bir biyogüvenlik kabini altında hazırlayın. Kayıpları önlemek için, bir mikrosantrifüj ile hızlı bir sıkma (10.000 x g, RT'de 1 dakika) gerçekleştirmeden önce astar çözeltisini pipetleyin veya hafifçe girdaplayın.
- Uzun süreli saklama için 10x astar karışımını -20 °C'de saklayın; Bununla birlikte, çok fazla donma-çözülme döngüsünden kaçınmak için birkaç numuneden bağımsız olarak en fazla beş deney için yeterince hazırlık yapın.
NOT Daha küçük bir hacimde astar karışımına ihtiyaç duyulursa, yeni hacimleri hesaplayarak değerleri ayarlayın (Tablo 2). Ayrıca, RdRp ve RdRp/Hel setleri LF primerini içermez çünkü RT-LAMP reaksiyonları için döngü primerleri gerekli değildir. Sonuç olarak, LF astarının hacmini nükleaz içermeyen su veya %0,1 DEPC su ile değiştirin.
2. RT-LAMP reaksiyonu
- Laminer akış kabinini üreticinin talimatlarına göre açın ve hava akışının stabilize olması için en az 3 dakika bekleyin.
- Hava akışı stabil hale geldiğinde, kabinin iç yüzeylerini aseptik bir teknik kullanarak temizleyin ve sterilize edin. Bunu başarmak için aşağıdaki dezenfektanları şu sırayla kullanın: 1000 ppm kuaterner amonyum (benzalkonyum klorür), %2 hipoklorit, %3 hidrojen peroksit ve %70 etanol.
NOT: Bu durumda, aseptik teknik, dezenfektanın uygulanmasını ve daha önce temizlenmiş yüzeylerin üzerinden geçmeden kabinin içinden dışarıya peçetelerle çıkarılmasını gerektirir. - Adım 2.2'deki dezenfektanları kullanarak kabine girecek malzemeleri aynı sırayla temizleyin.
NOT: Mikropipetler, filtre ucu kutuları, 1.5 mL ve 0.6 mL tüplü şişeler, 0.2 mL PCR tüpleri, raflar ve 400 mL beher kabine getirilmelidir. - Kabine biraz peçete ve nitril eldiven getirin. Bundan sonra kabini kapatın ve 15 dakika boyunca ultraviyole (UV) ışığa maruz bırakın.
DİKKAT: Uzun süreli radyasyona maruz kalmaktan kaynaklanan doku ve DNA hasarını önlemek için, adım 2.4'te belirlenen süre sona erene kadar UV ışığından kaçının.
NOT Protokole başlamadan önce Şekil 2'de gösterilen montajı gerçekleştirin ve adım 2.4'ü tamamladıktan sonra su banyosuna başlayın. Metal kabı neredeyse ağzına kadar içme suyu ile doldurmak ve demir laboratuvar ısıtma plakasının sıcaklığını 90 °C'ye ayarlamak çok önemlidir, çünkü bu, cıvalı termometre ile izlenen sistemde ~66.3 °C'lik bir sıcaklığa neden olacaktır. - Işınlama süresi sona erdikten sonra kabini yeniden başlatın ve adım 1.1'deki önerileri izleyin.
- Reaktifleri (Tablo 3, Tablo 4 ve Tablo 5) buz dolu bir soğutucuya veya küçük polistiren buzdolabına yerleştirin. Kabı %70 etanol ile temizledikten sonra kabine koyun.
- 0.6 mL'lik bir mikrosantrifüj tüpünde, amplifiye edilecek genin LAMP karışımını (RdRp, NA ve RdRp / Hel) hazırlayın ve yalnızca aşağıdaki bileşenleri ekleyin: 10x Tampon, MgSO4, dNTP'ler, 1x primer karışımı ve nükleaz içermeyen su veya% 0.1 DEPC suyu; Homojen hale getirmek için pipetleyerek iyice karıştırın.
DİKKAT: Kabin içindeki yanlış kullanım ve davranış nedeniyle, reaktif kontaminasyonu riski yüksektir. Bu sorunu azaltmak için aşağıdaki kurallara uyulmalıdır: (i) steril ve filtre uçları kullanın; (ii) her reaktif için bir uç kullanın; (iii) laminer akışı bozmamak için yavaş ve dikkatli hareket edin; (iv) düzeni korumak ve en az malzemeyi kullanmak; ve (v) karışımı hazırlamak ve genetik materyali eklemek için farklı eldivenler kullanın.
NOT: Tüm reaktifleri, özellikle enzimleri, buz üzerinde tutun, çünkü sıcaklık değişiklikleri onları denatüre edebilir ve polimeraz aktivitesini değiştirebilir. - 0.6 mL'lik tüp(ler)i kapağı kapalı olarak bir ısıtma bloğuna yerleştirin ve 95 °C'de 5 dakika inkübe edin.
NOT: LAMP karışım hazırlığına başlamadan önce kabinin dışında bulunan 1.5-2.0 mL tüpler için ısıtma bloğunu en az 30 dakika açın ve sıcaklığı (95 °C) bir cıva veya alkol termometresi ile izleyin. - Kuluçka tamamlandığında, tüpleri 5 dakika boyunca buz dolu bir polistiren soğutucuya yerleştirin.
- Tüpleri laminer akış kabinine geri koyun ve DNA polimeraz (Bst 3.0), ters transkriptaz ve yüksek kaliteli DNA polimeraz (Tablo 3, Tablo 4 ve Tablo 5) enzimlerini ekleyerek LAMP karışım hazırlığını tamamlayın. Kolorimetrik algılama kullanılması durumunda, hidroksinaftol mavisi (HNB) boyasını ekleyin.
- Bu reaktifleri ekledikten sonra, enzimleri ve boyayı çözündürmek için LAMP reaktiflerini pipetleyerek çok iyi karıştırın.
- Her bir PCR tüpünü 22.0 μL karışımla doldurun ve kabarcık oluşturmamaya dikkat edin. Ardından, negatif kontrol veya tüpsüz şablon kontrolüne (NTC) 3.0 μL %0.1 DEPC su veya nükleaz içermeyen su ekleyin ve kalan tüp(ler)i ekleme (genetik materyal) için bir kenara koyun.
NOT : Bst 3.0 enzimini aktive etmekten ve reaksiyonu erken başlatmaktan kaçınmak için numune eklenene kadar PCR tüplerini buz dolu bir soğutucuda tutun. - Tüm malzemeleri kabinden çıkarın ve yüzeyleri temizlemek için %70 etanol kullanın. Ardından, üreticinin talimatlarını izleyerek kapatın.
- Ayrı bir alanda, her bir PCR tüpüne 3 μL numune ekleyin ve iyice homojenize edin. Bunu gerçekleştirmek için 20 μL'lik bir mikropipet ve filtre uçları kullanın.
DİKKAT: Genetik materyali eklemek için kullanılan mikropipet yalnızca bu amaç için kullanılmalıdır ve karışımı hazırlamak için kullanılamaz. Bu şekilde, reaktiflerin kontaminasyonu önlenir. Ek olarak, RNA bozunması olasılığını azaltmak için RNA örneklerini her zaman buzun üzerinde tutun. Numune eklemek için aşağıdaki kişisel koruyucu ekipmanı (KKD) kullanın: tek kullanımlık önlük, şapka, N95 maskesi, tozluk, laboratuvar gözlüğü ve nitril eldivenler. - Kolorimetrik reaksiyonu gerçekleştirmeden önce, yüksek kaliteli bir kamera ile PCR tüplerinin fotoğraflarını çekin. HNB ile başlangıç rengi menekşe rengidir.
- Reaksiyonu aşağıdaki sistem veya ekipmanda gerçekleştirin: (i) termal döngüleyici ve (ii) su banyosu.
- Termal döngüleyici: Tüpleri reaksiyon bloğuna yerleştirin ve termoprofili (bkz. Tablo 6) ekipman üzerine kurun.
- Su Banyosu: Tüpleri dairesel kaplara koyun ve dışarı çıkmalarını önlemek için çok iyi ayarlayın. Bundan sonra, kapları Tablo 2'da listelenen sıcaklıkta su banyosuna (Şekil 6A, B) yerleştirin.
- Su banyosu durumunda, tüpler sistemin içine girdikten sonra zamanlayıcıyı 60 dakika boyunca başlatın (Tablo 6).
- Reaksiyon süresinden sonra tüpleri termal döngüleyiciden veya su banyosundan çıkarın ve elektroforetik çalışma için 4 °C'de veya kullanıma kadar -20 °C'de saklayın.
- Kolorimetrik bir reaksiyon gerçekleştirildiyse, yüksek kaliteli bir kamera kullanarak PCR tüplerinin fotoğraflarını çekin. HNB ile son renk gök mavisidir.
3. Agaroz jel içindeki amplifikasyon ürünlerinin analizi
NOT: Bu adımlar, standardizasyon adımı sırasında kolorimetrik reaksiyon veya performans kontrolü için ek kontroller olarak önerilir. Bunun nedeni, tekniğin bu testleri yapan laboratuvar için büyük bir kontaminasyon riski oluşturabilmesidir.
- Yatağı, kenar lastikleri duvarlara temas edecek şekilde elektroforez odasının içine yerleştirin ve agaroz (iç oda) ilavesi için sızdırmaz bir alan yaratın (Şekil 3A, B).
- Adım 3.1'i tamamladıktan sonra,% 2'lik bir jel elde etmek için gerekli miktarda agarozu 500 mL'lik bir beherde tartın. Bundan sonra, gerekli hacimde 0.5x Tris-asetat EDTA (TAE) tamponu ekleyin ve 1-2 dakika mikrodalgada pişirin.
NOT: Agaroz, fırından çıkarıldığında yarı saydam ve topaksız olduğunda tamamen erir. Bu doğrulanmazsa, zayıf jelleşmiş bölgeler kalabilir ve bu da amplifikasyon ürünlerinin elektroforetik çalışmasının ve görselleştirmesinin değişmesine neden olabilir. - Beheri fırından çıkarın ve agarozu adım 3.1'de oluşturulan iç hazneye dökün (Şekil 3C). Ardından, kabarcık olmadığını kontrol edin ve varsa, bir mikropipet ucu kullanarak bunları çıkarın.
- Tarağı kuyucukları oluşturacak şekilde düzenleyin ve agarozu oda sıcaklığında (RT) yaklaşık 30 dakika jelleşmeye bırakın.
- Bu süreden sonra, tarakların ve jeli içeren yatağın çıkarılmasını kolaylaştırmak için 5 mL 0.5x TAE tamponu ekleyin. Ardından jeli, oyuklar anotun içinde olacak şekilde konumlandırın (Şekil 3D).
- Elektroforez odasını üretici tarafından belirtilen kapasiteye kadar 0,5x TAE tamponu ile doldurun ve elektrotların tamponla temas halinde olduğundan emin olun.
- Jelin ilk oyuğuna 3 μL moleküler ağırlık markörü ekleyin ve sonraki oyuklara 9 μL NTC ve her bir numune ekleyin. Bunları, 7 μL amplifikasyon ürününü 3 μL yükleme tamponu ile birleştirerek yapın; daha sonra bu karışımın 9 μL'sini jelin kuyularına yükleyin.
- Elektroforez odasını kapakla kapatın ve kabloları renk desenindeki güç kaynağı bağlantı noktalarına bağlayın. Güç kaynağını aşağıdaki parametrelere ayarlayın: 100 V ve 120 dakika boyunca sabit amper.
- Elektroforetik çalışma tamamlandıktan sonra, jeli boyama solüsyonu (etidyum bromür) ile kabın içine koyun ve 30 dakika inkübe edin.
- İnkübasyondan sonra, jeli boyama solüsyonundan çıkarın ve kilitli bir torbaya koyun. Bu, amplikonları görselleştirmek için kullanılacak ekipmanın kirlenmesini önler.
- Jeli Amersham Imager 600 gibi bir aydınlatıcı veya görüntüleyici üzerinde görselleştirin.
Sonuçlar
Protokolün uygulanması, yukarıda açıklanan protokolü izleyerek her bir hedef gen için primer setinin tasarlanmasıyla başlar. Haziran 2020'de, NextStrain veritabanından 5.000 SARS-CoV-2 genomu elde edildi ve Kolombiya genomlarının %10'luk bir temsiliyeti oldu. Bu diziler, astar tasarım sürecinde kullanılan konsensüs dizisini elde etmek için hizalandı. Tablo 1 , RdRp/Hel ve RdRp primerleri için seçilen primer setini göstermektedir. Gen N amplifikasyonu için primer seti, daha önce yay...
Tartışmalar
RT-LAMP, moleküler tanı yapmak için tamamlayıcı bir metodoloji olarak kabul edilse de, protokol standartlaştırılırken ve uygulanırken dikkate alınması gereken bazı sınırlamaları ve kritik adımları da vardır.
SARS-CoV-2'nin tespiti için LAMP standardizasyonu, ana karışımdaki aşağıdaki parametreleri ve bileşenleri değerlendirdi: (a) primerlerin konsantrasyon ve hizalama sıcaklığı; (b) Enzimlerin konsantrasyonu, (c) magnezyum konsantrasyonu; (d) reaksiyon süresi; ...
Açıklamalar
Natalia Campillo-Pedroza, BioDx: Diagnóstico y Soluciones Biotecnológicas S.A.S. şirketinin CEO'sudur. Yazarların geri kalanı herhangi bir çıkar çatışması beyan etmemektedir.
Teşekkürler
Bu çalışma, Kolombiya'dan Sistema General de Regalías, BPIN 2020000100092 numaralı hibe ve Universidad Icesi - Convocatoria Interna, CA0413119 numaralı hibe tarafından finanse edilmiştir. MFVT ayrıca Universidad de los Andes'ten Yardımcı Doçentlik Fonları tarafından finanse edildi. Finansman sağlayan kuruluşlar, tasarımın yapılmasına, faaliyetlerin yürütülmesine, veri toplanmasına ve veri analizine ve makalenin hazırlanmasına katılmamıştır. Sars -CoV-2 örneklerinden elde edilen viral RNA için Üniversite Hastanesi Fundación Valle del Lili'ye ve el yazması hakkındaki yorumları için Dr. Alvaro Barrera-Ocampo'ya teşekkür ederiz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1 kb DNA Ladder | SOLIS BIODYNE | 07-12-00050 | Store at -20 °C |
| 50x TAE Electrophoresis Buffer | ThermoScientific | B49 | Store at roome temperature |
| Accuris High Fidelity Polymerase | ACCURIS LIFE SCIENCE REAGENTS | PR1000-HF-200 | It can be used in case Q5 High-Fidelity DNA polymerase cannot be purchased. For the enzyme, make aliquots of an appropriate volume and store at -20 °C until use. |
| Agarose | PanReacAppliChem | A8963,0100 | N/A |
| Bst 3.0 DNA Polymerase 8000 IU/mL | New England BioLabs | M0374S/M0374L | For the enzyme, make aliquots of an appropriate volume and store at -20 °C until use. |
| Deoxynucleotide (dNTP) Solution Set | New England BioLabs | N0446S | Store at -20 °C |
| Diethyl pyrocarbonate | Sigma-Aldrich | 159220-25G | Handle it with caution under an extraction cabinet |
| GeneRuler 100 bp Plus DNA Ladder, ready-to-use | ThermoScientific | SM0322 | Store at -20 °C |
| Hydroxy naphthol blue disodium salt | Santa Cruz Biotechnology | sc-215156B | N/A |
| Q5 High-Fidelity DNA polymerase 2000 IU/mL | New England BioLabs | M0491S/M0491L | For the enzyme, make aliquots of an appropriate volume and store at -20 °C until use. |
| WarmStart RTx Reverse Transcriptase 15000 IU/mL | New England BioLabs | M0380S/M0380L | For the enzyme, make aliquots of an appropriate volume and store at -20 °C until use. |
Referanslar
- World Health Organization. . Who coronavirus (COVID-19) dashboard (no date). , (2023).
- Ibrahim, N. K. Epidemiologic surveillance for controlling Covid-19 pandemic: types, challenges and implications. Journal of Infection and Public Health. 13 (11), 1630-1638 (2020).
- Rojas-Gallardo, D. M., et al. COVID-19 in Latin America: Contrasting phylodynamic inference with epidemiological surveillance. (Molecular epidemiology of COVID-19 in Latin America). medRxiv. , (2020).
- Liu, R., et al. Positive rate of RT-PCR detection of SARS-CoV-2 infection in 4880 cases from one hospital in Wuhan, China, from Jan to Feb 2020. Clinica Chimica Acta. 505, 172-175 (2020).
- Kevadiya, B. D., et al. Diagnostics for SARS-CoV-2 infections. Nature Materials. 20 (5), 593-605 (2021).
- Tomita, N., Mori, Y., Kanda, H., Notomi, T. Loop-mediated isothermal amplification (LAMP) of gene sequences and simple visual detection of products. Nature Protocols. 3 (5), 877-882 (2008).
- Li, Y., Fan, P., Zhou, S., Zhang, L. Loop-mediated isothermal amplification (LAMP): A novel rapid detection platform for pathogens. Microbial Pathogenesis. 107, 54-61 (2017).
- Notomi, T., Mori, Y., Tomita, N., Kanda, H. Loop-mediated isothermal amplification (LAMP): principle, features, and future prospects. Journal of Microbiology. 53 (1), 1-5 (2015).
- Augustine, R., et al. Loop-mediated isothermal amplification (LAMP): A rapid, sensitive, specific, and cost-effective point-of-care test for coronaviruses in the context of COVID-19 pandemic. Biology (Basel). 9 (8), 182 (2020).
- . Nextstrain Available from: https://nextstrain.org/ (2023)
- . Neb Lamp, NEB LAMP Available from: https://lamp.neb.com/ (2023)
- . Blast: Basic local alignment search tool (no date) Available from: https://blast.ncbi.nlm.nih.gov/ (2023)
- Zhang, Y., et al. Rapid molecular detection of SARS-CoV-2 (COVID-19) virus RNA using colorimetric LAMP. medRxiv. , (2020).
- Lu, R., et al. Development of a novel reverse transcription loop-mediated isothermal amplification method for rapid detection of SARS-CoV-2. Virologica Sinica. 35 (3), 344-347 (2020).
- Najafov, A., Hoxhaj, G. . PCR Guru. , (2017).
- Zhang, Y., et al. Enhancing colorimetric loop-mediated isothermal amplification speed and sensitivity with guanidine chloride. Biotechniques. 69 (3), 178-185 (2020).
- Ramírez-Chavarría, R. G., et al. Automatic analysis of isothermal amplification via impedance time-constant-domain spectroscopy: A SARS-CoV-2 case study. Chemosensors. 11 (4), 230 (2023).
- Haque, M. F. U., et al. A novel RdRp-based colorimetric RT-LAMP assay for rapid and sensitive detection of SARS-CoV-2 in clinical and sewage samples from Pakistan. Virus Research. 302, 198484 (2021).
- Donia, A., et al. Integration of RT-LAMP and microfluidic technology for detection of SARS-CoV-2 in wastewater as an advanced point-of-care platform. Food and Environmental Virology. 14, 364-373 (2022).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır