Hormonal, Metabolik ve Elektriksel Düzenleme Çalışmaları için Hedeflenen Hipotalamik Nöronların İzolasyonu
Bu Makalede
Özet
Burada kültürde spesifik hipotalamik hücre alt tiplerini büyütmek için bir protokol sunuyoruz. Hücreler, uygun/benzersiz membran belirteçlerine göre seçilebilir ve immünofloresan, elektrofizyolojik ve biyokimyasal testler dahil olmak üzere birçok uygulamada kullanılabilir.
Özet
Hipotalamus, gıda alımı, vücut ısısı ve hormon salınımı gibi çeşitli işlevleri kontrol ederek temel metabolik süreçleri düzenler. Hipotalamusun işlevleri, nöronal popülasyonların belirli alt kümeleri tarafından kontrol edildiğinden, onları izole etme yeteneği, metabolik mekanizmaları incelemek için önemli bir araç sağlar. Bu bağlamda, hipotalamusun nöronal karmaşıklığı istisnai zorluklar ortaya çıkarmaktadır.
Bu nedenlerden dolayı, Manyetik Aktifleştirilmiş Hücre Sıralama (MACS) gibi yeni teknikler araştırılmıştır. Bu makale, hedeflenen bir nöronal popülasyonu doğum öncesi farelerin beyinlerinden izole etmek için mikroboncuk teknolojisini kullanan yeni bir manyetik aktive hücre sınıflandırma (MACS) uygulamasını açıklamaktadır. Teknik basittir ve yüksek tekrarlanabilirliğe sahip oldukça saf ve canlı bir primer hipotalamik nöron kültürünü garanti eder. Hipotalamus nazikçe ayrıştırılır, nöronlar seçici olarak izole edilir ve glial hücrelerden ayrılır ve son olarak, bir hücre yüzey belirteci için spesifik bir antikor kullanılarak, ilgilenilen popülasyon seçilir.
İzole edildikten sonra, hedeflenen nöronlar morfolojik, elektriksel ve endokrin özelliklerini ve normal veya patolojik koşullardaki tepkilerini araştırmak için kullanılabilir. Ayrıca, hipotalamusun beslenme, metabolizma, stres, uyku ve motivasyonu düzenlemedeki alacalı rolleri göz önüne alındığında, hedeflenen ve bölgeye özgü nöronlara daha yakından bakmak, bu karmaşık ortamdaki görevleri hakkında fikir verebilir.
Giriş
Hipotalamus, beslenme, metabolizma, uyku, vücut ısısı, sosyal davranış ve cinsel dürtü dahil olmak üzere endokrin, otonomik, viseral ve davranışsal işlevlere aracılık eden beynin çok yönlü bir alanıdır 1,2,3,4,5. İşlevsel heterojenlik, biyokimyasal ve elektriksel mekanizmaların sinerjik bir kombinasyonu ile elde edilir: hipotalamik nöronlar, aksiyon potansiyellerini ateşler ve beyin bölgelerini ve vücudun organlarını modüle etmek için hormonları ve nöropeptitleri salgılar ve serbest bırakır. Son olarak, hipotalamik nöronlar, uzun vadeli ve kısa vadeli geri bildirim ve ileri besleme düzenlemeleri ile yanıt vererek vücuttan homeostatik mesajları çevirir6.
Hipotalamusun karmaşık nöronal ortamı, oksitosin ve vazopressin salgılayan magnoselüler endokrin nöronları içerir; esas olarak sistemik hormonal regülasyonda yer alan, örneğin hipofiz bezine tirotropin salınan hormon (TRH) ve kortikotropin salınan hormon (CRH) salgılayan parvosellüler nöronlar; oreksin ve melanin konsantre edici hormon (MCH) salgılayan büyük peptiderjik projeksiyon nöronları; ve sırasıyla ARC POMC ve ARC AgRP olarak adlandırılanPOMC (proopiomelanokortin) veAgRP (aguti ile ilişkili protein) salgılayan Arcuate Nucleus'un (ARC) parvosellüler peptiderjik nöronları. Salgı hücreleri ile birlikte, dopaminerjik, glutaminerjik ve GABAerjik nöronlar 7 dahil olmak üzere diğer uyarıcı ve inhibitör nöronlar, intrahipotalamik ve ekstrahipotalamik devrelerin oluşturulmasında rol oynar, böylece önemli hücresel heterojenliğe sahip büyük ölçekli koordineli ağlar oluşturur8.
Hipotalamik çeşitlilik, araştırmacıların son 50 yılda üstesinden gelmeye çalıştıkları bir zorluk olmuştur. Gelişmekte olan, olgunlaşan ve yaşlanan hipotalamideki bu heterojenliği incelemek için, araştırmacılar bir yandan nöronal organizasyonun yanı sıra moleküler ve transkriptomik imzaları keşfetmek için tek hücreli RNA dizilimi kullanıyorlar. Bu çaba, hipotalamik nöronların alacalı rollerine anlayışlı bir bakış sağlamış ve hücresel kimlik ile fizyolojik sistemdeki olası rolü arasındaki bağlantıları ele almıştır 8,9,10. Öte yandan, nöronal fonksiyonlar optogenetik manipülasyonlar ve fiber fotometri davranışsal yaklaşımları ile araştırılarak devre yapısına yakından bakılmıştır. Son yirmi yılda, Cre-rekombinaz teknolojisi, araştırmacıların davranışlardaki ve vücut tepkilerindeki değişiklikleri gözlemlerken hedeflenen bir nöron grubunu ontogenetik olarak uyarmalarına veya inhibe etmelerine izin verdi 6,11,12.
Bununla birlikte, bu yaklaşımlar, hipotalamik fonksiyonları, spesifik hücresel mekanizmalara veya karmaşık hipotalamik ortamdaki rollerinin biyolojik temeline daha derine inmeden genel bir perspektiften inceler. Bunu ele almak için, çok az sayıda çalışma, heterojen primer hipotalamik kültürleri kullanarak moleküler, biyokimyasal ve elektriksel özellikleri araştırmaya odaklanmıştır. Bu çalışmalar, karmaşık bir ortamda spesifik nöronal süreçleri incelemeye çalıştı ve fizyolojik mekanizmaların bütünleştirici modellerini oluşturdu13,14,15. Bununla birlikte, spesifik olmayan kültürler önemli zorluklar ortaya çıkarmaktadır. Örneğin, nöronların fizyolojik bağlantısı ve anatomik dağılımı, normalde etkileşime girmeyecek farklı hipotalamik bölgelerden gelen nöronların kaplanmasıyla bozulur ve kafa karıştırıcı etkiler yaratır. Ek olarak, her bölgenin farklı rolleri ve alacalı nöronal popülasyonları vardır, bu da basit biyolojik süreçleri incelemeyi zorlaştırır.
Bu zorlukların üstesinden gelmek için, son on yılda, immünopanning, Floresanla Aktive Edilmiş Hücre Sıralama (FACS) ve Manyetik Aktive Edilmiş Hücre Sıralama (MACS) gibi ilgilenilen nöronları izole etmek için yeni yaklaşımlar uygulanmıştır. İmmünopanning, bir dizi nöronal olmayan (negatif) ve nöronal (pozitif) seçim için antikor kaplı kaplar kullanarak hedeflenen hücreleri saflaştırmak için kullanılan bir stratejidir. Bu teknik, prensip olarak, yüksek verimli saflaştırılmış hücre kültürleri üretebilirken, pratikte, çoğunlukla astrositler ve oligodendrositler için kullanılır, çünkü bu hücreler saatlerce manipülasyonadayanabilir 16,17. FACS teknolojisi, akış sitometrisi 18,19,20 kullanarak hücreleri floresan belirteçlere ve hücresel özelliklere göre sıralamak için güçlü bir araçtır. Bununla birlikte, çok az sayıda çalışma, hücre kültürü için hücreleri izole etmek için bu yöntemi kullanmıştır. Teknik pahalıdır ve kullanımı ve bakımı için yüksek vasıflı personel gerektirir; Ek olarak, ayıklama prosedürünün sonunda canlı ve steril hücrelerin korunması zordur21. Genel olarak, MACS, hipotalamik primer nöronların oldukça saf ve canlı kültürlerini elde etmek için basit, pahalı olmayan bir teknik gibi görünmektedir. Yöntem, bir antikor aracılığıyla hücrelere bağlı manyetik boncuklar kullanır. Bu, kolonun manyetik alanı kullanılarak hücrelerin izole edilmesini sağlar.
Burada, tipik olarak kortikal nöronlarla kullanılan MACS teknolojisine dayalı bir yöntemi açıklıyoruz. Bu protokol, prensip olarak, canlı ve oldukça saf hipotalamik nöronların izole edilmesine izin verir. Bu çalışmada, sadece Arcuate Nucleus'ta bulunan ARCPOMC ve ARCAgRP nöronları gibi Leptin Reseptörünü (LepR) eksprese eden nöronların primer kültürlerini hazırlıyoruz. Bu nöronlar, yağ dokusu tarafından salgılanan anoreksijenik bir hormon olan leptine biyokimyasal ve elektriksel yollarla yanıt verir. Bu nedenle, bu nöron grubunun kültürde izolasyonu, hormonal, metabolik ve elektriksel özelliklerinin in vitro olarak incelenmesine izin verir.
Protokol
NOT: Deneysel prosedürün genel bir görünümü Şekil 1A'da grafiksel olarak gösterilmiştir. Bu çalışmada farelerle yapılan tüm deneyler kurumumuzun Hayvan Bakım ve Kullanım Komitesi (IACUC) tarafından onaylanmıştır. Bir veterinerin bakımı altında, Uluslararası Laboratuvar Hayvanları Bakımı Değerlendirme ve Akreditasyon Derneği (AAALAC) onaylı vivaryumda barındırılan 3 aylık C57BL6 / J farelerini kullandık. Fareler, 12 saatlik bir aydınlık-karanlık döngüsü ile büyük kafeslerde yaşadılar ve ad libitum ile beslendiler.
1. Gebe kalma ve hamilelik doğrulaması
- Üreme için herhangi bir geçmişe ve ilgilenilen genotipe sahip fareleri yerleştirin. Gebe kalmadan önce dişinin tarihini ve ağırlığını kaydedin.
- 6 saat sonra, dişiyi problu bir plak için inceleyin. Plak varsa, dişiyi erkekten ayırın. Plak yoksa, dişiyi ertesi güne kadar kafeste tutun, ardından fareleri ayırın.
- Gebe kaldıktan sonraki 7, 10 ve 14. günlerde, hamileliği doğrulamak için kadını tartın.
2. Ortam, 24 oyuklu plaka ve malzeme hazırlama
- Hücre izolasyonu gününde, kullanıma hazır, poli-D-lizin kaplı cam lameller (Malzeme Tablosuna bakınız) 24 oyuklu bir plakaya aşağıdaki gibi yerleştirin:
- Biyolojik bir kaputun altında, 15 lamel içeren tek bir paketi %70 etanol ile sterilize edin ve kurumaya bırakın. Paketi açın ve lamelleri 60 mm'lik bir plakaya yerleştirin. Lamelleri ayırmak için plakayı yatay olarak sallayın. Ardından, 24 oyuklu bir plakanın kuyucuklarına yerleştirilecek tek lamel almak için plakayı ters çevirin.
- Lamelleri bir kez 1.0 mL steril Hank's Balanced Salt Solution (HBSS) ile 5 dakika yıkayın.
- Bu arada, 20.0 mL kaplama ortamını aşağıdaki gibi hazırlayın: 1.0 mL ısıyla inaktive edilmiş fetal sığır serumu (FBS) ile desteklenmiş 18.31 mL BME'ye (Bazal Orta Kartal, + Earle Tuzları), 200 μL sodyum piruvat (100x stoktan), 200 μL glutamin (200 nM stoktan) ve 100 μL penisilin / streptomisin (200x stoktan).
- Kuyucuklardaki HBSS'yi 1.0 mL kaplama ortamıyla değiştirin ve plakayı 37 °C'de inkübatöre yerleştirin.
- Bir Bunsen brülörü kullanarak, üç Pasteur pipetini azalan çaplarda ateşle parlatın. Pipeti bir elinizle tutarak, ucu aleve sokun ve hızlıca çıkarın. Uç düzleşene ve çap istenen çapa (gözle değerlendirilen) düşene kadar işlemi tekrarlayın.
3. Nöral Dissosiyasyon kitinin talimatlarını izleyerek Nöral Doku Dissosiyasyonu için reaktif hazırlama
- Sindirim Tamponu 1'i oda sıcaklığında ısıttıktan sonra, 50 μL Enzim 1'i 1.91 mL Tampon 1 ile karıştırarak Enzim Karışımı 1'i ve 15 μL Enzim 2'yi 30 μL Sindirim Tamponu 2 ile karıştırarak Enzim Karışımı 2'yi hazırlayın. Karışımlar tüm embriyoların beyin dokusu için kullanılmak üzere yeterlidir.
- HBSS'de% 0.5 Sığır Serum Albümini (BSA) hazırlayın, örneğin, 50.0 mL HBSS'de 0.25 g.
4. Embriyo ekstraksiyonu
- İki düz ince forseps, bir kavisli nokta forseps ve bir çift ince cerrahi makası otoklavlayın ve kullanmadan önce %70 etanol ile sterilize edin. Ardından, Petri kaplarını HBSS ile doldurun.
- CO2 odasında bir E14-E16 hamile barajına ötenazi yapın ve servikal çıkık yapın.
NOT: Steril koşullar altında kaputun altında aşağıdaki adımlar gerçekleştirilmelidir: - Karnı% 70 etanol ile sterilize edin. Karın boşluğunu kasık simfizinden göğüs kafesinin ksifoid sürecine cerrahi makas ve forseps ile kesin.
- Rahim boynuzunu çıkarın ve buz gibi HBSS ile doldurulmuş 100 mm'lik bir tabağa koyun ve iyice yıkayın.
- Tüm embriyoları uterustan ince forseps ile çıkarın ve ayırın. İnce cerrahi makas ve/veya forseps ile embriyoların başını hızla dekapite edin. Kafaları HBSS ile doldurulmuş 60 mm'lik Petri kabına yerleştirin.
5. Hipotalamus ekstraksiyonu, toplanması ve doku ayrışması
- Beyni tutmak için göz boşluğuna ince bir forseps yerleştirin. Diğer ince forsepsleri kullanarak, beyin görünene kadar soyarak cildi ve kafatasını çıkarın. Beyni beyaz görünümüne göre diğer dokulardan ayırt edin. Deri ve kafatası pembe renktedir ve damar sistemi bakımından zengindir.
- Kavisli nokta forsepslerini kullanarak beyni kafatasından çıkarın ve beyni koku ampullerinden çıkararak baş aşağı çevirin.
- Şimdi korteks ventraldir ve hipotalamus üst yüzeyde dorsal olarak görülebilir (Şekil 1B). Kavisli forseps ile, beyin beyaz ve berrak görünene kadar meninks ve kan damarları tabakasını çıkarın.
- Kavisli forseps ile hipotalamik alanı beynin geri kalanından ayırın.
- Hipotalamusu 3-4 küçük parçaya bölün ve bir pipet ile parçaları 15 mL'lik bir tüpe aktarın.
- Tüp buz üzerindeyken diğer embriyolar için adımları tekrarlayın.
- Tüpü 6.0 mL HBSS ile doldurun ve dokunun yerleşmesine izin verin, süpernatanı çıkarın ve Enzim Karışımı 1'i ekleyin. Dokuyu önlemek için tüpü hafifçe karıştırın ve çalkalayın.
- Tüpü 37 ° C'lik bir su banyosunda 15 dakika inkübe edin ve dokuyu yeniden süspanse etmek için her 5 dakikada bir çalkalayın.
- 15 dakika sonra 30 μL Enzim karışımı 2 ekleyin. En büyük çapa (<1 mm) sahip pipet Pasteur'ü kullanarak beyin dokusunu ayrıştırın. Kabarcık oluşturmadan 10 kat yukarı ve aşağı pipetleyin.
- Su banyosunda 37 °C'de 10 dakika inkübe edin. Dokuyu her 5 dakikada bir yeniden süspanse etmek için tüpü hafifçe çalkalayın.
- 10 dakika sonra, kalan 15 μL Enzim karışımı 2'yi ekleyin. Dokuyu 10x, çapı azalan diğer iki ateşle parlatılmış pipetle, kabarcıklar oluşturmadan yukarı ve aşağı ayırın.
- Ayrışmış dokuya sahip tüpe hemen 10.0 mL HBSS-% 0.5 BSA ekleyin ve oda sıcaklığında 10 dakika boyunca 300 × g'da santrifüjleyin.
- Süpernatanı aspire edin ve hücre peletini 1.0 mL HBS-% 0.5 BSA içinde yeniden süspanse edin.
6. Hücre sayımı
- HBSS-0.5% BSA kullanarak hücre süspansiyonunu 1:5 oranında seyreltin.
- 10 μL seyreltilmiş hücre süspansiyonunu bir Neubauer sayım odasına yerleştirin.
- Parlak alan mikroskobu altında, yalnızca dört odanın köşe karelerinde bulunan hücreleri sayın. Ortalamayı hesaplayın ve 5 × 104 ile çarpın.
NOT: Hücre izolasyonuna devam etmek için >106 hücre olduğundan emin olun; En uygun hücre sayısı 107'dir.
7. Negatif seçim
NOT: Negatif seçim, kullanıcıların nöronal ve nöronal olmayan hücreleri ayırarak saf bir birincil nöron kültürü elde etmelerini sağlar. Önceden soğutulmuş çözeltiler kullanın.
- Hücre süspansiyonunu 3 dakika boyunca 300 × g'da santrifüjleyin (santrifüj 10 dakikaya kadar uzatılabilir). Süpernatanı nazikçe aspire edin ve peleti 80 μL HBSS-%0.5 BSA'da 107 hücre konsantrasyonuna yeniden süspanse edin.
- 20 μL Non-Nöronal Hücre Biotin-Antikor Kokteyli ekleyin ve 4 °C'de 5 dakika inkübe edin.
- Serbest antikoru çıkarmak için hücreleri 2.0 mL HBSS-% 0.5 BSA ile yıkayın ve 3 dakika boyunca 300 × g'da santrifüjleyin.
- Süpernatanı nazikçe aspire edin ve peleti 80 μL HBSS-%0.5 BSA içinde yeniden süspanse edin. 20 μL anti-biyotin Mikro boncuklar ekleyin, iyice karıştırın ve 4 °C'de 10 dakika inkübe edin.
- 10 7 hücreye kadar 0,5 mL HBSS-%0,5 BSA ekleyin ve manyetik kolon hazır olana kadar bekleyin.
8. Manyetik ayırma, negatif seçim
NOT: Manyetik ayırma, nöronal olmayan hücrelerin nöronal hücrelerden ayrılmasını sağlayan çok önemli bir adımdır. Nöronal ve nöronal olmayan hücreleri içeren örnek manyetik alandan geçirilir ve bir biyotin-antikor-manyetik boncuk kompleksine bağlı olan nöronal olmayan hücreler kolonda tutulur (Şekil 1C). Serbest nöronal hücreler kolondan ayrıştırılır ve 15 mL'lik bir tüpte toplanır.
- Standı (kite dahildir) ayırıcı ve MS sütunu ile Şekil 1C'de gösterildiği gibi hazırlayın.
- Sütunu açın ve standı yalnızca hücreler ayrılmaya hazır olduğunda kurun.
- Kolonu 0,5 mL HBSS-% 0,5 BSA ile durulayın. Çözelti damlaması durana kadar bekleyin.
- Nöronal hücreleri toplamak için, kolonun altına 15 mL'lik bir tüp yerleştirin ve 0.5 mL hücre süspansiyonunu kolondan geçirin. Elüatı damlamayı durdurana kadar tüpte toplayın. Artık nöronal hücreleri yakalamak için, 3 x 0.5 mL HBSS-0.5% BSA sütununu yıkayın.
- Nöronal olmayan hücreleri toplamak için, sütunu mıknatıstan çıkarın ve 15 ml'lik yeni bir tüpün içine yerleştirin. Kolona 1.0 mL HBSS -% 0.5 BSA ekleyin ve manyetik olarak etiketlenmiş nöronal olmayan hücreleri toplamak için pistonu kullanın.
- Nöronal ve nöronal olmayan hücreleri 3 dakika boyunca 300 × g'da santrifüjleyin. Süpernatanı nazikçe aspire edin ve hücreleri 1.0 mL HBSS-% 0.5 BSA'da yeniden süspanse edin. Hücreleri daha önce bölüm 6'da açıklandığı gibi sayın.
- Gerekirse, nöronal olmayan hücreleri 24 oyuklu bir plakaya yerleştirin; aksi takdirde onları atın.
9. Pozitif seçim
NOT: Saf bir nöronal hücre süspansiyonu elde edildikten sonra, hedeflenen hücreleri izole etmek için pozitif seçim gerçekleştirilir. Hücreler, bir yüzey antijeni için spesifik bir biyotin konjuge antikor kullanılarak izole edilebilir. Antikor, anti-biyotin manyetik boncuklar tarafından tanınır. Hücre süspansiyonunu kolondan akıtarak, manyetik alanda sadece ilgilenilen hücreler tutulur.
- Saf nöronal hücre süspansiyonunu 300 × g'da 3 dakika santrifüjleyin. Süpernatanı nazikçe aspire edin ve peleti 80 μL HBSS-%0.5 BSA içinde yeniden süspanse edin. Üreticinin talimatlarını izleyerek spesifik antikoru ekleyin ve 4 °C'de 10 dakika inkübe edin.
NOT: LepR'yi eksprese eden hücreler aranırsa, 0.50 μg/106 hücre konsantrasyonunda bir Fare Leptin R Biyotinillenmiş Antikoru (Malzeme Tablosuna bakınız) öneririz. - Fazla antikoru 2.0 mL HBSS-% 0.5 BSA ile yıkayın ve 300 × g'da 3 dakika santrifüjleyin.
- Süpernatanı çıkarın, peleti 80 μL HBSS-%0.5 BSA içinde yeniden süspanse edin ve 20 μL anti-biyotin mikro boncukları ekleyin. 4 °C'de 10 dakika inkübe edin.
- Her 107 hücre için 0,5 mL HBSS-%0,5 BSA ekleyin ve manyetik kolon hazır olana kadar bekleyin.
10. Manyetik ayırma, pozitif seçim
- Standı ayırıcı ve MS sütunu ile hazırlayın. MS kolonunu 0,5 mL HBSS-%0,5 BSA ile durulayın. Damlama durana kadar bekleyin.
- Kolonun altına 15 mL'lik bir tüp yerleştirin, 0.5 mL hücre süspansiyonunu kolondan geçirin ve spesifik olmayan nöronal hücreleri içeren elüatı toplayın. Kalıntı spesifik olmayan nöronal hücrelerin kolonunu temizlemek için 3 x 0.5 mL HBSS-% 0.5 BSA ile yıkayın.
- Kolonu mıknatıstan çıkarın, 15 mL'lik yeni bir tüpe yerleştirin ve 1.0 mL HBSS-%0.5 BSA ekleyin. Hedeflenen hücreleri temizlemek için pistonu kullanın.
- Her iki tüpü de 300 × g'da 3 dakika santrifüjleyin. Süpernatanı yavaşça çıkarın ve 0,5 mL kaplama ortamında yeniden süspanse edin.
- Hücreleri daha önce bölüm 6'da açıklandığı gibi sayın.
- Daha önce bölüm 2'de tarif edildiği gibi hazırlanan 24 oyuklu plakada 120.000-200.000 hücre/mm3 yoğunlukta pozitif kontrol olarak hedeflenen hücreleri ve negatif kontrol olarak spesifik olmayan hücreleri plaka ve 12 saat boyunca %5 CO2, %9O2 ve %95 nemde 37 °C'de inkübe edin.
11. Hücre kültürü bakımı
- 19.2 mL Nöronal Kültür Ortamı, 400 μL B27 takviyesi (50x stoktan), 200 μL glutamin (200 μM stoktan) ve 100 μL penisilin / streptomisin (200x stoktan) ile 20 mL kültür ortamı hazırlayın.
- Nöronal veya nöronal olmayan hücreler içeren 24 kuyulu plakadan kaplama ortamını değiştirin.
- 2 x 1.0 mL HBSS ile yıkayın.
- 1.0 mL kültür ortamı ekleyin.
- 0,5 mL eski ortamı 0,5 mL yeni ortamla değiştirerek ortamı her 2/3 günde bir yenileyin.
NOT: Hücreler kültürde tutulabilir ve in vitro (DIV21) 21 güne kadar kullanılabilir.
12. Nöron immünofloresan boyama
- Boyamadan on iki saat önce 50/50 metanol ve asetondan oluşan bir çözelti hazırlayın ve gece boyunca -20 °C'de soğutun.
- 24 oyuklu plakadaki nöronları 2 x 1.0 mL 1x fosfat tamponlu salin (PBS) ile 5 dakika boyunca yıkayın.
- PBS çözeltisini 1.0 mL 50/50 çözeltisi ile değiştirin ve 20 dakika buzda inkübe edin.
- 1x PBS ile 3 x 5 dakika yıkayın.
- Nöronları oda sıcaklığında 1 saat boyunca 1x PBS'de% 3 BSA ile bloke edin.
- Üreticinin talimatlarında belirtilen antikor konsantrasyonunu kullanarak 1x PBS'de% 3 BSA'da birincil antikor çözeltisini hazırlayın. Kullanılan antikorlar ve konsantrasyonlar Malzeme Tablosunda listelenmiştir.
- Bloke edici çözeltiyi birincil antikor çözeltisi ile değiştirin ve gece boyunca 4 ° C'de inkübe edin.
- Hücreleri 1x PBS ile 3 x 10 dakika yıkayın.
- İkincil antikor çözeltisini, üreticinin talimatlarını izleyerek antikor konsantrasyonlarını kullanarak 1x PBS'de% 3 BSA ile hazırlayın. Kullanılan ikincil antikorlar Malzeme Tablosunda listelenmiştir.
- Hücreleri ikincil antikor çözeltisi ile oda sıcaklığında 1 saat inkübe edin.
- Hücreleri 1x PBS ile 3 x 10 dakika yıkayın.
- Montaj prosedürü sırasında nöronları 1x PBS'de bırakın. Mikroskop lamına küçük bir damla montaj ortamı (nükleer tanımlama için 4',6-diamidino-2-fenilindol ile veya olmadan) yerleştirin. Forsepsli nöronlar içeren bir cam lamel çıkarın ve fazla PBS'yi kurutmak için lamel kenarına bir kağıt mendil üzerine hafifçe vurun. Nöronların mikroskop slaytlarına baktığından emin olarak montaj ortamındaki lamel çevirin; Fazla montaj ortamını kağıt mendille hafifçe bastırın ve çıkarın.
- Mikroskop slaytları, parlak alan veya konfokal mikroskop ile analiz edilmeye hazırdır.
Temsili Sonuçlar
Bu makale, hipotalamusun hedeflenen nöronlarının izolasyonu için bir protokolü açıklamaktadır (Şekil 1). Yöntemin kapsamı, kontrollü ve izole bir bağlamda spesifik nöronal özellikleri incelemektir. Böylece, fare embriyoları E14-E16'daki hamile barajlardan çıkarıldı. Meninksler çıkarıldı ve hipotalamus beynin geri kalanından izole edildi. Doku, referans verilen ayrışma kiti kullanılarak taze hazırlanmış iki enzim karışımı ile nazikçe ayrıştı. İlk olarak, nöronal olmayan hücreler nöronal hücrelerden ayrıldı - glia, mikroglia ve nöronlar aynı tek hücreli süspansiyonda toplandı. Bu amaçla, nöronal olmayan hücreler, nöronal olmayan yüzey epitoplarını tanıyan bir antikor kokteyli kullanılarak etiketlendi. İnkübasyondan sonra, antikor-hücre kompleksi manyetik mikroboncuklarla konjuge edildi ve daha sonra nöronal olmayan hücreleri yakalamak için manyetik bir kolondan geçirildi.
Bu adım, biri nöronal olmayan, diğeri nöronal hücreler içeren iki hücre süspansiyonu verdi. Her iki süspansiyon da hemen kaplanabilir. Alternatif olarak, nöronal hücre süspansiyonu, aynı stratejiyi kullanarak bir nöronal alt popülasyonu (hedeflenen süspansiyon) diğerlerinden ayırmak için daha fazla manipüle edilebilir. İlgilenilen deneye dayanarak, nöronal hücreler 125.000 ila 200.000 hücre /mm3 arasında kaplanabilir. Daha az yoğun kültürler, nöronları tek hücreli çözünürlükte analiz etmek için kullanılabilir: aksonal gelişim, sinaptik oluşum ve iletimden elektrofizyolojiye. Daha yoğun kültürler, DNA ve RNA ekstraksiyonu, western blot, Southern blot, Northern blot, gerçek zamanlı PCR ve RNA dizilimi dahil olmak üzere biyokimyasal analizler için kullanılabilir.
Bu çalışmada, ARCPOMC ve ARCAgRP nöronları gibi melanokortin sisteminde yer alan nöronları izole etmek için LepR hedeflenmiştir. Hücreler, LepR + nöronları için 120.000 hücre / mm 3 ile jenerik nöronal popülasyonlar için 200.000 hücre / mm3 arasında değişen yoğunluklarda kaplandı. 48 saat sonra, LepR+ nöronları nöritler oluşturmaya başladı (Şekil 2). DIV4'te aksonal uzantılar ilerleme gösterirken, dendritik süreçler ortaya çıkmaya başladı. DIV6'da nöronlar yeterince gelişmişti ve bu nedenle analiz edilmeye hazırdı. LepR+ nöronları üzerinde yapılan immünofloresan deneyleri, LepR'nin %99 ekspresyonunu gösterdi (yeşil, Şekil 3A). Birincil nöronal kültürün saflığını doğrulayan hiçbir glial hücre veya diğer nöronal olmayan hücreler gözlenmedi. Hücrelerin nöronal doğası, aksonların ve dendritik çıkıntıların tanımlanmasıyla mikrotübül ilişkili protein 2 (MAP2) boyama ile doğrulandı (Şekil 3B). DIV10'da, LepR+ hücrelerinin% 30'u POMC (kırmızı) eksprese etti. LepR+ hücrelerinin çoğunluğu POMC veya AgRP'yi eksprese ettiğinden bu beklenir. Şekil 3C,D, POMC ve LepR sinyalleri arasındaki ortak lokalizasyonu göstermektedir. Birlikte lokalizasyonun beklendiği gibi çekirdekte ve çevresinde belirgin olduğuna dikkat edin.
Kontrol için heterojen hipotalamik nöronal popülasyonları içeren genel kültürler kullanıldı. İmmünofloresan, Sinapsin-1 (yeşil) ve PSD 95 (kırmızı) birlikte boyama ile değerlendirildiği gibi sinaptik bağlantı ve işlevsellik gösterdi (Şekil 4A, B). Genel kültürde bulunan LepR+ nöronlarının sayısı ~%5 idi, bu da LepR eksprese eden nöronların çoğunluğunun manyetik ayırma işlemi sırasında seçildiği fikriyle tutarlı bir yüzdeydi (temsili LepR+ hücreleri Şekil 4C,D'de gösterilmiştir). Bu çalışma sırasında üretilen veya analiz edilen tüm veriler https://doi.org/10.5061/dryad.cnp5hqc9c'da mevcuttur.
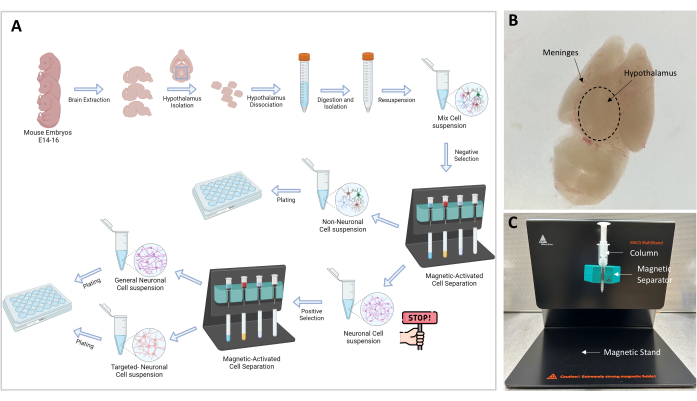
Şekil 1: Deneysel akış şeması ve kurulumu . (A) Deneysel prosedürün grafiksel gösterimi. Gitme: Hücre izolasyonuna devam etmek için ≥106 hücre gereklidir; En uygun hücre sayısı 107'dir. (B) Bir E16 embriyo beyninin temsili görüntüsü. Hipotalamus ve meninksler endikedir. (C) Hedeflenen hücrelerin ayrılması ve izolasyonu için kullanılan MACS kurulumu. Manyetik stand, manyetik ayırıcı ve kolon belirtilmiştir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
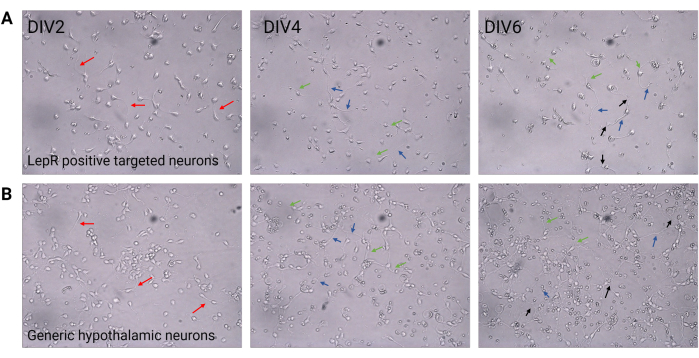
Şekil 2: DIV2 ve DIV6 arasındaki nöronal kültür . (A) Pozitif seleksiyondan elde edilen LepR+ hücreleri, hücre yoğunluğunun ve bağlantısının azaldığını, ancak nöritlerin (kırmızı oklar), aksonların (mavi oklar) ve dendritlerin (yeşil oklar) normal gelişimini gösterir. Hücreler 120.000 hücre/mm3 yoğunlukta kaplandı. Ölçek çubuğu = 100 μm. (B) 200.000 hücre/mm3 yoğunlukta kaplanmış jenerik hipotalamik nöronlar, normal gelişim ve büyüme özellikleri ve bağlanabilirlik (siyah oklar) gösterir. Ölçek çubuğu = 100 μm. Kısaltmalar: DIV = in vitro günler; LepR = leptin reseptörü. Bu rakamı oluşturmak için üretilen veya analiz edilen tüm veriler https://doi.org/10.5061/dryad.cnp5hqc9c'da mevcuttur. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
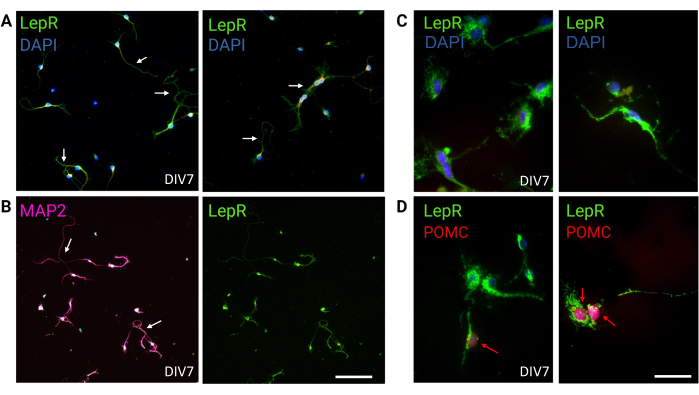
Şekil 3: İn vivo nöronlar, kültürlenmiş LepR+ nöronları tarafından özetlenir. (A) LepR'yi ifade eden bir nöron kültürünün temsili görüntüleri (yeşil; DAPI mavidir). Hücrelerin yüzde doksan dokuzu LepR'yi eksprese etti. Nöronlar 120.000 hücre/mm3 yoğunlukta kaplandı. DIV7'de nöronlar uzamış aksonlar, dendritik olgunlaşma ve nöronal bağlantı (oklar) sundu. Ölçek çubuğu = 40 μm. (B) Hücrelerin nöronal doğasını doğrulamak için anti-MAP2 ile immünofloresan kullanıldı. Aksonlar, dendritler ve çıkıntılar gibi nöronale özgü morfolojiler gösterilmiştir (oklar). Ölçek çubuğu = 40 μm. (C) LepR+ hücrelerinin büyütülmesi. Yeşil renkte LepR ve mavi renkte DAPI. Ölçek çubuğu = 10 μm. (D) LepR (yeşil) ve POMC (kırmızı) ile birlikte boyama. LepR+ nöronlarının kabaca %30'u, çekirdek seviyesinde tespit edilen POMC'ye (kırmızı oklar) karşı immünoreaktifti. Ölçek çubuğu = 10 μm. Kısaltmalar: DAPI = 4',6-diamidino-2-fenilindol; MAP2 = mikrotübül ile ilişkili protein 2; POMC = proopiomelanokortin; LepR = leptin reseptörü. Bu rakamı oluşturmak için üretilen veya analiz edilen tüm veriler https://doi.org/10.5061/dryad.cnp5hqc9c'da mevcuttur. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
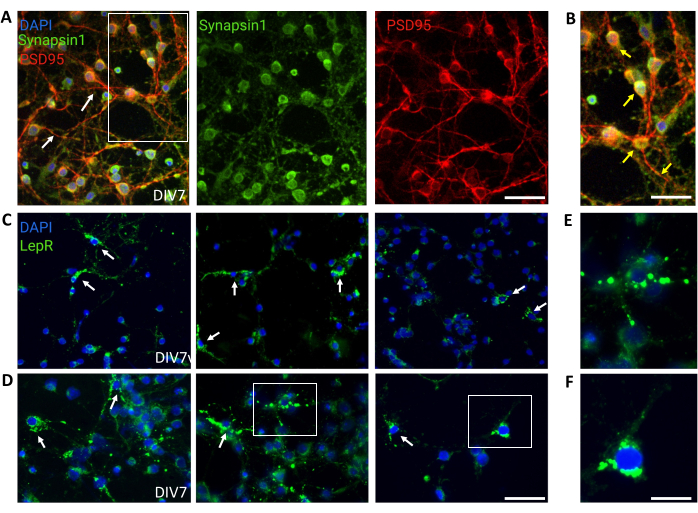
Şekil 4: İn vivo hücreler, kültürlenmiş jenerik hipotalamik nöronlar tarafından özetlenir. (A) Synapsin 1 (yeşil), PSD95 (kırmızı) ve DAPI (mavi) ile boyanmış jenerik hipotalamik nöronal kültürün temsili görüntüleri. Nöronlar iyi gelişmiş bağlantı ve sinaptik işlevsellik (oklar) sergiledi. Ölçek çubuğu = 40 μm. (B) Synapsin 1 (yeşil) ve PSD95'in (kırmızı, oklar) birlikte lokalizasyonunu gösteren (A)'daki kutunun büyütülmesi. Ölçek çubuğu = 20 μm. (C,D) Genel bir kültürde LepR+ hücrelerini gösteren temsili görüntüler. LepR+ hücreleri (yeşil) toplamın ~%5'ini oluşturuyordu. Temsili LepR+ hücreleri oklarla gösterilir. Ölçek çubuğu = 40 μm. (E,F) Somada lokalize yeşil punkta leptin reseptörlerini gösteren (C,D)'deki kutuların büyütmeleri. Ölçek çubuğu = 20 μm. Bu rakamı oluşturmak için üretilen veya analiz edilen tüm veriler https://doi.org/10.5061/dryad.cnp5hqc9c'da mevcuttur. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Hipotalamik nöronların biyokimyasal ve elektriksel özelliklerini araştırmak, metabolizmanın, termoregülasyonun, ruh hali yönetiminin, beslenme davranışının ve daha fazlasının moleküler temelini anlamanın anahtarıdır. Bununla birlikte, hipotalamusun nöronal heterojenliği bu çabayı zorlaştırır ve spesifik hipotalamik alt popülasyonları izole etmek ve incelemek için yöntemlere ihtiyaç vardır.
İn vivo teknikler CRE-rekombinaz, optogenetik, fiber fotometri ve kalsiyum görüntüleme kullanır. Bu yaklaşımlar öncelikle hipotalamik nöronların elektriksel özelliklerinin incelenmesine izin verir ve şu anda elektriksel olmayan özelliklerini araştırmak için çok az yöntem mevcuttur. Bu çalışmada geliştirilen MACS teknolojisi, spesifik hipotalamik nöronal alt popülasyonları in vitro olarak izole etmeye uygun bir teknik sağlayabilir ve böylece hedefe yönelik tedaviler ve analizler sağlayabilir. Nöronal kültürlerin yönetimi, farklı nöronal popülasyonların ko-kültürlerine kıyasla daha kolaydır. Ek olarak, saf kültürler, glia ve mikroglia'nın varlığından kaynaklanan kafa karıştırıcı etkilerden kaçınır. Bu nedenle, aynı hipotalamik bölge ve tipteki nöronlar, spesifik metabolik ve hormonal girdilere yanıt olarak incelenebilir.
Bu protokolde LepR'yi eksprese eden hipotalamik nöronları seçtik. İzole edilmiş LepR+ hücreleri, in vivo olarak incelenmesi zor olan hücresel, morfolojik ve moleküler özelliklerini araştırmak için kültürlendi.Kültürlerin saflığı% 99 idi ve yöntemin doğruluğunu destekledi. Ek olarak, LepR + hücreleri DIV7'de DIV21'e kadar sağlıklı ve canlıydı.
Bununla birlikte, bu tekniğin bazı sınırlamaları vardır. E18 veya daha eski saf nöron kültürlerinin bakımı zordur. Bu nedenle, ekstraksiyon penceresi E14-E16 ile sınırlıdır. Bu, E16'dan sonra meydana gelen hücresel değişikliklerin gözden kaçırıldığı anlamına gelir. Örneğin, ARC nöronlarındaki leptin reseptörünün ekspresyonu doğum sonrası erken dönemdeartar 22. İzolasyon prosedürü, hücresel stresi ve ölümü azaltmak ve verimi artırmak için mümkün olduğunca çabuk yapılmalıdır. İşlem 5 saate kadar sürebilir; Bu nedenle, steril koşulların korunması ve manipülasyonun gerekli en aza indirilmesi esastır. Pozitif seçim, düşük miktarda mevcut doku nedeniyle düşük verime yol açabilir ve tek bir preparatla gerçekleştirilebilecek deney sayısını sınırlayabilir. Muhtemelen düşük hücre yoğunluğu ve azalmış nöronal bağlantı ve intranöronal destek nedeniyle yüksek nöronal ölüm gözlendi.
Ayrıca, ilgilenilen antijeni hedef alan antikor, doğru bir ayrımı garanti etmek için hücre yüzeyine bağlanmalıdır; genellikle akım sitometrisi için kullanılan antikorlar MACS tekniği için uygundur. Hücre ayırma yöntemlerinde antikor daha önce kullanılmamışsa, ideal kullanım ve konsantrasyonu belirlemek için validasyon ve titrasyon deneylerine ihtiyaç vardır. Hedeflenen hücrelerin çıkarılması, bir hücre yüzeyi işaretleyicisi gerektirir. Burada biyotinillenmiş bir antikor kullandık, ancak prensip olarak FITC (floresein izotiyosiyanat) ve PE (saflaştırılmış anti-fikoeritrin) gibi diğer moleküllerle konjuge edilmiş antikorlar da kullanılabilir. MACS teknolojisi, GFP veya başka bir Tag proteini gibi bir floroforu eksprese eden nöronlara da uygulanabilir ve potansiyel olarak özgüllüğü ve verimi artırabilir. Bir florofor kullanılmazsa, alternatif, canlı hücre deneyleri yapmadan önce immünofloresan ile ilgilenilen molekülün ekspresyonunu doğrulamak olacaktır. Gelecekteki çalışmalar bu alternatiflerin geçerliliğini test edecektir.
Bu çalışmanın ele almadığı önemli bir husus, alt nöronal popülasyonların "aslına uygunluğu" ile ilgilidir. Kültürlenmiş LepR+ nöronlarının, doğal ARC POMC nöronlarının bir imzası olanPOMC'yi eksprese ettiğini tespit ettik. Bununla birlikte, LepR+ nöronal kültürlerinin doğal in vivo muadillerini özetlediği sonucuna varmak için daha fazla test gerekli olacaktır. Genel olarak, burada sunulan MACS nöronal izolasyon protokolü, in vivo olarak araştırılması zor olan in vitro hipotalamik mekanizmaları incelemek için geçerli ve etkili bir yöntem sağlayabilir.
Açıklamalar
Yazarlar herhangi bir çıkar çatışması olmadığını beyan ederler.
Teşekkürler
Grafiksel şekiller BioRender.com ile oluşturuldu. Bu çalışma, FS'ye bir NIA hibesi (R01AG060919) ve bir NSF hibesi (2030348) ile desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Embryo extraction | |||
| 1 curved point forceps | Fine Science Tools | 11270-20 | Dumont |
| 1 fine surgical scissor | Fine Science Tools | 14058-11 | Dumont |
| 100 mm Petri dish | Corning | 430167 | |
| 2 straight fine forceps | Fine Science Tools | 11254-20 | Dumont |
| 60 mm Petri dish | Corning | 430196 | |
| 70% ethanol | Decon Laboratories, INC. | 2801 | Ethanol 190 Proof |
| Anti-Biotin MicroBeads 1mL | Miltenyi Biotec | 130-115-390 | |
| Anti-MAP2 antibody | Abcam | ab5392 | 1 : 800 |
| Bench pads | |||
| Bovine Serum Albumin | Sigma-Aldrich | A9418-50G | |
| Buffer Y | Miltenyi Biotec | 130-094-802 | |
| Buffer Z | Miltenyi Biotec | 130-094-802 | |
| Cell Culture | |||
| Anti-Biotin MicroBeads 1mL | Miltenyi Biotec | 130-115-390 | |
| Bovine Serum Albumin | Sigma-Aldrich | A9418-50G | |
| Buffer Y | Miltenyi Biotec | 130-094-802 | |
| Buffer Z | Miltenyi Biotec | 130-094-802 | |
| Enzyme A | Miltenyi Biotec | 130-094-802 | |
| Enzyme P | Miltenyi Biotec | 130-094-802 | |
| GG-12-1.5, 12 mm dia.#1.5 thick 100 pc cell culture tested German coverglasses | Neuvitro Corporation | GG-12-15 | |
| Gibco B-27 Supplement 10 mL | ThermoFisher | 17504-044 | |
| Gibco Basal Medium Eagle (BME) 500 mL | ThermoFisher | 21010046 | (+) Earle's Salts, (-) L-Glutamine |
| Gibco HBBS (1x) Hanks' Balanced Salt Solution 500 mL | ThermoFisher | 14025092 | Calcium, Magnesium, No phenol red |
| Gibco HI FBS 100 mL | ThermoFisher | 16140-063 | |
| Gibco L-Glutamine 200 mM (100x) | ThermoFisher | 25030-081 | |
| Gibco Penicilline/Streptomicine | ThermoFisher | 15140-122 | 10,000 U/mL |
| Gibco Sodium Pyruvate (100 mM) 100 mL | ThermoFisher | 11360070 | |
| MiniMACS Separator and Starting Kit | Miltenyi Biotec | 130-042-102 | |
| Mouse Leptin R Biotinylated Antibody | R&D Systems | ABAF497 | 0.25 μg/106 cells |
| MS Column | Miltenyi Biotec | 130-042-201 | |
| Neaubeaur-Improved Brightline 100 µm Chamber | Hausser Scientific | 3120 | |
| Neural Tissue Dissociation Kit - Postnatal Neurons | Miltenyi Biotec | 130-094-802 | |
| Neuronal Culture Medium 500 mL | ThermoFisher | 88283 | |
| Non-Neuronal Cell Biotin-Antibody Cocktail mouse 1 mL | Miltenyi Biotec | 130-115-389 | |
| Olympus SZ61 Zoom Stereomicroscope | Olympus Life Science | SZ61/SZ51 | |
| Pierce Primary Neuron Isolation Kit | ThermoFisher | 88280Y | |
| Staining | |||
| Anti-MAP2 antibody | Abcam | ab5392 | 1 : 800 |
| Donkey anti-Mouse IgG (H+L) Highly Cross-Adsorbed Secondary Antibody, Alexa Fluor Plus 488 | ThermoFisher | A32766 | 1 : 500 |
| Donkey anti-Rabbit IgG (H+L) Highly Cross-Adsorbed Secondary Antibody, Alexa Fluor Plus 488 | ThermoFisher | A32790 | 1 : 500 |
| Dulbecco's Phosphate Buffered Saline (DPBS) | Sigma Aldrich | MFCD00131855 | |
| Goat anti-Chicken IgY (H+L) Cross-Adsorbed Secondary Antibody, Alexa Fluor Plus 647 | ThemoFisher | A32933 | 1 : 500 |
| Goat anti-Rabbit IgG (H+L) Highly Cross-Adsorbed Secondary Antibody, Alexa Fluor 594 | ThermoFisher | A11037 | 1 : 200 |
| Invitrogen Leptin Receptor Recombinant Rabbit Monoclonal Antibody (JA73-01) | ThermoFisher | MA5-32685 | 1 : 500 |
| Mouse Leptin R Biotinylated Antibody | R&D Systems | ABAF497 | 1 : 500 |
| POMC Rabbit mAb | Cell Signaling Technology | D3R1U | 1 : 500 |
| PSD95 (D74D3) XP Rabbit mAb | Cell Signaling Technology | D74D3#3409 | 1 : 500 |
| Streptavidin, Alexa Fluor 594 conjugate | ThermoFisher | S11227 | 1 : 500 |
| Synapsin 1 Monoclonal Antibody (7H10G6) | ThermoFisher | MA5-31919 | 1 : 500 |
| Vectashield Plus Antifade Mountina Medium with DAPI 10 mL | Vector Laboratories | H-2000 |
Referanslar
- Cone, R. D. Anatomy and regulation of the central melanocortin system. Nature Neuroscience. 8 (5), 571-578 (2005).
- Clarke, I. J. Hypothalamus as an endocrine organ. Comprehensive Physiology. 5 (1), 217-253 (2015).
- Mignot, E., Taheri, S., Nishino, S. Sleeping with the hypothalamus: emerging therapeutic targets for sleep disorders. Nature Neuroscience. 5 Suppl, 1071-1075 (2002).
- Baird, A. D., Wilson, S. J., Bladin, P. F., Saling, M. M., Reutens, D. C. Neurological control of human sexual behaviour: insights from lesion studies. Journal of Neurology, Neurosurgery, and Psychiatry. 78 (10), 1042-1049 (2007).
- Caria, A., Dall, O. G. Functional neuroimaging of human hypothalamus in socioemotional behavior: a systematic review. Brain Sciences. 12 (6), 707 (2022).
- Andermann, M. L., Lowell, B. B. Toward a wiring diagram understanding of appetite control. Neuron. 95 (4), 757-778 (2017).
- Romanov, R. A., Alpar, A., Hokfelt, T., Harkany, T. Unified classification of molecular, network, and endocrine features of hypothalamic neurons. Annual Review of Neuroscience. 42, 1-26 (2019).
- Hajdarovic, K. H., Yu, D., Webb, A. E. Understanding the aging hypothalamus, one cell at a time. Trends in Neurosciences. 45 (12), 942-954 (2022).
- Zhang, Y. H., et al. Cascade diversification directs generation of neuronal diversity in the hypothalamus. Cell Stem Cell. 28 (8), 1483-1499 (2021).
- Chen, R., Wu, X., Jiang, L., Zhang, Y. Single-cell RNA-seq reveals hypothalamic cell diversity. Cell Reports. 18 (13), 3227-3241 (2017).
- Ma, C., et al. Neural pathways from hypothalamic orexin neurons to the ventrolateral preoptic area mediate sleep impairments induced by conditioned fear. Frontiers in Neuroscience. 17, 1122803 (2023).
- Wang, F., et al. A parabrachial to hypothalamic pathway mediates defensive behavior. Elife. 12, e85450 (2023).
- Cowley, M. A., et al. Leptin activates anorexigenic POMC neurons through a neural network in the arcuate nucleus. Nature. 411 (6836), 480-484 (2001).
- Parekh, R. U., et al. Hypothalamic kinin B1 receptor mediates orexin system hyperactivity in neurogenic hypertension. Scientific Reports. 11 (1), 21050 (2021).
- Schmidt, C. X., Tsang, A. H., Oster, H. Generation of mouse primary hypothalamic neuronal cultures for circadian bioluminescence assays. Bio-protocol. 11 (5), e3944 (2021).
- Foo, L. C. . Purification of rat and mouse astrocytes by immunopanning. 2013 (5), 421-432 (2013).
- Emery, B., Dugas, J. C. . Purification of oligodendrocyte lineage cells from mouse cortices by immunopanning. 2013 (9), 854-868 (2013).
- Zhao, H., et al. Changes of constituents and activity to apoptosis and cell cycle during fermentation of tea. International Journal of Molecular Sciences. 12 (3), 1862-1875 (2011).
- Zhang, Z. M., et al. Down-regulation of human leukocyte antigens class I on peripheral T lymphocytes and NK cells from subjects in region of high-incidence gastrointestinal tumor. Chinese Medical Journal. 124 (12), 1813-1817 (2011).
- Drake, S. S., Zaman, A., Simas, T., Fournier, A. E. Comparing RNA-sequencing datasets from astrocytes, oligodendrocytes, and microglia in multiple sclerosis identifies novel dysregulated genes relevant to inflammation and myelination. WIREs Mechanisms of Disease. 15 (2), e1594 (2023).
- Mattanovich, D., Borth, N. Applications of cell sorting in biotechnology. Microbial Cell Factories. 5, 12 (2006).
- Cottrell, E. C., et al. Developmental changes in hypothalamic leptin receptor: relationship with the postnatal leptin surge and energy balance neuropeptides in the postnatal rat. American Journal of Physiology. Regulatory, Integrative and Comparative Physiology. 296 (3), R631-R639 (2009).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır