Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Tendonlarda Gen Ekspresyon Seviyelerinin Mekansal Yüksek Çözünürlüklü Analizi
Bu Makalede
Özet
Bu makale, tendonlar için optimize edilmiş bir in situ protokolün nasıl gerçekleştirileceğini açıklamaktadır. Bu yöntemde doku hazırlama, kesit geçirgenliği, prob tasarımı ve sinyal amplifikasyon yöntemleri ele alınmaktadır.
Özet
Son yıllarda, birçok farklı tıbbi ve biyoloji alanında yüksek çözünürlüklü transkriptomik için birçok protokol geliştirilmiştir. Bununla birlikte, matristen zengin dokular ve özellikle tendonlar, düşük hücre sayıları, hücre başına düşük RNA miktarı ve yüksek matris içeriği nedeniyle geride kaldı ve bu da onları analiz etmeyi karmaşık hale getirdi. En yeni ve en önemli tek hücreli araçlardan biri, tendonlardaki gen ekspresyon seviyelerinin mekansal analizidir. Bu RNA uzamsal araçları, yeni ve bilinmeyen popülasyonların spesifik hücrelerini bulmak, tek hücreli RNA-seq sonuçlarını doğrulamak ve tek hücreli RNA-seq verilerine histolojik bağlam eklemek için tendonlarda özellikle yüksek öneme sahiptir. Bu yeni yöntemler, hücrelerde RNA'nın olağanüstü hassasiyetle analiz edilmesini ve tek hücre düzeyinde tek moleküllü RNA hedeflerinin tespit edilmesini sağlayacak, bu da tendonları moleküler olarak karakterize etmeye ve tendon araştırmalarını teşvik etmeye yardımcı olacaktır.
Bu yöntem makalesinde, tek hücre seviyelerinde sağlam hücreler içinde hedef RNA'yı tespit etmek için yeni in situ hibridizasyon testleri kullanarak histolojik kesitlerde uzamsal gen ekspresyon seviyelerini analiz etmek için mevcut yöntemlere odaklanacağız. İlk olarak, tendon dokusunun mevcut farklı tahliller için nasıl hazırlanacağına ve hedefe özgü sinyallerin arka plan gürültüsü olmadan, ancak yüksek hassasiyet ve yüksek özgüllük ile nasıl yükseltileceğine odaklanacağız. Daha sonra, makale belirli geçirgenleştirme yöntemlerini, farklı prob tasarımlarını ve şu anda mevcut olan sinyal amplifikasyon stratejilerini açıklayacaktır. Tek hücre çözünürlüğünde farklı genlerin transkripsiyon seviyelerini analiz etmek için bu benzersiz yöntemler, çeşitli hayvan modellerinin ve insan tendon dokularının genç ve yaşlı popülasyonlarında tendon dokusu hücrelerinin tanımlanmasını ve karakterizasyonunu sağlayacaktır. Bu yöntem aynı zamanda kemikler, kıkırdak ve bağlar gibi diğer matris açısından zengin dokulardaki gen ekspresyon seviyelerinin analiz edilmesine de yardımcı olacaktır.
Giriş
Tendonlar, kas ve kemik arasındaki kuvvetin iletimini sağlayan bağ dokularıdır1. Gelişimsel olarak, eksenel tenositler, somitlerin2 sklerotomu içindeki mezenkimal hücrelerden türetilir; uzuv tendonları lateral plaka mezoderminden türetilir; ve kraniyal tendonlar, kraniyal nöral krest soyundankaynaklanır 3,4. Tendon, skleraksi transkripsiyon faktörü5'in ekspresyonu ile karakterize edilebilir, ancak tenomodulin, mohawk ve erken büyüme yanıtı 1/2 6,7,8,9 dahil olmak üzere çeşitli belirteçler de tendon gelişiminde önemli bir rol oynar.
Genel olarak, tendonun bilinen birkaç belirtecine rağmen, daha derinlemesine bir karakterizasyon zor olmaya devam etmektedir, çünkü tendon, bir biyomekanik özellik gradyanı boyunca yayılan hücreler içerir. Miyotendinöz bileşke, tendon orta gövdesi ve daha kalsifiye entezden, tendon hücreleri, gerilme özellikleri arasında değişen hücre dışı matrislerde bulunur. Tendonun, yumuşak ve sert doku arasındaki mekanik mukavemet farkının neden olduğu gerilme gerilimine dayanması gerektiğinden, tendondaki hücrelerin mekansal organizasyonu, işlevi için özellikle önemlidir. Bununla birlikte, bu tendon alt popülasyonları hakkında çok az şey bilinmektedir.
Tek hücreli RNA Seq veya in situ hibridizasyon dahil ancak bunlarla sınırlı olmamak üzere hücre alt popülasyonlarını açıklamaya başlamak için birçok yüksek çözünürlüklü uzamsal transkriptomik araç kullanılabilir. Bununla birlikte, bu uzamsal profil oluşturma testleri, mikrodiseksiyon veya kesit alma işleminden sonra doku boyunca RNA ekspresyonunu ortaya çıkarmaya yardımcı olurken, bu yöntemler tendon dokusu üzerinde gerçekleştirildiğinde zor olabilir. Tendonlar, kuru kütle10 ile kollajenin yaklaşık% 86'sından oluşan matris açısından zengin dokulardır ve bu da hücrelerin dizileme için çıkarılmasını zorlaştırır. Hem matristen hücrelerin izole edilmesindeki komplikasyonlar, hem tendon11'in hiposellüler doğası hem de nispeten düşük RNA sayısı nedeniyle, tendon analiz edilmesi zor bir dokudur.
Bu yazıda, doku hazırlama, permeabilizasyon ve prob tasarım yöntemleri sağlayarak yeni in situ hibridizasyon testlerini tendonlar için kullanmak üzere optimize etmek için bir yöntem sunuyoruz. Mevcut dizileme teknolojileriyle birleştiğinde, bu, araştırmacıların gelişmekte olan, yetişkin veya yaralı tendonlar boyunca tendon alt popülasyonlarını artan test duyarlılığı ve özgüllüğü ile mekansal olarak karakterize etmelerine yardımcı olabilir.
Access restricted. Please log in or start a trial to view this content.
Protokol
Tüm hayvan deneyleri, Kurumsal Hayvan Bakım ve Kullanım Komitesi (IACUC) ve AAALAC yönergelerine uygun olarak gerçekleştirilmiştir. Deneyler, Massachusetts General Hospital'da onaylanmış protokol #2013N000062 altında gerçekleştirildi. Bu çalışmada C57BL/J6 fareleri (5 haftalık ve P0) kullanılmıştır. Bu protokolde kullanılan tüm malzemeler, reaktifler ve aletlerle ilgili ayrıntılar için Malzeme Tablosuna bakın.
1. Numune hazırlama ve sabitleme
- Fareleri bir CO2 odasında ötenazi yapın, ardından ikincil bir ötenazi yöntemi olarak servikal çıkık yapın. Ardından, farenin arka ayaklarını kalça eklemi12 boyunca kesmek için makas kullanın. Bir sintilasyon şişesinde, farenin arka ayağını, numuneyi tamamen kaplayacak kadar %4'lük paraformaldehit (PFA) çözeltisine daldırın ve dokuyu 24 saat sabitleyin.
NOT: Fiksasyon için %4 PFA yerine %10 formalin de kullanılabilir. Fiksasyondan sonra, numune daha sonraki işlemlere kadar fosfat tamponlu salin (PBS) içinde saklanabilir. Tüm arka ayağı sabitleyerek, tendon üzerindeki gerginliği koruyabilir ve entezi, tendon orta gövdesini veya miyotendinöz bileşkeyi inceleme fırsatına sahip oluruz. - PFA'yı sintilasyon şişesinden çıkardıktan sonra, numuneyi kaplayacak kadar PBS ekleyerek numuneyi 1x PBS ile 3 x 10 dakika yıkayın. Daha sonra, arka ayakları 1-2 hafta çalkalayarak 4 ° C'de 0,5 M EDTA'ya daldırın ve her 2-3 günde bir taze EDTA ile değiştirin.
- EDTA'yı çıkardıktan sonra, numuneyi 1x PBS ile 3 x 10 dakika yıkayın, numuneleri% 70 EtOH içinde kurutun ve istenen yönde parafine gömün. Dokuyu 3 μm kalınlığında kesitlere ayırmak için geleneksel FFPE kesit alma tekniklerini kullanın ve kesitleri işlenmiş, yüklü bir mikroskop lamına aktarın (bkz. Malzeme Tablosu)13.
NOT: Bölümler, sonraki adımlara geçmeden önce 4 °C'de saklanabilir. - Deparafinizasyon
- Slaytları sıcak bir plaka üzerinde 60 °C'de 1 saat pişirin ve ardından slaytların oda sıcaklığına (RT) gelmesine izin verin. Parafin mumunu slaytlardan çıkarmak için, slaytları bir sürgülü rafa yerleştirin ve ksilen ile doldurulmuş bir boyama kabına indirin. Taze ksilen içinde 3 x 5 dakika tekrarlayın.
DİKKAT: Ksilen tehlikelidir; Dikkatli tutun. - Bölümleri yeniden sulandırmak için, slaytları yıkama başına 5 dakika boyunca, tümü RT'de olmak üzere aşağıdakilere daldırın: 2x'i %100 EtOH'de, 1x'i dH2O'da seyreltilmiş %75 EtOH'de, 1x'i PBS'de seyreltilmiş %50 EtOH'de, 1x'i PBS'de seyreltilmiş %25 EtOH'de ve 2x'i PBS'de yıkayın.
NOT: Tüm rehidrasyon adımları, bir sürgülü raf üzerindeki slaytlarla ve boyama tabaklarındaki çeşitli EtOH çözeltileri ile yapılır.
- Slaytları sıcak bir plaka üzerinde 60 °C'de 1 saat pişirin ve ardından slaytların oda sıcaklığına (RT) gelmesine izin verin. Parafin mumunu slaytlardan çıkarmak için, slaytları bir sürgülü rafa yerleştirin ve ksilen ile doldurulmuş bir boyama kabına indirin. Taze ksilen içinde 3 x 5 dakika tekrarlayın.
2. RNAscope (ticarileştirilmiş ISH) protokolü14 adaptasyonu
- Çözeltilerin ve probların hazırlanması
- pH 8'de 25 mM Tris-HCl, 10 mM EDTA ve 50 mM glikozu birleştirerek kesitli numunelerin ön işlemi için TEG çözeltisi hazırlayın. Tüm numunelerin işlenmesi için yeterli bir hacim oluşturun veya fazlasını hazırlayın; filtre-sterilize edin ve RT'de saklayın; Kullanmadan önce çözeltiyi uygun şekilde karıştırın.
- Tüm yıkamalar için yeterli miktarda 1x Yıkama Tamponu (Malzeme Tablosuna bakın) hazırlayın ve RT'de saklayın.
- 40 ° C'lik bir su banyosunda veya inkübatörde, ilgilenilen probları 10 dakika ısıtın. Ardından, probları ISH protokolü14'e göre hazırlayın.
- Numunelerin ön muamelesi
- Önerilen ön işlem solüsyonunu kullanmak yerine, slaytları 60 ° C'de 4 saat boyunca TEG tamponu içeren bir boyama kabına daldırın.
NOT: TEG tampon inkübasyonu, doku özellikle yoğunsa veya ilgilenilen RNA bağlanma motifinin antijen alımı zorsa 6 saate kadar uzatılabilir. Bu durumda buraya bir durma noktası eklenebilir, slaytlar kurutulabilir ve gece boyunca 4 °C'lik bir buzdolabında saklanabilir. - Numuneleri tampondan çıkarın ve kurumasını bekleyin. Daha sonra, numunelerin etrafını hidrofobik bir bariyer kalemle çizin, proteaz IV içeren başka bir boyama kabına daldırın ve 40 °C'de 45 dakika fırında inkübe edin.
NOT: Yetişkin fareler için proteaz IV'ü öneririz. P0 gibi daha genç fareler kullanıyorsanız, 30 dakika boyunca proteaz III gibi daha hafif bir enzim kullanmanızı öneririz. Farklı yaşlar için sorun giderirken, tendonun bütünlüğünü gözlemleyin ve bozulma olup olmadığını kontrol edin. Doku ayrışıyor veya bozuluyorsa, inkübasyon süresini azaltın veya kullanılan proteazı değiştirin. - Numuneleri tekrar TEG tamponunda 30 dakika yıkayın ve ardından probları ISH protokolüne14 göre hibritleyin.
- Numunenin üzerine 50-100 μL montaj reaktifi ekleyin. Mikroskopi için numunelerin üzerine bir lamel yerleştirin. Görüntüleme yaparken, sinyali görüntülemek için yüksek bir büyütme (40x objektif veya daha yüksek) kullanın.
- Önerilen ön işlem solüsyonunu kullanmak yerine, slaytları 60 ° C'de 4 saat boyunca TEG tamponu içeren bir boyama kabına daldırın.
3. HCR ISH protokolü15 adaptasyonu
- Sonradan Tespit
- PBS'de %4 PFA (PBS'de), PBT çözeltisi (PBS'de %0.1 Tween-20) ve PBS'de Proteinaz K (stok konsantrasyonu 10 mg/mL, nihai konsantrasyon 5 μg/mL) hazırlayın.
- İlk sonek adımına başlamak için, slaytları 5 dakika boyunca %4 PFA içeren bir boyama kabına daldırın; daha sonra %4 PFA solüsyonunu çıkarın ve sonraki adımlarda kullanmak üzere saklayın. Slaytları PBT solüsyonunda 2 x 5 dakika durulayın ve PBT solüsyonunu çıkarın. Slaytları 5 dakika boyunca Proteinaz K çözeltisi (5 μg/mL) içeren bir boyama kabına koyun ve 2 x 5 dakika PBT çözeltisinde durulayın.
- İkinci sonek adımına başlayın ve slaytları 5 dakika boyunca %4 PFA'ya daldırın.
NOT: Bu, adım 3.1.2'den kaydedilen %4'lük PFA'nın aynısıdır. - Slaytları PBT solüsyonunda 3 x 5 dakika durulayın.
NOT: Tüm sabitleme sonrası adımlar, bir sürgülü raf üzerindeki slaytlarla ve ilgili solüsyonları içeren boyama kaplarında yapılır.
- Asetilasyon
- 625 μL asetik anhidrit, 3.3 mL 1 M trietanolamin (TEA) tamponu ve 246 mL ddH2O içeren asetilasyon solüsyonunu hazırlayın. İyice karıştırdığınızdan ve hazırlandıktan hemen sonra kullandığınızdan emin olun.
- Slaytları 10 dakika asetilasyon solüsyonuna yerleştirin ve ardından PBT solüsyonunda 3 x 5 dakika durulayın. Slaytları ddH2O'da durulayın ve 30 dakika kurumaya bırakın. Ardından, hidrofobik bir bariyer kalemle numunelerin etrafını çizin.
NOT: Tüm asetilasyon adımları, bir sürgülü raf üzerindeki slaytlarla ve ilgili solüsyonları içeren boyama kaplarında yapılır.
- Hibridizasyon
- Hibridizasyon tamponunu 37 °C'ye önceden ısıtın ve nemlendirilmiş bir odayı 37 °C'ye ısıtın.
DİKKAT: Tampon, tehlikeli bir madde olan formamid içerir. Slaytlar yeterince kuru değilse, fazla dH2O'yu çıkarmak için kenarları bir laboratuvar bezi ile kurulayın. - 100 μL hibridizasyon tamponuna her prob karışımından 0,4 pmol ekleyerek prob çözeltileri hazırlayın.
NOT: dHCR görüntüleme kullanılıyorsa, prob hibridizasyon verimliliğini artırmak için daha yüksek bir prob konsantrasyonu kullanın. - 3 M NaCl (4 L'lik son hacimde 701.1 g NaCl) ve 0.3 M Na3CH6H5O7•2H2O (352.8 g) birleştirerek 4 L Sodyum Klorür Sodyum Sitrat Tamponu (20x SSC) hazırlayın ve ardından HCl veya 10 N NaOH ekleyerek nihai pH'ı 7'ye ayarlayın. 4 L'ye ulaşmak için yeterli H2O ekleyin. 20x SSC'yi 5x'e seyrelterek ve toplam hacmin% 0.1'i olacak şekilde% 10 Tween 20 ekleyerek 5x SSCT hazırlayın.
- Numuneye 200 μL hibridizasyon tamponu ekleyin, slaytları nemlendirilmiş bir odaya yerleştirin ve slaytların 10 dakika inkübe etmesine izin verin. Hibridizasyon solüsyonunu çıkarın ve kenarları bir laboratuvar mendili ile lekeleyerek sürgü üzerindeki fazla tamponu boşaltın.
- Hazırlanan prob çözeltisinden 100 μL'yi numunenin üzerine ekleyin ve numunenin üzerine bir lamel yerleştirin. Gece boyunca bir fırında veya yaklaşık 12-16 saat, 5x SSC ve% 50 formamid içeren bir çözelti ile nemlendirilmiş bir odada inkübe edin. Sıcaklığı 37 °C'ye ayarlayın.
NOT: Kuluçka gece boyunca olduğundan, lamel ilavesi buharlaşmayı en aza indirmek içindir. - 37 ° C'lik bir su banyosunda 5x SSCT çözeltisinden oluşan bir alikot ve RT'de ikinci bir alikot bırakın. Bir sonraki adımda numune numarasına ve yıkama sayısına bağlı olarak ihtiyaç duyulan bu alikotların hacimlerini tahmin edin.
- Hibridizasyon tamponunu 37 °C'ye önceden ısıtın ve nemlendirilmiş bir odayı 37 °C'ye ısıtın.
- Yıkama
- Önceden ısıtılmış 5x SSCT çözeltisini kullanarak, %75 yıkama tamponu/%25 5x SSCT, %50 yıkama tamponu/%50 5x SSCT ve %25 yıkama tamponu/%75 5x SSCT solüsyonu hazırlayın.
- Fazla probları çıkarmak için, slaytları yıkama başına 15 dakika boyunca 37 °C'de %75 yıkama tamponu/%25x SSCT, %50 yıkama tamponu/%50x SSCT ve %50 yıkama tamponu/%25 5x SSCT'ye daldırın. Lamellerin numunelerden kaymasına izin verin.
- Slaytları %100 5x SSCT ile 2 x 15 dakika inkübe edin ve ardından RT'de 5 dakika boyunca 5x SSCT'ye daldırın.
NOT: Yıkama adımları, bir sürgülü raf üzerindeki slaytlarla ve ilgili solüsyonları içeren boyama kaplarında veya damlacıklar halinde eklenen solüsyonlarla yapılabilir.
- Amplifikasyon
- 6 μL saç tokası h1 ve 6 pmol saç tokası h2'yi 2 μL'lik 3 μM'lik bir stoğu çırparak hazırlayın (95 °C'de 90 saniye ısıtın ve RT'ye soğutun). Bu işlem sırasında saç tokalarını ışıktan koruyun.
NOT: HCR saç tokaları h1 ve h2, bir saç tokası saklama tamponunda sağlanır ve ani soğutma için hazırdır. Cool h1 ve h2 saç tokalarını ayrı tüplere oturtun. - Slaytları kenarlarını bir laboratuvar mendiliyle lekeleyerek kurulayın. Ardından, numunenin üzerine 200 μL amplifikasyon tamponu ekleyin ve RT'de 30 dakika boyunca nemlendirilmiş bir odaya yerleştirin. RT'de 100 μL amplifikasyon tamponuna snapcool h1 saç tokaları ve snapcool h2 saç tokaları ekleyerek saç tokası karışımını hazırlayın.
- Amplifikasyon tamponunu çıkarın ve kenarları bir laboratuvar mendiliyle lekeleyerek sürgü üzerindeki fazla sıvıyı boşaltın. Önceden hazırlanmış firkete karışımından 100 μL ekleyin ve numunenin üzerine parafilm yerleştirin. Slaytları RT'de karanlık, nemlendirilmiş bir odada en az 4 saat veya gece boyunca inkübe edin.
- Fazla saç tokalarını çıkarmak için, slaytları bir boyama kabına 5x SSCT'ye daldırın ve RT'de 30 dakika inkübe edin. Yıkamayı taze 5x SSCT'de 30 dakika ve üçüncü kez 5 dakika tekrarlayın.
- Kenarları bir laboratuvar mendili ile kurulayarak slaytları kurulayın ve numunenin üzerine 50-100 μL montaj reaktifi ekleyin. Mikroskopi için numunelerin üzerine bir lamel yerleştirin. Görüntüleme yaparken, sinyali görüntülemek için yüksek bir büyütme (40x objektif veya daha yüksek) kullanın.
- 6 μL saç tokası h1 ve 6 pmol saç tokası h2'yi 2 μL'lik 3 μM'lik bir stoğu çırparak hazırlayın (95 °C'de 90 saniye ısıtın ve RT'ye soğutun). Bu işlem sırasında saç tokalarını ışıktan koruyun.
Access restricted. Please log in or start a trial to view this content.
Sonuçlar
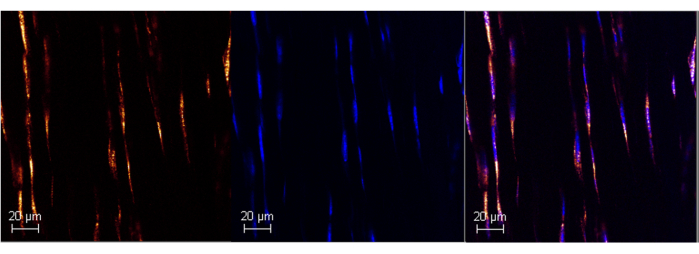
Şekil 1: RNAScope kullanılarak yetişkin fare Aşil tendonunda Poli A RNA ekspresyonu. Ticarileştirilmiş ISH testi kullanılarak fare Aşil tendonunda (sol panel) başarılı Poly A etiketlemesinin temsili görüntüsü. DAPI ile kolokalizasyon, probun özgüllüğünü (orta ve sağ paneller) doğrulayarak ark...
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
Bu yazıda, tendon dokusunda yüksek derecede özgüllük ve duyarlılıkla kullanılabilecek şekilde mevcut ISH araçlarından yararlanmak için yapılan modifikasyonları açıklıyoruz. Tendon oldukça matris yoğun bir doku olduğundan, benzer derecelerde prob penetrasyonu ve özgüllüğü elde etmek için protokol ayarlamaları sıklıkla yapılmalıdır. Bu spesifik permeabilizasyon yöntemleri ve tendon dokusunun sinyal amplifikasyon stratejileri, tartışılan ISH protokollerin...
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
Yazarların açıklanacak herhangi bir çıkar çatışması yoktur.
Teşekkürler
Yazarlar, bu protokollerin geliştirilmesi ve sorun giderme konusundaki destekleri ve teşvikleri için Jenna Galloway'e ve Galloway Lab üyelerine teşekkür eder.
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1 M triethanolamine buffer | |||
| 10% Formalin solution | |||
| 10% Tween-20 | |||
| 20x Saline Sodium Citrate buffer | |||
| 4% PFA | |||
| ACD RNAscope Fluorescent Multiplex Fluorescent Reagent Kit V2 | ACD | 323100 | |
| Acetic Anhydride | |||
| Axio Imager Microscope | ZEISS | ||
| C57BL/J6 mice | JAX ID: 000664 | ||
| Coverslips | Fisher | 12-541-042 | |
| ddH2O | |||
| ETDA | Thermofisher | AM9262 | |
| EtOH | |||
| Glucose | VWR Chemicals BDH | BDH9230-500G | |
| HCR RNA-FISH Bundle | Molecular Instruments Inc. | ||
| HybEZ II Hybridization System | ACD | ||
| Immedge Barrier Pen | Vector Laboratories | H4000 | |
| Leica SPE Confocal Microscope | Leica | ||
| Parafilm | Fisher | ||
| Phosphate-buffered saline (PBS, 1x) | Invitrogen | AM9625 | Dilute 10x PBS in milli-Q water to get 1x solution |
| Protease IV | |||
| Proteinase K | Roche | 3115836001 | |
| RNAscope H2O2 and Protease Reagents | ACD | PN 322381 | Included in ACD RNAscope Fluorescent Multiplex Fluorescent Reagent Kit V3 |
| RNAscope Multiplex Fluorescent Detection Kit | ACD | PN 323110 | Included in ACD RNAscope Fluorescent Multiplex Fluorescent Reagent Kit V2 |
| RNAscope Target Retrieval reagents | ACD | 322000 | Included in ACD RNAscope Fluorescent Multiplex Fluorescent Reagent Kit V4 |
| RNAscope Wash Buffer | ACD | PN 310091 | Included in ACD RNAscope Fluorescent Multiplex Fluorescent Reagent Kit V5 |
| RNAscope Probe Diluent | ACD | 300041 | |
| Slide holder | StatLab | 4465A | |
| Staining Dish with Lid | StatLab | LWS20WH | |
| Superfrost Plus Microscope slides | Fisher | 1255015 | treated, charged slides |
| Tris-HCl | |||
| Xylene | Sigma-Aldrich | 534056-4L |
Referanslar
- Sharma, P., Maffulli, N. Tendon injury and tendinopathy: healing and repair. Journal of Bone and Joint Surgery. 87 (1), 187-202 (2005).
- Brent, A. E., Schweitzer, R., Tabin, C. J. A somitic compartment of tendon progenitors. Cell. 113 (2), 235-248 (2003).
- Noden, D. M. The role of the neural crest in patterning of avian cranial skeletal, connective, and muscle tissues. Developmental Biology. 96 (1), 144-165 (1983).
- Chen, J. W., Galloway, J. L. The development of zebrafish tendon and ligament progenitors. Development. 141 (10), 2035-2045 (2014).
- Schweitzer, R., et al. Analysis of the tendon cell fate using Scleraxis, a specific marker for tendons and ligaments. Development. 128 (19), 3855-3866 (2001).
- Tsai, S., Nödl, M., Galloway, J. Bringing tendon biology to heel: Leveraging mechanisms of tendon development, healing, and regeneration to advance therapeutic strategies. Developmental Dynamics. 250 (3), 393-413 (2021).
- Kannus, P., et al. Location and distribution of non-collagenous matrix proteins in musculoskeletal tissues of rat. The Histochemical Journal. 30 (11), 799-810 (1998).
- Kannus, P. Structure of the tendon connective tissue. Scandinavian Journal of Medicine & Science in Sports. 10 (6), 312-320 (2000).
- Thorpe, C. T., Birch, H. L., Clegg, P. D., Screen, H. R. C. The role of the non-collagenous matrix in tendon function. International Journal of Experimental Pathology. 94 (4), 248-259 (2013).
- Lin, T. W., Cardenas, L., Soslowsky, L. J. Biomechanics of tendon injury and repair. Journal of Biomechanics. 37 (6), 865-877 (2004).
- Grinstein, M., et al. A distinct transition from cell growth to physiological homeostasis in the tendon. eLife. 8, e48689(2019).
- Villaseñor, S., Grinstein, M. Two-photon microscopy for the study of tendons. Journal of Visualized Experiments. , e65853(2023).
- Qin, C., et al. The cutting and floating method for paraffin-embedded tissue for sectioning. Journal of Visualized Experiments. (139), e58288(2018).
- Wang, F., et al. RNAscope®: A Novel In Situ RNA Analysis Platform for Formalin-Fixed Paraffin-Embedded Tissues. Journal of Molecular Diagnostics. 14 (1), 22-29 (2012).
- Choi, H. M. T., et al. Third-generation situ hybridization chain reaction: multiplexed, quantitative, sensitive, versatile, robust. Development. 145 (12), 165753(2018).
- Jackson, D. J., Herlitze, I., Hohagen, J. A whole mount in situ hybridization method for the gastropod mollusc Lymnaea stagnalis. Journal of Visualized Experiments. (109), e53968(2016).
- Young, A. P., Jackson, D. J., Wyeth, R. C. A technical review and guide to RNA fluorescence in situ hybridization. PeerJ. 8, e8806(2020).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır