İn Vitro Kültürlenmiş Memeli Hücrelerinde Orto-ftalaldehit Kullanılarak Oksitlenmiş ve İndirgenmiş Glutatyon Formlarının Hızlı Miktar Tayini
Bu Makalede
Özet
Hem oksitlenmiş hem de indirgenmiş glutatyon formlarının (sırasıyla GSSG ve GSH) miktar tayini, Orto-ftalaldehit (OPA) kullanılarak elde edilmiştir. OPA, GSH'ye konjuge edildiğinde yüksek oranda floresan hale gelir, ancak indirgenene kadar GSSG'yi konjuge edemez. Burada, normalizasyon için protein miktar tayini kullanarak her ikisini de ölçmek için multiparametrik bir tahlili açıklıyoruz.
Özet
Glutatyon uzun zamandır hücrenin antioksidan tepkisini belirlemek için önemli bir biyobelirteç olarak kabul edilmektedir. Bu nedenle, reaktif oksijen türleri çalışmaları için birincil bir belirteçtir. Yöntem, glutatyon(lar)ın hücresel konsantrasyonunu ölçmek için Orto-ftalaldehit (OPA) kullanır. İndirgenmiş glutatyon (GSH) ile OPA konjugatları, daha sonra bir izoindol oluşturmak üzere sülfhidril bağlanması yoluyla yüksek oranda floresan bir konjuge ile sonuçlanır. Hem oksitlenmiş glutatyon (GSSG) hem de GSH'nin doğru bir sonucunu elde etmek için, bu protokolde uygulanan maskeleme ajanları ve indirgeyici ajanların bir kombinasyonu gereklidir. Tedaviler ayrıca hücresel canlılığı da etkileyebilir. Bu nedenle, protein tahlili yoluyla normalizasyon, bu multiparametrik tahlilde sunulmaktadır. Test, GSH'ye özgü 0.234 - 30μM (R2 = 0.9932±0.007 (N = 12)) sözde doğrusal bir algılama aralığı göstermektedir. Önerilen tahlil ayrıca, indirgenmiş glutatyonu bağlamak için maskeleme ajanı N-etilmaleimid ilavesiyle oksitlenmiş glutatyonun belirlenmesine izin verir ve indirgeyici ajan tris (2-karboksietil) fosfin, iki molekül üretmek için GSSG'deki disülfid bağını parçalamak için sokulur. Test, protein miktar tayini için doğrulanmış bir bikinkoninik asit testi ve sitotoksisite değerlendirmesi için bir adenilat kinaz testi ile kombinasyon halinde kullanılır.
Giriş
Reaktif oksijen türleri (ROS), oksidatif stresin birincil indükleyicisidir; oksidatif stres, DNA mutasyonları, hücresel yaşlanma / ölüm, çeşitli kanserler, diyabet, nörolojik hastalıklar (Parkinson ve Alzheimer gibi) ve diğer bazı yaşamı zayıflatan durumlarda iyi bir şekilde kurulmuştur 1,2,3,4,5. ROS'a karşı önemli bir savunma, proton donörleri olarak hareket ederek oksidanları veya radikalleri indirgeyebilentiyolik, enzimatik olmayan antioksidanlardır 6,7. Glutatyon (GSH) ve sistein, memelilerde bulunan en yaygın iki tiyoldür8, diğer çeşitli düşük moleküler ağırlıklı tiyoller (ergothioneine gibi) bulunurken, GSH ve sistein, literatürde bulunan en yaygın ölçülen enzimatik olmayan antioksidanlardır 9,10,11 ve ROS 8,12,13,14 ile mücadele için en büyük öneme sahiptir.
GSH bir antioksidan olarak kullanıldığında, iki GSH molekülü, glutatyon disülfür (GSSG) yapmak için bir disülfid bağı yoluyla kovalent olarak birbirine bağlanır. GSH'nin tükenmesi genellikle oksidatif stresin bir göstergesi olarak kullanılır 15,16. Bu değerlendirme aynı zamanda GSSG'nin tespiti ile de birleştirilebilir, ancak hücrelerde GSSG'deki artışlar genellikle aktif ihracat süreçleri ile sınırlıdır, çünkü GSSG hücrelerde nispeten reaktif olabilir ve bu da diğer protein tiyolleri ile disülfid bağı oluşumuna yol açabilir16.
GSH ve GSSG'yi ölçmek için geleneksel yöntemler basit işlemler değildir ve litik reaktifler17,18 kullanılarak hücresel ekstraksiyon dahil olmak üzere çok sayıda adım gerektirir. Burada özetlenen protokol, bu yöntemleri basitleştirir ve enzimatik olmayan tiyollerin doğru ölçümüne ve hücresel protein içeriği veya adenilat kinaz salınımı kullanılarak normalizasyona izin verir. Ek olarak, GSH / GSSG ekstraksiyonundan önce hücresel canlılığı ölçmek mümkündür. Daha önce çeşitli yöntemler, indirgenmiş ve oksitlenmiş enzimatik olmayan tiyolleri verimli bir şekilde hedeflemeye ve ölçmeye çalışmıştır; HPLC 19,20,21, plaka tahlili (biyokimyasal)22,23,24,25 ve tiyol konjugasyonu için 5,5-ditio-bis-(2-nitrobenzoik asit) (DTNB/ Ellman reaktifi) gibi yaygın reaktifler kullanan yöntemler (DTNB/ Ellman reaktifi)19, Monoklorobiman (mBCI)26,27,28. Birkaç şirket ayrıca glutatyonun tespiti için özel kitler hazırlamıştır; Bununla birlikte, kullanılan tedavilere bağlı sorunlar sunan reaktif uyumsuzluklarını yayınlamazlar29.
Bu protokol, sırasıyla 340/450 Ex/Em'de tespit edilebilen bir floresan sinyali üretmek için orto-ftalaldehit (OPA) konjugasyonu yoluyla indirgenmiş tiyolleri (GSH gibi) tespit eden multiparametrik bir testi ana hatlarıyla belirtir. Bu test, maskeleme ajanları (N-etilmaleimid) ve GSSG indirgeyici ajanlar (tris (2-karboksietil) fosfin) kullanılarak hem GSH hem de GSSG'nin aynı anda (plaka içinde) saptanmasını kolaylaştırır. Bu çoklu biyobelirteç protokolü ayrıca, hücresel parçalanma aşamasında, son ölçümün tamamlanmasının ardından numunelerin normalleştirilmesi için biskinkoninik asit testi yoluyla veya hücre ortamından bir adenilat kinaz testi yoluyla proteinleri ölçmek için bir fırsat sağlar. Bu tahlil, çoğu laboratuvarda kolayca bulunabilen birkaç reaktif kullanılarak gerçekleştirilebilir ve gerçekleştirmek için yalnızca birkaç ek nadir kimyasal gerektirir. İşlem basit, erişilebilir ve zahmetli aşamalar olmadan 2 saatten daha kısa sürede gerçekleştirilebilir.
Bu protokolde, daha önce ROS'u indüklediği gösterilen veya oksidatif stresi indüklediğinden şüphelenilen çeşitli nanomalzemeler seçilmiştir30,31. Bu nanomalzemelerin maruz kalmasının çeşitli hücre hatları üzerindeki etkilerini ve testin antioksidan tiyollerin miktarını belirlemedeki etkinliğini görmek için bir konsantrasyon aralığı araştırıldı.
Protokol
NOT: Aşağıdaki protokol, numuneleri tedavilere normalleştirmek için bir bikinkoninik asit (BCA) protein testi ve bir adenilat kinaz (AK) testi ile birlikte kullanılma kapasitesi ile tasarlanmıştır. Malzemelerin hazırlanması ve kullanımı boyunca operatörün uygun kıyafetler ve Howie laboratuvar önlüğü, nitril eldivenler ve sınıf I güvenlik gözlükleri gibi gerekli güvenlik ekipmanlarını giydiğinden emin olun. Protokol birkaç aşamaya ayrılmıştır.
1. Stok ve çalışma solüsyonlarının hazırlanması
- 1 mM HCl'de 100 mM GSH standardında stok çözeltileri hazırlayın (çift damıtılmış suda (ddH2O)% 37 HCl'den hazırlanır).
NOT: %37 HCl gibi yüksek konsantrasyonlu asitten seyreltiliyorsa, sınıf I çeker ocakta suya asit eklemek için doğru işlemi sağlayın. - Mutlak etanolde 22.35 mM OPA'lık bir stok hazırlayın. Bu adımı bir sınıf I çeker ocakta gerçekleştirin. ddH 25 O'da 2 mM N-etilmaleimid (NEM) hazırlayın.Bu adımı sınıf I davlumbazda gerçekleştirin.
NOT: Bu üç çözelti -20 °C'de 3 aya kadar saklanabilir. - 100 kuyu için gerekli olan toplam 500 μL hacme kadar 0.01 M Tris(2-karboksietil) fosfin (TCEP) hazırlayın. ddH2O kullanılarak 100 mM stoktan seyreltilmiş 100 μL 1 mM GSH standardı hazırlayın.
- İmmünopresipitasyon (IP) lizis tamponu veya aşağıdaki formülasyonu kullanın: 394 mg Tris-HCl (son konsantrasyon 25 mM), 877 mg NaCl (son konsantrasyon 150 mM), 29 mg EDTA (son konsantrasyon 1 mM), 1 mL% 100 NP-40 veya IGEPAL CA-630 (nihai konsantrasyon% 1 V / V), 5 mL gliserol (nihai konsantrasyon% 5 V / V), 84 mL ddH2O. Bileşenleri hafifçe karıştırarak karıştırın ve pH'ı 7.4'e ayarlayın. 100 mL'lik hacimsel bir şişeye boşaltın ve 100 mL'lik bir nihai hacme ulaşmak için kalan ddH2O hacmini ekleyin. 0,22 μm'lik bir filtreden steril filtre geçirin ve 2-8 ° C'de 6 aya kadar saklayın.
NOT: Lizasyon çözeltileri bu tahlilde bir kirletici/parazit görevi görür; Bu nedenle, yukarıdaki formülasyonlar belirtilmiştir. - Etilendiamin tetraasetik asit (PBS-EDTA) ile desteklenmiş 3 farklı pH değerinde, özellikle 7.2, 8.5 ve 9.0 L 0.1 M fosfat tamponlu salin hazırlayın. 1 mM EDTA (292.24 mg / L) veya aşağıdaki 10x (1 L) formülasyonu ile desteklenmiş ticari bir 0.1 M PBS tamponu kullanın: 80 g NaCl, 2.0 g KCl, 14.4 g Na2HPO4, 2.4 g KH2PO4, 800 mL ddH2O ekleyin ve karıştırın; 1 L'ye kadar doldurun Sterilite solüsyonunu otoklavlayın ve oda sıcaklığında 12 ay boyunca saklayın. 10x stok çözeltisinden, çalışan bir PBS çözeltisi yapın ve bunu EDTA (daha önce belirtildiği gibi konsantrasyon) ile destekleyin.
NOT: pH kritik öneme sahiptir; Protokole başlamadan önce pH'ın doğru olduğundan emin olun. - ddH2O(1 mM, 500 μM, 250 μM, 125 μM, 62.5 μM, 31.25 μM, 15.625 μM ve 7.8125 μM) kullanarak 1 mM GSH'nin 1: 2 seri seyreltmesini gerçekleştirin. Standart kuyucuklara her konsantrasyondan 10 μL ekleyin (çift olarak gerçekleştirilir). Numuneler, lizis tamponunda daha da seyreltilecektir; bu nedenle, konsantrasyonlar daha sonra orijinal konsantrasyonlarının 1 /5'i olacaktır (200, 100, 50, 25, 12.5, 6.25, 3.125, 1.5625 μM).
NOT: Kalibrasyon için nihai konsantrasyonlar 30 μm, 15 μm, 7.5 μm, 3.75 μm, 1.875 μm, 937.5 nm, 468.8 nm ve 234.4 nm olacaktır.
2. Tahlil hazırlığı
NOT: Bu protokol, ATCC'den ticari olarak satın alınan HepG2, A549 ve J774 insan hücre hatlarını kullanır. Bu hücre hatları, Üniversitenin hayvan ve doku kültürü yasaları ve yönetmelikleri tarafından belirtilen onaylanmış kılavuzlar altında kullanılmıştır.
- Tahlil başlamadan 24 saat önce, Tablo 1'de gösterilen konsantrasyonlarda tohum hücreleri; Bununla birlikte, kullanılan hücre hattına / tipine ve tedaviye bağlı olarak, yoğunluğu gerektiği gibi ayarlayın. Hücreleri tam büyüme ortamında büyütün (% 10 Isı ile inaktive edilmiş fetal buzağı serumu (HIFS),% 1 Penstrep (10.000U / mL penisilin / 10mg / mL streptomisin) ve% 1 esansiyel olmayan amino asitler içeren Eagles modifiye edilmiş esansiyel ortam (EMEM).
- Konvansiyonel hücre tohumlama yöntemleri kullanılarak tohumlanan hücreler32. Tahlil sonrası mikroskopi kullanılmıyorsa tamamen siyah plakalardaki tohum hücreleri. Mikroskopi ile kullanmadan önce T75 şişesindeki hücreleri birleşme ve genel sağlık açısından değerlendirin.
- Temiz, steril, sınıf II bir biyolojik güvenlik kabininde ve sıkı bir aseptik tekniği izleyerek, hücre ortamını atın, hücreleri ~ 15 mL steril, oda sıcaklığında (RT) PBS ile nazikçe yıkayın ve atın.
- Hücre şişesine 5 mL steril 1x tripsin ekleyin, hücre tek tabakasının kaplanmasını sağlamak için hafifçe sallayın ve hücre ayrılmasını kolaylaştırmak için 5 dakika boyunca 37 ° C'de bir inkübatöre yerleştirin.
- Yaklaşık 10 mL, ısıyla inaktive edilmiş fetal buzağı serumu (% 10) içeren büyüme ortamı ekleyerek tripsinizasyonu durdurun.
- Hücreleri 50 mL'lik bir santrifüj tüpüne aktarın ve 5 dakika boyunca 200 x g'da pelet yapın. Ortamı atın ve aynı ortamdan 5 mL ile değiştirin. Tüpteki hücreleri homojen olana ve topaklanma gözlenmeyene kadar yeniden süspanse edin.
- 20 μL hücre süspansiyonunu çıkarın ve saymak için bir hemositometreye yerleştirin. Gerekli hücre sayısı hesaplandıktan sonra, doğru hücre yoğunluğuna sahip bir çözelti yapmak için bir seyreltme gerçekleştirin.
- Kuyucuk başına maksimum 200 μL hacme sahip 96 oyuklu plakalarda (350 μL kapasiteli) hücreler içeren pipet ortamı. Hücreleri, plaka yüzeyine yapışması için 24 saat boyunca% 5 CO2 içeren 37 ° C'lik bir inkübatöre yerleştirin.
- Hem toplam glutatyon hem de GSSG'yi değerlendirmek için, her iki durum için de numuneleri tedavi edin. GSH ve GSSG'nin her birine 3 teknik tekrar ile 2 set sağlamak için 6 kuyuyu tohumlayın ve tedavi edin (Şekil 1 yerleşimi göstermektedir).
- Testin başlamasından önce tüm reaktiflerin uygun şekilde hazırlandığından emin olun; Kullanıma kadar buzda/buzdolabında tutulması gereken pH 7.4 PBS (EDTA olmadan) hariç, tamponların yapımına veya tahlilde kullanıma başlamadan önce tüm tampon bileşenlerinin ve reaktiflerin RT'de olduğundan emin olun.
NOT: Test içinde istenen reaksiyonların meydana gelmesine izin vermek ve plaka okuyucu aracılığıyla doğru miktar tayinine izin vermek için kabarcık oluşumunun minimumla sınırlandırılması kritik öneme sahiptir.
| Hücre hattı | Tohumlama yoğunluğu (96 oyuklu plaka) |
| HepG2 | 10.000 hücre / kuyu |
| A549 Serisi | 5.000 hücre / kuyu |
| J774 Serisi | 10.000 hücre / kuyu |
Tablo 1: Seçilen hücre hatları için önerilen tohumlama yoğunlukları. Temsil edilen verilerde kullanılan üç farklı hücre hattı, özellikle A549, J774 ve HepG2 için farklı tohumlama yoğunlukları gösterilmiştir.
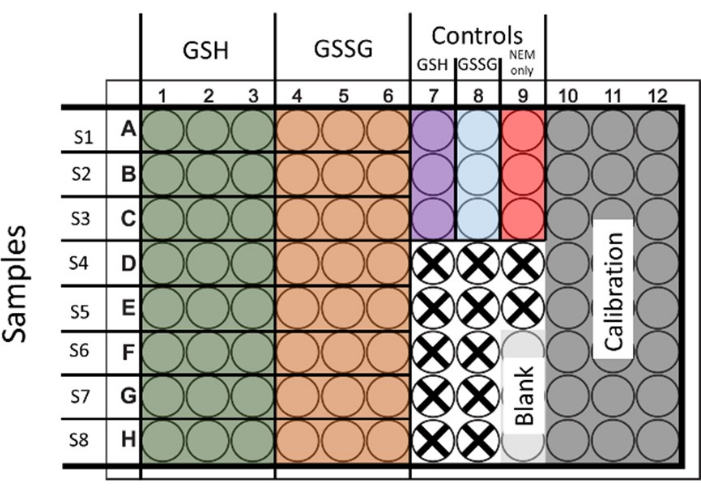
Şekil 1: Toplam Glutatyon ve Glutatyon disülfidin aynı anda belirlenmesi için 96 kuyulu plakanın tohumlanması için önerilen düzen. Kalibrasyon ve kontroller için kuyular da gösterilmiştir. Kullanılmayan kuyular bir haç ile temsil edilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
3. Nanomalzeme tedavisi
- Nanomalzemeleri (özellikle ZnO, TiO2, CuO ve Ag) μg kapasiteli bir ağırlık ölçeğinde tartın. Nanomalzeme başına 1 mg / mL'lik bir başlangıç konsantrasyonu elde etmek için bir hesaplama yapın.
- Nanomalzeme çözeltilerini bir sonikatörün içine aktarın ve homojen bir çözelti üretmek için bir sonikasyon banyosu (38 W) kullanarak 16 dakika boyunca sonikat yapın. Her nanomalzeme için 125, 62.5, 31.25, 15.625 μg / mL'de bir dizi seyreltme yapın.
- Hücreleri inkübatörden çıkarın ve RT PBS ile hafifçe yıkayın. Tüm PBS'nin çıkarıldığından emin olduktan sonra, kontrollerle (HIFS'siz kültür ortamı) plakaya 100 μL tedavi ekleyin. Hücrelere tedavi uyguladıktan sonra, nanomalzemelerle 37 ° C'lik bir inkübatörde (% 5 CO2) 4 saat inkübe edin; daha sonra, GSH'yi ölçmek için aşağıdaki protokolü kullanın: GSSG, protein konsantrasyonu ve AK salınımı.
4. Tahlil protokolü
- Tedaviye maruz kaldıktan sonra (Şekil 2A), adenilat kinaz (AK) aktivitesi (isteğe bağlı) yoluyla canlılığı değerlendirin. Bu test için üreticinin talimatlarını izleyerek ticari bir kit kullanın.
- Pelet muamelesini ve hücre kalıntılarını hafifçe temizlemek için plakaları 200 x g'da 5 dakika boyunca bir santrifüjde döndürün (Şekil 2B).
- Her numuneden 20 μL ortam süpernatantını nazikçe çıkarın ve kontrol kuyusunu (yukarıda belirtildiği gibi) ve aynı yerleşim formatında bitişik 96 oyuklu beyaz bir plakaya pipetleyin (Şekil 2C).
- AK kitinden her bir oyuğa 100 μL çalışma solüsyonu ekleyin, plakayı ışıktan koruyun ve oda sıcaklığında 10 dakika gelişmeye bırakın. 1000 sayım/sn'de bir plaka okuyucu kullanarak lüminesansı kaydedin.
- GSH standartları için, her kuyucuğa 40 μL toplam glutatyon tamponu ekleyin (Şekil 2D; isteğe bağlı, miktar tayini için gereklidir).
- Plakadan kalan ortamı aspire edin ve 3x'i buz gibi soğuk 0.1 M PBS, pH 7.2 ile yıkayın, standartlar hariç her yıkamayı atın (Şekil 2E). GSH kalibrasyonu plakaya yüklenene kadar son yıkamayı plakada bırakın.
- Her glutatyon konsantrasyonundan 10 μL ekleyin ve üç kopya halinde kuyucuklara boşaltın (ddH2O).
- Son PBS yıkamasını çıkarın ve istenen hedef miktar tayini için karışımları Tablo 2'ye göre her bir kuyucuğa ekleyin (Şekil 2E). Tam arabelleklerle zamana duyarlı etkinlik kaybı nedeniyle bu adıma başlamadan önce gerekli hacimleri hesaplayın. Test işlemine başlamadan önce bu reaktif karışımlarının yapıldığından emin olun, ancak kullanmadan önce 30 dakikadan fazla oturmalarına izin vermeyin.
- Bir orbital plaka çalkalayıcıya yerleştirin ve plakanın 300 RPM'de 2 dakika sallanmasına izin verin (Şekil 2F).
- Çalkalayıcıdan çıkarın ve NEM kontrol kuyusu hariç her kuyucuğa 5 μL 0.01M TCEP çözeltisi ekleyin. Plakayı çalkalayıcıya geri koyun ve 10 dakika inkübe edin (Şekil 2F).
- Plakayı santrifüje aktarın ve 5 dakika boyunca 200 x g'da döndürün. Her numune kuyucuğundan 25 μL'yi başka bir 96 oyuklu plakaya (şeffaf) aktarın; Bu, protein konsantrasyonu için kullanılacaktır (bkz. adım 4.15; Şekil 2G). Standartları veya tahlil kontrollerini aktarmayın.
- Her kuyucuk için son hacmin 30 μL olduğundan emin olun; bu gereksinimi karşılamak için kontrollerden ve standartlardan sesi çıkarın (Şekil 2H).
- Her kuyucuğa 170 μL çalışma OPA çözeltisi ekleyin, plakayı ışıktan koruyun ve 15 dakika çalkalayıcı üzerine yerleştirin (Şekil 2I).
- Ex340/EM450'de bir plaka okuyucu kullanarak floresansı okuyun (Şekil 2J). Ölçüm aşamasında kabarcık olmadığından emin olun; Hem reaksiyon hem de plaka okuyucu aracılığıyla miktar tayini üzerinde zararlı bir etkiye sahip olacaklardır.
- Parçalanmış hücrelerin protein içeriğini ölçmek için ticari bir BCA test kiti kullanın. Adım 4.12'den alınan numuneleri, kuyucuk başına 25 μL'lik yeni bir 96 oyuklu plakaya (şeffaf) aktarın.
- IP lizis tamponunda seyreltilmiş bir sığır serum albümini (BSA) standardı kullanın ve kuyucuk başına 25 μL'de üç kopya halinde plakaya ekleyin. Kesin konsantrasyonlar BCA kit protokolünde tanımlanmıştır.
- BCA kitinden 50:1 oranında A ve B reaktiflerinden oluşan bir çalışma solüsyonu hazırlayın ve numune, standart ve kontrol içeren her bir oyuğa 200 μL ekleyin. Plakaları ışıktan koruyun ve 37 ° C'de 30 dakika inkübe edin (Şekil 2K).
- Numuneleri inkübatörden çıkarın, oda sıcaklığında 5 dakika dengelenmesine izin verin, ardından 562 nm'de plaka okuyucu aracılığıyla absorbasyonu okuyun (Şekil 2L).
| Toplam glutatyon konsantrasyonu lizis reaktif karışımı | |
| Parça | Hacim |
| Lizis tamponu | 50μL |
| Toplam hacim / kuyu | 50μL |
| Oksitlenmiş glutatyon konsantrasyonu lizis reaktif karışımı | |
| Parça | Hacim |
| Lizis tamponu | 49,5 μL |
| NEM (25mM) | 0,5μL |
| Toplam hacim / kuyu | 50μL |
| HER IKI ÇÖZELTIYI DE KARIŞIM BILEŞIMINDEN 30 DAKIKA SONRA KULLANIN | |
| OPA algılama çözümü bileşeni | Hacim |
| OPA 3mg / mL | 5μL |
| PBS (pH 9.0) | 165μL |
| Toplam hacim / kuyu | 170μL |
Tablo 2: Protokolü gerçekleştirmek için gerekli reaktif hacimleri. Toplam glutatyon, glutatyon disülfür ve çalışma reaktifinin belirlenmesi için kuyu başına gereken hacimler gereklidir. Gerekli hacimlerin hesaplandığından ve aktarım yoluyla hacim kaybını hesaba katmak için bir fazlalığın dahil edildiğinden emin olun.
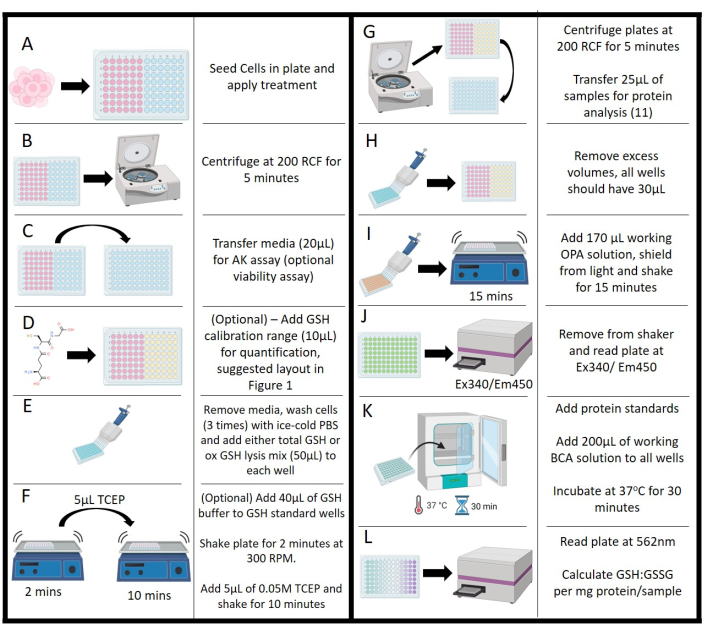
Şekil 2: Protokolün şematik gösterimi. (A) Hücrelerin ilk tohumlanması, kuluçka ve tedavisi. (B) Ortamı askıda katı maddelerden ayırmak için santrifüjleme. (C) Adenilat kinaz testi için ortam transferi. (D) Kalibrasyon aralığı için glutatyon konsantrasyonlarının eklenmesi. (E) Yıkama aşamaları ve parçalama reaktifi ilavesi. (F) Tampon ilavesi ve çalkalama adımı ile tris (2-karboksietil) fosfin ilavesi. (G) Protein analizi için ortamın uzaklaştırılması için parçalanmış hücrelerin santrifüjlenmesi. (H) Plaka boyunca hacmi eşitlemek için ortamın çıkarılması. (I) Çalkalama inkübasyonu ile orto-ftalaldehit çalışma solüsyonunun eklenmesi. (J) Orto-ftalaldehit floresansın plaka okuyucu ile ölçülmesi. (K) Protein tayini için Bikinkoninik asit testi için inkübasyon aşamaları. (L) Glutatyonun normalleşmesine izin veren protein konsantrasyonunun ölçümü: glutatyon disülfid değerleri. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Temsili Sonuçlar
Bu protokolü takiben, A549 ve J774 hücre hatları sırasıyla 5.000 hücre / kuyu ve 10.000 hücre / kuyu yoğunluklarında tohumlandı ve 48 saat boyunca% 5 CO2 içinde 37 ° C'de kültürlendi. Nanomalzeme işleminden sonra AK analizi Ek Tablo 1'de gösterilmiştir ve protein konsantrasyonu Ek Tablo 2'de gösterilmiştir.
Kalibrasyon grafiği
Şekil 3'te gösterilen, üç farklı hücre tipinden (kalibrasyonu etkilememelidir) üç farklı hücre tipinden üç ayrı plakadan belirtilen konsantrasyon aralığını (0.234 - 30 μM nihai konsantrasyon) kullanan üç farklı, ardışık olmayan günde yapılan üç kalibrasyondur. 3 örnek gösterilirken, 12'lik bir N gözlendi ve ortalama R2 değeri 0.9932 ± 0.007 olan benzer doğrusal regresyonlar gösterdi.
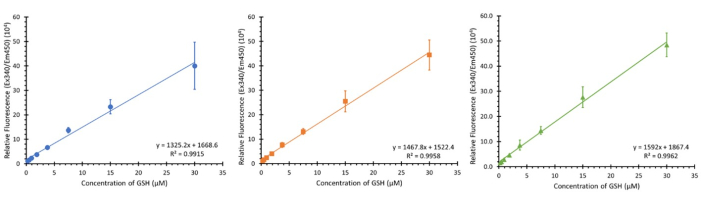
Şekil 3: Test için glutatyon kalibrasyon grafikleri. Her biri bir hafta arayla gerçekleştirilen ayrı plaka içi glutatyon kalibrasyon aralıklarından üç kalibrasyon grafiği; SD ± hata çubukları (n=3, N=12) n=teknik kopyalar, N=Biyolojik kopyalar. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Örnek sonuçlar
HepG2, A549 ve J774 hücreleri, oksidatif stres yoluyla hücresel mekanizmalarda değişikliklere neden olduğundan şüphelenilen çeşitli nanomalzemelerin değerlendirilmesinde kullanıldı. Açıklanan tespit ve miktar belirleme protokolü kullanıldı.
3 ölçümden (AK, BCA ve GSH/GSSG) elde edilen veriler aşağıdaki gibi ele alınmıştır. Normalizasyon için AK ve BCA testi uygulandı; Önerilen kiti kullanan AK testi, hücre ortamına salınan AK miktarı için en hızlı ve en basit veriyi verecektir. Hücre ölümünün artması için AK değerlerinde artış beklenir. Bu nedenle, bir -ve (Canlı) ve +ve (Ölü) kontrolü gereklidir. Bu, yüzdeye dayalı normalleştirmeye izin verecektir.
BCA testi daha uzun bir işlemdir, ancak protein miktar tayini (mg / mL) yoluyla ölçülebilir sonuçların elde edilmesine izin verecektir. Bu, AK'de olduğu gibi bir -ve veya +ve kontrolü gerektirmez, ancak yine de değerlerin normalleştirilmesine izin vermek için genel bir -ve kontrolü (işlenmemiş hücreler) gerektirecektir.
Bu temsili sonuçlar bölümünde, tedavinin (nanomalzemeler) AK testi ile etkileşime neden olma potansiyeline sahip olduğu bulunmuştur. Bu nedenle, tüm normalizasyonlar BCA verileri kullanılarak gerçekleştirildi. Bu nedenle, bilgi, mg / mL protein başına (BCA testi yoluyla) tespit edilen türlerin konsantrasyonu (GSH veya GSH + GSSG (ancak, GSSG konsantrasyonunu elde etmek için toplam GSH + GSSG konsantrasyonundan GSH konsantrasyonunun çıkarılması gerçekleştirilir) olarak sunulur. İstenirse, bu daha sonra istenen tedaviden GSH: GSSG'deki değişikliği değerlendirmek için bir orana dönüştürülebilir.
Şekil 4'te gösterilen GSH'dir: OPA protokolü kullanılarak elde edilen ve BCA (μg / mL) yoluyla protein ekspresyonuna normalize edilen üç farklı hücre hattından (A549, J774 ve HepG2) GSSG oranı verileri, ek GSH ve GSSG değerlerini belirten daha fazla veri Ek Şekil 1'de bulunabilir.
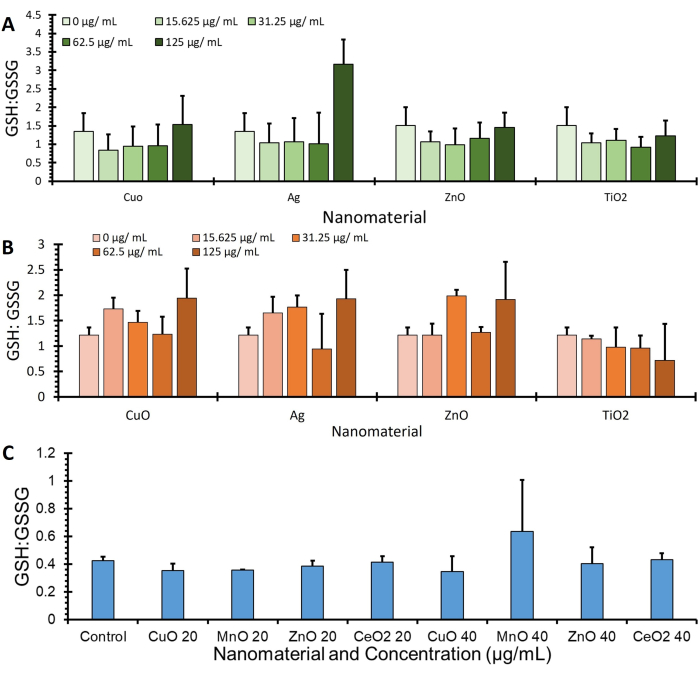
Şekil 4: Glutatyon: Glutatyon disülfür oranıtahlilin gerçekleştirilmesinden elde edilir. Gösterilen glutatyondur: (A) A549, (B) J774 ve (C) HepG2 olmak üzere 3 hücre hattının glutatyon disülfür oranları. Hücreler 4 saat boyunca tedavilerle (serum içermeyen ortamda çeşitli nanomalzemeler) inkübe edildi. Hücreler, glutatyon ve glutatyon disülfürdeki değişiklikleri ölçmek için bu protokol kullanılarak işlendi ve protein miktar tayini, hata çubukları ± SE yoluyla normalize edildi (n=3, N=3) Bu rakamın daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Plaka ayrıca testin doğru şekilde çalıştığından emin olmak için bir dizi kontrol içerir. NEM, OPA algılama ortamı ile etkileşim eksikliğini göstermek için ayrı bir bileşen olarak eklenir. Kalibrasyon standardı, OPA tespit reaktifinin artan GSH konsantrasyonlarına etkili bir şekilde bağlanması için etkili kapasiteyi gösteren GSH konsantrasyonunda doğrusal bir artış gösterir.
Bu testin özellikle tiyollerde yaygın olarak bulunan serbest sülfhidril gruplarını (yaygın olarak antioksidanlar olarak kabul edilen GSH gibi) hedef aldığına dikkat edilmelidir. Potansiyel bir etkileşim, OPA'nın protein tiyollerine bağlanmasıdır ve bu da yanlış veri toplanmasına neden olur. Bu nedenle, BCA testi, verileri proteine normalleştirmek ve serbest GSH'nin doğru bir şekilde yansıtılmasına izin vermek için çok önemli bir aşamadır.
Ek Şekil 1: Glutatyon, glutatyon disülfür ve glutatyonu gösteren şekiller: (A) A549, (B) J774 ve (C) HepG2 olmak üzere 3 hücre hattından glutatyon disülfid oranı. Hücreler 4 saat boyunca tedavilerle (serum içermeyen ortamda çeşitli nanomalzemeler) inkübe edildi. Hücreler, glutatyon ve glutatyon disülfiddeki değişiklikleri ölçmek için bu protokol kullanılarak işlendi ve protein miktar tayini, hata çubukları ± SE (n = 3, N = 3) yoluyla normalize edildi Bu Dosyayı indirmek için lütfen buraya tıklayın.
Ek Tablo 1: A549 ve J774 hücreleri için adenilat kinaz değerlerinin meta verileri. Bu dosyayı indirmek için lütfen buraya tıklayın.
Ek Tablo 2: A549, J774 ve HepG2 hücreleri için kalibrasyon ile Biskinkoninik asit değerlerinin meta verileri. Bu dosyayı indirmek için lütfen buraya tıklayın.
Tartışmalar
Belirtildiği gibi, hücresel redoksu anlama, oksidatif stres durumlarını izleme ve antioksidan tepki, kanserler ve nörodejenerasyon gibi sayısız hastalığın anlaşılması ve önlenmesinde her zaman çok önemli olmuştur33,34. Burada, hızlı ve minimum hazırlıkla doğru GSH: GSSG tespitinin erişilebilirliğini artırarak çeviri ortamını iyileştirmenin bir yolu gösterilmiştir.
Bu protokol, BCA protein testi ve / veya AK testi yoluyla 2 normalizasyon yolu ile hücre içi glutatyon / tiyol türlerinin (indirgenmiş ve oksitlenmiş) belirlenmesi için multiparametrik bir test dizisini gösterir. Bu tahlil, ilk aracı ekstraksiyon adımı boyunca diğer çeşitli belirteçleri tespit etmek için de değiştirilebilir ve kalibrasyon aralığının hariç tutulmasıyla basitçe oksitlenmiş/indirgenmiş bir tiyol oranı verecek şekilde basitleştirilebilir.
Analitlerin değerlendirilmesi göz önüne alındığında, hem mBCI hem de OPA araştırıldı ve kullanım için karşılaştırıldı. mBCl başlangıçta iyi sinyal potansiyeli gösterirken, kullanımda önemli sınırlamalar keşfedildi. Öncelikle, canlı hücrelerin kullanımı mBCl'nin en iyi kullanımını gösterir; bununla birlikte, hücre lizizinden sonra, sinyalin söndürüldüğü ve genellikle OPA35'e kıyasla çok kuyulu bir formatta azaldığı bulundu. Diğer bir konu ise GSSG'nin mBCl ile ölçülmesidir, bu konuda literatür seyrektir ve protokol optimizasyonu/araştırması yoluyla mBCl yoluyla GSSG'nin doğru tespiti sağlanamamıştır.
OPA testinin, 0,234 - 30 μM GSH konsantrasyon aralığında R2 ortalaması 0,9932 ± 0,007 (N = 12) ile önemli ölçüde güvenilir kalibrasyon aralıkları sunduğunu gösterdik. Bu aralık, literatürde bulunan önceki referans aralıkları nedeniyle seçilmiştir35. Bu aralıkların dışında glutatyonu tespit etmek teorik olarak mümkündür, ancak reaktiflerin konsantrasyonunda, inkübasyon süresinde ve potansiyel olarak tespitte kullanılan ekipmanda değişiklik yapılması gerekecektir. Her plakanın miktar tayini için kendi standart aralığını gerektirdiğine dikkat edilmelidir; Farklı günlerde gerçekleştirilen plakalar arasındaki en ufak bir zaman farkı, ölçüm sırasında elde edilen değerler üzerinde önemli bir etkiye sahip olabilir.
Bu protokolden doğru ve güvenilir veriler elde etmek, birkaç önemli adıma sıkı sıkıya bağlı kalınmasına bağlıdır. Protokolde gerekli olan çeşitli tamponları oluştururken, pH'ın doğru olması çok önemlidir. Bu nedenle, pH 9 gerektiren tamponlar, bu değerin ± 0,1'inden fazla sapmaya sahip olmamalıdır. Bunun nedeni, tampon bileşenlerinin çözeltiden yanlış pH'ta çökelme potansiyelidir; Bu protokolü tam olarak takip etmek bu sorunu önleyecektir.
İşlemin tamamen çıkarılması ve parçalamadan önce doğru yıkama, plaka okuma aşamasında artefaktları ve yanlış veri toplamayı önlemek için de kritik öneme sahiptir. Hücreler parçalandıktan sonra (adım 4.8), tedavinin çıkarılması mümkün değildir ve plaka kurtarılamaz. Protokol boyunca eklenen tampon/reaktif hacimlerinin numuneler ve standartlar arasında değişmesi nedeniyle, kullanıcının adım 4.12 ve 4.13'te belirtilen çeşitli hacimlerin farkında olması çok önemlidir. Tahlil operatörü ayrıca bu çeşitli hacimlerden haberdar edilir ve doğru ölçümün elde edilmesini sağlamak için tüm hacimlerin aynı olmasını sağlaması talimatı verilir. Numuneler ve standartlar arasındaki hacimler gözle görülür şekilde önemli olmadığından, numune kuyusunda fazla çözelti bulunması ile ilgili olarak yapılması kolay bir hata olabilir.
Bu protokolün, doğru ve güvenilir veri elde etmek için kritik olan önemli adımlara dayanan sınırlamaları vardır. Bu testi yapan kullanıcıların, kabarcık oluşumu gibi istenmeyen sorunları önlemek için makul düzeyde laboratuvar becerilerine sahip olmaları gerekir. Kabarcık oluşumu, hem mikroplaka içinde reaksiyonların meydana gelme kapasitesi hem de floresan ölçümü üzerinde ciddi bir etkiye sahiptir. Bu protokolde kullanılan parçalama maddesi, kabarcık oluşumunu önlemek için mücadele edebilecek acemi bir araştırmacı için zorluk çıkaran bir deterjan içerir. Anında santrifüjleme bu hatayı kurtarabilir. Protokol ayrıca hücre tipi ile ilgili olarak potansiyel olarak sınırlıdır; hücre hatları A549, J774 ve HepG2, bu protokol için hem optimize etmek hem de veri üretmek için kullanıldı. Diğer hücre hatları, doğru verileri elde etmek için farklı tohumlama yoğunlukları ve protokolün optimizasyonunu gerektirebilir.
Bu protokol, mevcut birkaç tahlillere göre çok sayıda avantaj sunar. Ftalaldehit kullanılarak tiyollerin tespiti yeni bir kavram olmasa da, bunun gibi birleşik bir tahlil formatında, bir mikroplakada, sınırlı gerekli malzeme ve ekipmanla kullanım, tüm laboratuvarların bu protokole erişmesi için büyük bir potansiyel sunar. Ticari tedarikçilerden gelen çoğu Thiol / GSH kiti, reaktiflerinin bileşimini açıklamaz. Bu nedenle, uyumsuzluklar/parazit potansiyelini öngörmek zor olabilir. Burada, bu potansiyeli sınırlamak için kullanılan tüm reaktiflerin her bir bileşenini sunuyoruz.
Bu protokol de ilk tedavi süresinin tamamlanmasının ardından oldukça hızlı bir şekilde gerçekleştirilir. Kuluçka aşamaları arasındaki kullanıcı işlemesini hesaba katan bu protokolün tiyol miktar tayini yönü 1 saatin altında gerçekleştirilebilir. Numuneler aynı anda parçalanır ve bu reaksiyon türleri için en uygun olan numunelerin otomatik oksidasyonunu önlemek için bağlanır. Protokolde belirtilmemiş olsa da, numuneler teknik olarak bir plaka içinde parçalanabilir ve mühürlenebilir, bu da gelecekteki analizler için dondurulmalarına izin verir. Ancak, protokolde yapılan bu değişiklik araştırılmamıştır.
Açıklamalar
Yazarlar herhangi bir çıkar çatışması beyan etmemektedir.
Teşekkürler
Bu araştırma Avrupa projeleri GRACIOUS (GA760840) ve SUNSHINE (GA952924) tarafından finanse edilmiştir. Yazarlar ayrıca, bu protokolün geliştirilmesine bir şekilde yardımcı olan herkesin çabalarını da takdir etmek isterler.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 0.22µm filter (optional-For lysis buffer) | Fisher scientific | 12561259 | |
| 100mL volumetric flask | Fisher scientific | 15290866 | |
| 1L Volumetric flask | Fisher scientific | 15230876 | |
| 250mL beaker (optional-For lysis buffer) | Fisher scientific | 15409083 | |
| 8-Channel micropipette (20-200µL) | SLS | FA10011D2 | |
| 8-Channel micropipette (2-20µL) | SLS | B2B06492 | |
| 96 well plates - black with clear bottom, TC treated | Fisher scientific | 10000631 | Preferred plate for seeding and fluoresence, use TC treated clear if unavailable |
| 96 well plates - clear (TC treated and untreated) | Fisher scientific | 10141161 | If black plates with clear bottom is not available/ suitable use TC treated clear |
| 96 well plates - white, Not TC treated | Fisher scientific | 11457009 | |
| A549 (lung carcinoma) cell line | ATCC | CCL-185 | |
| Absolute ethanol | Merck (Sigma-Aldrich) | 1.08543 | |
| Aluminium foil | Fisher scientific | 11779408 | For protecting plates from light |
| BCA Assay Kit | Thermo | 23225 | |
| Benchtop Centrifuge (with 96 plate rotor) | Eppendorf | 5804 | |
| Ethylenediaminetetraacetic acid (EDTA) | Merck (Sigma-Aldrich) | E9884 | |
| Glutathione (GSH) | Merck (Sigma-Aldrich) | G6013 | |
| Glutathione disulfide (GSSG) | Merck (Sigma-Aldrich) | G4501 | |
| Glycerol | Merck (Sigma-Aldrich) | G5516 | |
| HCl, 37% | Merck (Sigma-Aldrich) | 258148 | Dilute to 1mM for GSH stock, pH adjustment also |
| HepG2 (Hepatocarcinoma) cell line | ATCC | HB-8065 | |
| IGEPAL CA-630 | Merck (Sigma-Aldrich) | 18896 | Use either IGEPAL CA-630 or NP-40 for solution, not both |
| IP lysis buffer | Fisher scientific | 11825135 | |
| J774 (monocyte, macrophage) cell line | ATCC | TIB-67 | |
| KCl | Merck (Sigma-Aldrich) | P3911 | |
| KH2PO4 | Merck (Sigma-Aldrich) | P0662 | |
| Micropipette (20-200µL) | SLS | B2B06482 | |
| Micropipette (2-20µL) | SLS | B2B06478 | |
| Microplate shaker | VWR | 444-0041 | |
| Na2HPO4 | Merck (Sigma-Aldrich) | S9763 | |
| NaCl | Merck (Sigma-Aldrich) | S9888 | |
| NaOH, 10M | Merck (Sigma-Aldrich) | 72068 | For pH adjustment only |
| N-Ethylmaleimide (NEM) | Merck (Sigma-Aldrich) | E3876 | |
| NP-40 | Merck (Sigma-Aldrich) | 492016 | Use either IGEPAL CA-630 or NP-40 for solution, not both. NP-40 alternative suggested |
| Ortho -Phthaldialdehyde (OPA) | Merck (Sigma-Aldrich) | P1378 | |
| PBS 0.1M | Merck (Sigma-Aldrich) | P2272 | PBS can either be acquired pre-made or made in house, see notes |
| Plate reader (with fluoresence capacity) | Tecan | SPARK | |
| Stir bar (optional-For lysis buffer) | Fisher scientific | 16265731 | |
| Toxilight bioassay kit (AK assay) | Lonza | LT17-217 | |
| Tris(2-carboxyethyl)phosphine hydrochloride (TCEP) 0.5M in H2O | Alfa Aesar | H51864 | Can also be purchased crystalised and suspended |
| TRIS-HCl | Merck (Sigma-Aldrich) | 93363 | |
| X100 phosphatase and protease cocktail | Fisher scientific | 10025743 |
Referanslar
- Barnham, K. J., Masters, C. L., Bush, A. I. Neurodegenerative diseases and oxidative stress. Nat Rev Drug Discov. 3 (3), 205-214 (2004).
- Arfin, S., et al. Oxidative stress in cancer cell metabolism. Antioxidants. 10 (5), 642 (2021).
- Cooke, M. S., Evans, M. D., Dizdaroglu, M., Lunec, J. Oxidative DNA damage: mechanisms, mutation, and disease. The FASEB Journal. 17 (10), 1195-1214 (2003).
- Ghezzi, P., Jaquet, V., Marcucci, F., Schmidt, H. H. H. W. The oxidative stress theory of disease: levels of evidence and epistemological aspects. Br J Pharmacol. 174 (12), 1784-1796 (2017).
- Bhattacharyya, A., Chattopadhyay, R., Mitra, S., Crowe, S. E. Oxidative stress: An essential factor in the pathogenesis of gastrointestinal mucosal diseases. Physiol Rev. 94 (2), 329-354 (2014).
- Yin, F., Sancheti, H., Cadenas, E. Mitochondrial thiols in the regulation of cell death pathways. Antioxi Redox Sig. 17 (12), 1714-1727 (2012).
- Balcerczyk, A., Bartosz, G. Thiols are main determinants of total antioxidant capacity of cellular homogenates. Free Rad Res. 37 (5), 537-541 (2003).
- McBean, G. J. Cysteine, glutathione, and thiol redox balance in astrocytes. Antioxidants. 6 (3), 62 (2017).
- Nimse, S. B., Pal, D. Free radicals, natural antioxidants, and their reaction mechanisms. RSC Adv. 5 (35), 27986-28006 (2015).
- Nordberg, J., Arnér, E. S. J. Reactive oxygen species, antioxidants, and the mammalian thioredoxin system1. Free Rad Biol Med. 31 (11), 1287-1312 (2001).
- Pham-Huy, L. A., He, H., Pham-Huy, C. Free radicals, antioxidants in disease and health. Int J Biomed Sci. 4 (2), 89 (2008).
- Harris, I. S., DeNicola, G. M. The complex interplay between antioxidants and ROS in cancer. Trend Cell Biol. 30 (6), 440-451 (2020).
- Traverso, N., et al. Role of glutathione in cancer progression and chemoresistance. Oxid Med Cell Longev. 2013, 972913 (2013).
- Day, R. M., Suzuki, Y. J. Cell proliferation, reactive oxygen and cellular glutathione. Dose-Resp. 3 (3), 425-442 (2005).
- Aquilano, K., Baldelli, S., Ciriolo, M. R. Glutathione: new roles in redox signaling for an old antioxidant. Front Pharmacol. 5, 196 (2014).
- Zitka, O., et al. Redox status expressed as GSH: GSSG ratio as a marker for oxidative stress in paediatric tumour patients. Onco Lett. 4 (6), 1247-1253 (2012).
- Childs, S., Haroune, N., Williams, L., Gronow, M. Determination of cellular glutathione: glutathione disulfide ratio in prostate cancer cells by high performance liquid chromatography with electrochemical detection. J Chrom A. 1437, 67-73 (2016).
- Giustarini, D., et al. glutathione disulfide, and S-glutathionylated proteins in cell cultures. Free Rad Biol Med. 89, 972-981 (2015).
- Özyürek, M., et al. Determination of biothiols by a novel on-line HPLC-DTNB assay with post-column detection. Analytica Chimica Acta. 750, 173-181 (2012).
- Zhang, L., Lu, B., Lu, C., Lin, J. Determination of cysteine, homocysteine, cystine, and homocystine in biological fluids by HPLC using fluorosurfactant-capped gold nanoparticles as postcolumn colorimetric reagents. J Sep Sci. 37 (1-2), 30-36 (2014).
- Tsiasioti, A., Georgiadou, E., Zacharis, C. K., Tzanavaras, P. D. Development and validation of a direct HPLC method for the determination of salivary glutathione disulphide using a core shell column and post column derivatization with o-phthalaldehyde. J Chromat B. 1197, 123216 (2022).
- Huang, D., Ou, B., Prior, R. L. The chemistry behind antioxidant capacity assays. J Agri Food Chem. 53 (6), 1841-1856 (2005).
- Berker, K. I., Güçlü, K., Tor, &. #. 3. 0. 4. ;., Demirata, B., Apak, R. Total antioxidant capacity assay using optimized ferricyanide/prussian blue method. Food Anal Meth. 3 (3), 154-168 (2010).
- Rahman, I., Kode, A., Biswas, S. K. Assay for quantitative determination of glutathione and glutathione disulfide levels using enzymatic recycling method. Nat Prot. 1 (6), 3159-3165 (2007).
- Kampa, M., et al. A new automated method for the determination of the Total Antioxidant Capacity (TAC) of human plasma, based on the crocin bleaching assay. BMC Clin Pathol. 2 (1), 3 (2002).
- Fernández-Checa, J. C., Kaplowitz, N. The use of monochlorobimane to determine hepatic GSH levels and synthesis. Anal Biochem. 190 (2), 212-219 (1990).
- Nauen, R., Stumpf, N. Fluorometric microplate assay to measure glutathione S-transferase activity in insects and mites using monochlorobimane. Anal Biochem. 303 (2), 194-198 (2002).
- Stevenson, D., Wokosin, D., Girkin, J., Grant, M. H. Measurement of the intracellular distribution of reduced glutathione in cultured rat hepatocytes using monochlorobimane and confocal laser scanning microscopy. Toxicol in vitro. 16 (5), 609-619 (2002).
- McBeth, C., Stott-Marshall, R. J. Interference of reversible redox compounds in enzyme catalysed assays–Electrochemical limitations. Anal Biochem. 662, 114972 (2023).
- Yu, Z., et al. Reactive oxygen species-related nanoparticle toxicity in the biomedical field. Nanoscale Res Lett. 15 (1), 115 (2020).
- Boyles, M., et al. Development of a standard operating procedure for the DCFH2-DA acellular assessment of reactive oxygen species produced by nanomaterials. Toxicol Mech Meth. 32 (6), 439-452 (2022).
- Segeritz, C. P., Vallier, L. Cell culture: Growing cells as model systems in vitro. Basic Sci Meth Clin Res. , 151-172 (2017).
- Ma, Q. Role of nrf2 in oxidative stress and toxicity. Ann Rev Pharmacol Toxicol. 53, 401-426 (2013).
- Calabrese, V., Cornelius, C., Dinkova-Kostova, A. T., Calabrese, E. J., Mattson, M. P. Cellular stress responses, the hormesis paradigm, and vitagenes: novel targets for therapeutic intervention in neurodegenerative disorders. Antioxid redox Signal. 13 (11), 1763-1811 (2010).
- Ishkaeva, R. A., Zoughaib, M., Laikov, A. V., Angelova, P. R., Abdullin, T. I. Probing cell redox state and glutathione-modulating factors using a monochlorobimane-based microplate assay. Antioxidants. 11 (2), 391 (2022).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır