Method Article
Acanthamoeba spp.'nin miktar tayini Motilite
Bu Makalede
Özet
Bu prosedür, Acanthamoeba spp.' nin nasıl görselleştirileceğini, izleneceğini ve ölçüleceğini açıklar.Motilite.
Özet
Acanthamoeba keratit, tedavide zorluklar yaratan ve körlüğe yol açabilen ciddi bir oküler enfeksiyondur. Her yerde bulunmasına ve suya maruz kaldıktan sonra kontakt lenslerin potansiyel kontaminasyonuna rağmen, bu patojenin doğal davranışı belirsizliğini korumaktadır. Acanthamoeba'nın hareket kalıplarını anlamak, kontakt lensleri nasıl kolonize ettiği ve hastanın korneasını nasıl kontamine ettiği hakkında bize bilgi verebilir. Şanslı ki Acanthamoeba spp. 4x büyütmeden başlayarak parlak alan mikroskobu ile görülebilir. Sitopatik etkiler veya elektrik alanına yetersiz maruz kalma ile ilgili olarak Acanthamoeba motilitesini ölçmek için önceki teknikler geliştirilmiştir. Burada, Acanthamoeba spp. 'yi izlemek ve ölçmek için bir yöntem açıklıyoruz.motilite uzun süreli (saatler ila günler), birden fazla amip suşuna, yüzeylerine ve amipin beslenme durumuna uygulanabilen bir protokoldür. Bu prosedür, enfeksiyon, proliferasyon veya davranış değişikliğinin farklı aşamalarını izlemek için gerekli olan mesafe, hız, hapsetme ve yönlülük gibi birçok temel motilite niceliklerini belirlemek için gereklidir.
Giriş
Acanthamoeba'nın korneaya bağlanmasını takiben parazitik bir enfeksiyon olan Acanthamoeba keratitinin (AK) prevalansının artması nedeniyle Acanthamoeba araştırmaları son yıllarda önemli ölçüde artmıştır1. AK salgınları uygun olmayan kontakt lens bakımı veya etkisiz kontakt lens bakım solüsyonlarına 2,3,4,5 bağlanabilirken, şu anda piyasadaki herhangi bir ürün için Acanthamoeba dezenfeksiyon etkinliğini göstermek için herhangi bir gereklilik yoktur. Bununla birlikte, bilim camiasında ve standart kuruluşları içinde, kontakt lens bakım ürünlerinin dezenfeksiyon etkinliğini ölçmek için gerekli protokolleri incelemek için devam eden bir çaba vardır 6,7. Ayrıca, hücresel ve fonksiyonel yönlerden insan makrofajlarına benzerliği nedeniyle, Acanthamoeba'nın, amipin kendisinin getirdiği patojeniteye ek olarak, diğer insan patojenlerini8 barındırmada ve yaymada önemli bir role sahip olduğu kaydedilmiştir.
Sitopatik etkiler veya elektrik alanına9,11 yetersiz maruz kalma ile ilgili olarak, genellikle Brown hareketine 9,10 yüksek oranda tabi olmayan Acanthamoeba motilitesini ölçebilen son teknikler ve ayrıca Acanthamoeba'yı izlenebilir viral vektör olarak kullanan dev virüs araştırmalarında motilite analizindeki ilerlemeler 12, 13. Ayrıca, son 20 yılda, burada kullanılan görüntüleme yazılımı gibi yeni yazılım programları, yeni algoritmalar ve derin öğrenme teknolojileri kullanılarak hücre ve parçacık takibinde sürekli ve önemli gelişmeler olmuştur14. Bununla birlikte, bu, tezgah üstü araştırma, klinik uygulama ve endüstriyel standartlarla ilgili nispeten yeni ve büyüyen bir bilim alanıdır ve özellikle kontakt lenslere yapışmayı takiben veya kontakt lens dezenfeksiyonu sırasında veya sonrasında davranış değişikliklerini ölçmek için bu amipleri görselleştirme ve izleme yöntemleriyle ilgili olarak yayınlanmış veri yetersizliği olmuştur. Uzun vadeli görsel izlemeye genişleyen diğer alanlar bu çabayı desteklemiştir 15,16,17. Acanthamoeba'nın doğası gereği zorlu doğası nedeniyle - plazmitlere karşı genel bir direnç (floresan verebilir), amipin standart hücre boyalarını tüketme ve yok etme yeteneği ve benzersiz bir dış protein yapısı - antikor etiketlemeyi zorlaştırır - diğer hücreler için mevcut olan ve onları parlak alan görüntüleme dışındaki ortamlarda görünür kılan yöntemler bu organizmada kullanılamaz olmuştur. Bu nedenle, bu amipin motilitesinin ölçülmesi, alana önemli bir katkı sağlamıştır. Burada açıklanan yöntemi kullanarak, amiplerin besinler18 olmadan en az 12 saat boyunca hareketli kaldığını ve bir dezenfeksiyon işlemi ile zorlanan ve dezenfeksiyon sırasında motiliteyi durduran amiplerin, tam olarak parçalanmadıkları takdirde dezenfeksiyon sonrası motilitelerini geri kazanabileceklerini tespit edebildik19.
Bu protokol, amipin motilitesinin mikroskobik olarak görsel olarak nasıl izleneceğini ve ölçüleceğini detaylandırır. Birincil adımlar, görüntüler arasındaki uygun odak ve zamanlamayı kullanarak parlak alanda amip kaydetmek, görüntüleme yazılımı kullanarak görüntüleri ikili hale getirmek ve ardından deneysel parametreleri ayarlamak için bir görüntüleme yazılımının izleme eklentisini kullanmak ve hız, mesafe ve hapsetme gibi gerekli ölçümleri belirlemek için her amip'i takip etmektir. Bunu takiben, yönlülüğü tanımlamak için bir amip veya bir amip popülasyonunun kemotaksisini ölçmek mümkündür. Bu yöntemin temel katkısı, farklı beslenme desteği, yüzey yapışması, dezenfeksiyon zorluğu veya memeli hücre kültürü ile birlikte yaşama gibi diğer çevresel değişiklikler sırasında amip davranışını görselleştirmek ve ölçmektir.
Protokol
1. Acanthamoeba hazırlığı
NOT: Bu protokol ATCC 50655, 30872, 50702, 30010, 30461, 50370, 50703, 30137, PRA-115 ve PRA-411 için doğrulanmıştır. Bu bir BSL2 patojenidir ve bir BSL2 başlığı ve laboratuvarında çalışılmalıdır.
- Bir T75 şişesini30 mL AC6 ortamı ile doldurarak bir numune şişesinden veya hazırlanmış fiş 20'den bir ana kültür oluşturun ve aseptik olarak buna bir tapa veya bir numune şişesinin içeriğini ekleyin. Şişeyi 3-5 gün boyunca 26-30 °C'de, şişe %50 ila %80 birleşene kadar inkübe edin.
- Homojen bir trofozoit popülasyonu oluşturmak için hücreleri ihtiyaç duyulmadan bir gün önce geçirin.
- Suşun ihtiyaçlarına göre, yapışan trofozoitleri çıkarmak için ana kültürü 2x sallayın ve / veya hızlı bir şekilde vurun.
- Bir T75 şişesini 30 mL AC6 ortamı ile doldurun. Pasaja 2 mL ana kültür ekleyin. Şişeyi 26-30 °C'de 18-24 saat inkübe edin.
- Hasattan önce, trofozoit popülasyonunu mikroskopta 4x büyütme altında görsel olarak inceleyin. Trofozoitlerin yapışık ve homojen olduğundan emin olun.
- Yapışmış trofozoitleri çıkarmak için şişeye 2x hızlı bir şekilde vurun. İçeriği 50 mL'lik konik bir tüpe dökün.
- Amipleri peletlemek için tüpü dengeli bir santrifüjde 5 dakika boyunca 500 x g'da döndürün. Süpernatan ortamı dökün veya pipetleyin ve atın. Peleti 2-10 mL 1/4 Ringer solüsyonunda seyreltin.
- Numuneyi girdaplayın. Tek kullanımlık bir hemositometreye 10 μL numune ekleyin ve Acanthamoeba'nın CFU / mL'sini sayın.
- Hemositometre sayısına bağlı olarak, amip peletini 1/4 Ringer solüsyonunda 7.5 x 103 hücre / mL konsantrasyona seyreltin.
- Cam, plastik veya besleyici olmayan agar olabilen bir yüzey üzerinde tohum amipleri ve aşağıda açıklandığı gibi deneysel ihtiyaçlara bağlı olarak çeşitli kuyu şekilleri.
- 96 oyuklu plaka: Her bir kuyucuğu 200 μL Acanthamoeba süspansiyonu ile tohumlayın ve plakayı kapakla kapatın.
- 48 oyuklu plaka: Her bir kuyucuğa 1 mL Acanthamoeba süspansiyonu serpin ve plakayı kapakla kapatın.
- Akış hücresi: Haznedeki kabarcıkları önleyerek, steril bir alüminyum akış hücresinin steril portlarından yavaşça 4 mL Acanthamoeba süspansiyonu ekleyin. Süspansiyon eklendikten sonra bağlantı noktalarını kapatın.
- Görüntülemeden önce, mikroskobik kayda başlamadan önce amipin yüzeye yapışması için en az 30 dakika bekleyin.
2. Acanthamoeba'nın görselleştirilmesi ve kaydedilmesi
- Amipleri parlak alanda 4x büyütmede görselleştirin. Arka plan açık gri görünmeli ve amip siyah olmalıdır. Işığı ayarlayın ve odaklayın, böylece amip yarı saydam yerine katı koyu halkalar olacak şekilde ayarlayın (bu nedenle, biraz odak dışı, Şekil 1.).
NOT: Birkaç nedenden dolayı izleme için en uygun büyütme 4x'tir: İzleme sırasında görüş alanından çıkan veya görüş alanına giren amipler veri analizine dahil edilmemelidir, bu nedenle daha düşük büyütme, bir zaman diliminde analize dahil edilen maksimum amip sayısını en iyi şekilde destekler. Amip, izleme analizi için onları ikiliye dönüştürmek için parlak alanda düz siyah daireler olarak görünmelidir. Bu, daha düşük bir büyütmede elde edilmesi en kolay yoldur, çünkü daha yüksek büyütmeler amipin yarı saydam doğasını ve iç yapılarını kolayca ortaya çıkarır. Genel olarak, daha düşük bir büyütme oranıyla tek bir görüş alanında daha fazla amip yakalanabilir ve bu da daha sağlam veri analizini destekler. - Amipi izlemek için görüntüleme yazılımındaki kayıt programlarını düzenli aralıklarla bir görüntü kaydedecek şekilde ayarlayın. Doğru izlemeye izin verecek görüntüler arasındaki en uzun süre 30 saniyedir, dosya boyutu ve izleme ayrıntısı için en uygun süre 12 sn veya 24 sn olarak önerilir.
- Amipler aynı anda birden fazla gün boyunca izlenebilir, ancak bu tür bir kaydın oluşturacağı dosya boyutunun ve son derece büyük dosyaları manipüle etmenin doğasında var olan zorluğun farkında olun. Bunu önlemek için, amipleri belirli aralıklarla zaman dilimleri için kaydedin. Örneğin, 5 gün boyunca her 12 saatte bir 1 saat kaydedin.
- Mikroskop ve program izin veriyorsa, plaka kuyularının XY koordinatlarını veya bir akış hücresinin birden çok konumunu kullanarak tek bir oturumda birden fazla kuyu kaydedin. Gerekirse, 4x büyütmede daha geniş bir görüş alanı oluşturmak için bir kuyunun veya akış hücresinin birden çok bölümünü birleştirin.
NOT: Kaç konumun kaydedilebileceğine ilişkin tek kısıtlama, mikroskop aşamasının görüntü aralığı süresi içinde konumlar arasında ne kadar hızlı hareket edebileceğidir (örneğin, her 12 saniyede, 24 saniyede bir görüntü çekmek, vb.). Ancak, bu gerekli değildir ve tek bir konumdan yapılan izleme videoları, sağlam istatistiksel analiz için yine de yeterli sayıda parçaya sahip olabilir. Bu çalışmada bir Nikon Eclipse Ti-U Mikroskobu kullanıldı ve aynı anda birden fazla kuyucukta görüntü kaydetmek için otomatik hareketli aşama kullanıldı. Bununla birlikte, programlanabilir kayıt özelliğine sahip herhangi bir mikroskop çalışacaktır. Mikroskop bir bilgisayara bağlanmalı ve görüntüleri bir programa veya sabit sürücüye kaydedebilmelidir.
3. Amip boyutu analizi
- Mikroskop dosyasını görüntüleme yazılımında açın. Biyo-formatları içe aktarma seçenekleri açılacaktır. İletişim kutusunda, aşağıdakilerin doğru olduğundan emin olun: Yığın görüntüleme; Şununla görüntüle: Seçim-Hiperyığın; Bellek Yönetimi: Sanal yığını kullan'ı işaretleyin; Renk modu: Varsayılan.
- Diğer açılır menülerin veya onay kutularının hiçbirinin etkinleştirilmediğinden emin olun. Tamam'a tıklayın.
- Biyo-format serisi seçeneklerini açın. Hangi Serinin gerekli olduğunu seçin. Bir seferde yalnızca bir konum kaydedilirse, burada muhtemelen yalnızca bir seçenek olacaktır. Tamam'a tıklayın.
- Yalnızca bir C kanalı > yalnızca bir Z kanalı seçerek aynı anda çalışılan tek kuyuyu çoğaltmak için Görüntü ve Çoğalt'ı seçin.
- Bundan sonra, orijinal görüntü ile değil, manipülasyon ve analiz için yalnızca çoğaltılan görüntü ile çalışın. Görüntü > Türünü Seçin > 8 bit. İşlem'i seçin > Arka planı çıkarın.
- Yuvarlanan topu 10.0'a ayarlayın. Açık Arka Plan'ı kontrol edin. Kayan paraboloidi kontrol edin.
- Kontrastı Geliştirmek > İşlem'i seçin. Doymuş pikselleri trofozoitler için %0,1 veya bir hücre ve agrega grubu için %0,3 olarak ayarlayın.
- Görüntü > > Eşiğini Ayarla'yı seçin (varsayılan > S&B). Make Binary işlemi açılacaktır. Varsayılan'ı seçin ve Siyah arka plan (İkili Maskeler) seçeneğini işaretleyin.
- Eşiği agresif bir şekilde seçin, böylece çoğu arka plan noktası görünmez, ancak her amipin bir kısmı görünür olur.
- Görüntüleme yazılımı görüntüyü ters çevirdiyse ve arka plan beyazsa ve amip siyahsa, siyah bir arka plan > beyaz amip olarak düzeltmek için Düzenle ve Ters Çevir'e gidin.
- İşlem> İkili > Kapat'ı seçin, hücrelerin odak dışı olması veya hücrenin hareketliliği nedeniyle dış zarda hafif bir boşluk olması durumunda.
- Boşlukları doldurmak > ikili > işlemi seçin. Şekil çizme araçlarını ve Düzenle > Dolgu'yu kullanarak amip olmayan yapıları kaldırın. Bu noktada arka plan beyazsa ve amip siyahsa, Düzenle > Ters Çevir'i seçin. Bu noktada, görüntü Şekil 2'deki ikili resimleri temsil etmelidir.
- Her amipin boyutunu kaydetmek için Analiz Et > Parçacıkları Analiz Et'i seçin. Set boyutu: 10-sonsuz, dairesellik: 0-1, Göster: Hiçbir şey. Yalnızca sonuçları görüntüle'yi işaretleyin ve özetleyin.
- Görüntülenen CSV dosyalarını kaydedin. Dosya > Farklı Kaydet > Tiff'i seçin ve adı istediğiniz belirtime göre düzenleyin.
4. Takip için mikroskop dosyalarının hazırlanması (motilite analizi)
- Mikroskop dosyasını görüntüleme yazılımında açın. Biyo-Formatları İçe Aktarma Seçenekleri açılacaktır.
- İletişim kutusunda, aşağıdakilerin doğru olduğundan emin olun: Yığın görüntüleme; Şununla görüntüle: Seçim-Hiperyığın. Bellek yönetimi için Use Virtual Stack'i (Sanal Yığın Kullan) kontrol edin. Tamam'a tıklayın.
- Biyo-Formatlar Seri Seçenekleri açılacaktır. Hangi Serinin gerekli olduğunu seçin. Bir seferde yalnızca bir konum kaydedilirse, burada muhtemelen yalnızca bir seçenek olacaktır. Tamam'a tıklayın.
- Görüntü > Çoğalt'ı seçin. Bundan sonra, orijinal dosya üzerinde çalışmak yerine yalnızca videonun yinelenen bölümü üzerinde çalışın.
NOT: Videonun o sırada izlenen bölümünü çoğaltın. Bunu yapmak için, deney için gereken dakikalara karşılık gelen kareleri bilmek gerekir. Örneğin, 1. saati takip etmek ve her 24 saniyede bir görüntü çekmek isteniyorsa, 1. saatte 150 kare olmalıdır. Bu nedenle, 1. saat 1-150 arası çerçeveler, 2. saat 151-300 vb. olacaktır. - Görüntü > Türü > 8 bit'i seçin. İşlem'i seçin > Arka planı çıkarın. Yuvarlanan topu 10.0 olarak ayarlayın.
- Açık Arka Plan'ı kontrol edin. Kayan paraboloidi kontrol edin. İşlem > Kontrastı Geliştir'i seçin ve %0,1 olarak ayarlayın.
- Tüm x# Dilimleri'ni işaretleyin (örneğin, 150 dilimin tümü). Normalleştir seçeneğinin işaretini kaldırın. Görüntü > > Eşiğini Ayarla'yı seçin (varsayılan > S&B).
- Make Binary işlemi açılacaktır. Varsayılan'ı seçin. Siyah arka planı (ikili maskelerin) kontrol edin.
- Eşik agresif bir şekilde, bu nedenle çoğu arka plan noktası görünmez, ancak amipin bazı kısımları görülebilir. Bu adımda, arka plan beyazsa ve amip siyahsa, Düzenle > Ters Çevir'i seçin. Arka plan siyah olmalı ve amip beyaz olmalıdır.
- İşlemi > İkili > Kapat'ı seçin. Boşlukları doldurmak > ikili > işlemi seçin. Dosya > Farklı Kaydet'i > Tiff'i seçin ve adı istediğiniz belirtime göre düzenleyin. Dosya artık izlenmeye hazırdır.
5. İzleme yoluyla hareketliliği analiz etme
- İzlemeyi açmak için gereken tiff dosyasına sahip görüntüleme yazılımından Eklentiler > İzleme > Trackmate'e gidin. Trackmate sürümü açılacaktır.
- İleri'yi seçin. Dedektör açılır menüsünden LoG dedektörünü seçin. Tahmini blob çapını ayarlayın: 35,0 mikron, eşik 1,0. Medyan filtreyi kullan ve Alt piksel yerelleştirmesi yap seçeneklerinin işaretini kaldırın.
- İlk, orta ve son dilimlerde Önizleme'yi tıklatın. Tüm amiplerin mor bir daire tarafından yakalandığından ve arka plan kusurlarının veya artefaktlarının dahil edilmediğinden emin olun.
- İleri'yi seçin. İşlemeye başlar ve bu adımın tamamlanması birkaç dakika sürebilir. Ekranın üst kısmındaki bir algılama çubuğu, işlemin ne kadarının tamamlandığını gösterecektir.
- İstendiğinde İleri'yi seçin. İlk eşiklemede, hiçbir şey seçmeden tekrar İleri'yi seçin. Bir görünüm seçerken Hyperstack Displayer'ı seçin. İleri'yi seçin.
- Noktalarda filtreyi ayarlayın ve hiçbir şey seçmeden İleri'yi seçin. Bir izleyici seçin; bunu yapmak için LAP Tracker'ı seçin (Simple LAP Tracker yerine). İleri'yi seçin.
- Kareden kareye bağlantıda maksimum mesafeyi 40 μm olarak ayarlayın. Parça segmentinde boşluk kapatmayı kontrol edin: Boşluk Kapanmasına İzin Ver. Bunun için maksimum mesafeyi 100 μm ve maksimum kare aralığını 4 olarak ayarlayın. Segment bölmeyi takip et veya Segmenti birleştirmeyi takip et için hiçbir şey seçmeyin.
- İleri'yi seçin. İzlemenin yürütülmesi önemli ölçüde zaman alabilir. Tamamlandığında, pencerede şöyle yazmalıdır: İzleme alt kısımda x s ile yapıldı. İleri'yi seçin.
- İzleme tamamlandığında tekrar İleri'yi seçin. İzlerde filtreleri ayarlama: İzlerdeki nokta sayısı için bir filtre eklemek üzere sol alttaki + işaretini seçin. Karelerin en az %93'ü için filtreyi Üst olarak ayarlayın (örneğin, 150 kare için en az 140 nokta gerekir).
NOT: Bu yazılımın bazı sürümleri, istenen sayıya ulaşmak için bir satırı sola veya sağa sürükleyerek yapılabilen en az %7'nin altında gibi zıt eşdeğerin seçilmesini gerektirir. - İleri'yi seçin. Görüntüleme Seçenekleri görünecektir. Trackmate XML dosyasını veya Tracks CSV dosyasını kaydetmeden önce her karedeki izlerin amipin hareket etme biçiminde deforme olmadığından veya garip olmadığından emin olun.
- Bir parçanın silinmesi gerekiyorsa, TrackScheme'e tıklayın. TrackScheme, tüm çerçevelerde amip için tüm izleri ve temas noktalarını gösterecektir.
NOT: Bir parçayı silmenin olası nedenleri, bir amipin kayıt sırasında görüş alanına girmiş / çıkmış olması, bir parçanın amipin gerçek yoluna kıyasla uygun olmayan bir şekle sahip olması veya herhangi bir nedenle iz veya amipin deneysel parametrelere göre verilerde aykırı bir değer olması vb. - Ekranda yeşil noktayı vurgulamak için amiplere tıklayın ve Trackscheme'de noktanın etrafında yeşil bir kare olacaktır. Bu, hangi parçanın veya noktanın kaldırılması gerektiğini gösterecektir.
- Kaldırılması gereken parçaya sağ tıklayın ve Tüm Parça'yı seçin. Sil düğmesine basın.
- Tüm parçaları inceledikten sonra, izleme yazılımı açılır penceresinin sol alt kısmındaki Kaydet'e tıklayarak izleme dosyasını kaydedin. Video adını kullanarak XML dosyasını kaydedin. İzleme yazılımı açılır penceresine geri dönmek için Sürdür'ü tıklayın.
- Parçalar'a tıklayın ve soldaki Parçalar'ı seçin. CSV'ye Aktar'a tıklayın ve CSV dosyasını kaydedin.
- Elektronik tablo elde edilen CSV'yi tanımazsa, aşağıdaki adımları uygulayın.
- Kaydedilen CSV dosyasını Not Defteri'nde açın. Tüm içeriği kopyalamak için Control + A ve Control + C tuşlarına tıklayın.
- E-tabloyu açın ve e-tabloya yapıştırmak için Control + V'yi tıklayın. Tüm veriler tek bir hücrede olacaktır.
- Veri içeren hücreler seçili durumdayken, Veri > Metinden Sütunlara'ya gidin. Sınırlandırılmış > İleri'yi seçin. Sonraki > Son'> Virgül'ü seçin. Bu dosyayı yeni CSV dosyası olarak kaydedin.
- İzleme CSV'si, analiz için kullanılabilecek birçok parametreye sahip olacaktır (Şekil 3). Analiz etmek için istenen parametreleri kopyalayıp yeni bir CSV dosyasına (Şekil 4) yapıştırın. Burada kullanılan parametre aşağıda açıklanmıştır.
- Kat edilen toplam mesafe: μm cinsinden bir amip tarafından kat edilen toplam mesafe.
- Kat edilen maksimum mesafe: bir amipin başlangıç noktasından itibaren yolundaki maksimum mesafe - bu mutlaka bitiş noktası olmayabilir
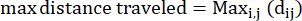
Burada dij, herhangi bir I noktasına olan mesafedir ve pistteki herhangi bir j noktasına olan mesafedir. - Hapsetme oranı: Hapsetme oranı, bir amipin başlangıç noktasından uzaklaşmada ne kadar etkili olduğunu gösterir: başlangıç noktasından (1'e yakın bir değer) düz bir çizgide mi hareket etti yoksa başlangıç noktasına nispeten yakın mı kaldı (0'a yakın bir değer).
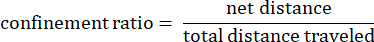
- Ortalama hızı takip edin: Saniyede mikron cinsinden kat edilen toplam mesafe boyunca amipin ortalama hızı.
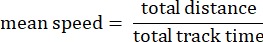
- İz yer değiştirmesi: Bir amipin başlangıç noktası ile bitiş noktası arasındaki mikron cinsinden mesafe.
NOT: Tüm görüntüleme yazılımı analiz parametreleri ve tanımları burada bulunabilir: https://imagej.net/plugins/trackmate/analyzers/. Kaydedilen her dosyanın, o sırada analiz edilen parçaların bir özeti olduğunu unutmayın. Sağlam bir veri analizi üretmek için, verilere uygun olduğu şekilde birden çok tekrar, saat vb. elde edilen sonuçların uygun şekilde birleştirilmesi gerekecektir (Şekil 5 ve Şekil 6).
Sonuçlar
Bu yöntemi kullanarak başarıya ulaşmak için, dikkate alınması gereken birkaç önemli genel parça vardır. Birincisi amipin ve mikroskobun fiziksel kurulumu, ikincisi görüntüleme yazılımının uygun şekilde kullanılması ve üçüncüsü görüntüleme verilerinin anlamlı bir şekilde dışa aktarılması ve analiz edilmesidir.
Mikroskobik kayıt başlamadan önce, amipin mikroskop aşamasına düzgün bir şekilde odaklandığından emin olmak çok önemlidir (Şekil 1). Bireysel ayrıntılar için en uygun Z düzleminde amiplere odaklanmak yerine, burada onları çok az odak dışında görüntülemek idealdir, böylece ayrıntılı olarak bakıldığında yarı saydam durumlarının aksine düz siyah noktalar haline gelirler. Bunları bu şekilde görüntülemek, görüntüleme yazılımının ve izleme yazılımının, dosya ikiliye dönüştürüldüğünde her bir amip'i çok daha kolay bulmasını sağlayacaktır (Şekil 2). Görüntüleme yazılımında amacın ne olduğunu bilmek, yani her amipin iyi tanımlanmış beyaz bir daire olarak görünmesi, okuyucunun orijinal görüntüleri parlak alanda çekerken doğru odağı bulmasına yardımcı olabilir. Daha sonra, her daire açıkça tanımlandığında, izleme yazılımı her bir amip için bireysel hareketlilik ölçümlerini düzgün bir şekilde izleyebilecek ve toplayabilecektir.
Görüntüleme yazılımı ve izleme yazılımı için yukarıda listelenen protokolde yer alan adım adım yönergeleri izledikten ve görüntüleme yazılımı kullanımının önemli ilk adımlarına yardımcı olması için ilgili videoya başvurduktan sonra, görüntüleme yazılımı verilerini niceleme ve veri analizi için dışa aktarmanın zamanı gelmiştir. İzleme yazılımından elde edilen ham çıktı, Şekil 3'te görülene benzer olacaktır. Burada, dışa aktarılan parçalardaki spot sayısının beklenenle doğru olup olmadığını kontrol etmek önemlidir (örneğin, her parçada karelerin %93'ünün bulunması istendiyse ve videoda toplam 100 kare varsa, dışa aktarılan her parçanın 93 noktadan büyük veya buna eşit olması gerekir). Noktalar gereksinimlere uymuyorsa, gerekli parametrelerin doğru şekilde ayarlandığından emin olmak için izleme yazılımı adımlarına geri dönülmesi gerekebilir.
Ham dışa aktarmadan veri analizi sayfasını oluşturmaya başlayın (Şekil 4). Her parçanın tekil bir kopya içinde tekil bir amipleri temsil ettiğini hatırlamak önemlidir. Bu nedenle, Şekil 4, Şekil 5 ve Şekil 6'da görüldüğü gibi, bir çerçeve seti veya zaman noktası için tüm izlerin ortalaması alınmalıdır (Şekil 4) ve bu işlem tüm bir serideki her kare seti veya zaman noktası için yapılmalıdır (yani, toplam 3 saatlik bir video alınırsa ve veri noktaları saate bölünürse, daha sonra çoğaltma başına analiz etmek için üç kare seti/saat olacaktır, Şekil 5). Son olarak, her bir kopyada ayarlanan her bir karedeki ortalamaların bu kombinasyonundan, birden çok kopyadaki verilerin zaman noktası başına gerçek ortalamayı ve standart sapmayı belirlemek için analiz edilebilmesi için ortalama verilerin her bir çoğaltmadan tek bir alanda birleştirilmesi gerekir (Şekil 6).
Her bir kopyadan elde edilen ortalamalar veri analizi için kullanılacak ve tüm kopyalardan elde edilen birleşik ortalama ve standart sapma veya standart hata, grafiksel gösterim için kullanılacaktır ( Şekil 7'deki bir örnekte görüldüğü gibi). Burada yaptığımız gibi verileri analiz ediyorsak, yani birden fazla zaman noktasında birden fazla örnek izleniyorsa, bunları post hoc Tukey testi ile 2 yönlü tekrarlı ölçüm ANOVA kullanarak analiz etmek en uygunudur. Bu, her zaman noktasında numuneler arasındaki farkları belirlememize ve ayrıca zaman içinde her bir numune içindeki farkları belirlememize olanak tanır.

Resim 1: Amip, parlak alan mikroskobunda opak karanlık formlar olarak görülür. 4x büyütmede amipin temsili görüntüsü yakınlaştırıldı, düz koyu halkalar olarak görünmek için biraz odak dışında. Ölçek çubuğu = 500 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
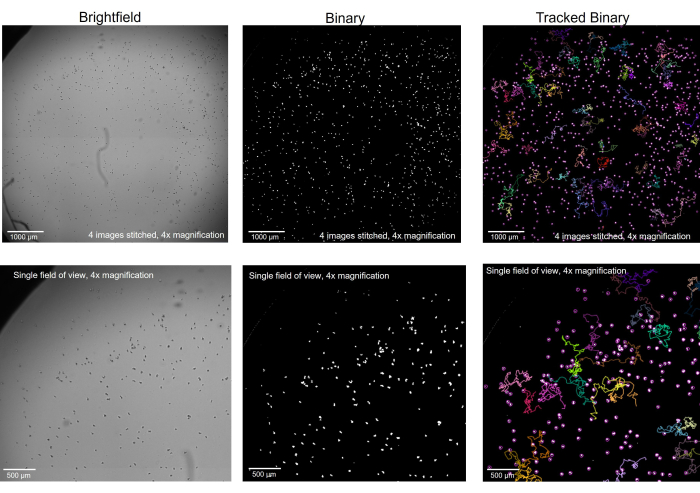
Resim 2: Brightfield mikroskobu ile görüntülenen amip, ikiliye dönüştürüldü ve izlendi. 4x büyütme oranındaki amip, parlak alanda (solda), artefaktlar kaldırılarak (ortada) ve izlendikten sonra seçilen parçalar gösterilerek (sağda) ikiliye dönüştürüldü. Üst sıra: 4 görüntünün bir araya getirilmesiyle iyi görüntülenen bir bütün, ölçek çubuğu = 1000 μm. Alt sıra: dikişten önceki tek bir görüntünün boyutu, ölçek çubuğu = 500 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
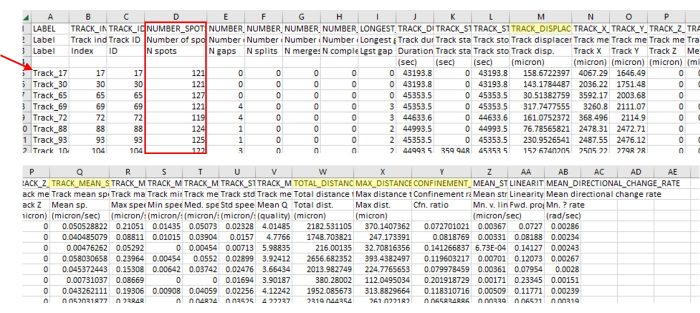
Şekil 3: Görüntüleme ve izleme yazılımından elde edilen anlık veri analizi çıktısı, çok çeşitli veri türlerini içerir. İzlemeden elde edilen temsili çıktı, tekil bir video olan Şekil 2'de gösterilmektedir. İzleme yazılımının parametrelerle hizalanmayan parçaları doğru şekilde kaldırdığını gösteren parça numaralarının (kırmızı ok) atlama numaralarına dikkat edin. Bu örnekte, 5385 parçadan yalnızca 71'i parametrelerle hizalanmış parçaları tanımlamıştır. Bu kadar katı kurallar göz önüne alındığında bu oran normaldir. Bu iz sayısı aynı zamanda bu protokolde kullanılan amip sayısı ile de uyumludur (örneğin, 96 oyuklu bir plaka, oyuk başına 200 μL 7.5 x 103 CFU/mL ile tohumlanırsa, o zaman kuyuda yaklaşık 1.500 amip beklenmelidir ve kabaca 4 dikişli bir görüş alanında bu kadar çok şey görülebilir. Amip görüş alanına girip çıkarken ve yeni izler oluştururken, muhtemelen amip olduğundan çok daha fazla iz olacaktır). Bu parça numarası, çok sayıda noktaya kıyasla yalnızca birkaç parçanın görülebildiği Şekil 2'de tekrar belirgindir. Yalnızca doğru parça uzunluklarının dahil edildiğinden emin olmak için her zaman parçadaki nokta sayısını (kırmızı kutu) kontrol edin. Örneğin, burada çerçevelerin %93'ünden fazlasını dahil ediyoruz ve bu bölümde 127 kare vardı, bu nedenle tüm nokta sayıları 118'in üzerinde olmalıdır. Sarı renkle vurgulanan, protokolde belirtilen ölçümlerdir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
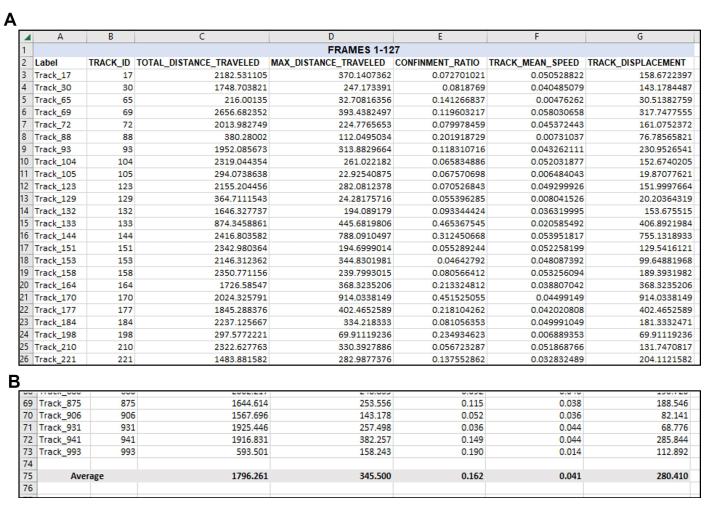
Şekil 4: Veriler, ilk veri çıktısını takiben gerektiği gibi yeniden düzenlendi. Dışa aktarma işleminden sonra istenen verilerin organizasyonu. (A) Nicelik belirlemek için seçilen ilgili ölçümler, izleme yazılımı dışa aktarımından (Şekil 3) kopyalandı ve yeni bir elektronik tabloya yapıştırıldı. (B) İstenen ölçümler yeni elektronik tabloda düzenlendikten sonra, her parçanın ortalaması hesaplanmalıdır. Bu nedenle, bu temsili örnekte, bu tekil videodaki her kullanılabilir parçanın Toplam Mesafesi, Maksimum Mesafesi, Hapsi, Ortalama Hızı ve Yer Değiştirmesi, her ölçüm için tekil bir sayıya ortalaması alınmıştır. Burada, toplam 71 parçanın Çerçeve 1-127 için parametreleri karşıladığını tekrar not edin. Şekil 5'te görüldüğü gibi, analiz edilen her video veya kare setinden muhtemelen farklı sayıda uygun parça olacaktır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
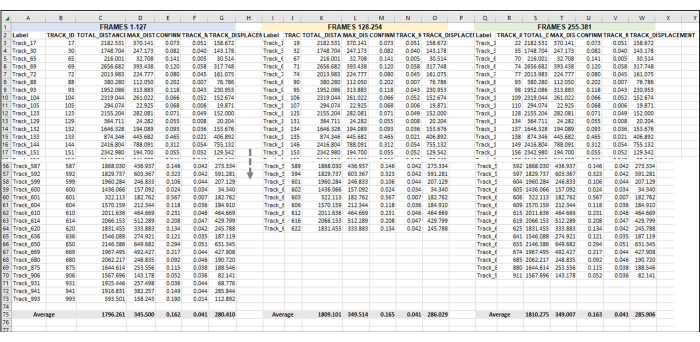
Şekil 5: Tüm bir görüntü serisinin veya videonun analizi için ayarlanan sıralı çerçeveler. Bu, veri analizine sıralı videoların eklenmesinin temsili bir görüntüsüdür. 1-127 arasındaki karelerin videonun 1. saatini oluşturduğunu varsayarsak (burada 1 saat, her 28 saniyede bir görüntü çekmekten oluşur). 128-254 arasındaki kareler videonun 2. saati, 255-381 arası kareler ise videonun 3. saati olacaktır. Dışa aktarılan verileri ( Şekil 3'te dışa aktarıldığı gibi) tüm saatlerden tek bir sayfada birleştirin ve hepsiyle aynı anda çalışın. Şekil 4'te yapıldığı gibi, her kare seti/h için tüm kullanılabilir parçalardan gelen verilerin ortalaması alınacaktır. Şekil 5'teki her şey bir kopyadan veya bir örnekten elde edilen verilerdir. 3 kopya varsa, aynı şekilde düzenlenmiş 3 ayrı elektronik tablo sekmesi olacak ve bunlardan elde edilen veriler, Şekil 6'da gösterildiği gibi yeni bir sekmeye beslenecektir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
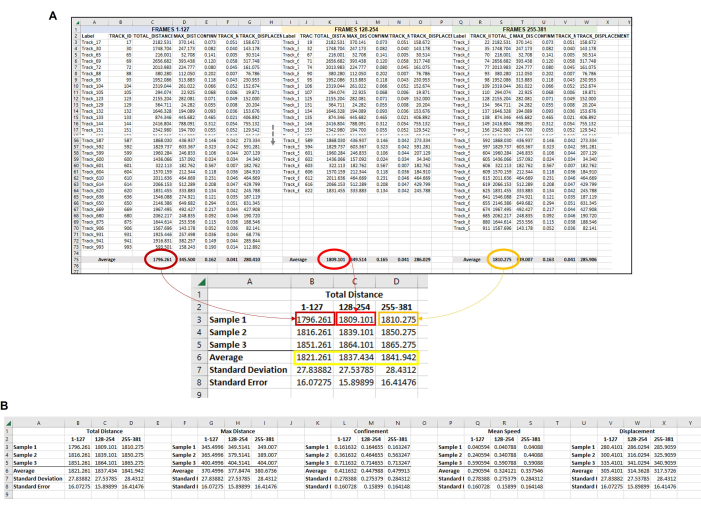
Şekil 6: Tek bir kopyayı temsil etmek için kullanılan her çerçeve kümesindeki tüm amiplerden elde edilen bileşik veriler. (A) Şekil 5'te ayarlanan her bir çerçeveden elde edilen tüm ortalamaların, nihai veri analizinin tamamlanabilmesi için merkezi bir konumda toplanması gerekir. Bu temsili görüntüde, ilk üç kare kümesinden (veya saatten) elde edilen Toplam Mesafe ortalamaları gösterilmektedir. Bu, çalıştırılan her örnek/koşul/çoğaltma için tekrarlanmalıdır. Ardından, her çerçeve setinden her bir numuneden elde edilen ortalamaların ortalaması alınmalıdır (sarı kutu). Bu, standart sapma ve standart hatanın hesaplanabileceği son veri noktasıdır. Her Örnekten alınan bireysel ortalamalar (burada, Toplam Mesafe Örneği 1 için B3, B4 ve B5'teki sayılar; Toplam Mesafe Örneği 2 için C3, C4 ve C5, vb.) istatistiksel analizi çalıştırmak için kullanılacaktır. Bu işlem, gerekli tüm ölçümler için tekrarlanacaktır (Maksimum Mesafe, Hapsetme, Ortalama Hız, Yer Değiştirme, vb.) (B) Nicelemenin grafiksel bir temsilini yapmak için, sarı kutudaki sayıları son grafik için kullanılacak veri noktaları olarak kullanın. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
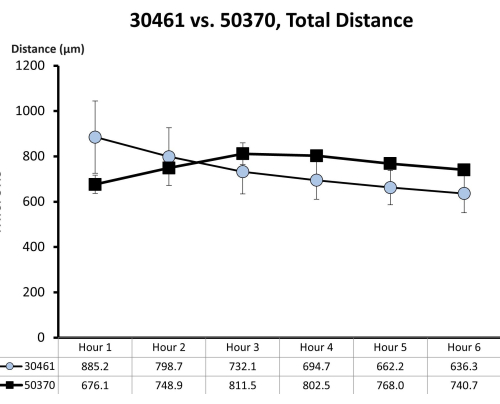
Şekil 7: ATCC 30461 ve ATCC 50370 için ham motilite verileri. Ham veriler (burada her saat için ortalama ± SE olarak temsil edilmektedir) daha önce toplanmış ve önceki çalışmalar için yayınlanmamıştır18,19. Bu motilite ölçümü, bu iki amipin ilk 6 saatlik motilitelerinde (o saatte kat edilen mikron cinsinden toplam mesafe ile ölçüldüğü gibi) bir cam yüzey üzerindeki 1/4 Ringer çözeltisinde benzer olduğunu göstermektedir. Her zaman noktası, her biri 20-200 amip izinden oluşan üç ayrı kopyayı temsil eder. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Düşük hızlı Brown hareketindenetkilenmeyen yapışık mikroskobik organizmalar olan Acanthamoeba gibi amiplerin hareketliliğini izleyebilmek ve ölçebilmek 9,10, amip davranışı hakkında önemli miktarda bilgi ortaya koymakta ve AK önleme yöntemlerine ilişkin aydınlanmayı büyük ölçüde artırabilir. Bu protokol son yayınlarda detaylandırılmıştır ve veriler diğer benzer veri analizleri ile doğrulanmıştır veya birleştirilmiştir18,19. Burada, bu yöntem kullanılarak detaylandırılan amipin hızının diğer gruplar tarafından yayınlananlara benzer olduğunu not ediyoruz. Bu protokol, temel olarak ışığa karşı şeffaf olan herhangi bir yüzey veya amip tedavisinde kullanılabilme kabiliyeti ile dikkat çekicidir, ancak bu protokolün potansiyel olarak diğer organizmalarla çalışacak şekilde değiştirilebilmesine rağmen, yalnızca şu ana kadar optimize edildiğini belirtmek önemlidir. Yukarıdaki protokol laboratuvarda sürekli olarak iyi çalışmıştır, ancak yöntemi diğer ihtiyaçlara uyacak şekilde değiştirmek veya zor durumları gidermek için aşağıdaki değişiklikler sağlanmıştır.
İzleme parametrelerinin belirlenmesi: Yukarıdaki protokolde, son yayınlar için en uygun olan kareden kareye bağlantı, boşluk kapatma, maksimum çerçeve boşluğu ve yoldaki nokta sayısı listelenmiştir. Bununla birlikte, diğer parametrelerin diğer ihtiyaçlar için daha uygun olması mümkündür. Ayrıca, başkalarının kullanmak isteyeceği ancak burada kullanılmayan parametreler olabilir (örneğin, pist filtreleri altındaki bir parkurun Maksimum Mesafesi). Her bir parametre ve ne tanımladıkları hakkında daha fazla bilgiye web sitesinde erişilebilir (bkz. referans21). Hangi parametrelerin ve filtrelerin diğer deneylerle en alakalı olduğuna ve bunların nasıl ayarlanması gerektiğine karar verirken, belirli bir proje için istatistiksel olarak neyin rasyonel olduğunu düşünün; Örneğin, bir amipten çıkan ve sonra görüş alanına geri dönen bir amipten veri ister mi? Ya da hiç hareket etmeyen ama yine de bir parça olarak etiketlenen bir amipin verilerini saklamak ister mi? ve görüntülerin kaydedildiği kare sayısı ve kareler arasındaki sürenin uzunluğu için neyin anlamlı olduğu.
Blob boyutunu değiştirme: Herhangi bir yazılım veya herhangi bir mikroskop kurulumuyla - standart laboratuvarlarda bulunan mevcut teknolojilere ve yazılımlara dayalı olarak - zaman içinde değiştikçe bir toplamdaki amip sayısını doğru bir şekilde izlemenin son derece zor olduğunu gördük. Bir blobun boyutunu izliyor ve bu boyutu içindeki organizma sayısıyla ilişkilendirmeye çalışıyorsanız, bir toplamın boyutunu matematiksel olarak tahmin etmek için tekrarlanan deneylerden sonra oluşturulan standart bir eğri kullanın. Örneğin, agregalar, kuyu başına 8, 16, 32, 125, 250, 500, 1.000 ve 2.000 hücre gibi çeşitli amip sayılarına sahip kuyuların tohumlanmasıyla oluşturuldu. 24 saat boyunca her kuyucuğun çeşitli zaman noktalarında hızlandırılmış görüntüler oluşturuldu. Her bir sferoid (bilinen bir amip sayısından olan) iki boyutlu bir alan için analiz edildi ve zaman içinde amip sayısına karşı sferoid boyutunun bir fonksiyonu olarak standart bir eğri oluşturuldu. Bu deney, üretilen herhangi bir eğrinin uygun bir standart sapmasını bize vermek için en az üç kopya halinde tekrarlandı.
Amipin yönlülüğünün belirlenmesi: Bu, belirli çalışmalar için gerekli olmasa da, amipin yönlülüğünü anlamak yardımcı olabilir. Bu, tedavinin veya deneyin kemotaktik etkileri hakkında veri sağlayacaktır. Bu veriler hem görsel (grafik) hem de nicel veriler oluşturmak için de kullanılabilir. Bu, görüntüleme yazılımı için ücretsiz bir eklenti olan Kemotaksis ve Geçiş Aracı aracılığıyla kullanılabilir. Başvuru kılavuzu ve örnek resimler ve filmler ile birlikte web sitesinde mevcuttur (bkz.
Ayrıntılı hareket dinamikleri: diğer gruplar, burada tartışılanların ötesinde son derece gelişmiş ve gelişmiş istatistiksel analizlerle yayılma dinamiklerini ve yayılma yörüngelerini incelemişlerdir 9,10,22. Bunlar, kullanıcının ihtiyaçlarına göre düşünülebilir.
Herhangi bir başarılı yöntemde olduğu gibi, bu el yazmasında ayrıntılı olarak açıklanan protokol, tutarlılık sağlamak için birçok sorun giderme turundan geçmiştir. Her saniye bir görüntü çekerek (veya mikroskobun yapabildiği kadar hızlı, bir saniyeden az olabilir) mükemmel yüksek kaliteli izlenebilir videolar oluşturulabilirken, bu, üzerinde çalışılması zor olabilen son derece büyük dosyalar oluşturur. Bu, yalnızca en fazla birkaç dakika boyunca kaydedilen çok kısa süreli videolar için gerçekçi bir şekilde uygundur. Tersine, birkaç saniyede bir görüntü çekerek, amip davranışının bu türün hızına bağlı olarak hala çok izlenebilir olduğunu ve saatler veya günler boyunca uygulanabilir videolar oluşturmanın mümkün olduğunu bulduk. Görüntüler arasındaki maksimum sürenin, amipin görüntüleme yazılımı tarafından doğru bir şekilde izlenmesi için gereken süre olan 30 s olduğunu bulduk. Kullanıcının seçtiği zaman aralığı, mikroskobun görüntüleri ne kadar hızlı kaydedebileceği, kuyu başına kaç görüntüye ihtiyaç duyulduğu ve her aralıkta kaç kuyu kaydedildiği gibi bilinen kısıtlamalar kullanılarak düşünülmelidir. Benzer şekilde, bu protokolde bahsedilen maksimum yer değiştirme, izin verilen çerçeve boşlukları, gereken minimum kareler vb. ile ilgili parametreler, en eksiksiz amip izlerini içeren iz bilgilerini oluşturmak ve tamamlanmamış izlerin yarattığı gürültüyü, videonun ortasında sahneye katılan veya sahneyi terk eden amipleri veya iki amipin parçanın ortasında buluşup sonra ayrılması gibi görüntüleme yazılımı karışıklığının yarattığı hataları göz ardı etmek için bu laboratuvar tarafından deneme yanılma yoluyla belirlenmiştir. Bu tür hatalar ve eksik parçalar, sürekli olarak birbirleriyle etkileşime giren mikroskobik biyolojik organizmaların son derece uzun (saatler ila günler) videolarını oluştururken anlaşılır bir şekilde yüksektir ve hatalı izlerin çok büyük bir bölümünün reddedilmesinin nedenidir. Protokoldeki doldurma delikleri adımının, bu laboratuvarın deneyimine göre, görüntüleme yazılımının amipleri nasıl izlediğine dair hatayı azaltmak için önemli olduğuna dikkat edilmelidir. Her amipin bazen bir çörek veya c şekli yerine katı bir daire olduğundan emin olarak, yazılımın her amip'i başarılı bir şekilde izleyebilme olasılığı çok daha yüksektir.
Ayrıca, tartışıldığı gibi, bir görüntüyü veya videoyu analiz etmek için bir kullanıcının kullanabileceği birçok parametre vardır. Deneysel ihtiyaçlara dayanarak, toplam mesafe, maksimum mesafe, hız ve yer değiştirmeyi analiz etmekten sürekli olarak en fazla faydayı sağladık. Bunlar, önceki yayınlardagrafiksel yorumlarla (farklı gerinimler ve yüzeyler kullanılması dahil) derinlemesine tartışılmaktadır 18,19. Bu dört parametre, bir kullanıcının bir amipin doğrusal mesafeler kat etme yeteneğini ve bunu yapmanın ne kadar sürdüğünü tahmin etmesine olanak tanır, bu da kontakt lens kontaminasyonu ile ilgili davranışlarını anlamaya yardımcı olur. Bu parametreleri almak ve analiz etmek, şekillerimizde ayrıntılı olarak açıklandığı gibi büyük bir iştir. Görüntüleme yazılımı çıktısından elde edilen büyük ve çok sayıda elektronik tabloyla çalışırken, gerekli tüm analizleri otomatik olarak hesaplayan kilitli elektronik tablo şablonları oluşturarak kasıtsız hataları sınırladık. Bununla birlikte, bu yöntemde olası bir iyileştirme, bu verileri işleyebilecek ve sıralayıp analiz edebilecek bir komut dosyası yazmak olacaktır.
Sonuç olarak, birçok farklı koşulda Acanthamoeba boyutunu ve motilitesini ölçmek için erişilebilir ve doğru bir yöntem burada açıklanmaktadır. Bu yöntemin birçok farklı amip suşuna uygulanabileceğini gösterdik ve motilite bilgisi elde etmek için basit parametreler olsa da, bu deney düzeneğinin herhangi bir özel ihtiyaca göre yüksek oranda uyarlanabileceğini belirttik.
Açıklamalar
Tüm yazarlar Alcon Research, LLC'nin çalışanlarıdır.
Teşekkürler
Bu çalışma Alcon Research, LLC tarafından finanse edilmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| ¼ Ringer’s solution | ThermoFisher Scientific | BR0052G | Oxoid Ringers Solution Tablets. Follow directions to make one-quarter strength instead of full strength Ringers. |
| 10 µL pipette | Eppendorf Research | 3123000039 | 2 µL-20 µL single channel |
| 10 µL pipette tips | Neptune Scientific, San Diego, CA, USA | BT10.N | 10 µL Universal Barrier Tip |
| 48 well plate | Millipore Sigma, | CLS3548 | Corning Costar TC-Treated Multiple Well Plate: polystyrene plate, flat bottom wells, sterile, with lid |
| 50 mL conical tubes (1 for each sample, 1 for each pass 2 sample) | Fisher Scientific | Falcon 352098 | Falcon 50 mL High Clarity Conical Centrifuge Tubes, polypropylene |
| 96-well plate | Millipore Sigma, Burlington, MA, USA | CLS3596 | Corning Costar TC-Treated Multiple Well Plate: polystyrene plate, flat bottom wells, sterile, with lid |
| Acanthamoeba | American Type Culture Collection, Manassas, VA, USA | ATCC 30461 | This protocol has been verified for ATCC 50655, 30872, 50702, 30010, 30461, 50370, 50703, 30137, PRA-115, and PRA-411 |
| Axenic culture media (AC6) | Made in house | n/a | Containing 20 g biosate peptone, 5 g glucose, 0.3 g KH2PO4, 10 µg vitamin B12, and 1 glass5 mg l-methionine per liter of distilled deionized water. Adjust pH to 6.6-6.95 with 1 M NaOH and autoclave at 121 °C for 20 min, store at room temperature for up to 3 months. |
| Centrifuge and appropriate rotor | Thermo Scientific, Waltham, MA, USA | Sorvall ST 40R | Any equivalent centrifuge and rotor are acceptable so long as it can spin 50 mL conical tubes at 500 x g for 5 min |
| Chemotaxis and Migration Tool | Free software based on ImageJ, available at https://ibidi.com/chemotaxis-analysis/171-chemotaxis-and-migration-tool.html | ||
| Disposable hemocytometer | Bulldog Bio, Portsmouth, NH, USA | DHC-N01 | Neubauer Improved 2-Chip Disposable Hemocytometer, Individually packaged, Nonpyrogenic |
| ImageJ software with Trackmate plugin (this protocol written with Trackmate version 6.0.2.) | Free software developed by the National Institutes of Health, available at imagej.net. Trackmate plugin available at https://imagej.net/plugins/trackmate/ | ||
| Microscope, preferably with automated moveable stage | Nikon, Tokyo, Japan | A Nikon Eclipse Ti-U Microscope was used in this study and the automated moveable stage was utilized to be able to record images in multiple wells at a time. | |
| NIS-Elements software | Nikon | ||
| Serological pipette | Fisher Scientific, Hampton, NH, USA | BrandTech 26331 | BrandTech accu-jet pro Pipet Controller |
| Serological pipette tips | VWR | 5 mL: 76201-710 10 mL: 170356 25 mL: 89130-900 50 mL: 75816-088 | VWR Serological Pipette, Non-Pyrogenic |
| Sterile aluminum transmission flow cell | Biosurface Technologies Corporation, Bozeman, MT, USA | FC 81-AL | Anodized aluminum single channel transmission flow cell with 96-well plate footprint for use with an inverted microscope |
| T75 Flasks | VWR, Radnor, PA, USA | 734-2316 | VWR Tissue Culture Flask, 182.5 cm, Surface treated, Plug seal cap, Sterile |
Referanslar
- Randag, A. C., et al. The rising incidence of Acanthamoeba keratitis: A 7-year nationwide survey and clinical assessment of risk factors and functional outcomes. PLoS One. 14 (9), e0222092 (2019).
- Szentmary, N., et al. Acanthamoeba keratitis - Clinical signs, differential diagnosis and treatment. J Curr Ophthalmol. 31 (1), 16-23 (2019).
- Carnt, N., et al. Acanthamoeba keratitis: confirmation of the UK outbreak and a prospective case-control study identifying contributing risk factors. Br J Ophthalmol. 102 (12), 1621-1628 (2018).
- Verani, J. R., et al. National outbreak of Acanthamoeba keratitis associated with use of a contact lens solution, United States. Emerg Infect Dis. 15 (8), 1236-1242 (2009).
- Tu, E. Y., Joslin, C. E. Recent outbreaks of atypical contact lens-related keratitis: what have we learned. Am J Ophthalmol. 150 (5), 602-608 (2010).
- International Organization for Standardization. ISO 14729:2001/A1. Ophthalmic optics-Contact lens care products-Microbiological requirements and test methods for products and regimens for hygienic management of contact lenses. International Organization for Standardization. , (2010).
- . ASC Z80, Parent Committee Meeting Available from: https://www.thevisioncouncil.org/sites/default/files/ASCZ80_ParentCommitteeMinutes_February_27_2018_FINALMar19-2018.pdf (2023)
- Rayamajhee, B., et al. Acanthamoeba, an environmental phagocyte enhancing survival and transmission of human pathogens. Trends Parasitol. 38 (11), 975-990 (2022).
- Reverey, J. F., et al. Superdiffusion dominates intracellular particle motion in the supercrowded cytoplasm of pathogenic Acanthamoeba castellanii. Sci Rep. 5, 11690 (2015).
- Thapa, S., Lukat, N., Selhuber-Unkel, C., Cherstvy, A. G., Metzler, R. Transient superdiffusion of polydisperse vacuoles in highly motile amoeboid cells. J Chem Phys. 150 (14), 144901 (2019).
- Rudell, J. C., et al. Acanthamoeba migration in an electric field. Invest Ophthalmol Vis Sci. 54 (6), 4225-4233 (2013).
- Fukaya, S., Aoki, K., Kobayashi, M., Takemura, M. Kinetic analysis of the motility of giant virus-infected amoebae using phase-contrast microscopic images. Front Microbiol. 10, 3014 (2019).
- Fukaya, S., Takemura, M. Kinetic analysis of Acanthamoeba castellanii infected with giant viruses quantitatively revealed process of morphological and behavioral changes in host cells. Microbiol Spectr. 9 (1), 0036821 (2021).
- Cheng, H. J., Hsu, C. H., Hung, C. L., Lin, C. Y. A review for cell and particle tracking on microscopy images using algorithms and deep learning technologies. Biomed J. 45 (3), 465-471 (2022).
- Mathieu, E., et al. Time-lapse lens-free imaging of cell migration in diverse physical microenvironments. Lab Chip. 16 (17), 3304-3316 (2016).
- Svensson, C. M., Medyukhina, A., Belyaev, I., Al-Zaben, N., Figge, M. T. Untangling cell tracks: Quantifying cell migration by time lapse image data analysis. Cytometry A. 93 (3), 357-370 (2018).
- Piltti, K. M., et al. Live-cell time-lapse imaging and single-cell tracking of in vitro cultured neural stem cells - Tools for analyzing dynamics of cell cycle, migration, and lineage selection. Methods. 133, 81-90 (2018).
- Campolo, A., et al. Continuous real-time motility analysis of Acanthamoeba reveals sustained movement in absence of nutrients. Pathogens. 10 (8), 995 (2021).
- Campolo, A., Patterson, B., Lara, E., Shannon, P., Crary, M. Complete recovery of Acanthamoeba motility among surviving organisms after contact lens care disinfection. Microorganisms. 11 (2), 299 (2023).
- Crary, M. J., Walters, R., Shannon, P., Gabriel, M. M. Variables affecting the recovery of Acanthamoeba trophozoites. Pathogens. 10 (2), 221 (2021).
- . imagej Available from: https://imagej.net/plugins/trackmate/tutorials/getting-started (2024)
- Cherstvy, A. G., Nagel, O., Beta, C., Metzler, R. Non-Gaussianity, population heterogeneity, and transient superdiffusion in the spreading dynamics of amoeboid cells. Phys Chem Chem Phys. 20 (35), 23034-23054 (2018).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır