Fare Modellerinde Tekrarlanan İntrakarotis Enjeksiyonlarının Yeni Bir Enjeksiyon Alanı Onarım Tekniği ile Kolaylaştırılması
Bu Makalede
Özet
Enjeksiyondan sonra bir fare modelinde intrakarotis arterin onarımı, enjekte edilen materyalin dağılımını olumsuz etkilemeden kan akışını artere geri döndürür. Enjeksiyon bölgesi onarımı, aynı arterden sonraki enjeksiyonları kolaylaştırır ve tam bir Willis Çemberi olmayan fare suşlarında serebral iskemiyi önler.
Özet
Nöro-onkolojide endovasküler seçici intraarteriyel uygulama yöntemleri kullanılarak yeni antitümör terapötiklerin uygulanmasındaki son gelişmeler göz önüne alındığında, sonraki enjeksiyonlara izin vermek için enjeksiyondan sonra farelerde karotis arteri onarma yöntemleri de dahil olmak üzere, fare modellerinde intrakarotis enjeksiyonları için yöntemlerin geliştirilmesine acil bir ihtiyaç vardır. İki alternatif prosedürle terapötikleri internal karotis artere (ICA) vermek için bir fare modelinde intrakarotis enjeksiyonu yöntemi geliştirdik.
Enjeksiyon sırasında, iğne, dış karotis arter (ECA) etrafına bir dikiş bağlandıktan sonra ortak karotis artere (CCA) yerleştirilir ve enjekte edilen terapötikler ICA'ya verilir. Enjeksiyonu takiben, ortak karotis arter (CCA) bağlanabilir, bu da intrakarotis enjeksiyonlarının sayısını bir ile sınırlar. Bu makalede açıklanan alternatif prosedür, intrakarotis arter enjeksiyonunun ardından CCA'nın enjeksiyon bölgesi onarımının yapıldığı, CCA içindeki kan akışını geri kazandıran ve bazı fare modellerinde görülen serebral iskemi komplikasyonunu önleyen bir modifikasyonu içerir.
Ayrıca, kemik iliği kaynaklı insan mezenkimal kök hücrelerinin (BM-hMSC'ler), enjeksiyonu takiben enjeksiyon bölgesi onarımı ile ve enjeksiyon bölgesi onarımı olmadan intrakarotis enjeksiyonu yoluyla verildiğinde intrakraniyal tümörlere verilmesini karşılaştırdık. BM-hMSC'lerin verilmesi, yöntemler arasında önemli ölçüde farklılık göstermez. Sonuçlarımız, CCA'nın enjeksiyon bölgesi onarımının, aynı arterden tekrar enjeksiyonlara izin verdiğini ve enjekte edilen materyalin iletimini ve dağılımını bozmadığını, böylece insanlarda intrakarotis enjeksiyonunu daha yakından taklit eden daha fazla esnekliğe sahip bir model sağladığını göstermektedir.
Giriş
Kan-beyin bariyerinin (BBB) ve kan-tümör bariyerinin (BTB) geçirimsizliği nedeniyle beyin tümörlerine terapötiklerin verilmesi zordur. BBB'yi atlatmak için terapötiklerin doğrudan intratümöral enjeksiyonu, bir Ommaya rezervuar kateteri, konveksiyonla güçlendirilmiş teslimat için düşük akışlı mikroinfüzyon veya rezeksiyon boşluğuna veya bitişik dokuya lokal enjeksiyon kullanılarak elde edilebilir1. Ancak bu yöntemlerle ulaşılan toplam tümör dokusu hacmi 2,3,4 ile sınırlıdır. İntraarteriyel enjeksiyonlar daha önce tümörün daha fazlasına ulaşmak amacıyla beyin tümörlerine terapötik ajanlar vermek için kullanılmıştır 5,6,7,8 ve son zamanlarda hem intraarteriyel iletim tekniklerindeki hem de yeni terapötik ajanlardaki ilerlemeler, bu yaklaşımın beyin tümörlerinin tedavisinde kullanılmasının yararını göstermiştir 7, 9. Bu ilerlemeler arasında mikrokateterlerin geliştirilmesi, ileri görüntüleme ile endovasküler selektif intraarteriyel (ÇSED) iletimi, BBB ve BTB'yi bozmak için ozmotik ajanların kullanımı ve hedefe yönelik biyolojik tedavilerin geliştirilmesi yer almaktadır. Bu nedenle, intraarteriyel enjeksiyonlar yoluyla uygulanan yeni terapötik ajanların klinik öncesi testlerini yapmak için uygun translasyonel araştırma modelleri gereklidir 9,10.
Beyin tümörlerinin fare modellerinde, intraperitoneal veya intravenöz olarak (kuyruk damarı yoluyla) verilen terapötik ajanlar, beyin de dahil olmak üzere tüm vücuda dağıtılmadan önce sırasıyla karaciğerden veya kalp ve akciğerlerden geçer. Bu ilk geçiş etkileri, ajanı yakalayabilir ve çıkarabilir veya beyne ulaşmadan önce ajanı seyreltebilir ve beyinde terapötik bir doza ulaşmadan önce doz sınırlayıcı toksisiteler gösterebilir. Buna karşılık, intrakarotis arter enjeksiyonu, ilk geçiş metabolizmasını atlayarak ve hedef dışı iletimi sınırlayarak dolaşımdan önce beyne odaklanmış iletimi sağlar. Farelerde intrakarotis enjeksiyonu daha emek yoğun olsa da, tekniğin özgüllüğü ve tekrarlanabilirliği, araştırmaları tamamlamak için hayvan sayısının azalmasına neden olur11,12.
Genel olarak, farelerde daha önce tarif edilen intrakarotis arter enjeksiyonu yöntemlerinde, enjeksiyondan sonra ortak karotis arter bağlanır ve beyne giden dolaşım, Willis11,12 çemberi aracılığıyla kontralateral karotis arter ve posterior serebral dolaşım tarafından sağlanır. Bu yöntem, iç veya dış karotis artere en fazla tek bir enjeksiyona izin verme gibi doğal bir sınırlamaya sahiptir. Karotis arterin bağlandığı deneylerde kullanılan fare suşlarının, bağlanmış arter13'e bağlı serebral iskemiyi önlemek için tam bir Willis Çemberine sahip olması da çok önemlidir. Karotis arterin tıkanmasının da serebral kan akışını azalttığı ve enjekte edilen partiküllerin dağılımını sınırladığı gösterilmiştir14. Ek olarak, enjeksiyonu takiben farelerde karotis arterin tıkanması, insan hastalarda intrakarotis arter enjeksiyonunu taklit etmez.
Grubumuz daha önce mezenkimal kök hücreleri beyne başarılı bir şekilde iletmek için intrakarotis arter enjeksiyonları kullanmıştır 10,15,16,17,18,19. Bu makalede, bu intrakarotis arter enjeksiyonu yöntemini ayrıntılı olarak açıklıyoruz ve geliştirdiğimiz, enjeksiyon sonrası karotis arter ligasyonunun getirdiği sınırlamalardan kaçınarak, arteri tıkamadan enjeksiyon bölgesinin onarıldığı yöntemin bir modifikasyonunu dahil ediyoruz. Bu yöntemde, ana karotis arter (CCA), hedeflenen enjeksiyon bölgesinin her iki ucunda birer tane olmak üzere iki dikiş yerleştirilerek enjeksiyona hazırlanır ve alt sütür (enjeksiyon bölgesinin altında) sıkılaştırılır. Dış karotis arter (ECA) başka bir sütür kullanılarak kapatılır. İğne CCA'ya yerleştirilir ve terapötikler iç karotis artere (ICA) verilir. Bunu takiben, ICA'dan geri akışı önlemek için CCA üzerindeki üst sütür sıkılaştırılır. Bu adımda, enjekte edilen CCA bağlanabilir veya onarılabilir. CCA bağlanacaksa dikişler sıkılaştırılır ve yerinde bırakılır. Enjeksiyon bölgesi onarılırsa, onarımdan sonra dikişler çıkarılır ve kan akışı yeniden sağlanır. Bu alternatif prosedürlerin ayrıntıları aşağıda verilmiştir.
Protokol
Aşağıda özetlenen tüm adımlar, Texas Üniversitesi MD Anderson Kanser Merkezi'ndeki Kurumsal Hayvan Bakımı ve Kullanımı Komitesi tarafından belirlenen ve onaylanan yönergeleri izleyen protokolümüze uygundur.
1. Cerrahi işlem için ameliyat masası ve farenin hazırlanması
- Cerrahi işlem için ameliyat masası ve farenin hazırlanması (bkz. Şekil 1A,B)
- Diseksiyon mikroskobunu ve ışık kaynağını, aktif bir süpürme sistemi ile izofluran buharlaştırıcının önüne yerleştirin veya aşağı çekişli bir masaya yerleştirin. Elektrikli ısıtma pedini diseksiyon mikroskobu tabanına (veya taban sağlamsa ve ısıyı iletebiliyorsa tercihen mikroskobun altına) yerleştirin ve steril bir cerrahi örtü ile örtün.
NOT: Tüm cerrahi aletler ve örtüler kullanımdan önce otoklavlama ile sterilize edilmeli ve tüm tek kullanımlık malzemeler steril ve ayrı ayrı paketlenmelidir. Kurulum ve prosedür boyunca steril eldivenler kullanılmalı ve steriliteyi korumak için gerektiğinde değiştirilmelidir. - Vinil laboratuvar bandı kullanarak yatağı (4-5 "uzunluğunda x 2" genişliğinde) cerrahi örtü üzerinde hazırlayın. 1,5 inç x 1,5 inç karelik bir gazlı bez kesin, sıkıca yuvarlayın ve haddelenmiş gazlı bezi bir yastık oluşturmak için yatağın "başına" 3 inçlik bir vinil bant parçasının altına yerleştirin (bir yastık kullanımıyla baş eğimi, ventral boyun bölgesinin daha fazla uzamasına izin verir).
- Yatağın kenarlarına (vinil bandın üzerine) 4 inçlik cerrahi bant parçaları yerleştirin. [İzofluran kullanıyorsanız, yatağın başına yakın bir yere ağırlık (veya bant) takılı bir anestezi burun konisi yerleştirin. Fare uyuşturulduktan ve kısıtlandıktan sonra belirli bir yerleştirme için ayarlayın.] Şekil 1A,B'ye bakın.
- Bir iğne ucu veya ağır forseps kullanarak, bir pamuklu çubuktan küçük pamuk parçalarını koparın ve 0,5 ila 1 mm çapında çeşitli boyutlarda toplar halinde yuvarlayın (fare başına 8-10 pamuk parçası). Pamuğu yatağın baş kısmına yakın cerrahi örtünün üzerinde tutun.
- Steril aletler kullanarak 6-0 dikiş ipini 1 cm'lik parçalar halinde kesin (fare başına 3-4 parça). Hazırlanan dikiş boylarını steril bir örtü üzerine yerleştirin. Buprenorfin veya diğer uygun analjeziklerin uygulanması için 1 mL'lik bir şırınga hazırlayın (Kurumsal Hayvan Bakımı ve Kullanımı Komitesi [IACUC] protokolü tarafından onaylandığı gibi). Aletleri steril alana yerleştirmeden önce tüm cerrahi aletleri IACUC standartlarına göre sterilize edin.
- Diseksiyon mikroskobunu ve ışık kaynağını, aktif bir süpürme sistemi ile izofluran buharlaştırıcının önüne yerleştirin veya aşağı çekişli bir masaya yerleştirin. Elektrikli ısıtma pedini diseksiyon mikroskobu tabanına (veya taban sağlamsa ve ısıyı iletebiliyorsa tercihen mikroskobun altına) yerleştirin ve steril bir cerrahi örtü ile örtün.
- Farenin cerrahi prosedür için hazırlanması (bkz. Şekil 1C-F)
- Büyük sağkalım ameliyatları için IACUC tarafından onaylanan yöntemleri izleyerek bir fareyi uyuşturun (tek tek farelerin duyarlılığına bağlı olarak izofluran% 1 -% 4 veya 100-200 mg / kg'da 10 mg / mL ketamin, 1 mg / mL ksilazin kokteyli kullanın (ketamin) vücut ağırlığı). Gerekirse kürkü kırpın veya epilasyon yapın. Cerrahi prosedürün başlamasından 30 dakika önce deri altı enjeksiyonla 0.5-1.0 mg / kg buprenorfin ER (Uzatılmış salım) uygulayın.
- Anestezi uygulanmış fareyi, yastık boynun altına dayanacak şekilde konumlandırın (Şekil 1C). Yastık, anestezi burun konisi ile birlikte kullanıldığında boynun uzamasına ve desteklenmesine yardımcı olur. Ketamin / ksilazin kokteyli kullanıyorsanız, başı eğmek ve boynu uzatmak için kesici dişlerin arkasına ağza ağırlıklı bir diş çubuğu veya benzeri bir alet yerleştirin.
- Daha önce cerrahi yatağın kenarlarına yerleştirilmiş cerrahi bandı kullanarak ön ayakları kısıtlayın (Şekil 1D). Farenin mikroskop altındaki konumunu, boynun ventral yüzeyi görünecek şekilde ayarlayın ve cerrahi bölgeyi rahatça gözlemlemek için büyütmeyi ayarlayın (Şekil 1E).
NOT: Diseksiyon mikroskobunun büyütmesi, cerrah tarafından her adım için konfor seviyelerine göre ayarlanmalıdır. - Steril bir pamuklu çubuk kullanarak suni gözyaşı uygulayın. Dezenfektan başına üç kez betadin veya klorheksidin ve alkolden oluşan dairesel swabları değiştirerek cerrahi bölgeyi dezenfekte edin (Şekil 1F).
- Farenin ayak parmağı sıkışmasına yanıt olarak bacağını geri çekmediğinden emin olarak anestezi derinliğini onaylayın. Solunum hızını izleyin ve farenin nefes almadığından emin olun, çünkü bu, izofluran kullanırken aşırı anestezinin bir göstergesidir. Gerekirse, uygun anestezik derinliğe ve hatta solunuma ulaşmak için oksijen ve izofluran akış hızlarını ayarlayın.
2. Cerrahi işlem (Şekil 2, Şekil 3, Şekil 4, Şekil 5, Şekil 6 ve Şekil 7)
- Primer insizyon ve diseksiyon
- 1 cm boyuna, orta hatta bir kesi yaparak başlayın, manubriuma sadece kraniyal olarak başlayın (sternumun kraniyal ucunda çıkıntılı yumru) ve kullanıcının onaylı IACUC yönergelerini izleyerek steril bir neşter bıçağı veya benzeri bir alet kullanarak trakea üzerinden devam edin (Şekil 2A).
- Kapalı makasın ucunu insizyona yerleştirin ve iki tükürük bezini ayırarak deri altı bağ dokusunun künt diseksiyonunu yapmak için yavaşça açın. İnce forsepslerle, aseptik olarak hazırlanmış cilt yüzeyine dayanması için sağ tükürük bezini insizyondan nazikçe çekin veya künt kanca ekartörü kullanarak tükürük bezini yanal olarak geri çekin (Şekil 2B,C). Dış bez kuru veya yapışkan görünüyorsa, steril tuzlu su ile nemlendirin.
- Sternokleidomastoid ve digastrik kaslar görünene kadar bağ dokusunun künt diseksiyonuna devam edin (Şekil 2D).
NOT: Trakea/sternohyoid (sh) kası, sternokleidomastoid (sm) kası ve digastrik (dg) kasın (kaudal göbek) oluşturduğu kas üçgeni, protokolde sağ CCA'yı ve karotis arter bifurkasyonunu bulmak için kullanılacaktır. Genel olarak, daha küçük omohyoid (oh) kası da CCA boyunca enine uzanırken görülebilir (Şekil 2D); Bununla birlikte, bu kasın boyutu değişir ve omohyoid kasın genç veya küçük farelerde tamamen olmaması nadir değildir.
- CCA izolasyonu
- Açılı uçlu forsepsleri kullanarak, ortak karotis arteri, juguler veni ve vagus sinirini ortaya çıkarmak için kas üçgeninin kaudal ucuna yakın bağ dokusunun (forsepsin uçlarını açarak) dikkatli bir şekilde diseksiyonuna devam edin.
NOT: Ortak karotis arter, trakeaya bitişik en büyük kan damarıdır ve genellikle kas üçgeninin tabanında kolayca tanımlanabilir (Şekil 2E, ok). Kan damarlarının etrafındaki ince forsepslere son derece dikkat edin, çünkü uçlar damarları kolayca çentikleyebilir ve bu da aşırı ve potansiyel olarak ölümcül kanamaya neden olabilir. - Ortak karotis arterin bir kısmı etrafındaki bağ dokusunun, kas üçgeninin tabanından omohyoid kasa kadar dikkatli bir şekilde diseksiyonuna devam edin. Küçük kanamaları kontrol etmek ve gerektiğinde tükürük bezlerinden salgılanan sıvıları emmek için küçük, steril pamuk toplarını kullanın.
- CCA'yı vagus sinirinden ayırmak için bağ dokusunu dikkatlice inceleyin. CCA'ya bitişik kalın, beyaz, sinir demeti olarak kolayca tanımlanan vagus sinirinin işlenmesini ve hasar görmesini en aza indirmek için özel dikkat gösterin (Şekil 2F).
- Açılı uçlu forsepsleri kullanarak, ortak karotis arteri, juguler veni ve vagus sinirini ortaya çıkarmak için kas üçgeninin kaudal ucuna yakın bağ dokusunun (forsepsin uçlarını açarak) dikkatli bir şekilde diseksiyonuna devam edin.
- CCA hazırlığı
- CCA, sternokleidomastoid kastan tamamen mobilize edildikten ve görünür olduğunda omohyoid kasa kadar hareket ettikten sonra, farenin sternumunun aseptik olarak hazırlanmış cildine (kolay geri almak için) 1 cm'lik bir parça 6-0 sütür yerleştirin ve açılı uç forsepslerini CCA'nın altından geçirin (CCA'yı vagus siniri ve juguler venden izole etmeye özen göstererek) (Şekil 3A). Omohyoid kas mevcut değilse, önerilen enjeksiyon bölgesine CCA, kraniyal ve kaudal üzerine dikişler yerleştirebilmek ve iğneyi yerleştirmek için CCA'nın etrafındaki alanı yeterince temizleyin.
- Sol elinizdeki ince forsepslerle, dikişin ucuna yakın bir yerden kavrayarak dikişi açılı uçlu forsepslere geçirin. Açılı uç forseps ile dikişin uzunluğunun yarısını CCA'nın altına yavaşça çekin (Şekil 3B).
- Bu işlemi ilk dikişe paralel olarak ikinci bir dikişle tekrarlayın (Şekil 3C).
- Her bir dikişi CCA'nın etrafına gevşek bir şekilde bağlayın, ancak düğümleri sıkmayın veya kan akışını kısıtlamayın (Şekil 3D).
- Eksternal karotis arter izolasyonu ve hazırlanması
- Açılı uçlu forsepsleri kullanarak, CCA'yı ve ECA ve ICA'ya bifurkasyonu bulmak için kas üçgeninin kraniyal ucundaki, omohyoid kasın kraniyalindeki bağ dokusunu dikkatlice çıkarın (Şekil 4A).
NOT: ECA orta hatta doğru açı yapar ve biraz daha yüzeyseldir, ICA ise yanal olarak açı yapar ve boynun daha derinlerine doğru hareket eder. Bifurkasyonun hemen üzerindeki ICA üzerinden geçen hipoglossal sinirin (HN) hasar görmesini önlemek için özel dikkat gösterin. - Çatallanmanın yakınındaki ECA'nın her tarafından bağ dokusunu dikkatlice temizleyin. ECA'dan yeterince bağ dokusu temizlendikten sonra, farenin sternumundaki aseptik olarak hazırlanmış cilde bir parça sütür yerleştirin ve açılı uçlu forsepsleri ECA'nın altından geçirin. Sol eldeki ince forseps ile ipliği ICA ve ECA arasındaki boşluktaki açılı uçlu forsepslere geçirin ve sütürün uzunluğunun yarısını nazikçe çekin (Şekil 4B). Dikişi ECA'nın etrafına gevşek bir şekilde bağlayın, ancak düğümü sıkmayın.
NOT: ECA'dan, yanlışlıkla arterleri çevreleyen bağ dokusunu tutmadan, sütür alındığında arterlere zarar vermeden açılı uçlu forseps ile dikişi kavrayabileceğiniz yeterli bağ dokusunun temizlenmesi önemlidir.
- Açılı uçlu forsepsleri kullanarak, CCA'yı ve ECA ve ICA'ya bifurkasyonu bulmak için kas üçgeninin kraniyal ucundaki, omohyoid kasın kraniyalindeki bağ dokusunu dikkatlice çıkarın (Şekil 4A).
- İğne ve şırınga hazırlama
NOT: Bu adım için enjeksiyon, şırınganın farenin gövdesine dayanmasına ve onun tarafından stabilize edilmesine izin veren düz bir iğne ile gerçekleştirilebilir (Şekil 5A). Alternatif olarak, enjeksiyon, ucun yakınında bükülmüş bir iğne kullanılarak gerçekleştirilebilir, bu da şırınganın el ameliyat masası üzerinde dururken bir kalem gibi tutulmasına izin verir (Şekil 5B). Her iki teknik de iyi çalışır ve teknik seçimi kişisel bir tercihtir.- Bükülmüş iğneyi hazırlamak için, eğim yukarı bakacak şekilde 33 G, 1/2 inçlik bir iğne tutun ve ucu steril bir iğne tornavida ile kavrayın (Şekil 5C). İğneyi yaklaşık 30-40° doğrudan eğime doğru bükün (Şekil 5D).
- Şırıngayı, enjekte edilecek çözeltinin uygun hacmi ile doldurun (enjeksiyon çözeltisi şırıngayı yüklemek için iğneden yukarı çekilmezse, iğnenin boşluk alanını hesaba kattığınızdan emin olun). İğneyi takın ve hava kabarcıklarını çıkarın. Çözeltinin menisküsünün iğnenin eğiminde göründüğünden emin olun.
- İntrakarotis enjeksiyonu
- ECA'nın etrafındaki dikişin düğümünü sıkın. Daha sonra, CCA üzerindeki alt sütürü mümkün olduğunca sternokleidomastoid kaslara doğru kaydırın ve düğümü sıkın. CCA üzerindeki üst sütürün enjeksiyon sonrasına kadar gevşek kaldığından emin olun. Enjeksiyon sırasında salgılanan sıvıyı ve kanı emmek için boşluğun kenarına steril bir pamuk topu yerleştirin.
- Şırıngayı sağ elinizde ve ince forsepsleri sol elinizde tutarak, iğneyi CCA'daki alt sütürün hemen üzerindeki artere getirin. İnce forsepslerle, CCA'ya düşük bir gerilim seviyesi yerleştirmek için alt sütürün gevşek ucunu kaudal yönde nazikçe çekin (Şekil 6A).
- İğneyi eğimin hemen yanından CCA'ya sokun ve sütürdeki gerilimi yavaşça serbest bırakın (Şekil 6B).
NOT: Arter önemli miktarda kan akışına sahiptir ve iğne yerleştirildiğinde muhtemelen cerrahi boşluğa kanayacaktır. Bununla birlikte, iğne eğimi geçtikten sonra, arter iğnenin etrafında bir conta oluşturacak ve kanama duracaktır. İğne yerindeyken sürekli kanama, iğnenin artere yeterince uzak olmadığını (eğimden gelen boşluk kanın akmasına izin verir) veya iğnenin arterin arkasından itildiğini gösterir. Arterin yırtılmasını veya iğnenin kaymasına izin vermemek için iğneyi son derece hareketsiz tutmak önemlidir. Kanama olayları olan hayvanları sürekli olarak izleyin ve kanama önemliyse (örneğin bir hayvanın rengini kaybetmesi, siyanotik görünmesi, dokunulduğunda soğuması veya hayvan kullanım protokolünde açıklanan diğer herhangi bir insancıl son nokta gibi), insancıl uç noktaların uygulanması gerekir. - Çözeltiyi çok yavaş enjekte etmek için şırınga pistonunu itmek için sol elinizi kullanın (Şekil 5B, 100 μL çözelti enjekte etmek için en az 15 saniye). Solüsyonu enjekte etmeyi bitirdiğinizde iğneyi çıkarmayın. Geri akışı önlemek için, sol eldeki ince forseps ile CCA'daki üst sütürü (hala gevşek bir şekilde bağlı) düğümden kavrayın ve arteri bükmek için kaldırın (Şekil 6C).
- İğneyi çıkarın, şırıngayı bir kenara koyun ve sağ elinizle açılı uçlu forsepsleri alın. Bükülmeyi arterde tutarak, CCA üzerindeki üst dikişteki düğümü sıkın (Şekil 6D).
NOT: Bu noktada, ameliyat boşluğuna ek bir kanama olmamalıdır. Bu adımı takiben, aşağıdaki 2.7 ve 2.8 adımlarında açıklandığı gibi iki alternatif prosedür vardır. CCA bağlanacaksa, adım 2.7'yi izleyin. CCA enjeksiyon bölgesinde onarılacaksa, adım 2.8'de listelenen değişikliği izleyin.
- CCA'nın Ligasyonu
- CCA'ya dolaşımın geri yüklenmesini gerektirmeyen durumlarda, arteri bağlı bırakın ve her iki sütürü de CCA üzerinde sıkılaştırın. Dikiş uçlarını kesin ve dikiş düğümlerinin tamamen sıkıldığını onaylayın.
- Adım 2.9'da açıklanan kapatma ve analjezi prosedürlerine devam edin.
- CCA-Enjeksiyon bölgesi onarımının ligasyonuna ve dolaşımın eski haline getirilmesine alternatif
- Steril pamuk topları kullanarak, cerrahi boşlukta kalan kanı emdirin. CCA'daki enjeksiyon bölgesini bulun (Şekil 7A) ve kapatmak için gereken sütür sayısını belirleyin. Pıhtılaşmış kanı çıkarmak için CCA'nın izole edilmiş alanının enjeksiyon bölgesini ve lümenini iyice sulayın.
- Açılı uçlu forsepsleri kullanarak 9-0 dikiş iğnesini iğne gövdesinden sörveye yakın bir yerden kavrayın. Arteri karşı taraftan desteklemek için ince forsepsleri kullanırken, arter duvarına enjeksiyon bölgesine yaklaşık 1-1.5 mm yanal, artere dik olarak nüfuz ederek CCA'ya tek bir sütür yerleştirin. Arteri ince forsepslerle tutun, enjeksiyon bölgesini açın ve iğneyi ve dikişi sağ ve sol taraflardan ayrı ayrı geçirin. Alternatif olarak, arteri tutun, ince forsepslerle yanları hafifçe bastırın, iğneyi geçirin ve tek bir ısırıkla arterin her iki tarafından dikin.
NOT: Her iki teknikte de, iğne ve sütürün arterin içindeki arka duvara nüfuz etmemesine dikkat edin, çünkü bu, sıkıldığında lümeni kapatacaktır. - Enjeksiyon bölgesini bir cerrah düğümü ile kapatın, en az dört atış kullanarak ince forseps ve açılı uçlu forseps ile bir alet bağı yapın (Şekil 7B). Genel olarak, 33 G'lik bir iğnenin enjeksiyon bölgesini kapatmak için tek bir basit kesintili sütür kullanın.
- İnce forsepsleri kullanarak dolaşımı yeniden sağlamak için, ECA'nın etrafındaki sütürü çözün ve çıkarın, ardından CCA'nın üzerindeki üst sütürü uygulayın (Şekil 7C,D). Ardından, CCA üzerindeki alt dikişi yavaşça gevşetin, ancak hemen çözmeyin. Geri kazanılmış kan basıncı ve akışı ile büyük kanamayı önlemek için enjeksiyon bölgesinin yeterince kapalı olduğunu onaylayın (Şekil 7D).
NOT: Enjeksiyon bölgesinde büyük kanama meydana gelirse, CCA üzerindeki alt sütür hızlı bir şekilde yeniden sıkılabilir ve gerekirse enjeksiyon bölgesi ayarlanabilir veya yeniden dikilebilir. - Üst ve alt CCA sütürlerini çıkarın (Şekil 7E). Adım 2.9'a gidin.
- Kapanış ve analjezi
- Tükürük bezini boşlukta yeniden konumlandırın ve steril bir dikiş paketi kullanarak kesiyi üç basit kesintili sütürle kapatın. Cerrahi bant tutucularını çıkarın ve farenin bir ısıtma yastığı üzerindeki anesteziden kurtulmasına izin verin.
NOT: Analjezik takip dozları, kullanıcının onaylı IACUC protokolünde belirtilen sıklık ve doza göre verilmelidir. Enjeksiyonlar arasında bir haftalık bir iyileşme süresi önerilir. Tekrarlanan enjeksiyonlara ihtiyaç duyulursa, ilk enjeksiyondan sonra enjeksiyon bölgesinin onarımı kullanılabilir ve sonraki enjeksiyonlar için aynı cerrahi prosedür izlenebilir. Sonraki enjeksiyon, CCA kraniyaline onarılan enjeksiyon bölgesine uygulanabilir, çünkü aynı enjeksiyon bölgesini onarmak için tekrarlanan dikiş muhtemelen yara izine ve kan pıhtılarına yol açacaktır.
- Tükürük bezini boşlukta yeniden konumlandırın ve steril bir dikiş paketi kullanarak kesiyi üç basit kesintili sütürle kapatın. Cerrahi bant tutucularını çıkarın ve farenin bir ısıtma yastığı üzerindeki anesteziden kurtulmasına izin verin.
Temsili Sonuçlar
Önceki raporlar, intrakarotis enjeksiyonu ile verilen kemik iliği kaynaklı insan mezenkimal kök hücrelerinin (BM-hMSC'ler) farelerde19 intrakraniyal gliomlara başarılı bir şekilde yerleştirildiğini göstermiştir. Bu modeli, glioma taşıyan farelerde BM-hMSC'lerin intrakarotis enjeksiyonunu takiben restore edilmiş dolaşım ile CCA ligasyonunun CCA onarımına karşı etkilerini karşılaştırmak için kullandık. Atimik çıplak farelere U87 glioma hücreleri implante edildi, ardından GFP etiketli BM-hMSC'lerin enjeksiyonu ve ardından CCA ligasyonu veya dolaşımın geri kazanılması ile CCA onarımı yapıldı. 3 gün sonra fareler sakrifiye edildi ve beyinler toplandı, düzeltildi ve GFP'yi tespit etmek için immünohistokimya yapıldı ve GFP pozitif hücreler sayıldı (Şekil 8A-D).
GFP-BM-hMSC'lerin intrakraniyal gliomlara genel olarak bağlanması, aynı örnekten iki farklı slaytta (>75 μm aralıklı bölümler) tümör sınırı içindeki toplam GFP pozitif hücre sayısı ile değerlendirildi. Ortalamaların eşleştirilmemiş t-testi ile karşılaştırılması, iki prosedür arasında gözlenen ortalama hedef arama arasında anlamlı bir fark olmadığını göstermiştir (P = 0.6858) (Şekil 8E). GFP-BM-hMSC'lerin tümör boyunca dağılımı, tümör içindeki 10 yüksek güçlü alan boyunca GFP pozitif hücrelerin sayılmasıyla değerlendirildi. Yüksek güçlü alanlarda artan hücre sayıları, prosedürdeki varyasyondan kaynaklanan tümör boyunca hücrelerin dağılımındaki değişiklikleri gösterebilir. Wilcoxon İşaretli Sıra testi kullanılarak medyan değerlerin karşılaştırılması, CCA ligasyonu ve CCA onarım grupları arasındaki yüksek güçlü alanlardaki GFP pozitif hücrelerin medyan sayıları arasında anlamlı bir fark olmadığını göstermiştir (Şekil 8F).

Şekil 1: Ameliyat masası ve farenin ameliyat için hazırlanması. (A,B) Cerrahi yatak (etiketler A. Yatağı oluşturan vinil bant, B. Cerrahi bant ön ayak kısıtlamaları, C. Yastık, D. Ağırlık, E. Anestezi burun konisi, F. Künt kanca ekartörü, G. %70 etanolde 1 cm sütürler, H. İnce forseps, I. Açılı uçlu forseps, J. Dar makas, K. Steril pamuk topları). (C,D) Fareyi konumlandırma. (E,F) Ameliyat bölgesi ve ameliyat bölgesinin dezenfeksiyonu. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
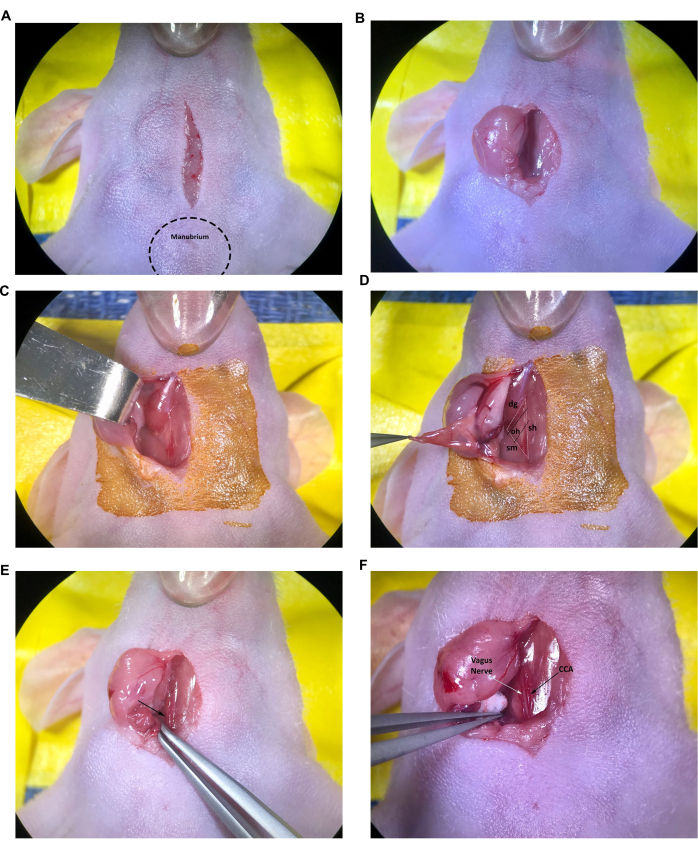
Şekil 2: Enjeksiyon bölgesindeki yapıların insizyonu ve maruz kalması. (A) Orta hat insizyonu. (B,C) Sağ tükürük bezinin geri çekilmesi. (D) Trakea / sternohyoid kas, sternokleidomastoid kas ve digastrik kas, omohyoid kas tarafından oluşturulan kas üçgeni de görülebilir. (E) Okla gösterilen ortak karotis arter. (F) Oklarla gösterilen vagus siniri ve ortak karotis arter. Kısaltmalar: sh = trakea/sternohyoid kas; SM = sternokleidomastoid kas; dg = digastrik kas; oh = omohyoid kas; CCA = Ortak karotis arter. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
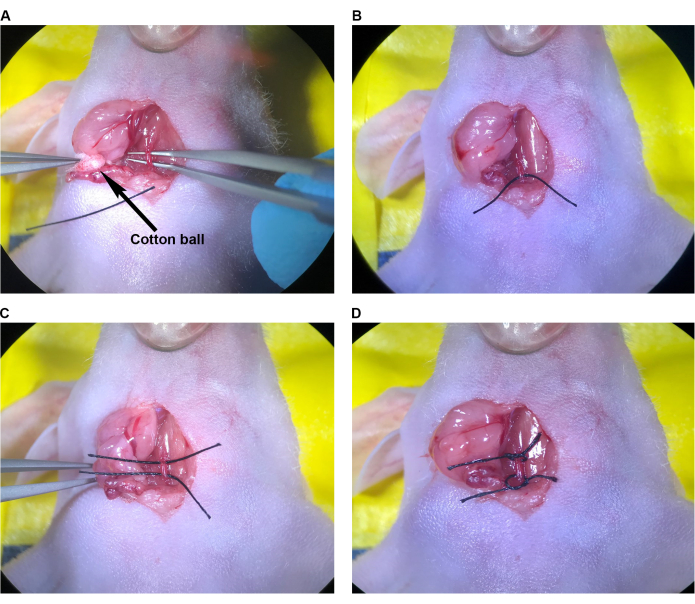
Şekil 3: CCA'nın enjeksiyon için hazırlanması. (A) Açılı uçlu forsepsler CCA'nın altından geçirildi. (B) Sütür, açılı uçlu forseps kullanılarak CCA'nın altına yarıya kadar çekildi. (C) İkinci sütür CCA'nın altına yarıya kadar çekildi. (D) CCA'nın etrafında gevşek bir şekilde bağlanmış dikişli. Kısaltma: CCA = Ortak karotis arter. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
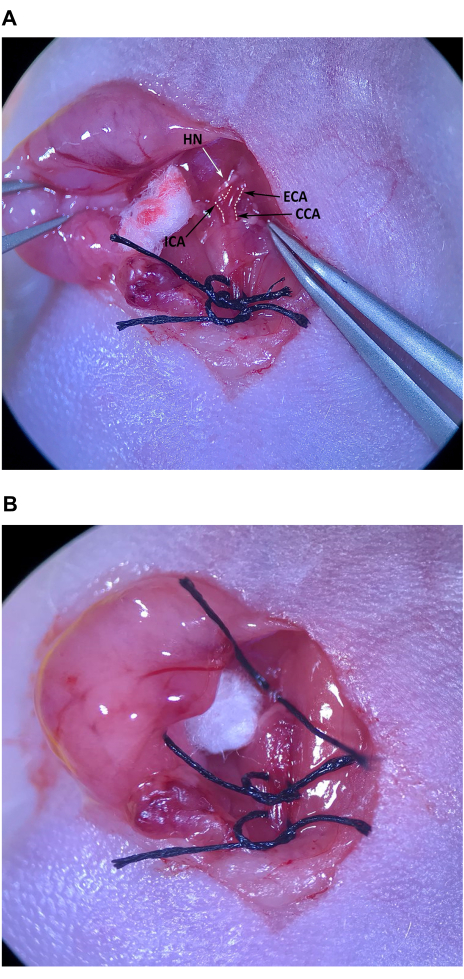
Şekil 4: Eksternal karotis arter izolasyonu ve hazırlanması. (A) CCA, eksternal karotis arter ve internal karotis arter. (B) Sütür, ECA'nın altından yarıya kadar çekildi. Kısaltmalar: CCA Ortak karotis arter; ECA = dış karotis arter; ICA = iç karotis arter. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
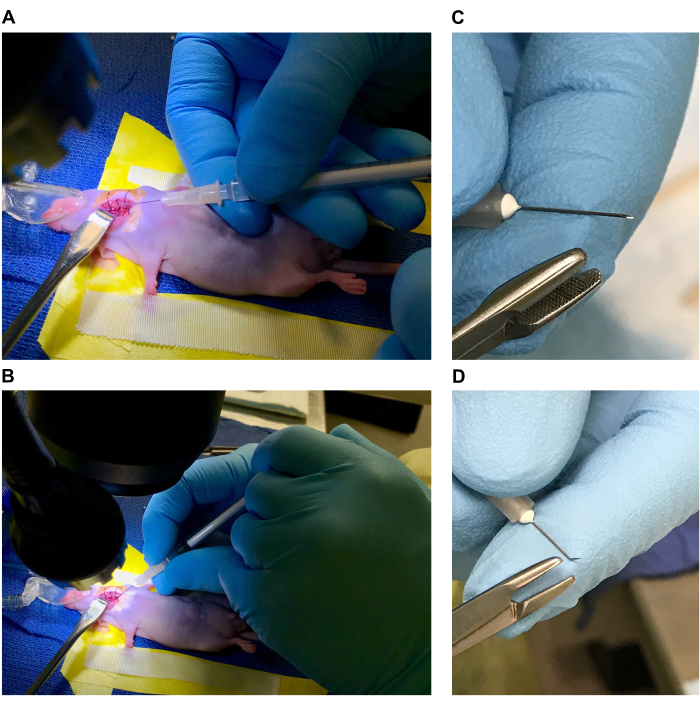
Şekil 5: İğne ve şırınga hazırlama. (A) Farenin vücuduna dayanan bir şırınga ile düz bir iğne ile enjeksiyon. (B) Ameliyat masasına dayanacak şekilde bükülmüş bir iğne ile enjeksiyon. (C,D) Bükülmüş bir iğne hazırlamak. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
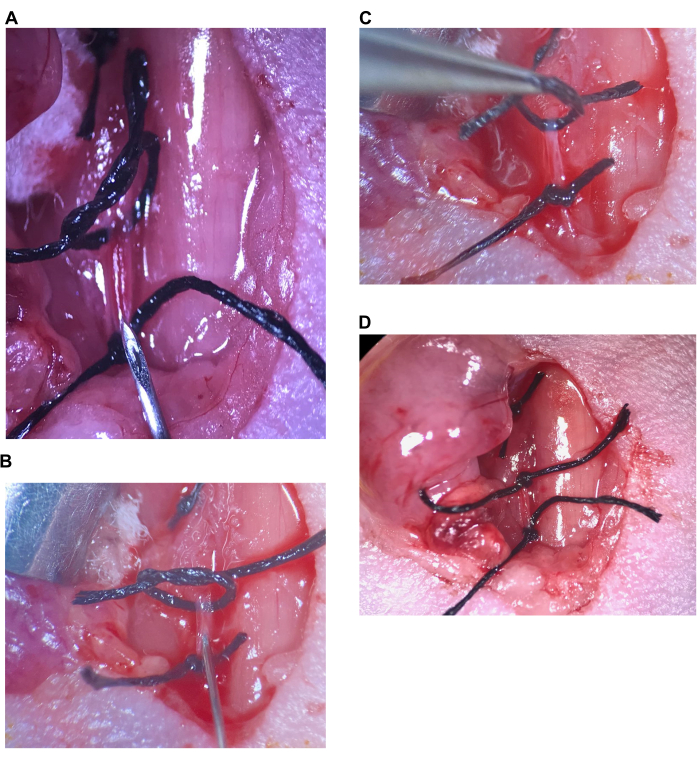
Şekil 6: İntrakarotis enjeksiyonu. (A) Üst sütür gevşek, alt sütür CCA üzerinde sıkılaştırılır, iğne alt sütürün üzerine yerleştirilir. (B) İğne eğimin hemen yanından sokulur, arter iğnenin etrafına kapatılır. (C) Arteri yukarı doğru bükmek ve geri akışı önlemek için üst sütür kaldırılır. (D) CCA üzerindeki üst sütür sıkılaştırılır. Kısaltma: CCA = Ortak karotis arter. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
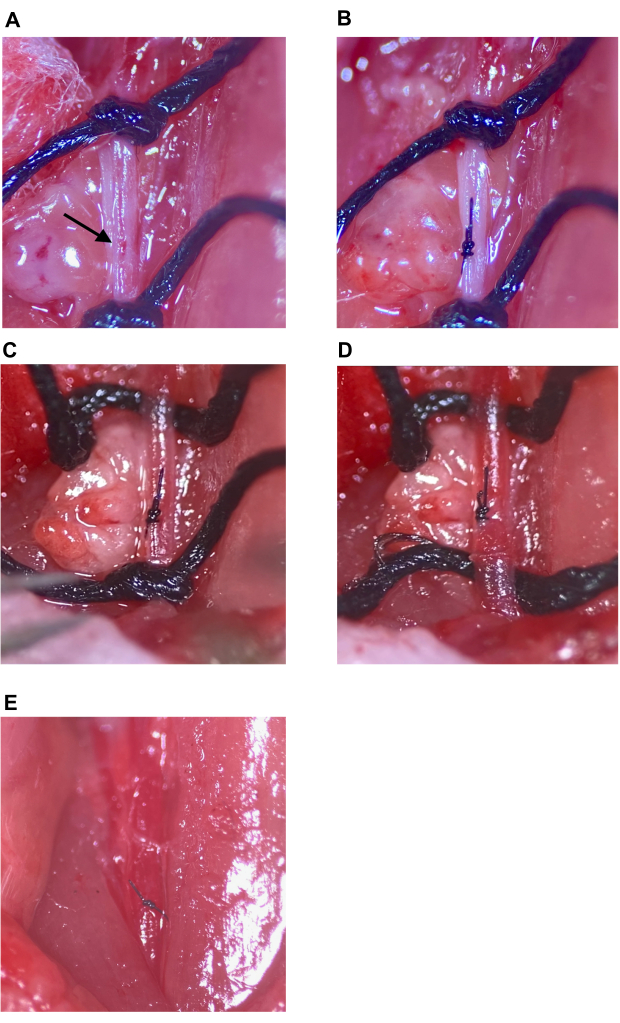
Şekil 7: Enjeksiyon bölgesi onarımı ve dolaşımın eski haline getirilmesi. (A) Bir okla gösterilen enjeksiyon bölgesi. (B) Enjeksiyon bölgesi bir cerrah düğümü ile kapatıldı, en az dört atış. (C,D) Enjeksiyon bölgesi onarımından sonra CCA üzerindeki üst ve alt dikişlerin gevşemesi; Dikiş gevşetme sonrası kanama görülmez. (E) Enjeksiyon bölgesinin yeterince onarıldığı belirlendikten sonra dikişler alınır. Kısaltma: CCA = Ortak karotis arter. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
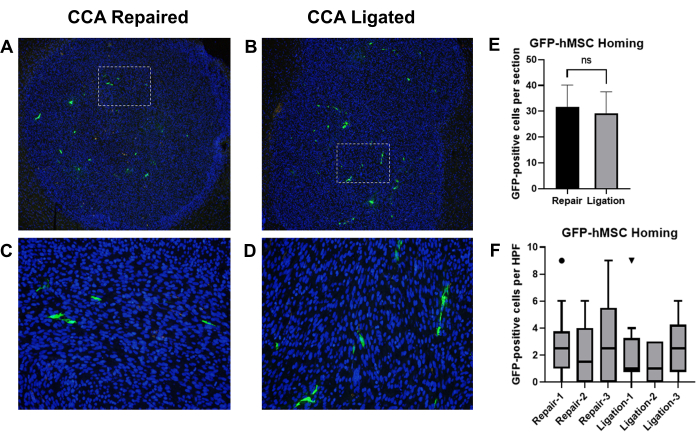
Şekil 8: GFP-BM-hMSC'lerin intrakarotis enjeksiyonu ve CCA ligasyonu veya CCA onarımı sonrası intrakraniyal glioma tümörlerine geri yüklenen dolaşımın karşılaştırılması. Tümör taşıyan farelerden alınan beyin dokusu kesitleri, GFP-BM-hMSC'leri (yeşil) etiketlemek için anti-GFP birincil ve Alexa Fluor 488 ikincil antikorları ile boyandı. Çekirdekler Hoechst 33342 (mavi) ile boyandı. Tümöre genel hedef göstermeyi gösteren etiketli bölümlerin temsili düşük güçlü alanları ve (A, C) CCA onarımı veya (B, D) CCA ligasyonundan sonra GFP pozitif hücre dağılımını gösteren yüksek güçlü alanlar. (E) GFP-BM-HMSC'lerin tümörlere genel olarak bağlanması, iki farklı slaytta tümör sınırı içindeki toplam GFP-pozitif hücre sayısı ile değerlendirildi ve ortalamalar t-testi ile karşılaştırıldı. Alternatif prosedürler arasında genel hedef arama açısından anlamlı bir fark gözlenmedi (P = 0.6858). (F) GFP-BM-HMSC'lerin tümör boyunca dağılımı, tümör içindeki 10 yüksek güçlü alan boyunca GFP pozitif hücrelerin sayılmasıyla değerlendirildi. Medyan değerlerin Wilcoxon İşaretli Sıra testi ile karşılaştırılması, prosedürden bağımsız olarak bireyler arasında anlamlı bir fark olmadığını gösterir (P = 0.1914, 0.5000, 0.1641, 0.9512, 0.8828, 0.2207). Kısaltmalar: GFP = yeşil floresan proteini; GFP-BM-HMSC'LER = GFP ETIKETLI KEMIK ILIĞI KAYNAKLı INSAN MEZENKIMAL KÖK HÜCRELERI; CCA = Ortak karotis arter. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
İntrakarotis arter enjeksiyonları, beyin tümörlerine terapötik sağlamak için son yıllarda giderek daha fazla kullanılmaktadır. Sonuç olarak, araştırma amacıyla insanlarda intrakarotis arter enjeksiyonlarını yansıtan fare modellerinin oluşturulması önemlidir. Daha önce, farelerde intrakarotis arter enjeksiyonları, arterin daha sonra bağlanması ile gerçekleştiriliyordu, bu da artereyapılan enjeksiyon sayısını sınırlıyordu 11,12. Ek olarak, farelerde karotis arterin tıkanması, tam bir Willis13 Çemberine sahip olmayan bazı fare suşlarında serebral iskemiye yol açabilir. Önceki yöntemlerin sınırlamalarının üstesinden gelmek için enjekte edilen karotis arteri onarmak için bir yöntem geliştirdik. Enjeksiyon bölgesinin onarımı, enjekte edilen artere kan akışının yeniden sağlanmasına, serebral iskemi olasılığının azaltılmasına ve aynı iç karotis artere sonraki enjeksiyonların kolaylaştırılmasına neden olur.
Başarı için kritik olan birkaç adım, aşağıdakileri içeren cerrahi aletlerin veya dokunun dikkatli bir şekilde kullanılmasını gerektirir: intrakarotis enjeksiyonu sırasında kanamayı önlemek için iğnenin arterin lümenine doğru şekilde yerleştirilmesi; iğne yerleştirilmeden önce bağ dokusunun enjeksiyon bölgesinden dikkatli bir şekilde diseksiyonu; enjeksiyondan önce şırınga ve iğnedeki tüm topakların ve hava kabarcıklarının çıkarılması; ve onarım sırasında arterin lümeninin kapanmasını önlemek için enjeksiyon bölgesinin doğru şekilde kapatılması. İğne yerleştirildikten sonra kanamayı önlemek için, iğne milinin etrafında bir sızdırmazlık oluşturmak için iğnenin eğimi geçecek şekilde artere sokulduğundan emin olun. Arterin arka duvarında bir yırtılmayı önlemek için, iğneyi sığ bir açıyla yerleştirin ve iğne ucunu arteriyel arka duvardan uzak tutmak için şırıngayı ve iğneyi hafifçe sallayın. Enjekte edilen solüsyon enjeksiyon sırasında dışarı sızarsa, bu, iğnenin yalnızca arteri çevreleyen bağ dokusuna sokulduğunu gösterir; Enjeksiyondan önce fazla bağ dokusunun enjeksiyon bölgesinden dikkatli bir şekilde çıkarılması bu sorunu önleyecektir.
Sütür seçimi ve kapama tekniği ile ilgili olarak, ilk enjeksiyonda 33 G'lik bir iğne kullanılmışsa ve artere temiz bir şekilde yerleştirilmişse, arteri onarmak için 9-0 dikişli basit bir sütür yeterlidir. Enjeksiyon için daha büyük bir iğne kullanılırsa (30 G vb.) veya iğne yerleştirilirken herhangi bir yırtılma meydana gelirse (örneğin, iğne merkezden uzakta olduğunda veya fare nefes aldığı için arter hareket ediyorsa), bu, onarılması gereken biraz daha büyük bir deliğe neden olur. Bu tip daha büyük deliği onarmak için genellikle iki basit dikiş veya sekiz rakamı yeterlidir. Bu iki teknik arasındaki seçim, cerrahın bu durumdaki tercihine bağlıdır. Enjeksiyon bölgesi deliğinin yukarıda belirtilen durumdan önemli ölçüde daha büyük olduğu durumlarda onarım tekniğinin değerlendirilmediğine dikkat etmek önemlidir. Enjeksiyon bölgesindeki yırtılma yanlara doğru uzanırsa (arterin çevresinin üçte birinden daha geniş bir delik açarsa), bu yöntemle onarım yapmak arterin kasılmasına ve tromboz riskinin artmasına neden olabilir.
Dikişler alınırken onarılan enjeksiyon bölgesinden kanama varsa, normal dolaşım devam ederken onarılan bölgenin gerilmesine bağlı olabilir; Bu, onarılan enjeksiyon bölgesini steril pamukla nazikçe kaplayarak ve 30 saniye boyunca hafif basınç uygulayarak düzeltilebilir. Alternatif olarak, onarılan enjeksiyon bölgesinden görünür kan akımı olmayan ve proksimal şişmiş bir arter kanaması varsa, onarım sırasında dikiş iğnesinin arterin arka duvarından geçtiğini gösterir. Bu durumda, onarım sırasında enjeksiyon bölgesi kenarlarını nazikçe açın, dikiş iğnesini arterden sığ bir açıyla geçirin ve dikiş düğümünü bağlamadan önce dikişin arka duvardan geçmediğini görsel olarak onaylayın.
Bu önlemler alındığında, enjeksiyon bölgesi onarım yöntemi, genetik arka plan veya yaştan bağımsız olarak hayvan kohortları arasında kesin ve tekrarlanabilir. Deneyimlerimize göre, işlemi gerçekleştiren üç farklı cerrah ile başarı oranı %100 olmuştur. Yeterli tecrübe ve verilen protokolü dikkatli bir şekilde takip ederek, diğer cerrahların bu işlemi gerçekleştirmesi için herhangi bir zorluk öngörmüyoruz. Uygulama ile yetenekli bir cerrah işlemi 15-20 dakika içinde tamamlayabilir. Deney buna izin verirse, üst ve alt CCA sütürlerini sağlam bırakarak, enjeksiyon bölgesinin onarımından vazgeçerek hayvan başına geçen süre de azaltılabilir. Bununla birlikte, yukarıda belirtildiği gibi, serebral vasküler anatomide suşa özgü farklılıklar belgelenmiştir ve deneye başlamadan önce prosedürde kullanılan farenin suşunun bunu tolere edebileceğini doğrulamak önemlidir.
Bu cerrahi bir işlem olduğundan, farelerin geri kazanımı dikkate alınmalıdır. Stres toleransı ve yara iyileşmesi, farklı fare türlerine göre değişecek önemli hususlardır. Ayrıca ameliyat bölgesinde iltihaplanma ve skar dokusu oluşumu tekrarlayan ameliyatlar sonrası iyileşme süresini artırabilir. 7 gün arayla birden fazla enjeksiyonu başarıyla gerçekleştirdik, ancak daha sık enjeksiyonlar gerekliyse, kullanılacak spesifik fare suşlarında dikkatlice değerlendirilmelidir. CCA üzerindeki kuvvetli kullanım ve stres (izolasyon, dikişlerin bağlanması ve çıkarılması ve enjeksiyon sırasında) arteriyel duvarlara zarar verebilir ve zayıflatabilir ve tekrarlanan enjeksiyonlar sırasında yırtılmaya neden olabilir. CCA etrafındaki destekleyici bağ dokusunun diseksiyonunu ve bifurkasyonu en aza indirmek ve artere aşırı gerilim uygulamaktan kaçınmak önemlidir.
Sonuçlarımız, bu özel modelde, enjeksiyondan sonra restore edilmiş dolaşım ile CCA ligasyonu veya CCA onarımının, intrakraniyal tümörler arasında enjekte edilen BM-hMSC'lerin genel hedef arama sıklığı veya dağılımı açısından farklılık göstermediğini göstermektedir. Bu, farklı fare suşlarında değişebilse de, enjeksiyon bölgesi onarımının kullanılması, enjekte edilen artere kan akışını geri döndürme, aynı artere sonraki enjeksiyonlara izin verme ve daha da önemlisi, insan hastalarda intrakarotis arter enjeksiyonlarına benzer bir avantaj sunar. Enjekte edilen arteri onarmaya karşı bağlama seçimi, deneyin türüne ve kullanılan fare modeline bağlıdır. İkinci bir enjeksiyona ihtiyaç duyulursa veya fare modelinde tam bir Willis Çemberi yoksa, enjeksiyon bölgesi onarımı kullanılmalıdır. CCA'yı fare modellerinde yeniden enjekte etme yeteneği, ek deneysel manipülasyonu kolaylaştırabilir. Örneğin, zaman içinde verilen potansiyel bir terapötiğin çoklu dozlarını test etmek için, enjekte edilen arterin onarımı, sonraki enjeksiyonları gerçekleştirmek için gereklidir. Bu yöntem, farklı zamanlarda enjekte edilmesi gereken terapötik ajanların kombinasyonlarının enjeksiyonunu içeren deneylerde de yararlı olacaktır. Enjekte edilen arterin onarımı ile sağlanan intrakarotis enjeksiyonlarında artan esneklik, fare beyin tümörü modellerinin translasyonel faydasını iyileştirir.
Açıklamalar
Yazarların ilgili herhangi bir açıklaması/çıkar çatışması yoktur.
Teşekkürler
Bu çalışma, Ulusal Kanser Enstitüsü'nden (R01CA115729, R01CA214749 ve 1P50 CA127001) alınan hibeler ve Texas Üniversitesi MD Anderson Kanser Merkezi Ay Çekimleri Programı™, Broş Beyin Kanseri Araştırmaları Vakfı, Elias Ailesi Beyin Tümörü Araştırmaları Fonu, Priscilla Hiley Kanser Araştırma Fonu, Bauman Ailesi Curefest Beyin Kanseri Araştırma Fonu, Chuanwei Lu Fonu, Tatlı Aile Beyin Kanseri Araştırma Fonu, Ira Schneider Memorial Kanser Araştırma Vakfı, Jim & Pam Harris Fonu, Beyin Kanseri Araştırmaları için Gene Pennebaker Fonu, Sorenson Beyin Tümörü Araştırmaları Fonu, Brian McCulloch Anma Fonu, Kalpten TLC Vakfı ve Mary Harris Pappas Glioblastoma Araştırmaları için Bağış Fonu, hepsi F.F.L.'ye.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1 mL syringes (low dead space) | Air-tite Products Co. | A1 | |
| 26 G; 1/2" needle | Air-tite Products Co. | N2612 | |
| 33 G; 1/2" needle | JBP, Air-tite Products Co. | JBP3313B | |
| 3 cm Petri dish | Falcon, Fisher Scientific | 08-772A | |
| 3M durapore surgical tape | Fisher Scientific | 19-071-152 | |
| 6-0 suture thread | Fine Science Tools | 18020-60 | |
| 70% Ethanol | Fisher Scientific | 04-355-122 | |
| 9-0 microsurgical suture with needle | Fine Science Tools | 12052-09 | |
| Analgesic for major surgery | |||
| Artificial tears/ophthalmic ointment | Covetrus | 8897 | |
| Bead Sterilizer | Fisher Scientific | 14-955-341 | |
| Betadine/Chlorhexidine | McKesson, Fisher Scientific | NC1696484 | |
| Blunt hook retractor | Fine Science Tools | 17022-13 | |
| Dissecting microscope | Zeiss Microscopy, LLC | 491903-0010-000 | |
| Electric heating pad | Insource, Fisher Scientific | NC0667724 | |
| Extra narrow scissors | Fine Science Tools | 14088-10 | |
| Fine forceps - Dumont #5 forceps with micro-blunted tips | Fine Science Tools | 11253-20 | |
| Fine forceps - Dumont #5/45 angled tip forceps with micro-blunted tips | Fine Science Tools | 11253-25 | |
| Isoflurane vaporizer (or Ketamine/Xylazine cocktail) | Kent Scientific | VetFlo-1231 | |
| Light source | Laxco, Fisher Scientific | AMPSILED21 | |
| Mouse anesthesia nose cone | Braintree Scientific, Inc | XENO- M | |
| Needle driver | Fine Science Tools | 12002-12 | |
| Sterile cotton swabs | Texwipe, Fisher Scientific | 18-366-472 | |
| Sterile gauze pads | Covidien, Fisher Scientific | 22-037-907 | |
| Sterile saline (0.9%) | KD Medical, Fisher Scientific | 50-103-1363 | |
| Sterile surgical drapes | Fisher Scientific | 50-129-6666 | |
| Sterile surgical/downdraft table | |||
| Sterile suture pack (any suitable diameter for mouse wound closure) | Ethicon, Fisher Scientific | 50-209-2811 | |
| Surgical tools | |||
| Vinyl lab tape | Fisher Scientific | 15-901 |
Referanslar
- Loya, J., Zhang, C., Cox, E., Achrol, A. S., Kesari, S. Biological intratumoral therapy for the high-grade glioma part i: Intratumoral delivery and immunotoxins. CNS Oncol. 8 (3), (2019).
- Garfield, J., Dayan, A. D. Postoperative intracavitary chemotherapy of malignant gliomas. A preliminary study using methotrexate. J Neurosurg. 39 (3), 315-322 (1973).
- Kroin, J. S., Penn, R. D. Intracerebral chemotherapy: Chronic microinfusion of cisplatin. Neurosurgery. 10 (3), 349-354 (1982).
- Sendelbeck, S. L., Urquhart, J. Spatial distribution of dopamine, methotrexate and antipyrine during continuous intracerebral microperfusion. Brain Res. 328 (2), 251-258 (1985).
- Alter, R. A., et al. Long-term benefit of intra-arterial bevacizumab for recurrent glioblastoma. J Exp Ther Oncol. 12 (1), 67-71 (2017).
- Angelov, L., et al. Blood-brain barrier disruption and intra-arterial methotrexate-based therapy for newly diagnosed primary cns lymphoma: A multi-institutional experience. J Clin Oncol. 27 (21), 3503-3509 (2009).
- Chen, S. R., Chen, M. M., Ene, C., Lang, F. F., Kan, P. Perfusion-guided endovascular super-selective intra-arterial infusion for treatment of malignant brain tumors. J Neurointerv Surg. 14 (6), 533-538 (2022).
- Faltings, L., et al. Rechallenging recurrent glioblastoma with intra-arterial bevacizumab with blood brain-barrier disruption results in radiographic response. World Neurosurg. 131, 234-241 (2019).
- Srinivasan, V. M., et al. Advances in endovascular neuro-oncology: Endovascular selective intra-arterial (esia) infusion of targeted biologic therapy for brain tumors. J Neurointerv Surg. 12 (2), 197-203 (2020).
- Shinojima, N., et al. Tgf-β mediates homing of bone marrow-derived human mesenchymal stem cells to glioma stem cells. Cancer Res. 73 (7), 2333-2344 (2013).
- Liu, Z., et al. Improving orthotopic mouse models of patient-derived breast cancer brain metastases by a modified intracarotid injection method. Scientific Reports. 9 (1), 622 (2019).
- Zhang, C., Lowery, F. J., Yu, D. Intracarotid cancer cell injection to produce mouse models of brain metastasis. Journal of visualized experiments : JoVE. (120), e55085 (2017).
- Barone, F. C., Knudsen, D. J., Nelson, A. H., Feuerstein, G. Z., Willette, R. N. Mouse strain differences in susceptibility to cerebral ischemia are related to cerebral vascular anatomy. J Cereb Blood Flow Metab. 13 (4), 683-692 (1993).
- Benbenishty, A., et al. Maintaining unperturbed cerebral blood flow is key in the study of brain metastasis and its interactions with stress and inflammatory responses. Brain, behavior, and immunity. 62, 265-276 (2017).
- Doucette, T., et al. Mesenchymal stem cells display tumor-specific tropism in an rcas/ntv-a glioma model. Neoplasia. 13 (8), 716-725 (2011).
- Hata, N., et al. Platelet-derived growth factor bb mediates the tropism of human mesenchymal stem cells for malignant gliomas. Neurosurgery. 66 (1), 144-156 (2010).
- Nakamizo, A., et al. Human bone marrow-derived mesenchymal stem cells in the treatment of gliomas. Cancer Res. 65 (8), 3307-3318 (2005).
- Qiao, Y., et al. Magnetic resonance and photoacoustic imaging of brain tumor mediated by mesenchymal stem cell labeled with multifunctional nanoparticle introduced via carotid artery injection. Nanotechnology. 29 (16), 165101 (2018).
- Yong, R. L., et al. Human bone marrow-derived mesenchymal stem cells for intravascular delivery of oncolytic adenovirus delta24-rgd to human gliomas. Cancer Res. 69 (23), 8932-8940 (2009).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır