Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Shigella ile Epitel Hücre Enfeksiyonu Analizleri
Bu Makalede
Özet
Mevcut protokol, in vitro epitel hücre dizileri kullanılarak Shigella aderansı, invazyonu ve hücre içi replikasyonunu sorgulamak için enfeksiyon testlerini açıklamaktadır.
Özet
İnsan tarafından uyarlanmış enterik bakteriyel patojen Shigella, her yıl milyonlarca enfeksiyona neden olur, pediatrik hastalar arasında uzun vadeli büyüme etkileri yaratır ve dünya çapında ishal ölümlerinin önde gelen nedenidir. Enfeksiyon, patojenin gastrointestinal sistemden geçmesi ve kolonu kaplayan epitel hücrelerini enfekte etmesi sonucu sulu veya kanlı ishale neden olur. Antibiyotik direncindeki şaşırtıcı artışlar ve onaylanmış aşıların mevcut eksikliği nedeniyle, standartlaştırılmış araştırma protokolleri bu zorlu patojeni incelemek için kritik öneme sahiptir. Burada, kolonik epitel hücrelerinde bakteriyel aderans, invazyon ve hücre içi replikasyonun in vitro analizlerini kullanarak Shigella'nın moleküler patogenezini incelemek için metodolojiler sunulmaktadır. Enfeksiyon analizlerinden önce, Shigella kolonilerinin virülans fenotipi, Kongo kırmızı boyasının agar plakalarına alınmasıyla doğrulandı. Takviye edilmiş laboratuvar ortamı, in vivo koşulları taklit etmek için bakteri kültürü sırasında da düşünülebilir. Bakteri hücreleri daha sonra, enfeksiyonun her aşamasını analiz etmek için adaptasyonlarla belirlenmiş bir enfeksiyon çokluğunda doku kültürü plakalarındaki kolon epitel hücrelerini enfekte etmek için standart bir protokolde kullanılır. Aderans testleri için, Shigella hücreleri, epitel hücreleriyle bakteriyel teması teşvik etmek için azaltılmış ortam seviyeleri ile inkübe edilir. Hem invazyon hem de hücre içi replikasyon deneyleri için, hücre dışı bakterileri ortadan kaldırmak ve invazyonun değerlendirilmesini ve / veya hücre içi replikasyon oranlarının ölçülmesini sağlamak için çeşitli zaman aralıklarında gentamisin uygulanır. Tüm enfeksiyon protokolleri, enfekte epitel hücre lizatlarını seri olarak seyrelterek ve Kongo kırmızı agar plakaları üzerindeki enfekte titrelere göre bakteri kolonisi oluşturan birimleri kaplayarak yapışık, istila edilmiş ve/veya hücre içi bakterileri numaralandırır. Birlikte, bu protokoller, bu patojeni başarılı bir şekilde incelemek için epitel hücrelerinin Shigella enfeksiyonunun her aşaması için bağımsız karakterizasyon ve karşılaştırmalar sağlar.
Giriş
Enterik bakteriyel patojenlerin neden olduğu ishalli hastalıklar önemli bir küresel sağlık yüküdür. 2016 yılında, ishalli hastalıklar dünya çapında 1,3 milyon ölümden sorumluydu vebeş yaşından küçük çocuklarda dördüncü önde gelen ölüm nedeniydi 1,2. Gram-negatif, enterik bakteriyel patojen Shigella, dünya çapında ishal ölümlerinin önemli bir nedeni olan shigellozun etken maddesidir3. Shigellosis her yıl düşük ve orta gelirli ülkelerdeki çocuklarda önemli morbidite ve mortaliteye neden olurken, 4,5 yüksek gelirli ülkelerdeki enfeksiyonlar kreş, gıda kaynaklı ve su kaynaklı salgınlarlabağlantılıdır 6,7,8,9. Etkisiz aşı geliştirme10 ve artan antimikrobiyal direnç (AMR) oranları11,12, büyük ölçekli Shigella salgınlarının yönetimini karmaşıklaştırmıştır. Son Hastalık Kontrol ve Önleme Merkezleri verileri, Amerika Birleşik Devletleri'ndeki Shigella enfeksiyonlarının yaklaşık %46'sının 2020'de ilaç direnci gösterdiğinigösteriyor 13,14, Dünya Sağlık Örgütü ise Shigella'yı acilen yeni tedavilere ihtiyaç duyulan AMR öncelikli bir patojen olarak ilan etti15.
Shigella enfeksiyonları, kontamine yiyecek veya suyun yutulması üzerine fekal-oral yolla veya doğrudan insan teması yoluyla kolayca bulaşır. Shigella, hastalığa neden olmak için yeterli 10-100 bakteri dozu ile verimli, insana uyarlanmış bir patojen olarak gelişmiştir16. İnce bağırsak geçişi sırasında Shigella, yüksek sıcaklık ve safra gibi çevresel sinyallere maruz kalır17. Bu sinyallerin saptanması, bakterilerin insan kolonunu enfekte etme yeteneğini artıran virülans faktörlerini ifade etmek için transkripsiyonel değişiklikleri indükler 17,18,19. Shigella, apikal yüzeyden kolon epitelini istila etmez, bunun yerine folikülle ilişkili epitel20,21,22 içindeki özel antijen sunan mikro kıvrım hücrelerine (M hücreleri) alımını takiben epitel tabakası boyunca geçiş yapar. Transsitozu takiben, Shigella hücreleri yerleşik makrofajlar tarafından fagosite edilir. Shigella hızla fagozomdan kaçar ve makrofaj hücre ölümünü tetikleyerek proinflamatuar sitokinlerin salınmasına neden olur 5,23,24. Shigella daha sonra bazolateral taraftan kolon epitel hücrelerini istila eder, makropinositik vakuolün parçalanması ve sitoplazmada replikatif bir niş oluşturur 5,25. Pro-inflamatuar sitokinler, özellikle interlökin-8 (IL-8), polimorfonükleer nötrofil lökositleri (PMN'ler) enfeksiyon bölgesine toplar, bu da epitelyal sıkı bağlantıları zayıflatır ve bazolateral enfeksiyonu şiddetlendirmek için epitel astarının bakteriyel infiltrasyonunu sağlar5. PMN'ler, enfeksiyonu kontrol altına almak için enfekte epitel astarını tahrip eder, bu da basiller (kanlı) dizanteri5'in karakteristik semptomlarına neden olur. İnvazyon ve hücre içi replikasyon mekanizmaları kapsamlı bir şekilde karakterize edilmiş olsa da, yeni araştırmalar Shigella enfeksiyonunda gastrointestinal (GI) geçiş sırasında virülans regülasyonu17, aderans19, bariyer geçirgenliği26 yoluyla gelişmiş bazolateral erişim ve yetersiz beslenen çocuklarda asemptomatik taşıma27 dahil olmak üzere önemli yeni kavramları göstermektedir.
Shigella spp.'nin ishal hastalığına neden olma yeteneği insanlar ve insan olmayan primatlarla sınırlıdır (NHP)28. Zebra balığı 29, fareler30, kobaylar31, tavşanlar21,32,33 ve domuzlar34,35 için Shigella bağırsak enfeksiyonu modelleri geliştirilmiştir. Bununla birlikte, bu model sistemlerin hiçbiri, insan enfeksiyonu sırasında gözlemlenen hastalık özelliklerini doğru bir şekilde kopyalayamaz36. Shigella patogenezini incelemek için NHP shigellosis modelleri oluşturulmuş olsa da, bu model sistemlerin uygulanması pahalıdır ve insanların enfeksiyöz dozundan dokuz kat daha yüksek olan yapay olarak yüksek enfeksiyöz dozlar gerektirir 37,38,39,40,41,42. Bu nedenle, Shigella'nın insan konakçıların enfeksiyonu için dikkate değer adaptasyonu, Shigella patogenezinin doğru bir şekilde sorgulanması için fizyolojik olarak ilgili modelleri yeniden oluşturmak için insan kaynaklı hücre kültürlerinin kullanılmasını gerektirir.
Burada, HT-29 kolonik epitel hücrelerinde Shigella'nın yapışması, invazyonu ve replikasyon oranlarını ölçmek için ayrıntılı prosedürler açıklanmaktadır. Bu standartlaştırılmış protokoller kullanılarak, bakteriyel virülans genlerinin ve çevresel sinyallerin Shigella enfeksiyonunun her adımını etkilediği moleküler mekanizmalar, dinamik konakçı-patojen etkileşimi ilişkisini daha iyi anlamak için sorgulanabilir.
Protokol
1. Reaktiflerin ve malzemelerin hazırlanması
NOT: Tüm hacimler, iki adet 6 oyuklu plaka kullanan bir tahlil ile tutarlıdır.
- TSB ortamı: 15 g Triptik Soya Suyu (TSB, Malzeme Tablosuna bakınız) ortamına ve otoklava 0,5 L deiyonize (DI) su ekleyin. Oda sıcaklığında saklayın.
- Safra tuzları ortamı (TSB + BS): % 0.4 (a / h) safra tuzları içeren TSB'yi hazırlamak için, 15 mL otoklavlanmış TSB içinde 0.06 g safra tuzunu (BS, Malzeme Tablosuna bakınız) yeniden süspanse edin. Filtre, 0,22 μm PES filtresi kullanarak sterilize edilir.
NOT: Safra tuzları, 1:1 sodyum kolat ve sodyum deoksikolat karışımından oluşur. Kullanmadan hemen önce yeni ortam hazırlayın. - DMEM +% 10 (h / h) FBS: 45 mL Dulbecco'nun Modifiye Eagle Medium'una (DMEM) 5 mL fetal sığır serumu (FBS) ekleyin. 4 °C'de saklayın.
- DMEM + gentamisin: 50 mL'lik bir tüpe 50 mL DMEM ve 50 μL 50 mg/mL gentamisin ekleyin (bkz.
NOT: Her deneyden önce taze alikot yapın ve 37 °C'lik bir su banyosunda ısıtın. - PBS +% 1 (h / h) Triton X-100: 150 μL Triton X-100 ila 15 mL Fosfat tamponlu salin (PBS) ekleyin.
NOT: Her deneyden önce taze alikot yapın ve 37 °C'lik bir su banyosunda ısıtın. - TSB + Kongo kırmızı gösterge plakaları: 1 L'lik bir şişeye 15 g TSB, 7,5 g seçkin agar ve 0,125 g Kongo kırmızı boyası ( Malzeme Tablosuna bakınız) ekleyin. 0,5 L DI su ve otoklav ekleyin. Ayrı steril Petri kaplarına (100 mm x 15 mm) 10-20 mL ortam dökün ve katılaşmasına izin verin.
DİKKAT: Kongo kırmızısı kanserojendir ve üreme toksinidir. Kongo kırmızısının işlenmesinin uygun kişisel koruyucu ekipman kullanılarak yapıldığından emin olun. Daha fazla bilgi için ürün güvenlik bilgi formuna bakın.
NOT: 0,5 L Kongo kırmızı malzemesinden yaklaşık 20 plaka yapılmıştır. Plakalar 2-3 gün önceden hazırlanabilir ve kullanıma kadar oda sıcaklığında ters çevrilmiş halde bırakılabilir. Uzun süreli saklama için, ters çevrilmiş plakaları 3 aya kadar 4 °C'de plastik kılıflara yerleştirin. - DMEM +% 10 (h / h) FBS ve% 5 (h / h) dimetil sülfoksit (DMSO): 50 mL'lik bir tüpe 42.5 mL DMEM, 5 mL FBS ve 2.5 mL DMSO ekleyin. 4 °C'de saklayın.
2. Bakterilerin hazırlanması
NOT: Tüm Shigella laboratuvar yetiştirme ve depolama protokolleri Payne, S. M.43'ten uyarlanmıştır.
DİKKAT: Shigella spp. Risk Grubu 2 patojenleridir44. Tüm laboratuvar çalışmalarını, Shigella spp.'nin düşük bulaşıcı dozu nedeniyle kazara maruziyetleri sınırlamak için alınan ek güvenlik önlemleri ile bir BSL-2 ortamında gerçekleştirin.
- Shigella'nın donmuş stoklardan büyümesi
- Steril bir aplikatör kullanarak kriyojenik flakondan az miktarda donmuş kültürü bir TSB + Kongo kırmızı agar plakasına aktarın.
- Bir aşılama döngüsünü alevle sterilize edin ve soğumaya bırakın. İnokulumu plakanın bir çeyreği boyunca ileri geri hareket ettirin. Halkayı alevlendirin, soğumaya bırakın, ardından ilk kadrandan plakanın ikinci çeyreğine doğru çizin. Aşılamayı plakanın üçüncü ve dördüncü kadranlarına sürmek için tekrarlayın.
NOT: Alternatif olarak, her kadran arasında yeni bir steril aplikatör kullanarak aşılamayı çizgileyin. - Plakayı ters çevirin ve gece boyunca 37 °C'de inkübe edin.
NOT: Kongo kırmızı-pozitif (CR+) fenotipi45'in gözlemlenmesi için gerekli olan Shigella virülans faktörlerinin ekspresyonu için ≥37 °C sıcaklıklarda inkübasyon gereklidir. Avirulent koloniler beyaz bir görünüme sahip olacak ve istilacı olmayacaktır. - Plakayı parafin filmle kapatın ve 4 °C'de buzdolabında saklayın.
NOT: Bakteri kolonileri agar plakalarında 1-2 hafta canlı kalacaktır.
- Shigella'nın sıvı kültürde bir gecede büyümesi
- 3 mL TSB ortamını steril 14 mL kültür tüplerine alın.
- Steril bir aplikatör kullanarak tek, iyi izole edilmiş kırmızı (CR +) bir koloni seçin ve sıvı ortamda yeniden süspanse edin.
- Kültürleri gece boyunca (16-18 saat) 37 ° C'de dakikada 250 devirde (rpm) çalkalayarak inkübe edin.
3. HT-29 ökaryotik hücrelerin hazırlanması
NOT: Tüm hacimler, iki adet 6 oyuklu plaka kullanan bir tahlil ile tutarlıdır. HT-29 hücre hatları, Amerikan Tipi Kültür Koleksiyonu'ndan (ATCC) elde edildi. HT-29 bakım protokolleri, ATCC tavsiyelerinden46 uyarlanmıştır. Tüm ortamlar kullanımdan önce 37 °C'de bir su banyosunda önceden ısıtılmalıdır. Tüm HT-29 bakım protokolleri bir biyogüvenlik kabininde gerçekleştirilmelidir. pH'ta dramatik değişikliklerden kaçınmak için ortamdaki HT-29 hücrelerini karıştırırken/çalışırken kabarcık üretmekten kaçının.
- HT-29 hücrelerinin donmuş stoktan çözülmesi
- HT-29 hücrelerinin şişesini 37 ° C'lik bir su banyosunda çözdürün.
NOT: Kirlenmeyi önlemek için kapağın tamamen suyun üzerinde kaldığından emin olun. Çözdürme işlemi 2 dakikadan az sürmelidir. - Kültür tamamen çözüldükten hemen sonra şişeyi sudan çıkarın ve% 70 etanol ile dekontamine edin. Bu noktadan itibaren tüm adımların aseptik teknikler kullanılarak gerçekleştirildiğinden emin olun.
- Şişenin tüm içeriğini 9 mL DMEM +% 10 FBS içeren 15 mL'lik bir santrifüj tüpüne ekleyin. Oda sıcaklığında 5 dakika boyunca 125 x g'da santrifüjleyin.
- Süpernatanı bir atık kabına boşaltın ve peleti 10 mL sıcak DMEM +% 10 FBS içinde yeniden süspanse edin. Süspanse hücreleri, 10 mL sıcak DMEM +% 10 FBS (toplam hacim 20 mL) içeren 75cm2'lik bir doku kültürü şişesine (T75) aktarın.
- Hücreleri% 90 birleşmeye ulaşana kadar (yaklaşık 6-7 gün) hücreleri% 5 CO2 ile 37 ° C'de inkübe edin.
NOT: Birleşme görsel yaklaşımla tahmin edilir.
- HT-29 hücrelerinin şişesini 37 ° C'lik bir su banyosunda çözdürün.
- HT-29 hücrelerinin tohumlanması
- 37 °C su banyosunda 20 mL PBS ve 50 mL DMEM +% 10 FBS'yi önceden ısıtın ve 3 mL% 0.25 (a / h) Tripsin-EDTA'yı oda sıcaklığına önceden ısıtın.
- HT-29 hücreleri (adım 3.1'den itibaren) %90 birleşmeye ulaştığında, HT-29 hücre kültürü ortamını T75 şişesinden bir atık kabına boşaltın. Şişeye ~ 10 mL ılık PBS dökün ve yıkamak için hafifçe döndürün. PBS'yi bir atık kabına boşaltın. Tekrar ılık PBS ile yıkayın ve boşaltın.
- 2-3 mL% 0.25 (a / h) Tripsin-EDTA ekleyin ve tüm yüzey alanı boyunca hafifçe döndürün. 37 °C'de %5 CO2 ile 4 dakika inkübe edin.
- Şişeyi inkübatörden çıkarın ve Tripsin-EDTA'yı hafifçe döndürerek tüm hücrelerin yüzeyden ayrılmasını sağlayın.
- Tripsin'i devre dışı bırakmak için hemen 6 mL ılık DMEM +% 10 FBS ekleyin. İyice karıştırmak için yukarı ve aşağı pipetleyin.
- Tüm içeriği 15 mL'lik bir santrifüj tüpüne aktarın ve oda sıcaklığında 5 dakika boyunca 500 x g'da döndürün.
- Süpernatanı bir atık kabına nazikçe boşaltın ve peleti 6 mL ılık DMEM +% 10 FBS içinde yeniden süspanse edin.
- Yeniden süspansiyondan hemen sonra, 10 μL askıda HT-29 hücrelerini kültürün ortasından 0.2 mL'lik bir PCR tüpüne aktarın. PCR tüpüne 10 μL Tripan mavi boya ekleyin ve karıştırın.
- Tek kullanımlık bir Kontes hücre sayaç odası slaytına 10 μL HT-29 hücre / Tripan mavisi karışımı ekleyin (Malzeme Tablosuna bakın). Canlı hücrelerin sayısını numaralandırın ve hücre canlılığını hesaplayın.
NOT: Örnekteki hücre sayısını belgelerken, toplam hücre sayısını değil, "canlı" hücre sayısı altındaki sayıyı okuyun. Alternatif olarak, hücre sayımı bir hemositometre kullanılarak manuel olarak gerçekleştirilebilir. - Tohum, HT-29 hücrelerini taze bir T75 şişesine veya 6 oyuklu plakaya yeniden süspanse etti.
- T75 şişesi için:
- Karıştırmak için nazikçe pipetleyin, ardından aşağıdaki denkleme göre 2,5 x 106 hücreyi taze bir T75 şişesine aktarın:
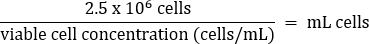
- 20 mL'lik bir son hacme (1.25 x 10 5 hücre / mL son konsantrasyon) sıcak DMEM +%10 FBS ortamı ekleyin.
- Hafifçe ileri geri sallayarak hücreleri şişe boyunca eşit şekilde dağıtın.
- Hücreler% 80 birleşmeye ulaşana kadar% 5 CO2 ile 37 ° C'de inkübe edin.
NOT: Optimum büyüme için, T75 şişesindeki DMEM + %10 FBS ortamını ~3 günde bir değiştirin. Ortamı bir atık kabına boşaltın ve şişeye 10 mL sıcak PBS ekleyin. PBS'yi yavaşça döndürün ve atık kabına boşaltın. Daha sonra şişeye 20 mL taze, ılık DMEM +% 10 FBS ekleyin ve 37 ° C,% 5 CO2 inkübatöre geri dönün.
- Karıştırmak için nazikçe pipetleyin, ardından aşağıdaki denkleme göre 2,5 x 106 hücreyi taze bir T75 şişesine aktarın:
- 6 oyuklu plaka için:
- Karıştırmak için hafifçe pipetleyin, ardından aşağıdaki denkleme göre 5,85 x 106 hücreyi 50 mL'lik yeni bir konik tüpe aktarın:
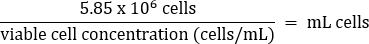
- 26 mL'lik bir son hacme (2.25 x 10 5 hücre / mL son konsantrasyon) sıcak DMEM +%10 FBS ortamı ekleyin.
- Karıştırmak için nazikçe pipetleyin, ardından 2 mL'yi (4,5 x 105 hücre) 6 oyuklu plakaların ayrı kuyucuklarına dağıtın.
- Hafifçe yukarı/aşağı ve sola/sağa 2-3x sallayarak hücreleri kuyu boyunca eşit şekilde dağıtın.
- Hücreler %80-95 birleşmeye ulaşana kadar (yaklaşık 3-4 gün) %5 CO2 ile 37 °C'de inkübe edin.
NOT: İnvazyon ve hücre içi replikasyon deneyleri için %85 birleşme önerilirken, yapışma deneyleri için %90-95 birleşme önerilir. Hücreler, yaklaşık 1 x 106 hücre / kuyu nihai konsantrasyonu ile 48 saatlik inkübasyondan sonra ~% 85 birleşmeye ulaşmalıdır. Ekilen hücre sayısında ve inkübasyon uzunluğunda ayarlamalar gerekebilir.
- Karıştırmak için hafifçe pipetleyin, ardından aşağıdaki denkleme göre 5,85 x 106 hücreyi 50 mL'lik yeni bir konik tüpe aktarın:
- T75 şişesi için:
- HT-29 stoklarının dondurulması
- 1 mL DMEM +% 10 FBS +% 5 DMSO ortamını ayrı kriyojenik şişelere ekleyin.
- Her şişeye adım 3.2.7'den 1 x 106 HT-29 hücresi ekleyin. Hücrelerin hacmini aşağıdaki formüle göre hesaplayın:
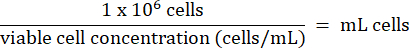
- HT-29 hücrelerini sıvı nitrojen buharı depolama dondurucusunda -130 ° C'nin altında uzun süre saklayın.
4. Bağlılık testi
NOT: Tüm hacimler, iki adet 6 oyuklu plaka kullanan bir tahlil ile tutarlıdır.
- Alt kültür bir gecede Shigella kültürleri 1:50 oranında seyreltilerek taze ortama dönüştürülür.
- Vorteks, daha sonra uygun büyüklükte bir kültür tüpünde 5 mL taze TSB veya TSB + BS'ye her gece kültüründen 100 μL ekleyin.
NOT: Uygun havalandırmayı sağlamak için kültür hacmini kültür şişesi veya tüp hacminin %<20'si ile sınırlayın. - Hücreler 0.7'lik bir optik yoğunluğa (OD600) ulaşana kadar ( Shigella büyümesinin orta log fazı) 250 rpm'de çalkalayarak 37 ° C'de inkübe edin; yaklaşık 2-2,5 saat.
NOT: Alt kültür sırasında, tüm yıkama adımları için 50 mL DMEM ve yeterli hacimde PBS alın ve 37 ° C'lik bir su banyosuna koyun. Kullanmadan önce ortamın 37 °C'ye ulaşmasını bekleyin.
- Vorteks, daha sonra uygun büyüklükte bir kültür tüpünde 5 mL taze TSB veya TSB + BS'ye her gece kültüründen 100 μL ekleyin.
- 2 x 108 koloni oluşturan birim (CFU) alt kültürlenmiş Shigella'yı ayrı 2 mL mikrosantrifüj tüplerine aktarın.
NOT: 2 x 108 CFU, 0.7'lik bir OD600'de yaklaşık 1 mL bakteri hücresine karşılık gelir. Her bir spektrofotometrenin kalibrasyonuna göre CFU/mL'yi yaklaşık olarak hesaplamak için OD600 okumalarını kullanın. - Her Shigella örneğini 2x PBS ile yıkayın.
- Oda sıcaklığında 2 dakika boyunca 17.000 x g'da santrifüjleme ile pelet hücreleri. Süpernatanı aspire edin, ardından 1 mL ılık PBS ekleyin ve karışım tamamen homojen olana kadar (8-10x) numuneyi hafifçe yukarı ve aşağı pipetleyerek peleti iyice süspanse edin.
- Adım 4.3.1'i 1x ek süre tekrarlayın.
- Oda sıcaklığında 2 dakika boyunca 17.000 x g'da santrifüjleme yoluyla pelet hücreleri, süpernatanı aspire edin ve peletleri 2 mL ılık DMEM'de yeniden süspanse edin.
NOT: Yeniden süspanse edilmiş bakterilerin nihai konsantrasyonu 1 x 108 CFU/mL olacaktır.
- Vorteks, daha sonra 6 oyuklu plakalarda (adım 3.2.10.2'den itibaren) hazırlanan HT-29 kolonik epitel tek katmanlarının her bir oyuğuna 1 mL (1 x 108 CFU) yeniden süspanse Shigella ekleyin.
NOT: Enfeksiyonlar normalde 100 enfeksiyon çokluğunda (MOI; bakteriyel/epitel hücrelerine oranı) gerçekleştirilir. Farklı MOI'leri test etmek için, yeniden süspanse edilmiş Shigella'yı ılık DMEM'de istenen konsantrasyona seyreltin, ardından HT-29 tek katmanlarına 1 mL seyreltilmiş bakteri ekleyin. Örneğin, 10'luk bir MOI'yi test etmek için, 1.35 mL sıcak DMEM'e 150 μL 1 x 108 CFU / mL bakteri ekleyerek bakterileri 1:10 oranında seyreltin, ardından HT-29 hücrelerine 1 mL (1 x 107 CFU) uygulayın. - 6 oyuklu plakaları 37 ° C'de% 5 CO2 ile 3 saat inkübe edin.
- Kuluçka sırasında bakteriyel enfeksiyon titresini belirleyin.
- Yeniden süspanse edilmiş Shigella hücrelerinin (adım 4.3.3'ten itibaren) PBS'ye 10 kat seri dilüsyonlarını hazırlayın.
- 1 x 10-5 ve 1 x 10-6 dilüsyonların 100 μL'sini TSB + Kongo kırmızı plakalarına yerleştirin ve gece boyunca 37 °C'de inkübe edin.
NOT: 1 x 10-5 ve 1 x 10-6 seyreltmelerden 100 μL kaplama, sırasıyla 1 x 10-6 ve 1 x 10-7'lik bir nihai seyreltme faktörüne karşılık gelir.
- İnkübasyondan sonra, tek katmanları 4-5x PBS ile yıkayın.
- Her kuyudan medyayı aspire edin.
NOT: 6 oyuklu plakalardan ortam aspire ederken, HT-29 hücreleriyle temastan kaçınmaya çalışarak aspiratörün ucunu kuyucukların alt tarafı boyunca yönlendirin. - Her kuyucuğa 1 mL ılık PBS ekleyin ve nazikçe yıkayın.
NOT: 6 kuyucuklu tek katmanları PBS ile nazikçe yıkamak için, plakayı tezgah üzerinde yukarı ve aşağı ve yan yana hareket ettirin. Plakaların dairesel hareketlerle yıkanması ve/veya plakanın tezgah yüzeyinden çıkarılması, hücrelerin plastikten mekanik olarak çıkarılmasına neden olabilir. - 4.7.1 ve 4.7.2 adımlarını 4 kez daha tekrarlayın.
- Her kuyudan medyayı aspire edin.
- PBS'yi aspirasyonla çıkarın ve her oyuğa 1 mL PBS +% 1 Triton X-100 ekleyerek HT-29 hücrelerini parçalayın.
- 6 oyuklu plakaları 37 °C'de 5 dakika inkübe edin.
- Parçalanmış hücreleri kuyu dibinden kazımak için bir hücre kazıyıcı veya bükülmüş bir pipet ucu kullanın ve 1 mL'nin tamamını 1.7 mL'lik yeni bir mikrosantrifüj tüpüne aktarın.
- Hücre ile ilişkili bakteri sayısını belirleyin.
- Shigella'yı parçalanmış ökaryotik hücrelerden daha fazla uzaklaştırmak için her tüpü (adım 4.10'dan itibaren) en az 30 saniye boyunca vorteksleyin.
- PBS'ye 10 kat seri lizat dilüsyonları hazırlayın.
- 1 x 10-2, 1 x 10-3 ve 1 x 10-4 dilüsyonların 100 μL'sini TSB + Kongo kırmızı plakalarına yerleştirin ve gece boyunca 37 °C'de inkübe edin.
NOT: 1 x 10-2, 1 x 10-3 ve 1 x 10-4 seyreltmelerden 100 μL kaplama, sırasıyla 1 x 10-3, 1 x 10-4 ve 1 x 10-5'lik bir nihai seyreltme faktörüne karşılık gelir.
5. İstila testi
NOT: Tüm hacimler, iki adet 6 oyuklu plaka kullanan bir tahlil ile tutarlıdır.
- Alt kültür bir gecede Shigella kültürleri 1:50 oranında seyreltilerek taze ortama dönüştürülür.
- Vorteks, daha sonra uygun büyüklükte bir kültür tüpünde 5 mL taze TSB veya TSB + BS'ye her gece kültüründen 100 μL ekleyin.
NOT: Uygun havalandırmayı sağlamak için kültür hacmini kültür şişesi veya tüp hacminin %<20'si ile sınırlayın. - Hücreler 0.7'lik bir OD600'e ( Shigella büyümesinin orta log fazı) ulaşana kadar 250 rpm'de çalkalayarak 37 ° C'de inkübe edin; yaklaşık 2-2,5 saat.
NOT: Alt kültür sırasında, tüm yıkama adımları için 50 mL DMEM + 50 mg / mL gentamisin ve yeterli miktarda PBS alın ve 37 ° C'lik bir su banyosuna koyun. Kullanmadan önce ortamın 37 °C'ye ulaşmasını bekleyin.
- Vorteks, daha sonra uygun büyüklükte bir kültür tüpünde 5 mL taze TSB veya TSB + BS'ye her gece kültüründen 100 μL ekleyin.
- 2 x 108 CFU subkültürlenmiş Shigella'yı ayrı 2 mL mikrosantrifüj tüplerine aktarın.
NOT: 2 x 108 CFU, 0.7'lik bir OD600'de yaklaşık 1 mL bakteri hücresine karşılık gelir. Her bir spektrofotometrenin kalibrasyonuna göre CFU/mL'yi yaklaşık olarak hesaplamak için OD600 okumalarını kullanın. - Shigella örneklerini 1x PBS ile yıkayın.
- Oda sıcaklığında 2 dakika boyunca 17.000 x g'da santrifüjleme ile pelet hücreleri. Süpernatanı aspire edin, ardından 1 mL ılık PBS ekleyin ve karışım tamamen homojen olana kadar (8-10x) numuneyi hafifçe yukarı ve aşağı pipetleyerek peleti iyice süspanse edin.
- Adım 5.3.1'i tekrarlayın. 1x ek süre.
- Oda sıcaklığında 2 dakika boyunca 17.000 x g'da santrifüjleme yoluyla pelet hücreleri, süpernatanı aspire edin ve peletleri 2 mL ılık DMEM'de yeniden süspanse edin.
NOT: Yeniden süspanse edilmiş bakterilerin nihai konsantrasyonu 1 x 108 CFU/mL olacaktır.
- Vorteks, daha sonra 6 oyuklu plakalarda (adım 3.2.10.2'den itibaren) hazırlanan HT-29 kolonik epitel tek katmanlarının her bir oyuğuna 1 mL (1 x 108 CFU) yeniden süspanse Shigella artı 1 mL DMEM ekleyin.
NOT: Enfeksiyonlar normalde 100 enfeksiyon çokluğunda (MOI; bakteriyel/epitel hücrelerine oranı) gerçekleştirilir. Farklı MOI'leri test etmek için, DMEM'de yeniden süspanse edilmiş Shigella'yı istenen konsantrasyona seyreltin, ardından HT-29 tek katmanlarına 1 mL seyreltilmiş bakteri ekleyin. Örneğin, 10'luk bir MOI'yi test etmek için, 1.35 mL DMEM'e 150 μL 1 x 108 CFU / mL bakteri ekleyerek bakterileri 1:10 oranında seyreltin, ardından HT-29 hücrelerine 1 mL (1 x 107 CFU) ekleyin. - HT-29 hücreleri ile bakteriyel teması teşvik etmek için, 6 oyuklu plakaları 2.000 x g'da oda sıcaklığında 10 dakika veya sıcaklık ayarı ayarlanabiliyorsa 37 °C'de santrifüjleyin.
NOT: Santrifüjleme, yapışma faktörlerine olan ihtiyacı atlayan ve bakterilerin hücreleri hızla istila etmesine izin veren HT-29 hücreleri ile bakteriyel teması teşvik eder. - 6 oyuklu plakaları 37 °C'de %5CO2 ile 45 dakika inkübe edin.
- Kuluçka sırasında bakteriyel enfeksiyon titresini belirleyin.
- Yeniden süspanse edilmiş Shigella hücrelerinin (adım 5.3.3'ten itibaren) PBS'ye 10 kat seri dilüsyonlarını hazırlayın.
- 1 x 10-5 ve 1 x 10-6 dilüsyonların 100 μL'sini TSB + Kongo kırmızı plakalarına yerleştirin ve gece boyunca 37 °C'de inkübe edin.
NOT: 1 x 10-5 ve 1 x 10-6 seyreltmelerden 100 μL kaplama, sırasıyla 1 x 10-6 ve 1 x 10-7'lik bir nihai seyreltme faktörüne karşılık gelir.
- Enfekte olmuş HT-29 hücrelerini 3x 1 mL PBS ile iyice yıkayın.
- Her kuyudan medyayı aspire edin.
NOT: 6 oyuklu plakalardan ortam aspire ederken, HT-29 hücreleriyle temastan kaçınmaya çalışarak aspiratörün ucunu kuyucukların alt tarafı boyunca yönlendirin. - Her kuyucuğa 1 mL ılık PBS ekleyin ve nazikçe yıkayın.
NOT: 6 kuyucuklu tek katmanları PBS ile nazikçe yıkamak için, plakayı tezgah üzerinde yukarı ve aşağı ve yan yana hareket ettirin. Plakaların dairesel hareketlerle yıkanması ve/veya plakanın tezgah yüzeyinden çıkarılması, hücrelerin plastikten mekanik olarak çıkarılmasına neden olabilir. - 5.8.1 ve 5.8.2 adımlarını 2 kez daha tekrarlayın.
- Her kuyudan medyayı aspire edin.
- PBS'yi aspirasyonla çıkarın, ardından her bir oyuğa 50 μg / mL gentamisin ile desteklenmiş 2 mL ılık DMEM ekleyin ve% 5 CO2 ile 37 ° C'de 30 dakika inkübe edin.
- Enfekte olmuş HT-29 hücrelerini 3x 1 mL PBS ile iyice yıkayın.
- Yıkama adımı 5.8'i tekrarlayın.
- PBS'yi aspirasyonla çıkarın, daha sonra her bir oyuğa 50 μg / mL gentamisin ile desteklenmiş 2 mL ılık DMEM ekleyin ve% 5 CO2 ile 37 ° C'de 60 dakika inkübe edin.
- Enfekte olmuş HT-29 hücrelerini 3x 1 mL PBS ile iyice yıkayın.
- Yıkama adımı 5.8'i tekrarlayın.
- PBS'yi aspirasyonla çıkarın ve her oyuğa 1 mL PBS +% 1 Triton X-100 ekleyerek HT-29 hücrelerini parçalayın.
- 6 oyuklu plakaları 37 °C'de 5 dakika inkübe edin.
- Parçalanmış hücreleri kuyu dibinden kazımak için bir hücre kazıyıcı veya bükülmüş bir pipet ucu kullanın ve 1 mL'nin tamamını 1.7 mL'lik yeni bir mikrosantrifüj tüpüne aktarın.
- Hücre içi bakteri sayısını belirleyin.
- Shigella'yı parçalanmış ökaryotik hücrelerden daha fazla uzaklaştırmak için her tüpü (adım 5.15'ten itibaren) en az 30 saniye boyunca vorteksleyin.
- PBS'ye 10 kat seri lizat dilüsyonları hazırlayın.
- 1 x 10-2 ve 1 x 10-3 dilüsyonların 100 μL'sini TSB + Kongo kırmızı plakalarına yerleştirin ve gece boyunca 37 °C'de inkübe edin.
NOT: 1 x 10-2 ve 1 x 10-3 dilüsyonlardan 100 μL kaplama, sırasıyla 1 x 10-3 ve 1 x 10-4'lük bir nihai seyreltme faktörüne karşılık gelir.
6. Hücre içi replikasyon testi
NOT: Tüm hacimler, iki adet 6 oyuklu plaka kullanan bir tahlil ile tutarlıdır.
- Alt kültür bir gecede Shigella kültürleri 1:50 oranında seyreltilerek taze ortama dönüştürülür.
- Vorteks, daha sonra uygun büyüklükte bir kültür tüpünde 5 mL taze TSB veya TSB + BS'ye her gece kültüründen 100 μL ekleyin.
NOT: Uygun havalandırmayı sağlamak için kültür hacmini kültür şişesi veya tüp hacminin %<20'si ile sınırlayın. - Hücreler 0.7'lik bir OD600'e ( Shigella büyümesinin orta log fazı) ulaşana kadar 250 rpm'de çalkalayarak 37 ° C'de inkübe edin; yaklaşık 2-2,5 saat.
NOT: Alt kültür sırasında, tüm yıkama adımları için 50 mL DMEM + 50 mg / mL gentamisin ve yeterli miktarda PBS alın ve 37 ° C'lik bir su banyosuna koyun. Kullanmadan önce ortamın 37 °C'ye ulaşmasını bekleyin.
- Vorteks, daha sonra uygun büyüklükte bir kültür tüpünde 5 mL taze TSB veya TSB + BS'ye her gece kültüründen 100 μL ekleyin.
- 2 x 108 CFU subkültürlenmiş Shigella'yı ayrı 2 mL mikrosantrifüj tüplerine aktarın.
NOT: 2 x 108 CFU, 0.7'lik bir OD600'de yaklaşık 1 mL bakteri hücresine karşılık gelir. Her bir spektrofotometrenin kalibrasyonuna göre CFU/mL'yi yaklaşık olarak hesaplamak için OD600 okumalarını kullanın. - Shigella örneklerini 1x PBS ile yıkayın.
- Oda sıcaklığında 2 dakika boyunca 17.000 x g'da santrifüjleme ile pelet hücreleri. Süpernatanı aspire edin, ardından 1 mL ılık PBS ekleyin ve karışım tamamen homojen olana kadar (8-10x) numuneyi hafifçe yukarı ve aşağı pipetleyerek peleti iyice süspanse edin.
- 6.3.1 adımını tekrarlayın. 1x ek süre.
- Oda sıcaklığında 2 dakika boyunca 17.000 x g'da santrifüjleme yoluyla pelet hücreleri, süpernatanı aspire edin ve peletleri 2 mL ılık DMEM'de yeniden süspanse edin.
NOT: Yeniden süspanse edilmiş bakterilerin nihai konsantrasyonu 1 x 108 CFU/mL olacaktır.
- Vorteks, daha sonra 6 oyuklu plakalarda (adım 3.2.10.2'den itibaren) hazırlanan HT-29 kolonik epitel tek katmanlarının her bir oyuğuna 1 mL (1 x 108 CFU) yeniden süspanse Shigella artı 1 mL DMEM ekleyin.
NOT: Enfeksiyonlar normalde 100 enfeksiyon çokluğunda (MOI; bakteriyel/epitel hücrelerine oranı) gerçekleştirilir. Farklı MOI'leri test etmek için, DMEM'de yeniden süspanse edilmiş Shigella'yı istenen konsantrasyona seyreltin, ardından HT-29 tek katmanlarına 1 mL seyreltilmiş bakteri ekleyin. Örneğin, 10'luk bir MOI'yi test etmek için, 1.35 mL DMEM'e 150 μL 1 x 108 CFU / mL bakteri ekleyerek bakterileri 1:10 oranında seyreltin, ardından HT-29 hücrelerine 1 mL (1 x 107 CFU) uygulayın. - HT-29 hücreleri ile bakteriyel teması teşvik etmek için, 6 oyuklu plakaları 2.000 x g'da oda sıcaklığında 10 dakika veya sıcaklık ayarı ayarlanabiliyorsa 37 °C'de santrifüjleyin.
NOT: Santrifüjleme, yapışma faktörlerine olan ihtiyacı atlayan ve bakterilerin hücreleri hızla istila etmesine izin veren HT-29 hücreleri ile bakteriyel teması teşvik eder. - 6 oyuklu plakaları 37 °C'de %5CO2 ile 45 dakika inkübe edin.
- Kuluçka sırasında bakteriyel enfeksiyon titresini belirleyin.
- Yeniden süspanse edilmiş Shigella hücrelerinin (adım 6.3.3'ten itibaren) PBS'ye 10 kat seri dilüsyonlarını hazırlayın.
- 1 x 10-5 ve 1 x 10-6 dilüsyonların 100 μL'sini TSB + Kongo kırmızı plakalarına yerleştirin ve gece boyunca 37 °C'de inkübe edin.
NOT: 1 x 10-5 ve 1 x 10-6 seyreltmelerden 100 μL kaplama, sırasıyla 1 x 10-6 ve 1 x 10-7'lik bir nihai seyreltme faktörüne karşılık gelir.
- Enfekte olmuş HT-29 hücrelerini 3x 1 mL PBS ile iyice yıkayın.
- Her kuyudan medyayı aspire edin.
NOT: 6 oyuklu plakalardan ortam aspire ederken, HT-29 hücreleriyle temastan kaçınmaya çalışarak aspiratörün ucunu kuyucukların alt tarafı boyunca yönlendirin. - Her kuyucuğa 1 mL ılık PBS ekleyin ve nazikçe yıkayın.
NOT: 6 kuyucuklu tek katmanları PBS ile nazikçe yıkamak için, plakayı tezgah üzerinde yukarı ve aşağı ve yan yana hareket ettirin. Plakaların dairesel hareketlerle yıkanması ve/veya plakanın tezgah yüzeyinden çıkarılması, hücrelerin plastikten mekanik olarak çıkarılmasına neden olabilir. - 6.8.1 ve 6.8.2 adımlarını 2 kez daha tekrarlayın.
- Her kuyudan medyayı aspire edin.
- PBS'yi aspirasyonla çıkarın, ardından her bir oyuğa 50 μg / mL gentamisin ile desteklenmiş 2 mL ılık DMEM ekleyin ve% 5 CO2 ile 37 ° C'de 30 dakika inkübe edin.
- Enfekte olmuş HT-29 hücrelerini 3x 1 mL PBS ile iyice yıkayın.
- Yıkama adımı 6.8'i tekrarlayın.
- PBS'yi aspirasyonla çıkarın, daha sonra 6 oyuklu plakaların her bir oyuğuna 50 μg / mL gentamisin ile 2 mL ılık DMEM ekleyin ve hücre içi replikasyona izin vermek için istenen süre boyunca% 5 CO2 ile% 37 ° C'de inkübe edin (24 saate kadar).
- Hücreleri 2x 1 mL PBS ile iyice yıkayın.
- Yıkama adımı 6.8'i tekrarlayın.
- PBS'yi aspirasyonla çıkarın ve her oyuğa 1 mL PBS +% 1 Triton X-100 ekleyerek HT-29 hücrelerini parçalayın.
- 6 oyuklu plakaları 37 °C'de 5 dakika inkübe edin.
- Parçalanmış hücreleri kuyu dibinden kazımak için bir hücre kazıyıcı veya bükülmüş pipet ucu kullanın ve 1 mL'nin tamamını 1.7 mL'lik yeni bir mikrosantrifüj tüpüne aktarın.
- Hücre içi bakteri sayısını belirleyin.
- Shigella'yı parçalanmış ökaryotik hücrelerden daha fazla uzaklaştırmak için her tüpü (adım 6.15'ten itibaren) en az 30 saniye boyunca vorteksleyin.
- PBS'ye 10 kat seri lizat dilüsyonları hazırlayın.
- 1 x 10-2, 1 x 10-3 ve 1 x 10-4 dilüsyonların 100 μL'sini TSB + Kongo Kırmızısı plakalarına yerleştirin ve gece boyunca 37 °C'de inkübe edin.
NOT: 1 x 10-2, 1 x 10-3 ve 1 x 10-4 seyreltmelerden 100 μL kaplama, sırasıyla 1 x 10-3, 1 x 10-4 ve 1 x 10-5'lik bir nihai seyreltme faktörüne karşılık gelir.
Sonuçlar
Aderans, invazyon ve hücre içi replikasyon testleri, S. flexneri 2457T vahşi tip (WT) ile Shigella virülansını negatif olarak düzenlediği varsayılan bir mutant olan S. flexneri ΔVF (ΔVF) karşılaştırılarak gerçekleştirildi. Shigella, virülansıdüzenlemek için bir sinyal olarak safra tuzlarını kullandığından 17,18,47, TSB ortamında bakteri alt kültüründen sonra deneyler yapıldı ve TSB% 0.4 (a / h) safra tuzları ile destekl...
Tartışmalar
Bu protokol, bağırsak epitel hücrelerinin Shigella aderansı, invazyonu ve hücre içi replikasyonunu incelemek için üç standart testi açıklar. Bu yöntemler, konakçı hücreler içindeki çeşitli bakteriyel patojenlerin invazyonunu ve hücre içi replikasyonunu incelemek için kullanılan klasik gentamisin testlerinin yalnızca değiştirilmiş versiyonları olsa da 49,50,51, Shigella'yı incelerken ...
Açıklamalar
Yazarlar herhangi bir çıkar çatışması beyan etmezler.
Teşekkürler
Yazarlara verilen destek arasında Massachusetts General Hospital Pediatri Bölümü, Araştırma Geçici Destek Fonu İcra Komitesi (ISF) ödülü 2022A009041, Ulusal Alerji ve Bulaşıcı Hastalıklar Enstitüsü hibe R21AI146405 ve Ulusal Diyabet ve Sindirim ve Böbrek Hastalıkları Enstitüsü Harvard'daki Beslenme Obezite Araştırma Merkezi (NORCH) 2P30DK040561-26. Fon sağlayıcıların çalışma tasarımı, veri toplama ve analizi, yayınlama kararı veya makalenin hazırlanmasında hiçbir rolü yoktu.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 0.22 μm PES filter | Millipore-Sigma | SCGP00525 | Sterile, polyethersulfone filter for sterilizing up to 50 mL media |
| 14 mL culture tubes | Corning | 352059 | 17 mm x 100 mm polypropylene test tubes with cap |
| 50 mL conical tubes | Corning | 430829 | 50 mL clear polypropylene conical bottom centrifuge tubes with leak-proof cap |
| 6-well tissue culture plates | Corning | 3516 | Plates are treated for optimal cell attachment |
| Bile salts | Sigma-Aldrich | B8756 | 1:1 ratio of cholate to deoxycholate |
| Congo red dye | Sigma-Aldrich | C6277 | A benzidine-based anionic diazo dye, >85% purity |
| Countess cell counting chamber slide | Invitrogen | C10283 | To be used with the Countess Automated Cell Counter |
| Dimethyl sulfoxide (DMSO) | Sigma-Aldrich | D8418 | A a highly polar organic reagent |
| Dulbecco’s Modified Eagle Medium (DMEM) | Gibco | 10569-010 | DMEM is supplemented with high glucose, sodium pyruvate, GlutaMAX, and Phenol Red |
| Fetal Bovine Serum (FBS) | Sigma-Aldrich | F4135 | Heat-inactivated, sterile |
| Gentamicin | Sigma-Aldrich | G3632 | Stock concentration is 50 mg/mL |
| HT-29 cell line | ATCC | HTB-38 | Adenocarcinoma cell line; colorectal in origin |
| Paraffin film | Bemis | PM999 | Laboratory sealing film |
| Petri dishes | Thermo Fisher Scientific | FB0875713 | 100 mm x 15 mm Petri dishes for solid media |
| Phosphate-buffered saline (PBS) | Thermo Fisher Scientific | 10010049 | 1x concentration; pH 7.4 |
| Select agar | Invitrogen | 30391023 | A mixture of polysaccharides extracted from red seaweed cell walls to make bacterial plating media |
| T75 flasks | Corning | 430641U | Tissue culture flasks |
| Triton X-100 | Sigma-Aldrich | T8787 | A common non-ionic surfactant and emulsifier |
| Trypan blue stain | Invitrogen | T10282 | A dye to detect dead tissue culture cells; only live cells can exclude the dye |
| Trypsin-EDTA | Gibco | 25200-056 | Reagent for cell dissociation for cell line maintenance and passaging |
| Tryptic Soy Broth (TSB) | Sigma-Aldrich | T8907 | Bacterial growth media |
Referanslar
- Karambizi, N. U., McMahan, C. S., Blue, C. N., Temesvari, L. A. Global estimated Disability-Adjusted Life-Years (DALYs) of diarrheal diseases: A systematic analysis of data from 28 years of the global burden of disease study. PloS one. 16 (10), e0259077 (2021).
- WHO. WHO methods and data sources for country-level causes of death 2000-2016. World Health Organization. , (2018).
- Kotloff, K. L. Shigella infection in children and adults: a formidable foe. Lancet Glob Health. 5 (12), e1166-e1167 (2017).
- Kotloff, K. L., et al. Burden and aetiology of diarrhoeal disease in infants and young children in developing countries (the Global Enteric Multicenter Study, GEMS): A prospective, case-control study. Lancet. 382 (9888), 209-222 (2013).
- Schroeder, G. N., Hilbi, H. Molecular pathogenesis of Shigella spp.: Controlling host cell signaling, invasion, and death by type III secretion. Clin Microbiol Rev. 21 (1), 134-156 (2008).
- Arvelo, W., et al. Transmission risk factors and treatment of pediatric shigellosis during a large daycare center-associated outbreak of multidrug resistant shigella sonnei: Implications for the management of shigellosis outbreaks among children. Pediatr Infect Dis J. 28 (11), 976-980 (2009).
- Kozyreva, V. K., et al. Recent outbreaks of Shigellosis in California caused by two distinct populations of Shigella sonnei with either increased virulence or fluoroquinolone resistance. mSphere. 1 (6), 1-18 (2016).
- Bowen, A., et al. Importation and domestic transmission of Shigella sonnei resistant to ciprofloxacin - United States, May 2014-February 2015. MMWR Morb Mortal Wkly Rep. 64 (12), 318-320 (2015).
- Tansarli, G. S., et al. Genomic reconstruction and directed interventions in a multidrug-resistant Shigellosis outbreak in Seattle, WA, USA: a genomic surveillance study. Lancet. 3099 (22), 1-11 (2023).
- Barry, E. M., et al. Progress and pitfalls in Shigella vaccine research. Nat Rev Gastroenterol Hepatol. 10 (4), 245-255 (2013).
- Increase in Extensively Drug-Resistant Shigellosis in the United States. CDC Health Alert Network. Centers for Disease Control and Prevention Available from: https://emergency.cdc.gov/han/2023/han00486.asp?ACSTrackingID=USCDC_511-DM100260&ACSTrackingLabel=HAN%20486%20-%20General%20Public&deliveryName=USCDC_511-DM100260 (2023)
- Shiferaw, B., et al. Antimicrobial susceptibility patterns of Shigella isolates in Foodborne Diseases Active Surveillance Network (FoodNet) sites, 2000-2010. Clin Infect Dis. 54, S458-S463 (2012).
- Centers for Disease Control and Prevention. COVID-19: U.S. Impact on Antimicrobial Resistance, Special Report 2022. Atlanta, GA: U.S. Department of Health and Human Services. CDC. , (2022).
- Centers for Disease Control and Prevention. Antibiotic resistance threats in the United States, 2019. CDC. 10 (1), (2019).
- WHO. Prioritization of pathogens to guide discovery, research and development of new antibiotics for drug-resistant bacterial infections, including tuberculosis. WHO. , (2017).
- DuPont, H. L., Levine, M. M., Hornick, R. B., Formal, S. B. Inoculum size in shigellosis and implications for expected mode of transmission. J Infect Dis. 159 (6), 1126-1128 (1989).
- Nickerson, K. P., et al. Analysis of Shigella flexneri resistance, biofilm formation, and transcriptional profile in response to bile salts. Infect Immun. 85 (6), 1-18 (2017).
- Faherty, C. S., Redman, J. C., Rasko, D. A. Shigella flexneri effectors OspE1 and OspE2 mediate induced adherence to the colonic epithelium following bile salts exposure. Mol Microbiol. 85 (1), 107-121 (2012).
- Chanin, R. B., et al. Shigella flexneri adherence factor expression in in vivo-like conditions. mSphere. 4 (6), e00751 (2019).
- Baranov, V., Hammarström, S. Carcinoembryonic antigen (CEA) and CEA-related cell adhesion molecule 1 (CEACAM1), apically expressed on human colonic M cells, are potential receptors for microbial adhesion. Histochem Cell Biol. 121 (2), 83-89 (2004).
- Wassef, J. S., Keren, D. F., Mailloux, J. L. Role of M cells in initial antigen uptake and in ulcer formation in the rabbit intestinal loop model of shigellosis. Infect Immun. 57 (3), 858-863 (1989).
- Sansonetti, P. J., Arondel, J., Cantey, J. R., Prévost, M. C., Huerre, M. Infection of rabbit Peyer's patches by Shigella flexneri: Effect of adhesive or invasive bacterial phenotypes on follicle-associated epithelium. Infect Immun. 64 (7), 2752-2764 (1996).
- Sansonetti, P. J., et al. Caspase-1 activation of IL-1beta and IL-18 are essential for Shigella flexneri-induced inflammation. Immunity. 12 (5), 581-590 (2000).
- Zychlinsky, A., Fitting, C., Cavaillon, J. M., Sansonetti, P. J. Interleukin 1 is released by murine macrophages during apoptosis induced by Shigella flexneri. J Clin Invest. 94 (3), 1328-1332 (1994).
- Sansonetti, P. J., Ryter, A., Clerc, P., Maurelli, A. T., Mounier, J. Multiplication of Shigella flexneri within HeLa cells: lysis of the phagocytic vacuole and plasmid-mediated contact hemolysis. Infect Immun. 51 (2), 461-469 (1986).
- Maldonado-Contreras, A., et al. Shigella depends on SepA to destabilize the intestinal epithelial integrity via cofilin activation. Gut Microbes. 8 (6), 544-560 (2017).
- Collard, J. -. M., et al. High prevalence of small intestine bacteria overgrowth and asymptomatic carriage of enteric pathogens in stunted children in Antananarivo, Madagascar. PLoS Negl Trop Dis. 16 (5), e0009849 (2022).
- Mattock, E., Blocker, A. J. How do the virulence factors of shigella work together to cause disease. Front Cell Infect Microbiol. 7, 1-24 (2017).
- Mostowy, S., et al. The zebrafish as a new model for the in vivo study of Shigella flexneri interaction with phagocytes and bacterial autophagy. PLoS Pathog. 9 (9), e1003588 (2013).
- Martinez-Becerra, F. J., et al. Parenteral immunization with IpaB/IpaD protects mice against lethal pulmonary infection by Shigella. Vaccine. 31 (24), 2667-2672 (2013).
- Shim, D. -. H., et al. New animal model of shigellosis in the Guinea pig: its usefulness for protective efficacy studies. J Immunol. 178 (4), 2476-2482 (2007).
- Marteyn, B., et al. Modulation of Shigella virulence in response to available oxygen in vivo. Nature. 465 (7296), 355-358 (2010).
- West, N. P., et al. Optimization of virulence functions through glucosylation of Shigella LPS. Science. 307 (5713), 1313-1317 (2005).
- Maurelli, A. T., et al. Shigella infection as observed in the experimentally inoculated domestic pig, Sus scrofa domestica. Microbial Pathog. 25 (4), 189-196 (1998).
- Jeong, K. -. I., Zhang, Q., Nunnari, J., Tzipori, S. A piglet model of acute gastroenteritis induced by Shigella dysenteriae Type 1. J Infect Dis. 201 (6), 903-911 (2010).
- Kim, Y. -. J., Yeo, S. -. G., Park, J. -. H., Ko, H. -. J. Shigella vaccine development: prospective animal models and current status. Curr Pharm Biotechnol. 14 (10), 903-912 (2013).
- Kent, T. H., Formal, S. B., LaBrec, E. H., Sprinz, H., Maenza, R. M. Gastric shigellosis in rhesus monkeys. Am J Pathol. 51 (2), 259-267 (1967).
- Shipley, S. T., et al. A challenge model for Shigella dysenteriae 1 in cynomolgus monkeys (Macaca fascicularis). Comp Med. 60 (1), 54-61 (2010).
- Higgins, R., Sauvageau, R., Bonin, P. Shigella flexneri Type 2 Infection in captive nonhuman primates. Can Vet J. 26 (12), 402-403 (1985).
- Oaks, E. V., Hale, T. L., Formal, S. B. Serum immune response to Shigella protein antigens in rhesus monkeys and humans infected with Shigella spp. Infect Immun. 53 (1), 57-63 (1986).
- Formal, S. B., et al. Protection of monkeys against experimental shigellosis with a living attenuated oral polyvalent dysentery vaccine. J Bacteriol. 92 (1), 17-22 (1966).
- Levine, M. M., Kotloff, K. L., Barry, E. M., Pasetti, M. F., Sztein, M. B. Clinical trials of Shigella vaccines: two steps forward and one step back on a long, hard road. Nat Rev Microbiol. 5 (7), 540-553 (2007).
- Payne, S. M. Laboratory cultivation and storage of Shigella. Curr Protoc Microbiol. 55 (1), 93 (2019).
- NIH Guidelines. NIH guidelines for research involving recombinant or synthetic nucleic acid molecules. NIH Guidelines. 2, 142 (2019).
- Maurelli, A. T., Blackmon, B., Curtiss, R. Loss of pigmentation in Shigella flexneri 2a is correlated with loss of virulence and virulence-associated plasmid. Infect Immun. 43 (1), 397-401 (1984).
- HT-29 cell line product sheet. ATCC Available from: https://www.atcc.org/products/htb-38 (2023)
- Sistrunk, J. R., Nickerson, K. P., Chanin, R. B., Rasko, D. A., Faherty, C. S. Survival of the fittest: How bacterial pathogens utilize bile to enhance infection. Clin Microbiol Rev. 29 (4), 819-836 (2016).
- Stensrud, K. F., et al. Deoxycholate interacts with IpaD of Shigella flexneri in inducing the recruitment of IpaB to the type III secretion apparatus needle tip. J Biol Chem. 283 (27), 18646-18654 (2008).
- Mandell, G. L. Interaction of intraleukocytic bacteria and antibiotics. J Clin Invest. 52 (7), 1673-1679 (1973).
- Elsinghorst, E. A. Measurement of invasion by gentamicin resistance. Methods Enzymo. 236 (1979), 405-420 (1994).
- Elsinghorst, E. A., Weitz, J. A. Epithelial cell invasion and adherence directed by the enterotoxigenic Escherichia coli tib locus is associated with a 104-kilodalton outer membrane protein. Infect Immun. 62 (8), 3463-3471 (1994).
- Dorman, C. J., McKenna, S., Beloin, C. Regulation of virulence gene expression in Shigella flexneri, a facultative intracellular pathogen. Int J Med Microbiol. 291 (2), 89-96 (2001).
- Porter, M. E., Dorman, C. J. Positive regulation of Shigella flexneri virulence genes by integration host factor. J Bacteriol. 179 (21), 6537-6550 (1997).
- Maurelli, A. T., Blackmon, B., Curtiss, R. Temperature-dependent expression of virulence genes in Shigella species. Infect Immun. 43 (1), 195-201 (1984).
- Schuch, R., Maurelli, A. T. Virulence plasmid instability in Shigella flexneri 2a is induced by virulence gene expression. Infect Immun. 65 (9), 3686-3692 (1997).
- Formal, S. B., Hale, T. L., Sansonetti, P. J. Invasive enteric pathogens. Rev Infect Dis. 5, S702-S707 (1983).
- Pál, T., Hale, T. L. Plasmid-associated adherence of Shigella flexneri in a HeLa cell model. Infect Immun. 57 (8), 2580-2582 (1989).
- Noben, M., et al. Human intestinal epithelium in a dish: Current models for research into gastrointestinal pathophysiology. United European Gastroenterol J. 5 (8), 1073-1081 (2017).
- Liévin-Le Moal, V., Servin, A. L. Pathogenesis of human enterovirulent bacteria: lessons from cultured, fully differentiated human colon cancer cell lines. Microbiol Mol Biol Rev R. 77 (3), 380-439 (2013).
- Mitchell, D. M., Ball, J. M. Characterization of a spontaneously polarizing HT-29 cell line, HT-29/cl.f8. In Vitro Cell Dev Biol - Anim. 40 (10), 297-302 (2004).
- Gagnon, M., Zihler Berner, A., Chervet, N., Chassard, C., Lacroix, C. Comparison of the Caco-2, HT-29 and the mucus-secreting HT29-MTX intestinal cell models to investigate Salmonella adhesion and invasion. J Microbiol Methods. 94 (3), 274-279 (2013).
- Koestler, B. J., et al. Human intestinal enteroids as a model system of Shigella pathogenesis. Infect Immun. 87 (4), 00733 (2019).
- Ranganathan, S., et al. Evaluating Shigella flexneri pathogenesis in the human enteroid model. Infect Immun. 87 (4), (2019).
- Nickerson, K. P., et al. A versatile human intestinal organoid-derived epithelial monolayer model for the study of enteric pathogens. Microbiol Spectr. 9 (1), 1-17 (2021).
- Perlman, M., Senger, S., Verma, S., Carey, J., Faherty, C. S. A foundational approach to culture and analyze malnourished organoids. Gut Microbes. 15 (2), 2248713 (2023).
- Pope, L. M., Reed, K. E., Payne, S. M. Increased protein secretion and adherence to HeLa cells by Shigella spp. following growth in the presence of bile salts. Infect Immun. 63 (9), 3642-3648 (1995).
- Faherty, C. S., et al. The synthesis of OspD3 (ShET2) in Shigella flexneri is independent of OspC1. Gut Microbes. 7 (6), 486-502 (2016).
- Ridlon, J. M., Kang, D. -. J., Hylemon, P. B. Bile salt biotransformations by human intestinal bacteria. J Lipid Res. 47 (2), 241-259 (2006).
- Köseoğlu, V. K., Hall, C. P., Rodríguez-López, E. M., Agaisse, H. The Autotransporter IcsA promotes Shigella flexneri biofilm formation in the presence of bile salts. Infect Immun. 87 (7), 1-14 (2019).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır