Bireysel Çok Fonksiyonlu Hücrelerin Eşzamanlı ve Ardışık Sitokin Sekresyonunu Çözmek için Mikroakışkan Yaklaşım
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Protokol, bireysel insan periferik kan mononükleer hücrelerinin sitokin sekresyon dinamiklerini kantitatif olarak ölçmek için gelişmiş bir mikroakışkan platformu tanımlar. Platform, örnek olarak lipopolisakkarit ile uyarılan her bir hücre için paralel olarak üç adede kadar sitokini (IL-6, TNFa ve IL-1β) ölçer.
Özet
Enfeksiyonlar, otoimmün hastalıklar, tedaviye istenen ve advers immünolojik yanıtlar in vivo olarak karmaşık ve dinamik bir sitokin yanıtına yol açabilir. Bu yanıt, bağışıklık reaksiyonunu düzenlemek için çeşitli sitokinler salgılayan çok sayıda bağışıklık hücresini içerir. Bununla birlikte, farklı sitokinlerin çeşitli hücre alt tipleri tarafından salgılama dinamikleri, miktarları ve birlikte ortaya çıkması, bunları incelemek için uygun araçların bulunmaması nedeniyle tam olarak anlaşılamamıştır. Burada, tek hücre düzeyinde paralel olarak birkaç sitokin için sekresyon dinamiklerinin zamanla çözülmüş kantitatif ölçümüne izin veren bir mikroakışkan damlacık platformu kullanan bir protokolü açıklıyoruz. Bu, sitokin konsantrasyonlarının paralel olarak ölçülmesi için çoğullanmış bir immünolojik test ile birlikte tek tek hücrelerin mikroakışkan damlacıklara kapsüllenmesi, dinamik floresan görüntüleme için immobilize edilmesi ve salgılanan miktarları ve dinamikleri elde etmek için ilgili görüntülerin analizi ile sağlanır. Protokol, işlevselleştirilmiş manyetik nanopartiküllerin hazırlanmasını, kalibrasyon deneylerini, hücre hazırlanmasını ve floresan görüntüleme için hücrelerin ve nanopartiküllerin damlacıklara kapsüllenmesini ve ardından lipopolisakkarit ile uyarılmış insan periferik kan mononükleer hücreleri örneğini kullanarak görüntü ve veri analizini açıklar. Sunulan platform, ölçülen hücre örneğinde beklenen fenotipik heterojenliği karakterize ederek, tek ve birlikte salgılayan hücreler için farklı sitokin sekresyon davranışı tanımladı. Ayrıca, testin modüler doğası, çeşitli proteinleri, sitokinleri ve hücre örneklerini incelemek için adaptasyonuna ve uygulanmasına izin verir, bu da potansiyel olarak farklı bağışıklık hücresi tipleri arasındaki etkileşimin ve sıkı bir şekilde düzenlenmiş bağışıklık tepkisini şekillendirmek için dinamik olarak salgılanan farklı sitokinlerin rolünün daha derin bir şekilde anlaşılmasına yol açar. Bu yeni bilgiler, bağışıklık düzensizlikleri çalışmalarında veya tedavi ve ilaç geliştirmede hedef popülasyonların belirlenmesinde özellikle ilginç olabilir.
Giriş
Enfeksiyonlar genellikle doğuştan gelen ve adaptif bağışıklık sistemlerini içeren karmaşık konak reaksiyonlarına neden olur 1,2. Enfeksiyöz ajanların enfeksiyonu veya tanınması üzerine, konak hücreler, kritik iletişimciler olarak bilinen ve bağışıklık sistemini modüle eden küçük proteinler olan çok çeşitli kemo- ve sitokinler üretebilir3. Pro-inflamatuar sitokinler, bağışıklık tepkisini başlatmak için enfeksiyondan erken sonra salınır, daha sonra doku hasarını ve müteakip kronik veya otoinflamatuar hastalıkları önlemek için kritik olan anti-inflamatuar sitokinler tarafından takip edilir. Tehdidin ortadan kaldırılması ve doku koruması arasındaki bu denge, enfeksiyon sırasında farklı işlevler gösteren geniş bir sitokin repertuarı olarak ortaya çıkar ve yanıtın ince ayarına izin verir 4,5. Bu karışım içinde, patojene ve indükledikleri sinyallere, doku konumuna ve kaynaklandıkları bağışıklık hücrelerine bağlı olarak benzersiz imzalar gözlemlenebilir. Bununla birlikte, sitokin salınımı aynı zamanda her hücre popülasyonuna özgü, salgı dinamikleri ve bireysel yanıt açısından farklılık gösteren çok işlevli bir biyolojik süreç oluşturuyor gibi görünmektedir. Bu heterojenlik, literatürde uzun yıllardır, örneğin, otoinflamatuar hastalıklar ve şiddetli COVID-19 enfeksiyonları üzerine yapılan araştırmaların hastalar içinde ve arasında büyük bir fonksiyonel inflamatuar belirteç çeşitliliği sergilediğiT hücresi alt popülasyonları 6,7 arasındatanımlanmıştır 8,9. Son zamanlarda, tek hücreli dizilemenin ortaya çıkışı, daha önce belirgin olmayan bağışıklık mikro ortamları içindeki alt popülasyonlar arasındaki yüksek plastisiteyi ve karışmayı vurguladı ve bu heterojenliği yakalamak için tek hücreli yöntemlerin gerekli olduğunu gösterdi10,11. Transkriptomu analiz etmek için yeni yöntemler geliştirilirken, fenotipik analiz zor olmaya devam etmektedir, çünkü bu, tek hücre düzeyinde protein sekresyonunun eşzamanlı, kantitatif ve zaman çözümlü ölçümlerini gerektirir. Bu tür ölçümler, bir repertuar veya bir sitokin paneli için salgı hücresi kimliklerini, dinamiklerini ve salgı modellerini (yavaş/hızlı, erken/geç, eşzamanlı/sıralı) araştırmamıza izin verir. Bir bağışıklık tepkisi sırasında sitokin salınımının dinamiklerinin kantitatif olarak ve zamansal çözünürlükle çalışılmasını sağlayarak, elde edilen içgörüler, hücresel topluluğun ve indüklenen yanıtın anlaşılmasına izin verebilir.
Standart protokollerde, sitokinler genellikle enzime bağlı immünosorbent testi (ELISA) kullanılarak hücre süspansiyonlarının ve serumun süpernatanında tespit edilir ve toplu olarak salgılanan miktarlar elde edilir. Toplu ölçümler, her hücre tarafından üretilen sitokin miktarlarının ölçülmesine izin vermez, bu özellikle heterojen hücre örneklerinde vurgulanan bir sorundur. Hücre içi sitokin boyama, enzime bağlı immünospot (ELISpot) testi veya mikro oyulmuş testler (örneğin, Isoplexis) gibi alternatif yöntemler, tek tek hücreler tarafından eksprese edilen sitokinleri tespit eder, ancak yalnızca son nokta ölçümleri sağlar12,13. Bu, inkübasyon süresi boyunca hücresel sekresyon modelinde meydana gelebilecek sekresyon dinamiklerinin ve değişikliklerin göz ardı edildiği anlamına gelir. Ek olarak, son nokta ölçümleri eşzamanlı ve sıralı sitokin sekresyonu arasında ayrım yapamaz, bu nedenle sitokin sekresyonunda bağışıklık hücrelerinin eşzamanlı poliişlevselliğinin gerçek kapsamı bu yöntemler kullanılarak belirsizliğini korumaktadır.
Tek hücreli çözünürlük, bağışıklık hücrelerini tek hücre düzeyinde benzersiz sitokin sekresyon fenotipleri üzerinde incelemek için pikolitre boyutunda fiziksel bölmeler oluşturmak ve işlemek için damlacık mikroakışkanları kullanılarak elde edilebilir14,15. Bu bölmeler yağda su emülsiyonlarından oluşur ve mikroakışkan çipler16,17 kullanılarak üretilebilir. Gerçekten de, damlacık bazlı mikroakışkan tahliller, farklı biyolojik numunelerin ve repertuarların tek hücre düzeyinde analizini ve bunların yukarı akış (hücre ve reaktif işleme) ve aşağı akış süreçleri (tek hücreli sıralama, proteomik veya dizileme) ile entegrasyonunu sağlamada son derece çok yönlülük göstermiştir18,19,20,21,22. Özellikle, damlacık immobilizasyonuna izin veren kurulumlar, zaman içinde tek hücreli bir işlevselliğin ölçülmesine izin verir, bu da protein sekresyonunun analizi için değerlidir18. Ayrıca, çoğullanmış, kantitatif tahlillerin entegre edilmesi, daha önce erişilemeyen boyutlarda, birlikte sekresyon ve çok işlevli bağışıklık hücrelerinin tanımlanması gibi süreçlere ek araştırmaları kolaylaştırır23,24.
Bu protokolde, tek tek hücrelerden paralel olarak üç adede kadar sitokinin salgılanmasını tespit etmek, ölçmek ve zamansal olarak ölçmek için hareketsiz hale getirilmiş damlacık tabanlı tek hücreli bir iş akışını açıklıyoruz17,23. Teknoloji, 20.000'den fazla hücreden gelen sitokin tepkilerini paralel olarak izleme yeteneği sunar.
Sunulan iş akışı, tek bağışıklık hücrelerinin ve işlevselleştirilmiş nanopartiküllerin 60 pL yağ içinde su damlacıklarına mikroakışkan kapsüllenmesinden oluşur. Bir gözlem odasında >100.000 damlacığın immobilizasyonu ve zamanla çözülen floresan mikroskobu, her damlacık ve her sitokin içindeki sitokin salgı dinamiklerinin ölçülmesine izin verir (Şekil 1A). Bir damlacık içindeki her bir hücre için, sitokin sekresyonu, spesifik bir yakalama antikoru ile işlevselleştirilmiş manyetik nanopartiküllerin salgılanan sitokini bağladığı ve floresan etiketli tespit antikorlarının müteakip yer değiştirmesine ve bağlanmasına yol açtığı bir sandviç immünolojik test ile ölçülür (Şekil 1B,C). Sitokin varlığında floresan yer değiştirmesinin ölçülebildiği manyetik nanopartiküllerin hizalanmasıyla bir boncuk çizgisi oluşturulur. Burada, floresan yer değiştirmesi, boncuk çizgisinde bulunan ortalama floresan yoğunluğunun, kalan damlacığın ortalama floresan yoğunluğuna bölünmesi olarak tanımlanır. Bu test, farklı şekilde işlevselleştirilmiş nanopartikül partilerini ve farklı floresan kanallarında23 etiketlenmiş ilgili tespit antikorlarını karıştırarak birkaç sitokin için çoğullanabilir, bu da farklı kanallarda spesifik floresan yer değiştirmeleri ile sonuçlanır. Özelleştirilmiş bir analiz senaryosunun yardımıyla, floresan yer değiştirme değerleri çıkarılabilir ve görüntüler, her bir hücre ve sitokin için salgı dinamik profillerine dönüştürülebilir. Bu nedenle, elde edilen veri kümeleri, zaman içinde kantitatif sekresyon ölçümü, birlikte salgılayan alt popülasyonların tanımlanması ve hücrelerin salgılanan miktarlara, oranlara ve sitokin kombinasyonlarına göre dağılımları gibi çok sayıda okuma verir.
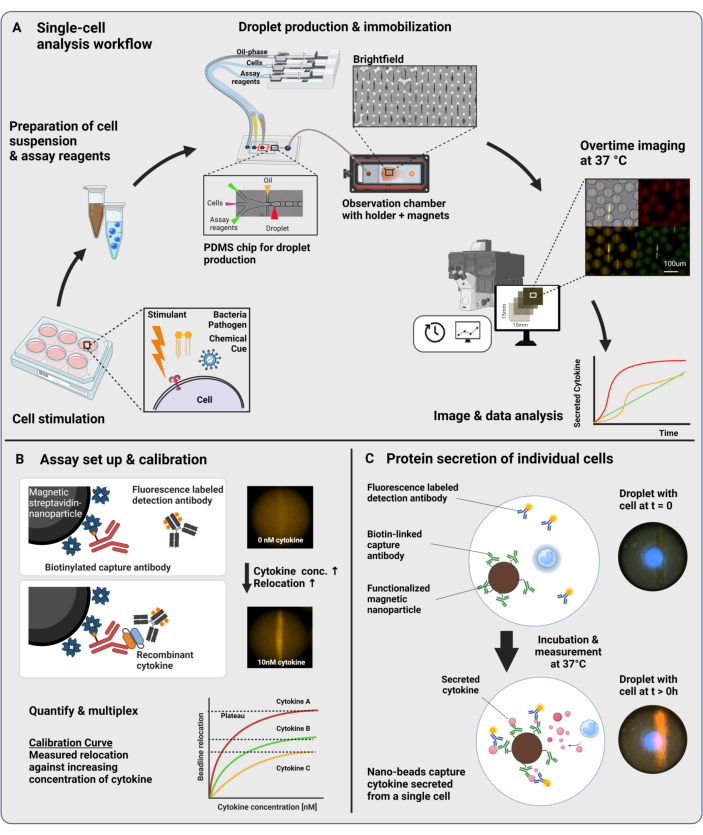
Şekil 1: İş akışı ve tahlil prensibi. (A) Stimülasyondan sonra sitokin salgılayan hücreleri analiz etmek için iş akışına genel bakış. Tek hücreli süspansiyonlar ve manyetik nanopartiküller hazırlanır ve hacimsel yağ / su emülsiyonlarında (damlacıklar) 60 pL'ye kapsüllenir. Damlacıklar hareketsiz hale getirilir ve nanopartiküller, her 30 dakikada bir 4 saate kadar ölçümden önce bir manyetik alan içinde hizalanır. Son olarak, görüntüler analiz edilir ve her damlacık, zaman noktası ve floresan kanalı için parametreler çıkarılır. Bu rakam17'den değiştirildi. (B) Damlacık sandviç biyo-tahlilinin prensibi. İşlevselleştirilmiş nanopartiküller, salgılanan sitokinleri bağlar, bu da floresan etiketli tespit antikorlarının daha sonra nanopartiküllere yer değiştirmesine yol açar. Floresansın bu yer değiştirmesi, rekombinant sitokinlerle gerçekleştirilen kalibrasyon deneyleri ile ölçülür ve doğrulanır. Farklı işlevselleştirilmiş nanopartiküllerin karıştırılması, aynı anda üç sitokin'e kadar çoğullanmış ölçümlere izin verir. (C) Hücre bazlı deneylerde, damlacıklar ölçüm süresi boyunca takip edilir ve salgılayan hücreler, nanopartiküller üzerine floresan yer değiştirmesinin fazla mesai artışı ile tanımlanır. Şemalar ölçeğe uygun değil. BioRender.com ile oluşturulan figür. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Protokol
Tüm deneyler EK202-N-56 etik sözleşmesi kapsamında gerçekleştirildi ve ETH Zürih'in etik komisyonu tarafından onaylandı. İnsan hücrelerinin işlenmesi, bir biyogüvenlik seviye 2 laboratuvarında bulunan bir laminer akış kabininde gerçekleştirildi.
NOT: Aşağıdaki bölümler, tek hücre düzeyinde zamanla çözülen sitokin sekresyonunu ölçmek için protokolü detaylandırmaktadır. Burada özetlenen prosedür, periferik kan mononükleer hücrelerinin (PBMC) lipopolisakkarit (LPS) ile uyarılması ve sitokinler IL-6, TNFa ve IL-1β'nın paralel ölçümü için uygulanır. Bununla birlikte, gerekirse, protokol diğer hücre tiplerine, uyarıcılara ve sitokinlere uyarlanabilir.
1. Gözlem odası imalatı
NOT: Görüntüleme sırasında damlacıkların hareketini önlemek için, damlacık çapından yaklaşık %10 daha küçük bir yüksekliğe sahip bir gözlem odası hazırlanır.
- Kesme çift taraflı bant ve üst cam sürgünün hazırlanması
- Kesme yazılımının Tasarım sekmesinde hazne kesiminin istenen tasarımını çizin veya yükleyin. Burada kullanılan belirli boyutlar için Şekil 2E'ye bakın.
- 32 μm kalınlığındaki çift taraflı yapışkan bandı bant kullanarak yapışkan kesme matına sabitleyin ve kesme matını otomatik kesme makinesine yerleştirin.
- Adım 1.3'te daha kolay sökme için haznenin uzun kenarlarını aynı yönde kesmeye dikkat ederken hazne tasarımını banttan kesin.
- Uzun süreli saklama için bant kesiklerini oda sıcaklığında saklayın. Kısa süreli saklama için -20 °C'de saklayın ve adım 1.3'ten kısa bir süre önce çıkarın. daha kolay kullanım için.
- Bir standart mikroskop lamının (1 mm x 76 mm x 26 mm) ortasına, iki delik arasındaki mesafe yaklaşık 3,5 cm olacak şekilde, yaklaşık 3,5 mm çapında iki delik açın.
- Cam slaytların temizlenmesi ve plazma aktivasyonu
- Bir cam sürgünü delikli ve deliksiz bir cam sürgüyü sabun kullanarak temizleyin. Damıtılmış suyla iyice durulayın ve tüy bırakmayan hassas mendiller kullanarak kurulayın.
- Cam slaytları bir plazma temizleyiciye yerleştirin ve üst yüzeyleri 10 dakika boyunca 55 W'ta plazma işlemine tabi tutun. Cam slaytları çıkarın ve adım 1.3'e geçin.
- Oda montajı
- Delikli cam sürgünü, plazma ile aktive olan tarafı yukarı bakacak şekilde, aktif hale getirilmiş yüzeye dokunmadan temiz bir yüzeye yerleştirin.
- Çift taraflı yapışkan bandın bir tarafından koruyucu tabakayı aynı kesme yönünde çıkarın. Dokunmadan, bant kesiğini cam sürgünün kenarları ve delinmiş deliklerle hizalayın ve bandı kısa kenardan başlayarak cam sürgü ile yavaşça temas ettirin.
NOT: Bantta herhangi bir esneme veya kıvrım oluşturmamaya dikkat edin, çünkü bu yanlış hazne yüksekliklerine neden olur. Bu adım hataya açık olduğundan ve bazı pratik deneyimler gerektirdiğinden, paralel olarak birkaç cam slayt hazırlamanız önerilir. - İkinci koruyucu tabakayı banttan tekrar kesme yönünde çıkarın ve ikinci cam sürgüyü, etkinleştirilmiş yüzey aşağı bakacak şekilde deliksiz olarak yerleştirin. Üstüne düz bir tahta yerleştirerek ve üst gövde kuvveti ile yaklaşık 10 saniye aşağı bastırarak iki cam sürgünün tüm yüzeyini birbirine bastırın.
- İki cam sürgüyü monte ettikten sonra, hazneyi iki delik size bakacak şekilde çevirin. Bağlantı noktasının altındaki halkaya az miktarda UV ile kürlenebilen yapıştırıcı koyarak ve bağlantı noktasını cam slayttaki deliğin üzerine yerleştirerek nanoportları iki deliğe yapıştırın. Bağlantı noktasının etrafına UV ile kürlenebilen bir tutkal halkası ekleyin ve yapıştırıcıyı bir UV lambası ile sertleştirin. Oda şimdi Şekil 2E'de gösterildiği gibi görünmelidir. Hemen adım 1.4'e geçin.
NOT: UV ışığı gözlere ve cilde zarar verebilir. Uygun koruyucu ekipman giyin.
- Oda yüzeyinin florofilik kaplaması
NOT: Bu adım, iyi bir kaplama verimliliği sağlamak için cam slaytların plazma işleminden (adım 1.2.2) sonra 1 saat içinde gerçekleştirilmelidir.- Florlu yağda (HFE-7500) 1 mL% 1 florosilan çözeltisi (1H, 1H, 2H, 2H-perflorodesiltriklorosilan) taze olarak hazırlayın ve bir şırıngaya doldurun. Kaplama solüsyonunu bir PTFE şırınga filtresinden ve 27 mm x 0.75 mm PTFE mikro boruya bağlı 0.3G x 0.76 inçlik bir iğneden gözlem odasına itin.
- 1 dakikalık inkübasyondan sonra, bir davlumbaz altında nitrojen basıncı kullanarak kaplama solüsyonunu hazneden dışarı atın. Başka bir şırınga tertibatı kullanarak hazneyi florlu yağ (yalnızca HFE-7500) ile durulayın.
- Florlu yağ ile doldurulmuş hazneyi, oda sıcaklığında (RT) kapalı girişlerle saklayın. Her deneyden sonra, kaplamanın iyi bir şekilde korunmasını sağlamak için hücreleri ve damlacıkları doğrudan yıkayın.
NOT: Protokol burada duraklatılabilir ve odalar birkaç ay boyunca saklanabilir ve yeniden kullanılabilir.
- Mıknatıslı hazne tutucu
- Manyetik nanopartiküllerin hizalanması için, damlacık kapsülleme ve görüntüleme sırasında gözlem odasına statik bir manyetik alan uygulayın. Bunun için, hazneyi, haznenin uzun kenarları boyunca iki neodimyum mıknatıs tutan özel bir 3D baskılı mikroskopi tutucusuna (bkz. Şekil 2D ve Bounab ve ark.17 Ek Veri 4'te bulunan dosyaya bakınız) yerleştirin.
2. Nanopartikül işlevselleştirme
NOT: Nanopartikül işlevselleştirme işlemi her sitokin için benzerdir, tek fark sitokin spesifik yakalama antikorlarının eklenmesidir. Her sitokin için işlevselleştirme, paralel olarak farklı, bireysel reaksiyon tüplerinde gerçekleştirilir. Bu protokolden önce, TNFα yakalama antikoru ve IL-1β tespit antikoru, sırasıyla biotin ve Alexa Fluor 647 ile kurum içinde etiketlendi. Konjugasyon, satıcının web sitesinde bulunan üreticinin protokolüne göre gerçekleştirildi ( Malzeme Tablosundaki bağlantılara bakınız) ve antikorlar aliquoted edildi ve -20 ° C'de saklandı.
- TNFα tespiti için hedeflenen tüpe 50 μL streptavidin ile işlevselleştirilmiş nanopartiküller (çap (Ø) 300 nm), IL-1β için 50 μL ve IL-6 için 100 μL ekleyin. Nanopartikül çözeltisini 1: 1 (h / h) fosfat tamponlu salin (PBS) içinde seyreltin.
- Her tüpe, biyotinile yakalama antikorlarının ilgili hacminin (0.5 mg / mL'de stok konsantrasyonları) 1/20 (h / v) ekleyin ve RT'de 30 dakika inkübe edin.
NOT: Nanopartikül çözeltisine küçük hacimler eklerken, hacmi tüpün üst kısmına yerleştirin ve çözeltinin büyük kısmı ile birden çok kez yıkayın. Bu, uygun karıştırmayı sağlar ve agrega oluşumunu önler. - Tüpe 1/100 (h/h) 1 mM D-biotin çözeltisi ekleyin ve RT'de 5 dakika inkübe edin. Bu, 10 μM'lik bir nihai biyotin konsantrasyonu ile sonuçlanır.
NOT: Fazla biyotin, nanopartiküller üzerindeki serbest bağlanma taraflarını bloke eder ve istenmeyen agrega oluşumunu azaltır. - Tüpe yakın bir neodimyum mıknatıs tutarak parçacıkları toplayın. Süpernatan temizlenene kadar bekleyin ve süpernatanı atın.
NOT: Test boyunca kullanılan mıknatıslar çok güçlü çekici kuvvetler sergiler, bu da iki mıknatısın yanlışlıkla birbirine kırılması durumunda fiziksel zarara neden olabilir. - Nanopartikül yüzeyine spesifik olmayan adsorpsiyonu azaltmak için, nanopartikülleri Pluronic F-127'nin (% 10) 2.1. adımının son hacminin 0.5 katı ve PBS hacminin 0.5 katı kadar hemen yeniden süspanse edin. Çözeltiyi RT'de 30 dakika inkübe edin.
- Mıknatısı kullanarak parçacıkları toplayın, süpernatanı atın ve depolama tamponu hacminin 1 katı kadar yeniden süspanse edin (RPMI 1640,% 5 nakavt serum replasmanı,% 1 Pen / Strep,% 1 rekombinant insan serum albümini (HSA), 25 mM HEPES,% 0.1 Pluronic F-127). Çözeltiyi RT'de 30 dakika inkübe edin.
NOT: Protokol burada duraklatılabilir ve parçacıklar artık 4 °C'de 1 haftaya kadar saklanabilir. - Kapsüllemeden hemen önce, partikülleri pipetleme ile yeniden süspanse edin ve konjuge nanopartikülleri sırasıyla IL-6: TNFα: IL-1β için 2: 1: 1 (v / v) oranında karıştırın.
NOT: İşlevselleştirilmiş nanopartiküllerin farklı oranları, her sitokin için kullanılan antikor çiftine bağlıdır ve optimal bir dinamik aralık elde etmek için kalibrasyon numuneleri aracılığıyla deneysel olarak belirlenmiştir. - Parçacıkları mıknatısla toplayarak, süpernatanı atarak ve yeniden süspanse ederek tam ortamla (RPMI 1640, %10 FBS, %1 Pen/Strep, 25 mM HEPES) yıkayın. Bu adımı tekrarlayın, ancak yalnızca adım 2.7'deki tam ortamın hacminin 0,5 katı kadar yeniden askıya alın.
- Her biri 10 nM'lik bir nihai konsantrasyona ulaşmak için farklı etiketli IL-6, TNFa ve IL-1β tespit antikorlarını çözeltiye ekleyin. Çözelti artık damlacık deneyleri için kullanılmaya hazırdır.
3. Hücre hazırlığı
NOT: PBMC, Zürih kan bankasından alınan bir buffy paltodan izole edildi. Hücreler donduruldu ve birkaç ay boyunca sıvı nitrojen içinde kriyoviyallerde (1 x 107 hücre / şişe) saklandı.
- Hücre çözülmesi
- Deneye başlamadan 1 saat önce, tüm ortamı ve MACS tamponunu (2 mM EDTA, DPBS'de %0,5 BSA, steril filtreli) RT'de ısınmaya bırakın. 15 mL'lik bir tüpe 9 mL tam ortam ekleyerek ve 37 °C'deki su banyosunda tutarak hücreleri içeren tüpü hazırlayın.
- Bir PBMC kriyoviyalini (~ 1 x 107 hücre içeren) sıvı nitrojen içindeki deposundan alın. Kriyotüpü su banyosunda 37 °C'de çok az miktarda buz kalana kadar döndürün.
- Tüpü %70 EtOH ile silin ve laminer akış kabinine aktarın. Kriyoviyal için 1 mL önceden ısıtılmış tam ortam ekleyin, hafifçe karıştırın ve tüm hücreleri sıcak tam ortam içeren tüpe aktarın. Kriyoviyal, maksimum hücre sayısını geri kazanmak için 1 mL ılık tam ortam ile yıkanabilir.
- Hücreleri RT'de 5 dakika boyunca 500 x g'da döndürün, süpernatanı atın ve hücre peletini 1 mL tam ortam ile bir pipetle hafifçe yeniden süspanse edin. 9 mL tam ortam ekleyin.
- Hücreleri RT'de 5 dakika boyunca 500 x g'da döndürün. Süpernatanı atın ve daha önce olduğu gibi 1 mL tam ortama yeniden süspanse edin.
- Kullanılabilir hücre sayacını kullanarak hücreleri sayın. Bu durumda, otomatik bir hücre sayacı kullanıldı. Hücreler, 10 μL hücre süspansiyonunun 10 μL Tripan mavisi ile karıştırılması ve karışımın 10 μL'sinin hücre sayma slaytına aktarılmasıyla sayıldı.
- Boyama ve FcR engelleme
- Toplam hücre sayısını ve hücreleri 2 x 106 canlı hücre/mL'de yeniden süspanse etmek için gereken hacmi hesaplayın. Stok (5mM) 1000x'i PBS'de (5 μM çalışma konsantrasyonu) seyrelterek hücre boyama solüsyonunu (CellTrace Violet) hazırlayın.
- Hücreleri RT'de 5 dakika boyunca 500 x g'da döndürün. Süpernatanı atın ve hücreleri, adım 3.2.1'de hazırlanan hesaplanan hücre boyama çözeltisi hacminde yeniden süspanse edin. Hücreleri 37 ° C'de 5 dakika inkübe edin.
- İnkübasyonun sonunda, tam ortam ekleyerek (boya çözeltisinin hacminin en az 2 katı) çözeltide kalan boyayı söndürün. Hücreleri RT'de 5 dakika boyunca 500 x g'da döndürün.
- Süpernatanı atın, hücre peletini 60 μL MACS tamponuna yeniden süspanse edin ve 1 x 107 hücre başına 20 μL insan FcR bloğu ekleyin. Hücreleri RT'de 10 dakika inkübe edin.
- Tüpü MACS Buffer ile 10 mL'ye kadar doldurun ve hücreleri RT'de 5 dakika boyunca 500 x g'de döndürün.
- Süpernatanı atın ve hücreleri 1 mL tam ortamda yeniden süspanse edin Hücreleri adım 3.1.6'da açıklandığı gibi sayın.
- LPS ile hücre stimülasyonu
- Hücre sayımını kullanarak, hücreleri 1 x 106 hücre / mL'de seyreltin ve ultra düşük bağlayıcı 6 oyuklu bir plakada her bir oyuğa 2 mL hücre aktarın.
- LPS'yi tam ortamda seyreltin ve 1 μg/mL'lik nihai LPS konsantrasyonu için hücreleri içeren kuyuya ekleyin. Hücreleri 37 ° C'de 6 saat inkübe edin.
- Kapsülleme için hazırlık
- Stimülasyon süresinin sonunda, hücre süspansiyonunu 15 mL'lik yeni bir tüpe aktarın.
- Boş kuyuya 1 mL tam ortam ekleyin. Bir hücre kazıyıcı ile kalan hücreleri ayırın. Hücreleri 15 mL'lik yeni bir tüpe aktarın. İyiliği 1 mL tam ortamla yıkayın ve 15 mL'lik başka bir tüpe aktarın.
- İki tüpü RT'de 5 dakika boyunca 500 x g'da döndürün ve gerekirse daha fazla analiz için 1 mL seyreltilmemiş süpernatant çözeltiyi (yıkanmamış hücreleri içeren ilk tüpten) yeni bir tüpe aktarın (ör., ELISA).
- Süpernatantların geri kalanını atın.
- Peletleri 0,5 mL tam ortamda yeniden süspanse edin, hücreleri aynı kuyudan birleştirin ve bunları bir santrifüj tüpüne aktarın. Hücreleri adım 3.1.6'da açıklandığı gibi sayın.
- Hücreleri RT'de 5 dakika boyunca 500 x g'da döndürün ve süpernatantın çoğunu atın (yaklaşık 100 μL bırakarak). Peleti yeniden askıya almadan, çok dikkatli bir şekilde 200 μL tam ortam ekleyin.
- Süpernatanı atın. Adım 8.6'da tanımlandığı gibi, kapsülleme için λ = 0.2-0.4'lük bir damlacık başına ortalama hücre sayısı elde etmek için hücreleri 6.6 ila 13.3 x 106 hücre / mL konsantrasyonda tam ortamda yeniden süspanse edin.
NOT: Süpernatana sitokin salgılanmasını önlemek için 3.4.6 ve 3.4.7 adımları, kapsüllemeden hemen önce gerçekleştirilmelidir. Damlacık başına hücre sayısı bir Poisson dağılımını takip eder: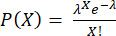 burada P, X hücreleri içeren damlacıkların fraksiyonunu gösterir ve λ, damlacık başına ortalama hücre sayısıdır.
burada P, X hücreleri içeren damlacıkların fraksiyonunu gösterir ve λ, damlacık başına ortalama hücre sayısıdır.
4. Kapsülleme ve damlacık üretimi
NOT: Hücrelerin damlacıklar halinde kapsüllenmesi, fabrikasyonun başka bir yerde ayrıntılı olarak açıklandığı bir mikroakışkan damlacık üreteci çipi tarafından sağlanır17. Alternatifler ticari olarak temin edilebilir ( Malzeme Tablosundaki örneğe bakın). Uygun bir damlacık jeneratörü çip tasarımı, sulu fazlar için iki girişe, yağ fazı için bir girişe ve üretilen damlacıklar için bir çıkışa sahiptir. Ayrıca, uygun bir ticari damlacık jeneratörü çipi, 40-60 pL hacimli florlu yağ damlacıklarında su üretimini sağlamalıdır. Burada açıklanan protokol, 50 μm çapında su/yağ emülsiyonları (damlacıklar) ile sonuçlanır. Protokolü değiştirmek için çeşitli seçeneklerin kullanılması, daha büyük veya daha küçük damlacıklara neden olabilir.
- Şırınga pompasının hazırlanması (Şekil 2A)
- 1 mL'lik bir şırıngayı, HFE-7500 florlu yağ içinde% 2 008-Florosürfaktan içeren 500 μL sürekli faz ile doldurun. 27G x 0.75 inçlik bir iğneyi 0.30 mm x 0.76 mm PTFE mikro boruya bağlayın ve düzeneği şırıngaya ve ardından şırınga pompasına monte edin.
NOT: Şırıngada veya kanülde hava kalmadığından emin olun, çünkü bu tutarlı akış hızlarını engeller. - Sulu fazlar için iki adet özel yapım pipet ucu konektörü hazırlayın (Şekil 2B): Ø0.75 mm ile ~5 mm yüksekliğinde bir PDMS oyuğunun ortasına Ø6 mm biyopsi deliği ile bir delik açın. ~3 cm PTFE boruyu (0.56 mm iç çap, 1.07 mm dış çap) PDMS oyuğundaki delikten çekin ve düzeneği 200 μL'lik bir pipet ucunun üstüne itin. Tüpün diğer tarafını 23Gx 1.25 inçlik bir iğneye bağlayın. Pipetin üzerine UV ile kürlenebilen yapıştırıcı sürerek konektörü kapatın ve UV ışığıyla kürleyin.
NOT: UV ışığı göze zararlı olduğundan, korunmak için UV engelleyici gözlükler takın. - İki adet 1 mL'lik şırıngayı 500 μL hafif mineral yağ ile doldurun, iki adet 23G iğneyi özel yapım ataşmanlarla takın ve her ikisini de şırınga pompasına monte edin.
- Şırınga pompası kontrol yazılımını kullanarak 30 μL nanopartikül ve 30 μL hücre solüsyonunu sulu fazların pipet uçlarına aspire edin.
- Kir ve tozu temizlemek için yüzeyi su ile temizleyerek bir gözlem odası hazırlayın ve hassas mendillerle kurulayın. Hazneyi, iki neodimyum mıknatısla donatılmış basılı hazne tutucusuna sıkıştırın.
NOT: Uzun bir agrega oluşturmak için mıknatısların doğru yönü (birbirini çekerek) gösterdiğinden emin olun. - Hazneyi hafifçe açılandırın (30°). Her iki bağlantı noktasını da açın ve doldurma sırasında fazla dış fazı emmek için üst bağlantı noktasına bir kağıt havlu takın.
- 1 mL'lik bir şırıngayı, HFE-7500 florlu yağ içinde% 2 008-Florosürfaktan içeren 500 μL sürekli faz ile doldurun. 27G x 0.75 inçlik bir iğneyi 0.30 mm x 0.76 mm PTFE mikro boruya bağlayın ve düzeneği şırıngaya ve ardından şırınga pompasına monte edin.
- Damlacık üretimi ve hazne dolumu
- Sürekli fazı boru aracılığıyla mikroakışkan çipin üst girişine bağlayın (Şekil 2A, C, F). Çipi 1800 μL/s'lik bir akış hızı kullanarak sürekli fazda yaklaşık 30 saniye boyunca yıkayın.
- Sulu çözeltilerin pipet uçlarını iki orta girişe bağlayın (Şekil 2A,C,F).
- Sulu çözeltinin akışını her biri 200 μL/s ile başlatın ve kanalların ve çıkışın sıvı ile doldurulmasına izin verin. Manyetik nanopartiküller kullanılırken, homojen, kahverengi-kırmızı renkli bir çözelti çip çıkışından dışarı akmalıdır.
- Sıvı çıkışta göründüğünde, 800 μL/s'de florlu yağ fazı akışını başlatın ve çıkışta homojen, gri, parlak bir çözeltinin çıkışıyla onaylanan kararlı bir damlacık üretimi oluşana kadar bekleyin.
- İstikrarlı bir damlacık üretimi sağlandıktan sonra, PTFE mikro borularını (0,3 mm iç çap x 0,76 mm dış çap) çıkış portuna bağlayarak üretilen damlacıkları toplayın ve mikroboruyu parmak sıkılığında tek parça bir bağlantı parçasının yüksük modülünden geçirerek bir gözlem odasına yönlendirin (Şekil 2A).
- Uygun damlacık üretimi meydana gelirse, homojen, parlak bir sıvı, hazneyi aşağıdan yukarıya doğru düz bir cephe ile doldurmalıdır.
- Hazne dolduğunda, akışı durdurun ve parmak geçirmez basınç kullanarak portları port tapalarıyla kapatın.
NOT: Hazneyi çok sıkı kapatmamaya dikkat edin. Sıkışma veya hava akışı, damlacıkların hareketlerine yol açabilir ve bu nedenle ölçüm sırasında izlemeyi tehlikeye atabilir. - Damlacık üretiminden sonra, çipi florlu yağ ile yıkayın ve işlevini korumak için nitrojen ile sıvı hatırlatıcılarını üfleyin. Cipsler birden çok kez tekrar kullanılabilir ve tıkanmadıkları sürece aylarca saklanabilir.
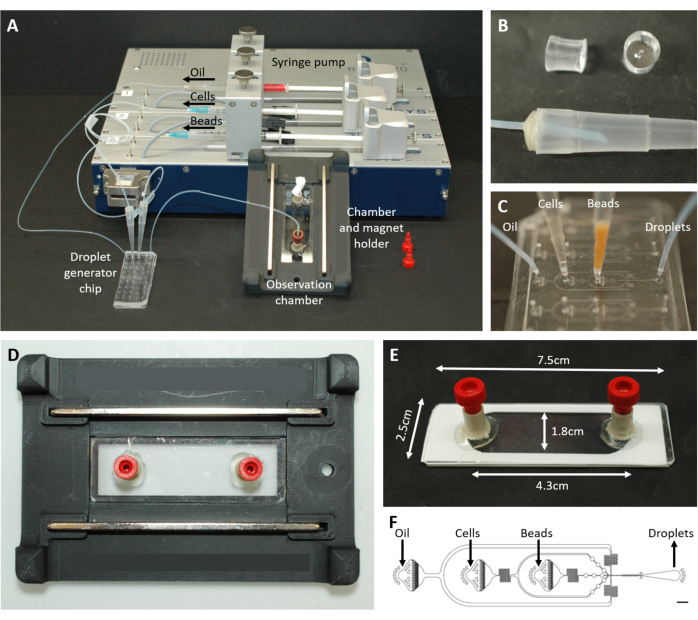
Şekil 2: Mikroakışkan kurulumuna genel bakış. (A) Şırınga pompası, damlacık üretim çipi ve gözlem odası ve mikroskop tutucu ile damlacık kapsülleme için kurulum. (B) Protokol adımı 4.1.2'de açıklandığı gibi 200 μL'lik bir pipet ucuna (altta) bir konektör oluşturmak için delinmiş PDMS fişinin (üstte) resmi. (C) Boru ve pipet uçlarının damlacık oluşturma çipine bağlantısının görüntüleri. (D) Üstte ve altta iki mıknatıs bulunan özel 3D baskılı mikroskop tutucusunun içine yerleştirilen odanın resmi. (E) Gözlem odasının fotoğrafı (gösterim için beyaz bantlı). (F) Damlacık oluşumu için mikroakışkan çipin yerleşimi (ölçek çubuğu: 750 μm). Bu rakam17'den değiştirildi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
5. Görüntü elde etme ve ölçme
NOT: Görüntü alımı, 37 °C'de ölçümlere izin veren bir inkübatöre yerleştirilmiş standart bir ters çevrilmiş epi-floresan mikroskobu üzerinde gerçekleştirilir. Burada açıklanan ayarlar, bir Orca Fusion kamera ile donatılmış NIS Elements yazılımı (V. 5.30.04) ile çalışan bir Nikon Eclipse Ti2 mikroskobuna özgüdür, ancak genellikle diğer floresan mikroskopları ve kameralarına uyarlanabilir.
- Ölçüm parametrelerinin ayarlanması
- Görüntünün boyutunu ayarlamak için 10 x 10 görüntüden oluşan bir dizi boyutu seçin. Bu dizi kabaca 50.000-70.000 damlacık içerecektir. Görüntü birleştirme için %1 örtüşme kullanın ve karıştırmayı etkinleştirin.
- Ölçülen kanalların sayısını ayarlamak için, hücre tespiti için DAPI kanalını, sitokin tespiti için FITC, TRITC, Cy5 kanallarını (boncuk çizgileri) ve damlacık tespiti için BF kanalını seçin. Bit derinliği için 2 x 2 ve 16 bit piksel gruplaması kullanın. Her floresan kanalı için kameranın maksimumuna ulaşmayan damlacık yoğunluğu piksel değerlerini elde etmek için kamera ayarlarını uyarlayın.
NOT: Her kanal için tam maruz kalma süreleri ve lamba yoğunlukları, kullanılan modele ve reaktiflere bağlıdır ve kalibrasyon eğrileri oluşturulmadan önce belirlenir (adım 7). Kalibrasyon ve hücre ölçümlerinde aynı toplama ayarlarının kullanılması, doğru miktar tayini için önemlidir. - Zamana bağlı ölçümü ayarlamak için, toplam 9 ölçüm için her 30 dakikada bir bir ölçüm seçin.
NOT: Ölçüm parametreleri, kullanılan hücreler, uyarıcılar, reaktifler, ölçülen sitokinler, inkübasyon sıcaklığı ve mikroskop modelleri için farklılık gösterebilir.
- Ölçümün başlatılması
- Hazne tutucuyu bir kuyu plakası formatı aşaması (Şekil 2D) ile mikroskoba monte edin ve 10x objektifi kullanarak parlak alan (BF) kanalına geçin.
- BF'deki hareketsiz damlacıklara odaklanın ve etrafta kaydırarak ve gerekirse ayarlayarak düzeneğin mükemmel bir düzlemde monte edildiğinden emin olun. Sonraki adımlar için odanın ortasına gidin.
- Otomatik odaklama sistemini (PFS) etkinleştirin ve BF kanalındaki en uygun ölçüm düzlemine ayarlayın, böylece damlacık kenarları, yağ fazı ve arka plandan kolayca ayırt edilebilen siyah, keskin daireler olarak görünür.
NOT: Ölçümler otomatik odaklama sistemi olmadan da mümkündür, ancak mikroskopta bir tane varsa, kullanmanızı şiddetle tavsiye ederiz. Bu, büyük ve yoğun şekilde dikilmiş görüntüler için ölçüm kalitesini artırır. - Tüm floresan kanallarını gözden geçirin ve her biri için en uygun ölçüm düzlemini ayarlayın. FITC, TRITC ve Cy5 kanallarındaki yer değiştirme ölçümleri için, nanopartikül agregasının mükemmel odakta olduğundan emin olun, DAPI kanalı için hücrelerin odakta olduğundan emin olun.
NOT: Optimum odak düzlemleri ve z değerleri, ölçülen tüm kanallar için farklı olabilir. Her kanal için ayrı PFS ofsetlerini kaydettiğinizden emin olun. - Ölçüme başlamadan önce, tek tek odakları iki kez kontrol etmek için tüm kanallardan geçin ve çözeltiler ısınırken başlangıçta hareket meydana gelebileceğinden, dengelemek için 5 dakika bekleyin.
- Ölçümü başlatın. İlk görüntüyü oluşturduktan sonra, herhangi bir düzensizlik olup olmadığını kontrol edin (odak, hareketli damlacıklar, yanlış kanallar vb.). Gerekirse alımı yeniden başlatın veya hava olması durumunda hazneyi yeniden doldurun (adım 4.1.4'ten başlayın). Damlacıkları 4 saat boyunca görüntülemek için montajdan çıkın.
6. Görüntü analizi
- MatLab'a (https://github.com/ESPCI-LCMD/MiMB) görüntü analiz yazılımını (DropMap Analyzer App v 4.023) yükleyin ve oluşturulan .nd2 dosyasını deneyden bir analiz bilgisayarına aktarın.
- Uygulamayı açın. Belirtilen ayarları seçin, aksi takdirde varsayılan değeri bırakın: CH1: DAPI, WD (tüm damlacık) seçili; CH2: FITC, BL (boncuk çizgisi) seçili; CH3: TRITC, BL seçildi; CH4: Cy5, BL seçili; Maksimum Düşme Çapı (μm): 70; Düşme Algılama: Tam; İzleme: Evet. .nd2 dosya konumunu seçmek ve analizi başlatmak için Başlat düğmesine (meyve simgesi) basın.
- Birkaç dakika sonra, program görüntünün örnek bir bölümünü gösterecektir (Şekil 3A). Damlacık algılama için uygun bir tane bulana kadar Boşluk tuşuna basın, ardından Enter tuşuna basın. Aynı görüntü bölümünde, damlacıkları algılamak için eşik parametrelerini bulmak için temsili bir alanda bir dikdörtgen çizin.
- Birkaç dakika sonra, DAPI kanalının yoğunluk dağılımını gösteren başka bir pencere açılacaktır. Yalnızca lekeli hücrelerden gelen sinyali algılamak için kaydırıcıyı sürükleyip bırakın ve sağ üst köşedeki Bitti'yi tıklayın.
- Görüntüyü, Maksimum Damla Çapından (μm) daha küçük çaplara sahip tek damlacıklara böldükten sonra, program şimdi daha fazla kullanıcı girişi olmadan her damlacık, zaman noktası ve floresan kanalı için aşağıdaki adımları gerçekleştirecektir (bkz. Şekil 3).
- Yazılım, zaman noktaları arasında damlacığın taşınan piksellerini hesaplar (40 pikselden fazla hareket eden damlacıklar otomatik olarak hariç tutulur).
- Yazılım, tüm damlacığın ortalama floresan değerini ölçerek, yatay bir çizgideki en parlak pikseli bularak ve damlacığın yukarıdan aşağıya dikey bir çizgideki tüm piksel yoğunluklarının ortalamasını alarak ortalama boncuk çizgisi yoğunluğunu algılar ve ölçer. Bu otomatik olarak yapılır ve aşağıdaki denkleme göre ortalama boncuk hattı yer değiştirme değerlerini (Şekil 3B) hesaplamak için kullanılır:
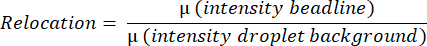
- Yazılım, DAPI kanalında ayarlanan eşiğin üzerindeki damlacık alanındaki toplam piksellerin yüzdesini hesaplar.
- Ortaya çıkan .xslx dosyası, daha fazla analiz için aşağıdaki ilgi sütunlarını içerecektir: DropIdX (zaman içinde izlenen damlacığın kimliği), TrueCentroid_ t*2-1 ve t+2 (t zaman noktası için damlacık merkezinin sırasıyla x ve y koordinatları), DiameterMicrons (μm cinsinden damlacık çapı), TrackingMove (tüm ölçüm süresi boyunca taşınan piksel sayısı), FluoChannel_BL_Ratio_t (t zaman noktasında FluoChannel için yer değiştirme değeri), DAPI_WD_PosPxlCount_t (t zaman noktasında DAPI kanalındaki tüm damlacıkta eşiğin üzerindeki piksel sayısı).
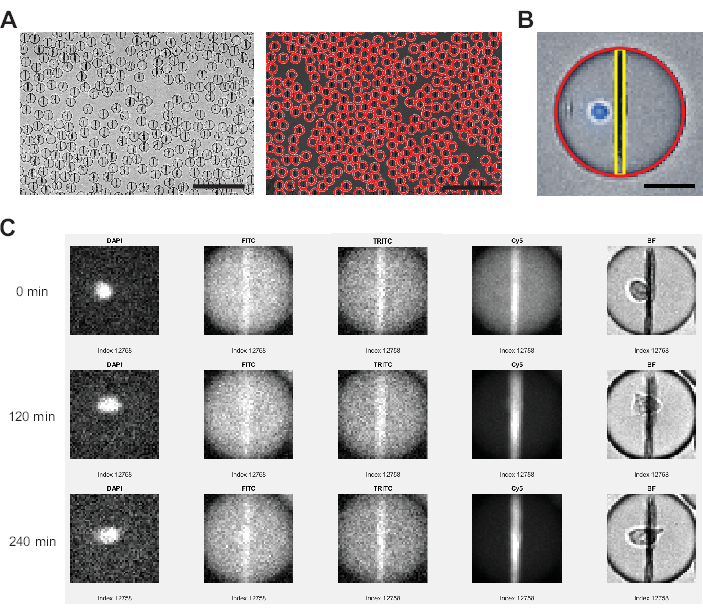
Şekil 3: Görüntü analiz yazılımı tarafından gerçekleştirilen görüntü analizi. (A) Damlacıklar, bir Hough dönüşümü kullanılarak parlak alan (BF) kanalında algılanır ve her damlacık kırmızı bir daire ile işaretlenir. Ölçek çubukları: 200 μm. (B) Her damlacık içinde, nanopartikül boncuk çizgisi, yatay düzlemdeki en parlak pikseller ve damlacığın yukarıdan aşağıya uzanan tüm pikseller için ortalama floresan yoğunlukları aracılığıyla tanımlanır. Ek olarak, hücre, tüm damlacık alanı için eşiğin üzerinde bir piksel yüzdesi >0 ile tanımlanır. Ölçek çubuğu: 20 μm. (C) Analizör yazılımı, nanopartiküller üzerindeki floresan yoğunluğunu, her bir damlacık için ölçülen tüm zaman noktalarında FITC, TRITC ve Cy5 kanalları için damlacık arka planıyla karşılaştırır. Gösterilen zaman noktaları 0, 4 (120 dk) ve 9 (240 dk). Doğru damlacık ve hücre algılamasını manuel olarak kontrol etmek için DAPI ve BF kanalları da görüntülenir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
7. Kalibrasyon
NOT: Kantitatif bir okuma için, farklı deney düzenekleri arasında farklılıklar olabileceğinden, sitokin konsantrasyonlarının floresan yer değiştirme değerlerine kalibrasyonunun bir kez yapılması gerekir. Gerekli tüm adımlar, atıfta bulunulduğu gibi önceki protokol bölümlerinde ayrıntılı olarak açıklanmıştır.
- Nanopartikülleri 2. adımda açıklandığı gibi hazırlayın.
- İnsan IL-6, TNFα ve IL-1β rekombinant proteinlerini üreticinin talimatlarına göre sulandırın.
NOT: Dondurulmuş alikotların yalnızca bir kez çözüldüğünden ve hemen kullanıldığından emin olun. - Başlangıç konsantrasyonu 80 nM'den 0.625 nM'ye kadar olan tam ortam (%10 FBS, %1 Pen/Strep, 25 mM HEPES) kullanarak üç proteinin tümü için 2 katlı bir seyreltme serisi hazırlayın.
- Kapsüllemeyi, birinci fazda işlevselleştirilmiş nanopartiküller ve yalnızca ikinci sulu fazda RPMI ile adım 4'te açıklandığı gibi gerçekleştirin. Bu ölçüm boş değer görür ve ölçülen standart sapma daha sonra veri analizi için kullanılır.
- 5 dakika bekleyin ve damlacıkları 5. adımda açıklandığı gibi görüntüleyin. İlgili floresan kanallarında 2 x 2 dizi boyutunda 3 görüntü çekin.
- Adım 7.4 ve 7.5'i, en düşükten başlayıp en yüksek konsantrasyonla bitecek şekilde hazırlanan tüm kalibrasyon çözeltileri ile tekrarlayın.
- Görüntüleri 6. adımda açıklandığı gibi analiz edin. DAPI kanalı için WD seçeneğini kullanmayın ve İzleme'yi Hayır olarak ayarlayın.
- Analiz, tek bir görüntüde ölçülen her damlacık için floresan yer değiştirme değerlerini verir. Her floresan kanalı için medyan ve standart sapmayı çıkarın. Konsantrasyon başına ölçülen her görüntü için medyan ve standart sapmanın ortalamasını alın.
- Her bir rekombinant proteinin ölçülen konsantrasyonlarına karşı ortalama medyan yer değiştirmeyi çizerek bir kalibrasyon eğrisi oluşturun.
- Tek fazlı bir ilişkilendirme kullanarak eğrileri sığdırın:
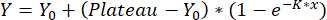 ,
,
Y = x'te yer değiştirme, Y0 = boş ölçümün yer değiştirmesi ve x kullanılan konsantrasyon. Elde edilen kalibrasyon eğrisi, adım 8'de açıklandığı gibi yer değiştirme değerlerini ölçmek için kullanılır.
NOT: Yalnızca ölçülen en yüksek yer değiştirmeye kadar olan değerleri uyun ve daha düşük ölçülen yer değiştirme ile daha yüksek konsantrasyonlardaki değerleri hariç tutun. Daha yüksek konsantrasyonlarda ölçülen yer değiştirme değerlerinde bir azalma beklenir ve Hook etkisi ve nanopartiküllerin sınırlı bağlanma kapasitesi nedeniyle oluşur.
8. Veri analizi
- TrackingMove değeri 10'dan yüksek olan, yani ölçümün zaman boyunca 10 pikselden fazla hareket eden damlacıkları hariç tutun.
- Sütun DAPI_WD_PosPxlPercent_1'nde 0'dan üstün değerlere sahip damlacıkları sıralayarak ilk zaman noktasında lekeli hücreler (DAPI kanalı) içeren damlacıkları tanımlayın.
- Her floresan kanalının (FluoChannel_BL_Ratio_t sütun) floresan yer değiştirmesine aşağıdaki 3 kriteri uygulayarak salgılayan hücreleri içeren damlacıkları tanımlayın.
- Ölçüm süresi boyunca pozitif bir eğim için sıralama yaparak artan yer değiştirme değerlerine sahip damlacıkların belirlenmesi.
- Algılama sınırına (LOD) ulaşan yer değiştirme değerlerine sahip damlacıkların belirlenmesi. Ölçüm süresi boyunca maksimum floresan yer değiştirmesi, başka bir yerde açıklandığı gibi hesaplanan LOD'den daha üstün olduğunda bir damlacık seçilir25:
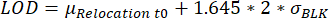 , burada μ Yer Değiştirme t0, 0 zaman noktasındaki tüm yer değiştirme değerlerinin medyanıdır ve BLKσ kalibrasyon sırasında ölçülen boşluğun standart sapmasıdır, her biri sitokine özgüdür.
, burada μ Yer Değiştirme t0, 0 zaman noktasındaki tüm yer değiştirme değerlerinin medyanıdır ve BLKσ kalibrasyon sırasında ölçülen boşluğun standart sapmasıdır, her biri sitokine özgüdür. - Ölçüm süresi boyunca ölçülen maksimum ve minimum floresan yer değiştirmesi arasındaki değişimin aşağıdakilerden üstün olduğunu kontrol ederek yer değiştirme değerindeki artışın önemli olduğunu doğrulamak:
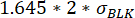 .
.
- Adım 8.3'te açıklanan kriterleri karşılayarak birlikte salgılayan hücreleri tanımlayın. aynı anda birden fazla floresan kanalı için.
- Adım 8.3'ü tekrarlayın. hücre içermeyen tüm damlacıklar için (DAPI_WD_PosPxlPercent_1 = 0). Yanlış pozitif yüzdeyi hesaplamak için bu damlacıkları kullanın.
- Rastgele 200 - 500 damlacık seçerek ve bunları görüntü analizi yazılımının Doğrula ve sırala işleviyle inceleyerek ölçümün doğru λ değerini belirleyin. Bu damlacıklardaki hücre sayısını sayın ve hesaplayın:
λ = sayılan hücre sayısı / analiz edilen damlacık sayısı - Ölçüm için kapsüllenmiş hücrelerin toplam sayısını şu şekilde hesaplayın:
Toplam hücre sayısı = λ × analiz edilen damlacık sayısı - Belirlenen hücre sayısını kullanarak salgılayan hücrelerin yüzdesini hesaplayın. Ek olarak, her sitokin için yanlış pozitif yüzdesini hesaplayın (kanal başına gerçek pozitiflerin sayısına göre genellikle %3-5'ten az) ve bunları deneysel tutarlılık ve tekrarlanabilirlik için dahili bir kontrol olarak kullanın.
- Salgılanan sitokin konsantrasyonlarını hesaplamak için, adım 7.10'daki yerleşik kalibrasyon denklemlerini kullanarak yer değiştirme değerlerini konsantrasyona dönüştürün.
- Aşağıdaki denklemi kullanarak zaman noktaları arasındaki salgı oranını (SR) hesaplayın.
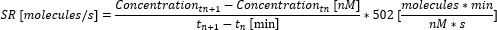
- Zaman noktaları arasındaki bireysel salgılama oranlarının ortalamasını alarak ölçüm üzerinden ortalama salgılama oranını hesaplayın. Ölçümün bitiminden önce maksimum ölçülebilir yer değiştirmeye ulaşıldıysa, konsantrasyonu maksimum ölçülebilir konsantrasyona ayarlayın (bu değer sitokine özgüdür ve adım 6.10'daki kalibrasyon eğrisinde ölçülen ve kullanılan maksimum konsantrasyona karşılık gelir) ve daha fazla konsantrasyon hesaplamayın. Salgı oranını hesaplayın ve sadece bu zaman noktasına kadar ortalamasını alın.
NOT: Bir floresan kanalında 50'den az salgı hücresi tespit edilirse, damlacıklar doğrulama ve sıralama işlevi aracılığıyla görsel olarak incelenmelidir ve floresan veya nanopartikül agregalarına sahip damlacıklar analizden çıkarılabilir. - Her bir hücrenin salgılama eğrisinden daha fazla parametre çıkarmak için, özel bir Python komut dosyası (istek üzerine temin edilebilir) kullanarak her hücre ve sitokin için zaman-konsantrasyon eğrisine en az kare uyumu gerçekleştirin. Takılan fonksiyon, aşağıda açıklanan formülü izleyen sigmoidal bir eğridir (R2<0.95 ile uyumlar aşağıdaki adımların dışında tutulur):
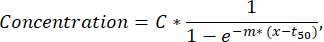
burada C konsantrasyon platosuna [nM], t50 yarı maksimumun [s] kaymasına ve m Tepe eğimine [min-1] karşılık gelir. Bu parametrelerden, aşağıdaki eğri tanımlayıcıları aşağıda açıklandığı gibi çıkarılır.- Cmaks [nM]: Ölçülen maksimum konsantrasyon.
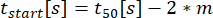 : Uyumun C'nin %10'una ulaştığı sekresyonun başlama zamanı.
: Uyumun C'nin %10'una ulaştığı sekresyonun başlama zamanı.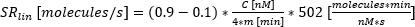 : zaman-konsantrasyon eğrisinin %10 ile %90'ı arasındaki eğrinin yaklaşık doğrusal eğimi olarak salgılama oranı.
: zaman-konsantrasyon eğrisinin %10 ile %90'ı arasındaki eğrinin yaklaşık doğrusal eğimi olarak salgılama oranı.
Temsili Sonuçlar
Sunulan fonksiyonel tek hücreli platform, çeşitli parametrelerin ölçülmesine izin verdi. İlk olarak ve standart tekniklere benzer şekilde, salgılayan hücrelerin frekansı ölçümün sonunda gösterilir (Şekil 4A). 6 saatlik periferik kan mononükleer hücreleri (PBMC) için 1 μg/mL lipopolisakkarit (LPS) ile stimülasyonu takiben, hücrelerin %5.81'i IL-6 (n= 1270), %4.55'i TNFα (n= 995) ve %6.06'sı IL-1β (n= 1326) salgıladı.
Sitokin sekresyonunu ölçmek için, bilinen rekombinant sitokin konsantrasyonları ile kalibrasyon eğrileri oluşturuldu (Şekil 4B). Bu kalibrasyon eğrileri, zaman içinde damlacık içi sitokin konsantrasyonlarının miktarının belirlenmesine izin verir. Örnek olarak, ortalama damlacık içi IL-6 konsantrasyonu, LPS ile uyarılan PBMC için 90 dakika sonra bir platoya ulaşırken, ortalama damlacık içi IL-1β 90 dakikadan daha hızlı artarak platformun dinamik çözünürlüğünü ve spesifik sitokinleri salgılayan hücre alt popülasyonlarını çıkarma olasılığını gösterir (Şekil 4C). Konsantrasyon ölçüm noktaları arasında değiştikçe, sitokin başına dinamik sekresyon oranlarını hesaplamak mümkündür. Her sitokin için ortalama sekresyon hızı göz önüne alındığında (Şekil 4D), IL-6 salgılayan hücreler ortalama sekresyon hızında sabit bir azalma sergilerken, TNFα ve IL-1β salgılayan hücrelerin her ikisi de 90 dakikalık ölçüm süresinden sonra sekresyon hızında bir artış ve 150 dakika sonra ikinci bir azalma göstermiştir.
Ayrıca, salgılanan ve birlikte salgılanan sitokinlere bağlı olarak hücreleri alt popülasyonlara ayırmak mümkündür (Şekil 4E). Burada, IL-6 ve TNFα, IL-6 veya TNFa salgılayan hücrelerin sırasıyla% 30.2 ve% 26.4'ü tarafından tek salgılanırken, tek salgılanan IL-1β hücreleri, tüm IL-1β salgılayan hücrelerin% 68.8'ini oluşturur. Ek olarak, ko-sekresyonun salgılanan konsantrasyonlar ve sekresyon oranları üzerindeki etkileri çözülebilir (Şekil 4F). IL-6 salgılayan hücrelere bakarak, hücreler ek olarak TNFα veya IL-1β ürettiyse farklı miktarlarda IL-6 salgılandı. Benzer şekilde, ölçüm boyunca ortalama sekresyon oranlarının dağılımı, TNFα (daha yüksek sekresyon oranları) ve IL-1β (daha düşük IL-6 sekresyon oranları) ile birlikte sadece IL-6 veya IL-6 salgılayan hücreler arasında istatistiksel olarak farklılık göstermiştir.
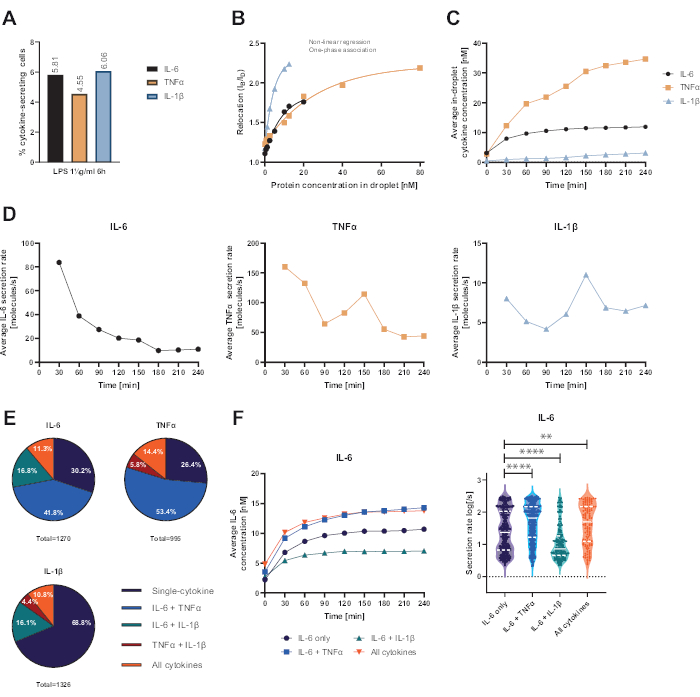
Şekil 4: 1 μg/mL LPS ile 6 saatlik stimülasyondan sonra PBMC salgılayan IL-6, TNFα ve IL-1β'nin temsili sonuçları. (A) 4 saatlik ölçümün sonunda IL-6, TNFα ve IL-1β salgılayan PBMC yüzdesi. (B) Çoğullanmış sitokin kalibrasyon eğrileri, bilinen rekombinant sitokin konsantrasyonları ile oluşturulur. Bu, yer değiştirme değerinden damlacık içindeki sitokin konsantrasyonunu hesaplayarak hücre deneylerinin nicelleştirilmesine izin verir. Noktalar, doğrusal olmayan tek fazlı ilişkilendirme eğrisi uyumu, r2=0.9926 (IL-6), 0.9901 (TNFα), 0.9990 (IL-1β) kullanılarak yerleştirildi. (C) 4 saatlik ölçüm süresi boyunca PBMC salgılanarak salınan ortalama salgılanan IL-6, TNFα ve IL-1β konsantrasyonları. (D) 4 saatlik ölçüm süresi boyunca IL-6, TNFα ve IL-1β'nın ortalama sekresyon oranları. (E) IL-6, TNFa veya IL-1β salgılayan birlikte salgılayan hücrelerin nispi yüzdesi ve bunların kombinasyonları. Her sitokin için tespit edilen tüm salgılayan hücrelere normalize edilmiştir. (F) Birlikte sekresyon çözünürlüğüne sahip IL-6 salgılayan hücreler için ölçüm süresi ve ortalama sekresyon hızı (log) dağılımları boyunca ortalama IL-6 konsantrasyonları (sadece IL-6 için n = 383, IL-6 + TNFa için n = 531, IL-6 + IL-1β için n = 213 ve IL-6 + TNFα + IL-1β için n = 143). Sekresyon hızı dağılımlarındaki istatistiksel farklılıklar iki taraflı, eşleştirilmemiş, parametrik olmayan Kolmogorov-Smirnov testleri kullanılarak %95 güvenle değerlendirildi, p değeri temsil edildi. ** (p <0.002) ve **** (p <0.0001). Tam çizgi medyanı ve noktalı çizgi çeyrekleri temsil eder. ntoplam hücre = 21 866. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tek hücre seviyesi hakkında ek bilgi elde etmek için, her hücrenin ve sitokinin konsantrasyon-zaman noktalarına bir sigmoid fonksiyonu takılabilir (Şekil 5). Bir hücre için zaman içinde örnek bir konsantrasyon veri seti ve karşılık gelen sigmoidal uyum Şekil 5A'da gösterilmiştir. Burada, en küçük kareler uydurma prosedürü aşağıdaki parametreleri verir: Eğrinin üst plato değerine karşılık gelen C, eğrinin sıfırdan zaman açısından kaymasını ölçen t50 ve ölçüm boyunca ulaşılan %10 ve %90 konsantrasyon değerleri ile sigmoid eğrisinin yükselen kısmının dikliğini tanımlayan Hill eğimi m. Bu uyum parametrelerinden, bazı eğri tanımlayıcıları adım 7.12'de açıklandığı gibi çıkarılabilir. verinin en yüksek konsantrasyon değeri olan Cmax'ı verirken, üst plato konsantrasyon değerinin %10'una ulaşması olarak tanımlanan sekresyonun başlama zamanı olan t başlangıcı ve eğrinin yükselen kısmı sırasında salgılanma hızı olan SRlin.
Hücre alt popülasyonlarını sınıflandırmak için, tüm tek hücreli uyumlardan elde edilen eğri tanımlayıcılarının her biri üç kategoriye ayrıldı: Cmax değerleri, tbaşlangıcı için erken, orta ve geç bir SRlin'e yavaş, orta ve hızlı salgılayıcılar için düşük, orta ve yüksek olarak gruplandırıldı. Bu sınıflandırmayı göstermek için, dört örnek tek hücreli sekresyon eğrisi ve bunlara karşılık gelen eğri tanımlayıcıları gösterilmiştir (Şekil 5A-D), burada A eğrisi orta hızlı bir erken düşük sekretörün özelliklerini sergiler, eğri B erken, yavaş ve yüksek bir sekretördür, C eğrisi erken hızlı bir yüksek sekresyondur ve D eğrisi geç düşük sekresyonunu gösterir. Bu kriterler için kesme noktalarının hücre, sitokin ve tahlil parametresine özgü olduğunu ve her araştırma sorusu için uyarlanması gerektiğini belirtmek önemlidir. Ayrıca, burada 6 saat boyunca 1 μg/mL LPS stimülasyonundan sonra PBMC'nin sadece IL-6 sekresyonu düşünüldü, bu da çoğu hücrenin sırasıyla %80 ve %79 ile erken ve yüksek sekresyon olduğu anlamına geliyordu (Şekil 5E-F). Sekresyon oranı ile ilgili olarak, IL-6 salgılayan hücrelerin %55'i yavaş sekresyon ve %39'u hızlı sekresyonör olan bipolar bir yanıt gözlenmiştir (Şekil 5G).
Sekresyon davranışını daha fazla karakterize etmek için, her hücre için eğri tanımlayıcıları birbirine karşı çizildi ve farklı kümeler çıkarıldı (Şekil 5H-J). Tbaşlangıcı ile Cmax arasında net bir korelasyon verilmemiştir (Şekil 5H): en büyük iki popülasyon, sekresyon başlangıcından bağımsız olarak erken düşük sekretörler ve yüksek sekretörlerdi. Tbaşlangıç ve SRlin arasındaki ilişki göz önüne alındığında (Şekil 5I), çoğu hücre erken yavaş salgılayıcıydı ve açık bir erken yüksek salgı popülasyonu ve az sayıda yavaş/orta ila geç salgı vardı. SRlin ve Cmax (Şekil 5J) korelasyonları ile ilgili olarak, hemen hemen hiç hızlı düşük ila orta salgılayıcı mevcut değildi, sadece daha büyük bir hızlı düşük salgılayıcı popülasyonu vardı. Ayrıca, maksimum ölçülen konsantrasyona bağlı olmayan büyük bir hızlı salgı popülasyonu vardı ve iki yüksek salgı popülasyonu yavaş veya hızlı salgılanıyordu. Özetle, tek tek hücreler için eğri tanımlayıcıları arasındaki ilişkinin araştırılmasının çok daha ayrıntılı bir analiz sağladığı ve tek hücre sekresyon ölçümlerinden potansiyel olarak yeni biyolojik bulgular çıkarabileceği sonucuna varılabilir.
Yukarıda tanıtılan analizle, birlikte salgılayan hücrelerin salgılama dinamiklerini çıkardık (Şekil 6). İki örnek eğri, her iki sitokinlerin aynı anda başlaması (Şekil 6A) veya önce IL-6'nın salgılanması (Şekil 6B) ile sıralı bir sekresyon başlangıcı olan iki tek hücreden IL-6 ve TNFa için farklı ko-sekresyon dinamiklerini göstermektedir. Tüm birlikte salgılayan hücreleri sınıflandırmak için, 60 dakikalık bir sekresyon gecikmesi tanımlandı, bu aralıkta sekresyona başlayan tüm hücreler eşzamanlı salgılar olarak kabul edildi ve daha uzun gecikmelere sahip tüm hücreler sıralı salgılar olarak kabul edildi. Bu analiz aynı zamanda ilk olarak hangi sitokinin salgılandığını gözlemleme olanağına da izin verdi. IL-6 ve TNFa için, hücrelerin %76'sında esas olarak eş zamanlı birlikte sekresyon gözlenirken (Şekil 6C), IL-6 ve IL-1β için hücrelerin %86'sında sıralı ko-sekresyon gözlenmiştir ve IL-6 çoğu durumda salgılanan ilk sitokindir (Şekil 6D).
Tüm bireysel birlikte salgılayan hücreler için farklı sitokinler için sekresyonun başlangıç zamanına bakıldığında, gerçekleştirilen deneylerde sekresyon başlangıç zamanları arasında net bir korelasyon gözlenmemiştir. IL-6 ve TNFα ko-sekresyonu için (Şekil 6E), IL-6 ile başlayan birlikte salgılayan hücrelere daha yaygın olarak karşılık gelen, yaklaşık 0 dakika civarında daha büyük bir dikey küme mevcuttu. IL-6 ve IL-1β birlikte sekresyonu için (Şekil 6F), çoğu hücre ölçümün başlangıcında IL-6 salgılamaya başlarken, IL-1β esas olarak daha sonra salgılandı. Özetle, burada sunulan analiz, farklı sekretör alt popülasyonlarının ve kompleks sitokin ko-sekresyon dinamiklerinin tanımlanmasını sağlamıştır.
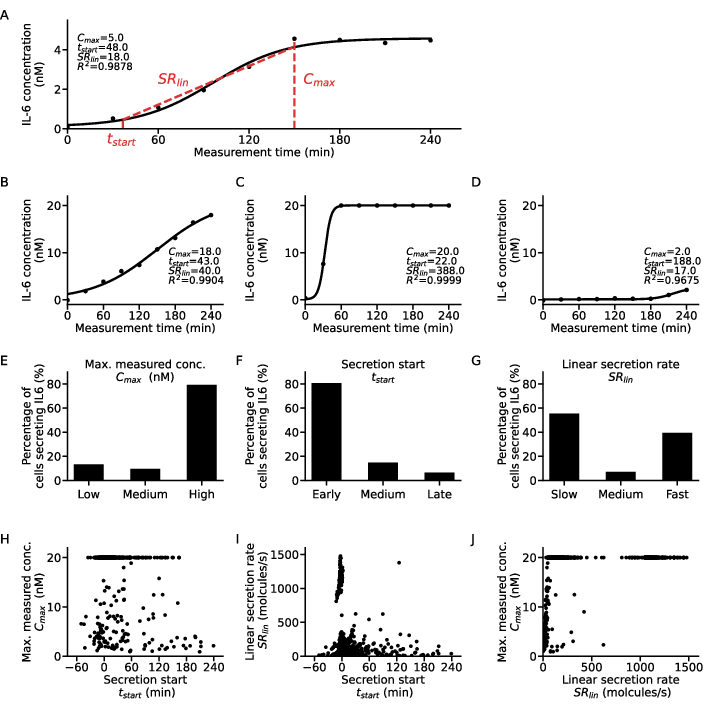
Şekil 5: Tek IL-6 salgılayan hücre eğrileri için farklı sekresyon dinamiği modellerinin ayrıntılı analizi. (A) Takılan sigmoid eğrisi ve ekstrakte edilen parametreler ile ölçüm süresi boyunca temsili tek hücreli sitokin konsantrasyon verileri. (B-D) LPS stimülasyonundan sonra IL-6 sekresyonu için bulunan farklı sitokin sekresyon tipleri için üç örnek tek hücreli sitokin konsantrasyon eğrisi. (E-G) Aşağıdaki kriterlerle farklı sekretör tiplerine göre sınıflandırılan IL-6 salgılayan hücrelerin yüzdeleri (n=633): E. Cmaks: düşük <5 nM, yüksek >19.5 nM, F. tbaşlangıç: erken <30 dk, geç >120dk, G. SRlin: yavaş <250 molekül/s, hızlı >750 molekül/s. (H-J) Üç sekresyon eğrisi tanımlayıcısı arasındaki ilişki Cmaks, Her bir hücre için tbaşlangıç ve SRlin (n = 633). Cmax = 20nM'deki büyük popülasyon, testin üst tespit sınırına ulaşılmasından kaynaklanır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
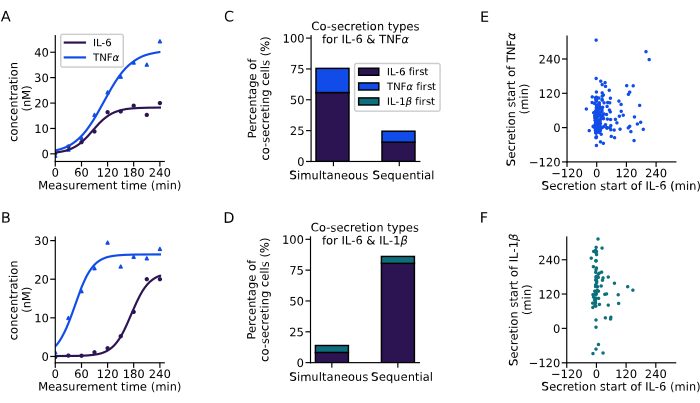
Şekil 6: Tek hücreli konsantrasyon eğrilerinden ko-sekresyon modellerinin çıkarılması. (AB) IL-6 ve TNFa'yı (A) sırasıyla aynı anda ve (B) sırayla birlikte salgılayan tek hücreler için temsili konsantrasyon eğrileri. (C-D) Sırasıyla IL-6 ve TNFα (n = 249) veya IL-6 ve IL-1β (n = 72) ile eşzamanlı ve sıralı birlikte sekresyon sergileyen hücrelerin yüzdesi. Sıralı sekresyon, sitokin sekresyonunun başlaması arasındaki 60 dakikadan fazla gecikme ile tanımlanır. Renkler, hangi sitokinlerin ilk olarak salgılanmaya başladığını gösterir. (E-F) Her salgılayan hücre için farklı sitokinler için sekresyon başlangıç zamanları arasındaki ilişki (nIL6-TNFα=249, nIL6-IL1β=72). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Sitokin salınımı ve sekresyonu immünoloji ve klinik tıpta sıklıkla araştırılmaktadır3. Dengesiz sitokin sekresyonu, enfeksiyonlardan muzdarip hastalar için değil, aynı zamanda nörolojik hastalık, iltihaplanma veya kanserde de zararlı etkilere yol açabilir 26,27,28. Sağlık ve hastalıktaki önemleri iyi bilinmesine rağmen, mevcut metodolojiler tek bir hücreden kaynaklanan sitokinleri zamana bağlı bir şekilde doğru bir şekilde tespit etme ve ölçme yeteneğine sahip olmadığından, sitokinleri ve salgılayan hücrelerini incelemek zor olmaya devam etmektedir. Burada sunulan iş akışı için, PBMC ile yerleşik bir stimülasyon protokolü kullanıldı ve bunların IL-6, TNF-α ve IL-1β salgılanması ölçüldü. Bireysel, saflaştırılmış alt popülasyonlar yerine PBMC'lerin kullanılması seçimi, sitokin salınım sendromlarını (CRS) araştırmak için önceki uygulamadan kaynaklanmıştır.23 IL-6, TNF-α ve IL-1β29 dahil olmak üzere proinflamatuar sitokinlerin oldukça yüksek plazma konsantrasyonları ile karakterize bir durum. CRS genellikle sadece bir popülasyona bağlı olmadığından, in vivo olarak mevcut olacakları için PBMC'leri kullandık. Bununla birlikte, bilimsel soru bu adımı gerektiriyorsa, hücresel alt popülasyonlar saflaştırılabilir ve ayrı ayrı değerlendirilebilir. Kuluçka süresi, stimülasyon koşulları ve dinamik tahlil aralıkları, ilgilenilen üç sitokin için sekresyonunu ölçmek için optimize edildi. Burada sunulan iş akışı ve veriler, çoklu sitokinlerin zamanla çözülen tek hücreli salgılanmasının nasıl ayarlanacağını, kalibre edileceğini, ölçüleceğini, ölçüleceğini ve analiz edileceğini gösterir. Bu protokol, sitokin sekresyonunun çok işlevli analizinin, hastalarda salgılanan sitokinin büyük fonksiyonel ve dinamik çeşitliliğini nasıl sağlayabileceğine dair bir plan sağlar.
Açıklanan tahlil protokolünün birkaç önemli yönü, benzersiz bir biyolojik okuma sağlar. İlk olarak, mikroakışkan damlacıklardaki tek hücreli kapsülleme, her bir hücre için verilerin çıkarılmasına izin verdi. Çoklu hücre kapsülleme olayları, araştırma sorusuna bağlı olarak görüntü analizi ile tespit edilebilir ve sıralanabilir veya sıralanabilir. İkincisi, birkaç bağımsız damlacık içi floresan immünolojik testin dahil edilmesi ve işlevselleştirilmiş nanopartiküllerin hizalanması, paralel olarak üç sitokin konsantrasyonuna kadar kantitatif ölçüme izin verdi. Bu çoğullama, sitokin ortak sekresyon modellerinin tek hücre düzeyinde analizini mümkün kıldı. Üçüncüsü, damlacıkların immobilizasyonu, her salgılayan hücre için sitokin sekresyonunun zaman bazında ölçülmesine ve korelasyonuna izin verdi ve ko-okakımı sıralı sekresyondan ayırt etmeye izin verdi. Zaman çözünürlüğü, farklı sekretör tiplerinin sekresyon modelleri ve alt popülasyonları hakkında benzersiz bir şekilde veri sağladı. Son olarak, paralelleştirilmiş görüntü analizi, 20.000'den fazla ayrı hücreyle yapılan ölçümlerden büyük miktarda verinin verimli bir şekilde çıkarılmasını ve izlenmesini sağladı. Tek sekresyon eğrilerinden ekstraksiyon, fenotipik alt popülasyonların ve işlevlerin keşfedilmesine daha fazla izin verdi.
Eşsiz okumasının yanı sıra, tahlilin standart sitokin analizine göre teknik avantajları da vardır. Kapsülleme bölmelerinin yaklaşık 60 pL'lik küçük boyutu sayesinde, salgılanan sitokinlerin mutlak miktarları, hücre sekresyonuna uyan tespit limitleri ile doğrudan biyolojik kaynaktan tespit edilebilir. Tahlil minyatürleştirmesi ayrıca daha küçük miktarlarda pahalı biyo-reaktifler kullanır. Ayrıca, kurulum, genellikle biyoloji ve biyomühendislik laboratuvarlarında zaten mevcut olan çok az özel ekipman gerektirir. Floresan mikroskopları yaygın olarak bulunur ve şırınga pompaları biyomühendislik laboratuvarlarında sıklıkla kullanılır veya nispeten düşük bir maliyetle satın alınabilir. Bir hücre kültürü mevcutsa, deneyleri yürütmek için gereken tam ekipmanın maliyeti yaklaşık 148.000 Euro'dur ve çoğunluğu otomatik epifloresan mikroskobun (130.000 Euro) katkısıdır. Bununla birlikte, böyle bir alet genellikle biyolojik laboratuvarlarda bulunabilir ve maliyetin geri kalanı şırınga pompasına (13.000 Euro, ancak daha ucuz alternatifler mevcuttur) ve daha küçük ekipmanlara dağıtılır. Damlacık çipinin ve gözlem odasının imalatı çok iyi tanımlanmıştır17 ve çoğu biyomühendislik laboratuvarında bulunan fırınlar ve plazma temizleyiciler gibi gerekli altyapıya sahip bir temiz oda ortamının dışında gerçekleştirilebilir. Alternatif olarak, ilgili laboratuvarlara damlacık jeneratörü çipleri tedarik etmek için farklı tedarikçiler mevcuttur. İhtiyaç duyulan küçük hacimler nedeniyle, tahlil uygun maliyetlidir ve kurulumu kolaydır.
En yüksek derecede tekrarlanabilirliği sağlamak için, protokolün başarısı için bazı kritik adımlar belirledik. İlk kez kullananlar için yaygın bir sorun, ölçüm sırasında damlacık hareketidir. Analiz yazılımı tek tek damlacıkları bir dereceye kadar izleyebilse de, aşırı hareket tek hücre çözünürlüğünün kaybına ve yanlış sonuçlara yol açar. Uygun hava geçirmez ölçüm odaları, doğru damlacık boyutu ve oda boyutları, ölçüme başlamadan önce kısa bir dengeleme süresi ve uygun yüzey aktif madde konsantrasyonu kullanılarak hareket önlenebilir. Bir diğer kritik adım, ölçüme başlamadan önce doğru odaklamadır. Yanlış odaklama, floresan yer değiştirme değerlerinin önemli ölçüde düşmesine ve salgılanan sitokin miktarının hafife alınmasına yol açar. Son olarak, eldeki soruya ve protokole bağlı olarak, farklı adımlar arasındaki doğru zamanlama, tekrarlanabilirlik için son derece önemlidir. Özellikle haznenin doldurulması ile ölçümün başlatılması arasındaki bekleme süresi tutarlı olmalıdır, aksi takdirde salgılanan sitokinlerin ölçüm penceresi kaçırılabilir.
Sunulan teknolojinin sınırlamaları, kapsüllemeden sonra hücreleri daha fazla manipüle etme yeteneğinin kısıtlı olmasını içerir. Bu nedenle şu anda uyarıcılar, antikorlar veya ek reaktifler eklemek veya çıkarmak mümkün değildir. Ek olarak, hücreler izole edilmiş biyoreaktörlerinde kapsüllendiğinden, ölçüm sırasında hücreler arasında herhangi bir etkileşim (temas tabanlı veya parakrin sinyalleme) gerçekleşemez. Bu sınırlama, önceden toplu inkübasyonlarla kısmen aşılabilir. Ayrıca, salgılanan sitokinlerden artmış otokrin etkiler de mümkündür ve bu etkiler, yalnızca antikor tarafından tespit edilen salgılanan sitokinler ölçüldüğü için kesin olarak ölçülemez veya dışlanamaz. Bu nedenle, sitokin sekresyonu ile ilgili izole görüş her zaman ilgili soru ve uygulama bağlamında tanımlanmalıdır. Bununla birlikte, bu sınırlama, ilgi çekiciyse, kapsüllenmiş katlar, çiftler ve üçlülerin ayrıntılı çalışması için de kullanılabilir. Bu, hücre-hücre temasını veya parakrin tabanlı soruları araştırmak için yararlı olan ilginç bir kurulum sağlayacaktır. Son olarak, testin dinamik aralığı da sınırlıdır ve spesifik uygulamaya uyarlanması gerekir. Burada, testin dinamik aralığını, ölçülen sitokinlerin beklenen salgılanan miktarına uyarladık.
Tahlilin yeteneklerini ve uygulanabilirliğini daha da ilerletmek için, gelecekte biyolojik, teknik ve veri analizi yönlerinde çeşitli gelişmeler ele alınabilir. Biyolojik açıdan, ek sitokinlerin, diğer salgılanan proteinlerin, metabolik veya hücre yüzeyi belirteçlerinin ölçümü, testin uyarlanmasıyla entegre edilebilir. Ayrıca, bu tahlil, okumaları genişletmek için diğer hücre bazlı tahlillerle birlikte bir iş akışına entegre edilebilir (örneğin, akış sitometrisi boyama veya dizileme). Ek olarak, tahlilin kullanılabilirliği, örneğin damlacık oluşturma ve gözlemleme için entegre bir mikroakışkan çip oluşturularak basitleştirilebilir, böylece potansiyel olarak klinik bir ortamda biyomühendislik laboratuvarları dışında daha geniş bir uygulama mümkün kılınabilir. Veri analizi ile ilgili olarak, görüntülerden bilgilerin çıkarılması ve izlenmesi, otomasyonun geliştirilmesi ve makine öğrenimi yaklaşımlarının kullanılmasıyla, örneğin floresan etiketleme olmadan her damlacıktaki hücrelerin ve boncuk çizgisinin varlığını ve konumunu tespit ederek genişletilebilir. Bunu yapmak, immünolojik testler için kullanılabilecek ek floresan kanalları açacak ve paralel olarak daha fazla sitokinin ölçülmesine neden olacaktır.
Sunulan tahlil ve ilgili protokoller ve analiz, sitokin sekresyon dinamikleri ile ilgili çeşitli potansiyel kullanım durumları için uygulanabilir. Daha spesifik olarak, tahlil, hücre tipi ve aktivasyona özgü sitokin sekresyon profillerinin tanımlanması, sitokin salgılayan hücrelerin poliişlevselliği veya sitokin dengelerinin zamansallığı ve bakım mekanizmaları gibi temel immünolojik soruları potansiyel olarak ele alabilir. Ayrıca, klinik uygulamalarda platform, COVID-1930'da gözlemlendiği gibi aktif veya kronik inflamatuar yanıtlar sırasında sitokinlerin rolünün çözülmesini sağlayabilir veya otoinflamasyonda olduğu gibi benzersiz imzalara dayalı olarak hastaları sınıflandırmak ve tedavileri kişiselleştirmek için bir araç sağlayabilir31. Sonuç olarak, tek hücrelerden sitokin sekresyonunun kantitatif zaman çözümlü değerlendirmesi, belirli bir ilacın, enfeksiyonun, genetik değişikliğin veya ex vivo stimülasyonun belirli bir yanıtı nasıl indüklediğini açıkladığı için çok ihtiyaç duyulan bir yöntemdir.
Açıklamalar
Hücrelerin boncuk çizgisi ölçümleri gibi belirli yönler patentlenmiştir.
Teşekkürler
Bu proje, ETH Alanının (İsviçre Federal Teknoloji Enstitüleri) Stratejik Odak Alanı Kişiselleştirilmiş Sağlık ve İlgili Teknolojiler (PHRT) #2021-349 hibesi, Avrupa Araştırma Konseyi başlangıç hibesi (hibe #803,336) ve İsviçre Ulusal Bilim Vakfı (hibe #310030_197619) ile desteklenmiştir. Ek olarak, Guilhem Chenon ve Jean Baudry'ye çalışmaları ve ilk DropMap analizörünü geliştirmeleri için teşekkür ederiz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 008-FluoroSurfactant | RAN Biotechnologies | 008-FluoroSurfactant-10G | |
| 2-Stream flow-focusing droplet maker, 30 µm nozzle, PFOS hydrophobic surface treatment | Wunderli chips | ||
| Alexa Fluor 647 NHS Ester | ThermoFisher | A20006 | https://www.thermofisher.com/ch/en/home/references/protocols/cell-and-tissue-analysis/labeling-chemistry-protocols/fluorescent-amine-reactive-alexa-fluor-dye-labeling-of-igm-antibodies.html |
| Anti-Human IL-1β (Monoclonal Mouse), AF647 labelled in-house | PeproTech | 500-M01B | |
| ARcare92524 double-sided adhesive tape | Adhesvies Reasearch | ARcare92524 | |
| Bio-Adembeads Streptavidin plus 300nm | Ademtech | Cat#03233 | |
| Biotinylated Goat Anti-Human IL-1β | PeproTech | 500-P21BGBT | |
| Bovine Serum Albumin (BSA) | Sigma-Aldrich | A3059 | |
| Cell Scraper | TPP | 99002 | |
| CellTrace Violet Cell Proliferation Kit | Invitrogen | C34557 | Cell staining solution |
| Chromafil Xtra PTFE-45/25 syringe filters | Macherey-Nagel | 729205 | |
| Costar 6-well Clear Flat Bottom Ultra-Low Attachment | Corning | 3471 | |
| Countess Cell Counting Chamber Slides | Invitrogen | C10283 | |
| D-Biotin | Fluorochem | M02926 | |
| DPBS, no calcium, no magnesium | Gibco | 14196-094 | |
| epT.I.P.S. Standard 2-200 µl | Eppendorf | 30000889 | |
| Ethylenediaminetetraacetic acid disodium salt solution | Sigma-Aldrich | 3690 | |
| EZ-LINK-NHS-PEG4-Biotin | ThermoFisher | A39259 | https://www.thermofisher.com/order/catalog/product/20217 |
| FcR Blocking Reagent, human | Miltenyi Biotec | 130-059-901 | |
| Fetal Bovine Serum | Gibco | 10270-106 | |
| Handy dish soap | Migros | 5.01002E+11 | |
| HEPES (1 M) | Gibco | 15630-080 | |
| HFE-7500 Oil 3M TM Novec | Fluorochem | B40045191 | |
| Idex F-120 Fingertight One-Piece Fitting, Standard Knurl, Natural PEEK, 1/16" OD Tubing, 10-32 Coned | Cole-Parmer | GZ-02014-15 | |
| IL-6 Monoclonal Antibody (MQ2-13A5 - Rat), FITC | ThermoFisher | 11-7069-81 | |
| IL-6 Monoclonal Antibody (MQ2-39C3), Biotin | ThermoFisher | 13-7068-85 | |
| KnockOut Serum Replacement | ThermoFisher | 10828-010 | |
| Loctite AA 3491 curable UV glue | Henkel AG & Co | 3491 | |
| Microscope slides (76x26x1mm, clear white) | Menzel Gläser | ||
| Mineral oil light | Sigma-Aldrich | 330779 | |
| NanoPort Assembly Headless, 10-32 Coned, for 1/16" OD | Idex | N-333 | |
| Neodymium block magnet | K&J Magnetics | BZX082 | |
| Omnifix-F Spritze, 1 ml, LS | Braun | 9161406V | |
| Penicillin-Streptomycin (10,000 U/mL) | Gibco | 15140-122 | |
| Phosphate buffered saline | Sigma-Aldrich | P4417 | |
| Pluronic F-127, 0.2 µm filtered (10% Solution in Water) | ThermoFisher | P6866 | |
| Precision wipes | Kimtech Science | 5511 | |
| PTFE microtubing 0.30 × 0.76 mm | FisherScientific | 1191-9445 | |
| PTFE microtubing 0.56 × 1.07 mm | FisherScientific | 1192-9445 | |
| Recombinant Human IL-1β | Peprotech | Cat#200-01B | |
| Recombinant Human IL-6 | Peprotech | Cat#200-06 | |
| Recombinant human serum albumine (HSA) | Sigma-Aldrich | A9731 | |
| Recombinant Human TNF-α | Peprotech | Cat#300-01A | |
| Reusable biopsy punch diameter 0.75 mm and 6 mm | Stiefel | 504529 and 504532 | |
| RPMI 1640 Medium, no phenol red | Gibco | 11835-030 | |
| Standard LPS, E. coli K12 | InvivoGen | tlrl-eklps | |
| Sterican needles 23 G for 0.56 mm diameter microtubing | FisherScientific | 15351547 | |
| Sterican needles 27 G for 0.30mm diameter microtubing | FisherScientific | 15341557 | |
| TNF alpha Monoclonal Antibody (MAb11), PE | ThermoFisher | 12-7349-81 | |
| TNF-alpha Monoclonal Antibody (MAb1), biotinylated in-house | ThermoFisher | 14-7348-85 | |
| Trypan Blue Stain (0.4%) for use with the Countess Automated Cell Counter | Invitrogen | T10282 | |
| Vacuum Filtration "rapid"-Filtermax | TPP | 99500 | |
| Devices | |||
| Cameo 4 automatic cutting machine | Silhouette | ||
| Cetoni Base 120 + 3x NEMESYS Low Pressure Syringe Pumps | Cetoni | NEM-B101-03 A | |
| Countess II Automated Cell Counter | ThermoFisher | ||
| Inverted Epi-fluorescence microscope Ti2 | Nikon | ECLIPSE Ti2-E, Ti2-E/B*1 | |
| OKO Lab Cage Incubator, dark panels | OKO Lab | ||
| ORCA-Fusion Digital CMOS camera | Hammatsu | C14440 | |
| SOLA Light Engine | Lumencor | sola 80-10247 |
Referanslar
- Chen, L., et al. Inflammatory responses and inflammation-associated diseases in organs. Oncotarget. 9 (6), 7204-7218 (2017).
- Cicchese, J. M., et al. Dynamic balance of pro- and anti-inflammatory signals controls disease and limits pathology. Immunol Rev. 285 (1), 147-167 (2018).
- Liu, C., et al. Cytokines: From clinical significance to quantification. Adv Sci. 8 (15), e2004433 (2021).
- Rojas, J. M., Avia, M., Martín, V., Sevilla, N. IL-10: A multifunctional cytokine in viral infections. J Immunol Res. 2017, 6104054 (2017).
- Kohanawa, Y. M. A regulatory effect of the balance between TNF-α and IL-6 in the granulomatous and inflammatory response to Rhodococcus aurantiacus infection in mice. J Immunol. 177 (1), 642-650 (2006).
- Geginat, J., et al. Plasticity of human CD4 T cell subsets. Front Immunol. 5, 630 (2014).
- Sallusto, F. Heterogeneity of human CD4+ T cells against microbes. Ann Rev Immunol. 34 (1), 317-334 (2016).
- Chetaille Nézondet, A. L., Poubelle, P. E., Pelletier, M. The evaluation of cytokines to help establish diagnosis and guide treatment of autoinflammatory and autoimmune diseases. J Leukocyte Biol. 108 (2), 647-657 (2020).
- Sims, J. T., et al. Characterization of the cytokine storm reflects hyperinflammatory endothelial dysfunction in COVID-19. J Allergy Clin Immunol. 147 (1), 107-111 (2021).
- Yasen, A., et al. Single-cell RNA sequencing reveals the heterogeneity of infiltrating immune cell profiles in the hepatic cystic echinococcosis microenvironment. Infection and Immunity. 89 (12), (2021).
- Jiang, Y., et al. Single-cell RNA sequencing highlights intratumor heterogeneity and intercellular network featured in adamantinomatous craniopharyngioma. Sci Adv. 9 (15), (2023).
- Tanguay, S., Killion, J. J. Direct comparison of ELISPOT and ELISA-based assays for detection of individual cytokine-secreting cells. Lymphokine Cytokine Res. 13 (4), 259-263 (1994).
- Bucheli, O. T. M., Sigvaldadóttir, I., Eyer, K. Measuring single-cell protein secretion in immunology: Technologies, advances, and applications. Eur J Immunol. 51 (6), 1334-1347 (2021).
- Brower, K. K., et al. Double emulsion flow cytometry with high-throughput single droplet isolation and nucleic acid recovery. Lab Chip. 20 (12), 2062-2074 (2020).
- Brower, K. K., et al. Double emulsion picoreactors for high-throughput single-cell encapsulation and phenotyping via FACS. Anal Chem. 92 (19), 13262-13270 (2020).
- Luo, X., Chen, J. Y., Ataei, M., Lee, A. Microfluidic compartmentalization platforms for single cell analysis. Biosensors. 12 (2), 58 (2022).
- Bounab, Y., et al. Dynamic single-cell phenotyping of immune cells using the microfluidic platform DropMap. Nat Protoc. 15 (9), 2920-2955 (2020).
- Eyer, K., et al. Single-cell deep phenotyping of IgG-secreting cells for high-resolution immune monitoring. Nat Biotechnol. 35 (10), 977-982 (2017).
- Gaa, R., et al. Versatile and rapid microfluidics-assisted antibody discovery. mAbs. 13 (1), 198130 (2021).
- Gerard, A., et al. High-throughput single-cell activity-based screening and sequencing of antibodies using droplet microfluidics. Nat Biotechnol. 38 (6), 715-721 (2020).
- De Jonghe, J., et al. spinDrop: a droplet microfluidic platform to maximise single-cell sequencing information content. Nat Comm. 14 (1), 4788 (2023).
- Wheeler, M. A., et al. Droplet-based forward genetic screening of astrocyte-microglia cross-talk. Science. 379 (6636), 1023-1030 (2023).
- Portmann, K., Linder, A., Oelgarth, N., Eyer, K. Single-cell deep phenotyping of cytokine release unmasks stimulation-specific biological signatures and distinct secretion dynamics. Cell Rep Meth. 3 (7), 100502 (2023).
- Portmann, K., Linder, A., Eyer, K. Stimulation-induced cytokine polyfunctionality as a dynamic concept. eLife. 12, 89781 (2023).
- Armbruster, D. A., Pry, T. Limit of blank, limit of detection and limit of quantitation. Clin Biochem Rev. 29, S49-S52 (2008).
- Yang, J., et al. New insight into neurological degeneration: Inflammatory cytokines and blood-brain barrier. Front Mol Neurosci. 15, 1013933 (2022).
- Kim, P. S., Ahmed, R. Features of responding T cells in cancer and chronic infection. Curr Opin Immunol. 22 (2), 223-230 (2010).
- Becher, B., Spath, S., Goverman, J. Cytokine networks in neuroinflammation. Nat Rev Immunol. 17 (1), 49-59 (2017).
- Cosenza, M., Sacchi, S., Pozzi, S. Cytokine release syndrome associated with T-cell-based therapies for hematological malignancies: Pathophysiology, clinical presentation, and treatment. Int J Mol Sci. 22 (14), 7652 (2021).
- Hu, B., Huang, S., Yin, L. The cytokine storm and COVID-19. J Med Virol. 93 (1), 250-256 (2021).
- Marcuzzi, A., et al. Autoinflammatory diseases and cytokine storms-Imbalances of innate and adaptative immunity. Int J Mol Sci. 22 (20), 11241 (2021).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır