İzole, Basınçlı Lenf Damarlarında Mutlak, Sitosolik, Serbest Ca2+ ve Karşılık Gelen Kontraktilitenin Gerçek Zamanlı Değerlendirmesi
Bu Makalede
Özet
Bu protokol, kasılan lenf damarlarında sitosolik, serbest kalsiyum [Ca2 +] i ve damar çapını gerçek zamanlı olarak ölçmek ve ardından mutlak Ca2+ konsantrasyonlarının yanı sıra kasılma / ritmiklik parametrelerini hesaplamak için bir yöntemi tanımlar. Bu protokol, çeşitli deneysel koşullarda Ca2+ ve kasılma dinamiklerini incelemek için kullanılabilir.
Özet
Şimdi sıklıkla "üçüncü dolaşım" olarak adlandırılan lenfatik damar sistemi, birçok hayati organ sisteminde bulunur. Lenfatik vaskülatür sisteminin temel mekanik işlevi, sıvıyı hücre dışı boşluklardan merkezi venöz kanallara geri döndürmektir. Lenf taşınmasına lenf damarlarının (LV'ler) spontan ritmik kasılmaları aracılık eder. LV kasılmaları büyük ölçüde sitosolik, serbest kalsiyumun ([Ca2+]i) döngüsel yükselişi ve düşüşü ile düzenlenir.
Bu makale, izole, basınçlı LV'lerde gerçek zamanlı olarak [Ca2+]i'nin mutlak konsantrasyonlarındaki ve damar kasılması/ritmikliğindeki değişiklikleri eşzamanlı olarak hesaplamak için bir yöntem sunmaktadır. İzole sıçan mezenterik LV'leri kullanarak, ilaç ilavesine yanıt olarak [Ca2 +] i ve kasılma / ritmiklikteki değişiklikleri inceledik. İzole edilmiş LV'ler, oransal Ca2+ algılama göstergesi Fura-2AM ile yüklendi ve [Ca2+]i ve çap ölçümlerini gerçek zamanlı olarak sürekli olarak yakalamak için kenar algılama yazılımı ile birleştirilmiş video mikroskobu kullanıldı.
Her bir LV'den gelen Fura-2AM sinyali, her gemi için minimum ve maksimum sinyale kalibre edildi ve mutlak [Ca2+]i'yi hesaplamak için kullanıldı. Çap ölçümleri, kasılma parametrelerini (amplitüd, diyastolik son çap, sistolik çap sonu, hesaplanan akış) ve ritmisiteyi (frekans, kasılma süresi, gevşeme süresi) hesaplamak için kullanıldı ve mutlak [Ca2+]i ölçümleri ile ilişkilendirildi.
Giriş
Lenfatik damar sistemi beyin, kalp, akciğerler, böbrek ve mezenter 1,2,3,4,5,6 dahil olmak üzere birçok organ sisteminde bulunur ve sıvı homeostazını sürdürmek için sıvıyı (lenf) interstisyel boşluklardan merkezi venöz kanallara iterek çalışır 7,8,9,10 . Toplayıcı lenf damarlarına (LV'ler) boşalan vasküler kılcal yataklar içindeki kör uçlu lenfatik kılcal damarlarla başlar. Toplayıcı LV'ler iki hücre katmanından oluşur: bir lenfatik kas hücresi tabakası (LMC'ler) tarafından kapsanan bir endotel hücreleri tabakası10,11. Lenf sıvısı taşınması hem dışsal kuvvetler (ör. yeni lenf oluşumu, arteriyel pulsasyonlar, merkezi venöz basınç dalgalanmaları) hem de içsel kuvvetler12 yoluyla sağlanır.
Lenf transportu için içsel kuvvet, lenfatik fonksiyonu araştıran çalışmaların çoğunun odak noktası olan toplayıcı LV'lerin spontan ritmik kasılmasıdır. Bu intrinsik lenfatik pompa esas olarak sitosolik, serbest Ca2 + ([Ca2 +] i) nin döngüsel yükselişi ve düşüşü ile düzenlenir. LMC'lerde plazma membranının spontan depolarizasyonu, voltaj kapılı "L-tipi" Ca2+ (Cav1.x) kanallarını aktive ederek Ca2+ akışını ve ardından LV ritmik kasılmasınıtetikler 8,9,10. Bu rol, LV kasılmalarını inhibe eden ve damar genişlemesine neden olan nifedipin gibi spesifik ajanlarla Cav1.x'i bloke ederek gösterilmiştir13,14. Cav1.x kanallarının aracılık ettiği LMC'lerde [Ca2 +] i veya "Ca2 + spike" deki geçici artış, sarkoplazmik retikulum (SR) üzerindeki inositol trifosfat (IP3) reseptörlerini ve ryRs reseptörlerini (RyR'ler) aktive ederek hücre içi Ca2 + depolarını da harekete geçirebilir15,16,17,18. Mevcut kanıtlar, IP3 reseptörlerinin RyRs15,16,19,20,21'e kıyasla normal LV kasılmaları için gereken Ca2 + 'ya daha fazla katkıda bulunduğunu göstermektedir; bununla birlikte, RyR'ler patoloji sırasında veya farmasötik müdahaleye yanıt olarak rol oynayabilir17,18. Ek olarak, Ca2+ ile aktive edilen K + kanallarının22 ve ATP'ye duyarlı potasyum (KATP) kanallarının23,24 aktivasyonu, LMC membranını hiperpolarize edebilir ve spontan kasılma aktivitesini inhibe edebilir.
LV'lerin toplanmasında Ca2+ dinamiklerini düzenleyebilen birçok başka iyon kanalı ve protein vardır. Farmakolojik ajanlara gerçek zamanlı olarak yanıt olarak Ca2+ ve damar kontraktilitesindeki değişiklikleri incelemek için yöntemler kullanmak, bu potansiyel düzenleyicileri anlamak için önemlidir. LV [Ca2 +] i'deki nispi değişiklikleri ölçmek için Fura-2'yi kullanan daha önceki bir yöntem tarif edilmiştir25. Fura-2 ve Ca2+ için ayrışma sabiti26 olarak bilindiğinden, bu yöntemin uygulamasını genişleten ve Ca2+ sinyali, membran uyarılabilirliği ve kasılma mekanizmaları27 hakkında ek bilgi sağlayan gerçek Ca2+ konsantrasyonlarını hesaplamak mümkündür, ayrıca deney grupları arasında temel karşılaştırmalara izin verir. Bu ikinci yaklaşım kardiyomiyositler28'de kullanılmıştır ve bu nedenle LV'lere uyarlanabilir. Bu makale, izole edilmiş, basınçlı LV'lerde mutlak [Ca2+]i'deki değişiklikleri ve ayrıca damar kasılmalarını/ritmikliğini sürekli olarak gerçek zamanlı olarak ölçmek ve hesaplamak için bu iki yaklaşımı birleştiren gelişmiş bir yöntem sunmaktadır. Ayrıca nifedipin ile tedavi edilen LV'ler için temsili sonuçlar da sağlıyoruz.
Protokol
Dokuz ila 13 haftalık erkek Sprague-Dawley sıçanları ticari bir satıcıdan satın alındı. Varıştan sonra, tüm sıçanlar standart bir laboratuvar diyetiyle Arkansas Üniversitesi Tıp Bilimleri (UAMS) Laboratuvar Hayvan Tıbbı Bölümü (DLAM) tesisinde barındırıldı ve tutuldu ve 25 ° C'de12 saat aydınlık: karanlık döngüsüne maruz bırakıldı. Tüm prosedürler, UAMS'nin Kurumsal Hayvan Bakımı ve Kullanımı Komitesi (IACUC) tarafından onaylanmış hayvan kullanım protokolü #4127'ye göre gerçekleştirilmiştir.
1. Mezenterik LV'lerin diseksiyonu ve kanülasyonu
NOT: Deneyi bozacak herhangi bir akış kesintisi veya sızıntı olmadığından emin olmak için mezenterik LV'lerin izolasyonundan önce perfüzyon odasının kurulması önemlidir.
- Perfüzyon banyosu hazırlığı
- Ticari bir satıcıdan borosilikat cam mikropipetler (1,2 mm dış çap, 0,68 mm iç çap ve 75-100 μm dış uç çapına çekilmiş) satın alın. İzole edilmiş damar perfüzyon odasına monte etmek için mikropipetleri (diğer adıyla kanül) yaklaşık 1-2 cm uzunluğunda kesin ve parlatın.
- Kap perfüzyon odasına monte edilmiş her bir cam kanülü, polietilen boru kullanarak bağımsız yerçekimi beslemeli basınç regülatörleri ile aynı hizada yerleştirilmiş bağımsız basınç transdüserlerine bağlayın.
NOT: Bu, çalışma tasarımına bağlı olarak giriş ve çıkış basınçlarının bağımsız olarak manipüle edilmesine izin verir. Şekil 1'de bu kurulum ayrıntılı olarak gösterilmektedir. - Perfüzyon odasını (5 mL), cam mikropipetleri ve bağımsız yerçekimi beslemeli basınç regülatörünü polietilen boru ile birlikte fizyolojik tuz çözeltisi (PSS; 119 mM NaCl; 24 mM NaHCO3; 1.17mM NaH2PO4; 4.7 mM KCl; 1.17 mM MgS04; 5.5 mM C6H12O6 (glikoz); 0.026 mM C10H16N2O8 (EDTA); ve 1.6 mM CaCl2) herhangi bir hava kabarcığı içermez. Ardından, kanüllere basınç uygulanmaması için basıncı sıkıştırın.
NOT: Bu çözeltinin pH'ı ~ 7.5'tir. Adım 1.3.7'de açıklandığı gibi PSS içindeki bikarbonat tamponlama sistemine etki etmek için CO2 köpürmesi kullanılarak perfüzyon banyosunda 7.4'lük bir pH korunur. EDTA burada fazla Ca2+ iyonlarını şelatlamak için kullanılır.
- Düğümlerin hazırlanması
- Mikroskop altında örgülü ipek dikiş ipliği (8-0 numara) kullanarak çift el üstü düğüm atın. Temel adımlar Şekil 2'de gösterilmiştir.
- Tek bir filamenti ayırın.
- Mikrokünt uçlu iki Dumont # 5 forseps kullanın ve bir forseps kullanarak diğer forsepsin ucunun etrafında çift halka yapın.
- İlmekli forseps ile dikişin gevşek ucunu tutun ve düğümü tamamen kapalı çekmemeye ve küçük bir açıklık bırakmamaya dikkat ederek her iki halkadan da çekin.
- Her iki taraftan fazla dikişi kesmek için Vanna yaylı makas kullanın. LV'yi kanüllere sabitlemek için bu düğümleri daha sonra kullanın.
NOT: Düğüm atma sırasında forseps uçlarına zarar verme tehlikesi daha fazla olduğundan, diseksiyon yapacağınız veya kanül yapacağınız aynı forsepsleri kullanmayın.
- Mikroskop altında örgülü ipek dikiş ipliği (8-0 numara) kullanarak çift el üstü düğüm atın. Temel adımlar Şekil 2'de gösterilmiştir.
- Mezenterik LV'lerin izolasyonu ve kanülasyonu
- 1.5 L / dak O2 doz aşımı ile% 5'lik bir izofluran uygulayarak hayvanları derinlemesine uyuşturun ve dekapitasyon ile kan kaybedin.
- Mezenterik LV'lerin diseksiyonu için önce karın duvarının orta hattı boyunca uzunlamasına bir kesim yaparak, mezenteri dıştan çıkararak ve ardından pilor sfinkterinin hemen altında ve çekumun ~ 2-3 cm üzerinde bağlantıyı keserek ve ayrıca rektuma olan bağlantıyı keserek tüm mezenterleri izole edin.
- Diseke edilmiş bütün mezenterleri 200 mL buz gibi soğuk PSS'de yıkayın ve daha sonra buz gibi soğuk PSS içeren silikon kaplı (8-10 mm) bir Petri kabına (100 mm) aktarın ve sabitleyin.
- Bir stereomikroskop, diseksiyon Dumont # 5 Inox ince forseps ve Vanna yaylı makas kullanarak çevredeki yağ ve bağ dokusundan ikinci dereceden mezenterik LV'leri inceleyin. Dokudan çıkarıldıktan sonra LV'lerin uçlarını tanımlamaya yardımcı olmak için, LV'nin proksimal ucunda küçük bir yağ parçası bırakın.
- Diseke edilen LV'leri cam kanüller üzerinde kanülasyon için damar perfüzyon odasına aktarın.
- Lenf akış yönünü taklit etmek için LV'nin distal ucu P1 kanülü (giriş) ve damarın proksimal ucu P2 kanülü (çıkış) üzerinde olacak şekilde LV'leri kanül etmek için iki önceden keskinleştirilmiş Dumont #5 Inox Fine Forseps, düz uçlu (0.05 x 0.01 mm) kullanın.
NOT: P1 ve P2 kanülleri aynıdır ve yalnızca AG'nin hangi ucunun bağlı olduğuna göre farklılık gösterir. İnce damar duvarının tutulmasını kolaylaştırmak için uçta mükemmel bir şekilde buluşan ve hasarsız forsepslerin kullanılması önemlidir.- Daha sonra kabı kanüllere sabitlemek için her bir cam kanülün üzerine önceden hazırlanmış tek bir düğüm kaydırın.
- LV yönünü yönlendirmeye yardımcı olmak için küçük bir yağ parçası kullanarak, önce distal ucu P1'e kanüle edin.
- Düğümü kanülden aşağı kaydırın ve LV'yi sabitlemek için sıkın. Kanül ucunu aşırı sıkmamaya ve kırmamaya dikkat edin.
- Perfüzyon odasında AG'yi 4-5 mm Hg'ye kadar basınçlandırın.
NOT: Amaçlarımız için, P1 ve P2 basıncını eşit olacak şekilde ayarladık; Bununla birlikte, deneysel koşullara bağlı olarak, basınç, kesme gerilimi veya geri akışı indüklemek için her kanülde ayarlanabilir. - LV'nin proksimal ucunu P1.3.6.1 üzerine kanüle etmek için 1.3.3.6.4-2 adımlarını tekrarlayın.
- Fizyolojik pH'ı korumak için %7 karbondioksit (CO2) /% 93 oksijen (O2) içeren köpüren taşı banyo odasına yerleştirin.
- Odayı sıcaklık regülatörüne bağlayın ve LV'lerin dengelenmesi ve kararlı, kendiliğinden kasılmalar geliştirmesi için 37 °C'ye ayarlayın (yaklaşık 30 dakika).
NOT: Şekil 1'de bu kurulum ayrıntılı olarak gösterilmektedir.
2. LV'lerde [Ca2 +] i'nin mutlak konsantrasyonlarının ölçümü
- Kanüllü LV'lerin fura-2AM boyaması
- Spontan kasılmalar geliştikten sonra (adım 1.3.8'den itibaren), LV'leri Fura-2-asetoksimetil ester (Fura-2AM; 2 μM veya 10 μL / 5 mL) ve pluronik asit (PA;% 0.02 W / V veya 5 μL / 5 mL% 20 PA) ile karanlıkta 30 dakika inkübe edin.
NOT: Fura-2AM'nin eklenmesinden sonra, kalan tüm adımlar karanlıkta gerçekleştirilmelidir. - 30 dakika sonra, tüm banyo hacmini negatif basınçlı bir vakumla boşaltarak ve sıcaklığa uygun (37 oC) reaktif içermeyen PSS ile değiştirerek perfüzyon odasındaki çözeltiyi 3x değiştirin.
NOT: Bu, AG'nin havada asılı kalma süresini en aza indirmek için hızlı bir şekilde yapılmalıdır. Örneğin, vakum için sağ elinizi ve yeni reaktif içermeyen PSS'yi değiştirmek için sol elinizi kullanın. - Yıkadıktan sonra, fazla indikatörü çıkarmak ve deesterifikasyona izin vermek için LV'leri karanlıkta 15 dakika inkübe edin.
- Spontan kasılmalar geliştikten sonra (adım 1.3.8'den itibaren), LV'leri Fura-2-asetoksimetil ester (Fura-2AM; 2 μM veya 10 μL / 5 mL) ve pluronik asit (PA;% 0.02 W / V veya 5 μL / 5 mL% 20 PA) ile karanlıkta 30 dakika inkübe edin.
- Ca'yı Yakalamak2+ Floresan ve damar çapı
- Odayı, bir LED ışık kaynağı, bir 20x S Fluor objektif, bir hücre çerçeveleme adaptörü ve 15 Hz'de kare kare floresan yakalamayı sağlayan hızlı bir CMOS video kamera sistemi ile donatılmış ters çevrilmiş floresan mikroskop sahnesine aktarın.
NOT: Bu iş akışı kurulumunun bir şeması Şekil 3'te sunulmuştur. Ca2+ sinyali, en az 15 fps'lik bir CCD kamera kullanılarak yakalanabilir. - Floresan ve kenar algılamayı kaydetmek için mikroskobu görüntüleme yazılımıyla donatılmış bilgisayara bağlayın.
NOT: Referans verilen yazılım aynı zamanda eşzamanlı basınç kaydını da mümkün kılar; Ancak, bu buraya dahil değildir. - LED ışık kaynağını ve Floresan Sistem arayüzünü açın.
NOT: Burada açıklanan yazılım talimatları, başvurulan yazılım içindir, ancak bu verileri elde etmek için başka yazılımlar da kullanılabilir. - Yazılımı açın (IonWizard).
- Dosya sekmesi altında Yeni'yi seçin.
- Topla sekmesi altında Deneme'yi seçin.
- İstediğiniz deneysel şablonu yükleyin ve Tamam'ı tıklatın.
NOT: Ölçülecek parametrelerle bir deney şablonu oluşturmanız gerekecektir. Şablon kurulum talimatları yazılım kılavuzundabulunabilir 29. - Damar Çapı, Pay (340 sinyali), Payda (380 sinyali) ve Oranı azalan sırada görmek için ekrandaki izleri ayarlayın.
- İzleri görselleştirmeye yardımcı olmak için y ekseni ölçeğini gerektiği gibi ayarlayın.
- İzlemeler'in altında, Kullanıcı Sınırlarını Düzenle'yi seçin. Otomatik Limitler'in işaretli olmadığından emin olun.
- Ayarlamak istediğiniz parametreyi seçin, eksen için minimum ve maksimum değerleri girin ve ardından Tamam'ı seçin.
- Denemeye başlamak için BAŞLAT'a tıklayın (ekranın alt kısmında).
- LV çapını aynı anda ölçmek için, görüntüleme sistemine dahil edilen ve 3 Hz'de LV'lerin kasılma izlerini oluşturan kenar algılama yazılımını kullanın. Bölüm 3'te açıklanan ve Şekil 4'te gösterilen kasılma ve ritmiklik parametrelerini analiz etmek için bu ölçümleri kullanın.
- Aydınlatmayı, AG duvarı koyu çizgiler olarak görünecek şekilde ayarladığınızdan emin olun.
- Yağ ve kalıntı içermeyen bir ilgi alanı (ROI) seçin. Deneme başladıktan sonra bu ROI'yi taşımayın.
- Eşiğin, tüm kasılma döngüsü boyunca damar duvarı kenarı algılanacak şekilde ayarlandığından emin olun.
- Floresan ölçümleri için Fotoçoğaltıcı Tüpü (PMT) açın.
- LED aydınlatıcılar kullanarak 50 ms'lik pozlamalarda 340 ve 380 nm dalga boylarını değiştirerek oransal bir gösterge olan Fura-2'yi uyarın ve tüm görüntüleme alanı boyunca 15 Hz'de 510 nm'de emisyon spektrumlarını yakalayın.
NOT: Tekrarlanabilir Ca2+ ölçümleri elde etmek için tüm optik parametrelerin (uyarma ayarları, emisyon filtreleri, objektif lens ve dikroik aynalar) tüm deney serisi için aynı tutulması önemlidir. - Sinyal-arka plan oranını, önce LV görüş alanının (sinyal) ortasındayken 340 ve 380 floresansı elde ederek ve ardından sahne manipülatörlerini kullanarak görüş alanını kap olmadan banyonun kenarına taşımak için (silikon kaplı kenardan kaçınmaya dikkat ederek ve/veya banyodaki kalıntıları temizleyerek) ölçün.
NOT: Ca2+ ölçümleri için her seferinde kabın orijinal bölümüne geri dönmek önemlidir. - Banyodaki fazla göstergeyi gidermek için banyo solüsyonunu sıcaklığa uygun reaktif içermeyen PSS ile değiştirin. Fazla Fura-2'yi çıkarmak için birkaç banyo değişimi gerekebilir, bu nedenle sinyal-arka plan oranı yaklaşık 10:1 olana kadar bu değişimi tekrarlayın.
- Başlangıç Fura-2 floresan sinyalini ve spontan kasılmaları yaklaşık 30 dakika boyunca kaydedin, ardından voltaja bağlı bir Cav1.x antagonisti olan nifedipinin (NIF; 0.1-100 nM) kümülatif konsantrasyon tepkisi izleyin. Her ilaç konsantrasyonu için arka plan ölçümleri alın.
- Her deneyin sonunda, Ca 2+ yokluğunda minimum Fura-2 floresan sinyalini (Rmin) ve LV'lerin maksimum çapını elde etmek için LV'leri sıcaklığa uygun Ca2+ içermeyen PSS ile yıkayın. Arka planı ölçtüğünüzden emin olun.
NOT: Ca2+ içermeyen PSS, PSS ile aynı bileşime sahiptir ancak CaCl2 içermez ve EDTA, 1 mM EGTA (C14H24N2O10) (pH ~ 7.5) ile değiştirilir. - Doymuş Ca2+ koşullarında maksimum Fura-2 floresan sinyalini (Rmax) ve LV'lerin minimum çapını elde etmek için banyo solüsyonunu 10 mM Ca2+ ve iyonomisin (10 μM IONO), bir Ca2+ iyonoforu içeren sıcaklığa uygun PSS ile değiştirin. Arka planı ölçtüğünüzden emin olun.
- Odayı, bir LED ışık kaynağı, bir 20x S Fluor objektif, bir hücre çerçeveleme adaptörü ve 15 Hz'de kare kare floresan yakalamayı sağlayan hızlı bir CMOS video kamera sistemi ile donatılmış ters çevrilmiş floresan mikroskop sahnesine aktarın.
- Mutlak ölçme formülü [Ca2+]i
- 340 ve 380 nm dalga boylarının oranını kalibre etmek ve mutlak sitozolik serbest Ca2+ konsantrasyonunu ([Ca2 +] i) hesaplamak için Rmin ve Rmax kullanın.
- Denklem (1)26'yı kullanarak mutlak sitozolik serbest Ca2 + konsantrasyonunu ([Ca2 +] i) hesaplayın:
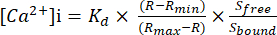 (1)
(1)
Kd = 225 nM (Fura-2 için ayrışma sabiti)26, R = 340/380 oranı, Rmin = 340/380 oranı Ca2+ yokluğunda, Rmax = 340/380 oranı doymuş Ca2+ koşullarıyla, Sserbest = 380 sinyali Ca2+ yokluğunda, Sbağlı = 380 sinyali doygun Ca2+ koşullarıyla
NOT: Tüm floresan sinyaller arka plan floresansı için düzeltilmiştir. - Şekil 5, hangi parametrelerin kaydedildiğini detaylandıran bir örnek Ca2+ izidir. Taban çizgisi Ca2+'yı Ca2+ artışından önceki en düşük dinlenme Ca2+ ve tepe Ca2+ Ca 2+ artışı sırasında elde edilen en yüksek Ca2+ olarak tanımlayın. Genlik, Tepe ve Taban Çizgisi Ca2+ arasındaki farktır. Çevrimdışı olarak Ca2+ ani artış/sn sayısı olarak hesaplanacak olan Ca2+ ani yükselme sıklığı dışında tüm parametreleri doğrudan görüntüleme yazılımından dışa aktarın. Aşağıda, bu parametreleri elde etmek için başvurulan yazılımdaki temel adımlar verilmiştir.
NOT: Tüm izler bir .txt dosyasına aktarılabilir ve tüm parametreler tercih ettiğiniz yazılımda analiz edilebilir veya hesaplanabilir. - Rmin için, Ca2+ içermeyen PSS sırasında arka plana karşılık gelen Pay izlemesinin bölümünü vurgulayın. Bir iletişim kutusu açılır ve izlemenin bu bölümü için değerler sağlanır.
- İşlemler'in altında Sabitler'i seçin.
- Kalsiyum-Sayısal arka planı seçin ve önceki adımdan Pay ve Payda için arka plan numaralarını girin. Tamam'a tıklayın.
- Oran izlemesinin, Ca2+ içermeyen PSS sırasında en düşük orana karşılık gelen bölümünü vurgulayın. Bu Rdk. Ayrıca bu bölüm için Payda değerini de not edin; bu Sücretsizdir.
- 2.3.4 ile 2.3.7 arasındaki adımları, izlemenin yüksek Ca2+ serbest PSS'ye ve en yüksek orana karşılık gelen bölümüylebağlı olarak R max ve S için tekrarlayın.
- İşlemler'in altında Sabitler'i seçin.
- Kalsiyum-Kalsiyum Kalibrasyonu'nu seçin ve Denklem 1'de listelenen değerleri girin. Tamam'a tıklayın.
- Ekrandaki izlerden birini Adım 2.2.8'de açıklandığı gibi ayarlayın , böylece Kalsiyum-Sayısal çıkarılmış Kalsiyum'u görebilirsiniz.
- Kalan parametreleri elde etmek için Monotonik Geçici Olay Analizi gerçekleştirin. Bunun için talimatlar yazılım kılavuzunda30 bulunabilir.
- Alternatif olarak, Dışarı Aktar'ın altında Geçerli İzleme'yi seçin.
- .txt dosyasını dışa aktarmak istediğiniz konumu seçin ve Tamam'a tıklayın.
NOT: Dışa aktarmak istediğiniz tek tek ize tıkladığınızdan emin olun. İzlemenin tamamını veya izlemenin seçili bölümlerini dışa aktarabilirsiniz.
3. AG kasılma ve ritmikliğinin ölçülmesi
- Görüntüleme sistemine dahil edilen kenar algılama yazılımı, yukarıda açıklandığı gibi AG çapı ölçümleri için kasılma izleri oluşturur. Kasılma ve ritmik parametreleri analiz etmek için bu ölçümleri kullanın. Şekil 4 , hangi kasılma parametrelerinin kaydedileceğini detaylandıran örnek bir kasılma izidir. Çevrimdışı olarak hesaplanacak olan kasılma sıklığı, hesaplanan akış ve aralık dışında, Çap izi30'daki Monotonik Geçici Olay Analizi işlevini kullanarak tüm parametreleri doğrudan görüntüleme yazılımından dışa aktarın.
NOT: Tüm izler bir .txt dosyasına aktarılabilir ve tüm parametreler aşağıdaki denklemler kullanılarak tercih ettiğiniz yazılımda analiz edilebilir veya hesaplanabilir. - EDD, ESD, genlik, frekans ve hesaplanan akış ölçümleri
- LV'lerin ritmik ve spontan kasılmaları sırasında elde edebilecekleri maksimum ve minimum çapları (sırasıyla diyastol sonu çapı [EDD] ve sistolik sonu çapı [ESD]) ölçün.
- Kasılmaların genliğini (AMP) EDD ve ESD arasındaki fark olarak hesaplayın.
- Frekansı, ölçüm periyodu başına kasılma sayısı (s cinsinden) olarak hesaplayın.
- Denklem (2) kullanarak μm başına hesaplanan akışı hesaplayın:
Hesaplanan akış = π/4 (EDD2- ESD2) F (2)
EDD2 = gevşemiş durumda damar kesit alanı, ESD2 = daralma sırasında damar kesit alanının ölçüsü, F = kasılma sıklığı/s
- Ritmiklik: kasılma ve gevşeme süresi:
- LV ritmikliğinin diğer ölçümleri kasılma süresi ve gevşeme süresidir.
- Kasılma süresini, LV'nin her kasılmada ESD'ye ulaşması için geçen süre olarak tanımlayın.
- Gevşeme süresini, LV'nin her gevşeme için EDD'ye ulaşması için geçen süre olarak tanımlayın, bu da belirli bir zaman çerçevesi içinde mutlak [Ca2+]i ile ilişkili genel bir ritmiklik göstergesi verecektir.
- Denklem (3)'ten aralık süresini (ΔT) hesaplayın.
Δt = t2 (ESD2)-t1 (ESD1) (3)
Temsili Sonuçlar
LV'lerin kontraktilitesi ve sitozolik, serbest Ca2 + ([Ca2 +] i), değişen nifedipin konsantrasyonlarına (NIF; 0.1-100 nM) maruz kaldıktan sonra izole sıçan mezenterik LV'lerinde değerlendirildi (Şekil 6). Ca2 + spike genliği, taban çizgisi Ca2 + ve tepe Ca2 + dahil olmak üzere parametreler, perfüzyon odasına artımlı NIF ilavesi ile konsantrasyona bağlı bir azalma sergiledi (Şekil 7A). Aynı zamanda, kasılma genliği ve hesaplanan akış gibi kasılma parametreleri de kademeli bir azalma göstermiştir (Şekil 7B). NIF ile EDD çapında küçük bir artış vardı (Şekil 7B). Ca2+ ani yükselme frekansı ve kasılma frekansı, ya hep ya hiç yanıtı gibi görünmektedir. Bununla birlikte, bu etki bir LV için 10 nM'de meydana gelirken, tüm LV'ler kasılmaları 100 nM durdurmuştur. Böylece, birleştirilmiş veriler, kademeli bir konsantrasyon tepkisine benzeyen grafikler oluşturur. Bu etki, diğer preparatlarda LV'ler üzerinde NIF kullanan önceki yayınlarla tutarlıdır (tel ve basınç miyografisi13,14). Manhattan grafikleri, aralık, kasılma süresi ve gevşeme süresi dahil olmak üzere ritmiklik ölçümleri için bireysel LV yanıtlarını gösterir (Şekil 7C). Bu tür bir veri temsili, araştırmacının, altta yatan mekanizmalar hakkında ek bilgi sağlamak için bu ya hep ya hiç yanıtlarını veya kasılma ritimlerindeki değişkenliği ortaya çıkarmasına olanak tanır. Sonuç olarak, kasılma genliği ve frekansındaki azalmalar, in vivo fonksiyon için bir vekil gösterge görevi gören bu izole LV'ler boyunca hesaplanan akışta bir azalmaya neden oldu. Genel olarak, LV kasılmalarındaki azalma [Ca2 +] i'deki azalma ile ilişkilidir. Bulgularımız, 100 nM aralığında, NIF'in lenf kas hücrelerinde (LMC'ler) bulunan Cav1.x kanallarını antagonize ederek LV'lerdeki kasılmaları ve [Ca2+]i salınımlarını etkili bir şekilde durdurduğuna dair doğrudan kanıt sağlar.
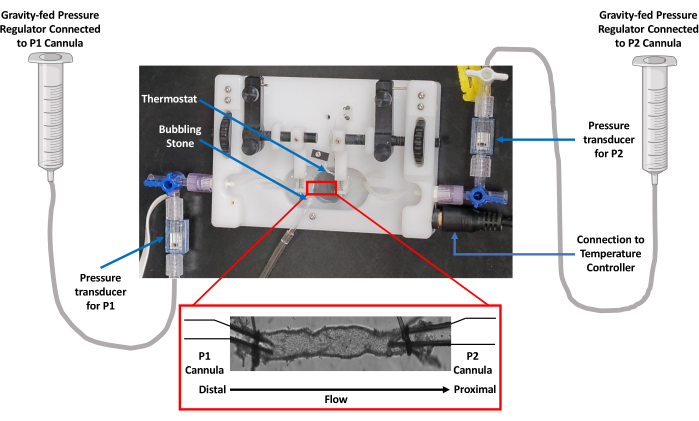
Şekil 1: İzole edilmiş kap haznesi kurulumunun görüntüsü. Damar perfüzyon çalışmaları, bir termoregülatör ile donatılmış izole bir damar odası kullandı. Yerçekimi, bir PSS rezervuarı aracılığıyla basıncı kontrol etmek için kullanıldı. Basınç, hem giriş (P1) hem de çıkış (P2) kanüllerine bağlı transdüserler tarafından izlendi. Kısaltma: PSS = fizyolojik tuz çözeltisi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: Bir bakışta düğüm hazırlama. (A) 3 katlı ipek dikiş ipliğinden tek bir filament kullanılarak diseksiyon mikroskobu altında çift ilmek hazırlığı, (B) gevşek ucu tutup her iki ilmeğin içinden çekerek, (C) küçük bir açıklık tutmak için düğümü her iki uçtan çekerek ve (D) her iki taraftan fazla filamenti keserek ve kullanıma hazır tam bir çift el üstü düğüm gösteren mavi kutu. Ölçek çubuğu = 1,5 mm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
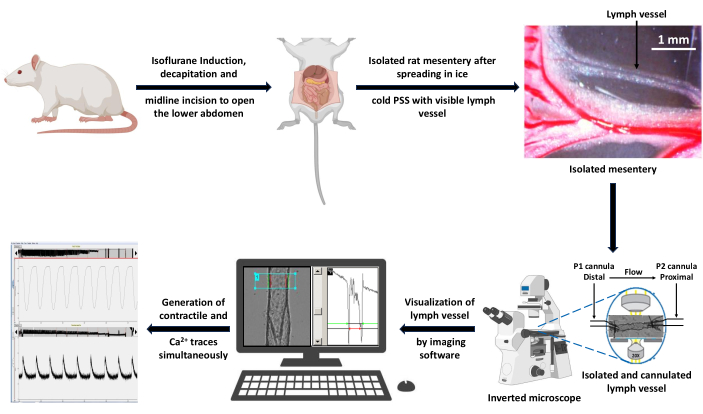
Şekil 3: Veri toplama için deneysel iş akışının şeması. Sağlıklı bir sıçan %5'lik izofluran indüksiyonu ile uyuşturuldu ve gövde kanını çıkarmak için dekapitasyon yapıldı. Mezenteri ortaya çıkarmak ve izole etmek için orta hat insizyonu yapıldı. İzole mezenter, buz gibi soğuk PSS solüsyonunda yayıldı ve izole bir damar perfüzyon odasında kanülasyon için bir LV yağdan arındırıldı. Banyo, 20x objektif lens kullanılarak ters çevrilmiş mikroskobun sahnesine yerleştirildi. Gemi alternatif olarak 340 ve 380 nm dalga boylu ışıkla uyarıldı ve emisyon floresan spektrumları 510 nm'de bir CCD kamera kullanılarak toplandı. Mikroskoba bağlı bilgisayar, floresan yakalama ve kenar algılama görüntüleme yazılımı kullanarak kasılma ve Ca2+ izlerini üretti. Ölçek çubuğu = 1 mm. Kısaltmalar: PSS = fizyolojik tuz çözeltisi; LV = lenf damarı; CCD = şarj bağlantılı cihaz. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
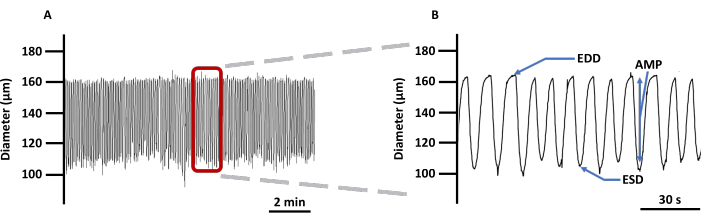
Şekil 4: Temsili LV kasılma izi. (A) PSS'de Ca2+ görüntüleme göstergesi Fura 2 ile yüklenen kanüllü LV'lerin çapındaki değişikliklerin örnek kaydı ve (B) damar kontraktilitesi ile ilgili tüm parametreleri göstermek için yakınlaştırılmış bir iz: EDD, ESD, AMP ve frekans. Bu değerler ritmik ve akışı hesaplamak için kullanılmıştır. Kısaltmalar: PSS = fizyolojik tuz çözeltisi; LV = lenf damarı; EDD = diyastol sonu çapı; ESD = sistolik uç çap; AMP = genlik. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
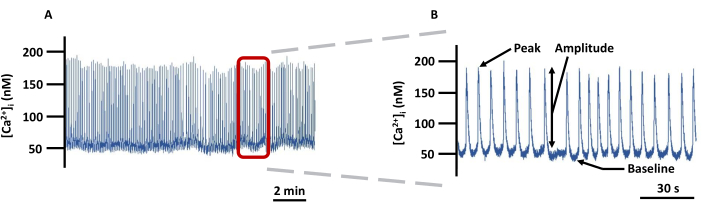
Şekil 5: Temsili LV Ca2+ görüntüleme izi. (A) PSS'de Fura-2 ile yüklü kanüllü LV'lerde mutlak [Ca2+]i'deki değişikliklerin örnek kaydı ve (B) [Ca2+]i ile ilgili tüm parametreleri (Tepe, Genlik ve Taban Çizgisi) göstermek için yakınlaştırılmış bir iz (arka plan düzeltilmemiş). Kısaltma: PSS = fizyolojik tuz çözeltisi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
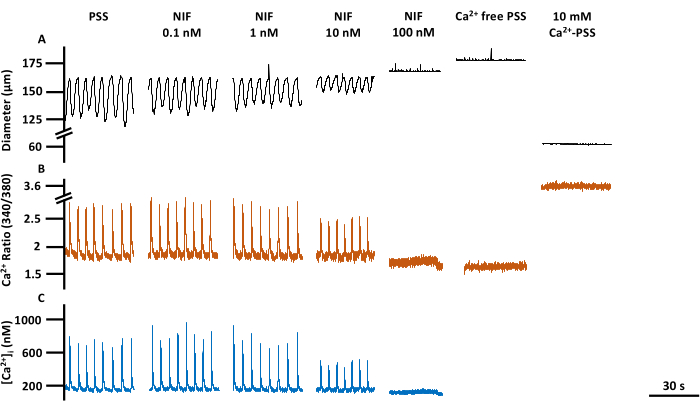
Şekil 6: Bir bakışta LV kontraktilitesi ve Ca2+ görüntüleme. (A) çapına, (B) 340/380 oranına ve (C) PSS taban çizgisinin mutlak [Ca2 +] i'sine karşılık gelen temsili izler, nifedipin, bir Cav1.x (Ca2 +) kanal antagonisti, Rmin ve Rmax dahil olmak üzere konsantrasyon yanıtı. Kısaltmalar: PSS = fizyolojik tuz çözeltisi; LV = lenf damarı; NIF = nifedipin; Rmin = minimum Fura-2 floresan sinyali; Rmax = maksimum Fura-2 floresan sinyali. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
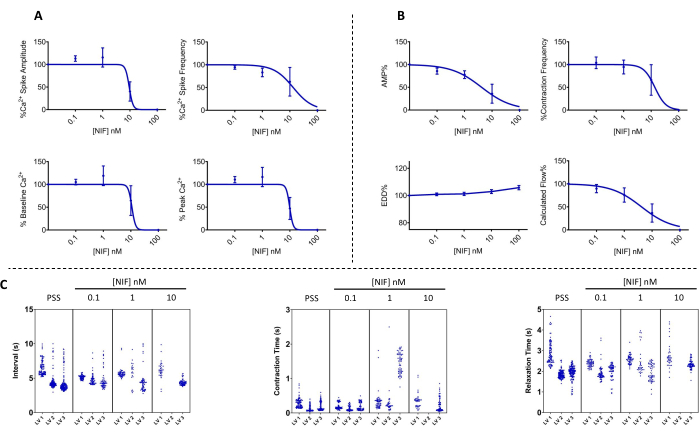
Şekil 7: LV'lerde nifedipin tarafından bloke edilen Ca2+ salınımı ve karşılık gelen kasılma. (A) Ca2+ (n = 3) ve (B) kontraktil (n = 3) parametreleri, voltaja bağımlı bir Cav1.x (Ca2 +) kanal antagonisti olan nifedipin ilavesiyle konsantrasyona bağlı bir şekilde azalmıştır. (C) Temsili Manhattan grafikleri, kasılmalar ile kasılma ve gevşeme süreleri arasındaki ortalama zaman aralığını (Δt) gösterir. Veriler ortalama ± SEM olarak sunulmuştur. Kısaltmalar: PSS = fizyolojik tuz çözeltisi; LV = lenf damarı; NIF = nifedipin; EDD = diyastol sonu çapı; AMP = genlik. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
LV'lerin kırılgan ve küçültücü doğası nedeniyle, hem diseksiyon hem de kanülasyon süreçleri sırasında azami özen gösterilmesi zorunludur. Damardaki küçük hasar bile canlı olmayan bir LV'nin gelişmesine yol açabilir veya [Ca2+]i geçici olaylarında anormalliklere yol açabilir. Uyarma ayarlarındaki tutarlılık, kontrol ve tedavi edilen gruplar arasında [Ca2 +] i ölçümlerinde karşılaştırılabilirliği sağlamak için tüm deney serisi boyunca eşit derecede önemlidir. Tekdüze ayarların sürdürülememesi, bir deney serisindeki gemiler arasında [Ca2+]i'yi fazla veya küçümseme konusunda önemli bir risk oluşturur. Benzer şekilde, her deney boyunca aynı damar bölgesini doğru bir şekilde tanımlamak ve izlemek de aynı derecede önemlidir.
Oransal indikatör Fura-2AM'nin kullanımı, tek dalga boylu boyalarda yaygın olan düzensiz doku kalınlığı, florofor dağılımı/sızıntısı veya foto ağartma sorunlarının neden olduğu floresan değişimlerini normalleştirir. 31 Bu, bu protokolde açıklanan sürekli izlemeyi mümkün kılar. Bununla birlikte, Fura-2, Ca2 + şelatlama ile çalıştığından, LV'leri aşırı yüklemek ve kasılma veya ilaç yanıtı için mevcut olan [Ca2 +] i'yi azaltmak mümkündür. Bu durumlarda, ritmik kasılmalar yokken Ca2+ sivri uçlar hala gözlenebilir. Değişen LV uzunluğu da bu fenomene katkıda bulunabilir. Bu Ca 2 + ölçümleri muhtemelen hala geçerli olsa da, hem Ca2 + hem de çap ölçümlerini başarılı bir şekilde elde etmek için tekrarlanan kurulumlarda Fura-2AM konsantrasyonunu azaltmak gerekebilir. Sonuçlarımız yalnızca başlangıçta hem Ca2 + sivri uçlarının hem de ritmik kasılmaların mevcut olduğu LV'leri içerir.
Rmin ve Rmax ölçümü, mutlak [Ca2+]i'nin hesaplanmasında kritik adımlardır. Rmin, Ca2 + yokluğunda Fura-2 oranı olması gerektiğinden, herhangi bir kalıntı Ca 2+ 'nın şelasyonunu sağlamak için Ca2 + içermeyen PSS'ye yüksek bir EGTA konsantrasyonu eklenmiştir. İlk çalışmalar, Ca2 + içermeyen PSS'de EDTA ile gerçekleştirildi ve bu, karşılık gelen Ca2 + sivri uçlarıyla sporadik damar kasılmaları ile sonuçlandı. Rmax için, [Ca2 +] i sinyalini en üst düzeye çıkarmak için bir iyonofor, iyonomisin ile birlikte PSS'ye yüksek bir Ca2 + konsantrasyonu eklenmiştir. Yüksek Ca2 + çözeltisi çökelebilir ve bu da EDTA'nın PSS'den çıkarılmasını gerektirebilir. Daha da önemlisi, Rmin ve Rmax'ın bu ek ölçümleri, membran uyarılabilirliği ve kasılma mekanizmaları27 hakkında bilgi sağlayabilen ve aynı zamanda Fura-2 için yalnızca 340/380 oranını bildiren protokollere kıyasla deney grupları arasında temel karşılaştırmalara izin veren [Ca2 +] i'deki fizyolojik olarak ilgili değişiklikleri değerlendirme fırsatı sağlar. Yeterli Rmin ve Rmax değerlerinin elde edilememesi, mutlak [Ca2+]i hesaplama yeteneğini engeller.
LV'lerin kasılma doğası nedeniyle, bu yöntem felçli damarlarda ölçülebilen yerel Ca2+ salınım olaylarından ziyade yalnızca küresel Ca 2+ seviyelerinin bir ölçüsünü sağlayabilir32. Bununla birlikte, bu yöntem, felçli damarlar veya tek tek hücreler kullanan yöntemlere kıyasla mutlak [Ca2+]i dinamiklerindeki değişiklikleri kasılma ile ilişkilendirmek için avantajlıdır28,32. Bu yaklaşım için, ölçülen Ca2 + 'nın çoğunluğunun lenf kası hücrelerinden kaynaklandığı varsayılmaktadır. Bununla birlikte, bu izole LV'lerde de bulunan endotel hücreleri, gözlenen toplam Ca2+ sinyaline katkıda bulunabilir33. Bu katkı, endotel34'ten arındırılmış LV'ler kullanılarak tahmin edilebilir. LV kasılmaları ayrıca kasılma döngüsü sırasında damar duvarının hafifçe odak içine ve dışına kaymasına neden olabilir. Bu nedenle, gergin ancak damarı germeden çekilebilen kısa damar segmentlerinin kullanılması önemlidir.
LV'lerdeki uygulamasının ötesinde, bu yöntem, arteriyoller ve damarlar dahil olmak üzere diğer vasküler yataklardan izole edilmiş damarları incelemek için kullanılabilir ve nörobiyoloji ve vasküler biyolojinin diğer dallarında potansiyel kullanım için umut vaat eder. Farklı sinyal iletim yollarını hedefleyen çeşitli agonistlerin veya antagonistlerin etkilerini keşfetmek, altta yatan Ca2 + dinamiklerini araştırmak için başka bir yoldur. Ayrıca, bu teknik, ilgili hayvanlardan alınan kontrol ve muamele edilmiş numuneleri içeren karşılaştırmalı araştırmalar için de kullanılabilir. Ayrıca, bu yaklaşım, perfüzyon odası ve mikroskop hedeflerinde minimum ayarlamalar gerektiren, izole edilmiş lenfatik kas hücreleri gibi hücresel düzeyde uygulama için uyarlanabilir. Özetle, bu yöntem, LV'lerdeki kasılma ve ritmiklik ile ilişkili olduğu için küresel Ca2+ dinamikleri hakkında fizyolojik olarak ilgili bilgiler sağlar ve LV'lerin toplanmasında Ca2+ dinamiklerinin potansiyel düzenleyicilerinin sağlam bir değerlendirmesini sağlar.
Açıklamalar
Yazarların açıklanacak herhangi bir çıkar çatışması yoktur.
Teşekkürler
Bu çalışma, Ulusal Genel Tıp Bilimleri Enstitüsü, Biyomedikal Araştırma Mükemmeliyet Merkezleri (COBRE), Kanser Tedavisine Konak Yanıtı Çalışmaları Merkezi [P20-GM109005], Ulusal Kanser Enstitüsü [1R37CA282349-01] ve Amerikan Kalp Derneği Doktora Öncesi Bursu [Ödül Numarası: 23PRE1020738; https://doi.org/10.58275/AHA.23PRE1020738.pc.gr.161089]. İçerik yalnızca yazarların sorumluluğundadır ve NIH veya AHA'nın resmi görüşlerini temsil etmek zorunda değildir. Şekil 1 ve Şekil 3 BioRender.com ile oluşturulmuştur.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 20x S Fluor objective | Olympus Corporation of the Americas (Center Valley, PA, United States) | UPlanSApo | |
| Borosilicate glass micropipettes | Living Systems Instrumentation (Burlington, VT, United States) | GCP-75-100 | |
| Calcium chloride (CaCl2) | Fisher Bioreagents (Waltham, MA, United States) | BP510-500 | |
| Carbon dioxide (CO2) | nexAir (Memphis, TN, United States) | UN3156 | |
| Dissection forceps | Fine Science Tools (Foster City, CA, United States) | 11254-20 | |
| EDTA (C10H16N2O8) | Fisher Bioreagents (Waltham, MA, United States) | BP118-500 | |
| EGTA (C14H24N2O10) | Fisher Bioreagents (Waltham, MA, United States) | O2783-100 | |
| Fura-2AM | Invitrogen (Waltham, MA, United States) | F1221 | |
| Glucose (C6H12O6) | Fisher Bioreagents (Waltham, MA, United States) | D16-500 | |
| Gravity-Fed Pressure regulator | custom-made in the lab | ||
| Heating unit | Living Systems Instrumentation (Burlington, VT, United States) | TC-09S | |
| Imaging software | IonOptix (Westwood, MA, United States) | ||
| Inverted fluorescent microscope | Olympus Corporation of the Americas (Center Valley, PA, United States) | IX73 | |
| Ionomycin | Invitrogen (Waltham, MA, United States) | I24222 | |
| IonOptix Cell Framing Adaptor | IonOptix (Westwood, MA, United States) | 665 DXR | |
| Isoflurane | Piramal Critical Care (Telangana, India) | NDC 66794-017-10 | |
| Isolated vessel perfusion chamber | Living Systems Instrumentation (Burlington, VT, United States) | CH-1 | |
| Knot preparation forceps | Fine Science Tools (Foster City, CA, United States) | 11253-20 | |
| LED light source | Olympus Corporation of the Americas (Center Valley, PA, United States) | TL4 | |
| Magnesium sulfate (MgSO4) | Acros Organics (New Jersey, NJ, Unites States) | 213115000 | |
| MyoCam-S3 Fast CMOS video system | IonOptix (Westwood, MA, United States) | MCS300 | |
| Nifedipine | Sigma (St. Louis, MO, United States) | N7634 | |
| Ophthalmic sutures | |||
| Oxygen (O2) | nexAir (Memphis, TN, United States) | UN1072 | |
| Pluronic acid | Sigma (St. Louis, MO, United States) | P2443 | |
| Potassium chloride (KCl) | Fisher Bioreagents (Waltham, MA, United States | BP366-500 | |
| Pressure monitor system | Living Systems Instrumentation (Burlington, VT, United States) | PM-4 | |
| Pressure Transducer | Living Systems Instrumentation (Burlington, VT, United States) | PT-F | |
| Silicone-lined petri-dish | custom-made in the lab | ||
| Sodium bicarbonate (NaHCO3) | Fisher Bioreagents (Waltham, MA, United States | BP328-500 | |
| Sodium chloride (NaCl) | Fisher Bioreagents (Waltham, MA, United States | BP358-212 | |
| Sodium phosphate (NaH2PO4) | Fisher Bioreagents (Waltham, MA, United States | BP329-500 | |
| Sprague-Dawley rats | Envigo RMS (Indianapolis, IN, USA) | Male | 9-13 weeks old |
| Stereomicroscope | Leica Microsystems (Wetzlar, Germany) | S9D | |
| Vannas spring scissors | Fine Science Tools (Foster City, CA, United States) | 15000-03 |
Referanslar
- Takahashi, T., Shibata, M., Kamiya, A. Mechanism of macromolecule concentration in collecting lymphatics in rat mesentery. Microvasc Res. 54 (3), 193-205 (1997).
- Ishikawa, Y., et al. The human renal lymphatics under normal and pathological conditions. Histopathology. 49 (3), 265-273 (2006).
- Fanous, M. Y. Z., Phillips, A. J., Windsor, J. A. Mesenteric lymph: the bridge to future management of critical illness. JOP. 8 (4), 374-399 (2007).
- El-Chemaly, S., Levine, S. J., Moss, J. Lymphatics in lung disease. Ann N Y Acad Sci. 1131 (1), 195-202 (2008).
- Klotz, L., et al. Cardiac lymphatics are heterogeneous in origin and respond to injury. Nature. 522 (7554), 62-67 (2015).
- Louveau, A., et al. Structural and functional features of central nervous system lymphatic vessels. Nature. 523 (7560), 337-341 (2015).
- Aukland, K., Reed, R. K. Interstitial-lymphatic mechanisms in the control of extracellular fluid volume. Physiol Rev. 73 (1), 1-78 (1993).
- Zawieja, D. C. Contractile physiology of lymphatics. Lymphat Res Biol. 7 (2), 87-96 (2009).
- Nipper, M. E., Dixon, J. B. Engineering the Lymphatic System. Cardiovasc Eng Technol. 2 (4), 296-308 (2011).
- Choi, I., Lee, S., Hong, Y. K. The new era of the lymphatic system: No longer secondary to the blood vascular system. Cold Spring Harb Perspect Med. 2 (4), 006445 (2012).
- Ji, R. C. Lymphatic endothelial cells, lymphedematous lymphangiogenesis, and molecular control of edema formation. Lymphat Res Biol. 6 (3-4), 123-137 (2008).
- Scallan, J. P., Zawieja, S. D., Castorena-Gonzalez, J. A., Davis, M. J. Lymphatic pumping: mechanics, mechanisms and malfunction. J Physiol. 594 (20), 5749-5768 (2016).
- Lee, S., Roizes, S., vonder Weid, P. Y. Distinct roles of L- and T-type voltage-dependent Ca2+ channels in regulation of lymphatic vessel contractile activity. J Physiol. 592 (24), 5409-5427 (2014).
- Telinius, N., et al. Human lymphatic vessel contractile activity is inhibited in vitro but not in vivo by the calcium channel blocker nifedipine. J Physiol. 592 (21), 4697-4714 (2014).
- Imtiaz, M. S., Zhao, J., Hosaka, K., vonder Weid, P. Y., Crowe, M., van Helden, D. F. Pacemaking through Ca2+ stores interacting as coupled oscillators via membrane depolarization. Biophys J. 92 (11), 3843-3861 (2007).
- Jo, M., Trujillo, A. N., Yang, Y., Breslin, J. W. Evidence of functional ryanodine receptors in rat mesenteric collecting lymphatic vessels. Am J Physiol Heart Circ Physiol. 317 (3), H561-H574 (2019).
- Stolarz, A. J., et al. Doxorubicin Activates Ryanodine Receptors in Rat Lymphatic Muscle Cells to Attenuate Rhythmic Contractions and Lymph Flow. J Pharmacol Exp Ther. 371 (2), 278-289 (2019).
- Van, S., et al. Dantrolene Prevents the Lymphostasis Caused by Doxorubicin in the Rat Mesenteric Circulation. Front Pharmacol. 12, 727526 (2021).
- Atchison, D. J., Johnston, M. G. Role of extra- and intracellular Ca2+ in the lymphatic myogenic response. Am J Physiol Regul Integr Comp Physiol. 272 (1), R326-R333 (1997).
- Atchison, D. J., Rodela, H., Johnston, M. G. Intracellular calcium stores modulation in lymph vessels depends on wall stretch. Can J Physiol Pharmacol. 76 (4), 367-372 (1998).
- Zhao, J., van Helden, D. F. ET-1-associated vasomotion and vasospasm in lymphatic vessels of the guinea-pig mesentery. Br J Pharmacol. 140 (8), 1399-1413 (2003).
- Cotton, K. D., Hollywood, M. A., McHale, N. G., Thornbury, K. D. Outward currents in smooth muscle cells isolated from sheep mesenteric lymphatics. J Physiol. 503 (1), 1-11 (1997).
- Mathias, R., vonder Weid, P. Y. Involvement of the NO-cGMP-KATP channel pathway in the mesenteric lymphatic pump dysfunction observed in the guinea pig model of TNBS-induced ileitis. Am J Physiol Gastrointest Liver Physiol. 304 (6), G623-G634 (2013).
- Garner, B. R., et al. KATP channel openers inhibit lymphatic contractions and lymph flow as a possible mechanism of peripheral edema. J Pharmacol Exp Ther. 376 (1), 40-50 (2021).
- Souza-Smith, F. M., Kurtz, K. M., Breslin, J. W. Measurement of cytosolic Ca2+ in isolated contractile lymphatics. J Vis Exp. (58), e3438 (2011).
- Grynkiewicz, G., Poenie, M., Tsien, R. Y. A new generation of Ca2+ indicators with greatly improved fluorescence properties. J Biol Chem. 260 (6), 3440-3450 (1985).
- Hill-Eubanks, D. C., Werner, M. E., Heppner, T. J., Nelson, M. T. Calcium signaling in smooth muscle. Cold Spring Harb Perspect Biol. 3 (9), 1-20 (2011).
- Harmer, A. R., Abi-Gerges, N., Morton, M. J., Pullen, G. F., Valentin, J. P., Pollard, C. E. Validation of an in vitro contractility assay using canine ventricular myocytes. Toxicol Appl Pharmacol. 260 (2), 162-172 (2012).
- IonOptix LLC. . IonWizard 7.2 Acquisition. , (2017).
- IonOptix LLC. IonWizard 7.2 Core & Analysis Functions. IonOptix LLC. , (2017).
- Roe, M. W., Lemasters, J. J., Herman, B. Assessment of Fura-2 for measurements of cytosolic free calcium. Cell Calcium. 11 (2-3), 63-73 (1990).
- Zawieja, S. D., et al. Ano1 mediates pressure-sensitive contraction frequency changes in mouse lymphatic collecting vessels. J Gen Physiol. 151 (4), 532-554 (2019).
- Behringer, E. J., et al. Calcium and electrical dynamics in lymphatic endothelium. J Physiol. 595 (24), 7347-7368 (2017).
- Ferrusi, I., Zhao, J., van Helden, D., vonder Weid, P. Y. Cyclopiazonic acid decreases spontaneous transient depolarizations in guinea pig mesenteric lymphatic vessels in endothelium-dependent and -independent manners. Am J Physiol Heart Circ Physiol. 286 (6), H2287-H2295 (2004).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır