Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Bağırsak mukozal bağışıklık tepkilerini analiz etmek için immünokompetan çip üzerinde bağırsak modeli
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Ayrıntılı protokolümüz, insan bağırsak mukozasını 3D yapılar ve çeşitli hücre tipleri ile simüle eden, mikrobiyal kolonizasyona yanıt olarak bağışıklık tepkilerinin ve hücresel fonksiyonların derinlemesine analizini sağlayan gelişmiş çip üzerinde bağırsak modelinin oluşturulmasını ve kullanımını özetlemektedir.
Özet
Epitelyal 3D organotipik, villus benzeri ve kript benzeri yapıları yeniden oluşturan gelişmiş bir çip üzerinde bağırsak modeli geliştirilmiştir. İmmünkompetan model, İnsan Göbek Veni Endotel Hücreleri (HUVEC), Caco-2 bağırsak epitel hücreleri, dokuda yerleşik makrofajlar ve doku içinde kendi kendini organize eden, insan bağırsak mukozasının özelliklerini yansıtan dendritik hücreleri içerir. Bu platformun benzersiz bir yönü, dolaşımdaki insan birincil bağışıklık hücrelerini entegre etme ve fizyolojik alaka düzeyini artırma kapasitesidir. Model, bağırsak bağışıklık sisteminin bakteri ve mantar kolonizasyonu ve enfeksiyonuna tepkisini araştırmak için tasarlanmıştır. Genişletilmiş boşluk boyutu nedeniyle model, geçirgenlik deneyleri, sitokin salınımı ve bağışıklık hücresi infiltrasyonu gibi çeşitli fonksiyonel okumalar sunar ve epitel hücre tabakası tarafından oluşturulan 3D yapıların immünofloresan ölçümü ile uyumludur. Bu vesileyle, hücre farklılaşması ve işlevi hakkında kapsamlı bilgiler sağlar. Çip üzerinde bağırsak platformu, mikrofizyolojik perfüze edilmiş bir biyoçip platformu içinde canlı bir mikrobiyotanın vekilleri ile insan konak dokusu arasındaki karmaşık etkileşimleri aydınlatmadaki potansiyelini göstermiştir.
Giriş
Çip Üzerinde Organ (OoC) sistemleri, geleneksel 2B hücre kültürü ile hayvan modelleri arasındaki boşluğu doldurabilen, gelişmekte olan bir 3B hücre kültürü tekniğini temsil eder. OoC platformları tipik olarak, zarlar veya hidrojeller gibi çok çeşitli iskeleler üzerinde büyütülen dokuya özgü hücreleri içeren bir veya daha fazla bölmeden oluşur1. Modeller, bir veya daha fazla tanımlanmış organotipik fonksiyonu taklit etme yeteneğine sahiptir. Pompalar, hücresel atık ürünlerin uzaklaştırılması, gelişmiş hücresel farklılaşma için beslenme ve büyüme faktörleri sağlanması ve temel in vivo koşulların yeniden oluşturulması için hücre kültürü ortamının sürekli mikroakışkan perfüzyonunu sağlar. Bağışıklık hücrelerinin entegrasyonu ile OoC sistemleri, in vitro 2'de insan bağışıklık tepkisini taklit edebilir. Bugüne kadar çok çeşitli organlar ve fonksiyonel birimler sunulmuştur1. Bu sistemler, ilaç testi 5,7 ve enfeksiyon çalışmaları6,8 için kolaylaştırılabilen vaskülatür 3, akciğer4, karaciğer 2,5 ve bağırsak6 modellerini içerir.
Burada, endotel astarı ve dokuda yerleşik makrofajlarla birleştirilmiş villus benzeri ve kript benzeri yapıların organotipik bir 3D topografyasını oluşturan insan epitel hücrelerini entegre eden bir çip üzerinde insan bağırsağı modeli sunuyoruz. Model, mikroskobik bir slayt formatında mikroakışkan olarak perfüze edilmiş bir biyoçip içinde kültürlenir. Her biyoçip iki ayrı mikroakışkan boşluktan oluşur. Her boşluk, gözenekli bir polietilen tereftalat (PET) zarı ile bir üst ve alt odaya bölünür. Zarın kendisi aynı zamanda hücrelerin her iki tarafta büyümesi için iskele görevi görür. Zarın gözenekleri, hücre katmanları arasında hücresel karışmayı ve hücre göçünü mümkün kılar. Her odaya iki dişi luer kilit boyutunda bağlantı noktası ile erişilebilir. İsteğe bağlı olarak, ek bir mini-luer kilit boyutlu bağlantı noktası, üst veya alt bölmeye erişim sağlayabilir (Şekil 1).
OoC platformu, tek bir deneyden elde edilebilecek bir dizi okuma sunar. Çip üzerinde bağırsak, hücre işaretleyici ekspresyonu, metabolizasyon oranları, bağışıklık tepkisi, mikrobiyal kolonizasyon ve enfeksiyonve bariyer fonksiyonunu değerlendirmek için perfüze edilmiş 3D hücre kültürü, atık su analizi ve floresan mikroskobunu birleştirmeye yönelik olarak uyarlanmıştır 3,6,8. Model, dokuda yerleşik bağışıklık hücrelerini ve canlı mikroorganizmaların konakçı doku ile doğrudan temasını içerir, bu da yayınlanan diğer modellere kıyasla bir avantajdır9. Ayrıca, epitel hücreleri, canlı bir mikrobiyota ile kolonizasyon için fizyolojik olarak ilgili bir arayüz sağlayan üç boyutlu yapılar halinde kendi kendini organize eder6.
Access restricted. Please log in or start a trial to view this content.
Protokol
Bu protokol, birincil insan monositlerini izole etmek için sağlıklı donörlerden biyoçip başına ~ 20 mL taze kana erişim gerektirir. Tüm bağışçılar, Jena Üniversite Hastanesi etik kurulu tarafından onaylanan bu çalışmaya katılmak için yazılı, bilgilendirilmiş onam verdiler (izin numarası 2018-1052-BO). Malzemelerle ilgili ayrıntılar için Malzeme Tablosu'na bakın. Tüm çözeltilerin ve ortamların bileşimi hakkında ayrıntılar için Tablo 1'e bakın.
1. Genel biyoçip işleme açıklamaları
- Bir rezervuar şeridini dikkatlice ayırın ve tek rezervuarlar ve kapaklar elde etmek için ısıtılmış bir bıçak kullanarak kapakları çıkarın. Silikon borunun tam oturması için kapağın deliğini genişletin.
- Silikon borunun iç çapı 0,5 mm'dir, asimetriktir ve iki peristaltik pompa durdurucu ile daha uzun (20 cm) ve daha kısa (12 cm) kenarlara ayrılmıştır. Bir tüpü bir erkek luer kilit bağlayıcısına ve tüpün karşı tarafındaki kapağa bağlayarak biyoçip başına her simetriden iki tüpü birleştirin. Ayrıca biyoçip başına dört rezervuar monte edin.
NOT: Hortumları ve rezervuarları önceden hazırlayın ve kullanmadan önce otoklavlayarak sterilize edin. Silikon borunun sınırlı bir ömrü olduğundan, 3-5 deneyden sonra boruyu değiştirin. Uyuşturucu testi gibi belirli araştırma ilgi alanları için, her deney için yeni borular hazırlanması tavsiye edilir. Bu protokolün birçok adımı paralel olarak çalışır; Şekil 2'de gösterildiği gibi bir günde gerçekleştirilen farklı adımları vurgulayan genel bakış şekline bakın.
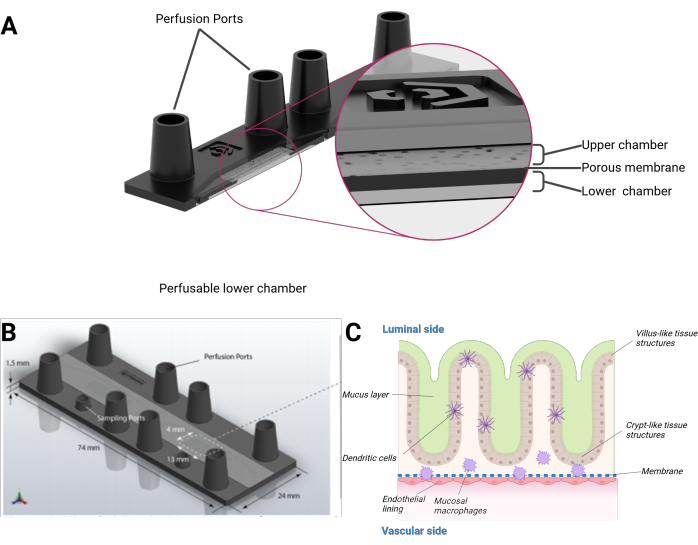
Şekil 1: Çip üzerinde bağırsak modelinin şematik gösterimi. (A) Biyoçip enine kesitsel bir görünümde sunulmaktadır. (B) Tüm biyoçipin yanı sıra düz, çıkarılabilir PET membranın boyutu görülebilir. Dişi luer kilit boyutu portları dahil olmak üzere üst haznenin toplam hacmi, alt hazne için sırasıyla 290 μL ve 270 μL'dir. (C) Bağırsak biyoçipinin şematik bir bileşimi, farklılaşmış bağışıklık hücreleri ve bir mukus tabakası dahil olmak üzere villus benzeri ve kript benzeri yapılara benzeyen üç boyutlu büyüme epiteli görülebilir. PET zarın diğer tarafı endotelyal bir tek tabaka ile kaplıdır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
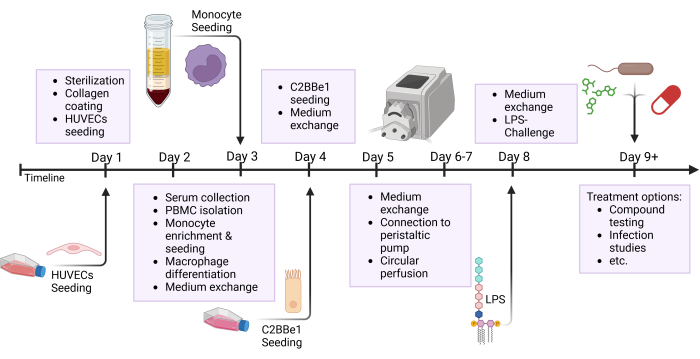
Şekil 2: Model oluşturma zaman çizelgesine ve deney düzeneğine şematik genel bakış. Bu şekil, sunulan protokolün şematik genel bakışını göstermektedir. Hücrelerin tohumlanması ve LPS ile epitel zorluğu gibi önemli prosedürler oklarla gösterilir. Kısaltmalar: HUVEC'ler = insan umbilikal venöz endotel hücreleri; LPS = lipopolisakkarit. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
2. Biyoçip sterilizasyonu
- 15 cm çapında,% 70 denatüre edilmemiş etanol ile steril bir cam Petri kabını doldurun. Biyoçipi, biyoçipin tüm portları tamamen etanol çözeltisi ile kaplanacak şekilde içine yerleştirin.
- Bağlantı noktası başına iki kez, çipin tüm odalarından 1 mL %70 etanol çekin. Oda sıcaklığında (RT) 45-60 dakika inkübe edin.
NOT: Biyoçipin içinde hava sıkışmadığından emin olun. Bu noktadan itibaren biyoçip sistemine hava girmemeli ve boşluklar sıvı ile dolu kalmalıdır. - Petri kabındaki etanolü çıkarın ve tüm portlar tamamen kaplanana kadar steril çift damıtılmış su (ddH2O) ile değiştirin. Yine, port başına iki kez, biyoçip boşluğundan 1 mL ddH2O çekin. Petri kabındaki ddH2O'yu yenileyin ve işlemi tekrarlayın.
- Petri kabındaki tüm sıvıyı çıkarın. Bundan sonra, tamamen sterilize edilmiş biyoçipleri, steril bir ortamın dışında olduklarında kapalı Petri kabının içinde saklayın. Biyoçip içindeki sıvının buharlaşmasını azaltmak için Petri kabına 2-5 mL ddH2O'luk küçük bir rezervuar (örneğin, 50 mL'lik bir tüpün kapağı) ekleyin.
NOT: Biyoçipler kullanılıncaya kadar steril bir ortamda muhafaza edildiği takdirde 3 gün öncesine kadar sterilize edilebilir. Bu, tek bir günde iş yükünde esneklik sağlar.
3. HUVEC'in hasadı ve tohumlanması
NOT: İnsan umbilikal venöz endotel hücreleri (HUVEC'ler),10'dan önce yayınlandığı gibi umbilikal kordlardan izole edildi.
- HUVEC'leri tohumlamadan önce, zarı insan kollajen IV ile kaplayın. Bunun için, Dulbecco'nun magnezyum ve kalsiyum (PBS +/+) içeren fosfat tamponlu tuzlu suyunda bir kollajen stok çözeltisinin (Tablo 1) 1:100 oranında seyreltilmesini hazırlayın. İlgili hazneye 350 μL seyreltilmiş stok çözeltisi ekleyin. RT'de 5 dakika inkübe edin.
NOT: Biyoçipi steril başlıkta tutuyorsanız, fazla ortamı toplamak için altına steril bir doku yerleştirmenizi öneririz. - Kalan kollajen ve asetik asidi yıkamak için tüm odaları 350 μL PBS +/+ ile iki kez yıkayın. Daha sonra, her odaya 350 μL endotel hücre büyümesi (EC) -ortamı ekleyin.
NOT: Buradan biyoçipler hücre tohumlaması için hazırdır ve kullanılana kadar 37 °C'de saklanabilir. - HUVEC'leri %80-90 hücre birleşmesinde 1-3 numaralı pasajlarda kullanın. HUVEC'leri, üretici tarafından sağlanan tanımlanmış bir ek karışım içeren EC ortamında yetiştirin. Bir HUVEC hücre kültürünün temsili bir parlak alan görüntüsü Şekil 3A'da sunulmuştur.
NOT: Vericiye bağlı olarak, daha yüksek pasajların HUVEC'leri farklılaşmaya başlayabilir ve biyoçip içinde güvenilir bir şekilde yoğun ve birleşik bir tek tabaka oluşturamaz. Antibiyotiklerin kullanımı, yani 100 U / mL penisilin ve 100 μg / mL streptomisin isteğe bağlıdır, ancak mikrobiyal kontaminasyonu önlemek için EC ortamına ek olarak önerilir. - Hücre kültürü ortamını bir T25 hücre kültürü şişesinden çıkarın ve hücreleri magnezyum ve kalsiyum içermeyen 3-5 mL Dulbecco'nun fosfat tamponlu salini ile nazikçe yıkayın (PBS -/-). PBS -/- çıkarın ve 1 mL tripsin ayrışma reaktifi ekleyin (Tablo 1). Hücreler hücre kültürü şişesinden ayrılana kadar 37 ° C'de 5 dakika inkübe edin.
- PBS -/-'de 9 mL% 5 fetal sığır serumu (FBS) kullanarak ayrılan hücreleri bir tüpe aktarın. RT'de 5 dakika boyunca 350 × g'da santrifüjleyin. Süpernatanı çıkarın, 1 mL EC ortamında yeniden süspanse edin ve hücre sayısını belirleyin. Hücre konsantrasyonunu 150 μL'de (alt haznede tohumlama) veya 250 μL'de (üst haznede tohumlama) başına 0,4 ×10 6 hücre olarak ayarlayın.
- İlgili hücre hacmini hazneye ekleyin. Alt haznede tohumlama yapıyorsanız, tüm portları kapatın ve biyoçipi hemen baş aşağı konumlandırın, böylece hücreler PET membranın üzerine düşer. Biyoçipleri nemlendirilmiş bir inkübatörde 37 ° C ve% 5 CO2'de inkübe edin.
- 24 saat sonra HUVEC içeren haznenin 350 μL EC ortamı ile orta değişimini gerçekleştirin. Karşı odadaki ortamın değiştirilmesine gerek yoktur.
4. İnsan serumu toplanması ve periferik kan mononükleer hücresi (PBMC) türevi monosit izolasyonu
NOT: PBMC'ler, Mosig ve ark.11'de tarif edildiği gibi izole edilmiştir.
- Sağlıklı donörlerden insan venöz kanını çekin. Biyoçip başına, serum toplanması için silikat içeren kan alma tüplerinde en az 10 mL tam kan temin edin. Tam pıhtılaşmadan sonra, kan alma tüplerini RT'de 10 dakika boyunca 2.500 × g'da santrifüjleyin. Serumu toplayın, alikot ve daha fazla kullanana kadar -20 ° C'de saklayın.
- PBMC izolasyonu için EDTA içeren kan alma tüplerinde aynı donörden en az 10 mL tam kan temin edin. Pıhtılaşmamış kanı 1: 1 izo-tampon (Tablo 1) ile ters çevirerek nazikçe karıştırın ve bu karışımın 35 mL'sini 50 mL'lik bir tüpte 1.077 g / mL yoğunluğa sahip 15 mL yoğunluk gradyan ortamının üzerine yavaşça katman.
- RT'de frensiz 20 dakika boyunca 800 × g'da santrifüjleyin. Yoğunluk gradyan ortamının üstünde görünen elde edilen bağışıklık hücresi tabakasını dikkatlice geri çekin ve yeni bir 50 mL tüpe aktarın. 50 mL'ye kadar soğuk izo-tampon ile doldurun ve hücreleri nazikçe ters çevirerek yıkayın.
- 200 × g'da 8 dakika boyunca 4 ° C'de frensiz santrifüjleyin. Süpernatanı atın ve yoğunluk gradyanı başına 10 mL izo-tamponda yeniden süspanse edin. İsteğe bağlı: Birkaç gradyan paralel olarak çalıştırılıyorsa, bir vericinin PBMC'lerini birleştirin.
- 150 × g'da 4 °C'de 8 dakika santrifüjleyin. Süpernatanı atın ve peleti yoğunluk gradyanı başına 10 mL izo-tampon içinde yeniden süspanse edin. Santrifüjleme adımı 4.4'ü tekrarlayın. Son olarak, süpernatanı atın ve hücreleri 2 mL monosit farklılaşma ortamında yeniden süspanse edin (Tablo 1).
NOT: M-CSF ve GM-CSF'nin eklenmesi, izole edilmiş monositlerin monosit türevli makrofajlara ve monosit türevli dendritik hücrelere (bu protokolün daha sonraki bir noktasında eklenen lipopolisakkarit [LPS] ile kombinasyon halinde) farklılaşmasını zorlar. Antibiyotiklerin kullanımı, yani 100 U / mL penisilin ve 100 μg / mL streptomisin isteğe bağlıdır, ancak mikrobiyal kontaminasyonu önlemek için ortamın bir takviyesi olarak önerilir. - 2 mL monosit farklılaşma ortamında 6 oyuklu bir plakanın oyuğu başına hücre sayısını ve tohum ~ 10 ×10 6 hücreyi belirleyin (Tablo 1). Monositlerin 6 oyuklu plakanın plastiğine yapışmasını sağlamak için nemlendirilmiş bir inkübatörde 37 ° C'de 1 saat inkübe edin.
- Süpernatanı dikkatlice atın ve bağlanmamış hücreleri çıkarmak için önceden ısıtılmış 2 mL hematopoietik hücre ortamı ile 2x'i yıkayın. Monosit farklılaşma ortamında 37 ° C'de 24 saat daha inkübe edin.
- Monositleri hasat etmek için, süpernatanı dikkatlice atın ve 2 mL önceden ısıtılmış PBS -/- ile bir kez yıkayın. Bu noktada monosit kültürünün parlak alan görüntüsünün bir örneği için Şekil 3B'ye bakın. Daha sonra, monositlerin 6 oyuklu plakanın plastiğinden ayrılmasını sağlamak için hücreleri 37 ° C'de 1 mL önceden ısıtılmış monosit ayırma reaktifinde (Tablo 1) 7 dakika inkübe edin.
- Ayrılan monositleri düşük bağlayıcı bir tüpe aktarın. İsteğe bağlı: daha yüksek bir hücre verimi elde etmek için, 6 oyuklu plakayı PBS -/- ile birkaç kez dikkatlice yıkayın.
- RT'de 8 dakika boyunca 300 × g'da santrifüjleyin. Süpernatanı atın ve EC şartlı ortamda yeniden süspanse edin (Tablo 1). Hücre sayısını belirleyin ve hücre konsantrasyonunu 150 μL (alt boşlukta tohumlama) veya 250 μL (üst boşlukta tohumlama) başına 0,1 ×10 6 hücre olarak ayarlayın.
NOT: Bağışıklık hücresi izolasyonunun tüm adımlarında nazik olun ve bağışıklık hücresi aktivasyonunu önlemek için kesme kuvvetlerini azaltın. Bu izolasyonu kurarken, PBMC'den türetilmiş monositlerin saflığını kontrol edin (örn., akış sitometrisi yoluyla). Tüm hücrelerin %95'inden fazlası CD14 gibi tipik monosit belirteçleri için pozitif olmalıdır.
5. Monosit tohumlama
- HUVEC içeren haznede 350 μL önceden ısıtılmış EC şartlandırılmış ortam ile bir ortam değişimi gerçekleştirin.
- Aynı odaya 150 μL (alt oda) veya 250 μL (üst oda) hazırlanan monosit süspansiyonu ekleyin (bkz. adım 4.10). Alt hazneye tohumlama yapıyorsanız, tüm portları kapatın ve hücrelerin HUVEC tabakasına düşmesi için biyoçipi hemen baş aşağı konumlandırın. Biyoçipi nemlendirilmiş bir inkübatörde 37 °C ve% 5 CO2'de inkübe edin.
- HUVEC + monosit içeren haznede her 24 saatte bir 350 μL EC şartlandırılmış ortam ile bir ortam değişimi gerçekleştirin.
6. C2BBe1 hasat ve tohumlama
NOT: Caco-2 fırça kenarlığı ifade eden hücreler 1 (C2BBe1)12 , 35. pasaja kadar kullanılır ve %80-90 birleşim mesafesindeki şişelerden alınır. Bir C2BBe1 kültürünün temsili bir parlak alan görüntüsü Şekil 3C'de sunulmuştur.
- C2BBe1 hücrelerini C2 ortamında yetiştirin (Tablo 1).
NOT: Antibiyotik kullanımı, yani 20 μg / mL gentamisin isteğe bağlıdır ancak mikrobiyal kontaminasyonu önlemek için C2 ortamının bir takviyesi olarak önerilir. - Bir T25 hücre kültürü şişesinin hücre kültürü ortamını çıkarın ve hücreleri 3-5 mL PBS -/- ile nazikçe yıkayın. PBS -/- çıkarın ve 1 mL tripsin ayrışma reaktifi ekleyin (Tablo 1). Hücreler hücre kültürü şişesinden ayrılana kadar 37 ° C'de 5 dakika inkübe edin.
- PBS -/-'de 9 mL% 5 fetal sığır serumu (FBS) kullanarak ayrılan hücreleri bir tüpe aktarın. RT'de 5 dakika boyunca 350 × g'da santrifüjleyin. Süpernatanı çıkarın, 1 mL C2-ortamında yeniden süspanse edin ve hücre sayısını belirleyin. Hücre konsantrasyonunu 150 μL (alt haznede tohumlama) veya 250 μL (üst haznede tohumlama) başına 0,5 ×10 6 hücre olarak ayarlayın.
- C2BBe1'in tohumlanmasından önce, ilgili hazneyi 350 μL C2-ortamı ile nazikçe yıkayın.
- Hazırlanan C2BBe1 süspansiyonundan 150 μL (alt oda) veya 250 μL (üst oda) ekleyin (bkz. adım 6.3) ilgili odaya. Alt hazneye tohum ekiyorsanız, tüm portları kapatın ve hücrelerin PET membranına düşmesi için biyoçipi hemen baş aşağı yerleştirin. Biyoçipleri nemlendirilmiş bir inkübatörde 37 ° C ve% 5 CO2'de inkübe edin.

Şekil 3: Biyoçipte tohumlamadan önce HUVEC'lerin, monositlerin ve C2BBe1'in hücre morfolojisi. Bu şekil, protokol boyunca kullanılan farklı hücre kaynaklarının temsili parlak alan görüntülerini göstermektedir. Görüntüler, 10x büyütme kullanılarak ters parlak alan mikroskobu ile çekildi. Tüm hücre tipleri, (A) HUVEC'ler, (B) monositler ve (C) C2BBe1, spesifik protokol bölümlerinde açıklandığı gibi 2D tek katmanlı hücre kültüründe yetiştirildi. Ölçek çubukları = 200 μm. Kısaltmalar: HUVEC'ler = insan umbilikal venöz endotel hücreleri; PBMC'ler = periferik kan mononükleer hücreleri. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
7. Peristaltik pompa ve dairesel perfüzyon bağlantısı
- Peristaltik bir pompa ilavesiyle boş bir inkübatör hazırlayın. Yarı steril bir ortam sağlamak için inkübatörün ve pompanın tüm alanlarını dezenfektanla iyice temizleyin.
NOT: Peristaltik pompalar çalışırken çok fazla ısı üretebilir. İyi yalıtılmış inkübatörlerde veya yetersiz klimalı laboratuvarlarda, inkübatörler aşırı ısınma eğiliminde olduğundan, inkübatör başına kullanılabilir pompa sayısı sınırlı olabilir. İnkübatör başına iki peristaltik pompa yeterli olmalıdır. - Sterilize edilmiş tüpleri biyoçipe takmadan önce, her bir tüpü 700 μL PBS +/+ ve ardından 500 μL C2 ortamı veya EC şartlandırılmış ortam ile yıkayın. Her ortam için her simetriden bir boru hazırlayın (bkz. adım 1.2). Sol boşluk için luer kilidinden peristaltik pompa durdurucusuna kısa mesafeli boruyu ve sağ boşluk için diğer simetriye sahip boruyu kullanın.
- Biyoçipi inkübatörden alın ve her oda için 350 μL ile orta bir değişim gerçekleştirin. Tüm fişleri çıkarın ve tüm bağlantı noktalarını en üste kadar doldurun.
- Sol boşluktan başlayarak, luer kilit adaptörünü biyoçipin portuna takarak ilk boruyu üst haznenin sağ portuna bağlayın. Ardından, ikinci boruyu alt bölmenin sol portuna bağlayın. Sağ mikroakışkan boşluğu için bu prosedürü tekrarlayın.
- Bir rezervuar alın ve rezervuarın dibine küçük bir damla hücre kültürü ortamı ekleyin. Ardından, rezervuarı ilk borunun karşı tarafına yerleştirin ve diğer bölme için tekrarlayın. Tüm portlar bir boruya veya rezervuara bağlandıktan sonra, rezervuarları 3.5 mL hücre kültürü ortamı ile doldurun.
- Her bir haznenin mikroakışkan sistemini kapatmak için kapağın takılı olduğu borunun gevşek tarafını rezervuarın üzerine yerleştirin. Bu durumda, biyoçipi peristaltik pompaya taşıyın.
NOT: İnkübatöre ve laboratuvar ortamına olan mesafeye bağlı olarak, cipsleri inkübatöre aktarmak için önceden temizlenmiş ve otoklavlanmış bir kutu kullanılabilir. - Hortumu pompaya bağlamak için peristaltik pompa tıpalarını kullanın. Her bir boruyu, ortam rezervuardan boşluğa, boruya ve pompa aracılığıyla tekrar rezervuara akacak şekilde peristaltik pompaya bağlayın (Şekil 4). Rezervuar, dairesel perfüzyonda bir kabarcık tutucu görevi görür ve havanın sistemde sıkışmasını önler. Her hazneyi 50 μL/dk'lık bir akış hızıyla perfüze edin, bu da üst haznede 0,013 dyn/cm2 ve alt haznede 0,006 dyn/cm2'lik bir kesme gerilimi ile sonuçlanır8.
NOT: Alt ve üst boşlukların ortamı zıt yönlerde hareket ettirilirse, bağırsak dokusunun daha yüksek üç boyutlu bir büyümesi elde edilebilir13. Bu nedenle, üst ve alt boşlukların rezervuarları karşılıklı taraflara yerleştirilir (Şekil 4). Dairesel perfüzyon, ihtiyaç duyulan hücre kültürü ortamı miktarını azaltır, ancak potansiyel olarak sitokinlerin ve metabolitlerin zenginleşmesine neden olabilir. İstenirse, biyoçipin doğrusal bir perfüzyonu da mümkündür. - Biyoçipi 72 saat boyunca 37 ° C'de ve% 5 CO2'de perfüze edin.

Şekil 4: Peristaltik pompaya bağlı biyoçip. Peristaltik bir pompaya bağlı bir biyoçip örneği sunulmuştur. Epitelyal C2BBe1 hücreleri alt odacıkta (kırmızı C2-ortamı öndeki rezervuarlarda bulunurken) yetiştirilirken, HUVEC'ler üst odacıkta (sarımsı EC koşullu ortam arkadaki rezervuarlarda bulunur) yetiştirilir. Farklı hücre kültürü ortamları, yetiştirilen dokunun bariyer fonksiyonu nedeniyle karışmaz. Biyoçip, peristaltik pompaya, ortamın rezervuardan boşluğa akacağı şekilde bağlanır. Buradan ortam, pompa aracılığıyla boru yoluyla rezervuara geri akar. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
8. Epitel bariyerinin LPS koşullandırması
- 72 saatlik preperfüzyondan sonra, peristaltik pompayı durdurun ve her bir rezervuarın borusuna bağlı kapağı çıkarın. Pompanın yanındaki steril bir dokuya yerleştirin.
- Tüm besiyerini çıkarın ve rezervuarları 2 mL taze hazırlanmış besiyeri ile doldurun. C2BBe1 hücrelerini içeren epitel tarafı için, ortama 100 ng / mL LPS ekleyin.
NOT: LPS, dokunun bariyer fonksiyonunu arttırır, monosit kaynaklı makrofajları epitel dokusuna göç etmesi için uyarır ve monosit kaynaklı dendritik hücre farklılaşmasına izin verir. - Hortumu ve kapakları rezervuara yeniden bağlayın ve dairesel perfüzyona 50 μL/dk akış hızında 24 saat daha devam edin.
NOT: Bu noktadan itibaren, çip modeli deneylerde-bileşik testlerinde veya enfeksiyon çalışmalarında kullanılabilir. Her 24 saatte bir rezervuar başına 2 mL'lik orta düzeyde bir değişim öneriyoruz.
9. Farklı okuma yöntemleri için dokuya erişim
- Perfüzyonun her zamanında rezervuarlardan hücre kültürü ortamı süpernatantlarını toplayın. Rezervuarı açın ve istediğiniz hacmi toplayın (bkz. adım 8.1-8.3). Metabolitlerin, sitokinlerin veya diğer moleküllerin tespiti için bu süpernatanları kullanın.
- Dokuya erişmek için, üst haznenin dışı boyunca hassas bir kesim yapmak için bir neşter kullanın ve mikroakışkan boşluğu açmak için yapıştırma folyosunu çıkarın. Bağırsak-biyoçip modelinin dokusu artık erişilebilir durumda. Membranı biyoçipten ayırmak için mikroakışkan haznenin dışını dikkatlice kesin. Cımbız kullanarak doku içeren zarı toplayın.
DİKKAT: Bu adım sırasında parmak yerleşimine dikkat edin ve kazaları önlemek için dikkatli çalışın. Kesilmeye dayanıklı eldivenler tavsiye edilir. - Alternatif olarak, hücreleri enzim çözeltileri, yani tripsin veya Triton X-100 içeren tamponlar kullanılarak parçalanan hücreler kullanarak biyoçip içindeki ayrı katmanlardan hasat edin.
10. FITC-dekstran difüzyonu ile geçirgenlik değerlendirmesi
NOT: Dokunun bariyer fonksiyonu, peristaltik pompanın bağlantısı kesildikten sonra bir FITC-dekstran geçirgenlik testi ile analiz edilebilir. FITC-dekstran geçirgenlik değerlendirmesi Deinhardt-Emmer ve ark.4'ten uyarlanmıştır.
- Floresein izotiyosiyanat (FITC)-dekstran stok çözeltisi hazırlayın (moleküler ağırlık 3-5 kDa, Tablo 1).
- Rezervuarları boşaltın ve çipi perfüzyondan ayırın.
- Fenol kırmızısı içermeyen ortam ile üst ve alt bölmede bir orta değişim gerçekleştirin.
NOT: Deney sırasında fenol kırmızısı içermeyen ortam zaten kullanılmışsa bu adım gerekli değildir. - C2BBe1 hücrelerini içeren odaya 350 μL 1 mg / mL FITC-dekstran çözeltisi ekleyin.
- Bağlantı noktalarını kapatın ve çipi epitel tarafı yukarı bakacak şekilde 37 °C'de 60 dakika inkübe edin.
- İnkübasyon süresinden sonra, kültür ortamını çipin her iki odasından ayrı ayrı toplayın ve ölçüme kadar ışıktan koruyarak 4 ° C'de saklayın.
- Ölçüm için, 11 ardışık 1: 2 seri seyreltme ile 1.000 μg / mL ila 0 μg / mL FITC-dekstran aralığında fenol kırmızısı içermeyen C2 ortamında ve EC koşullu ortamda standart bir eğri hazırlayın.
- Her numunenin 200 μL'sini şeffaf bir tabana sahip 96 oyuklu siyah bir plakaya aktarın. Floresansı, 495 nm'lik bir uyarma dalga boyunda ve 517 nm'lik bir emisyon dalga boyunda bir mikroplaka okuyucu ile ölçün.
- Numunelerin FITC-dekstran konsantrasyonunu ve dolayısıyla geçirgenlik katsayısını hesaplamak için standart eğriyi kullanın.
11. İmmünofloresan boyama
NOT: Canlı doku mikroskobik olarak incelenebilir. Daha kolay kullanım için, biyoçipin peristaltik pompadan çıkarılmasını ve ters çevrilmiş bir mikroskopta uzun mesafeli objektiflerin kullanılmasını öneririz. Bir son nokta analizi olarak, doku, immünofloresan boyama gibi prosedürler için biyoçipin içine sabitlenebilir.
- Peristaltik pompayı durdurun ve tüm boşlukların rezervuarlarını açın. Rezervuarları boşaltın ve boruyu ve rezervuarları biyoçipten ayırın.
- Oda başına iki kez, mikroakışkan boşlukları 500 μL soğuk PBS +/+ ile yıkayın. Tüm boşluklara 500 μL buz gibi soğuk metanol ekleyin ve -20 °C'de 15 dakika inkübe edin. Daha sonra, boşluk başına iki kez, mikroakışkan odayı 500 μL PBS +/+ ile yıkayın.
NOT: %4 paraformaldehit veya Carnoy fiksatifi ile fiksasyon gibi diğer fiksasyon yöntemleri de uygundur. Fiksasyondan sonra, talaşlar 4 °C'de saklanabilir veya doğrudan immün floresan boyamaya devam edilebilir. DİKKAT: Metanol veya paraformaldehit gibi sabitleyici kimyasallar toksiktir. İlgili görevleri bir çeker ocak altında gerçekleştirin ve atıkları buna göre toplayın. - Dokuya erişmek için çipi adım 9.2'de açıklandığı gibi açın. Doku içeren PET zarı, farklı immünopanellerle paralel olarak lekelemek için üç parçaya kadar kesin.
- Membran parçalarının her birini, hassas cımbız kullanarak bir bloke edici ve geçirgen hale getirme çözeltisi (Tablo 1) içeren ayrı bir 24 oyuklu plakaya aktarın. Tüm boyama işlemi boyunca ilgilenilen hücre katmanının her zaman yukarı baktığından emin olun. Membran parçalarını RT'de 30 dakika inkübe edin.
NOT: En iyi boyama sonuçları, serumu ikincil antikorla eşleştirdiğinde elde edilir. Örneğin keçi türünden sekonder antikorlar elde ediliyorsa normal keçi serumu kullanılmasını öneriyoruz. - Membran parçalarını nemli bir oda içindeki temiz bir cam kızağa aktarın. Boyama solüsyonunda birincil antikor panelini hazırlayın (Tablo 1) ve her zar parçasına 50 μL ekleyin. Gece boyunca 4 °C'de inkübe edin.
NOT: Optimal antikor konsantrasyonu ve boyama etkinliği, üreticiler ve klonlar arasında farklılık gösterebilir. Boyama panellerini önceden bir 2D hücre kültüründe test etmenizi öneririz. - İnkübasyondan sonra, numuneleri 24 oyuklu bir plakaya aktarın ve membranları yıkama solüsyonu ile 3 x 5 dakika boyunca nazikçe yıkayın (Tablo 1).
- Yine, membran parçalarını nemli bir oda içindeki temiz bir cam kızağa aktarın. İkincil antikor panelini boyama solüsyonunda hazırlayın (Tablo 1) ve her bir membran parçasına 50 μL ekleyin. Gerekirse, 4 ', 6-diamidino-2-fenilindol (DAPI) veya Hoechst gibi bir nükleer karşı boyama ekleyin. RT'de 30 dakika inkübe edin.
NOT: Floroforlarla çalışırken, görüntü kalitesini artırmak için foto ağartmayı önlemek için numuneleri ışıktan koruyun. - İnkübasyondan sonra, numuneleri 24 oyuklu bir plakaya aktarın ve membranları 2 x 5 dakika yıkama solüsyonu ile nazikçe yıkayın (Tablo 1). Ardından, PBS +/+ ile 5 dakika boyunca bir kez yıkayın.
- Membran parçalarını, bir floresan montaj ortamı ve bir kapak camı kullanarak temiz bir cam slayt üzerine monte edin. Mikroskobik görüntüleme yapılana kadar 4 °C'de saklayın.
Access restricted. Please log in or start a trial to view this content.
Sonuçlar
Bu temsili sonuçlar, çip üzerinde bağırsak modelinin farklı doku katmanlarını gösterir. Protokol bölüm 11'de tarif edildiği gibi immünofloresan lekelidirler. Görüntüler epifloresan veya konfokal floresan mikroskobu ile z-yığınları olarak çekildi ve ortogonal bir projeksiyona işlendi. Mikroskobik kurulum ve yazılım hakkında ayrıntılar için Malzeme Tablosuna bakın. Şekil 5, HUVEC'ler ve makrofajlardan oluşan bariyer oluşturan bir endotelyal tek ...
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
Sunulan protokol, çip üzerinde immünokompetan bir bağırsak modeli oluşturmak için gerekli adımları detaylandırır. İmmünofloresan mikroskobu, sitokin ve metabolit analizi, akış sitometrisi, protein ve genetik analiz ve geçirgenlik ölçümü gibi spesifik teknikleri ve olası okuma yöntemlerini tanımladık.
Açıklanan model,daha önce tarif edildiği gibi, mukus salgılayan, emici, enteroendokrin ve Paneth hücre benzeri popülasyonların y?...
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
M.R., Dynamic42 GmbH'nin CEO'sudur ve şirkette hisse sahibidir. A.S.M., Dynamic 42 GmbH'nin bilimsel danışmanıdır ve şirkette hisse sahibidir.
Teşekkürler
Çalışma, İşbirlikçi Araştırma Merkezi PolyTarget 1278 (proje numarası 316213987) tarafından V.D.W. ve A.S.M. A.F. ve A.S.M. ayrıca Almanya'nın Mükemmeliyet Stratejisi - EXC 2051 - Project-ID 690 390713860. kapsamında "Balance of the Microverse" Mükemmeliyet Kümesi tarafından sağlanan mali desteği de kabul eder. Astrid Tannert ve Jena Biyofotonik ve Görüntüleme Laboratuvarı'na (JBIL) konfokal lazer tarama mikroskobu ZEISS LSM980'e erişim sağladıkları için teşekkür ederiz. Şekil 1C ve Şekil 2 Biorender.com ile oluşturulmuştur.
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 96-well plate black, clear bottom | Thermo Fisher | 10000631 | Consumables |
| Acetic acid | Roth | 3738.4 | Chemicals |
| Alexa Fluor 488 AffiniPure, donkey, anti-mouse IgG (H+L) | Jackson Immuno Research | 715-545-150 | Secondary Antibody Vascular Staining and Epithelial Staining |
| Alexa Fluor 647 AffiniPure, donkey, anti-rabbit IgG (H+L) | Jackson Immuno Research | 711-605-152 | Secondary Antibody Epithelial Staining |
| Alexa Fluor 647, donkey, anti-rabbit IgG (H+L) | Thermo Fisher Scientific, Invitrogen | A31573 | Secondary Antibody Vascular Staining |
| Axiocam ERc5s camera | Zeiss | 426540-9901-000 | Technical equipment |
| Basal Medium MV, phenol red-free | Promocell | C-22225 | Cell culture consumables |
| Biochip | Dynamic 42 | BC002 | Microfluidic consumables |
| BSA fraction V | Gibco | 15260-037 | Cell culture consumables |
| C2BBe1 (clone of Caco-2) | ATCC | CRL-2102 | Epithelial Cell Source |
| Chloroform | Sigma | C2432 | Chemicals |
| CO2 Incubator | Heracell | 150i | Technical equipment |
| Collagen IV from human placenta | Sigma-Aldrich | C5533 | Cell culture consumables |
| Coverslips (24 x 40 mm; #1.5) | Menzel-Gläser | 15747592 | Consumables |
| Cy3 AffiniPure, donkey, anti-goat IgG (H+L) | Jackson Immuno Research | 705-165-147 | Secondary Antibody Vascular Staining |
| Cy3 AffiniPure, donkey, anti-rat IgG (H+L) | Jackson Immuno Research | 712-165-150 | Secondary Antibody Epithelial Staining |
| Descosept PUR | Dr.Schuhmacher | 00-323-100 | Cell culture consumables |
| DMEM high glucose | Gibco | 41965-062 | Cell culture consumables |
| DMEM high glucose w/o phenol red | Gibco | 31053028 | Cell culture consumables |
| DPBS (-/-) | Gibco | 14190-169 | Cell culture consumables |
| DPBS (+/+) | Gibco | 14040-133 | Cell culture consumables |
| EDTA solution | Invitrogen | 15575-038 | Cell culture consumables |
| Endothelial Cell Growth Medium | Promocell | C-22020 | Cell culture consumables |
| Endothelial Cell Growth Medium supplement mix | Promocell | C-39225 | Cell culture consumables |
| Ethanol 96%, undenatured | Nordbrand-Nordhausen | 410 | Chemicals |
| Fetal bovine Serum | invitrogen | 10270106 | Cell culture consumables |
| Fluorescein isothiocyanate (FITC)-dextran (3-5 kDa) | Sigma Aldrich | FD4-100MG | Chemicals |
| Fluorescent Mounting Medium | Dako | S3023 | Chemicals |
| Gentamycin (10mg/mL) | Sigma Aldrich | G1272 | Cell culture consumables |
| GlutaMAX Supplement (100x) | Gibco | 35050061 | Cell culture consumables |
| Histopaque | Sigma-Aldrich | 10771 | Cell culture consumables |
| Hoechst (bisBenzimid) H33342 | Sigma-Aldrich | 14533 | Epithelial Staining |
| Holotransferrin (5mg/mL) Transferrin, Holo, Human Plasma | Millipore | 616397 | Cell culture consumables |
| Human recombinant GM-CSF | Peprotech | 300-30 | Cell culture consumables |
| Human recombinant M-CSF | Peprotech | 300-25 | Cell culture consumables |
| Illumination device | Zeiss | HXP 120 C | Fluorescence Microscope Setup |
| Laser Scanning Microscope | Zeiss | CLSM980 | Fluorescence Microscope Setup |
| Lidocain hydrochloride | Sigma-Aldrich | L5647 | Cell culture consumables |
| Lipopolysaccharide (LPS) | Sigma | L2630 | Cell culture consumables |
| Loftex Wipes | Loftex | 1250115 | Consumables |
| Low attachment tubes (PS, 5 mL) | Falcon | 352052 | Consumables |
| Luer adapter for the top cap (M) | Mo Bi Tec | M3003 | Microfluidic consumables |
| Male mini luer plugs, row of four,PP, opaque | Microfluidic chipshop | 09-0556-0336-09 | Microfluidic consumables |
| MEM Non-Essential Amino Acids Solution | Gibco | 11140 | Cell culture consumables |
| Methanol | Roth | 8388.2 | Chemicals |
| Microscope | Zeiss | Axio Observer 5 | Fluorescence Microscope Setup |
| Microscope slides | Menzel | MZ-0002 | Consumables |
| Monoclonal, mouse, anti-human CD68 Antibody (KP1) | Thermo Fisher Scientific, Invitrogen | 14-0688-82 | Primary Antibody Vascular Staining |
| Monoclonal, rat, anti-human E-Cadherin antibody (DECMA-1) | Sigma-Aldrich, Millipore | MABT26 | Primary Antibody Epithelial Staining |
| Multiskan Go plate reader | Thermo Fisher | 51119300 | Technical equipment |
| Normal donkey serum | Biozol | LIN-END9010-10 | Chemicals |
| Optical Sectioning | Zeiss | ApoTome | Fluorescence Microscope Setup |
| Penicillin-Streptomycin (10,000 U/mL) | Gibco | 15140-122 | Cell culture consumables |
| Plugs | Cole Parmer | GZ-45555-56 | Microfluidic consumables |
| Polyclonal, goat, anti-human VE-Cadherin Antibody | R&D Systems | AF938 | Primary Antibody Vascular Staining |
| Polyclonal, rabbit, anti-human Von Willebrand Factor Antibody | Dako | A0082 | Primary Antibody Vascular Staining |
| Polyclonal, rabbit, anti-human ZO-1 antibody | Thermo Fisher Scientific, Invitrogen | 61-7300 | Primary Antibody Epithelial Staining |
| Power Supply Microscope | Zeiss | Eplax Vp232 | Fluorescence Microscope Setup |
| Primovert microscope | Zeiss | 415510-1101-000 | Technical equipment |
| Reglo ICC peristaltic pump | Ismatec | ISM4412 | Technical equipment |
| SAHA (Vorinostat) | Sigma Aldrich | SML0061-25MG | Chemicals |
| Saponin | Fluka | 47036 | Chemicals |
| S-Monovette, 7.5 mL Z-Gel | Sarstedt | 01.1602 | Consumables |
| S-Monovette, 9.0 mL K3E | Sarstedt | 02.1066.001 | Consumables |
| Sodium Pyruvate | Gibco | 11360-088 | Cell culture consumables |
| Tank 4.5 mL | ChipShop | 10000079 | Microfluidic consumables |
| Trypane blue stain 0.4% | Invitrogen | T10282 | Cell culture consumables |
| Trypsin | Gibco | 11538876 | Cell culture consumables |
| Tubing | Dynamic 42 | ST001 | Microfluidic consumables |
| Tweezers (Präzisionspinzette DUMONT abgewinkelt Inox08, 5/45, 0,06 mm) | Roth | K343.1 | Consumables |
| Wheat Germ Agglutinin (WGA) | Thermo Fisher Scientific, Invitrogen | W32464 | Epithelial Staining |
| X-VIVO 15 | Lonza | BE02-060F | Cell culture consumables, Hematopoietic cell medium |
| Zellkultur Multiwell Platten, 24 Well, sterile | Greiner Bio-One | 662 160 | Consumables |
| Zellkultur Multiwell Platten, 6 Well, sterile | Greiner Bio-One | 657 160 | Consumables |
| Zen Blue Software | Zeiss | Version 3.7 | Microscopy Software |
Referanslar
- Alonso-Roman, R., et al. Organ-on-chip models for infectious disease research. Nat Microbiol. 9 (4), 891-904 (2024).
- Fahrner, R., Groger, M., Settmacher, U., Mosig, A. S. Functional integration of natural killer cells in a microfluidically perfused liver on-a-chip model. BMC Res Notes. 16 (1), 285(2023).
- Raasch, M., et al. Microfluidically supported biochip design for culture of endothelial cell layers with improved perfusion conditions. Biofabrication. 7 (1), 015013(2015).
- Deinhardt-Emmer, S., et al. Co-infection with Staphylococcus aureus after primary influenza virus infection leads to damage of the endothelium in a human alveolus-on-a-chip model. Biofabrication. 12 (2), 025012(2020).
- Kaden, T., et al. Generation & characterization of expandable human liver sinusoidal endothelial cells and their application to assess hepatotoxicity in an advanced in vitro liver model. Toxicology. 483, 153374(2023).
- Maurer, M., et al. A three-dimensional immunocompetent intestine-on-chip model as in vitro platform for functional and microbial interaction studies. Biomaterials. 220, 119396(2019).
- Hoang, T. N. M., et al. Invasive aspergillosis-on-chip: A quantitative treatment study of human aspergillus fumigatus infection. Biomaterials. 283, 121420(2022).
- Kaden, T., et al. Modeling of intravenous caspofungin administration using an intestine-on-chip reveals altered Candida albicans microcolonies and pathogenicity. Biomaterials. 307, 122525(2024).
- Shah, P., et al. A microfluidics-based in vitro model of the gastrointestinal human-microbe interface. Nat Commun. 7, 11535(2016).
- Jaffe, E. A., Nachman, R. L., Becker, C. G., Minick, C. R. Culture of human endothelial cells derived from umbilical veins. Identification by morphologic and immunologic criteria. J Clin Invest. 52 (11), 2745-2756 (1973).
- Mosig, S., et al. Different functions of monocyte subsets in familial hypercholesterolemia: Potential function of cd14+ cd16+ monocytes in detoxification of oxidized ldl. FASEB J. 23 (3), 866-874 (2009).
- Peterson, M., Mooseker, M. Characterization of the enterocyte-like brush border cytoskeieton of the c2bbe clones of the human intestinal cell line, caco-2. J Cell Sci. 102, Pt 3 581-600 (1992).
- Shin, W., Hinojosa, C. D., Ingber, D. E., Kim, H. J. Human intestinal morphogenesis controlled by transepithelial morphogen gradient and flow-dependent physical cues in a microengineered gut-on-a-chip. iScience. 15, 391-406 (2019).
- Kim, H. J., Ingber, D. E. Gut-on-a-chip microenvironment induces human intestinal cells to undergo villus differentiation. Integr Biol (Camb). 5 (9), 1130-1140 (2013).
- Kim, H. J., Huh, D., Hamilton, G., Ingber, D. E. Human gut-on-a-chip inhabited by microbial flora that experiences intestinal peristalsis-like motions and flow. Lab Chip. 12 (12), 2165-2174 (2012).
- Karra, N., Fernandes, J., James, J., Swindle, E. J., Morgan, H. The effect of membrane properties on cell growth in an 'airway barrier on a chip'. Organs-on-a-Chip. 5, 10025(2023).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır