Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Yan Etki Riski Düşük Olan Sıçanlarda İntrakameral Enjeksiyon
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Bu protokol, merkezi bir kornea insizyonu ve ön kamaraya uzun bir tünel kullanılarak sıçanlarda intrakameral enjeksiyon için bir tekniği tanımlar. Bu enjeksiyon yöntemi, yanlışlıkla doku hasarına neden olma riskini en aza indirir ve böylece hassasiyeti ve tekrarlanabilirliği artırır.
Özet
İntrakameral enjeksiyon, oftalmolojide standart bir uygulama rutinidir. Araştırma için kemirgenlerde intrakameral enjeksiyonun uygulanması, küçük sulu mizah hacmi, lens eğriliği ve lens kalınlığı dahil olmak üzere gözün sınırlayıcı boyutları ve anatomisi nedeniyle zordur. İntrakameral enjeksiyonlar sırasında potansiyel hasar, yan etkilere ve deneysel değişkenliğe neden olur. Bu protokol, sıçanlarda intrakameral enjeksiyon için bir prosedürü tanımlar ve hassasiyet ve tekrarlanabilirlik sağlar.
Deneysel model olarak Sprague-Dawley cinsi sıçanlar kullanılmıştır. Sıçanlarda lens pozisyonu ön kamaraya çıkıntı yaptığından, insanlarda olduğu gibi çevreden enjekte etmek sakıncalıdır. Bu nedenle, ön kamaraya kendiliğinden sızdırmaz bir tünel oluşturmak için 31 gauge 0.8 mm'lik bir stiletto bıçak kullanılarak merkezi kornea bölgesinde bir kesi oluşturulur. Düzlüğe yakın bir açıda bir kesi, sulu mizah kaybını ve ön kamaranın sığlaşmasını en aza indiren uzun bir tünel oluşturulmasına izin verir. Enjeksiyon için tünele 34 gauge nanoiğne yerleştirilir. Bu, minimum sürtünme direnci ile penetrasyon sağlar ve lense dokunmayı önler. Tripan mavisi enjeksiyonu, ön kamaradaki boyanın varlığının yarık mikroskobu ile görselleştirilmesine ve sızıntının dışlanmasına izin verir. Kornea endotel tabakasının biyoyararlanımı, enjeksiyondan sonra kornea endotel hücrelerinin çekirdeklerini boyayan Hoechst boyasının enjeksiyonu ile gösterilir.
Sonuç olarak, bu protokol sıçanlarda doğru intrakameral enjeksiyon için bir prosedür uygular. Bu prosedür, deneysel sıçan modellerinde çeşitli ilaçların ve bileşiklerin intrakameral olarak verilmesi için kullanılabilir ve oftalmik araştırmanın verimliliğini ve tekrarlanabilirliğini arttırır.
Giriş
Topikal uygulama ile göz yüzeyine verilen bileşiklerin biyoyararlanımı büyük ölçüde sınırlıdır, tipik olarak %<5'tir1. Göz damlaları ile uygulanan bileşikler esas olarak drenaj, indüklenmiş lakrimasyon, gözyaşı sıvısı döngüsü ve konjonktival emilim ile elimine edilir. Ek olarak, bileşiklerin oküler yüzeyden nüfuz etmesi, kornea-konjonktiva bariyeri 1,2,3 tarafından oldukça kısıtlanmıştır. Kornea üç ana katmandan oluşur: en dıştaki epitel, ara stroma ve en içteki endotel. Yüzeysel kornea epiteli, güçlü sıkı bağlantılarla birbirine bağlanır ve madde geçirgenliğinin ana engeli olan yüksek paraselüler direnç oluşturur. Çoklu epitel katmanları, kornea epitelinin hücreler arası boşlukları boyunca hidrofilik ve büyük moleküllerin nüfuzunu daha da sınırlar. Epitelin ardından gelen stroma, kollajen liflerinden oluşur ve sulu gözenekler içerir. Kornea epitelinin aksine, stroma hidrofilik ilaçların hareketine izin verir; Bununla birlikte, lipofilik bileşikler 1,2,3'e karşı büyük ölçüde geçirimsizdir. Kornea epiteli ve stromal tabakalar birlikte, ilaç emilimini sınırlayan ana doku bariyerleri sunar. Kornea endotelinin ilaç taşınmasını kısıtladığı düşünülmemektedir.
Kornea iletim yoluna alternatif konjonktival yoldur. Konjonktiva, göz kapaklarının iç tarafını ve skleranın ön kısmını kaplayan çok epitel tabakasıdır. Konjonktiva, kornea epitelinden daha az sıkı bağlantı ile karakterize edilir ve hidrofilik ilaçların daha iyi geçirgenliğine izin verir. Bununla birlikte, konjonktivanın vaskülarizasyonu, uygulanan moleküllerin büyük bir kısmının sistemik olarak emilmesine neden olurve yine verilen bileşiklerin ön kamaraya 1,2 biyoyararlanımını büyük ölçüde sınırlar. Dış oküler geçirgenlik bariyerlerini atlamanın etkili bir yolu, ilacı doğrudan ilgilenilen bölgeye vermektir. Örneğin, vitreus mizahına4 intravitreal enjeksiyon yaygındır. Benzer şekilde, ön kamaraya5 verilmesi için intrakameral enjeksiyon kullanılır. Ön kamarada verimli bir konsantrasyon oluşturmak, intrakameral antibiyotik enjeksiyonu ile enfeksiyon tedavisi ve katarakt ameliyatlarında postoperatif antienflamatuar tedaviler gibi çeşitli klinik durumlar için kritik öneme sahiptir. İntramcameral enjeksiyonla sağlanan gelişmiş madde biyoyararlanımının avantajına rağmen, dikkate alınması gereken önemli güvenlik endişeleri vardır. Örneğin, intrakameral ilaç enjeksiyonu artmış göz içi basıncına, toksik ön segment sendromuna ve toksik endotel hücre yıkım sendromunaneden olabilir 5,6. Bu nedenle, tedavi verimliliğini en üst düzeye çıkarmak ve hastalarda potansiyel yan etkileri en aza indirmek için intrakameral enjeksiyonlarla verilen ilaçların etkinliğini ve güvenliğini klinik öncesi çalışmalarda dikkatli bir şekilde değerlendirmek önemlidir.
Deney hayvanı modelleri, yeni tedavileri araştırmak için yapılan klinik öncesi çalışmalarda vazgeçilmezdir. Fareler ve sıçanlar gibi küçük kemirgenler, bu tür amaçlar için en yaygın kullanılan laboratuvar hayvanlarıdır. Bu hayvanlar, insan anatomisi ve fizyolojisi ile çok sayıda benzerlik sergileyerek değerli bilgiler sağlar. Ayrıca, küçük boyutları, bakım kolaylığı, hızlı gebelik ve çok sayıda yavru üretme yetenekleri nedeniyle kullanımları ekonomik olarak avantajlıdır7.
Küçük kemirgenlerin göz hastalığı modellerinde yaygın olarak kullanılmasına rağmen, benzersiz göz boyutları ve anatomileri deneysel manipülasyonlar sırasında önemli zorluklar ortaya çıkarmaktadır. Örneğin, insanlarda nispeten basit olan intrakameral enjeksiyonlar gibi prosedürler, farelerde ve sıçanlarda teknik olarak zorlu hale gelir. Zorluklar, küçük hacimli sulu mizah, nispeten büyük ve esnek olmayan lens ve lensin kemirgenlerin gözleri içindeki engelleyici konumu ve eğriliği gibi faktörlerden kaynaklanmaktadır (Şekil 1)8. Bu zorluklar, kemirgenlerde intrakameral enjeksiyonlar sırasında hasar riskini artırır, potansiyel olumsuz etkilere yol açar ve çalışma sonuçlarının geçerliliğini etkileyebilecek deneysel değişkenliğe neden olur. Araştırmamızda, sıçanlarda güvenli intrakameral enjeksiyon için başarılı bir prosedür geliştirdik. Teknik, korneada ön kamaraya uzun, düz, kendinden sızdırmaz bir tünel oluşturmayı içerir. Bu yöntem sadece hassasiyeti sağlamakla kalmaz, aynı zamanda küçük kemirgenlerde enjeksiyon teknikleriyle ilgili sorunları ele alarak deneysel tekrarlanabilirliği de geliştirir.
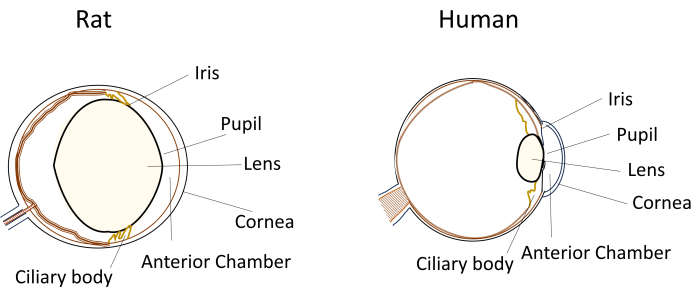
Şekil 1: Sıçan ve insan gözünün anatomik ön segment özelliklerinin şematik gösterimi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Protokol
Protokoldeki deneyler, hayvan bilimi için Ulusal İzin Komitesi tarafından onaylandı ve hayvanların oftalmik ve görme araştırmalarında kullanılması olan ARVO Beyanı'na uygun hale geldi. Bu çalışma için 8-10 haftalık dişi Sprague-Dawley sıçanları kullanıldı ve 12/12 saat aydınlık-karanlık döngülerine maruz bırakıldı. Hayvanlar ticari bir kaynaktan elde edilmiştir (bkz.
1. Hayvan hazırlama
- Anestezik bir ketamin (0.8 mL'de 80 mg / kg vücut ağırlığı) ve ksilazin (0.2 mL'de 4 mg / kg vücut ağırlığı) karışımı hazırlayın ve sıçanları uyuşturmak için tek bir enjeksiyonda intraperitoneal olarak enjekte edin.
- Analjezik buprenorfin (0.03 mg / kg) tek bir enjeksiyonda intraperitoneal olarak enjekte edin.
- Her iki göze topikal oftalmik anestezik% 0.4 oksibuprokain uygulayın.
2. Kendinden sızdırmaz bir kornea tüneli oluşturma
- Cerrahi oftalmik forseps ile superior sklerayı korneoskleral bileşkenin yanındaki dikey orta hatta tutarak gözü stabilize edin.
- Cerrahi mikroskop altında, steril 0,8 mm, 31 G stiletto bıçağını parasantral kornea bölgesindeki dikey orta hatta (göz bebeğinin merkezinin üstünde) yataya mümkün olduğunca yakın bir açıyla düz bir pozisyonda yerleştirin (Şekil 2).
- Bu pozisyonda, bir kesi yapmak için korneayı delin ve ön kamaranın merkezi alanına nüfuz edene kadar uzun bir tünel (2-3 mm) oluşturun. Lense dokunmaktan kaçının (Şekil 2).
NOT: Başarılı bir tünel, sulu mizahın sızmasına ve ön kamaranın sığlaşmasına neden olmaz. - Enjekte edilen göze topikal% 0.3 ofloksasin ve% 0.1 deksametazon uygulayın.
- Yarık mikroskobu altında aşağıdaki gibi inceleyin.
- Enjekte edilen gözün ön kamarasının derinliğini, enjekte edilmeyen göze kıyasla gözlemleyin.
NOT: Derinlik benzer olmalıdır. - Enjekte edilen gözün merceğini, enjekte edilmeyen göze kıyasla gözlemleyin.
NOT: Lens şeffaf olmalıdır. Opaklık, cerrahi prosedür sırasında lens hasarını yansıtabilir.
- Enjekte edilen gözün ön kamarasının derinliğini, enjekte edilmeyen göze kıyasla gözlemleyin.
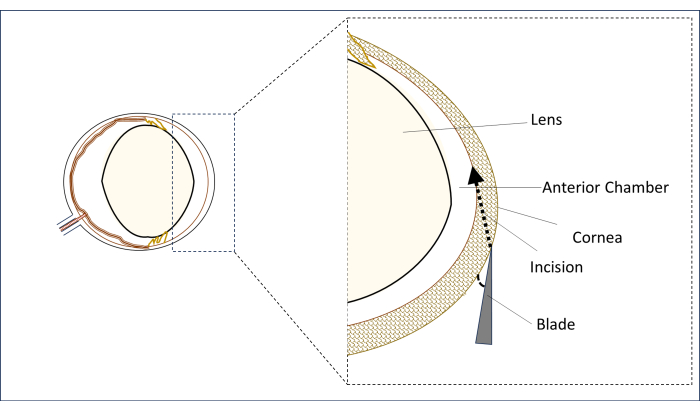
Şekil 2: Bıçağın ve insizyon açısının ve pozisyonunun şematik gösterimi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
3. Seçenek 1: Ön kamaraya başarılı enjeksiyonu değerlendirmek için tripan mavisinin intrakameral enjeksiyonu
- 34 G künt iğne ile steril 10 μL cam Hamilton şırıngaya 5 μL tripan mavisi yükleyin.
NOT: Tripan mavisi enjeksiyonu, model kalibrasyonu veya kurulum aşamaları sırasında enjeksiyonun başarısını değerlendirmek için bir araç olarak tanımlanmaktadır. Deneysel ortamlarda, şırınga tercih edilen bileşiğin bir çözeltisi ile yüklenebilir. - Yüklenen şırınga iğnesini 2. bölümde oluşturulan tünelden ön kamaraya sokun.
- Enjeksiyondan sonra iğneyi enjekte edin ve tüm sıvı temizlenene kadar 2-3 saniye yerinde tutun.
- Kornea tünelinden sızıntıyı önlemek için iğneyi nazikçe ve yavaşça dışarı çekerek çıkarın.
- Yarık mikroskobu altında inceleyin. Sığlığı dışlamak için ön kamaranın derinliğini değerlendirin ve ön kamarada tripan mavisi varlığını doğrulayın.
- Yarık muayenesini 24 saat, 48 saat ve 72 saat sonra tekrarlayın.
4. Seçenek 2: Endotel hücre tabakasına enjekte edilen materyalin biyoyararlanımını değerlendirmek için Hoechst'in intrakameral enjeksiyonu
- 34 G künt iğne ile steril 10 μL cam Hamilton şırıngaya 5 μL Hoechst yükleyin.
NOT: Hoechst enjeksiyonu, enjekte edilen materyalin endotel hücre tabakasına alım yoluyla biyoyararlanımını değerlendirmek için bir araç olarak tanımlanır ve model kalibrasyonu veya kurulum aşamaları sırasında yararlıdır. Deneysel ortamlarda, şırınga tercih edilen bileşiğin bir çözeltisi ile yüklenebilir. - Yüklenen şırınga iğnesini 2. bölümde oluşturulan tünelden ön kamaraya sokun.
- Enjeksiyondan sonra iğneyi enjekte edin ve tüm sıvı temizlenene kadar 2-3 saniye yerinde tutun.
- Kornea tüneli kesisinden sızıntıyı önlemek için iğneyi nazikçe ve yavaşça dışarı çekerek çıkarın.
- Enjeksiyondan yaklaşık 15-20 dakika sonra, 500 mg / kg sodyum pentobarbiton intraperitoneal enjeksiyonu ile sıçanları ötenazi yapın.
- Her iki gözü de enüklee edin ve korneaları izole edin. Enjekte edilmemiş korneayı kontrol olarak toplayın.
- Endotel hücrelerini tanımlamak için her iki korneayı da üretici talimatlarına göre% 0.5 Alizarin Red S ile boyayın.
- Endotel hücrelerinin alizarin-kırmızı boyamasını görüntülemek için ışık mikroskobu altında ve kontrol olarak enjekte edilmeyen korneaya kıyasla Hoechst boyamasını gözlemlemek için floresan mikroskobu altında inceleyin.
Sonuçlar
Sprague Dawley sıçanlarına, yukarıda tarif edilen protokole göre intrakameral olarak 5 μL tripan mavisi enjekte edildi. Enjeksiyondan hemen sonra yarık lamba muayenesi, haznenin tripan mavisi ile boyandığını gösterdi, bu da enjekte edilen materyalin ön kamaraya ulaştığını gösterdi (Şekil 3). Ayrıca, ön kamara derinliği sağlamdı, bu da enjeksiyonun sulu hümör sızıntısına ve odanın sığlaşmasına neden olmadığını düşünd...
Tartışmalar
Klinik öncesi araştırma modelleri, bulguların güvenilirliğini ve uygulanabilirliğini sağlamak için kontrollü ve tekrarlanabilir bir ortam sağlamalıdır. Oftalmoloji araştırmalarında, göz enjeksiyon modelleri, hastalık modellerinin oluşturulmasından, yeni tedavilerin test edilmesine ve doku reaksiyonlarının ve potansiyel yan etkilerin değerlendirilmesine kadar çeşitli araştırma yönlerinde yaygın olarak kullanılmaktadır.
İntrakamer...
Açıklamalar
Marcovich A. L., Steba Biotech, Yeda Weizmann, EyeYon Medical ve Mor Isum markalarında patentlere sahiptir ve EyeYon Medical ve Johnson & Johnson için danışmandır. Diğer tüm yazarların rekabet eden çıkarları yoktur.
Teşekkürler
Bu araştırma, İsrail Bilim Vakfı'nın 2670/23 ve 1304/20 no'lu hibeleri ile desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Alizarin Red | Alpha Aesar | 042040.5 | |
| Buprenorphine | Richter pharma | 102047 | |
| Dexamethasone 0.1% | Fisher Pharmaceutical | 393102-0413 | |
| Hamilton glass syringe 10 μL | Hamilton Co. | 721711 | |
| Hoeschst | Merck | B2261 | |
| Ketamine | Bremer pharma GMBH (medimarket) | 17889 | |
| Ofloxacin 0.3% eye drops | Allergan | E92170 | |
| Oxybuprocaine Hydrochloride 0.4% | Fisher Pharmaceutical | N/A | |
| Pentobarbital sodium 200 mg/mL | CTS | N/A | |
| Slit microscope | Haag-streit bern | b-90019115 | |
| Sprague-Dawley Rats | Envigo | N/A | |
| Stiletto blade 31 G 0.8 mm | Tecfen medical (skymed) | QKN2808 | |
| Surgical microscope | Zeiss | OPMI-6 CFC | |
| Trypan Blue | Sartorius | 03-102-1B | |
| Xylazine | Eurovet Animal Health | 615648 |
Referanslar
- Ramsay, E., et al. Corneal and conjunctival drug permeability: Systematic comparison and pharmacokinetic impact in the eye. Eur J Pharm Sci. 119, 83-89 (2018).
- Cholkar, K., Dasari, S. R., Pal, D., Mitra, A. K. . Eye: Anatomy, Physiology and Barriers to Drug Delivery. Ocular Transporters and Receptors. , (2013).
- Prausnitz, M. R. Permeability of cornea, sclera, and conjunctiva: A literature analysis for drug delivery to the eye. J Pharm Sci. 87 (12), 1479-1488 (1998).
- Varela-Fernández, R., et al. Drug delivery to the posterior segment of the Eye: Biopharmaceutic and pharmacokinetic considerations. Pharmaceutics. 12 (3), 269 (2020).
- Gautam, M., et al. Intracameral drug delivery: A Review of agents, indications, and outcomes. J Ocul Pharmacol Ther. 39 (2), 102-116 (2023).
- Shah, T. J., Conway, M. D., Peyman, G. A. Intracameral dexamethasone injection in the treatment of cataract surgery induced inflammation: design, development, and place in therapy. Clin Ophthalmol. 12, 2223-2235 (2018).
- Perlman, R. L. Mouse models of human disease: An evolutionary perspective. Evol Med Public Health. 2016 (1), 170-176 (2016).
- Chawla, S., Jena, S. . The Anatomy and Physiology of Laboratory Rat.Essentials of Laboratory Animal Science: Principles and Practices. , (2021).
- Lundström, M., Wejde, G., Stenevi, U., Thorburn, W., Montan, P. Endophthalmitis after cataract surgery: a nationwide prospective study evaluating incidence in relation to incision type and location. Ophthalmology. 114 (5), 866-870 (2007).
- Fine, I. H. Clear corneal incisions. Int Ophthalmol Clin. 34 (2), 59-72 (1994).
- Herretes, S., Stark, W. J., Pirouzmanesh, A., Reyes, J. M. G., McDonnell, P. J., Behrens, A. Inflow of ocular surface fluid into the anterior chamber after phacoemulsification through sutureless corneal cataract wounds. Am J Ophthalmol. 140 (4), 737-740 (2005).
- Masket, S., Belani, S. Proper wound construction to prevent short-term ocular hypotony after clear corneal incision cataract surgery. J Cataract Refract Surg. 33 (3), 383-386 (2007).
- Taban, M., Rao, B., Reznik, J., Zhang, J., Chen, Z., McDonnell, P. J. Dynamic morphology of sutureless cataract wounds - Effect of incision angle and location. Surv Ophthalmol. 49, S62-S72 (2004).
- Belforte, N., Sande, P. H., de Zavalía, N., Dorfman, D., Rosenstein, R. E. Therapeutic benefit of radial optic neurotomy in a rat model of glaucoma. PLoS One. 7 (3), e34574 (2012).
- Moreno, M. C., et al. A new experimental model of glaucoma in rats through intracameral injections of hyaluronic acid. Exp Eye Res. 81 (1), 71-80 (2005).
- Belforte, N., Sande, P., de Zavalía, N., Knepper, P., Rosenstein, R. Effect of chondroitin sulfate on intraocular pressure in rats. Invest Ophthalmol Vis Sci. 51 (11), 5768-5775 (2010).
- Matsumoto, Y., Kanamori, A., Nakamura, M., Negi, A. Rat chronic glaucoma model induced by intracameral injection of microbeads suspended in sodium sulfate-sodium hyaluronate. Jpn J Ophthalmol. 58 (3), 290-297 (2014).
- Liu, Y., et al. A novel rat model of ocular hypertension by a single intracameral injection of cross-linked hyaluronic acid hydrogel (Healaflow® ). Basic Clin Pharmacol Toxicol. 127 (5), 361-370 (2020).
- Bowen, R. C., et al. Comparative analysis of the safety and efficacy of intracameral cefuroxime, moxifloxacin and vancomycin at the end of cataract surgery: a meta-analysis. Br J Ophthalmol. 102 (9), 1268-1276 (2018).
- Kato, A., et al. Prophylactic antibiotics for postcataract surgery endophthalmitis: a systematic review and network meta-analysis of 6.8 million eyes. Sci Rep. 12 (1), 17416 (2022).
- Wang, M., Liu, Y., Dong, H. Effect of cefuroxime intracameral injection antibiotic prophylactic on postoperative endophthalmitis wound post-cataract: A meta-analysis. Int Wound J. 20 (5), 1376-1383 (2023).
- Katz, G., et al. Intracameral cefuroxime and the incidence of post-cataract endophthalmitis: an Israeli experience. Graefes Arch Clin Exp Ophthalmol. 253 (10), 1729-1733 (2015).
- Lipnitzki, I., Ben Eliahu, S., Marcovitz, A. L., Ezov, N., Kleinmann, G. Intraocular concentration of moxifloxacin after intracameral injection combined with presoaked intraocular lenses. J Cataract Refract Surg. 40 (4), 639-643 (2014).
- Colleaux, K. M., Hamilton, W. K., Morgan, R. A. Effect of prophylactic antibiotics and incision type on the incidence of endophthalmitis after cataract surgery. Can J Ophthalmol. 35 (7), 373-378 (2000).
- Libre, P. E., Della-Latta, P., Chin, N. X. Intracameral antibiotic agents for endophthalmitis prophylaxis: A pharmacokinetic model. J Cataract Refract Surg. 29 (9), 1791-1794 (2003).
- Carino, N. S., Slomovic, A. R., Chung, F., Marcovich, A. L. Topical tetracaine versus topical tetracaine plus intracameral lidocaine for cataract surgery. J Cataract Refract Surg. 24 (12), 1602-1608 (1998).
- Minakaran, N., Ezra, D. G., Allan, B. D. Topical anaesthesia plus intracameral lidocaine versus topical anaesthesia alone for phacoemulsification cataract surgery in adults. Cochrane Database Syst Rev. 7 (7), (2020).
- Dan-Ni, W., Li-Dian, H., Zhi-Guo, P., Qiang, W., Lei, S. Intracameral anti-VEGF injection for advanced neovascular glaucoma after vitrectomy with silicone oil tamponade. Int J Ophthalmol. 14 (3), 129-135 (2021).
- Bhagat, P. R., Agrawal, K. U., Tandel, D. Study of the effect of injection bevacizumab through various routes in neovascular glaucoma. J Curr Glaucoma Pract. 10 (2), 39-48 (2016).
- Al-Qaysi, Z. K., Beadham, I. G., Schwikkard, S. L., Bear, J. C., Al-Kinani, A. A., Alany, R. G. Sustained release ocular drug delivery systems for glaucoma therapy. Expert Opin Drug Deliv. 20 (7), 905-919 (2023).
- Eghrari, A. O., Gottsch, J. D. Fuchs' corneal dystrophy. Expert Rev Ophthalmol. 5 (2), 147-159 (2010).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır