Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
İnferior Vena Kava Uyumunun ve Genişletilebilirliğinin İn Vivo Küçükbaş Hayvan Modelinde 3D Anjiyografi Kullanılarak Ölçülmesi
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Bu protokol, çeşitli potansiyel uygulamalara izin veren bir sağkalım prosedürü olarak kateterizasyon ve 3D anjiyografi kullanılarak venöz uyum ve uzayabilirliğin in vivo olarak ölçülmesine izin verir.
Özet
Sentetik vasküler greftler, allogreftlerin, otogreftlerin ve ksenogreftlerin bazı zorluklarının üstesinden gelir, ancak genellikle implante edildikleri doğal damardan daha sert ve daha az uyumludur. Doğal damar ile uyum uyumu, greft başarısı için önemli bir özellik olarak ortaya çıkmaktadır. Damar uygunluğunu değerlendirmek için mevcut altın standart, damarın eksizyonu ve ex vivo çift eksenli mekanik testini içerir. Doğal fizyolojiyi daha iyi yansıtan ve akan kanın neden olduğu basınç değişikliğinin ve mevcut herhangi bir morfolojik değişikliğin etkisini dikkate alan venöz uyumu ve uzayabilirliği değerlendirmek için in vivo bir yöntem geliştirdik.
Bu yöntem, hayvan kullanımına olan ihtiyacı potansiyel olarak azaltırken uzunlamasına çalışmaları kolaylaştıran bir hayatta kalma prosedürü olarak tasarlanmıştır. Yöntemimiz, venöz vaskülatüre 20 mL/kg'lık bir salin bolusu enjekte edilmesini, ardından hedef bölgelerdeki intravasküler basınç ölçümleriyle eş zamanlı olarak bolusun neden olduğu değişiklikleri gözlemlemek için bolus öncesi ve sonrası 3D anjiyografilerin alınmasını içerir. Daha sonra bolus öncesi ve sonrası damarın çevresini ve kesit alanını ölçebiliyoruz.
Bu veriler ve intravasküler basınç ile belirli denklemlerle uyumu ve genişletilebilirliği hesaplayabiliyoruz. Bu yöntem, ameliyat edilmemiş yerli koyunlarda inferior vena kavanın uyumunu ve uzayabilirliğini, uzun süreli genleşmiş politetrafloretilen (PTFE) grefti ile implante edilen koyun kanalına karşılaştırmak için kullanıldı. Doğal damarın, ölçülen tüm konumlarda PTFE greftinden daha uyumlu ve uzayabilir olduğu bulundu. Bu yöntemin güvenli bir şekilde in vivo ven uyumu ve uzayabilirliği ölçümleri sağladığı sonucuna vardık.
Giriş
Kritik kardiyak anomalileri olan hastalar rekonstrüktif cerrahi gerektirir. Çoğu rekonstrüktif operasyon, vasküler greftler de dahil olmak üzere protez materyallerinin kullanılmasını gerektirir. Bu boşluğu doldurmak için potansiyel kanallar sentetik veya biyolojik malzemeleri içerir. Başlangıçta, homogreftler Fontan kanalı olarak kullanıldı, ancak o zamandan beri yüksek kalsifikasyon insidansı ve akut faz olayları nedeniyle terk edildi1. Şu anda, inorganik polimerlerden türetilen sentetik vasküler greftler kullanılmaktadır. Bu greftlerin implante edildikleri doğal damardan daha az uyumlu olması ve darlık, tıkanma ve kalsifikasyon gibi uzun vadeli komplikasyonlara sahip olması konusunda bir zorluk devam etmektedir 1,2,3,4,5.
Sentetik vasküler greftlerin yapısı, mekanik gerilme mukavemetine katkıda bulunur ve bu da doğal dokuya kıyasla her zaman daha düşük uyumlarına yol açar2. Basınçtaki bir değişiklik yerine damarın hacmindeki değişimi tanımlayan vasküler kompliyans, bir geminin mekanik yüklere verdiği tepkinin bir göstergesi olarak hizmet eder. Greft materyali ile doğal damar özellikleri arasındaki fark, kan akış modellerini bozduğu ve devridaim ve akış ayrımı alanlarına neden olduğu gösterilen bir uyum uyumsuzluğu yaratır 2,6,7,8,9. Bu fenomen endotel duvarındaki kayma stresini değiştirir ve intimal hiperplaziye neden olur 2,7,8,9. Bu tür yanıtlar greftle ilgili komplikasyonlara yol açarak greft replasmanı veya yeniden müdahale gerektirebilir6.
Vasküler uyum, greft sonuçlarının belirlenmesinde önemli bir rol üstlendiğinden, bu özelliğin doğru ölçümü esastır. Vasküler uyumu ölçmek için mevcut altın standart, ex vivo tübüler çift eksenli mekanik testtir. Bu yöntem, ilgilenilen bir greft veya damarın eksize edilmesini, lateks tüplere bağlanmasını ve çeşitli basınçlar boyunca çevresel gerilme-gerilme davranışını değerlendirmek için basınçlandırılmasını içerir. Uygunluk, basıncın iç çapın10 ölçümü ile karşılaştırılmasıyla belirlenir. Ancak ex vivo yöntemlerin bazı dezavantajları vardır. Ex vivo yöntemi kullanılarak implante edilen greftlerin işlevselliği değerlendirilirken, hayvanların kurban edilmesi ve greftlerin ekilmesi gereklidir, bu da uzun süreli incelemelerin yapılmasını imkansız hale getirir. Bu nedenle, bir in vivo uyumluluk ölçüm protokolü geliştirdik.
Grubumuz, konjenital kalp kusuru hipoplastik sol kalp sendromunu (HLHS) iyileştirmek için Fontan cerrahisinde kullanılmak üzere doku mühendisliği yapılmış vasküler greftler (TEVG'ler) geliştirmeye odaklanmaktadır. Konjenital kalp cerrahisi alanındaki son gelişmeler, ameliyat sonrası sonuçları iyileştirerek daha uzun yaşam beklentilerine yol açmıştır. Bu, implante edilen vasküler kanalın uzun vadeli özelliklerini ve başarısını giderek daha önemli hale getirmektedir. Şu anda, HLHS'nin herhangi bir hayvan modeli mevcut değildir, bu nedenle greftlerimizi hızlandırılmış büyük bir hayvan inferior vena kava (IVC) interpozisyon greft modelinde değerlendiriyoruz. Bu model, Fontan dolaşımının akışını yaratmaya çalışmasa da, benzersiz hemodinamik koşulları etkili bir şekilde özetlemektedir. Bu in vivo protokolü yakın zamanda kullanmamız, TEVG ve konvansiyonel genleşmiş politetrafloroetilen (PTFE) greftlerimiz arasında greft uyumunda önemli farklılıklar göstermiştir11. Bu önceki çalışma metodolojiye odaklanmadığından, bu yeni in vivo yöntemi detaylandıran ek deneyler yaptık.
Şu anda bakım standardı olarak hizmet veren ve genleşmiş politetrafloroetilenden (PTFE) oluşan sentetik grefti Dorset koyunları çalışma hayvanlarına implante ettik ve cerrahi olarak naif kontrol hayvanlarındaki doğal IVC ile karşılaştırdık. Bu protokol, bir PTFE kanalının implantasyonundan 5-7 yıl sonra PTFE grubu ve farklı yaşlarda ameliyat edilmemiş kontrol hayvanları üzerinde gerçekleştirildi. Bu nedenle, protokolü ve temsili sonuçları açıklayan sonraki bölümlerde, zaman zaman, örneğin IVC interpozisyon greftinin greft ortası (midgraft) bölgesi olarak ilgilenilen bölgeye atıfta bulunacağız.
Bu protokol, uzun vadeli bir zaman noktasında uyumsuz olduğu bilinen PTFE kanalının doğal damar ile in vivo uyumluluğunu analiz etmemizi sağlar. Klinik standart materyal olan PTFE'yi doğal ameliyat edilmemiş ven ile karşılaştırmayı seçtik. PTFE kanalının uyumsuz kaldığı ve kireçlenmeye eğilimli olduğu bilindiği için uzun vadeli bir zaman noktası seçtik, bu da uyumluluğunu daha da azaltıyor11. Sistemik hemodinamik değişiklikler in vivo yöntemlerle elde edilen ölçümlere doğru bir şekilde yansıtıldığı için tüm karşılaştırmaları in vivo yapmayı tercih ettik. Bu karşılaştırmadan, bu protokolün PTFE'nin uyumsuzluğunu doğrulayabildiğini ve in vivo venöz uyumun ölçümlerini güvenli ve tekrarlanabilir bir şekilde elde edebildiğini bulduk. Bu yöntem, in vivo11 PTFE kanalları ve doku mühendisliği yapılmış vasküler greftler (TEVG'ler) arasındaki istatistiksel olarak anlamlı farklılıkları göstermek için yayınlanmış bir çalışmada başarıyla uygulanmıştır.
Bu protokolün genel amacı, bir sağkalım prosedüründen elde edilen in vivo ölçümleri kullanarak bir küçükbaş hayvan modelinde torasik IVC'nin uyumluluğunu ve genişletilebilirliğini hesaplamaktır. Bu amaçla, torasik IVC'nin çevresi ve kesit alanındaki değişiklikleri bir sıvı bolusuna görselleştirdik ve ölçtük. Eş zamanlı olarak basınçtaki intravasküler değişimi ölçtük ve bu ölçümleri uyum ve uzayabilirliği hesaplamak için kullandık. 3D anjiyografi görüntülemeyi kullanmak, ölçümlerimizin damarın bir kesitinden alındığından emin olmak için görüntü yakalama sonrası görünümünü ayarlama yeteneği de dahil olmak üzere birçok avantaj sağlar ve aynı zamanda damar boyunca birden fazla yeri ölçmemize izin verir. Bu çalışmadaki üç ilgi alanı, midgreft bölgesinin yanı sıra PTFE greftinin iki bitişik anastomoz bölgesi ve doğal IVC'deki karşılaştırılabilir alanlardı. İn vivo deneyler yaparak, greftlerin gerçek kan akışı içinde ve doku ve organlarla çevrili işlevselliğinin değerlendirilmesinde avantajlar vardır. Bu yöntemle elde edilen ölçümlerin, greftlerin canlı bir organizmadaki gerçek işlevselliğini yansıttığına inanılmaktadır.
Protokol, koyunların prosedür öncesi hazırlanması, kateterizasyon, temel pre bolus verilerinin toplanması, çalışma verilerinin toplanması, hayvanların geri kazanılması ve veri analizi dahil olmak üzere altı ana bölüme ayrılmıştır. Hayvan hazırlama bölümünde, sedasyon, anestezinin başlatılması ve kateterizasyon prosedürü sırasında kullanılan izleme ekipmanının yerleştirilmesini tartışıyoruz. İkinci bölümde, veri toplama için gerekli olan iki kateter kılıfının yerleştirilme sürecini anlatıyoruz. Bu protokol için, her iki kılıf da iki çok kanallı kateterin damar içine sokulmasına izin vermek için sağ iç juguler ven (IJV) içine yerleştirilir. Biri basınçtaki değişikliği kaydetmek için ilgili bölgeye yerleştirilecek ve diğeri kontrast enjeksiyonu için damarın altına yerleştirilecektir. Kateterler yerleştirildikten sonra, karşılaştırma için bir taban çizgisi pre bolus 3D anjiyografi çekilir. Çalışma verilerinin toplanması, salin bolusunun uygulama için basınçlı bir torba sisteminde hazırlanması, salin bolusunun intravasküler basınçların kaydedilmesi ve bolus sonrası 3D anjiyografinin alınması ile başlar. Daha sonra protokolden sonra koyunların geri kazanılmasını kolaylaştırmak için süreci anlatıyoruz. Son olarak, analiz ve istatistiksel karşılaştırma için uygun görüntüleri ve kesitsel ölçümleri elde etme yöntemini tartışıyoruz.
Protokol
Çalışma protokolü, Nationwide Çocuk Hastanesi Abigail Wexner Araştırma Enstitüsü Kurumsal Hayvan Bakımı ve Kullanımı Komitesi (AR22-0004) tarafından onaylandı. Tüm hayvanlara, Ulusal Sağlık Enstitüleri tarafından yayınlanan Laboratuvar Hayvanlarının Bakımı ve Kullanımı Kılavuzu'na uygun olarak insancıl bakım verildi.
1. Hayvan hazırlama
- Hayvanın güvenli bir şekilde anestezi alabilmesini sağlamak için fizik muayene ve yaşamsal belirtilerin analizi de dahil olmak üzere kateterizasyondan 1 hafta önce bir veteriner ekibinin koyunları değerlendirmesini sağlayın.
- Anestezi indüksiyonu üzerine mide içeriğinin aspirasyon riskini sınırlamak için hayvanı gece boyunca veya işlemden 12 saat öncesine kadar aç bırakın.
- C kolunu ve 3D anjiyografi sistemini açmak için kontrol panelindeki açma düğmesine basın (Şekil 1A). Sistem tamamen yüklenene kadar bekleyin.
NOT: Floroskopinin görüntü almaya hazır olana kadar duraklatıldığından ve tüm personelin koruyucu kurşun taktığından emin olun. - 1.000 mL% 0.9 saline 1 mL heparin (1.000 USP birimi / mL konsantrasyon) ekleyerek prosedürde kullanmak üzere heparinize salin hazırlayın.
- Boynun sol tarafını tıraş edin ve alkolle ovalayın. Sol juguler ven içine ketamin (4 mg / kg), butorphanol (0.1 mg / kg) ve diazepam (0.5 mg / kg) kombinasyonu enjekte ederek sedasyon uygulayın.
- Sedasyonlu koyunu bir hastane yatağına yerleştirin ve entübasyon için sternal yatış pozisyonuna getirin. Koyunun büyüklüğüne bağlı olarak 9-14 mm'lik bir Endotrakeal (ET) tüp ile dil ve epiglot laringoskop ile bastırılarak ve ET tüpünü trakeaya yerleştirerek entübe edin.
- Koyunu sağ yanal pozisyonda konumlandırın. ET tüpünü bir ventilatöre takın ve 1-3 L/dk'da %100 Oksijen ile mekanik olarak havalandırın.
- % 1-3 inhale izofluran ile anesteziyi koruyun. Solunum hızını 15-30 nefes/dk'ya ve son tidal hacmi 8-10 mL/kg'a ayarlayın.
- Sağ ön bacağa bir kan basıncı manşeti, sağ kulağa oksijen doygunluğunu izlemek için bir kulak klipsi, yemek borusuna bir sıcaklık probu ve ET tüpüne bir uç tidal CO2 monitörü dahil olmak üzere standart izleme ekipmanını yerleştirin. Yünü, çiy pençeleri ve topuk arasındaki her toynağın kuyruk yönünden tıraş edin. Elektrokardiyogram (EKG) düğümlerini yerleştirin ve EKG düğümlerini bantla sabitleyin.
- Oftalmik merhem uygulayarak her iki gözü de yağlayın ve gaz ve yiyecek tahliyesini sağlamak için orogastrik bir tüp yerleştirin.
- Propofol sabit oranlı infüzyon (CRI) (20-40 mg∙kg-1∙h-1), bakım sıvıları (10 mL∙kg-1∙h-1) ve tuzlu bolusun uygulanmasına izin vermek için sol IJV'de bir IV hattı oluşturun.
- Koyunu sol yanal yaslanacak şekilde konumlandırın. Kateterizasyon bölgesine erişim sağlamak için boynun sağ tarafını tıraş edin (Şekil 2A). Alanı klorheksidin ovma ve alkol ile temizleyin.
- İzleme ekipmanı ve ventilatörden ayırın ve koyunları kateterizasyon laboratuvarı masasına taşıyın. Yine, hayvanı sol lateral yaslanmış pozisyonda yerleştirin (Şekil 3A).
- Ventilatöre ve izleme ekipmanına (EKG kabloları, sıcaklık probu, kan basıncı manşeti, nabız oksimetresi) yeniden bağlayın.
- % 100 O2 ve/veya propofol CRI (20-40 mg-kg-1∙h-1) ile inhale izofluran% 1-3 uygulayarak işlem sırasında anesteziyi koruyun.
NOT: Hayvan hareketini, ağrılı uyaranlara tepkiyi, solunum hızını, nabız hızını ve kan basıncını ölçerek anestezi düzlemini değerlendirin. Daha derin bir anestezi düzlemini indüklemek için 5-10 mL propofol bolusu kullanmak gibi sedasyonda uygun şekilde ayarlamalar yapın. - Büyük kaliperler kullanarak koyunların kalp bölgesindeki genişliğini ölçün. Basınç dönüştürücüyü ayarlamak için genişliği 2'ye bölün.
- Cerrahi bölgeyi aseptik olarak temizleyin ve steril bir şekilde örtün (Şekil 2B,C).
2. Kateterizasyon
- C-Arm'ı park edilmiş konumdan koyun göğsüne getirin ve masayı gerektiği gibi kaldırın. Kontrol panelindeki 7 ve 3 düğmelerine basın ve ardından masayı ve masanın sol tarafındaki C-Arm'ı otomatik olarak konumlandırmak için önceden programlanmış ayarları kullanmak için Başlat düğmesini basılı tutun (Şekil 1A).
- 21 G mikro delme iğnesi ve 10 cc Luer Slip şırınga kullanarak doğru IJV'ye erişin; şırınga pistonunu geri çekerken IJV'ye cilt boyunca kraniyal/kaudal yönde erişin. İğnenin damar içinde olduğunu doğrulamak için kanın aspire edildiğinden emin olun (Şekil 2A, B).
- İğneyi sabit tutarken şırıngayı dikkatlice ayırın.
- 0.018 inç Paslanmaz Çelik (SS) Tel Kılavuzunu iğneden kabın yaklaşık yarısına kadar yerleştirin. İğneyi SS telinin üzerinden çıkarın.
- SS telinin üzerine ve kabın içine 5 Fransız (Fr) dilatör yerleştirin. Dilatörün ve SS telinin iç parçasını çıkarın. Dilatörden yaklaşık yarıya kadar kabın içine 0.038 inçlik bir kılavuz tel besleyin ve dilatörü çıkarın.
- Telin girdiği damarın üzerindeki cildi kesmek için 11 bıçaklı bir neşter kullanın. Kılavuz telin üzerinden ve kabın içine 9-Fr'lik bir kılıf besleyin. İç kılıf bölümünü ve kılavuz teli çıkarın.
- Kan aspire ederek ve ardından kılıfı heparinize salin ile yıkayarak uygun kılıf yerleşimini onaylayın.
- Sağ IJV'de iki adet 9-Fr kılıf olacak şekilde 2.2-2.7 arasındaki adımları tekrarlayın.
- Pıhtılaşmayı önlemek için IV'ten 150 U / kg heparin uygulayın.
- Floroskopiyi başlatmak için ayak pedalını kullanın (Şekil 1B). Torasik IVC'yi diyafram boyunca abdominal IVC'ye takip ederek kılıftan bir Judkins Right (JR) kateteri yerleştirin.
- Abdominal IVC'ye ulaşana ve uç JR kateterinden çıkana kadar JR kateterinden bir Rosen teli geçirin. Rosen telini yerinde tutarken JR kateterini nazikçe çıkarın.
- 2.10-2.11 arasındaki adımları ikinci kılıfla tekrarlayın.
- Her bir Rosen telinin üzerine 7-Fr Çok Kanallı bir kateter geçirin.
- Floroskopi rehberliğinde, kontrast enjeksiyonu için abdominal IVC'ye çok kanallı bir anjiyografik kateter yerleştirin.
- Floroskopi kullanarak, basınç ölçümü için belirli bir ilgi alanına (örneğin, greftin merkezi) başka bir çok anjiyografik kateter yerleştirin (Şekil 2C).

Şekil 1: Kontrol paneli. (A) 3D anjiyografi sistemi kontrol paneli (B) Floroskopi ayak pedalları Bu şeklin daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
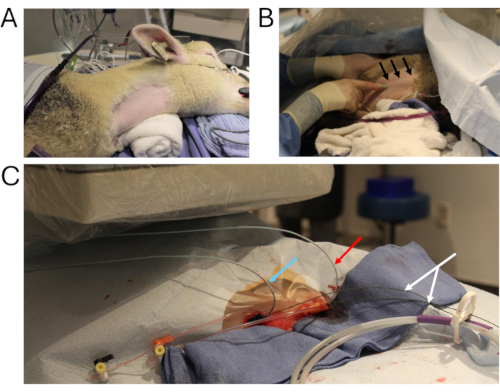
Şekil 2: Hayvan kateterizasyonu. (A) Kateterizasyon için hazırlanan anahtar cerrahi bölge. (B) Sağ iç juguler veni görselleştirme tekniği (siyah oklar). (C) Sağ internal juguler venden iki çok kanallı anjiyografik kateter yerleştirilir (mavi ok: greftte basınç ölçümü; kırmızı ok: abdominal IVC'ye kontrast enjeksiyonu; beyaz ok: sert teller). Kısaltma: IVC = inferior vena kava. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
3. Ön verilerin toplanması
- İlgilenilen bölgede merkezlenmiş çok kanallıyı, üç bir vana kullanarak basınç dönüştürücüsüne bağlayın. Musluk çoklu yola açıkken, hava kabarcıkları çıkana ve kan görülene kadar 10 mL'lik bir şırınga ile geri çekin.
- 10 mL'lik şırınga ters çevrilmişken, çok parçalı kanala herhangi bir havayı geri itmemeye dikkat ederek kanı koyunlara geri verin. Çok parçayı heparinize tuzlu su ile yıkayın.
- Vananın kapalı konumunu şırıngaya çevirin, böylece basınç dönüştürücü ve çok kanallı birbirine açık olur.
- Bir kontrast madde ekleyerek kontrast enjektörünü hazırlayın. 3D anjiyogram için minimum hacim 60 mL'dir ve toplam kontrast 5 mL/kg veya 250 mL'yi aşamaz.
- Kontrast enjektörünü abdominal IVC'de ortalanmış çok parçalı enjektöre bağlayın. Kontrast enjektörünü kullanarak, kan görülene kadar çoklu kanaldan hava kabarcıklarını çekmek için düğmeyi saat yönünün tersine yavaşça çevirin. Kontrastı çoklu kanala yavaşça ileri itmek için düğmeyi saat yönünde çevirin.
- Kontrastın çok kanalın ucuna ulaştığını doğrulamak için floroskopi kullanın.
- 3D anjiyografi için kullanılan toplam kontrastı alın ve mL/s elde etmek için 5'e bölün. Hız artışını 0 ve 600 psi olarak ayarlayın.
- Ekranın sağ üst köşesindeki Program düğmesine ve 3D DSA 110 8'' düğmesine (110 cm SID ile 3D Anjiyografi ve 8 inç'te Alan Görünümü) tıklayarak C kolunu önceden programlanmış moda ayarlayın.
- Tüm nesneleri ve insanları masanın önünden veya yanlarından uzaklaştırın. Kontrol paneli üzerinde bulunan 3 numaralı butona tıklayarak C-Arm programını başlatınız. Hedef bölgeyi (örn., midgraft) xy düzleminin merkezine yerleştirin (Şekil 3A-C).
- Kontrol paneli üzerinde bulunan 4 numaralı butona tıklayarak ikinci programa ilerleyiniz. Tablonun yüksekliğini, ilgilenilen bölgeyi ortalayacak şekilde ayarlayın.
- 5 numaralı butona basın ve test görüntüsünü alın.
- Koşulları Onayla düğmesine tıklayarak C-Arm'ın hareket aralığını önceden test edin | Başlat (Şekil 3D,E).
- Anestezi uzmanından ventilasyonu tutmasını isteyin ve orta çekim pedalı ile programı başlatarak kontrast enjeksiyonlu 3 boyutlu rotasyonel anjiyografi yapın. Aynı anda hedef bölgenin ortalama basıncını ölçün ve kaydedin.
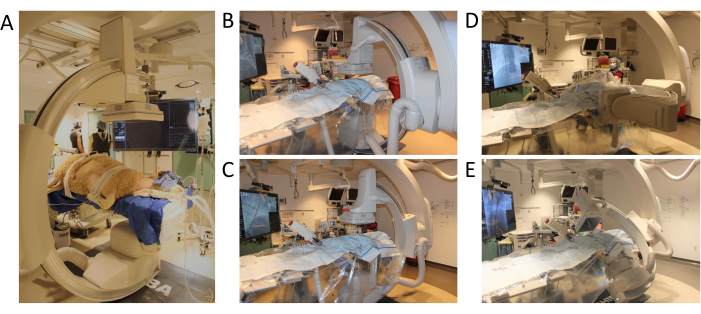
Şekil 3: C kolu konumlandırma ve hareket açıklığı. (A) Prosedürün başlangıcı için koyun pozisyonu: (B) 3D anjiyografi programı için ilk pozisyon: (C) Xy ekseninde hareket eden C-kolu (D), Z-ekseninde hareket eden C-kolu (E), C-kolu tam hareket açıklığı ile test dönüşünü tamamlar. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
4. Tuzlu bolusun uygulanması ve veri toplanması
- 20 mL / kg% 0.9 tuzlu su hazırlayın.
- Bolus basınçlı torbayı hazırlamak için, basınçlı bir torba ünitesine 1.000 mL'lik bir torba% 0.9 salin torbası ekleyin. Uygulanacak toplam hacmi elde etmek için gerekirse ikinci bir ünite kullanın.
- Şişirme ampulünü, manometre kırmızı çizgiden hemen önce (basınç 250-300 mmHg) yeşil bölgeye yükselene kadar sıkın. Tuzlu suyu hattan geçirin ve hava kabarcıklarını çıkarın.
- Basınçlı tuzlu su torbasını 9-Fr'lik bir kılıfa bağlayın ve bolusun sabit hızını korumak için 250-300 mmHg'yi koruyun. Koyun 20 mL/kg'a eşdeğer bir bolus alana veya ortalama basınç 15 mmHg'ye ulaşana kadar akmasına izin verin.
- Bolus akarken, hedef bölgenin intravasküler basınçlarını her dakika kaydedin.
- 3.9-3.12 adımlarını tekrarlayarak C-Arm'ı ikinci bir 3D rotasyonel anjiyografi için hazırlayın. Bolus biter bitmez, basınç düşmeye başlamadan önce, adım 3.13'te anlatıldığı gibi başlayarak ikinci 3D anjiyografiyi ve eşzamanlı intravasküler basınç ölçümünü yapın.
5. Kurtarma
- Görüntüleme tamamlandıktan sonra, 77 numarayı girerek ve C-Arm kendini konumlandırana kadar Başlat düğmesini basılı tutarak C-Arm'ı önceden programlanmış park konumuna geri yerleştirin.
- Çok kanallı anjiyografi kateterlerini ve Rosen tellerini çıkarın.
- Kanamayı durdurmak için en az 7 dakika boyunca hemostaz yaması ile yerleştirme bölgelerine doğrudan basınç uygularken her iki kılıfı da çıkarın.
- Steril bir gazlı bez rulosunu yamaların ve boynun etrafına sarın, böylece sargı basıncı korumak için güvenli olacak, ancak dolaşımı kesme veya nefes almayı önleme riskini alacak kadar sıkı olmayacak şekilde sarın.
- Anestezikleri (izofluran ve / veya propofol CRI) kapatın.
- Koyunları sürekli olarak kendi başlarına nefes alana kadar% 100 O2 ile vantilatörde tutun.
NOT: Koyunun uyandığına dair işaretler arasında hareket, göz kırpma, ağrılı uyaranlara tepki, çene tonu veya çiğneme girişimleri ve ventilatör yardımı olmadan nefes alma yer alır. - Koyunlar kendi başlarına nefes alabildiğinde, ekstübe edin (ET tüpünü çıkarın) ve orogastrik tüpü çıkarın.
- Tüm izleme ekipmanını çıkarın ve koyunları bir hastane yatağına aktarın. Konut odasına geri taşıyın.
- Koyunların sternal yaslanmada kalmasına veya koyunlar kendi başına dengeyi koruyabilene kadar ayakta durmaya çalışmasına yardımcı olun. Duvarlara çarpmalarını önleyin.
- Yeterince uyanık göründüklerinde, az miktarda saman veya tahıl verin.
6. Verilerin analizi
- Orijinal ham 3D anjiyografi verilerini anjiyografi görüntüleme yazılımından DICOM dosya formatında dışa aktarın.
- DICOM görüntüleyici yazılımını başlatın. Açmak için 3D anjiyografi dosyasını görüntüleyiciye sürükleyip bırakın (Şekil 4A).
- DICOM görüntüleyici yazılımı içinde, anjiyografi verilerinin 3B yeniden yapılandırılmış bir görünümünü oluşturmak için 3D MPR (Çok Düzlemli Rekonstrüksiyon) aracını seçin. Bu, üç farklı açıdan üç farklı 2B görünüm sunacaktır: eksenel, sagital (Şekil 4B) ve koronal (Şekil 4C) düzlemler.
- Hedef bölgeyi merkeze yerleştirerek ve her düzlemdeki referans çizgilerinin yönünü bir el aleti ile döndürerek istenen dikey konumu elde etmek için sagital ve koronal düzlemlerde hedef bölgenin yerleşimini ve yönünü ayarlayın (Şekil 4D).
- Hedef bölgenin eksenel görünümünde damar duvarının ana hatlarını çizmek için DICOM görüntüleyici içindeki kalem aracını kullanın (Şekil 4E). Yazılım, eksenel görünümün ortasındaki bölgenin hem alanını hem de çevresini (Çevre) otomatik olarak hesaplar ve gösterir.
- Uyumluluğu hesaplamak için denklem (1)'i kullanın, burada A kesit alanı (cm2) ve P basınçtır (mmHg):
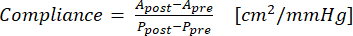 (1)
(1) - C'nin çevresi (cm) ve P'nin basınç (mmHg) olduğu uzayabilirliği hesaplamak için denklem (2) kullanın:
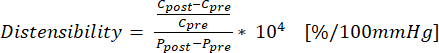 (2)
(2)
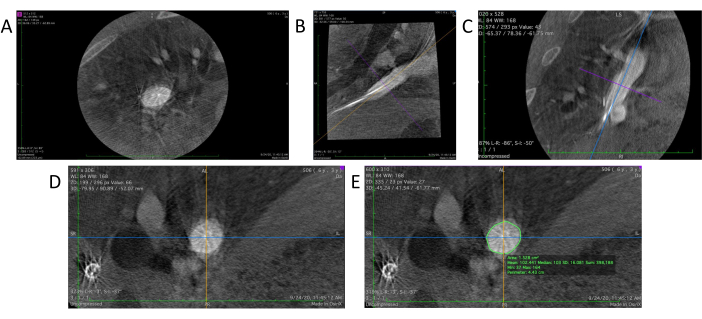
Şekil 4: DICOM görüntüleyicide veri analizi. (A) DICOM görüntüleyiciye yüklenen 3D anjiyografinin ham verileri. (B) Greftin sagital bölümü. (C) Koronal bölüm. (D) Sagital ve koronal kesitlerdeki açı ayarlandıktan sonra gerçek bir kesit görselleştirilir. (E) Kalem aracı, çevre ve kesit alanı ölçümleri yapmak için hedef kabın ana hatlarını çizmek için kullanılır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Sonuçlar
25'in üzerinde koyunla bu işlemi başarıyla gerçekleştirdik. Daha da önemlisi, bu işlemle ilgili herhangi bir morbidite ve mortalite vakası yoktu. Tüm koyunlar karmaşık olmayan iyileşmeler sergiledi. Bu temsili sonuçlar, PTFE greftleri implante edilen üç koyundan ve ameliyat edilmemiş üç yerli koyundan alınmıştır. Şekil 5 , protokol sırasında her iki çalışma hayvanı grubundan alınan intravasküler basınç ölçümlerini sağlar. Bu değerler, uyumluluk ve geni?...
Tartışmalar
Uyumluluk ve genişletilebilirlik, kan damarı fonksiyonu için temel özelliklerdir ve potansiyel komplikasyonların ve müdahalelerin göstergeleri olarak hizmet eder. Bu parametrelerdeki değişikliklerin kesin olarak ölçülmesi ve karşılaştırılması, greft etkinliğini değerlendirmek için önemlidir. İn vivo yöntemimiz, ex vivo analizin sınırlamalarının üstesinden gelir ve karşılaştırılabilir sonuçlar sağlar. İn vivo verilerimiz Blum ve arkadaşları tarafından sunu...
Açıklamalar
Bu çalışma kısmen Gunze Ltd. tarafından desteklenmiştir.
Teşekkürler
Bu çalışma R01 HL163065 ve W81XWH1810518 tarafından desteklenmiştir. Animal Research Core'daki kendini işine adamış personele minnettarlığımızı sunuyoruz. Ayrıca, çalışma boyunca paha biçilmez uzmanlığı ve dikkatli bakımı için Carmen Arsuaga'ya minnettarlığımızı ifade etmek istiyoruz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 0.035" x 260 cm Rosen Curved Wire Guide | Cook Medical | G01253 | Guide for holding placement swapping caths (Multi-track, IVUS, etc) |
| 0.035"x 150 cm Glidewire | Terumo | GR3507 | Guide for JR cath |
| 0.9% Sodium Chloride Saline | Baxter Healthcare Corporation | NCH pharmacy | For diluting norepinpherine, pressure monitoring |
| 10.0 Endotracheal tube | Coviden | 86117 | To secure airway |
| 16 G IV catheter | BD | 382259 | To administer fluids and anesthetic drugs |
| 22 G IV catheter | BD | 381423 | For invasive blood pressure |
| 5Fr x .35" JR2.5 | Cook Medical | G05035 | Guide for rosen wire |
| 70% isopropyl alcohol | Aspen Vet | 11795782 | Topical cleaning solution |
| 7Fr x 100 cm Multi-track | B. Braun | 615001 | Collecting pressure, Administering contrast to specific intravascular location |
| 9Fr Introducer sheath | Terumo | RSS901 | Access catheter through skin into vessel for wires to pass through |
| ACT cartridge | Abbot Diagnostics | 03P86-25 | Activated Clotting Time |
| Angiographic syringe w/ filling spike | Guerbet | 900103S | For contrast injector |
| Bag decanter | Advance Medical Designs, LLC | 10-102 | Punctures saline bag to pour and fill sterile bowl with saline |
| Butorphanol | Zoetis | NCH pharmacy | Sedation drug: Concentration 10 mg/mL, Dosage 0.1 mg/kg |
| Cath Research Pack | Cardinal Health | SAN33RTCH6 | Cath pack with misc. supplies |
| Cetacaine | Cetylite | 220 | Topical anesthetic spray |
| Chloraprep | BD | 930825 | Topical cleaning solution |
| Chlorhexidine 2% solution | Vedco INC | VINV-CLOR-SOLN | Topical cleaning solution |
| Conform stretch bandage | Coviden | 2232 | Neck wrap to prevent bleeding |
| Connection tubing | Deroyal | 77-301713 | Connects t-port to fluid/drug lines |
| Diazepam | Hospira Pharmaceuticals | NCH pharmacy | Sedation drug: Concentration 5 mg/mL, Dosage 0.5 mg/kg |
| EKG monitoring dots | 3M | 2570 | |
| Fluid administration set | Alaris | 2420-0007 | |
| Fluid warming set | Carefusion | 50056 | |
| Hemcon Patch | Tricol Biomedical | 1102 | Patch for hemostasis |
| Heparin | Hospira, Inc | NCH pharmacy | Angicoagulant: 1,000 USP units/mL |
| Infinix-i INFX-8000C | Toshiba Medical Systems | 2B308-124EN*E | Interventional angiography system |
| Invasive pressure transducer | Medline | 23DBB538 | For invasive blood pressure |
| Isoflurane | Baxter Healthcare Corporation | NCH pharmacy | Anesthetic used in prep room |
| Ketamine | Hospira Pharmaceuticals | NCH pharmacy | Sedation drug: Concentration 100 mg/mL, Dosage 4 mg/kg |
| Lubricating Jelly | MedLine | MDS0322273Z | ET tube lubricant |
| Micropuncture Introducer Set | Cook Medical | G47945 | Access through skin into vessel |
| Needle & syringes | Cardinal Health | 309604 | For sedation |
| Norepinpherine Bitartrate Injection, USP | Baxter Healthcare Corporation | NCH pharmacy | 1 mg/mL |
| Optiray 320 | Liebel-Flarsheim Company, LLC | NCH pharmacy | Contrast |
| Optixcare | Aventix | OPX-4252 | Corneal lubricant |
| OsiriX MD | Pixmeo SARL | - | DICOM Viewer and Analysis software |
| Pressure infusor bag | Carefusion | 64-10029 | To maintain invasive blood pressure |
| Propofol | Fresenius Kabi | NCH pharmacy | Anesthetic drug: Concentration 10 mg/mL, Dosage 20-45 mg·kg-1·h-1 |
| Silk suture 3-0 | Ethicon | C013D | To secure IV catheter |
| SoftCarry Stretcher | Four Flags Over Aspen | SSTR-4 | |
| Stomach tube | Jorgensen Lab, INC | J0348R | To release gastric juices and gas and prevent bloat |
| T-port | Medline | DYNDTN0001 | Connects to IV catheter |
| Urine drainage bag | Coviden | 3512 | Connects to stomach tube to collect gastric juices |
| Warming blanket | Jorgensen Lab, INC | J1034B |
Referanslar
- Hagler, D. J., et al. Fate of the Fontan connection: Mechanisms of stenosis and management. Congenit Heart Dis. 14 (4), 571-581 (2019).
- Nezerati, R. M., Eifert, M. B., Dempsey, D. K., Cosgriff-Hernandez, E. Electrospun vascular grafts with improved compliance matching to native vessels. J Biomed Mater Res B Appl Biomater. 103 (2), 313-323 (2015).
- Bates, O., Semple, T., Krupickova, S., Bautisa-Rodriguez, C. Case report of a Gore-Tex TCPC conduit dissection causing severe stenosis. Eur Heart J Case Rep. 5 (11), 1-6 (2021).
- Sathananthan, G., et al. Clinical importance of Fontan Circuit thrombus in the adult population: Significant association with increased risk of cardiovascular events. Can J Cardiol. 35 (12), 1807-1814 (2019).
- Kumar, P., Bhatia, M. Computed tomography in the evaluation of Fontan Circulation. J Cardiovasc Imaging. 29 (2), 108-122 (2021).
- Abbott, W. M., Megerman, J., Hasson, J. E., L'Italien, G., Warnock, D. F. Effect of compliance mismatch on graft patency. J Vasc Surg. 5 (2), 376-382 (1987).
- Weston, M. W., Rhee, K., Tarbell, J. M. Compliance and diameter mismatch affect the wall shear rate distribution near an end-to-end anastomosis. J Biomech. 29 (2), 187-198 (1996).
- Ballyk, P. D., Walsh, C., Butany, J., Ojha, M. Compliance mismatch may promote graft-artery intimal hyperplasia by altering suture-line stress. J Biomech. 31 (3), 229-237 (1997).
- Lemson, M. S., Tordoir, J. H. M., Daemen, M. J. A. P., Kitslaar, P. J. E. H. M. Intimal hyperplasia in vascular grafts. Eur J Vasc Endovasc Surg. 19 (4), 336-350 (2000).
- Blum, K. M., et al. Tissue engineered vascular grafts transform into autologous neovessels capable of native function and growth. Commun Med. 2, 3 (2022).
- Turner, M. E., et al. Tissue engineered vascular grafts are resistant to the formation of dystrophic calcification. Nat Commun. 15, 2187 (2024).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır