Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Düşük Maliyetli Bir Epimisyal Elektromiyografi Elektrodunun Geliştirilmesi: Üretim ve Test için Basitleştirilmiş Bir İş Akışı
Bu Makalede
Özet
Amacımız, epimisyal elektromiyografi elektrotlarının üretimi ve test edilmesi hakkında güncellenmiş, takip etmesi kolay bir kılavuz sağlamaktı. Bu amaçla, malzeme tedariki için talimatlar ve üretim ve test sürecinin ayrıntılı bir incelemesini sağlıyoruz.
Özet
Elektromiyografi (EMG), nöromüsküler anormallikleri tespit etmek için değerli bir tanı aracıdır. İmplante edilebilir epimisyal elektrotlar, klinik öncesi modellerde EMG sinyallerini ölçmek için yaygın olarak kullanılır. Epimisyal elektrot üretiminin ilkelerini tanımlayan klasik kaynaklar mevcut olsa da, elektrot teorisini pratiğe çeviren açıklayıcı bilgi seyrekliği vardır. Bunu düzeltmek için, düşük maliyetli bir epimisyal elektrotun üretilmesi ve test edilmesi hakkında güncellenmiş, takip etmesi kolay bir kılavuz sunuyoruz.
Elektrotlar, temas yüzeylerini oluşturmak için iki platin-iridyum folyonun önceden kesilmiş bir silikon tabana katlanması ve yerleştirilmesiyle yapıldı. Daha sonra, elektrot uçlarını oluşturmak için her bir temas yüzeyine kaplanmış paslanmaz çelik teller kaynaklandı. Son olarak, elektrodu kapatmak için bir silikon karışımı kullanıldı. Ex vivo test, özel olarak üretilmiş elektrodumuzu, tüm dalga formlarında yüksek düzeyde sinyal uyumu (sinüs [sınıf içi korelasyon - ICC= 0.993], kare [ICC = 0.995], üçgen [ICC = 0.958]) ve zamansal senkronizasyon (sinüs [r = 0.987], kare [r = 0.990], üçgen [r = 0.931]) bulunan bir tuzlu su banyosunda endüstri standardı bir elektrotla karşılaştırmak için yapılmıştır. Düşük elektrot empedansı seviyeleri de elektrokimyasal empedans spektroskopisi ile ölçüldü.
Bir sıçanın vastus lateralis kasının özel olarak üretilmiş elektrot ile cerrahi olarak enstrümantize edildiği ve yokuş yukarı ve yokuş aşağı yürüme sırasında sinyalizasyonun elde edildiği bir in vivo performans değerlendirmesi de yapıldı. Beklendiği gibi, tepe EMG aktivitesi yokuş aşağı yürüme sırasında (0.008 ± 0.005 mV) yokuş yukarı (0.031 ± 0.180 mV, p = 0.005) önemli ölçüde daha düşüktü ve bu da cihazın geçerliliğini destekledi. Cihazın güvenilirliği ve biyouyumluluğu, implantasyondan 14 gün ve 56 gün sonra düz yürüme sırasında tutarlı sinyalizasyon (sırasıyla 0.01 ± 0.007 mV, 0.012 ± 0.007 mV; p > 0.05) ve histolojik inflamasyonun olmaması ile desteklendi. Toplu olarak, düşük maliyetli epimisyal elektrotların üretimi ve test edilmesi için güncellenmiş bir iş akışı sağlıyoruz.
Giriş
Elektromiyografi (EMG), kasın elektriksel aktivitesini incelemek için güçlü bir araçtır. EMG kayıtları, nöromüsküler disfonksiyonu tedavi etmek için yapılan müdahalelerin etkinliğini değerlendirmek için klinik öncesi hayvan modellerinde özellikle yararlı olabilir. Bu modellerde, motor nöronlar ve kas lifleri arasındaki nörofizyolojik arayüzü değerlendirmek için implante edilebilir biyouyumlu elektrotlar yaygın olarak kullanılır. Bu implante edilebilir elektrotlar, kas uyarımının lokalize ölçümlerini sağlayabilir ve konfigürasyonları, şekilleri ve malzemeleri açısından çeşitli olabilir, optimal tasarım nihai olarak konum ve kullanım amacı tarafından belirlenir.
Klinik öncesi modellerde kas uyarımını değerlendirmek için uygunluklarına rağmen, epimisyal elektrotların kullanımı maliyetle sınırlandırılabilir. Sonuç olarak, birçok araştırmacı, şirket içinde üretilen özel olarak üretilmiş epimisyal elektrotlar kullanır. Elektrot üretimi, testi ve kullanımı 1,2 ile ilgili temel hususları detaylandıran kaynaklar mevcut olsa da, modern yöntemler kullanılarak epimisyal elektrotların tedarikini, üretimini ve doğrulanmasını detaylandıran güncellenmiş bir talimat kılavuzuna ihtiyaç vardır. Loeb ve Gans3'ün ve diğerlerinin elektrot teorisindeki temel çalışmalarından yola çıkarak, düşük maliyetli epimisyal elektrotların tedariki ve üretimi hakkında modern talimatlar sunuyoruz ve performanslarını bir dizi ex vivo ve in vivo deneyde test ediyoruz. Amaç, bilim camiasındaki diğer kişilere, hayvan kullanımı için kurum içi düşük maliyetli epimisyal elektrotları tedarik etmek, üretmek ve test etmek için kullanıcı dostu bir rehber sunmak ve klinik öncesi modellerde kas uyarımının daha geniş bir şekilde ölçülmesini sağlamaktır.
Bu protokolde, modern elektrofizyoloji laboratuvarında hayvan kullanımı için epimisyal elektrotların tedariki, üretimi ve test edilmesi için bir talimat kılavuzu sunuyoruz. İmalat için seçilen şekil, boyutlar, temas yüzeyi alanı, elektrotlar arası mesafe, kurşun uzunluğu vb. gibi elektrot parametreleri, deneysel ihtiyaçlarımıza uyacak şekilde seçilmiştir ve ticari olarak temin edilebilen bir endüstri standardı epimisyal elektrotla karşılaştırılabilirdir ( bkz. Diğer grupları, kullanım durumlarına uygun güvenilir bir endüstri standardı elektrot seçmenin yanı sıra bu parametreleri ihtiyaçlarına göre değiştirmeye teşvik ediyoruz.
Okuyuculara nispeten hızlı bir elektrot performansı hissi vermek amacıyla, elektrot empedansını ölçme seçeneği ile bir ex vivo test protokolü örneği de sunuyoruz. Ek olarak, in vivo elektrot performansının örnek bir değerlendirmesini veriyoruz. Ex vivo deney, stabil fizyolojik koşulları taklit etmek için özel olarak üretilmiş elektrotu tuzlu su banyosundaki bir endüstri standardıyla karşılaştırdı. Empedans ayrıca elektrokimyasal empedans spektroskopisi (EIS) ile ex vivo olarak değerlendirildi. İn vivo deney, özel olarak üretilmiş elektrotun, yüksek veya düşük bir sinyal ortaya çıkardığı bilinen koşullar sırasında (yokuş yukarı, yokuş aşağı yürüme) EMG sinyalini ölçmek için 16 haftalık bir dişi Long Evans sıçanına (HsdBlu: LE, Envigo) vastus lateralis (VL) kasına cerrahi implantasyonundan oluşuyordu. Özel olarak üretilen elektrotun güvenilirliğini değerlendirmek için, tam cerrahi iyileşmeyi takiben ve fedakârlıktan önce (implantasyondan 14 gün ve 56 gün sonra) düz yürüyüş sırasında EMG sinyali alındı. Özel olarak üretilen elektrotun biyouyumluluğunu değerlendirmek için aletli kas üzerinde hematoksilen-eozin (H&E) boyaması yapıldı.
Access restricted. Please log in or start a trial to view this content.
Protokol
İn vivo prosedür, Michigan Üniversitesi'ndeki Kurumsal Hayvan Bakımı ve Kullanımı Komitesi'nin (IACUC onayı #PRO00010765) onayı altında ve laboratuvar hayvanlarının bakımı ve kullanımına ilişkin Ulusal Sağlık Enstitüleri kılavuzlarına uygun olarak gerçekleştirilmiştir.
1. Elektrot tedariki ve imalatı
NOT: Şekil 1 , ek görsel talimatlar sağlayan bir QR bağlantısıyla birlikte tüm önemli üretim adımlarının üst düzey bir özetini sağlar.
- Biyouyumlu elektrot malzemelerini imalat için doğrudan üreticiden toplu olarak tedarik edin. Tüm elektrot bileşenlerini ve kaynak bulma ile ilgili ayrıntıları içeren Malzeme Tablosuna bakın.
NOT: Olumsuz bir bağışıklık tepkisini önlemek ve kronik implantasyona izin vermek için silikon tabanın, silikon dolgu macununun ve platin-iridyum temas folyolarının biyouyumlu olduğundan emin olun. Şirket içi imalatın ekonomik avantajlarını desteklemek için, özel olarak üretilen epimisyal elektrotun endüstri standardına kıyasla ayrıntılı bir maliyet analizini sunuyoruz (Malzeme Tablosu). - Kesme ve katlama aparatını hazırlayın (Ek Dosya 1, Ek Dosya 2). Aynı epimisyal elektrotların seri üretimi için kesme ve katlama aparatları tasarlamak için seçilen 3D baskı yazılımını kullanın.
- Kesme aparatını, tüm elektrotlar boyunca eşit temas yüzeyi alanı ve elektrotlar arası mesafe için silikon tabanın tutarlı şekilde boyutlandırılmış ve aralıklı deliklerini sağlayacak şekilde tasarlayın.
- Platin-iridyum temas yüzeylerini katlamak ve folyoların silikon tabana yerleştirilmesini basitleştirmek için katlama aparatını oluşturun.
NOT: Gcode dosyaları sağlanır; Kesme ve katlama aparatının boyutlarını ve özelliklerini deneysel ihtiyaçlara uyacak şekilde değiştirin.
- Silikon tabanı delin. Silikon tabanı kesme aparatının üzerine yerleştirin ve bantlayın. Temas folyolarının yerleştirilmesi için bir X-acto bıçak kullanarak kesme aparatındaki kılavuzları kullanarak silikonu delin.
- Temas yüzeylerini oluşturmak için folyoları silikon tabana yerleştirin. Biyouyumlu, önceden kesilmiş platin-iridyum temas folyolarını (1,25 mm x 5 mm) katlama aparatını kullanarak U şeklinde katlayın. Ardından, elektrotun temas yüzeylerini oluşturmak için katlanmış folyoların kollarını silikon tabandaki delikli yuvalara yönlendirin. Bu şekilde, 12 folyonun tümünü silikon tabana yerleştirin; Uygun boşluğu sağlamak için elektrotlar arasında tek bir sütun açık bırakın.
NOT: Bu konfigürasyon, 6 bipolar epimisyal elektrotun üretilmesine izin verecektir; Kesme aparatını düzenlemek, gerekirse kapasiteyi artırabilir. - Silikon tabanı kesme aparatından çıkarın. Folyoları yerinde tutmak için temas yüzeylerinin üzerine bir parça cerrahi bant yerleştirin. Ardından, silikon tabanı kesme aparatından çıkarın, U şeklindeki folyonun kolları açıkta kalacak şekilde ters çevirin ve U şeklindeki folyonun bir kolunu silikon tabanla aynı hizada katlayın.
- Elektrot uçlarını bağlayın. İstenilen uzunlukta keserek perfloroalkoksi (PFA) kaplı paslanmaz çelik tel hazırlayın. Ardından, piyasada bulunan bir çakmak kullanarak paslanmaz çelik telin bir ucunu ~ 1 cm denüle edin. Paslanmaz çelik telin soyulmuş ucunu folyonun katlanmamış kolunun iç kısmına yerleştirin. Paslanmaz çelik teli bir Mikro TIG kaynak makinesi kullanarak folyonun koluna kaynaklayın (darbe genişliği = 0, kaynak enerjisi = 25).
- Kurşun-folyo arayüzünü inceleyin. Paslanmaz çelik tele gerilim uygulayarak tel-folyo bağlantısını test edin. Bağlantı tutarsa, folyonun kolunu silikon tabanla aynı hizada katlayın ve silikon tabakayı çevreleyen bandı çıkarın.
NOT: Belirtilen kullanım durumunda uygulanan gerilimi temsil eden gerilim uygulayın. - Elektrodu kapatın. Daha ince bir kıvam elde etmek için 1 g biyouyumlu sıvı silikonu 0.75 mL toluen ile karıştırın. Karışımı 18 G künt uçlu bir şırınga kullanarak çekin ve elektrotların arkasını kapatmak için her elektrotun kaynaklı tarafına uygulayın.
DİKKAT: Toluen yanıcıdır, yutulduğunda veya solunum yollarına girdiğinde ölümcül olabilir ve cilt tahrişine neden olabilir. Çeker ocak altında çalışın ve açık alevlerden uzak tutun. - Partiyi ayrı elektrotlara ayırın. Elektrodu tutmadan önce silikon-toluenin 72 saat sertleşmesine izin verin. Ardından, silikon tabanı 10 x 5 mm boyutunda ayrı elektrotlar halinde kesmek için makas kullanın.
NOT: Elektrot boyutu, kesme aparatının boyutlarına ve özel kullanım durumuna bağlı olacaktır. Ultrasonik banyoda elektrotları otoklavlayın ve/veya temizleyin.
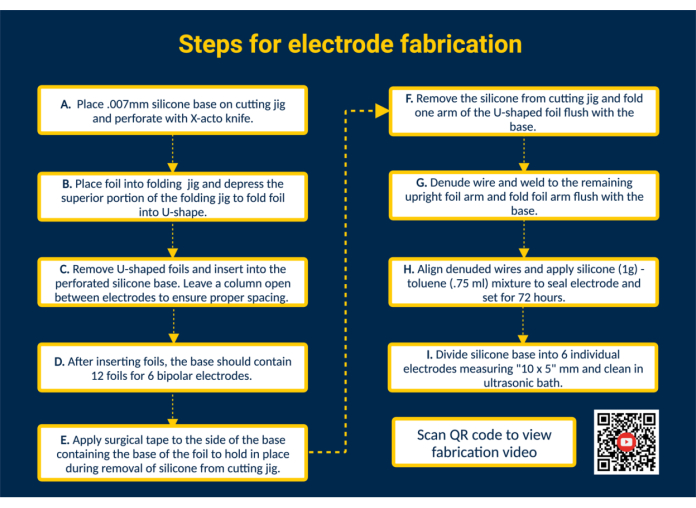
Şekil 1. Elektrot üretimi için adımlar. (A) Delikli silikon taban. (B) Katlama aparatını kullanarak U şeklinde folyolar oluşturun. (C) U şeklindeki folyoları delikli silikon tabana yerleştirin. (D) Silikon taban, 6 bipolar elektrot oluşturmak için 12 folyo içerir. (E) Kesme aparatından çıkarılırken folyoları sabitlemek için tabana cerrahi bant uygulayın. (F) Silikon tabanı kesme aparatından çıkarın. (G) PFA kaplı paslanmaz çelik teli denude edin ve bir Mikro TIG kaynak makinesi kullanarak dik folyo koluna kaynak yapın. (H) Kesilmiş telleri hizalayın, silikon-toluen dolgu macunu uygulayın ve sertleşmesine izin verin. (I) Silikon tabanı ayrı elektrotlara bölün ve ultrasonik bir banyoda temizleyin. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
2. Ex vivo test
- Elektrotları bir kayıt cihazına bağlayın. Her bir elektrot kurşun telini bir elektrot arayüz kartı (EIB) üzerindeki bir kanala sabitleyin. Karşılaştırma için seçilen bir endüstri standardı elektrot için bu adımı tekrarlayın (aynı EIB'yi kullanarak). EIB'yi manyetik bağlı bir kablo sistemi aracılığıyla bir veri toplama platformuna bağlayın.
NOT: Endüstri standardı elektrot, güvenilir olduğu kabul edilen ve deneysel ihtiyaçlara uygun herhangi bir elektrot olabilir. - EIB'yi topraklayın. PFA kaplı paslanmaz çeliğin bir ucunu denude edin ve bir topraklama kaynağına (örn. paslanmaz çelik bir vida) punta kaynağı yapın. Topraklama kablosu kablosunu belirtilen "toprak" konumunda aynı elektrot arayüz kartına sabitleyin.
- Tuzlu su banyosunu ayarlayın. Bir cam kabı (250 mL) 180 mL fizyolojik tuzlu su çözeltisi (% 0.9 steril tuzlu su çözeltisi) ile doldurun4. Özel olarak üretilmiş ve endüstri standardı epimisyal elektrotları tuzlu su banyosuna daldırın ve sabit bir konumda sabitleyin. Ardından, topraklama kaynağını tuzlu su banyosuna daldırın ve konumunu sabitleyin. Son olarak, iki uyarıcı iğne elektrodunu tuzlu su banyosuna batırın ve yapıştırın ve uyarıcı elektrotları sinyal üretecine bağlayın.
- Sinyal anlaşmasını ve zamansal senkronizasyonu değerlendirmek için bir sinyal üreteci kullanın. Seçilen bir voltaj ve frekansta (0.1 V ve 5 Hz) tekrarlanan dalga formlarını uyarıcı elektrotlar aracılığıyla tuzlu su banyosuna iletmek için bir sinyal üreteci kullanın (Şekil 2). Endüstri standardına göre özel olarak üretilmiş epimisyal elektrot arasında kaydedilen sinyalleri karşılaştırmak için çeşitli dalga biçimleri (sinüs, kare ve üçgen) sağlayın.
- Elektrotlar arasındaki sinyallerin ne derece değiştiğini değerlendirmek için performansı gerçek zamanlı olarak gayri resmi ve görsel olarak değerlendirin. Sırasıyla sinyal uyumunu ve zamansal senkronizasyonu değerlendirmek için sınıf içi korelasyonlar (ICC'ler) ve Pearson korelasyonları gerçekleştirin.
NOT: Analizimizin amaçları doğrultusunda, 4.000 Hz'de 8.000 numune alındı ve yüksek ve düşük geçişli bir Butterworth filtresi ile gerçek zamanlı olarak filtrelendi (yüksek geçiş = 75 Hz; düşük geçiş = 2 kHz). - Elektrot empedansını ölçün. Elektrot empedansını ölçmek için, Richie ve diğerleri tarafından aşağıda açıklanan prosedürü kullanarak bir potansiyostat ile 10 Hz-31 kHz5 frekansları üzerinde özel olarak üretilmiş elektrotlar (örn. 10 elektrot) üzerinde EIS toplayın.6. Bipolar elektrotlarda elektrot empedansının ölçülmesi hakkında ek bilgi için Sarolic ve ark.7.
- Richie ve ark.'nın prosedürünü takiben, epimisyal elektrodu 1 mm 1x fosfat tamponlu salin (PBS) içine daldırın. Gümüş-gümüş klorür (Ag|AgCl) referans elektrodu ve devreyi tamamlamak için karşı elektrot olarak paslanmaz çelik bir çubuk.
- Ag'yi Askıya Al|AgCl referans elektrodu ve 1x PBS'deki paslanmaz çelik çubuk, bir beher kelepçesi kullanarak. Referans elektrodu, kullanılan empedans sisteminin referansına bağlayın ve kullanılmakta olan empedans sisteminin karşı elektrot girişine bağlayın.
- 1 kHz empedans taraması yapmak için bir potansiyostat kullanın. Tek sinüs dalga biçiminde 0,01 Vrms'de 1 kHz tarama frekansına ayarlayın. Taramanın ilk 5 saniyesi boyunca, kaydedilen sinyali stabilize etmek için potansiyostatı 0 V'a ayarlayın. Ölçümleri kaydetmek için potansiyostat ile ilişkili yazılımı kullanın.
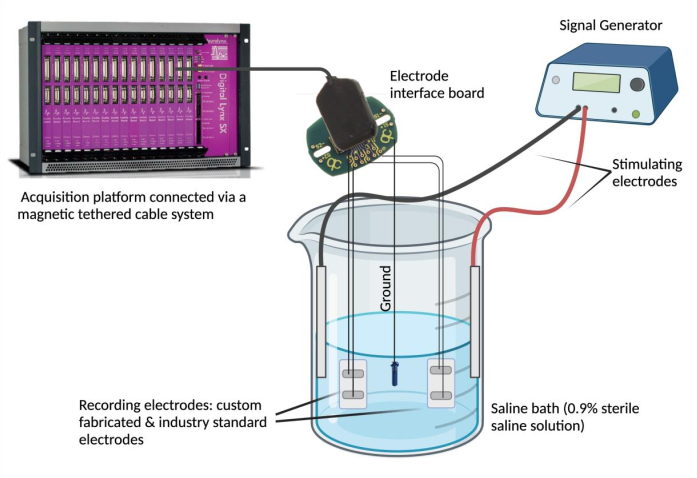
Şekil 2: Ex vivo test: Özel yapım elektrot, endüstri standardı elektrotlar, iki uyarıcı elektrot ve bir toprak kaynağı içeren tuzlu su banyosu. Sinyal uyumu ve zamansal senkronizasyon, sinüs, kare ve üçgen dalgalarının sinyal üretecinden tuzlu su banyosuna iletilmesi ve ilgili elektrotlar tarafından algılanan dalga formlarının bir veri toplama platformu kullanılarak kaydedilmesiyle değerlendirildi. NOT: Elektrokimyasal empedans spektroskopisi resimde gösterilmemiştir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
3. İn vivo test
NOT: İn vivo test prosedürü, deneysel kullanım durumumuzu açıklar. Özel olarak üretilmiş epimisyal elektrotların, kullanıcının amaçlanan deney koşullarına uygun bir şekilde in vivo olarak test edilmesi önerilir.
- Cerrahi bilgileri gözden geçirin; Aşağıdaki kaynakları kullanarak kronik nöral kayıt elektrotlarını implante etme sürecini öğrenen cerrahlar için bilgilere danışın 8,9.
NOT: Makalemizin odak noktasının elektrot üretimi ve testi olduğu göz önüne alındığında, burada laboratuvarımızda in vivo elektrot testi için kullanılan cerrahi tekniklere yalnızca kısa bir genel bakış sunuyoruz. - Aletli hale getirilecek bir sıçan seçin (örneğin, 16 haftalık bir dişi Long Evans sıçanı). Koşu bandı alışmasından önce farenin 1 haftalık bir laboratuvar iklimlendirme sürecinden geçmesini sağlayın. Laboratuvar iklimlendirmesinden sonra, fareyi kademeli olarak 16 m / dk'ya kadar artan hızlarda bir kemirgen koşu bandına maruz bırakın.
- Önce özel olarak üretilmiş bir epimisyal elektrotu EIB'ye bağlayarak ve her bir elektrot ucunu EIB üzerindeki bir kanala sabitleyerek EIB'yi hazırlayın. EIB'yi topraklamak için, PFA kaplı paslanmaz çelik telin bir ucunu denül edin ve seçilen bir topraklamaya (örn. paslanmaz çelik vida) nokta kaynağı yapın. Ardından, topraklama kablosu kablosunu belirtilen "toprak" konumunda aynı EIB'ye sabitleyin.
NOT: Enstrümantasyon sırasında elektrodu korumak için koruyucu bir örtü (örn. parafilm) ile sarın. - Başlamadan önce tüm cerrahi aletleri ve cerrahi alanı dezenfekte edin. Mühürlü, aseptik cerrahi malzemeler kullanın ve steril ambalajda olmayan tüm cerrahi aletleri otoklavlayın. Cerrahi örtü kullanarak steril bir cerrahi alan oluşturun.
- Hayvanı %3-5 izofluran ve 1 L/dk oksijen içeren bir indüksiyon odası kullanarak uyuşturun ve sıçanı hazırlarken %2 izofluran ve 500 mL oksijen içeren bir burun konisi ile muhafaza edin. Cerrahi anestezi düzlemine ulaştıktan sonra, ayak parmağı çimdikleme ile değerlendirildi, göz merhemi sürün, solunum hızını izleyin (70-110 nefes / dak) ve bir rektal prob kullanarak çekirdek sıcaklığını değerlendirin.
- Ardından, ameliyat bölgesini hayvan makası ile tıraş edin ve ameliyat bölgesindeki kalıntıları temizleyin. Cerrahi alan traş edildikten sonra, cerrahi bölgeyi klorheksidin, izopropil alkol ve povidon-iyot kullanarak cerrahi alanın merkezinden dışına doğru ovarak dezenfekte edin. Analjezikleri uygun ve onaylanmış şekilde uygulayın ve çekirdek vücut sıcaklığını (37.5-38.5 ° C) korumak için ısı sağlayın. Hazırlığın ardından, fareyi stereotaktik bir çerçeveye yerleştirin ve steril alanı oluşturun.
- Cerrahın uygun cerrahi hazırlığı için ellerinizi sabun ve/veya dezenfektan (klorheksidin) kullanarak iyice yıkayın. Uygun KKD'yi giyin: maske, steril eldivenler ve tek kullanımlık önlük/ovma üstü. Aseptik tekniğin herhangi bir nedenle ihlal edilmesi durumunda yeni steril eldivenler giyin.
- Sağ VL'yi enstrümantize etmek için, sağ arka ayağın anterolateral kısmında 3-5 cm'lik bir kesi yapmak için bir neşter kullanın ve VL kasını tanımlamak için künt diseksiyon kullanın.
- Koronal sütür boyunca 1 cm'lik bir sagital düzlem kesisi yapın ve kafatasını ortaya çıkarın. İnce bir çift forseps kullanarak, sağ arka bacaktan kafatasının tabanına kadar bir deri altı tüneli açın. Elektrodu almak ve elektrodu VL'ye yönlendirmek için forsepsleri kullanın.
- Calvaria'da bir delik oluşturmak için bir kemik matkabı kullanın (matkap özelliklerinin topraklama vidasınınkilerle eşleştiğinden emin olun). Topraklama vidasını sabitleyin ve EIB'yi diş çimentosu kullanarak kafatasına takın.
NOT: Kafatasının gözenekliliğini artırmak ve diş çimentosunun yapışmasını artırmak için az miktarda hidrojen peroksit uygulanabilir. - VL kasını tanımladıktan sonra, 4-0 emilemeyen monofilament kullanılarak kas lifleri doğrultusunda implante edilen özel yapım epimisyal elektrodu implante edin. Yara klipsleri kullanarak veya dikiş atarak kesiyi kapatın.
- Kapattıktan sonra, hayvanı anesteziden çıkarın ve temiz, kuru bir hayvan kafesinde tek tek barındırın. Sıçanın ısıtılmış bir ped üzerinde iyileşmesine izin verin ve hayvan yürüyene kadar her 15 dakikada bir sıçanın sıcaklığını ve solunum hızını izleyin. Enstrümantasyonu takip eden günlerde onaylanmış bir analjezik uygulayarak ameliyat sonrası ağrıyı tedavi edin.
NOT: Sıçanın tamamen iyileşene kadar ayrı ayrı barındırılması gerekir. - 14 günlük bir süreden sonra, kas aktivitesindeki fizyolojik değişiklikleri yakalamak için özel olarak üretilmiş epimisyal elektrotun geçerliliğini değerlendirmek için in vivo elektrot testi yapın. Aletli sıçanı bir kemirgen koşu bandına yerleştirin ve rastgele VL EMG sinyalinde bir artış veya azalma (16 ° eğim, 16 metre / dakikada 16 ° düşüş) ortaya çıkaran yokuş yukarı ve yokuş aşağı yürüme koşullarına maruz bırakın. Zaman içinde güvenilirliği sağlamak için boylamsal veriler (ör. ölçümlemeden 14 gün ve 56 gün sonra) toplayın.
NOT: 14 ve 56 günlük değerlendirmeler, 14 günlük bir süre tam cerrahi iyileşmeye izin verdiği ve 56 günlük süre deneysel zaman çizelgemizi aştığı için seçilmiştir. Başkalarını, kullanmadan önce deneysel zaman çizelgelerini kopyalayan bir zaman çerçevesi kullanarak elektrot performansını ve güvenilirliğini test etmeye teşvik ediyoruz. Hız (16m / dak) ve yürüme koşulları (16 ° eğim, 16 ° düşüş), bu modelde10 artan ve azalan VL uyarımının yerleşik koşullarına uyacak şekilde seçilmiştir. - Alım parametrelerini deneysel ihtiyaçlara uyacak şekilde değiştirin. Veri toplama platformunu kullanarak 2.000 Hz hızında yürüme sırasında EMG sinyalini yakalayın ve bir hareket yakalama sistemi ile senkronize edin.
NOT: Farklı bir toplama cihazı kullanıyorsanız, üreticinin talimatlarına göre ve deneysel ihtiyaçları karşılamak için EMG ve hareket yakalama toplayın. - Her yürüme koşulundan 25 sn yürüyüş verisi ayıklayın ve daha fazla sinyal işleme ve analiz için özelleştirilmiş bir Python komut dosyasına aktarın. Taban çizgisi ayarı (sıfır), düzeltin ve 50 ms bölme genişliğine sahip bir kök ortalama kare algoritması kullanarak düzgünleştirin. Sonraki veri analizlerinde kullanmak üzere RMS-EMG tepe noktalarını seçmek için bir tepe algılama algoritması uygulayın.
NOT: EMG verilerini önceden işlemek ve analiz etmek için yöntemleri kısaca açıkladık, çünkü bu adım programlama dilleri ve EMG edinme yazılımı ve donanımı nedeniyle büyük ölçüde değişir. Yazarları ek bilgi için aşağıdaki kaynaklara başvurmaya teşvik ediyoruz 3,11,12,13.
4. Biyouyumluluk testi
- Uzunlamasına EMG koleksiyonlarının sona ermesinin ardından (veya seçilen bir zaman noktasında), uygun ve onaylanmış yöntemler kullanarak sıçanı ötenazi yapın (ör., CO2 kullanarak boğulma ve ardından bilateral torakotomi).
- Ötenaziyi takiben, anterolateral sağ ve sol arka ayaklarda bir kesi oluşturarak bilateral VL kaslarını çıkarın. Sıvı nitrojen içinde hızlı dondurma ve -80 °C'de saklayın.
NOT: Ekstraksiyon sırasında elektrodu aletli kas (örn. sağ VL) üzerindeki konumunda tutmaya dikkat edin. Alternatif olarak, alt elektrot bölgesini işaretleyin veya alt elektrot bölgesinden sadece kası çıkarın. Bu kontralateral/kontrol kası için geçerli değildir. - Elektrot-fasyal arayüzün hemen altındaki bölgeden seri kas kesitlerini (7 μm) kesmek için bir kriyostat kullanın. Kontrol görevi görmek için kontralateral VL'nin kas karnından bölümler kesin. Kriyoseksiyon14 ile ilgili ayrıntılar için Kumar ve ark.'ya bakın.
- Hematoksilen ve Eozin (H & E) ile leke; iskelet kası kesitleri15 üzerindeki H&E boyaması ile ilgili ayrıntılar için Wang ve ark.'ya bakınız.
- 20x büyütmede bir ışık mikroskobu kullanarak lekeli bölümleri (aletli ve kontrol) inceleyin. Örneklerin kökenine kör olan histolojik değişiklikleri analiz edin. Aşağıdaki patolojik özellikler kullanılarak değerlendirilen doku sağlığını değerlendirin: bağışıklık hücresi infiltrasyonu, iç myonuclear birikimi, fibrogenez ve sarkolemma parçalanması.
5. Önerilen istatistiksel analizler
- Özel olarak üretilmiş epimiysal elektrotun performansını endüstri standardına kıyasla değerlendirmek için, ex vivo verileri seçilen bir istatistiksel pakete aktarın. Özel olarak üretilmiş ve endüstri standardı elektrotlardan toplanan ex vivo verilere aşağıdaki istatistiksel testleri uygulayın (örneğin, sinüs, üçgen ve kare dalga biçimlerinden 8.000 temsili numune). Alfa seviyesini a priori olarak p ≤ 0.05 olarak ayarlayın.
- Elektrotlar arasındaki sinyal uyum seviyesini test etmek için, sınıf içi korelasyonları (ICC'ler) ve Bland-Altman grafiklerini kullanın. ICC tahminlerini ve %95 güven aralıklarını, tek dereceli (k = 2), mutlak anlaşmalı, 2 yönlü rastgele etkiler modeline dayalı olarak hesaplayın.
- Zamansal senkronizasyon olarak da bilinen, dalga formlarının kaydının zaman içinde ne derece birlikte değiştiğini test etmek için, özel olarak üretilmiş ve endüstri standardı elektrotlarla toplanan değerler üzerinde Pearson korelasyonu gerçekleştirin.
- Seçilen özel yapım elektrotlardan (örn. 1 elektrot) her iki temas yüzeyi için (1 kHz'de ölçülen) ortalama elektrot empedansını endüstri standardı elektrotun empedansıyla karşılaştırın.
NOT: Elektrot empedans değerleri, kullanım durumuna ve elektrot üretimi sırasında kullanılan malzemelere göre farklılık gösterecektir.
- İn vivo kayıtların kalitesini değerlendirmek için, koşu bandında yürüyüş sırasında toplanan verileri seçilen bir istatistiksel pakete aktarın.
- İn vivo test sırasında özel olarak üretilen elektrotun geçerliliğini değerlendirmek için (sıçanın yürüyüşü, kas aktivitesinde fizyolojik değişikliklere neden olmak için yokuş yukarı ve yokuş aşağı yürüme yoluyla bozuldu), yokuş yukarı ve yokuş aşağı yürüme koşulları için ortalama tepe değerlerini karşılaştırmak için Welch'in t-testini gerçekleştirin.
NOT: Okuyucuların, burada kısaca sunulmayan ek testler ve analizler yapmaları teşvik edilir (örneğin, sinyal-gürültü oranı (SNR) değerlendirmeleri; EMG Sinyal Ediniminde Delysys Temel Kavramlar'a bakınız16. - Elektrotun sinyalizasyonunun zaman içindeki güvenilirliğini değerlendirmek için, eşleştirilmiş t-testleri yoluyla tutarlı koşullar (implantasyondan sonra 14 ve 56 günlük aralıklarla 16 m/dk'da düz yürüyüş) sırasında toplanan uzunlamasına verileri değerlendirin.
- İn vivo test sırasında özel olarak üretilen elektrotun geçerliliğini değerlendirmek için (sıçanın yürüyüşü, kas aktivitesinde fizyolojik değişikliklere neden olmak için yokuş yukarı ve yokuş aşağı yürüme yoluyla bozuldu), yokuş yukarı ve yokuş aşağı yürüme koşulları için ortalama tepe değerlerini karşılaştırmak için Welch'in t-testini gerçekleştirin.
Access restricted. Please log in or start a trial to view this content.
Sonuçlar
Ex vivo performans
ICC'ler, tüm dalga formlarında özel olarak üretilmiş ve endüstri standardı elektrotlar arasında yüksek düzeyde uyum olduğunu ortaya koydu (sinüs [ICC = 0.993], kare [ICC = 0.995], üçgen [ICC = 0.958]; p < .001). Bland-Altman grafikleri ayrıca elektrotlar arasında yüksek derecede bir sinyal uyumu olduğunu ortaya çıkardı. Bland Altman grafikleri ve Pearson korelasyonları, özel olarak üretilmiş ve endüstri standardı ...
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
Amacımız, EMG üretim sürecini kolaylaştırmak, epimisyal elektrot tasarımlarının daha geniş çapta benimsenmesini ve uygulanmasını sağlamak, böylece erişilebilirliği teşvik etmek ve nöromüsküler araştırmaları ilerletmekti. Bu amaçla, düşük maliyetli epimisyal elektrotları şirket içinde tedarik etmek, üretmek ve test etmek için kullanıcı dostu bir kılavuz sunuyoruz. Diğer araştırma gruplarını destekleme umuduyla, araştırma çabaları için kurum i?...
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
Yazarlar, bu yazıda rapor edilen çalışmayı etkilemiş gibi görünebilecek bilinen hiçbir rakip mali çıkarları veya kişisel ilişkileri olmadığını beyan ederler.
Teşekkürler
Bu çalışma Ulusal Artrit ve Kas-İskelet ve Deri Hastalıkları Enstitüsü Grant R01AR081235 tarafından desteklenmiştir (L. K. Lepley'e). Yazarlar, biyouyumlu elektrotumuzun üretilmesine ve test edilmesine katkılarından dolayı aşağıdaki kişilere teşekkür eder: Joel Pingel, Grant Gueller, Akhil Ramesh, Joe Letner, Jacky Tian ve Ross Brancati.
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Electrode Materials | |||
| Quantity & price per electrode | |||
| Contact surface | Prince and Izant PT90/IR10 1.25 mm x 5 mm foil | Catalog #1040055 | 2 per electrode $7.50 per foil $15.00 per electrode |
| PFA coated stainless-steel electrode lead wire | A-M Systems Multi-Stranded PFA-Coated Stainless Steel Wire 50.8 µm strand diameter | Catalog #793500 | Dependent on desired lead length (e.g., 9 inch lead wires x2) $128 per 25 ft spool $5.12 per foot $0.42 per inch (x18) $7.68 per electrode |
| Folding jig | 3D printed (see .gcode file) | NA | NA |
| Sealant for electrode body | Nusil Med-1137 liquid silicone | Catalog #MED-1137 | 1 gram $344.66 per 2 oz. (59.15 mL) $5.83 per electrode |
| Silicone base | Implantech Alliedsil Silicone Sheeting-Reinforced, Long Term Implantable (8” x 6”) .007 thick | Catalog #701-07 | 10mm x 5mm sheet $225.00 per 8 x 6 inch $0.36 per electrode (10 mm x 5 mm) |
| Thinner for sealant mixture | Toluene 99.5% ACS Reagent 500mL or Xylene ACS 99.5% | Catalog #179418-500 ML | 0.75 mL $25.53 per 500 mL $0.38 per electrode |
| Template for perforating silicone base | Cutting jig – 3D printed (see CAD file) | NA | NA |
| Custom-fabricated electrode: $29.25 | |||
| Industry standard electrode (EP105 EMG Patch Electrode, 2 contacts, single-sided, 7mm x 4mm, MicroProbe for Life Science): $305.00 | |||
| Additional Fabrication Materials | |||
| Quantity & price per electrode | |||
| 3D printing software | Solidworks (Solidworks, 2022) | ||
| Micro-Tig welder | Micro-Tig Welder (CD1000SPM, Single Pulse Research and Light Production Resistance Spot Welder, Sunstone) | SKU 301010 | $3,500 |
| Ultrasonic bath | Ultrasonic bath (CPX Series Ultrasonic Bath, Fisherbrand). | 15-337-403 | NA |
| Ex Vivo Testing Materials | |||
| Quantity & price per electrode | |||
| Data acquisition platform and software | DigitalLynx 4sX Base Cheetah version 6.0 (Neuralynx Inc.) | NA | EMG acquisition hardware and software |
| Electrode interface board (EIB) | EIB, EIB16-QC, Neuralynx Inc. | 31-0603-0007 | NA |
| Signal generator | 5 MHz Function Generator, B&K Precision | 4005DDS220V | $387.46 |
| Potentiostat | PGSTAT1 potentiostat (EcoChemie, Utrecht, Netherlands) | NA | NA |
| Stainless steel screw | Fine Science Tools | 19010-00 | $98 |
| Ex Vivo Testing Materials | |||
| Quantity & price per electrode | |||
| Rodent treadmill | Exer 3/6 Open Treadmill, Columbus Instruments | NA | NA |
| Dental cement | Excel Formula® Pourable Dental Material, St. George Technology Inc. | #24211 | $125.60 |
| Light microscope | Keyence BZ-X800, Keyence Corporation, Osaka, Japan | NA | NA |
| Motion capture system | Optitrack Color Camera, Optitrack, NaturalPoint Inc. | NA | NA |
| Peak detection algorithm | “SciPy.signal.find_peaks - SciPy v1.8.1 Manual”, 2022 | NA | NA |
| Python software | Python Software Foundation. Python Language Reference, version 3.9. Available at http://www.python.org | NA | NA |
| Rat | HsdBlu: LE, Envigo | 140 | NA |
| Statistical sotware | GraphPad Prism version 10.0.0 (GraphPad Software, Boston, Massachusetts USA) | NA | NA |
Referanslar
- Grandjean, P. A., Mortimer, J. T. Recruitment properties of monopolar and bipolar epimysial electrodes. Ann. Biomed. Eng. 14 (1), 53-66 (1986).
- Memberg, W. D., Stage, T. G., Kirsch, R. F. A fully implanted intramuscular bipolar myoelectric signal recording electrode. Neuromodulation J. Int. Neuromodulation Soc. 17 (8), discussion 799 794-799 (2014).
- Loeb, G. E., Gans, C. Electromyography for Experimentalists. , University of Chicago Press. Chicago, IL. (1986).
- Boehler, C., Carli, S., Fadiga, L., Stieglitz, T., Asplund, M. Tutorial: guidelines for standardized performance tests for electrodes intended for neural interfaces and bioelectronics. Nat. Protoc. 15 (11), 3557-3578 (2020).
- Patel, P. R., et al. Insertion of linear 8.4 µm diameter 16 channel carbon fiber electrode arrays for single unit recordings. J. Neural Eng. 12 (4), 046009(2015).
- Richie, J. M., et al. Open-source toolkit: benchtop carbon fiber microelectrode array for nerve recording. J. Vis. Exp. (176), e63099(2021).
- Impedance measurement of bipolar stimulation electrodes immersed in medium. Sarolic, A., Skalic, I., Deftu, A., Sapunar, D. 2018 EMF-Med 1st World Conf. Biomed. Appl. Electromagn. Fields EMF-Med, , 1-2 (2018).
- Pritchett-Corning, K. R., Mulder, G. B., Luo, Y., White, W. J. Principles of rodent surgery for the New Surgeon. J. Vis. Exp.: JoVE. (47), e2586(2011).
- Zealear, D., Li, Y., Huang, S. An implantable system for chronic in vivo electromyography. J. Vis. Exp. JoVE. (158), e60345(2020).
- Butterfield, T. A., Leonard, T. R., Herzog, W. Differential serial sarcomere number adaptations in knee extensor muscles of rats is contraction type dependent. J. Appl. Physiol. Bethesda Md 1985. 99 (4), 1352-1358 (2005).
- Farago, E., MacIsaac, D., Suk, M., Chan, A. D. C. A review of techniques for surface electromyography signal quality analysis. IEEE Rev. Biomed. Eng. 16, 472-486 (2023).
- Raez, M. B. I., Hussain, M. S., Mohd-Yasin, F. Techniques of EMG signal analysis: detection, processing, classification and applications. Biol. Proced. Online. 8, 11-35 (2006).
- Tankisi, H., et al. Standards of instrumentation of EMG. Clin. Neurophysiol. 131 (1), 243-258 (2020).
- Kumar, A., Accorsi, A., Younghwa, R., Mahasweta, G. Do's and don'ts in the preparation of muscle cryosections for histological analysis. J. Vis. Exp. JoVE. (99), e52793(2015).
- Wang, C., Yue, F., Kuang, S. Muscle histology characterization using H&E staining and muscle fiber type classification using immunofluorescence staining. Bio-Protoc. 7 (10), e2279(2017).
- Kreifeldt, J. G. Signal versus noise characteristics of filtered EMG used as a control source. IEEE Trans. Biomed. Eng. BME-18 (1), 16-22 (1971).
- Farina, D., Yoshida, K., Stieglitz, T., Koch, K. P. Multichannel thin-film electrode for intramuscular electromyographic recordings. J. Appl. Physiol. 104 (3), 821-827 (2008).
- Muceli, S., et al. Decoding motor neuron activity from epimysial thin-film electrode recordings following targeted muscle reinnervation. J. Neural Eng. 16 (1), 016010(2018).
- Guo, L., Guvanasen, G., Tuthill, C., Nichols, T., Deweerth, S. Characterization of a Stretchable Multielectrode Array for Epimysial Recording. , 694(2011).
- Zwarts, M. J., Stegeman, D. F. Multichannel surface EMG: basic aspects and clinical utility. Muscle Nerve. 28 (1), 1-17 (2003).
- Fabrication and test of robust spherical epimysial electrodes for lower limb stimulation. Aalb. Den. Koch, K. P., Leinenbach, C., Stieglitz, T. IFESS 5th Conf, , (2000).
- Uhlir, J. P., Triolo, R. J., Davis, J. A., Bieri, C. Performance of epimysial stimulating electrodes in the lower extremities of individuals with spinal cord injury. IEEE Trans. Neural Syst. Rehabil. Eng. 12 (2), 279-287 (2004).
- Deer, T. R., et al. The appropriate use of neurostimulation: new and evolving neurostimulation therapies and applicable treatment for chronic pain and selected disease states. Neuromodulation Technol. Neural Interface. 17 (6), 599-615 (2014).
- Ortiz-Catalan, M., Brånemark, R., Håkansson, B., Delbeke, J. On the viability of implantable electrodes for the natural control of artificial limbs: Review and discussion. Biomed. Eng. OnLine. 11, 33(2012).
- Sando, I. C., et al. Regenerative peripheral nerve interface for prostheses control: electrode comparison. J. Reconstr. Microsurg. 32 (3), 194-199 (2016).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır