Method Article
RGD İşlevselleştirilmiş Avidin-Biotin Bağları Kullanarak Trombosit Migrasyonunu İncelemek İçin Bir İn Vitro Test
Bu Makalede
Özet
Ayarlanabilir yoğunluğa sahip RGD ile işlevselleştirilmiş avidin-biyotin bağları kullanılarak tek göç eden trombositlerin görüntülenmesi için ayrıntılı bir protokol sağlanır ve trombositlerin avidin-biyotin bağını koparmak için yeterli kuvvet ürettiğini ortaya çıkarır.
Özet
Anükleasyonlu hücre parçaları olmalarına rağmen, trombositler artık çok yönlü yetenekleri ile yaygın olarak tanınmaktadır. Yaralanma sonrası kanamayı önlemek için sadece kan pıhtıları oluşturmakla kalmaz, aynı zamanda enfeksiyonlarla savaşırlar ve enflamatuar hastalıklar sırasında damar bütünlüğünü korurlar. Hemostatik tıkaçlar, trombositlerin toplu aktivasyonunu ve agregasyonunu gerektirirken, iltihaplı kan damarlarını korumadaki rolleri tek hücre düzeyinde gerçekleştirilir. Bu bağlamda, son veriler trombositlerin yapışkan ortamlarının mekanizasyonuna bağlı bir süreç olan otonom olarak göç edebildiğini göstermiştir. Burada, trombosit integrin bağlama motifi olarak bir poli-L-lizin greft poli (etilen glikol) (PLL-PEG) -biyotin omurgası (1), bir floresan avidin bağlayıcı (2) ve trombosit integrin bağlama motifi olarak biyotin-siklik Arg-Gly-Asp (cRGD) (3) içeren üç katmanlı bir kaplama sistemi kullanılarak tek trombosit migrasyonunun görüntülenmesi için ayrıntılı bir protokol sunulmaktadır. Bu indirgemeci yaklaşım, substrat yapışma özelliklerinin hassas kontrolüne izin verir ve trombosit göçünün altında yatan mekanizmaları incelemek için basit, standartlaştırılmış bir in vitro test görevi görür. Sonuçlar, cRGD'ye bağlanan göç eden trombositlerin avidin-biyotin bağını bozabilecek kuvvetler uyguladığını göstermektedir. Ayrıca, biotin-cRGD yoğunluğu hem trombosit yayılımını hem de göçünü önemli ölçüde etkiler.
Giriş
Trombositler, kemik iliğindeki megakaryositlerden türetilen küçük anükleasyonlu hücre parçalarıdır. Aktive edilmiş trombositler, fizyolojik hemostazda vasküler lezyonları kapatmak veya patolojik trombozdahastalıklı kan damarlarını tıkamak için bir kan pıhtısının temelini oluşturan agregalar halinde toplanır 1. Bununla birlikte, son yıllarda, trombositlerin, bağışıklık hücreleri, kanser hücreleri ve istilacı patojenlerle çok yönlü etkileşimlerin konakçı bağışıklık tepkisini şekillendirmek için kritik olduğu inflamasyon, enfeksiyon ve malignite patofizyolojisinde de merkezi bir rol oynadığı ortaya çıkmıştır 2,3. Son veriler, trombositlerin otonom olarak göç etme yeteneğine sahip olduğunu göstermiştir4. Sistemik bakteriyemiye yanıt olarak, trombositler karaciğer sinüzoidlerine alınır ve burada yapışır ve göç ederler. Migrasyon, trombositlerin bakterileri yakalamasına ve bağlamasına izin verir, bu da lökosit aktivasyonunu destekler. Özellikle, trombositler bu işlem sırasında intravasküler kalır ve subendotel dokusunagöç etmez 4. Ek olarak, trombositler vasküler inflamasyonun nöbetçileridir, iltihaplı kan damarlarını ekstravaze bağışıklık hücrelerinin neden olduğu mikro yaralanmalar için tarar5 ve iltihaplı kan damarlarını korumak için migrasyon kullanır 6,7. Burada trombositler, iltihaplı endotel üzerinde biriken fibrinojeni bağlamak için integrinlerini kullanır. Trombositler daha sonra çevrelerinin yapışkan özelliklerini taramalarına izin veren lamellipodial çıkıntılar oluşturur. Trombositler daha sonra polarize olur ve haptotaksi olarak bilinen bir süreç olan daha yüksek fibrinojen yoğunluklarına doğru göç eder. Yönlendirilmiş trombosit göçü, sonuçta kas ve akciğer dahil olmak üzere iltihaplı dokularda kanamayı önleyen endotelyal mikrolezyonlarda konumlandırmayı destekler.
Trombosit göçü kritik olarak yapışkan substratın 4,8 mekanik özelliklerine bağlıdır. Çevrenin mekanik özelliklerini algılama ve dönüştürme görevine, esas olarak, hücre dışı matris üzerindeki ligand'a hücre dışı alan bağlanması ve adaptör proteinler aracılığıyla aktin hücre iskeletine hücre içi alan bağlanması ile α- ve β-alt birimden oluşan transmembran heterodimerik proteinler olan integrin reseptörleri aracılık eder 9,10. En bol bulunan trombosit integrini αIIbβ3'tür ve ana ligandı fibrin (ojen)11'dir. İntegrin-ligand bağlantısı, yapışık bir trombositin7 ön kenarını oluşturan bir Arp2/3 tahrikli lamellipodyumun oluşumuyla sonuçlanan sinyal olaylarını tetikler. Yapışık trombositler, yapışkan ortamlarının mekanik özelliklerini üzerine çekerek anında araştırırlar4. Miyozin IIa'ya bağlı çekme kuvvetleri, hücre dışı matrisin (örneğin, fibrin (ogen)) mekanik stabilitesinin üstesinden geldiğinde, trombositler zayıflamış ligandları mekanik olarak yırtır ve lamellipodial çıkıntılarını yapışkan ligandlar için mikro ortamı taramak, yeni substrat bağları oluşturmak ve ligandın tükenmiş ortamdan uzaklaşmak için kullanırlar6. Proteolitik olmayan, mekanik ligand tükenmesinin neden olduğu hücre göçünün, yapışkan matrislerini8 mekanik olarak yeniden şekillendirebilen hücrelerde gözlemlenen genel bir fenomen gibi göründüğü için trombosit fonksiyonunun ötesinde bir rol oynaması muhtemeldir. Ligand tükenme hızı, göç hızını belirler ve substratın8 hem ligand stabilitesine hem de ligand yoğunluğuna bağlıdır. Düşük ligand yoğunluğundaki trombositler, yaklaşık 160 pikonewton (pN) bağlanma kuvvetine sahip biyotin-avidin bağları ile cam lamellere bağlı mühendislik integrin ligandlarını (döngüsel Arg-Gly-Asp (cRGD))6,7 mekanik olarak bozabilir12,13,14,15.
Burada, bu gözlemler, trombosit göç mekanizmalarının incelenmesini kolaylaştıran, ligand-kararsız yapışkan yüzeyler oluşturmak için basit bir in vitro protokol geliştirmek için kullanılmaktadır. Bu protokolde özetlenen yapışkan kaplama üç temel unsurdan oluşur: (1) bir PLL-PEG-biyotin omurgası ve (2) (3) biyotin-cRGD'nin (bir yapışkan ligand) PLL-PEG-biyotin omurgasına bağlanmasını kolaylaştıran bir nötravidin-floresein izotiyosiyanat (NA-FITC) bağlayıcısı (ayrıca bkz. Şekil 1B). Bu yapının stabilitesi, (A) PLL-PEG-biotin-NA-FITC veya (B) FITC-NA-biotin-cRGD arayüzünde kırılabilen biotin-avidin bağının gücüne bağlıdır. Ek olarak, yapışkan ligandların yoğunluğu, alt tabakadaki PLL-PEG-biyotin oranının PLL-PEG'ye uyarlanmasıyla ayarlanabilir. Bağın (A) bozulması, FITC'nin kaplamadan salınmasına neden olur ve bu da göç eden trombositlerin altındaki floresan sinyalinde bir azalmaya yol açar. Bu nedenle, bu protokolde açıklanan kaplama birlikte, mekanik ve yapışkan substrat özelliklerinin hassas bir şekilde ayarlanabilirliğine izin verir ve trombosit göçünün floresan bazlı kolay bir okumasını sağlar.
Protokol
Bu çalışmada yapılan hayvan deneyleri, fareleri içeren çalışmalar için ilgili tüm etik düzenlemelere uygun olarak gerçekleştirilmiş ve hayvanların korunmasına ilişkin yerel mevzuat tarafından onaylanmıştır (Regierung von Oberbayern, Münih, 190-15, 2015). Bu çalışmada 8-10 haftalık (vücut ağırlığı 20-25 g) dişi ve erkek C57BL / 6 fareleri kullanıldı. Kullanılan reaktiflerin ve ekipmanın ayrıntıları Malzeme Tablosunda listelenmiştir.
1. Biyotin-nötravidin-biotin cRGD kaplama
- 1 dakika boyunca% 20 HNO3 içinde cam lameller (24 mm x 24 mm; # 1.5) sonikate, ardından 1 dakika boyunca izopropanol, etanol ve H2O içinde sonikasyon yapılır. Her sonikasyondan sonra, lamelleri damıtılmış suda (ddH2O) yoğun bir şekilde durulayın ve son olarak inkübatörde kurutun.
- Önceden temizlenmiş lamelleri O2 plazma ile bir plazma temizleyicide 2 dakika işlemden geçirin ve ardından daha önce açıklandığı gibi yapışkan slaytlarlabirleştirin 16. Yapışkan slaytlar ve cam lameller aralarında bir kanal oluşturacaktır ( Şekil 1A'da gösterildiği gibi).
NOT: Etkili plazma tedavisi önemlidir. Plazma kaynağı olarak O2 kullanın. - Kanalı 97.5 μL PLL-PEG (1 mg / mL) içinde seyreltilmiş 2.5 μL PLL-PEG-biotin (1 mg / mL) ile doldurun ve oda sıcaklığında (RT) 30 dakika inkübe edin, ardından PBS ile üç kez yıkayın. PLL-PEG-biotin, bir sonraki adımda nötravidini bağlarken, PLL-PEG omurgası, proteinlerin ve trombositlerin spesifik olmayan bağlanmasını önleyen inert bir substrat oluşturur.
NOT: Kaplama çözeltilerindeki PLL-PEG-biotin konsantrasyonu, cRGD ligandlarının nihai yoğunluğunu tanımlar. - 100 μL Neutravidin-FITC (25 μg/mL) ekleyin ve RT'de karanlıkta 30 dakika inkübe edin, ardından PBS ile üç kez yıkayın.
NOT: Nötravidin-FITC konsantrasyonunu PLL-PEG-biyotin konsantrasyonuna ayarlayın. Daha yüksek PLL-PEG-biyotin yoğunlukları kaplanırsa Nötravidin-FITC konsantrasyonunu arttırın. - 100 μL siklo [Arg-Gly-Asp-D-Phe-Lys (Biotin-PEG-PEG)] (cRGD-biotin) (0.1-1 μM] ekleyin, RT'de 30 dakika inkübe edin ve PBS ile üç kez yıkayın. Lameller kullanıma hazırdır. Kaplamanın bir şeması Şekil 1B'de gösterilmiştir.
2. Kandan fare trombositleri izolasyonu
- 136.9 mM NaCl, 12.1 mM NaHCO3, 2.6 mM KCl, 5.5 mM glikoz, 10 mM HEPES içeren modifiye Tyrode tamponunu hazırlayın ve pH'ı 7.4 ve 6.5'e ayarlayın.
- 0.5 mg / kg fentanil, 5 mg / kg midazolam ve 0.05 mg / kg medetomidin intraperitoneal enjeksiyonu ile fareleri (kurumsal olarak onaylanmış protokolleri izleyerek) anestezikleştirin. Anestezi derinliğini ayak parmağı kıstırma ile doğruladıktan sonra göğüs derisini makasla çıkarın.
- Antikoagülan olarak 150 μL Asit-Sitrat-Dekstroz (ACD) içeren 2 mL'lik bir şırınga (26 G iğne) hazırlayın. Kalpten kan almak için iğneyi sternumun sol tarafındaki ikinci ve üçüncü kaburgalar arasına sokun. Daha sonra, fareyi servikal çıkık ile ötenazi yapın.
NOT: (1) ACD tampon bileşimi: 111 mM glikoz içinde 85 mM Sodyum sitrat tribazik dehidrat ve 65 mM sitrik asit monohidrat. (2) Herhangi bir pıhtı oluşumunu önlemek için kan alımı sorunsuz bir şekilde yapılmalıdır. 8-10 haftalık farelerden yaklaşık 1 mL kan elde edilebilir. - Kanı 5 mL FACS (polistiren yuvarlak tabanlı) tüpte 1 mL Tyrode tamponu (pH 6.5) ile karıştırın ve fren kapalıyken RT'de 20 dakika boyunca 70 x g'da santrifüjleyin.
- Santrifüjlemeden sonra, trombositten zengin plazma (PRP) içeren üst kısmı (yaklaşık 1 mL) alın. Trombosit aktivasyonunu önlemek için 3 mL Tyrode tamponu (pH 6.5) ile karıştırın ve 100 ng / mL prostasiklin (PGI2) ekleyin.
- RT'de 5 dakika boyunca 1200 x g'da santrifüjleyin, süpernatanı atın, peleti 500 μL Tyrode tamponunda (pH 6.5) yeniden süspanse edin ve bir hemositometre kullanarak trombosit sayılarını ölçün.
3. Biotin-nötravidin-biotin cRGD kaplamada fare trombosit göçü
- Modifiye edilmiş Tyrode tamponunu (pH 7.4) 10 x 103 / μL fare trombositleri, 1 mM CaCl2, 2 μM U46619 ve 4 μM Adenozin 5'-difosfat sodyum tuzu (ADP) ile destekleyin ve toplam 240 μL'lik bir hacim pipetleyin adım 1'de hazırlanan kanallara.
- Bir sahne inkübatörü ile donatılmış ters çevrilmiş bir mikroskop kullanarak canlı trombosit göçünü kaydedin. Alternatif olarak, kanalı bir inkübatörde 37 ° C'de 1 saat inkübe edin.
- Numuneyi RT'de 10 dakika boyunca% 4 paraformaldehit ile sabitleyin ve PBS ile beş kez yıkayın.
- Trombositleri Triton-X (PBS'de% 0.2) ile 5 dakika boyunca geçirgen hale getirin ve PBS ile beş kez yıkayın.
- 2,5 μL Alexa Fluor 594 falloidini (40x metanolik stok) 100 μL PBS içinde seyreltin. Karanlıkta 30 dakika boyunca trombositlerle inkübe edin, ardından PBS ile beş kez yıkayın.
- Slaytları bir floresan mikroskobu altında görüntüleyin.
4. Nicelik belirleme
NOT: Filopodia (parmak benzeri çıkıntılar) veya lamellipodia (yaprak benzeri çıkıntılar) oluşturan trombositler, yapışık trombositler4 olarak sayılmıştır. Çapının birden fazla göç mesafesine sahip trombositler, göç eden trombositler olarak tanımlandı.
- Göç eden trombositlerin fraksiyonu: Fiji'deki Çok Nokta aracıyla trombosit yapışma veya migrasyon sayılarını sayın. Çok noktalı aracı seçmek için araç çubuğundaki Nokta Aracı açılır menüsüne sağ tıklayın. Göç eden trombositlerin sayısını yapışkan trombositlerin sayısına bölerek göç eden trombositlerin fraksiyonunu hesaplayın.
- Ortalama migrasyon mesafesi: Serbest El Hattı Aracını kullanarak nötravidin-FITC kaplamada "basılmış" migrasyon yolunun uzunluğunu ölçerek sabit numunelerden migrasyon mesafesini çıkarın. Serbest El Çizgisi aracını seçmek için araç çubuğundaki Düz Çizgi açılır menüsüne sağ tıklayın.
- Trombosit şekli tanımlayıcıları: Eşik işlevini kullanarak floresan trombositleri (Alexa594-Phalloidin) bölümlere ayırarak ikili maskeler oluşturun. Araç çubuğunda Image > Adjust > Threshold (Eşiği Ayarla ) öğesini seçin.
- Alan, çevre, dairesellik ve en boy oranı gibi şekil tanımlayıcıları analiz parçacıklarında elde edilebilir. Analiz et > Ölçümleri ayarla'da şekil tanımlayıcılarını seçin, ardından Parçacıkları Analiz Et > Analiz Et'te sonuçları görüntüle'yi seçin.
Sonuçlar
Aktive edilmiş trombositler, PLL-PEG-biotin-nötravidin-FITC-biotin-cRGD kaplı slaytlara kolayca yapışır ve yayılır (Şekil 1C ve Şekil 2A; 0 dk ve 5 dk) ve daha sonra ön kenarda bir lamellipodyum oluşturarak polarize olur (Şekil 2A; 10 dk). Bu işlem sırasında, psödonükleus (trombositlerin merkezindeki koyu renkli alan) trombositin merkezinden arkasına doğru hareket etmiştir (Şekil 2A). Polarize trombositler daha sonra belirgin bir yönlülük olmadan göç etmeye başlar (Şekil 2A; 15 dakika ve 20 dakika ve Şekil 2B). PLL-PEG-biotin-nötravidin-FITC-biotin-cRGD kaplamalar üzerinde göç eden trombositlerin, göç yolu boyunca floresan yoğunluğundaki azalma ile kanıtlandığı gibi, nötravidin-FITC-biotin-PLL-PEG bağını kırabildiğini gözlemledik (Şekil 1C ve Şekil 2A,B). Ayrıca, bozulmuş nötravidin-FITC-biotin-cRGD kompleksi trombosit yüzeyinde birikir (Şekil 2A,B). Bu fenomen, göç eden trombositlerin fibrinojeni substrattan uzaklaştırdığı ve açık kanal sistemi (OCS) içinde biriktirdiği önceki bulgulara benzer4.
Ligand yoğunluğunun trombosit göçünü nasıl etkilediğini araştırmak için, cRGD yoğunluğu, ilk kaplama tabakasında PLL-PEG-biyotin'in PLL-PEG'ye oranı değiştirilerek ayarlandı. Bu veriler, fare trombositlerinin %2.5'lik bir PLL-PEG-biotin konsantrasyonunda optimal migrasyon elde ettiğini ortaya koymaktadır. Migrasyon, hem daha düşük (% 1) hem de daha yüksek (% 10) PLL-PEG-biyotin konsantrasyonlarında azalır (Şekil 3A, B). Göç davranışındaki bu substrata bağlı değişikliklere trombosit morfolojisindeki değişiklikler eşlik eder (Şekil 3C). Düşük ligand yoğunluklarında (% 1), düşük öngörülen trombosit alanı ve çevresi ile kanıtlandığı gibi trombositler yeterince yayılmaz (Şekil 3C). Bu, yetersiz integrin aktivasyonu ve dıştan içe sinyalleşme7'yi önerir. Sonuç olarak, trombositler cRGD ligandlarına kuvvet uygulayamaz, substratı yeniden şekillendiremez ve göç etmez (Şekil 3A,B).
Ara ligand yoğunluğunda (%2.5), trombosit alanı ve çevresinde önemli bir artış vardır (Şekil 3C). Trombositler etkili bir şekilde yayılır, kararsız cRGD ligandlarını mekanik olarak bozar ve göç eder (Şekil 3A,B). Bununla birlikte, yüksek ligand yoğunluklarında (% 10), yayılma artmasına rağmen, trombositler polarize olmaz, bu da azaltılmış bir en-boy oranı ile gösterilir (Şekil 3C). Bu koşullar altında, trombositler yapışkan substrata bağlı kalır ve kararsız cRGD ligandlarını kıramadıkları için göç etmezler (Şekil 3A,B).
Bu bulgular, trombosit göçünün kritik olarak substratın yapışkan özelliklerine bağlı olduğunu göstermektedir. Trombositler ancak yapışkan ligandlarla yeterince etkileşime girdiklerinde ve aynı anda yapışkan substratın 4,6,7,8 gerilim toleransının üstesinden gelmek için yeterince güçlü çekiş kuvvetleri ürettiğinde göç edebilir.
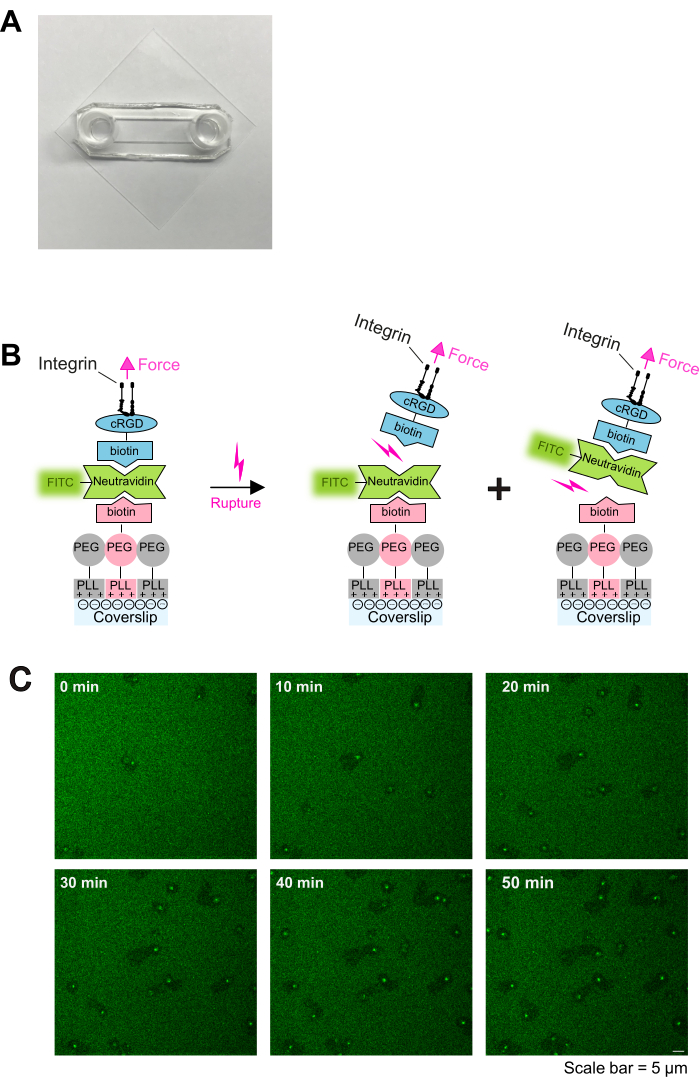
Şekil 1: Kaplama prosedürü ve trombosit-substrat etkileşiminin canlı görüntülenmesi. (A) Monte edilmiş odanın fotoğrafı. (B) Protokolün esası. Sol: Kaplamanın şeması. Plazma ile muamele edilmiş cam lameller üç kat ile kaplanmıştır. İlk katman, PLL-PEG ve PLL-PEG-biotin karışımıdır (PLL-PEG omurgası hücrelere karşı inerttir ve spesifik olmayan bağlanmayı önler). İkinci katman nötravidin-FITC'dir ve üçüncü katman biotin-cRGD'dir. Neutravidin-FITC, PLL-PEG-biotin ve biotin-cRGD arasında köprü kurar. Trombositler, plazma zarındaki integrinler aracılığıyla biotin-cRGD'ye bağlanır. Sağ: Trombosit integrinleri tarafından biotin-avidin bağlanmasının açılmasının gösterimi. Trombositler, integrin-cRGD bağlantısı yoluyla substrat üzerine kuvvet uygular ve üst cRGD-biotin - nötravidin-FITC - bağını veya alt nötravidin-FITC - PLL-PEG-biotin - bağını koparır. Nötravidin-FITC ve biotin-PLL-PEG arasındaki alt bağın yırtılması, floresan sinyalinin azalmasına neden olurken, biotin-cRGD ve nötravidin-FITC arasındaki üst bağın yırtılması olmaz. (C) Trombosit göçünü ve kararsız cRGD-ligandlarının tükenmesini gösteren zaman serileri. Floresan azalmış alanlar, trombositlerin göç izlerini gösterir (ayrıca bkz. Şekil 2A) ve artmış floresan alanları, göç eden trombositler üzerinde FTIC-nötravidin-biotin-cRGD birikimini gösterir. Ölçek çubuğu: 5 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: Yeniden modellenmiş substrat tarafından kodlanan trombosit göçünün immünofloresan görüntülemesi. (A) Tek trombosit göçünün temsili film sekansı. Solda: Göç eden trombositlerin faz kontrast görüntüleri. Trombositler, ön kenarda bir lamellipodyum oluşturarak polarize olur ve ardından göç eder. Sağda: Neutravidin-FITC substrattan çıkarıldı ve trombosit göçünün "ayak izi" bırakıldı. Yırtılmış cRGD-biotin-nötravidin-FITC, göç eden trombositlerin merkezinde birikir. (B) Ligand kararsız cRGD-biotin-avidin kaplamalarda trombosit göçünün temsili görüntüleri. Üst: Phalloidin (Alexa FluorTM 594) ile boyanmış trombositler, büyük lamellipodyum oluşumu ve göç eden trombositleri anımsatan polarize bir şekil gösterdi. Göç eden trombositler, cRGD-biotin-nötravidin-FITC bağını koparır ve azaltılmış FITC sinyali ile gösterilen substrat üzerinde göç yolları oluşturur. Alt: daha büyük büyütme ile kırpılmış görüntü. (C) Fiji'de göç yolları sarı çizgilerle manuel olarak çizildi. Ölçek çubukları: 5 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 3: PLL-PEG-biyotinin PLL-PEG'e oranı, trombosit göçünü ve şeklini belirler. (A) %1, %2.5 ve %10 PLL-PEG-biyotin kaplamalarda trombositlerin temsili görüntüleri, ölçek çubuğu: 5μm. (B) Trombosit yapışması, migrasyon verimliliği ve migrasyon mesafesinin ölçülmesi, n = 4 bağımsız deney; Ortalama/SD; Tek yönlü ANOVA/Tukey; **p < 0.01; p < 0.001; p < 0.0001, ns: önemli değil (C) Trombosit şekli tanımlayıcılarının nicelleştirilmesi (alan, çevre, dairesellik ve en boy oranı), n = 4 bağımsız deney; Ortalama/Min-Maks; Tek yönlü ANOVA/Tukey; **p < 0.01; p < 0.001; P < 0.0001, NS: Önemli değil. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Bu protokolde, (1) bir PLL-PEG-biyotin omurgası ve (2) (3) biyotin-cRGD'nin (bir yapışkan ligand) PLL-PEG-biyotin omurgasına bağlanmasını kolaylaştıran bir nötravidin-FITC bağlayıcısından oluşan üç katmanlı bir kaplama prosedürü sunulmaktadır (ayrıca bkz. Şekil 1B), PLL-PEG-biyotinin PLL-PEG'ye oranını değiştirerek mekanik ve yapışkan substrat özelliklerinin hassas bir şekilde ayarlanabilirliğini sağlar ve trombosit göçünün kolay floresan bazlı bir okumasını sağlar. Bu protokol, trombosit göçünü ve şeklini izlemek için FITC ile konjuge nötravidin ve Alexa Fluor 594 ile konjuge phalloidin kullanırken, diğer florofor konjuge avidin ve phalloidin kullanılabilir. PLL-PEG, PLL-PEG-biotin, nötravidin-FITC ve cRGD-biotin dahil olmak üzere tüm kaplama reaktiflerinin yanı sıra trombosit aktivatörleri ticari olarak mevcut olduğundan, bu deney çok fazla ek çaba harcamadan gerçekleştirilebilir. Kritik adım plazma tedavisidir, çünkü verimsiz plazma tedavisi PLL-PEG/PLL-PEG-biyotinin substrata yetersiz bağlanmasına yol açarak trombosit yapışması ve migrasyonunun başarısız olmasına neden olur. Plazma temizleyicinin performansı önemlidir. Genel olarak, 13.6 MHz jeneratörlü plazma temizleyiciler, 40 KHz veya 100 KHz olanlardan daha iyi performans gösterir. Ek olarak, bir oksijen plazma kaynağı ortam havasından daha uygundur. Başarılı bir plazma işleminden sonra, kaplama adımları neredeyse hatalara eğilimli değildir.
Trombositlerin daha önce substrat adezyonlara büyük ölçüde bağımlı olan mezenkimal göç modunu kullandığı gösterilmiştir 4,17. Fibroblastlara benzer şekilde, düşük ligand yoğunlukları, trombositler substrata yapışmak için mücadele ederken migrasyonu engellerken, yüksek ligand yoğunlukları sert adezyonların ayrılmasını önleyerek migrasyonu engeller18 (Şekil 3). Orta yoğunluklarda, trombositler yapışırken, integrin bağı başına miyozin IIA'ya bağlı çekme kuvvetleri adezyonları kırmak için hala yeterlidir. İntegrin αIIbβ3 ile ligandı fibrin (ojen) arasındaki yüksek afinitenin, adezyonların yapışkan ligandın salınması yoluyla değil, daha ziyade in vivo endotel hücreleri veya in vitro 4,6 gibi alttaki substrattan yırtılması veya ayrılması yoluyla sökülmesi ile sonuçlanması dikkat çekicidir.. Fibrinojeni alttaki substrattan ayırmak için gereken bağlanma kuvveti, genellikle kontrol edilmesi zor olan fiziksel ve (biyo-) kimyasal özelliklerden büyük ölçüde etkilenir ve bu da migrasyon verimliliğinde önemli değişkenliğe yol açabilir. Burada tanıtılan tahlil, bu sorunu ele almak için indirgemeci bir yaklaşım sunmaktadır. Bununla birlikte, avidin-biyotin bağının kırılma kuvveti yaklaşık 160 pN'de sabitlenmiştir, bu nedenle daha düşük kuvvet rejimlerinde trombosit yapışmasını incelemek için çift sarmallı bir DNA bağına dayananlar gibi daha karmaşık gerilim sensörleri kullanılmalıdır19.
Önceki çalışmalar, trombosit göçünün in vivo olarak bakteriyel enfeksiyon ve vasküler inflamasyonda rol oynadığını bulmuştur. Sonuç olarak, bozulmuş miyozin kontraktilitesi, aktin polimerizasyonu veya integrin dıştan içe sinyalleme gibi migrasyon kusurları olan trombositler, bozulmuş bakteri klerensi ve vasküler bütünlük gösterir 4,6,7. Burada sunulan test basit, stabildir ve bu nedenle küçük moleküler inhibitörlerin ve bunların trombosit göçü üzerindeki etkilerinin taranması için uygundur. Enflamasyon veya trombozda terapötik hedefleri keşfetmek için yeni bir in vitro araç sağlar.
Açıklamalar
Yazarların ifşa edecek hiçbir şeyi yok.
Teşekkürler
Bu çalışma Deutsche Forschungsgemeinschaft (DFG; Alman Araştırma Vakfı) proje numaraları 514478744 ve F.G.'ye 514477451. Proje Avrupa Birliği (ERC, MEKanics, 101078110) tarafından finanse edilmektedir. İfade edilen görüş ve düşünceler yalnızca yazar(lar)a aittir ve Avrupa Birliği veya Avrupa Araştırma Konseyi İcra Ajansı'nın görüşlerini yansıtmayabilir. Bunlardan ne Avrupa Birliği ne de izin veren makam sorumlu tutulamaz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Adenosine 5′-diphosphate sodium salt (ADP) | Sigma-Aldrich | A2754 | |
| Alexa Fluor 594 phalloidin | Thermofisher | A12381 | |
| Blood counter | Sysmex | XN-1000 | |
| Bottomless 6 channel sticky slide | IBIDI, sticky slides VI0.4 | 80608 | |
| Centrifuge | Eppendorf | 5804 | |
| Confocal microscope | Zeiss | LSM880 | |
| cyclo [Arg-Gly-Asp-D-Phe-Lys(Biotin-PEG-PEG)] | Peptide international | PCI-3697-PI | |
| FACS tubes | Corning Brand | 352052 | |
| FITC conjugate neutravidin | Thermofisher | A2662 | |
| Formaldehyde | Thermofisher | 28908 | |
| HEPES solution | Sigma-Aldrich | H0887 | |
| Phase contrast and epifluorescent microscope | Olympus | IX83 | |
| Plasma cleaner | Diener | 116531 | |
| PLL(20)-g[3.5]-PEG(2)/PEG(3.4)-biotin(50%) | Susos | PLL(20)-g[3.5]-PEG(2)/PEG(3.4)-biotin (50%) | |
| Poly(L-lysine)-graft-poly(ethylene glycol) co-polymer | Susos | PLL(20)-g[3.5]-PEG(2) | |
| Prostaglandin I2 sodium salt (PGI2) | Abcam | ab120912 | |
| Sonicator | BANDELIN | SONNOREX RK514M | |
| Ttriton X-100 20% v/v | Cayman Chemical | 600217 | |
| U46619 | Enzo Life Sciences | BML-PG023-0001) |
Referanslar
- Jackson, S. P. Arterial thrombosis--insidious, unpredictable and deadly. Nat Med. 17, 1423-1436 (2011).
- Kaiser, R., Escaig, R., Nicolai, L. Hemostasis without clot formation: how platelets guard the vasculature in inflammation, infection, and malignancy. Blood. 142 (17), 1413-1425 (2023).
- Gaertner, F., Massberg, S. Patrolling the vascular borders: Platelets in immunity to infection and cancer. Nat Rev Immunol. 19 (12), 747-760 (2019).
- Gaertner, F., et al. Migrating platelets are mechano-scavengers that collect and bundle bacteria. Cell. 171 (6), 1368-1382.e23 (2017).
- Gros, A., et al. Single platelets seal neutrophil-induced vascular breaches via GPVI during immune-complex-mediated inflammation in mice. Blood. 126 (8), 1017-1026 (2015).
- Nicolai, L., et al. Vascular surveillance by haptotactic blood platelets in inflammation and infection. Nature Comm. 11, 5778(2020).
- Kaiser, R., et al. Mechanosensing via a GpIIb/Src/14-3-3zeta axis critically regulates platelet migration in vascular inflammation. Blood. 141 (24), 2973-2992 (2023).
- Sarkar, A., LeVine, D. N., Kuzmina, N., Zhao, Y., Wang, X. Cell migration driven by self-generated integrin ligand gradient on ligand-labile surfaces. Curr Biol. 30 (20), 4022-4032 (2020).
- Hynes, R. O. Integrins: Bidirectional, allosteric signaling machines. Cell. 110 (6), 673-687 (2002).
- Kechagia, J. Z., Ivaska, J., Roca-Cusachs, P. Integrins as biomechanical sensors of the microenvironment. Nat Rev Mol Cell Biol. 20, 457-473 (2019).
- Shattil, S. J., Newman, P. J. Integrins: Dynamic scaffolds for adhesion and signaling in platelets. Blood. 104 (6), 1606-1615 (2004).
- Yuan, C., Chen, A., Kolb, P., Moy, V. T. Energy landscape of streptavidin-biotin complexes measured by atomic force microscopy. Biochemistry. 39 (33), 10219-10223 (2000).
- Florin, E. L., Moy, V. T., Gaub, H. E. Adhesion forces between individual ligand-receptor pairs. Science. 264 (5157), 415-417 (1994).
- Merkel, R., Nassoy, P., Leung, A., Ritchie, K., Evans, E. Energy landscapes of receptor-ligand bonds explored with dynamic force spectroscopy. Nature. 397, 50-53 (1999).
- Jurchenko, C., Chang, Y., Narui, Y., Zhang, Y., Salaita, K. S. Integrin-generated forces lead to streptavidin-biotin unbinding in cellular adhesions. Biophys J. 106 (7), 1436-1446 (2014).
- Fan, S., Lorenz, M., Massberg, S., Gaertner, F. Platelet migration and bacterial trapping assay underflow. Bio-Protocol. 8 (18), e3018(2018).
- Lauffenburger, D. A., Horwitz, A. F. Cell migration: A physically integrated molecular process. Cell. 84 (3), 359-369 (1996).
- Palecek, S. P., Loftus, J. C., Ginsberg, M. H., Lauffenburger, D. A., Horwitz, A. F. Integrin-ligand binding properties govern cell migration speed through cell-substratum adhesiveness. Nature. 385, 537(1997).
- Zhao, Y., Wetter, N. M., Wang, X. Imaging integrin tension and cellular force at submicron resolution with an integrative tension sensor. J Vis Exp. (146), e59476(2019).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır