Üç Boyutlu Fibrin Hidrojellerinde İnsan Timus Organoidlerinin Oluşumu
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Burada, timik epitel hücresi (TEC) olgunlaşmasını ve uzun süreli bakımı ve ayrıca in vitro timopoezi desteklemeyi amaçlayan 3D fibrin hidrojellerde büyütülen insan iPSC'den türetilmiş timus organoidlerinin oluşumu için bir protokol açıklıyoruz.
Özet
İşlevsel ve kendi kendine toleranslı bir T hücresi repertuarının oluşturulması, timik mikroçevreye ve öncelikle hücre dışı matrisinin (ECM) özelliklerine bağlı karmaşık bir süreçtir. Timik epitel hücreleri (TEC'ler), kendi kendine reaktif klonları filtreleyerek gelişmekte olan T hücrelerini besleyen ve seçen timopoezde çok önemlidir. TEC'lerin ECM tarafından sağlanan fiziksel ve kimyasal ipuçlarına özellikle duyarlı oldukları ampirik olarak gösterilmiştir ve klasik tek katmanlı hücre kültürü, ölümlerine kadar hızlı bir işlevsellik kaybına yol açar. Göreceli nadirlik ile birleşen bu hassas bakım nedeniyle ve timus biyolojisinin in vitro modellenmesindeki yüksek risklere rağmen, TEC nişini ölçekte ve zaman içinde sadık bir şekilde taklit edebilen modeller hala eksiktir. Burada, TEC bölmesinin insan kaynaklı pluripotent kök hücrelerden (iPSC) türetildiği ve üç boyutlu (3D) fibrin bazlı bir hidrojel içinde birincil erken timosit progenitörleri ile yeniden birleştirildiği çok hücreli bir insan timik organoid modelinin oluşumunu açıklıyoruz. Bu model, timik mikroçevreyi ex vivo olarak yeniden üreten ve işlevselliği, yani T hücreleri üretme ve birkaç hafta boyunca timus organoid büyümesini destekleme yeteneğini gösteren ölçeklenebilir bir kültür sistemi için mevcut ihtiyaçlara cevap verir. Bu nedenle, TEC biyolojisi ve T hücresi üretimi ex vivo araştırmalarına fayda sağlayacak iPSC'den türetilmiş organoidler aracılığıyla pratik bir in vitro timus işlevselliği modeli öneriyoruz.
Giriş
Timus, yetkin ve toleranslı bir bağışıklık sisteminin oluşturulmasında önemli bir rol oynayan birincil bir lenfoid organdır 1,2,3. Erken timik progenitörler (ETP'ler) kemik iliğinden timusa göç ederler, burada genişlerler ve fonksiyonel T hücrelerinefarklılaşırlar 1,2,4,5. Bu süreçlere özel bir popülasyon olan timik epitel hücreleri (TEC'ler) aracılık eder2,6,7. TEC'ler, timik epitelyal progenitörlerden (TEP'ler)8,9 türemiştir ve T hücresi göçü, genişlemesi ve olgunlaşması için gerekli olan özel 3D mikro ortamın oluşturulmasında belirli roller oynayan kortikal TEC'leri (cTEC'ler) ve medüller TEC'leri (mTEC'ler) içerir. TEC'ler, esas olarak büyüme ve farklılaşma faktörleri 1,10,11 sağlayarak ve kendi antijenlerinin sunumu yoluyla fonksiyonel olmayan ve toleranssız timositleri negatif olarak seçerek T hücresi gelişiminearacılık eder 5,7,12. Gelişmekte olan T hücreleri ve TEC'ler arasındaki karmaşık etkileşimler, timik karışma 1,11 olarak bilinen bir süreçte TEC popülasyonlarının olgunlaşmasında ve 3 boyutlu organizasyonunda da merkezi bir rol oynar. Timusun hücre popülasyonları arasındaki etkileşimler, hücre dışı matris (ECM) tarafından şekillendirilen spesifik mikro çevreye derinden dayanır. Timik ECM, timik hücre popülasyonları ile dinamik bir karşılıklılık durumundadır, gen regülasyonunu etkiler ve karşılığında enzimlerin veya matris proteinlerinin salgılanmasıyla sürekli olarak yeniden şekillendirilir13. ECM, büyüme faktörlerinin ve sitokinlerin biyoyararlanımının modifikasyonu, integrinler gibi zara bağlı reseptörler yoluyla doğrudan sinyalizasyon ve fiziksel kuvvetler yoluyla hücre iskeletlerini şekillendirerek hücreleri etkiler14. Kollajenler ve laminin gibi timik ECM bileşenlerinin, TEC bakımı için çok önemli olan büyüme faktörleri TGFb ve FGF'lere karşı yüksek bir afiniteye sahip olduğu ve bunları kompleksler oluşturarak sabitlemek için gösterilmiştir. Timik ECM plastisitesi, elastik modül ve yoğunluk da TEC'in kaderini belirlemede ve işlevselliği için gerekli olan timusun bölümlendirilmesini şekillendirmede çok önemli bir rol oynar. Bu ipuçları, timusu ex vivo taklit etmek için ECM'yi ve 3D yapısını hesaba katmanın önemini vurgulamaktadır. Bu nokta, birincil TEC'lerin klasik hücre kültürü kurulumlarındayetiştirildiğinde hızla farklılaşması, işlevselliğini kaybetmesi ve sonunda ölmesi gerçeğiyle desteklenmektedir 15,16,17.
ECM'nin yapısını ve TEC'lere sağladığı önemli ipuçlarını korumak için insan timik eksplantlarından fonksiyonel TEC popülasyonlarını genişletmek için kültür modelleri geliştirilmiştir 18,19,20. Bu kültür sistemi, in vitro olarak işlevsel bir TEC popülasyonunu başarılı bir şekilde genişletmeyi ve sürdürmeyi başardı, ancak 7 ila 8 günlük kültür18'den sonra sürdürülemedi. Bu nedenle, timik mikroçevreyi ve işlevselliğini in vitro ve uzun vadede yeniden üretebilen erişilebilir, pratik bir 3D kültür sisteminin geliştirilmesi, bu alanda çok önemli bir paydır. Son zamanlarda, hidrojel bazlı 3D kültür sistemlerinin geliştirilmesi, in vitro timik modelleme için büyük ilerleme sağlayan çeşitli yapay timik organoid sistemlerin ortaya çıkmasına yol açmıştır 15,16,21,22. İnsan birincil ETP'lerinin, indüklenmiş pluripotent kök hücrelerden (iPSC) sferoidlere türetilen insan TEP'leri ile yeniden toplanması ve bunların bir fibrin hidrojel üzerine tohumlanması yoluyla bir insan timik organoid (hTO) ko-kültür sistemi geliştirdik.
Bu çalışmada malzeme ve hidrojel kurulumunun seçimi, deneyler için uygun fiyatlı ve bol miktarda malzeme kaynağı elde etmek için süreci ölçeklendirme yeteneğini ve pratikliği korurken timik ECM'nin doğal yapısını yeniden üretmeyi amaçlamıştır15. Bu hTO sistemi, çok soylu farklılaşma potansiyeli gösterir ve ETP'lerden23'ten verimli bir timopoezi destekleyebilir. Bu organoid sistem, intratimik hücresel etkileşimlerin incelenmesi ve normal ve patolojik insan lenfopoezinin modellenmesi için güvenilir bir araç oluşturur. iPS hücrelerinin kullanımı, modele gen düzenleme yetenekleri de ekler. iPSC'nin fonksiyonel timik dokuya etkili bir şekilde farklılaşması, son 15 yıldır alanın uzun süredir devam eden bir hedefi olmuştur ve 21,24,25,26,27 TEC soy kaderinin deşifre edilmesinde önemli ilerleme kaydedilmiştir. Böyle bir in vitro 3D timik modele duyulan ihtiyacı karşılamak için, bu teknik not, hidrojel iskele oluşumu, hücre mikrokütlesinin yeniden toplanması ve tohumlanması ve organoid kültürü ve hasadına odaklanarak, iPSC'den türetilmiş insan timus organoidlerinin adım adım üretilmesi için yöntemleri ve teknik ayrıntıları açıklamaktadır.
Protokol
hiPSC hattı hiN.Fm.m.Lon71.019, erkek yetişkin fibroblastlardan üretildi ve mRNA transfeksiyonu yoluyla yeniden programlandı. hiPSC hattı hiN.Fm.f.Lon80.002, dişi yetişkin fibroblastlardan üretildi ve mRNA transfeksiyonu yoluyla yeniden programlandı. hiPSC hattı hiN.Fs.f.MIPS203.003, dişi erişkin fibroblastlardan üretildi ve rekombinant Sendai viral vektör enfeksiyonu yoluyla yeniden programlandı. Tüm hücre hatları Nantes iPSC platformu tarafından sağlandı. Hastalar, hücrelerinin araştırma amaçlı kullanılması için bilgilendirilmiş onam verdiler (anonimleştirilmiş toplama, Lonza, cat # CC-2511). Primer ETP'ler, DC-2017-2987 deklarasyonu kapsamındaki Fransız CODECOH yönetmeliğine uygun olarak, aynı gün Nantes Hastanesi'nde (CHU Nantes) pediatrik kalp ameliyatı geçiren hastalardan anonimleştirilmiş atılmış atık olarak elde edilen doğum sonrası insan timik örneklerinin ayrıştırılmasıyla izole edilir.
1. iPSC'lerin bir TEP kimliğine doğru yönlendirilmiş farklılaşması
NOT: Lai ve Jin tarafından yayınlanan ve murin embriyonik kök hücrelerinin (ESc'ler) timik epitel kimliğine doğru farklılaşmasını gösteren ilk çalışmalardan bu yana, insan iPS hücrelerinin bir TEP kimliğineyönlendirilmiş farklılaşmasını tanımlayan birkaç çalışma geliştirilmiş ve optimize edilmiştir 21,24,25,26,27,29. Bu çalışmalar, FOXN1 ve PAX9 24,25,28,30 gibi timik epitelyal kimlik belirteçlerini eksprese eden TEP'lerin yanı sıra DLL4 ve AIRE26 gibi işlevsellik belirteçlerini eksprese eden, ancak TEC olgunlaşma belirteçlerinden yoksunolan TEP'lerin farklılaşmasına yol açmaktadır 24,25. Farklılaşmış TEP'lerin olgun bir TEC kimliğine olgunlaşmasını desteklemek için iki yaklaşım gösterilmiştir: fareler29 gibi bir in vivo modele transplantasyon ve bir hava-sıvı arayüz kurulumunda yetiştirilen 3D timik organoid sistemlere yeniden birleştirme21. Her iki sistem de in vivo veya in vitro T lenfopoezi destekleyebilen fonksiyonel TEC popülasyonlarının olgunlaşmasını sürdürmede ve desteklemede 3D yapının oynadığı önemli rolü göstermiştir 15,24,25,31.
- Bu çalışmada kullanılan timik organoid sistem için, Provin ve ark.23'te geliştirilen ve detaylandırılan bir protokolü izleyerek iPS hücrelerinin bir TEP kimliğine doğru farklılaşmasını gerçekleştirin.
2. Pediatrik timik numuneden primer ETP'lerin izolasyonu
NOT: ETP'ler, T hücre soyuna ve timus içindeki dendritik hücrelere yol açan ve aşağıdaki fenotipi gösteren kemik iliği kaynaklı progenitörlerdir: CD3- CD4- CD8- CD14- CD19- CD56- CD45+ CD34+ CD7+32,33.
- Tükenme boncuklarının hazırlanması
- Bir gün önce, manyetik hücre izolasyon boncuklarını (Malzeme Tablosu) 15 mL'lik bir tüpe aktarın ve 4 mL İzolasyon Tamponu (PBS +% 0.1 BSA + 2 mM EDTA) ile yıkayın.
- Tüpü manyetik standa yerleştirin, süpernatanı çıkarın ve 2 mL izolasyon tamponu ekleyin.
- Boncuklara fare anti-insan CD3, CD4 ve CD8 antikorları ekleyin ve çalkalama altında 4 ° C'de 45 dakika inkübe edin. Tüpü manyetik standa yerleştirin, izolasyon tamponunda birkaç kez yıkayın ve 20 mL izolasyon tamponunda tekrar süspanse edin.
- Timus örneği ayrışması
- Taze timus örneklerini RPMI1640 ile doldurulmuş bir petri kabına aktarın (Malzeme Tablosu). Steril diseksiyon, makas ve pense ile yaklaşık 1 mm,3 boyutunda parçalar halinde kesin.
- 25 mL'lik bir pipetle, ortamı ve parçaları birkaç kez yıkayın (ortam bulanıklaşmalıdır), ardından parçaların çökelmesine ve ortamın yarısını 50 mL'lik bir tüpte toplamasına izin verin. Daha fazla orta ekleyin ve ortam temiz kalana kadar tekrarlayın.
- Ortamı gerektiği kadar çok 50 mL'lik tüpe toplayın ve tüpleri 5 dakika boyunca 200 x g'da döndürün.
- Süpernatanı çıkarın ve peletleri 10 mL kırmızı kan hücresi lizis çözeltisinde yeniden süspanse edin (Malzeme Tablosu). Oda sıcaklığında (RT) 5 dakika inkübe edin ve 20 mL yıkama tamponu ekleyin (PBS +% 0.5 BSA + 4 mM EDTA +% 1 penisilin / streptomisin).
- 5 dakika boyunca 200 x g'da döndürün ve süpernatanı çıkarın. Peletleri 10 mL yıkama tamponunda yeniden süspanse edin, 70 μm'lik bir gözenekli filtreden süzün ve hücreleri sayın.
- ETP zenginleştirme
- Hücreleri saydıktan sonra, yıkama tamponu ile hacmi tüp başına 10 mL'ye ayarlayın. Gerekli miktarda hücre izolasyon boncuğu ekleyin (200 milyon hücre başına, 20 mL izolasyon tamponunda 500 μL boncuk kullanın) ve 30 dakika çalkalama altında 4 ° C'de inkübe edin.
- Tüpü 2 dakika boyunca manyetik standa yerleştirin ve süpernatanı temiz bir tüpte dikkatlice toplayın. Tüpü çıkarın ve boncukları 20 mL izolasyon tamponu ile temizleyin. Tüpü girdaplayın, manyetik standa geri yerleştirin ve süpernatanı toplayın. Bu adımı iki kez tekrarlayın.
- Süpernatanları 5 dakika boyunca 200 x g'da döndürün. Peletleri 2 mL izolasyon tamponunda yeniden süspanse edin ve hücreleri sayın.
- ETP izolasyonu
- Konsantrasyonu mL başına 200 milyon hücreye ayarlayın ve lekesiz bir kontrol olarak küçük bir hacim toplayın.
- Hücreleri fare anti-insan Soy (Lin) (CD3, CD4, CD8, CD14, CD19, CD56), CD7 ve CD34 antikorları ile etiketleyin (tüm Lin belirteçleri için aynı florokrom kullanın). 4 °C'de 45 dakika inkübe edin.
- Hücreleri eşit hacimde yıkama tamponunda yıkayın. Hücreleri 5 dakika boyunca 200 x g'da döndürün, peleti 1 mL'de yeniden süspanse edin ve hücreleri sayın.
- Hacmi mL başına 50 milyon hücre konsantrasyonuna ayarlayın ve hücreleri 70 μm'lik bir ağ filtreden süzün.
- Tercih edilen canlılık işaretçisini ekleyin ve canlı Lin-CD34 + CD7 + hücrelerini 70 μm'lik bir nozul kullanarak akış sitometrisi ile sıralayın.
3. 3D timik organoid kültürü
- TEP hazırlığı
- ETP izolasyonundan hemen sonra, 13-15. günlerde TEP kültürünün kalitesini kontrol edin. Hücrelerin birleştiğinden ve şişkinlikli yoğun bir tek tabaka oluşturduğundan emin olun (Şekil 1).
- Farklılaşmış TEP'leri hasat etmek için, hücreleri DPBS-/- ile yıkayın, çıkarın, oyuk başına 1 mL TrypLE (Malzeme Tablosu) ekleyin ve 37 ° C'de 5-7 dakika inkübe edin.
- Oyuk başına 1 mL XVIVO10 (Malzeme Tablosu) ekleyin, hücreleri ayırmak için birkaç kez yıkayın, 15 mL'lik bir tüpe aktarın ve 5 dakika boyunca 200 x g'da döndürün.
- Süpernatanı çıkarın, peleti 1 mL XVIVO10 içinde yeniden süspanse edin ve hücreleri sayın.
NOT: Farklılaşmanın etkinliğini önceden değerlendirmek için, ayrı bir kültür kuyusu kullanın ve RT-qPCR ile FOXN1 ve PAX9 ekspresyonunu ve akış sitometrisi ile farklılaşma verimini doğrulayın (EPCAM+ CD205+ hücrelerinin fraksiyonu olarak hesaplanır,% 50'nin üzerinde olmalıdır) (Şekil 1). Farklılaşmanın bu aşamasında, neredeyse tüm EPCAM + hücreleri de CD205 için pozitiftir ve öncü kimliklerini11 kanıtlar.
- ETP hazırlığı
- ETP izolasyonundan hemen sonra, toplama tüpünü 5 dakika boyunca 200 x g'da döndürün. Peleti 1 mL XVIVO10 içinde tekrar süspanse edin ve hücreleri sayın.
- Timik organoidlerin toplanması
- Uygun hacimleri pipetleyin ve her iki hücre süspansiyonunu mL başına 2,00,000 TEP ve 40,000 ETP konsantrasyonunda toplayın, homojenize etmek için bir kez hafifçe yukarı ve aşağı pipetleyin.
- Tablo 1'e göre uygun takviyeleri ekleyin ve düşük bağlayıcı U tabanlı 96 oyuklu plakalarda oyuk başına 100 μL karışık hücre süspansiyonu plakası ekleyin. Daha fazla verim için çok kanallı bir pipet kullanın; Bununla birlikte, klasik tek uçlu pipet, değerli hücrelerin hacimlerinin kaybedilmesini sınırlar. Plakaları gece boyunca 37 ° C ve% 5 CO2'de inkübe edin.
- Hidrojellerin hazırlanması
NOT: Hidrojel oluşumu, organoid tohumlama ve kültür ortamı dağılımı için kullanılan deney düzeneği Şekil 2'de gösterilmiştir.- Ertesi gün (organoid kültür fazının 1. günü), Trombin (10 U / mL), Aprotinin (26.000 U / mL) ve Fibrinojen (8 mg / mL) alikotlarını çözün (Malzeme Tablosu). Trombin ve aprotini buz üzerinde ve fibrinojeni 37 ° C'lik bir su banyosunda çözdürün (çökeleceği için buzun üzerine koymayın). Girdap yapmayın, ancak alikotları kaputun altına yerleştirin ve nazikçe pipetleyerek homojenize edin.
- Tablo 2'de sunulan oranları takip ederek üretilen organoidlerin sayısı için gerektiği kadar asılı ek hazırlayın. Ekleri steril pense kullanarak kültür kuyucuklarına yerleştirin ve kültür plakasında en az bir sütun veya satırı boş bırakın.
- Dökülecek jeller kadar çok 1,5 mL'lik tüp hazırlayın. Her tüpte, önce Tablo 2'de detaylandırıldığı gibi gerekli Fibrinojen ve Aprotinin hacimlerini pipetleyin.
- İkinci kez, gerekli Trombin hacmini tek bir tüpe ekleyin, reaktifleri homojenize etmek için kabarcıklar oluşturmadan 2 kez hızlı bir şekilde yıkayın, ardından tüpün tüm içeriğini çekin ve karışımı hızlı bir şekilde asılı eke yıkayın. Pipeti ekin merkezinin üzerine dikey olarak yerleştirin ve reaktif karışımını kabarcık oluşturmadan nazikçe yıkayın.
NOT: Bu adımda, reaktifler birkaç saniye içinde polimerize olacağından yürütme hızı çok önemlidir ve jelde topak oluşumunu veya eşit olmayan yoğunluğu önlemek için bunları doğru şekilde karıştırmak önemlidir. Her kuyucuk için farklı bir 1,5 mL tüp kullanarak her seferinde bir kuyucuk ilerleyin (bir tüp birkaç kuyucuk için yeniden kullanılırsa, kalan katı jel topakları pipetin ucunu tıkayabilir). Trombinin yüksek aktivitesi nedeniyle polimerizasyon çok hızlı gerçekleşirse, 1:2 seyreltme kullanın. Dökümden hemen sonra, jeller şeffaf ila hafif yarı saydam olmalı ve plaka dikey olarak eğildiğinde birkaç saniye sonra hala akmalıdır. - Şeffaf çözelti katılaşana ve opak beyaza dönene kadar 37 °C'de en az 1 saat inkübe edin ve plaka dikey olarak eğildiğinde jeller sıkıca yerinde kalır (Şekil 2A).
- Organoid tohumlama
- Toplama adımının kalitesini doğrulayın. Mikrokütlelerin, daha düşük yoğunluklu bir ETP halesi ile çevrili kompakt bir çekirdek ile küresel hücre kütleleri oluşturduğundan emin olun (Şekil 3).
- Bir P200 konisinin ucunu kesin ve yapışma önleyici bir solüsyonla yıkayın (Malzeme Tablosu). Hücre kütlelerini hasat etmek için, plakayı neredeyse dikey bir konuma eğin: mikro kütleler kuyuların alt duvarına batar ve aspirasyon sırasında pipet ucunu kuyunun dibine kademeli olarak iterek kolayca geri kazanılabilir.
- Hidrojellerin üst kısmındaki kütleyi, Tablo 1'de sunulan oranları takip ederek, pipet ucuyla jele dokunmadan hassas bir şekilde biriktirerek tohumlayın (Şekil 2B). Organoidler bu aşamada serbest yüzer gibi görünse bile, kültür ortamı ile şiştiğinde jel yumuşayacak ve organoidler üst tabakada yuvalanacaktır. Mikroskop altında P96 kuyularında organoid kalmadığını kontrol edin.
- Tablo 1 ve Tablo 2'ye göre gerekli hacimde kültür ortamını hazırlayın ve her bir oyukta, hacmin dörtte birini hidrojellerin üst kısmına dokunmadan ekleme duvarları boyunca pipetleyerek yavaşça ekleyin ve kalan dörtte üçünü pipeti asılı ekin kolları arasına yerleştirerek kuyunun dibine ekleyin (Şekil 2C).
- Plakadaki nemi korumak için boş kültür kuyucuklarına 1 mL PBS yerleştirin. 37 ° C'de ve% 5 CO2'de inkübe edin.
- Timik organoid kültür
- 2. günde, organoidlerin iyi tohumlanıp tohumlanmadığını kontrol edin: hidrojeller yerinde kalmış olmalı ve organoidler ekin dibinde tortulaşmamış olmalıdır.
- Tablo 1 ve Tablo 2'ye göre gerekli miktarda kültür ortamını hazırlayın. Aspirasyon konisinin ucunu asılı ekin kolları arasına yönlendirerek ve jele dokunmamaya dikkat ederek ortamı çıkarın. Pipeti aynı şekilde konumlandırarak yeni ortamı ekleyin.
- Ortamı her 2 günde bir değiştirin, 2 ila 4 gün sonra (TEP farklılaşmasının başlamasını takip eden 18. günde) ikinci faz ortamına (Tablo 1) geçin.
NOT: Organoid partisi bu şekilde kültürde 6 haftaya kadar tutulabilir.
- Organoid toplama
- Hasat için oyuk başına 1 mL TrypLE içeren 15 mL'lik bir tüp hazırlayın.
- Bir P1000 konisinin ucunu kesin ve yapışma önleyici bir solüsyonla kaplayın. Pipet ucunu eklerin ortasına dikey olarak yerleştirerek jeli nazikçe pipetleyin (zarı delmemeye dikkat edin) ve TrypLE tüpüne aktarın. Ek parçanın zarını TrypLE ile yıkayın ve tüpe de aktarın.
- 37 ° C'de 15 dakika inkübe edin, 5 dakika aralıklarla hafifçe girdap yapın. Jellerin ve organoidlerin ayrıştığından emin olun.
- 15 dakika sonra, 70 μm'lik bir gözenekli filtrede süzün ve 5 dakika boyunca 200 x g'da döndürün. Peleti yıkama tamponunda yeniden süspanse edin ve tercih edilen analitik yönteme geçin.
Temsili Sonuçlar
Protokolün iş akışı Şekil 4'te özetlenmiştir. Bu 3D organoid kültür modeli için, sağladığı fiziksel ve mekanik ipuçları sayesinde, daha önce ekibimiz tarafından birincil fare mTEC'lerini birkaç gün boyunca korumak için kullanılmış olan bir trombin ve fibrinojen hidrojeli benimsedik34. Polimerizasyondan sonra, jel gevşek, sünger benzeri bir ağ yapısı göstermelidir (Şekil 5).
İlk tohumlama ve bağlanma aşamasından sonra, organoidler hem yüzeyde hem de jelin en üst katmanları içinde aşamalı olarak büyüdü ve gelişti. Jel özelliklerine, tohumlama koşullarına ve jel üzerine ekilen organoidlerin sayısına bağlı olarak, organoidler dikdörtgen yapılar oluşturmak için küresel oluşturur (Şekil 6) ve bazen daha büyük yapılar oluşturmak için birleşir. Kültürün ilk haftasından sonra organoidler içinde organizasyonun iki özel alt seviyesi gözlendi: ilk olarak, organoidlerden ışınlanan ve hidrojeli her yöne kolonize eden büyük hücreler tarafından oluşturulan uzun, hücre yüzeyi projeksiyon benzeri yapıları gözlemledik (Şekil 6 ve Şekil 7). İkincisi, bu hücre projeksiyonları etrafında yoğunlaşan daha küçük hücreler tarafından oluşturulan küme benzeri yapıları gözlemledik. Çalışma hipotezini doğrulamak için her iki hücre tipini de izole edememiş olsak da, bu fenomen, timik hemşire hücre kompleksleri11 olarak bilinen çok sayıda çok daha küçük gelişmekte olan T hücresi ile bireysel cTEC'lerin etkileşimi ile oluşan timik korteks içinde bulunan 3D düzenlemeleri anımsatmaktadır (Şekil 8).
Organoid kültür fazı sırasında birkaç zaman noktasında, timik organoidlerin hücresel bileşimini akış sitometrisi ile değerlendirdik ve birkaç anahtar bölme tanımladık: TEC (EPCAM + CD45- olarak karakterize edilir), timositler (EPCAM- CD45 + CD3 +) (Şekil 9) ve ayrıca timik hematopoietik timosit olmayan alt kümeleri içeren bir EPCAM-CD45 + CD3- bölmesi. Daha fazla ayrıntı Provin ve ark.23'te bulunabilir.
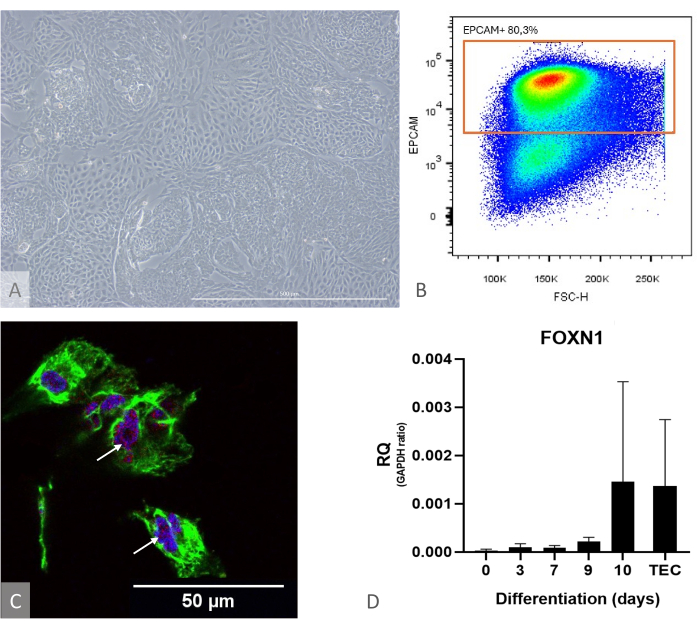
Şekil 1: iPSC'den TEP'e farklılaşma karakterizasyonu. (A) D13'te iPSC'den TEP'ye farklılaşma örneği, ters faz kontrast mikroskobu, 400x. Ölçek çubuğu: 500 μm. (B) Nokta grafiği örneği, farklılaşmanın 14. gününde DAPI hücreleri arasındaki EPCAM+ hücrelerinin oranı, FlowJo 10.0.7'den görüntü. (C) DAPI (mavi), PAX9 (kırmızı) ve KRT8'e (yeşil), immünofloresan ve iPSC'nin 16. gününde TEP farklılaşmasına karşı konfokal görüntüleme. Beyaz oklar, anti-PAX9 boyama örneklerine işaret eder. Ölçek çubuğu: 50 μm (D) iPS'den TEP'ye farklılaşma sırasında FOXN1'in (RQ'dan GAPDH'ye) ifade seviyesi. TEC: Pozitif kontrol referansı, pediatrik timus örneklerinden izole edilen birincil insan TEC'leri. Prism'den grafik (GraphPad sürüm 8.0.1). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
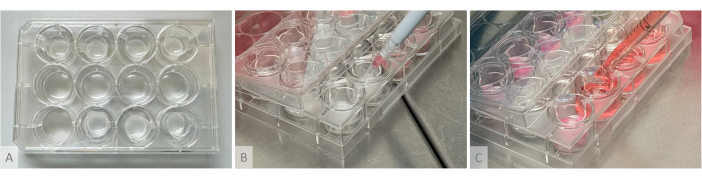
Şekil 2: Hidrojel oluşumu, organoid tohumlama ve kültür ortamı dağılımı için deney düzeneği. (A) Üst ve alt sıralara yerleştirilmiş asma uçlara dökülmüş hidrojelli kültür plakası. (B) Organoid tohumlama: 1 organoid içeren kesilmiş pipet konisi, dokunmadan hidrojelin üzerine yerleştirilir ve organoid, jelin yüzeyine nazikçe tohumlanır. (C) Kültür ortamı, pipetin ucunun asılı ekin kolları arasına yerleştirilmesiyle kültür kuyusunda biriktirilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
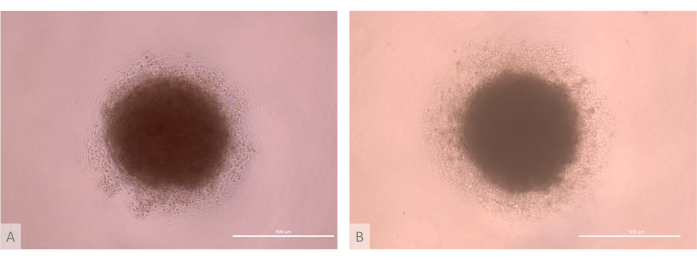
Şekil 3: Tohumlamadan önce timik organoid kültürün D0'ı (tam protokolün 13-15. günleri). (A) Lon71.019 iPS hattından türetilen TEC'lerle üretilen organoid. (B) MIPS203.003 iPS hattından türetilen TEC'lerle üretilen organoid. Ters faz kontrast mikroskobu, 1000x. Ölçek çubukları: 500 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
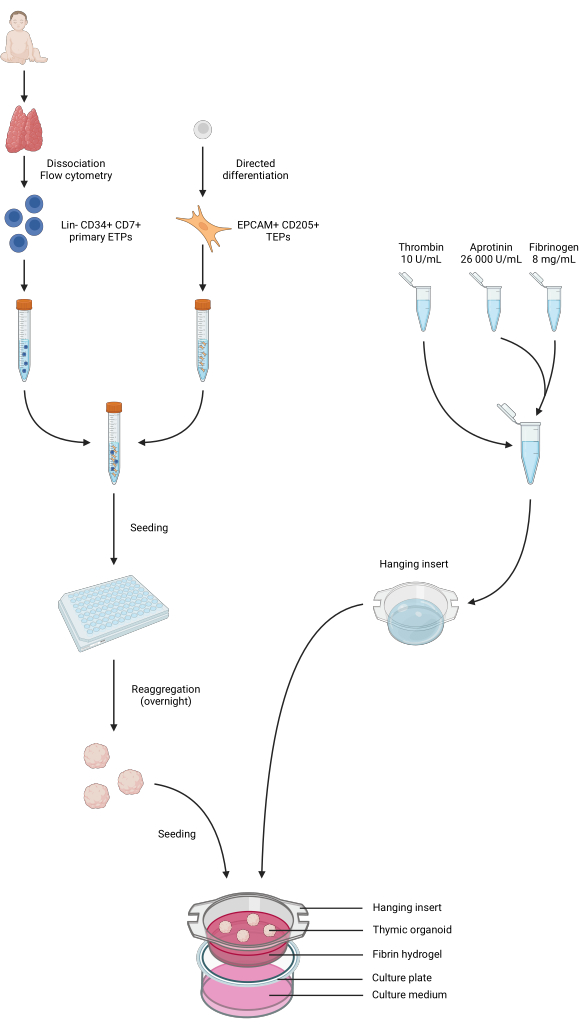
Şekil 4: Protokolün tüm adımlarının özet gösterimi. Pediatrik timus örnekleri toplanarak ayrıştırıldı ve primer Lin-CD34+ CD7+ ETP'ler akım sitometrisi ile sıralandı. iPS hücrelerinin farklılaşması bir TEP kimliğine doğru gerçekleştirildi. ETP'ler ve iPS'den türetilen TEP'ler, düşük bağlayıcı 96 oyuklu plakalarda toplandı ve tohumlandı ve gece boyunca timik organoidler halinde toplandı. Fibrin hidrojeller aprotinin, fibrinojen ve trombinden hazırlandı ve asılı eklere döküldü. Polimerizasyondan sonra, organoidler hidrojellerin üzerine ekildi ve faz 1 kültür ortamı kuyucuklara eklendi. Organoidler 6 haftaya kadar kültürde tutuldu. BioRender'da oluşturulan, yayın lisansı AG26EFCZOM. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
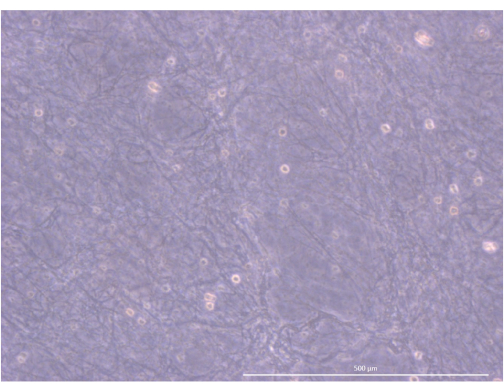
Şekil 5: Hidrojelin organizasyonu ve yapısı. Ters faz kontrast mikroskobu, 1000x. Ölçek çubuğu: 500 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
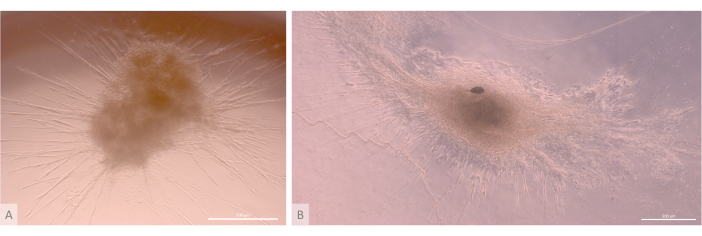
Şekil 6: Olgun organoidler ve üç boyutlu yapı. (A) 3D kültürün 24. gününde timik organoid, MIPS203.003 iPS hattı. (B) 3D kültürün 32. gününde bir timik organoidin kompozit görüntüsü, Lon71.019 iPS hattı. Ters faz kontrast mikroskobu. Ölçek çubukları: 500 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
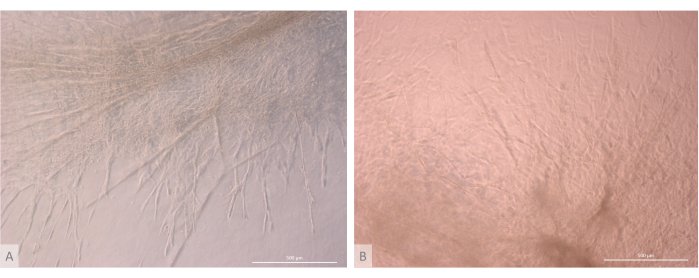
Şekil 7: Timik organoidlerin yapı detayı. (A) 3D kültürün 32. gününde timik organoid, L71.019 iPS hattı. (B) 3D kültürün 27. gününde timik organoid, L80.002 iPS hattı. Ters faz kontrast mikroskobu, 400x. Ölçek çubukları: 500 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
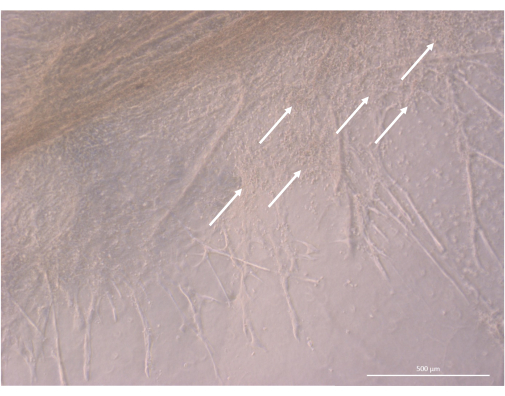
Şekil 8: 3D kültürün 32. gününde bir timik organoidin yapı detayı. Beyaz oklar, TEC hücrelerinin yakınında çoğalan küçük timosit kümelerine işaret ediyor. Ters faz kontrast mikroskobu, 400x. Ölçek çubuğu: 500 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
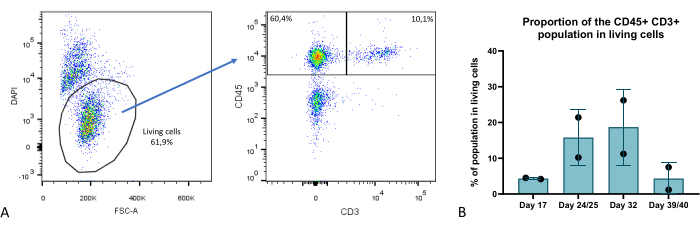
Şekil 9: Timik organoidler içindeki T hücresi bölmesinin oranı. (A) Nokta grafiği örneği, 3D kültürün 35. gününde timik organoidlerdeki canlı (DAPI-) hücreler içindeki CD45+ CD3+ hücrelerinin oranı, FlowJo 10.0.7'den görüntü. CD45+ CD3- fraksiyonu, hematopoietik timosit olmayan hücreleri içerir. (B) 3D kültürün 17, 24/25, 32 ve 39/40. günlerinde timik organoidlerdeki canlı hücreler içindeki CD45+ CD3+ hücrelerinin oranı, teknik çift veya üçlü kopyada n=2, Prism'den grafik (GraphPad sürüm 8.0.1). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| Birim | Aşama 1 orta Gün 14'ten 18. güne kadar | Aşama 2 orta Gün 19'dan itibaren | |
| Taban | XVIVO10 | XVIVO10 | |
| BMP4 Serisi | ng/mL | 50 | |
| FGF8 | ng/mL | 10 | |
| FGF10 Serisi | ng/mL | 10 | |
| IGF1 | ng/mL | 10 | |
| EGF (Türkçe) | ng/mL | 10 | |
| RÜTBE L | ng/mL | 50 | 50 |
| IL7 | ng/mL | 5 | 5 |
| FLT3 L | ng/mL | 5 | 5 |
| SCF | ng/mL | 10 | 10 |
| Glutamax (Glutamaks) | ng/mL | 1% | 1% |
Tablo 1: Takviyeler ve ilgili konsantrasyonları.
| Aprotininin (μL) | Trombin (μL) | Fibrinojen (μL) | Faz 1 ortamı | Organoidler (birim) | |
| 24 kuyulu plaka | 5 | 75 | 75 | 1 | 3 ila 5 |
| 12 oyuklu plaka | 9.2 | 138.2 | 138.2 | 1.8 | 5 |
| 6 kuyulu plaka | 16 | 240.8 | 240.8 | 3.2 | 8 ila 9 |
Tablo 2: 6, 12 ve 24 oyuklu plakalarda hidrojellerin hazırlanması ve organoidlerin tohumlanması için gerekli bileşen oranları.
Tartışmalar
2B'deki klasik tek katmanlı kültürle veya RTOC (yeniden birleştirilmiş timus organ kültürü) gibi daha gelişmiş son teknoloji 3B modellerle karşılaştırıldığında, burada tanımladığımız model önemli iyileştirmeler sunar. Teknik açıdan bakıldığında, bu model, TEC'ler kendi kendini yenileyen iPS hücrelerinden türetildiği için gelişmiş ölçeklenebilirlik ve tekrarlanabilirlik sunar. Ayrıca, TEC'lerde daha kolay knock in veya knock out çalışmaları için iPSC aşamasında gen düzenlemesine izin verir. Bu çalışmada gösterilen timik organoidlerin sağkalımı dikkat çekicidir ve 6 haftaya kadar T hücresi üretimi ile 2D veya RTOC kültürlerine kıyasla önemli bir iyileşme sağlar (Şekil 9). Bu nedenle, timik 3D yapının ve ECM özelliklerinin yeniden yapılandırılması, timik organoidlerimizde sürekli timik işlevselliğe, yani en olgun timosit bölmesinden T hücreleri üretme yeteneğine, hem CD4 + hem de CD8 + T hücrelerinin üretilmesiyle 3D kültürün yaklaşık 4. haftasında son timik göçmenlere yol açar23.
Timik mikro çevre yoğun bir genleşme ve farklılaşma aktivitesini desteklediğinden, uygun gaz değişimi herhangi bir in vitro timus modelinde çok önemli bir parametredir. Gerçekten de, zenginleştirilmiş bir dioksijen atmosferinde veya hava-sıvı arayüzlerinde21,35 tutulan modellerde daha iyi sonuçlar gözlenmiştir. Gözlemlerimiz bu noktayı desteklemekte ve hidrojelin tepesinde, hava arayüzünün hemen altında doğru bir organoid tohumlamanın önemini vurgulamaktadır. Viskoz ila sıvı hidrojellere yol açan polimerizasyondaki kusurlar, eklerin dibinde organoidlerin batmasına neden olacak ve büyümelerini engelleyecektir. Çip üzerinde endotel hücreleri ile kokültür, vaskülarizasyon ekleyerek bu engeli kırabilecek umut verici bir alternatiftir. Bu çalışmada üretilen timus organoidlerinin boyutu, iddiaya göre çekirdek alanlardaki gaz ve besin alışverişi eksikliğinden dolayı yaklaşık 5 mm ile sınırlıdır. Vaskülarizasyon böylece kültür ölçeğinin büyütülmesine izin verecek ve proses optimizasyonu ile birlikte milyonlarca TEC ve T hücresi içeren organoidlerin üretimine izin verecektir. Hidrojelin yoğunluğu da çok önemli bir parametredir ve enzimlerin donma ve çözülme döngülerine duyarlılığı göz önüne alındığında, partiler arasında tekrarlanabilirliği protokolün ana sınırlamalarından biridir. Hidrojel döküm adımı, protokolde kritik bir adımdır; Reaktif aktivitesini kontrol etmek için planlanan herhangi bir deneyden 1 saat önce bir hidrojel dökerek bir test yapmanızı öneririz. Bozulmuş polimerizasyona yol açan yetersiz enzimatik aktivite durumunda ve iPSC'den türetilmiş TEP'lerin maliyeti göz önüne alındığında, protokolü taze reaktiflerle yeniden başlatmaktan başka bir sorun giderme önermiyoruz. TEC'ler ECM'nin önemli üreticileridir; Bununla birlikte, timik fibroblastların rolünün anlaşılmasındaki son gelişmeler göz önüne alındığında, organoid modele bir ışınlanmış fibroblast popülasyonu eklemek ilginç olabilir. Bu popülasyon, TEC ve T hücresi farklılaşması ve bakımı üzerinde olumlu etkileri olan timik ortamın yeniden üretilmesine katılacak büyüme faktörlerini ve ECM'yi salgılayabilir. Bu timus organoid modelinin bir diğer önemli sınırlaması, uygun kortiko-medüller ayrımın olmamasıdır. Timusun kapsüler fibroblastlarının korteksin oluşumunu şekillendirdiği gösterildiğinden, kültür modeline eklenmeleri bu sınırlamanın ele alınmasına yardımcı olabilir. Bu nedenle, bu protokol timusun karmaşık in vitro modellerinin temelini ortaya koymaktadır. iPSC timik farklılaşması, 3D hidrojel bazlı kültürler ve in vitro lenfopoez alanlarında yapılan son gelişmeleri birleştirir. Bu model, ölçeklenebilirliği ele almak ve karmaşıklığını artırmak için, örneğin mezenkimal ve vasküler bölmeler ekleyerek daha da rafine edilebilir. Bu nedenle, bağışıklık veya kişiselleştirilmiş T hücresi bazlı hücre terapisindeki uygulamalar üzerine değerli araştırma platformlarıyla sonuçlanabilir.
Açıklamalar
Yazarlar herhangi bir çıkar çatışması olmadığını beyan ederler.
Teşekkürler
Laurent David başkanlığındaki Fransa'nın Nantes kentindeki iPSC çekirdek tesisinin üyelerine teşekkür etmek istiyoruz. Bu çalışma, JP-Nadir Hastalıklar JTC2019 programı TARID projesi (EJPRD19-208) tarafından ANR (ANR-19-RAR40011-5) tarafından M.G.'ye, RFI Bioregate hibesi (ThymIPS) ile la Région Pays de la Loire'den M.G.'ye, ANR (ANR-22-CE15-0045) tarafından M.G.'ye ve OrgaTreg'den M.G.'ye "SATT Ouest Valorisation" projesi tarafından desteklenmiştir. M.D.A. "la Fondation pour la Recherche Médicale" tarafından desteklendi. IBiSA ve Biogenouest tarafından desteklenen Nantes'ın iPSC çekirdek tesisine kaynaklarının kullanımı ve teknik desteği için teşekkür ederiz. Bu çalışma kısmen, ANR-11-LABX-0016-01 gelecek programının yatırımı yoluyla Ulusal Araştırma Ajansı tarafından desteklenen Labex IGO programı tarafından finanse edilmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Aprotinin | Sigma Aldrich | 616370 | |
| BMP4 | Miltenyi | 130-111-165 | |
| CCR7 (CD197) | BD Biosciences | PE | Clone: 3D12; Dilution: 1: 200 |
| CD14 | BD Biosciences | FITC | Clone: M5E2; Dilution: 1: 200 |
| CD19 | BD Biosciences | PE | Clone: HIB19; Dilution: 1: 200 |
| CD205 | BioLegend | FITC | Clone: MG38; Dilution: 1: 200 |
| CD3 | BD Biosciences | PE | Clone: HIT3a; Dilution: 1: 200 |
| CD34 | BD Biosciences | FITC | Clone: 8G12; Dilution: 1: 100 |
| CD4 | BD Biosciences | PE | Clone: RPA-T4; Dilution: 1: 100 |
| CD4 | BD Biosciences | BV711 | Clone: L200; Dilution: 1: 200 |
| CD45 | BD Biosciences | PerCP | Clone: HI30; Dilution: 1: 200 |
| CD56 | BD Biosciences | PE | Clone: B159; Dilution: 1: 200 |
| CD62L | BD Biosciences | BV605 | Clone: DREG-56; Dilution: 1: 200 |
| CD69 | BD Biosciences | BV510 | Clone: FN50; Dilution: 1: 200 |
| CD7 | BD Biosciences | APC | Clone: M-T701; Dilution: 1: 200 |
| CD8 | BD Biosciences | PeCy7 | Clone: RPA-T8; Dilution: 1: 200 |
| CD8 | BD Biosciences | PE | Clone: HIT8a; Dilution: 1: 200 |
| Dynabeads Pan Mouse IgG | Invitrogen | 11041 | |
| EGF | Miltenyi | 130-097-751 | |
| EPCAM (CD326) | BD Biosciences | PE | Clone: HEA-125; Dilution: 1: 200 |
| EPCAM (CD326) | Miltenyi | BV711 | Clone: EBA-1; Dilution: 1: 200 |
| FGF10 | Miltenyi | 130-127-858 | |
| FGF8 | Biotechne R&D | 423-F8 | |
| Fibrinogen | Sigma Aldrich | 341578 | |
| FLT3 L | Peprotech | AF-300-19 | |
| Glutamax | Gibco | 35050-61 | |
| IGF1 | Miltenyi | 130-093-886 | |
| IL7 | Peprotech | AF-200-07 | |
| RANK L | Biotechne R&D | 6449-TEC | |
| Red blood cell lysis solution | Miltenyi | 130-094-183 | |
| RPMI1640 | Gibco | 11875093 | |
| SCF | Peprotech | AF-300-07 | |
| Thrombin | Sigma Aldrich | 605190 | |
| TrypLE | Gibco | 2605010 | |
| XVIVO10 | Lonza | LONBE04-380Q |
Referanslar
- Starr, T. K., Jameson, S. C., Hogquist, K. A. Positive and negative selection of T cells. Annu Rev Immunol. 21, 139-176 (2003).
- Carpenter, A. C., Bosselut, R. Decision checkpoints in the thymus. Nat Immunol. 11 (8), 666-673 (2010).
- Miller, J. F. A. P. The function of the thymus and its impact on modern medicine. Science. 369 (6503), (2020).
- Haddad, R., et al. Dynamics of thymus-colonizing cells during human development. Immunity. 24 (2), 217-230 (2006).
- Cumano, A., et al. New molecular insights into immune cell development. Annu Rev Immunol. 37, 497-519 (2019).
- Bautista, J. L., et al. Single-cell transcriptional profiling of human thymic stroma uncovers novel cellular heterogeneity in the thymic medulla. Nat Commun. 12 (1), 1096 (2021).
- Kadouri, N., Nevo, S., Goldfarb, Y., Abramson, J. Thymic epithelial cell heterogeneity: TEC by TEC. Nat Rev Immunol. 20 (4), 239-253 (2020).
- Alves, N. L., et al. Serial progression of cortical and medullary thymic epithelial microenvironments. Eur J Immunol. 44 (1), 16-22 (2014).
- Baik, S., Jenkinson, E. J., Lane, P. J. L., Anderson, G., Jenkinson, W. E. Generation of both cortical and Aire+ medullary thymic epithelial compartments from CD205+ progenitors. Eur J Immunol. 43 (3), 589-594 (2013).
- Tavian, M., Peault, B. Embryonic development of the human hematopoietic system. Int J Dev Biol. 49 (2-3), 243-250 (2005).
- Abramson, J., Anderson, G. Thymic epithelial cells. Annu Rev Immunol. 35 (1), 85-118 (2017).
- Anderson, M. S., et al. Projection of an immunological self shadow within the thymus by the aire protein. Science. 298 (5597), 1395-1401 (2002).
- Sharma, H., Moroni, L. Recent advancements in regenerative approaches for thymus rejuvenation. Adv Sci. 8 (14), 2100543 (2021).
- Alenghat, F. J., Ingber, D. E. Mechanotransduction: all signals point to cytoskeleton, matrix, and integrins. Sci STKE. 2002 (119), 6 (2002).
- Pinto, S., Schmidt, K., Egle, S., Stark, H. -. J., Boukamp, P., Kyewski, B. An organotypic coculture model supporting proliferation and differentiation of medullary thymic epithelial cells and promiscuous gene expression. J Immunol. 190 (3), 1085-1093 (2013).
- Hun, M., Barsanti, M., Wong, K., Ramshaw, J., Werkmeister, J., Chidgey, A. P. Native thymic extracellular matrix improves in vivo thymic organoid T cell output, and drives in vitro thymic epithelial cell differentiation. Biomaterials. 118, 1-15 (2017).
- Asnaghi, M. A., et al. Thymus extracellular matrix-derived scaffolds support graft-resident thymopoiesis and long-term in vitro culture of adult thymic epithelial cells. Adv Funct Mater. 31 (20), 2010747 (2021).
- Villegas, J. A., et al. Cultured human thymic-derived cells display medullary thymic epithelial cell phenotype and functionality. Front Immunol. 9, 1663 (2018).
- Hauri-Hohl, M., Zuklys, S., Holländer, G. A., Ziegler, S. F. A regulatory role for TGF-β signaling in the establishment and function of the thymic medulla. Nat Immunol. 15 (6), 554-561 (2014).
- Campinoti, S., et al. Reconstitution of a functional human thymus by postnatal stromal progenitor cells and natural whole-organ scaffolds. Nat Commun. 11 (1), 6372 (2020).
- Ramos, S. A., et al. Generation of functional thymic organoids from human pluripotent stem cells. Stem Cell Reports. 18 (4), 829-840 (2023).
- Fan, Y., et al. Bioengineering thymus organoids to restore thymic function and induce donor-specific immune tolerance to allografts. Mol Ther. 23 (7), 1262-1277 (2015).
- Provin, N., et al. Combinatory differentiation of human induced pluripotent stem cells generates thymic epithelium that supports thymic crosstalk and directs dendritic- and CD4/CD8 T-cell full development. bioRxiv. 2023, 572664 (2023).
- Parent, A. V., et al. Generation of functional thymic epithelium from human embryonic stem cells that supports host T cell development. Cell Stem Cell. 13 (2), 219-229 (2013).
- Sun, X., et al. Directed differentiation of human embryonic stem cells into thymic epithelial progenitor-like cells reconstitutes the thymic microenvironment in vivo. Cell Stem Cell. 13 (2), 230-236 (2013).
- Inami, Y., et al. Differentiation of induced pluripotent stem cells to thymic epithelial cells by phenotype. Immunol Cell Biol. 89 (2), 314-321 (2011).
- Gras-Pena, R., et al. Human stem cell-derived thymic epithelial cells enhance human T cell development in a xenogeneic thymus. J Allergy Clin Immunol. 149 (5), 1755-1771 (2022).
- Lai, L., Jin, J. Generation of thymic epithelial cell progenitors by mouse embryonic stem cells. Stem Cells. 27 (12), 3012-3020 (2009).
- Ramos, S. A., et al. Generation of functional human thymic cells from induced pluripotent stem cells. J Allergy Clin Immunol. 149 (2), 767-781 (2022).
- Provin, N., Giraud, M. Differentiation of pluripotent stem cells into thymic epithelial cells and generation of thymic organoids: Applications for therapeutic strategies against APECED. Front Immunol. 13, 930963 (2022).
- Montel-Hagen, A., et al. In vitro recapitulation of murine thymopoiesis from single hematopoietic stem cells. Cell Rep. 33 (4), 108320 (2020).
- Park, J. -. E., et al. A cell atlas of human thymic development defines T cell repertoire formation. Science. 367 (6480), 3224 (2020).
- Flippe, L., et al. Rapid and reproducible differentiation of hematopoietic and T cell progenitors from pluripotent stem cells. Front Cell Dev Biol. 8, 577464 (2020).
- Padonou, F., et al. Aire-dependent transcripts escape Raver2-induced splice-event inclusion in the thymic epithelium. EMBO Rep. 23 (3), e53576 (2022).
- Han, J., Zúñiga-Pflücker, J. C. High-oxygen submersion fetal thymus organ cultures enable FOXN1-dependent and -independent support of T lymphopoiesis. Front Immunol. 12, 652665 (2021).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır