İnsan ve Fare İskelet Kası Liflerinde Mitokondriyal Solunumun Yüksek Çözünürlüklü Respirometri ile Ölçülmesi
Bu Makalede
Özet
Burada, insan veya fare kasından taze geçirgen iskelet kası liflerinde mitokondriyal oksidatif fosforilasyonu ölçmek için kapsamlı bir yöntem açıklıyoruz. Bu yöntem, mevcut mitokondriyal ağları ve membran bütünlüğünü korurken mitokondriyal solunumun gerçek zamanlı olarak ölçülmesine ve yakıt tercihinin ve metabolik esnekliğin değerlendirilmesine olanak tanır.
Özet
Hücresel enerji üretiminin temel taşı olan mitokondriyal fonksiyon, metabolik homeostazı korumak için kritik öneme sahiptir. İskelet kasındaki işlev bozukluğu, yaygın metabolik bozukluklar (örneğin, diyabet ve obezite), kas distrofileri ve sarkopeni ile bağlantılıdır. Mitokondriyal içeriği ve morfolojiyi değerlendirmek için birçok teknik olsa da, mitokondriyal fonksiyonu değerlendirmek için ayırt edici yöntem, respirometri ile mitokondriyal oksidatif fosforilasyonun (OXPHOS) ölçülmesidir. Mitokondriyal OXPHOS'un miktar tayini, mitokondriyal oksidatif enerji üretiminin ve hücresel biyoenerjetik enerjinin verimliliği hakkında bilgi sağlar. Yüksek çözünürlüklü bir respirometre, mitokondriyal oksijen tüketim oranındaki gerçek zamanlı değişiklikleri ölçerek geçirgen kas liflerinde mitokondriyal OXPHOS'un son derece hassas, sağlam ölçümlerini sağlar. İzole edilmiş mitokondrinin aksine geçirgen kas liflerinin kullanılması, mitokondriyal ağları korur, mitokondriyal zar bütünlüğünü korur ve nihayetinde fizyolojik olarak daha ilgili ölçümlere izin verir. Bu sistem aynı zamanda yakıt tercihinin ve metabolik esnekliğin ölçülmesine de izin verir - kas enerjisi metabolizmasının dinamik yönleri. Burada, yüksek çözünürlüklü bir respirometre kullanarak insan ve fare iskelet kası liflerinde mitokondriyal OXPHOS ölçümleri için kapsamlı bir kılavuz sunuyoruz. İskelet kası grupları, mitokondriyal yakıt tercihleri ve biyoenerjetik değerleri bakımından farklılık gösteren farklı lif tiplerinden oluşur. Yüksek çözünürlüklü bir respirometre kullanarak, yakıt tercihini ve metabolik esnekliği lif tipine bağlı bir şekilde değerlendirmek için hem aerobik glikolitik hem de yağ asidi substratlarını değerlendirmek için yöntemler açıklıyoruz. Protokol çok yönlüdür ve hem insan hem de kemirgen kas liflerine uygulanabilir. Amaç, kas sağlığı için önemli olan bir organel hakkındaki anlayışımızı geliştirecek olan mitokondriyal fonksiyon değerlendirmelerinin tekrarlanabilirliğini ve doğruluğunu artırmaktır.
Giriş
Mitokondri, hücresel enerji üretiminin temel taşıdır ve onları optimal hücresel ve organizma homeostazını sürdürmek için vazgeçilmez kılar. Bu çift zarlı organeller öncelikle oksidatif fosforilasyondan sorumludur. Bu işlem, şekerler ve yağ asitleri gibi besinleri, enerji için hücresel para birimi olan adenozin trifosfata (ATP) verimli bir şekilde dönüştürür. Mitokondri, enerji metabolizmasındaki rollerinin ötesinde, apoptoz, kalsiyum homeostazı ve reaktif oksijen türleri (ROS) dahil olmak üzere çeşitli hücresel süreçlerin de anahtar düzenleyicileridir1,2. Hücresel ve organizma homeostazının korunmasındaki önemli rolleri nedeniyle, mitokondriyal fonksiyondaki bozulmalar genellikle doku ve organizma sağlığı üzerinde zararlı etkilere sahiptir. İskelet kasında mitokondriyal disfonksiyon, metabolik bozukluklar (örneğin obezite, diyabet ve kardiyovasküler hastalık), sarkopeni ve kas distrofisi 3,4,5,6,7,8 dahil olmak üzere çok sayıda hastalık durumuyla ilişkilidir.
Mitokondriyal disfonksiyon öncelikle değişmiş mitokondriyal içerik, sayı ve morfolojinin yanı sıra bozulmuş metabolizma olarak ortaya çıkabilir. Bu nedenle, mitokondriyal disfonksiyonun kapsamlı bir şekilde anlaşılması, bütünleştirici ve bütüncül bir yaklaşım gerektirir. İlk karakterizasyon çalışmaları, mitokondriyal içeriğin bir okuması olarak solunum zinciri protein komplekslerinin ekspresyon seviyelerinin incelenmesini, mitokondriyal biyogenezin bir ölçüsü olarak mitokondriyal DNA'nın ve biyogenez belirteçlerinin ölçülmesini ve mitokondriyal morfolojiyi değerlendirmek için sofistike elektron mikroskobu görüntülemeyi içerir 9,10. Mitokondriyal fonksiyonun ek değerlendirmeleri, hücresel ROS ve ATP üretiminin ve mitokondriyal membran potansiyelinindeğerlendirilmesini içerir 9.
Mitokondri, hücresel enerji üretimi ve homeostaz için gerekli olduğundan, mitokondriyal fonksiyonu değerlendirmenin ayırt edici özelliği, mitokondriyal oksidatif fosforilasyonu (OXPHOS) ölçmektir. Geçirgenleştirilmiş kas liflerinin yüksek çözünürlüklü respirometrisi, mitokondriyal OXPHOS solunum zinciri aktivitesindeki dinamik değişiklikler için bir okuma olarak mitokondriyal oksijen tüketim oranındaki gerçek zamanlı değişikliklerin ölçülmesine izin verir 9,11,12. Seçici kimyasal modülatörlerin ve inhibitörlerin uygulanması, farklı solunum komplekslerinin aktivitesini doğrudan ve sıralı olarak ölçmeye izin verir. İzole mitokondri respirometride kullanılabilse de, taze, geçirgen kas liflerinin kullanılması endojen mitokondriyal ağları ve membran bütünlüğünü korur - böylece fizyolojik olarak daha ilgili ölçümlere izin verir. Ek olarak, farklı kas lifi türleri farklı substrat tercihlerine ve solunum oranlarına sahip olduğundan, bu sistem, lif tipi13'e dayalı olarak yakıt tercihi ve metabolik esneklikteki değişikliklerin ölçülmesine izin verir.
Burada, yüksek çözünürlüklü bir respirometre sisteminde insan veya fare iskelet kası liflerini kullanarak mitokondriyal OXPHOS ölçümleri için kapsamlı bir protokol açıklıyoruz. Substrat olarak piruvat veya palmitoil-karnitin kullanılarak oksidatif veya glikolitik liflerde mitokondriyal oksijen solunumunu ölçmek için yöntemler dahildir. Bu protokol, substrat kullanımı ve yakıt tercihindeki kusurlarla ilgili belirli metabolik soruları ele almak için diğer yakıt substratlarının kullanılmasına izin verir.
Protokol
Tüm fare prosedürleri Washington Üniversitesi Kurumsal Hayvan Bakımı ve Kullanımı Komitesi tarafından onaylandı. Herhangi bir cinsiyet, yaş ve ağırlıktaki fareler bu deneyler için kullanılabilir ve ele alınmaya çalışılan deneysel sorunun doğasına bağlı olacaktır. Burada kullanılan fareler yetişkin (12-16 haftalık), erkek vahşi tip C57BL / 6 farelerdir. Tüm insan prosedürleri Washington Üniversitesi Kurumsal İnceleme Kurulu tarafından onaylandı. Veri kullanımına izin verilen çalışma denekleri ve bu protokolde yer alan temsili insan denek verileri yayınlanmış bir çalışmadanalınmıştır 14. Buradaki veriler diyabetik olmayan menopoz sonrası (55-75 yaş) kadınlardan alınmıştır. Tahlil için gerekli reaktiflerin hazırlanmasına ilişkin detaylar Tablo 1'de sunulmuştur. Tahlilde kullanılan spesifik reaktifler, aletler ve makineler hakkındaki bilgiler Malzeme Tablosunda listelenmiştir. Protokolün şematik bir genel bakışı Şekil 1'de sunulmuştur.
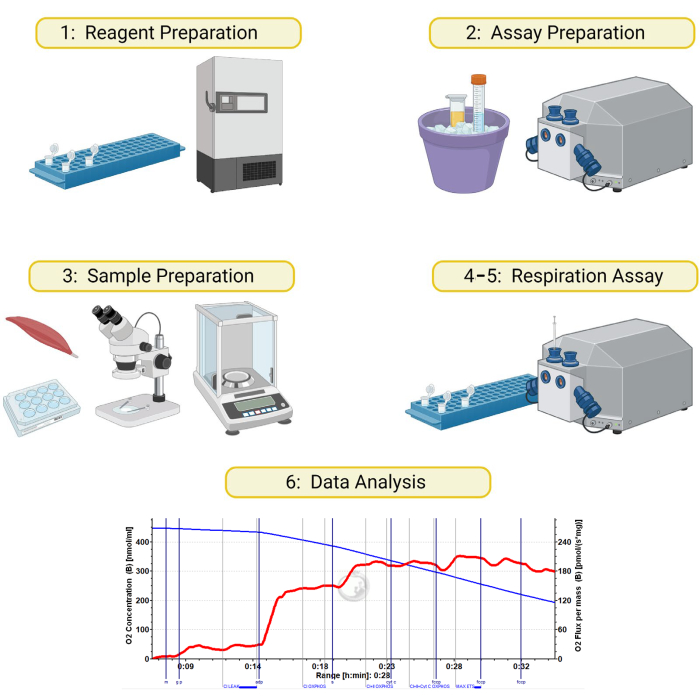
Şekil 1: Geçirgenleştirilmiş iskelet kası örneklerinde yüksek çözünürlüklü respirometri şeması.Bu yazıda ayrıntılı olarak açıklanan yöntem 6 bölüme ayrılmıştır: 1) solunum tamponlarının ve reaktiflerinin hazırlanması, 2) test gününde alet ve reaktif hazırlanması, 3) kas örneklerinin hazırlanması ve geçirgenliği, 4) numune ve alet hazırlama, 5) solunum testinin çalıştırılması ve 6) veri analizi. Şununla oluşturuldu BioRender.com Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
1. Tahlil hazırlama ve cihaz kalibrasyonu
- Tahlil gününde, her bir solunum bileşiğinin (blebbistatin, palmitoil-karnitin, glutamat, malat, ADP, süksinat, sitokrom C, FCCP) gerekli sayıda alikotunu çıkarın ve buz üzerinde çözdürün. BIOPS ve MiR05 şişelerini buz üzerinde çözdürün.
- Sabunin ve piruvat çözeltilerini Tablo 1'de belirtildiği gibi hazırlayın. Tablo 05'deki gibi MiR1'in çalışan bir çözümünü hazırlayın. Alet başına (2 oda) 5 mL MiR05 çalışma çözeltisi hazırlayın. Gerektiği gibi ölçeklendirin.
- Yüksek çözünürlüklü respirometri sistemini ve vakum sistemini açın. Tıpaları çıkarın,% 70 etanol depolama çözeltisini vakumla çıkarın ve hazneyi ultra saf moleküler derece H2O ile doldurun. H2O'yu vakumla çıkarın ve yeniden doldurun. Toplam 3 yıkama için tekrarlayın. Son yıkamadan sonra, her odaya 2 mL MiR05 (kreatin veya blebbistatin olmadan) ekleyin.
- Respirometri yazılımını açın. Yazılım başlatıldıktan sonra, cihaz ayarları için bir açılır kutu açılacaktır. Hazne karıştırma hızını 750 rpm'ye, sıcaklığı 37 °C'ye ve veri kayıt aralığını 2 s'ye ayarlayın. Oksijen sensörleri için kazancı 1'e ve polarizasyon voltajını 800 mV'a ayarlayın. Cihazla iletişim kurmak için Oxygraph'a Bağlan'a tıklayın.
- İletişim kurulduktan sonra, deney dosyasını adlandırmak ve kaydetmek için bir iletişim kutusu açılacaktır. Dosyayı geçerli tarih ve kalibrasyon ile kaydedin. Dosyayı kaydettikten sonra, deneysel ayrıntılar için bir açılır iletişim kutusu görünecektir. Kalibrasyon çalışması için herhangi bir bilgiye gerek yoktur ve kutu kapatılabilir.
- Odaların ısınmasına izin vermek ve hava kalibrasyonu sinyallerini kaydetmek için oksijen konsantrasyonunu en az 30 dakika boyunca kaydedin. Bu, aşağıdaki 2. adımda ayrıntılı olarak açıklandığı gibi kas lifleri hazırlanırken yapılabilir.
- Kalibrasyon periyodunun sonunda, oksijen konsantrasyonunun (mavi çizgi) sabit olduğu bölge boyunca bir kalibrasyon bölgesi işaretleyin. Bunu yapmak için, Shift tuşunu ve Sol Fare düğmesini basılı tutun ve zaman çizelgesinde bir bölge boyunca sürükleyin.
- Oxygraph > O2 Kalibrasyonu'na giderek kalibrasyon penceresini açın. Hava Kalibrasyonu için, adım 1.8'de oluşturulan işareti seçin. Kalibre Et ve Panoya Kopyala'yı tıklayın.
- Kalan oda için 1.6-1.8 adımlarını tekrarlayın. Günlük hava kalibrasyonu yapın. Hava kalibrasyonu kaydını durdurun ve filecihazla bağlantıyı keserek. Numuneler hazır olduktan sonra, testi gerçekleştirmek için 3. adıma geçin.
2. İskelet kası liflerinin toplanması ve geçirgenliği
- Fare dokusu izolasyonu
- Analiz edilecek her numune için, 12 oyuklu bir kültür kabının bir kuyusunu 1 mL BIOPS ile doldurun. Soğuması için tabağı buzun üzerine koyun.
- Fareyi karbondioksit inhalasyonu ve ardından servikal çıkık ile ötenazi yaptıktan sonra, tüm bağ dokusunu ve yağı çıkardığınızdan emin olarak ilgilenilen iskelet kasını hasat edin (Şekil 2A). Kası, BIOPS içeren kuyucuklardan birine yerleştirin. Lif hazırlanana kadar buzun üzerine koyun.
NOT: Herhangi bir iskelet kası bu protokol kullanılarak incelenebilir - incelenen kas tipi, ele alınmaya çalışılan deneysel soruya bağlı olacaktır. Gastroknemius gibi karışık lif tiplerine sahip iskelet kasları söz konusu olduğunda, ağırlıklı olarak hızlı seğirme (beyaz bölümler) ve ağırlıklı olarak yavaş seğirme (kırmızı bölümler) liflerini ölçmek için dokuyu beyaz ve kırmızı bölümlere ayırmak mümkündür (Şekil 2B).
- İnsan doku izolasyonu
- Klinik protokole uygun olarak doku toplayın14. Dokuyu soğuk, steril PBS ile hızlı bir şekilde durulayın ve 2 mL BIOPS solüsyonu içeren konik bir tüpe yerleştirin. Lif hazırlanana kadar dokuyu buz üzerinde tutun.
- Elyaf hazırlama
- Permeabilizasyon, 6 oyuklu bir doku kültürü plakasında gerçekleşecektir. Bir kuyucuk setine 2 mL BIOPS çözeltisi ve başka bir kuyucuk setine 2 mL MiR05 ekleyin. Tahlil edilen her numune için bir set kuyu gerekli olacaktır.
- Buzlu bir tepsi hazırlayın ve buzun üzerine baş aşağı bir cam Petri kabı yerleştirin. Kası her zaman buz üzerinde tuttuğunuzdan emin olun.
- Toplanan kas örneklerini forseps kullanarak soğutulmuş Petri kabı platformuna aktarın. İki ince uçlu forseps ve ışık kaynaklı bir diseksiyon mikroskobu kullanarak, kasa bağlı tendonları, fasyaları ve yağ dokusunu çıkararak dokuyu nazikçe temizleyin.
- Tüm yabancı kas dışı dokular çıkarıldıktan sonra, kas liflerini, uzunlukları 0.75 - 1.0 mm arasında değişen küçük yarı saydam lif demetleri olana kadar ince uçlu forseps ile nazikçe ayırın (Şekil 2C-D). Lifleri ayırdıktan sonra, lif demetlerini buz üzerinde BIOPS çözeltisi içeren 6 oyuklu plaka üzerindeki bir kuyuya aktarmak için forsepsleri kullanın.
- Her bir BIOPS kuyucuğuna 20 μL 5 mg / mL saponin çözeltisi ekleyin ve 20 dakika boyunca soğuk bir odada hafifçe sallanırken plakayı buz üzerinde inkübe edin.
- Saponin tedavisinden sonra, testten önce durulamak için kas liflerini MiR05 içeren kuyucuğa aktarın. 15 dakika boyunca soğuk bir odada hafifçe sallanırken buz üzerinde kuluçkaya yatırın.
- MiR05'teki lif inkübasyonu tamamlandıktan sonra, lifleri keskin forsepslerle toplayın ve kas liflerini bir görev mendili üzerinde nazikçe kurulayın. 1.5 mL'lik bir plastik mikrosantrifüj tüpünü ince bir teraziye darayın ve tüpe 2-3 mg lif yerleştirin. Her tüpün yan tarafındaki son lif ağırlığını kaydedin. Tüpü buzun üzerine yerleştirin. Diğer örneklerle tekrarlayın. Hemen 3. adıma geçin.
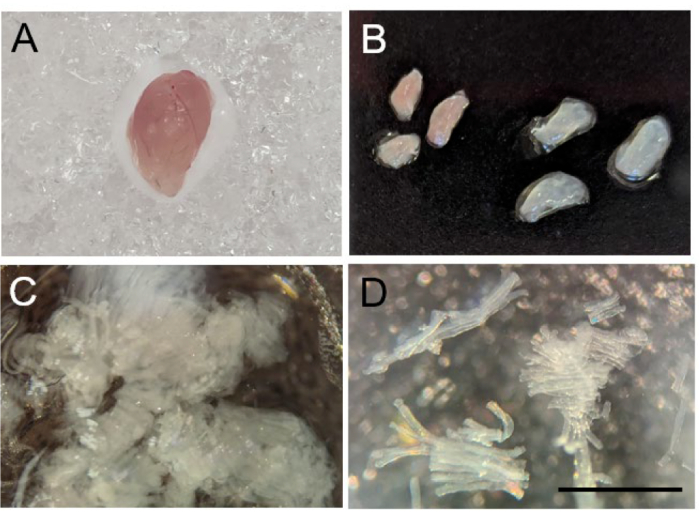
Şekil 2: Fare iskelet kası liflerinin ayrılması. (A) Hasattan sonra fare gastroknemiusunun brüt morfolojisi. (B) Gastroknemius'un kırmızı (sol) ve beyaz (sağ) segmentlere diseksiyonu. (C) Mekanik olarak ayrılmış kas lifleri. (D) Başarıyla ayrılmış kas liflerinin 10x görüntüsü. Ölçek çubuğu 1 mm'dir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
3. Respirometrede kas örneklerinin hazırlanması
- Yukarıdaki 05. adımda ayrıntılı olarak açıklandığı gibi cihaz kalibrasyonu için kullanılan MiR1'i vakumlayın ve her odaya 2.1 mL çalışan MiR05 çözeltisi ekleyin.
- Adım 1.5'te ayrıntılı olarak açıklandığı gibi aynı cihaz ayarlarını kullanarak deney için yeni bir dosya başlatın. üstünde. Dosya adını ve kaydetme ayarlarını yapın.
- Dosya adını ayarladıktan sonra, bir sonraki ekran iletişim kutusu belirli deneysel ayrıntılar için olacaktır. Numune bilgilerini ve her hazneye eklenen her numunenin ağırlığını girin. İletişim kutusunu kapatın.
- Yeni deney dosyasına girdikten sonra, O2 Kalibrasyon penceresini açarak kalibrasyonu ayarlayın. Dosyadan kopyala'ya tıklayın ve adım 1.9'da kaydedilen dosyayı seçin. üstünde. Tıkla Kalibre Et ve Panoya Kopyala düğmesine basın. Kalan oda için işlemi tekrarlayın.
- İnce forseps kullanarak, kas lifi demetlerini uygun oda için solunum çözeltisine dikkatlice aktarın. Kalan oda için tekrarlayın.
- Tıpaları haznenin üzerine yerleştirin ve tıpaları dibe doğru yarıya kadar iterek hazneyi dikkatlice yarı kapatın. Tıpalardaki o-ringler hazne duvarına geçtiğinde ve direnç oluştuğunda, kapatmak için aşağı iterken bir döndürme hareketi kullanın. Hazne yarıya kadar kapatıldığında, haznenin üst kısmında küçük bir hava kabarcığı görülebilir.
NOT: Geçirgen lifler, normal solunum koşulları altında oksijen difüzyon sınırlamalarına tabidir. Bu sınırlamayı aşmak için, test yüksek oksijen konsantrasyonları11 altında gerçekleştirilir. - 10 mL'lik bir plastik şırıngayı bir oksijen tankından saf oksijenle doldurun. Aletle birlikte verilen uzun, keskin olmayan iğneyi şırınganın üzerine yerleştirin. İğneyi ilk hazneye yerleştirin ve hazneye yavaşça yaklaşık 1 mL oksijen verin.
- Respirometri yazılımında oda oksijen konsantrasyonunu izleyin. Hazne oksijen konsantrasyonu 350-400 nmol/mL'ye ulaştığında, hazneyi tamamen kapatmak için aşağı iterken durdurucuyu hafifçe çevirin. Hazneye bakın ve hava kabarcığı kalmadığından emin olun. Bir hava kabarcığı varsa, hazneyi dikkatlice ve hızlı bir şekilde yeniden açın, 100 μL ek çalışma MiR05 solüsyonu ekleyin ve hazneyi hızlı bir şekilde tekrar kapatın. Kalan odacıklarla tekrarlayın.
- Test sırasında oksijen konsantrasyonları 250 nmol / mL'nin üzerinde tutulmalıdır. Hazneyi kısmen açarak, şırıngadan hava kabarcığına daha fazla oksijen ekleyerek ve hazneyi tekrar dikkatlice kapatarak gerektiği kadar ilave oksijen ekleyin.
- Oksijen akışı verilerini deney için kullanılan doku kütlesine göre normalleştirin. Grafikleri ayarlamak için düzeni O2 Akısını (pmol O2 / (s x mg)) yansıtacak şekilde değiştirin. Düzen menüsünden, 06 - Birim Örneği Başına Özgül Akı düzenini seçin. Veriler şimdi her odadaki doku miktarına göre normalleştirilmiş olarak sunulacaktır.
4. Yüksek çözünürlüklü respirometri
- Oksijen (mavi çizgi) konsantrasyonu veO2 akısı (kırmızı çizgi) oksijen ilavesini takiben stabilize olduğunda, solunum protokolüne başlayın. Mavi çizgi düz olduğunda veya yavaş yavaş azaldığında oksijen stabil olarak kabul edilebilir. O2 akısı da düz olmalı ve 5 pmol O2 / s x mg içinde olmalıdır.
- Cam şırıngalar kullanarak tüm reaktifleri ekleyin. Alt tabakalar, inhibitörler ve birleştiriciler için aynı şırıngayı kullanmamak önemlidir. Her biri için ayrı bir şırınga bulundurun. Her bir bileşiği ekledikten sonra, bir sonraki reaktifi eklemeden önce solunum hızı stabilize olduktan sonra 1-2 dakika boyunca oksijen akışını kaydedin.
- Solunum ölçümü
- 10 μL'lik bir cam şırınga kullanarak, her odaya 2,5 μL 0,8 M malat ekleyin. Zaman çizelgesini işaretlemek için F4 tuşuna basın ve işareti M ile etiketleyin. 1-2 dakika boyunca sabit O2 akısını kaydedin.
- Aşağıda açıklandığı gibi besine özgü reaktifler ekleyin.
- Aerobik Glikolitik: 10 μL'lik bir cam şırınga kullanarak, her odaya 10 μL 2 M glutamat ve 5 μL 2 M piruvat ekleyin. Zaman çizelgesini işaretlemek için F4 tuşuna basın ve işareti G P ile etiketleyin. 1-2 dakika boyunca sabit O2 akısını kaydedin.
- Yağ asidi: 10 μL'lik bir cam şırınga kullanarak, her odaya 10 μL 2 M glutamat ve 10 μL 10 mM palmitoil-karnitin ekleyin. Zaman çizelgesini işaretlemek için F4 tuşuna basın ve işareti G PC ile etiketleyin. 1-2 dakika boyunca sabit O2 akısını kaydedin.
- 25 μL'lik bir cam şırınga kullanarak, her odaya 20 μL 0.5 M (MgCl2 ile) ADP ekleyin. Zaman çizelgesini işaretlemek için F4 tuşuna basın ve işareti ADP ile etiketleyin. 1-2 dakika boyunca sabit O2 akısını kaydedin.
- 25 μL'lik bir cam şırınga kullanarak, her odaya 20 μL 1 M süksinat ekleyin. Zaman çizelgesini işaretlemek için F4 tuşuna basın ve işareti S ile etiketleyin. 1-2 dakika boyunca sabit O2 akısını kaydedin.
- 10 μL'lik bir cam şırınga kullanarak, her odaya 5 μL 4 mM Sitokrom C ekleyin. Zaman çizelgesini işaretlemek için F4 tuşuna basın ve işareti Cyt C ile etiketleyin. 2-1 dakika boyunca sabit O2 akısı kaydedin.
- 10 μL'lik bir cam şırınga kullanarak 1 mM FCCP'lik üç adet 1 μL bolus halinde titre edin. FCCP eklenirken genellikleO2 akı seviyelerinde kısa bir azalmaya neden olan bir karıştırma etkisi vardır. Bir sonraki adıma geçmeden önce O2 akısının artmasını ve stabilize olmasını bekleyin. Zaman çizelgesini işaretlemek ve FCCP ile işaretlemek için her eklemeden sonra F4 tuşuna basın. Her eklemeden sonra 1 dakika boyunca kararlı O2 akısını kaydedin.
- Solunum testi tamamlandığında, yukarı doğru çevirerek ve çekerek tıpaları nazikçe çıkarın. Hazneleri 3 kez bir fışkırtma şişesinden ultra saf H2O ile, ardından bir fışkırtma şişesinden% 3 etanol ile 70 kez durulayın. Son etanol durulamasından sonra, saklama için hazneleri %70 etanol ile doldurun.
- Direnç hissedene kadar tıpaları odalara yerleştirin. Tıpaları tamamen kapatmayın. Kapakları tıpaların üzerine yerleştirin, tahlil dosyasını kaydedin ve cihazı Respirometri yazılımından ayırın. Enstrümanı kapatın.
5. Veri analizi
- Analiz dosyasını respirometri yazılımında açın. Solunum bileşiklerinin enjeksiyonundan sonra elde edilen stabil oksijen akışı bölgelerinden veri çıkarın.
- İlgilenilen bölgeleri işaretlemek için Shift tuşunu basılı tutun, Sol fare düğmesine tıklayın ve aşağıda ayrıntıları verilen tahlil aşamaları için kutuyu sabit O2 akı hızı bölgesi boyunca sürükleyin.
- Tahlil aşamaları 14,15,16,17,18,19,20
- Malat/glutamat/piruvat (aerobik glikolitik protokol) veya malat/glutamat/palmitoil-karnitin (yağ asidi protokolü) eklendikten sonra zaman çizelgesini işaretleyin. Bu oran, Kompleks I Durum 2 solunum (LEAK(n)) oranını temsil eder.
- ADP'nin eklenmesinden sonra zaman çizelgesini işaretleyin. Bu oran, Kompleks I Durum 3 solunum (CI OXPHOS) hızını temsil eder.
- Süksinat eklendikten sonra zaman çizelgesini işaretleyin. Bu oran, Kompleks I+II Durum 3 solunum (CI+II OXPHOS) hızını temsil eder.
- Sitokrom C'yi ekledikten sonra zaman çizelgesini işaretleyin. Bu oran Kompleks I+II+Sitokrom Durum 3 solunum (CI+II+Cyt C, OXPHOS) hızını temsil eder.
- FCCP titrasyonu için zaman çizelgesini en yüksek O2 akı hızıyla işaretleyin. Bu oran Maksimum Solunum Hızını (MAX ETS) temsil eder.
- İstatistik İşaretle'yi seçerek zaman çizelgesinde işaretli bölgeler için veri değerlerini alın > İşaretli oda için O2 Akı oranını (pmol O2/(s x mg)) bir elektronik tabloya kopyalayın.
- Ek bölmeler için işaretleme ve veri çıkarma işlemlerini tekrarlayın.
- Kompleks I+II Durum 3'ü (süksinat ilavesini takiben) Kompleks I Durum 2'ye (ADP ilavesinden önce) bölerek solunum kontrol oranını (RCR) hesaplayın.
Temsili Sonuçlar
Şekil 3 ve Şekil 4 , uygun şekilde hazırlanmış murin kırmızısı ve beyaz gastroknemius kas lifleri için sırasıyla aerobik glikolitik ve yağ asidi respirometri protokollerinin oksijen grafiklerini göstermektedir. Ayrıca referans için temsili niceliksel sonuçlar da gösterilmiştir. Şekil 5 , uygun şekilde hazırlanmış insan kas biyopsi örneklerinde aerobik glikolitik respirometrinin oksijen grafiğini göstermektedir. Temsili niceliksel sonuçlar da gösterilir. Şekil 3, Şekil 4 ve Şekil 5 için, ADP ilavesinden sonra Sitokrom C ilavesinin oksijen akışı üzerinde bir etki yaratmadığını, bu da numunenin dış mitokondriyal zarının sağlam olduğunu gösterir. Şekil 6 , ADP'den sonra Sitokrom C ilavesinin oksijen akışında bir ani artış (%40 artış) ile sonuçlandığı, dış mitokondriyal zarın hasar gördüğünü ve bu nedenle numunenin respirometri için kullanılmaması gerektiğini gösteren aerobik glikolitik respirometrinin bir oksijen grafiğini göstermektedir - bu sonucun olası nedenleri dokunun uygun olmayan şekilde kullanılması veya donması/çözülmesi olabilir, dokunun geçirgenliğini uzatmak ve taze izole edilmiş doku kullanmamak.
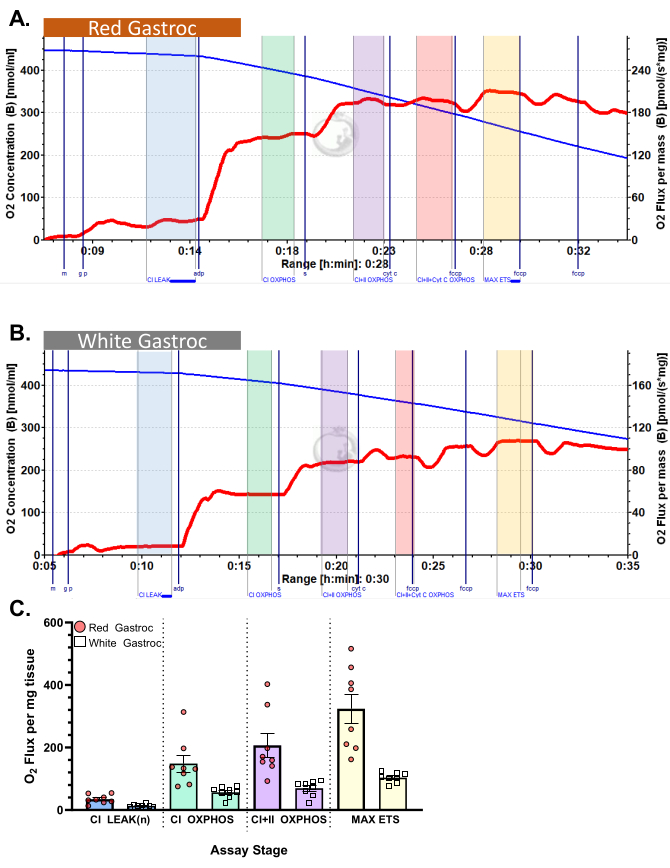
Şekil 3: Farede oksijen tüketimi. Sonuçlar, piruvat protokolü kullanılarak (A) kırmızı ve (B) beyaz gastroknemius cinsinden oksijen tüketimini göstermektedir. Malat, glutamat ve piruvat ilavesini takiben durum 2 akısı (mavi gölge, CI LEAK). ADP uygulamasından (yeşil gölge, CI OXPHOS) sonraO2 tüketiminde önemli bir uyarılma gözlenirken, süksinat (mor gölge, CI + II OXPHOS) ilavesinden sonra solunum daha da artar. Sitokrom C, dış mitokondriyal zarın sağlam olduğunu gösteren önemli bir artışa (%<15) neden olmadı (turuncu gölge, CI+II+Cyt C OXPHOS). Mitokondri, FCCP (sarı gölge, MAX ETS) ilavesini takiben ayrılır. Mavi çizgi, kapalı bir odadaki oksijen konsantrasyonunu temsil eder. Kırmızı çizgi, oksijen tüketim oranını (O2 akısı) temsil eder. Eklenen bileşikler: Malat (m), Glutamat (g), Pirüvat (p), Adenozin Difosfat (ADP), Sitokrom C (cyt c), Karbonil siyanür-p-triflometoksifenilhidrazon (FCCP). (C) Çubuk grafik temsili sonuçları yansıtır (n=8). Veriler ± SEM olarak temsil edilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
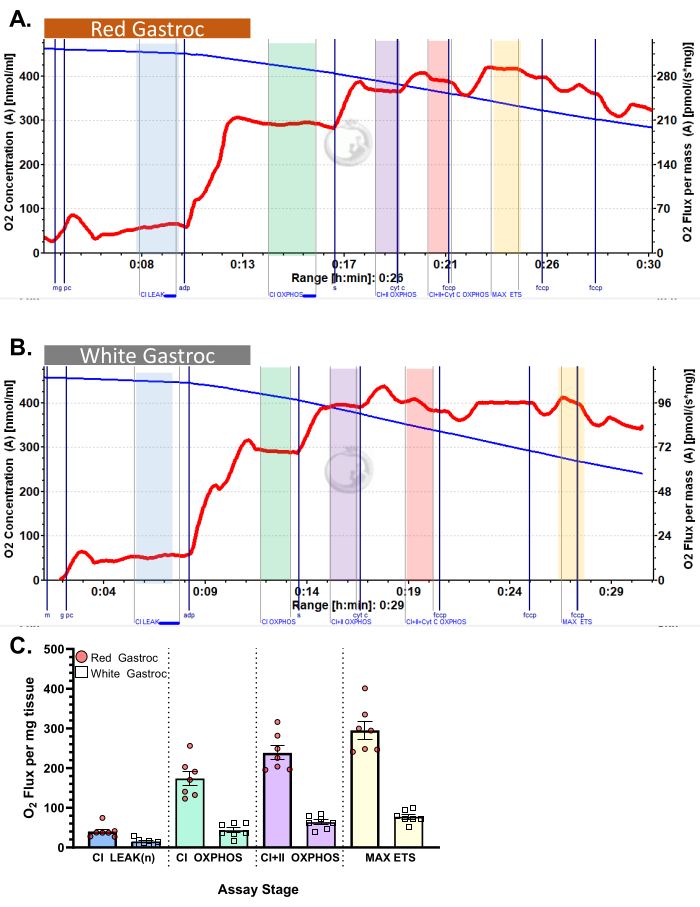
Şekil 4: Farede oksijen tüketimi. Sonuçlar, palmitoil-karnitin protokolü kullanılarak (A) kırmızı ve (B) beyaz gastroknemius cinsinden oksijen tüketimini göstermektedir. Malat, glutamat ve palmitoil karnitin (mavi gölge, CI LEAK) ilavesini takiben durum 2 akısı. ADP uygulamasından (yeşil gölge, CI OXPHOS) sonraO2 tüketiminde önemli bir uyarılma gözlenirken, süksinat (mor gölge, CI + II OXPHOS) ilavesinden sonra solunum daha da artar. Sitokrom C, dış mitokondriyal zarın sağlam olduğunu gösteren önemli bir artışa (%<15) neden olmadı (turuncu gölge, CI+II+Cyt C OXPHOS). Mitokondri, FCCP (sarı gölge, MAX ETS) ilavesini takiben ayrılır. Mavi çizgi, kapalı bir odadaki oksijen konsantrasyonunu temsil eder. Kırmızı çizgi, oksijen tüketim oranını (O2 akısı) temsil eder. Eklenen bileşikler: Malat (m), Glutamat (g), Palmitoil Karnitin (pc), Adenozin Difosfat (ADP), Sitokrom C (cyt c), Karbonil siyanür-p-triflorometoksifenilhidrazon (FCCP). (C) Çubuk grafik temsili sonuçları yansıtır (n=7). Veriler ± SEM olarak temsil edilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
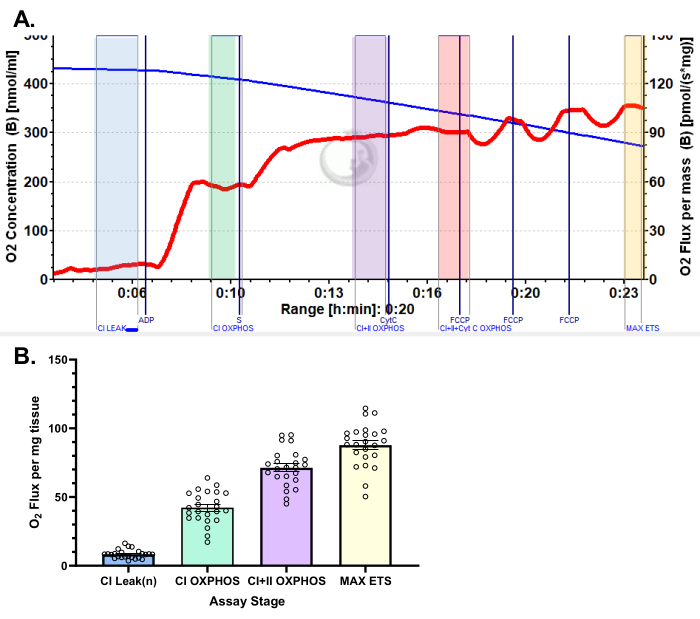
Şekil 5: Piruvat protokolü kullanılarak insan vastus lateralisinde oksijen tüketimi için temsili sonuçlar. (A) Malat, glutamat ve piruvat ilavesini takiben durum 2 akısı (mavi gölge, CI SIZINTISI). ADP uygulamasından (yeşil gölge, CI OXPHOS) sonraO2 tüketiminde önemli bir uyarılma gözlenirken, süksinat (mor gölge, CI + II OXPHOS) ilavesinden sonra solunum daha da artar. Sitokrom C, dış mitokondriyal zarın sağlam olduğunu gösteren önemli bir artışa (%<15) neden olmadı (turuncu gölge, CI+II+Cyt C OXPHOS). Mitokondri, FCCP (sarı gölge, MAX ETS) ilavesini takiben ayrılır. Mavi çizgi, kapalı bir odadaki oksijen konsantrasyonunu temsil eder. Kırmızı çizgi, oksijen tüketim oranını (O2 akısı) temsil eder. Eklenen bileşikler: Malat (m), Glutamat (g), Pirüvat (p), Adenozin Difosfat (ADP), Sitokrom C (cyt c), Karbonil siyanür-p-triflometoksifenilhidrazon (FCCP). (B) Çubuk grafik, vastus lateralis biyopsilerinden elde edilen temsili sonuçları yansıtır (n = 24). Veriler ± SEM olarak temsil edilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
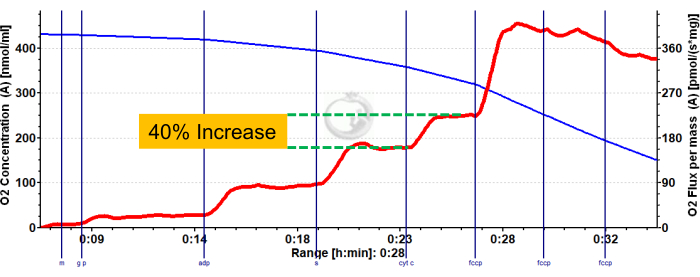
Şekil 6: Fare kırmızı gastroknemiusunda dış mitokondriyal membran bütünlüğünün bozulduğunu gösteren temsili sonuç. Malat, glutamat ve piruvat ilavesini takiben durum 2 akısı (mavi gölge, CI LEAK). ADP uygulamasından (yeşil gölge, CI OXPHOS) sonraO2 tüketiminde önemli bir uyarılma gözlenirken, süksinat (mor gölge, CI + II OXPHOS) ilavesinden sonra solunum daha da artar. Sitokrom C,O2 tüketiminde önemli bir artışa (%>15) neden oldu ve bu da dış mitokondriyal zarın hasar gördüğünü gösterdi. Mavi çizgi, kapalı bir odadaki oksijen konsantrasyonunu temsil eder. Kırmızı çizgi, oksijen tüketim oranını (O2 akısı) temsil eder. Eklenen bileşikler: Malat (m), Glutamat (g), Pirüvat (p), Adenozin Difosfat (ADP), Sitokrom C (cyt c), Karbonil siyanür-p-triflometoksifenilhidrazon (FCCP). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tablo 1: Solunum bileşiklerinin ve solunum çözeltilerinin reaktif hazırlanması. Nihai stok konsantrasyonları ve bunların nasıl hazırlanacağı ve saklanacağı da dahil olmak üzere, tahlil için gerekli reaktiflerin hazırlanmasına yönelik ayrıntılar sunulmaktadır. Bu Tabloyu indirmek için lütfen buraya tıklayın.
Tartışmalar
Bu protokol, hem insan hem de fare örnekleri için geçirgen iskelet kası liflerinde mitokondriyal fonksiyonu değerlendirmek için kapsamlı ve basit bir şablon protokolü sağlar. İzole mitokondri yerine geçirgen lifler kullanmanın çeşitli avantajları vardır. Önemli bir avantaj, geçirgenleştirilmiş liflerin kullanımının küçük (2-5 mg) miktarda doku gerektirmesidir, bu da bu yöntemi hem insan kas biyopsi örnekleri hem de fare kası için uygun hale getirir. İzole mitokondriye göre bir başka avantaj, hücresel mimarinin bozulmadan kalması ve mitokondri ile hücresel bileşenler arasındaki yapısal ve fonksiyonel etkileşimlerin korunmasını sağlamasıdır 12,21,22,23.
Aerobik glikolitik protokolümüzde piruvat, malat ve glutamat kullanımı, Kompleks I 24,25,26,27,28'e NADH tedarikinin kapsamlı, geniş spektrumlu bir değerlendirmesini sağlar. Bu kapsamlı yaklaşım, bütünsel ve fizyolojik olarak ilgili metabolik koşullar altında Kompleks I aktivitesinin bir değerlendirmesini sağlarken, piruvat-malat veya glutamat-malat kullanımı daha uygun bir deneysel yaklaşım olabilir. Örneğin, glutamat-malat kullanımı, amino asit katabolizması29 ile ilgili mitokondriyal fonksiyondaki farklılıkları ortaya çıkarabilir. Araştırmacıları, kendi özel araştırma modelleri için kullanacakları uygun yaklaşımı dikkatlice düşünmeye teşvik ediyoruz.
Bu protokol, mitokondriyal aktiviteyi değerlendirmek için substratların kullanımına odaklanırken, deneysel amaçlara ulaşmak için spesifik inhibitörlerin kullanılması gerekli olabilir. Örneğin, rotenon, Kompleks I 12,21,30'u inhibe etmek için kullanılabilir, oligomisin Kompleks V'yi (ATP Sentaz)12,21 inhibe etmek için kullanılır ve antimisin A, mitokondriyal olmayan solunumun değerlendirilmesi için Kompleks III 12,21'i bloke etmek için kullanılabilir. Yukarıda verilen protokol, spesifik inhibitörlerin kullanımını içerecek şekilde kolayca uyarlanabilir. Önemli bir not olarak, inhibitör kullanımıyla ilgili bir uyarı, bu bileşiklerin yapışkan olması ve alet odasından çıkarılması için kapsamlı temizlik gerektirmesidir. Rezidüel inhibitörlerin uzaklaştırılması için 60 dakika boyunca% 10'luk bir BSA çözeltisi kullanmanın yeterli olduğunu bulduk.
KAÇAK solunum, ATP sentezinden bağımsız olan oksijen tüketim oranını ifade eder. Bu hız, protonların iç mitokondriyal zar boyunca mitokondriyal matrise geri akışını temsil eder. ATP sentezinden (LEAK) bağımsız olarak oksijen tüketimini değerlendirmek için kabul edilen üç yöntem vardır. Birincisi, LEAK(n), substratların varlığında ancak adenilat (ADP veya ATP) eklenmeden oksijen tüketim oranını ölçer31,32,33. Bu SIZINTI durumu, mitokondriyal zarın içsel sızıntısını temsil eder. İkinci yöntem olan LEAK(t), ATP34 varlığında ölçülür ve üçüncü yöntem olan LEAK(o), ATP-sentaz inhibitörü oligomisin 35,36,37 varlığında ölçülür. Bu protokol, bu değerlendirme için LEAK(n) kullanır, ancak deneysel amaçlara ve modellere bağlı olarak, LEAK oksijen akısını ölçmek için başka yöntemler uygun olabilir.
Bu test için MiR05 hem kreatin (3 mg / mL) hem de blebbistatin (10 μM) ile desteklenir. Mitokondriyal ADP taşınması kreatin kinaz (CK) tarafından kolaylaştırılır ve CK aktivitesini doyurmak için solunum solüsyonunakreatin eklenir 38,39. Kas lifleri kendiliğinden kasılabilir ve ayrıca ADP'nin neden olduğu kasılmaya karşı hassastır. Kasılmanın etkisi olmadan mitokondriyal solunum aktivitesini değerlendirmek için, lif kasılma aktivitesini inhibe etmek için blebbistatin eklenmiştir38. Ek olarak, insan kası üzerinde yapılan çalışmalar, solunum kapasitesinin biyopsi yönteminden (mikrobiyopsi ve Bergstrom iğnesi) etkilenebileceğini ve bu farkın elde edilen lif uzunluğundaki farklılıklardan kaynaklanabileceğini düşündürmektedir40,41. Daha kısa lifler hazırlık sırasında hasara karşı daha duyarlı olabilir ve blebbistatin kullanımı işlevin korunmasına yardımcı olur. Lif gevşemesinin araştırma amaçlarına uymadığı bazı durumlar olabilir ve bu durumda blebbistatin MiR05 çözeltisinden çıkarılabilir.
İskelet kası liflerinin saponin ile geçirgenleşmesi, plazma zarında gözenekler oluşturur, substratların ve inhibitörlerin hücreye serbestçe girmesine izin verir. Saponin, hücresel plazma zarlarında zengin ve bol miktarda bulunan kolesterol için yüksek bir afiniteye sahipken, mitokondriyal zarlar kolesterolden fakirdir42,43. Bu protokolde lif hazırlama için kullanılan saponin işleminin mitokondriyal membran bütünlüğünü koruması beklenmektedir. Mitokondride hasar, dokunun mekanik olarak liflere ayrılmasından kaynaklanan kesme kuvvetleri nedeniyle de meydana gelebilir. Dokunun lif demetlerine ayrılmasının hızlı ve minimum işlemle yapılmasını öneriyoruz. Potansiyel mitokondriyal hasarı değerlendirmek için, solunum protokolüne Sitokrom C'nin titrasyonunu dahil ettik. Sitokrom C, sağlam bir dış mitokondriyal zardan12 geçemez, bu nedenle, Sitokrom C ilavesini takibenO2 akısındaki herhangi bir artış, numune hazırlama işlemi sırasında dış mitokondriyal zarda hasarın meydana geldiğini gösterir. Son çalışmalarımızdan birinde, Sitokrom C ilavesini takiben O2 akısının %8 oranında arttığını bulduk.15 Bu protokolde önerilen saponin kullanımının mitokondriyal hasara yol açmadığını doğruladık. Sitokrom C eklendikten sonraO2 akısında %15'ten fazla artış gösteren herhangi bir numunenin analiz44'ten çıkarılması gerektiğini öneriyoruz. Bu adım, Kompleks IV aktivitesinin bir değerlendirmesi olarak değil, kesinlikle bir kalite kontrol önlemi olarak dahil edilmiştir.
Yüksek çözünürlüklü respirometri, oksijen tüketiminin son derece hassas ve güvenilir ölçümlerini sağlamada üstün olsa da, enstrümantasyonun dikkate değer bir sınırlaması, cihaz başına aynı anda yalnızca iki numunenin ölçülebilmesidir. Bu, birden fazla örneklem içeren kohortları içeren çalışmalar tasarlanırken dikkatli bir şekilde değerlendirilmesini gerektirir. Gün boyunca çeşitli numune setleri üzerinde ölçüm yapmak cazip gelse de, araştırmacılara sirkadiyen ritmin metabolizma üzerindeki etkisini göz önünde bulundurmalarını şiddetle tavsiye ediyoruz. Hem insan hem de kemirgen iskelet kası üzerinde yapılan araştırmalar, mitokondriyal fonksiyon üzerinde biyolojik bir saat etkisi olduğunu ortaya koymuştur45,46. Sonuç olarak, bu sirkadiyen dalgalanmaları hesaba katmak için günün aynı saatinde birkaç gün boyunca ölçüm yapmanızı öneririz.
Son olarak, tekrarlanabilir ve sağlam respirometri ölçümleri sağlamak için respirometrenin düzenli temizlik, bakım ve kalibrasyon alması gerekir. Protokolde detaylandırıldığı gibi hava kalibrasyonu günlük olarak yapılmalıdır. Kullanıcılara ayrıca polarografik oksijen sensörlerinin tam aylık kalibrasyonunu (hem hava hem de sıfır) yapmalarını tavsiye ederiz. Kullanıcılar, bu kalibrasyon yöntemi hakkında daha fazla bilgi ve rutin cihaz bakımıyla ilgili talimatlar için üreticinin belgelerine ve web sitesine başvurmalıdır.
Yüksek çözünürlüklü respirometri, mitokondriyal solunumu ölçmek için altın standart olmaya devam etmektedir. Bu protokolde ayrıntıları verilen yöntem, hem kemirgen hem de insan iskelet kasında mitokondriyal kapasitenin sağlam bir şekilde değerlendirilmesini kolaylaştırır. Bu protokol, diyet takviyesi uygulamasından 14,20 ve egzersiz 17,18 sonrasında, kronik böbrek hastalığı19 bağlamında genetik fare modelleri 15,16 ile ilişkili mitokondriyal fonksiyonu değerlendiren çalışmalara uygulanmıştır.
Açıklamalar
Yazarların ifşa edecek hiçbir şeyi yok.
Teşekkürler
Bu yayında bildirilen araştırmalar, Beslenme Obezite Araştırma Merkezi, NIH hibe P30 DK056341 ve NIH hibe K01 HL145326 tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 10 µL Hamilton Syringe (glass syringe) | ThermoFisher | 14-813-125 | For respiration assay titration |
| 25 µL Hamilton Syringe (glass syringe) | ThermoFisher | 14-813-133 | For respiration assay titration |
| ADP | Merck | 117105 | Respirometry Assay |
| Black Glass Dissection Dish | Scintica | DD-90-S-BLK | For sample preparation |
| Blebbistatin | Sigma | B0560 | Working MiR05 Solution |
| BSA, fatty acid free | Sigma | A6003 | MiR05 Solution |
| Calcium Carbonate | Sigma | C4830 | BIOPS Solution |
| Creatine | Sigma | 27900 | Working MiR05 Solution |
| Cytochrome C | Sigma | C7752 | Respirometry Assay |
| DatLab | Oroboros Instruments | N/A | Respirometry Software |
| Dithiothreitol (DTT) | Sigma | D0632 | BIOPS Solution |
| D-Sucrose | Sigma | 84097 | MiR05 Solution |
| EGTA | Sigma | E4378 | BIOPS & MiR05 Solution |
| FCCP | Sigma | C2920 | Respirometry Assay |
| Glutamate | Sigma | G1626 | Respirometry Assay |
| HEPES | Sigma | H7523 | MiR05 Solution |
| Imidazole | Sigma | 56750 | BIOPS Solution |
| KH2PO4 | Sigma | P5379 | MiR05 Solution |
| Lactobionic acid | Sigma | 153516 | MiR05 Solution |
| Malate | Sigma | M1000 | Respirometry Assay |
| MES hydrate | Sigma | M8250 | BIOPS Solution |
| MgCl2 - 6 H2O | Sigma | M2670 | BIOPS & MiR05 Solution |
| Oroboros Oxygraph-2K (O2K) System | Oroboros Instruments | 10203-03 | High resolution respirometer |
| Palmitoyl-Carnitine | Sigma | P4509 | Respirometry Assay |
| Potassium Hydroxide | Sigma | P1767 | BIOPS Solution |
| Precision Tweezers | Fisher | 17-467-168 | For sample preparation |
| Saponin | Sigma | S2149 | For Fiber Permeabilization |
| Sodium ATP | Sigma | A2383 | BIOPS Solution |
| Sodium Phosphocreatine | Sigma | P7936 | BIOPS Solution |
| Sodium Pyruvate | Sigma | P2256 | Respirometry Assay |
| Succinate | Sigma | S2378 | Respirometry Assay |
| Taurine | Sigma | T0625 | BIOPS & MiR05 Solution |
Referanslar
- Rizzuto, R., De Stefani, D., Raffaello, A., Mammucari, C. Mitochondria as sensors and regulators of calcium signalling. Nat Rev Mol Cell Biol. 13 (9), 566-578 (2012).
- Ruegsegger, G. N., Creo, A. L., Cortes, T. M., Dasari, S., Nair, K. S. Altered mitochondrial function in insulin-deficient and insulin-resistant states. J Clin Invest. 128 (9), 3671-3681 (2018).
- Simoneau, J. A., Kelley, D. E. Altered glycolytic and oxidative capacities of skeletal muscle contribute to insulin resistance in NIDDM. J Appl Physiol. 83 (1), 166-171 (1997).
- Ryan, T. E., et al. Extensive skeletal muscle cell mitochondriopathy distinguishes critical limb ischemia patients from claudicants. JCI Insight. 3 (21), 123235 (2018).
- Sullivan, M. J., Green, H. J., Cobb, F. R. Skeletal muscle biochemistry and histology in ambulatory patients with long-term heart failure. Circulation. 81 (2), 518-527 (1990).
- Giebelstein, J., et al. The proteomic signature of insulin-resistant human skeletal muscle reveals increased glycolytic and decreased mitochondrial enzymes. Diabetologia. 55 (4), 1114-1127 (2012).
- Tezze, C., et al. Age-associated loss of OPA1 in muscle impacts muscle mass, metabolic homeostasis, systemic inflammation, and epithelial senescence. Cell Metab. 25 (6), 1374-1389 (2017).
- Hughes, M. C., et al. Early myopathy in Duchenne muscular dystrophy is associated with elevated mitochondrial H(2) O(2) emission during impaired oxidative phosphorylation. J Cachexia Sarcopenia Muscle. 10 (2), 643-661 (2019).
- Yin, Y., Shen, H. Common methods in mitochondrial research (Review). Int J Mol Med. 50 (4), 5182 (2022).
- Vue, Z., et al. 3D reconstruction of murine mitochondria reveals changes in structure during aging linked to the MICOS complex. Aging Cell. 22 (12), e14009 (2023).
- Doerrier, C., et al. High-resolution fluoRespirometry and OXPHOS protocols for human cells, permeabilized fibers from small biopsies of muscle, and isolated mitochondria. Methods Mol Biol. 1782, 31-70 (2018).
- Pesta, D., Gnaiger, E. High-resolution respirometry: OXPHOS protocols for human cells and permeabilized fibers from small biopsies of human muscle. Methods Mol Biol. 810, 25-58 (2012).
- Picard, M., Hepple, R. T., Burelle, Y. Mitochondrial functional specialization in glycolytic and oxidative muscle fibers: tailoring the organelle for optimal function. Am J Physiol Cell Physiol. 302 (4), C629-C641 (2012).
- Yoshino, M., et al. Nicotinamide mononucleotide increases muscle insulin sensitivity in prediabetic women. Science. 372 (6547), 1224-1229 (2021).
- Mousa, M. G., et al. Site-1 protease inhibits mitochondrial respiration by controlling the TGF-beta target gene Mss51. Cell Rep. 42 (4), 112336 (2023).
- Moon, S. H., et al. Genetic deletion of skeletal muscle iPLA(2)gamma results in mitochondrial dysfunction, muscle atrophy and alterations in whole-body energy metabolism. iScience. 26 (6), 106895 (2023).
- Bittel, A. J., et al. A single bout of premeal resistance exercise improves postprandial glucose metabolism in obese men with prediabetes. Med Sci Sports Exerc. 53 (4), 694-703 (2021).
- Bittel, A. J., et al. A single bout of resistance exercise improves postprandial lipid metabolism in overweight/obese men with prediabetes. Diabetologia. 63 (3), 611-623 (2020).
- Bittel, D. C., Bittel, A. J., Varadhachary, A. S., Pietka, T., Sinacore, D. R. Deficits in the skeletal muscle transcriptome and mitochondrial coupling in progressive diabetes-induced CKD relate to functional decline. Diabetes. 70 (5), 1130-1144 (2021).
- Mills, K. F., et al. Long-term administration of nicotinamide mononucleotide mitigates age-associated physiological decline in mice. Cell Metab. 24 (6), 795-806 (2016).
- Djafarzadeh, S., Jakob, S. M. High-resolution respirometry to assess mitochondrial function in permeabilized and intact cells. J Vis Exp. (120), e54985 (2017).
- Lemieux, H., Semsroth, S., Antretter, H., Hofer, D., Gnaiger, E. Mitochondrial respiratory control and early defects of oxidative phosphorylation in the failing human heart. Int J Biochem Cell Biol. 43 (12), 1729-1738 (2011).
- Gnaiger, E. Capacity of oxidative phosphorylation in human skeletal muscle: new perspectives of mitochondrial physiology. Int J Biochem Cell Biol. 41 (10), 1837-1845 (2009).
- Appelman, B., et al. Muscle abnormalities worsen after post-exertional malaise in long COVID. Nat Commun. 15 (1), 17 (2024).
- O'Rourke, A. R., et al. Impaired muscle relaxation and mitochondrial fission associated with genetic ablation of cytoplasmic actin isoforms. FEBS J. 285 (3), 481-500 (2018).
- Inigo, M. R., et al. Estrogen receptor-alpha in female skeletal muscle is not required for regulation of muscle insulin sensitivity and mitochondrial regulation. Mol Metab. 34, 1-15 (2020).
- Musci, R. V., et al. Phytochemical compound PB125 attenuates skeletal muscle mitochondrial dysfunction and impaired proteostasis in a model of musculoskeletal decline. J Physiol. 601 (11), 2189-2216 (2023).
- Englund, D. A., et al. p21 induces a senescence program and skeletal muscle dysfunction. Mol Metab. 67, 101652 (2023).
- Zhang, K., et al. Mitochondrial supercomplex assembly regulates metabolic features and glutamine dependency in mammalian cells. Theranostics. 13 (10), 3165-3187 (2023).
- Davis, M. S., Barrett, M. R. High-resolution fluoro-respirometry of equine skeletal muscle. J Vis Exp. (192), e65075 (2023).
- Schytz, C. T., et al. Skeletal muscle mitochondria demonstrate similar respiration per cristae surface area independent of training status and sex in healthy humans. J Physiol. 602 (1), 129-151 (2024).
- Hingst, J. R., et al. Inducible deletion of skeletal muscle AMPKalpha reveals that AMPK is required for nucleotide balance but dispensable for muscle glucose uptake and fat oxidation during exercise. Mol Metab. 40, 101028 (2020).
- Krumschnabel, G., Eigentler, A., Fasching, M., Gnaiger, E. Use of safranin for the assessment of mitochondrial membrane potential by high-resolution respirometry and fluorometry. Methods Enzymol. 542, 163-181 (2014).
- Gnaiger, E., Mendez, G., Hand, S. C. High phosphorylation efficiency and depression of uncoupled respiration in mitochondria under hypoxia. Proc Natl Acad Sci U S A. 97 (20), 11080-11085 (2000).
- Basse, A. L., et al. Nampt controls skeletal muscle development by maintaining Ca(2+) homeostasis and mitochondrial integrity. Mol Metab. 53, 101271 (2021).
- Flensted-Jensen, M., et al. Combined changes in temperature and pH mimicking exercise result in decreased efficiency in muscle mitochondria. J Appl Physiol. 136 (1985), 79-88 (2024).
- Porter, C., et al. Mitochondrial respiratory capacity and coupling control decline with age in human skeletal muscle. Am J Physiol Endocrinol Metab. 309 (3), E224-E232 (2015).
- Perry, C. G., et al. Inhibiting myosin-ATPase reveals a dynamic range of mitochondrial respiratory control in skeletal muscle. Biochem J. 437 (2), 215-222 (2011).
- Veksler, V. I., et al. Muscle creatine kinase-deficient mice. II. Cardiac and skeletal muscles exhibit tissue-specific adaptation of the mitochondrial function. J Biol Chem. 270 (34), 19921-19929 (1995).
- Isner-Horobeti, M. E., et al. Microbiopsies versus Bergstrom needle for skeletal muscle sampling: impact on maximal mitochondrial respiration rate. Eur J Appl Physiol. 114 (5), 885-889 (2014).
- Hughes, M. C., et al. Mitochondrial bioenergetics and fiber type assessments in microbiopsy vs. Bergstrom percutaneous sampling of human skeletal muscle. Front Physiol. 18 (6), 360 (2015).
- Kuznetsov, A. V., et al. Analysis of mitochondrial function in situ in permeabilized muscle fibers, tissues and cells. Nat Protoc. 3 (6), 965-976 (2008).
- Elustondo, P., Martin, L. A., Karten, B. Mitochondrial cholesterol import. Biochim Biophys Acta Mol Cell Biol Lipids. 1862 (1), 90-101 (2017).
- Ramos, P. M., Li, C., Elzo, M. A., Wohlgemuth, S. E., Scheffler, T. L. Mitochondrial oxygen consumption in early postmortem permeabilized skeletal muscle fibers is influenced by cattle breed. J Anim Sci. 98 (3), 044 (2020).
- van Moorsel, D., et al. Demonstration of a day-night rhythm in human skeletal muscle oxidative capacity. Mol Metab. 5 (8), 635-645 (2016).
- de Goede, P., et al. Time-restricted feeding during the inactive phase abolishes the daily rhythm in mitochondrial respiration in rat skeletal muscle. FASEB J. 36 (2), e22133 (2022).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır