Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Uyanık Marmosetlerde Elektroensefalografi Ölçümleri: Türgül Seslendirmelerin Dinlenmesi
Bu Makalede
Özet
Dilin evrimini incelemek için, insanlardaki beyin mekanizmalarını insan olmayan primatlardaki mekanizmalarla karşılaştırmak önemlidir. Uyanık hayvanların elektroensefalografisini (EEG) noninvaziv olarak ölçmek için bir yöntem geliştirdik. İnsanlar ve hayvanlar arasındaki EEG verilerini, onlara zarar vermeden uzun vadede doğrudan karşılaştırmamızı sağlar.
Özet
Sesli iletişim, primatların sosyal etkileşimlerinde, özellikle hayatta kalma ve sosyal organizasyonda çok önemli bir rol oynar. İnsanlar, dil biçiminde benzersiz ve gelişmiş bir sesli iletişim stratejisi geliştirdiler. İnsan dilinin evrimini incelemek için, insanlarda ses işlemenin altında yatan sinirsel mekanizmaları araştırmak ve beyin mekanizmalarının insan olmayan primatlardaki mekanizmalarla karşılaştırarak nasıl evrimleştiğini anlamak gerekir. Burada, uyanık insan olmayan primatların elektroensefalografisini (EEG) noninvaziv olarak ölçmek için bir yöntem geliştirdik. Bu kayıt yöntemi, hayvanlara zarar vermeden uzun vadeli çalışmalara izin verir ve daha da önemlisi, insan olmayan primat EEG verilerini insan verileriyle doğrudan karşılaştırmamıza olanak tanır ve insan dilinin evrimi hakkında fikir verir. Bu çalışmada, marmosetlerde türe özgü seslendirmelere yanıt olarak beyin aktivitesini araştırmak için kafa derisi EEG kayıt yöntemini kullandık. Bu çalışma, vokal algı sırasında marmosetlerde yaygın nöral temsilleri yakalamak ve mevcut bilgilerdeki boşlukları doldurmak için kafa derisi EEG'sini kullanarak yeni bilgiler sağlar.
Giriş
Primatlar, arayanın duygusal durumu veya sosyal bağları sürdürme niyeti, yırtıcıların varlığı veya diğer tehlikeli durumlar gibi biyolojik olarak önemli bilgileri iletmek için türe özgü seslendirmeler kullanır. Ses bakımından zengin insan olmayan primatlarda seslendirme algısının altında yatan sinirsel mekanizmaların araştırılması, insan dilinin evrimsel kökenlerini daha iyi anlamak için bize kritik ipuçları sağlayabilir.
Ortak marmosetler, Güney Amerika'ya özgü küçük primatlardır. Son yıllarda, marmosetler, yüksek üremeleri, küçük boyutları nedeniyle kullanım kolaylığı ve yararlı transgenik tekniklerin geliştirilmesi nedeniyle makak maymunlarının yanı sıra model hayvanlar olarak giderek daha fazla kullanılmaktadır 1,2,3. Hastalık modelleri olarak faydalarına ek olarak, gruplar içindeki zengin sesli iletişim, bu türün bir başka benzersiz özelliğidir 4,5,6,7. Marmosetler, ormandaki görünmez türdeşlerle iletişim kurmak için rutin olarak ses sinyalleri alışverişinde bulunurlar. Marmosetlerde ses algısı ve üretiminde yer alan beyin aktivitesini inceleyerek, beyindeki kendi veya türdeş çağrılarının işitsel bilgilerini nasıl işlediklerini belirleyebilir ve hangi nöral devrelerin dahil olduğunu belirleyebiliriz. Önceki çalışmalar, marmosetlerde vokal üretiminde yer alan birincil işitsel korteks 8,9,10,11,12 ve frontal korteks 13,14'te nöral aktivite göstermiştir. Ayrıca, bu uyarılmış ve bastırılmış nöronal tepkiler, birincil işitsel korteksteki işitsel-vokal etkileşimler tarafından modüle edildi 8,10. Bu çalışmalar, invaziv kayıt yöntemleri kullanılarak tek nöron düzeyinde ayrıntılı nöral aktivite verileri sağlamıştır. Çok sayıda çalışma, marmoset ses üretiminde yer alan nöral aktiviteyi daha fazla incelemiştir; Bununla birlikte, ses algısı tam olarak anlaşılamamıştır15,16.
Birkaç noninvaziv beyin görüntüleme çalışması, marmosetlerde vokal işlemenin nöral mekanizmalarını aydınlatmıştır 17,18,19; Yüksek uzamsal çözünürlükleri bir avantajdır, ancak tarama sırasında hayvanları uyanık durumda tutmak ileri teknikler gerektirir. Bununla birlikte, daha yakın zamanlarda, Jafari ve ark. fonksiyonel manyetik rezonans görüntüleme (fMRI) kullanarak uyanık marmosetlerde vokal algıda yer alan frontotemporal bölgeleri tanımladılar19. İnsanlarda ses algısı ve üretiminde yer alan beyin fonksiyonlarını aydınlatmaya yönelik hemen hemen tüm deneyler, kafa derisi elektroensefalografisi (EEG), manyetoensefalografi (MEG)20,21 ve fMRI 22,23,24 gibi invaziv olmayan yöntemler kullanılarak yapılmıştır. İnsanlarda yapılan çok sayıda çalışma, EEG kullanarak ses algısı ile ilgili beyin aktivitesini araştırmıştır. Bu çalışmaların çoğu duygusal bilgi25,26,27 ve duygusal kelimelerin belirginliği28 üzerine odaklanmıştır ve sonuçlar ses algısı29 sırasında olayla ilgili potansiyellerdeki değişiklikleri ortaya koymuştur. İnsanlarda intrakraniyal olarak implante edilmiş elektrotlar kullanılarak yapılan elektrokortikografi (ECoG) ve tek nöron kayıtları, nöroşirürji tedavisi gören hastalarda yalnızca sınırlı sayıda deneyde gerçekleştirilmiştir30,31.
İnsanları maymunlarla karşılaştıran evrimsel bir bakış açısı, insanlarda gelişen ses algısı ve üretiminin altında yatan benzersiz sinirsel mekanizmaları anlamak için önemlidir. Marmoset gibi ses açısından zengin insan olmayan primatlarda konuşma algısı ve seslendirme ile ilgili sinirsel mekanizmaları insanlarla doğrudan karşılaştırmak için, aynı yöntemi kullanarak iki tür arasındaki verileri karşılaştırmak önemlidir. Fonksiyonel MRG, tüm beyin görüntülemesine izin verir ve yüksek uzamsal çözünürlüğe sahiptir. Kafatasına dik olarak veya EEG veya MEG ile kaydedilmesi zor olan derin bölgelerde aktivite kaydetme avantajına sahiptir. Bununla birlikte, MRI makinesinin kurulumu ve bakımı pahalıdır ve cihazın doğası gereği sunulabilecek uyaranlar üzerinde birçok kısıtlama vardır. Karşılaştırıldığında, EEG, olayla ilgili potansiyeller (ERP'ler) ve MEG, yüksek bir zamansal çözünürlüğe sahiptir, bu da onları zaman serisi vokal işlemeyi analiz etmek için kullanışlı kılar. Özellikle, EEG, yüksek mobilite ve çeşitli deneysel ortamlarda kullanılabilme yeteneği, nispeten düşük maliyet ve sadece tek bir operatör gereksinimi gibi avantajlara sahiptir.
İnsanlarda zaten büyük miktarda EEG verisi elde edildiğinden, insan olmayan primatlar için non-invaziv paradigmaları kullanan EEG ölçüm yöntemlerine ihtiyaç vardır. Araştırma grubumuz, makaklar ve marmosetler için tüpler32'yi kullanarak benzersiz bir noninvaziv EEG kayıt yöntemi geliştirdi. Burada, insan olmayan primatlarda işitsel işleme ile ilgili birkaç yeni bulgu bildiriyoruz 33,34,35,36,37. Marmosetlerdeki türe özgü seslendirmelere yanıt olarak beyin aktivitesini karakterize etmek için, kafa derisine yerleştirilen elektrotları kullanarak beyin aktivitesini noninvaziv olarak kaydetmek için deneysel bir sistem oluşturduk. Bu çalışmada marmosetler için EEG ölçüm yöntemi anlatılmıştır.
Protokol
Tüm deneyler EHUB Hayvan Deneyleri Komitesi (No.2022-003, 2023-104) tarafından onaylanmış ve EHUB tarafından yayınlanan Laboratuvar Primatlarının Bakım ve Kullanım Kılavuzu'na uygun olarak yürütülmüştür. Deney için dokuz yaygın marmoset (Callithrix jacchus, altı erkek ve üç dişi, 2-12 yaş, 330-490 g ağırlığında) kullanıldı.
1. Hayvanlar
- Marmosetleri yuva kutuları, ahşap tünekler ve diğer zenginleştirme cihazlarıyla donatılmış tek kafeslerde saklayın.
- Odaları, sıcaklık ve nem sırasıyla 28 ± 2 °C ve %40 ± %20'de tutularak 12 saatlik bir aydınlık-karanlık döngüsü altında tutun.
- Hayvanları günde iki kez 14 g Yeni Dünya maymun peleti ile besleyin, arap zamkı ve un kurdu gibi yiyeceklerle destekleyin. Su ad libitum sağlayın.
- Tüm deneyleri bir deney odasında ses yalıtımlı bir kutuda gerçekleştirin.
2. Ekipman (Şekil 1B ve Malzeme Tablosu)
- 4 mm gümüş elektrotlar kullanın. Elektrot yüzeyindeki AgCl kaplama, polarizasyonu önler ve stabil kayıt sağlar.
- EEG sinyallerini kaydetmek için bir amplifikatör kullanın. Bant geçiren filtre (0,016-250 Hz) ve verileri 1.000 Hz'de örnekleyin.
- 64 kanallı bir Elektrot Giriş Kutusunu amplifikatöre bağlayın ve konunun önüne yerleştirin.
- Hoparlörü marmoset kafasından 30 cm uzağa yerleştirin ve kulak konumunda ölçüldüğü gibi ses seviyesini 65-75 dB'de kontrol edin. İşitsel uyaranları bu hoparlör aracılığıyla iletin.
- EEG kaydı sırasında durumlarını izlemek için kamerayı konunun önüne yerleştirin.
- Primat sandalye akrilik plakalardan ve sentetik reçine direklerden yapılmıştır. Deneyler için, araştırmacının hayvanları ayak plakasına otururken tutmasını sağlayın; Bu noktada, bir boyunluk yerleştirin ve boyun paneline sabitleyin ve bel parçasını bel paneline yerleştirin ve sabitleyin. Her marmosetin tüm gövdesinin gevşek bir şekilde sabitlendiğinden emin olun.
3. Anestezi
- Hayvanları intramüsküler alfaksalone (6-8 mg / kg) ve atropin (0.05 mg / kg) enjeksiyonu ile uyuşturun. Bu protokol anestezinin yaklaşık 20 dakika sürdürülmesini sağlar. İşlem daha uzunsa anestezi süresini uzatmak için ek dozlarda alfaxalone uygulayın. Ayrıca, alfaksilin bir yan etkisi olan mide bulantısına karşı koymak için önceden antiemetik ajanlar (Maropitant 1 mg / kg, deri altı enjeksiyon) uygulayın.
NOT: Marmosetlerin işlemler sırasında enjeksiyon veya inhalasyon anestezisi altında olması ve saç tıraşından hemen sonra kendine gelmesine izin verilmesi gerekir. - Hayati değerleri bir nabız oksimetresi ile izleyin ve gerekirse oksijen-hava karışımı (Ø2 0,5 L / dak, hava 0,5 L / dak) uygulayın.
- Oda sıcaklığını 27 °C'nin üzerinde tutun ve hipotermiyi önlemek için marmosetin gövdesinin etrafına bir ısıtma bezi sarın.
4. Epilasyon
- Tüm başınızı (kulak kepçesinin arkası dahil) elektrikli tıraş makinesiyle tıraş edin.
- Hassas ciltler için tüy dökücü krem uygulayın. Kremayı 5 dakika sonra ıslak bir gazlı bezle silin.
5. Maske hazırlığı
- Maymun sandalyesinin boyutuna uyacak şekilde önceden bir termoplastik maske işleyin. Spesifik olarak, sandalyenin dikey uzunluğundan çıkıntı yapan sırt kısmını, sandalyenin boyun plakasına sabitlenebilecek şekilde dört vida deliği ile delin.
NOT: Termoplastik maskeler güvenlidir ve hastalarda radyasyon tedavisi sırasında başı hareketsiz hale getirmek için kullanılabilir. Çocuklar için tasarlanmış küçük bir maske kullandık ve marmosetlerin boyutuna uyacak şekilde kestik. Bu maske 75 °C'deki ılık suya konulduğunda yumuşar ve sudan çıkarıldığında sıcaklık düştükçe sertleşir. - Deneyler için hayvanları bir primat sandalyesine yerleştirin. Anestezi uygulanan hayvanı boyun ve bel plakalarını kullanarak destekleyin ve hayvanı ve bu plakaları sandalyeye sabitleyin.
- Maskeyi sıcak suda ısıtın ve ardından marmosetin kafasına uyacak şekilde kalıplayın. Maskeyi ılık sudan çıkardıktan sonra, yanıkları önlemek için sıcaklığın düşmesini bekleyin (yaklaşık 50s °C aralığında) ve ardından maskeyi kalıplamak için deneğin kafasına yerleştirin.
- Soğuduktan ve sertleştikten sonra, maskeyi hayvandan ayırın ve elektrot ayarı için alanı ortaya çıkarmak için maskenin baş ve kulak kısımlarının üst kısımlarını kesin.
NOT: Bu maske yapıldıktan sonra diğer kişiler üzerinde de kullanılabilir.
6. Sandalye ve maske adaptasyonu (3 gün boyunca 30 dk / gün)
- Hayvanı uyanık koşullarda bir sandalyeye koyarak ve yaklaşık 30 dakika boyunca ödüllendirerek sandalyeye alıştırın. Bu işlemi 3 gün boyunca tekrarlayın.
- Hayvanı 2 gün boyunca maskeyi kullanarak kafa fiksasyonuna alıştırın.
NOT: Bu adaptasyon süreci bireyin durumuna göre özelleştirilmiştir. Adaptasyondan sonra, hayvanlar yakalama ve kafa maskesi ayarı sırasında geçici olarak direnebilirler, ancak sandalyeye oturduklarında ve başları sabitlendiğinde sakinleşirler. - Sandalye adaptasyonu sırasında, aşağıdaki davranışsal parametreleri değerlendirin: i) endişeli veya endişe verici seslerin yayılması, ii) teklif edilen ödülün reddedilmesi ve iii) şiddetli hareketler. Bu davranışlardan herhangi biri gözlenirse, marmosetin deney ortamına kademeli olarak adapte olmasına izin vererek o gün için oturumu sonlandırın.
7. EEG kaydı (2 saat/gün)
- Konu hazırlığı
- Ev kafesinin küçük bir penceresine bir transfer kafesi takın ve marmoseti ev kafesinden transfer kafesine, genellikle kendi başına hareket ettirin. Taşıma kafesini bir bezle örtün ve deney odasına aktarın.
- Kafa fiksasyonu
- Koruyucu eldivenler kullanarak marmoseti yakalayın ve özel sandalyeye yerleştirin.
- Hazırlanan maskeyi marmosetin kafasına yerleştirin. Sandalyeye takılı vida gövdesini maskedeki delikten geçirin ve kelebek vidalar kullanarak sabitleyin.
- Başı sabitleyin ve nasyonun hemen altındaki bir bantla hafifçe maskeleyin.
NOT: Elektrotlar hareketle çıkarılmadığı sürece deneğin kafasının tamamen sabitlenmesine gerek yoktu. Bu nedenle, tüm deneklerde aynı maskeyi kullandık.
- Elektrotların yerinin tanımı
- Uluslararası 10-20 yöntemi32,33,34,35,36,37'ye göre elektrotların yerini belirlemek için nasion, inion ve kulak memelerini anatomik yer işaretleri olarak kullanın. Orta çizgideki nasion ve inion arasındaki mesafeyi bir mezura ile ölçün. Mesafenin ortasındaki Cz konumunu tanımlayın. Diğer elektrotları (Fz, Pz, Oz, F3 veya F4) elektrot aralığı olarak inion-neion uzunluğunun %20'si olacak şekilde konumlandırın. Yağ bazlı bir dermatograf kullanarak kafa derisindeki elektrot konumlarını işaretleyin.
- Cilt hazırlığı
- Saç derisindeki kiri ve sebumu temizlemek için işaretli alanı alkole batırılmış ince bir pamuklu çubukla ovalayın.
- Elektrot ayarları
NOT: Elektrotları Fz, Cz, C7.2.1, C3, Pz, A7.2.3, Pz, A3 ve F4 (veya F4) konumuna yerleştirmek için tüm elektrot konumlarında 1-4 adımlarını gerçekleştirin.- Bir boru kesici kullanarak, iç çapı 4 mm ve dış çapı 7 mm olan bir silikon boru parçasını yaklaşık 20 mm uzunluğunda kesin.
- Kesilen tüpün kenarlarına yapıştırıcı sürün ve kafa derisine yapıştırın.
- Tüpün içini bir şırınga ve sivri olmayan bir şırınga iğnesi kullanarak EEG jeli ile doldurun.
- Referans elektrodu Pz'ye ve toprak elektrotlarını F3 veya F4'e bağlayın (Şekil 1C).
- Elektrotları tüpe yerleştirin ve elektrot kablosunu giriş kutusuna bağlayın.
- Elektrot empedansını ölçmek için EEG kayıtları uygulamasını başlatın ve tüm elektrotların 5 kΩ'un altında olduğundan emin olmak için parametreleri ayarlayın.
- Gürültüyü azaltmak için elektrot kablolarını demetleyin.
- Kafa immobilizasyon prosedürü sırasında ve görev oturumları arasında 1-3 mL sıvı ödülün (sakız veya beslenme) bir şırınga kullanılarak manuel olarak uygulanarak ödüller verin.
- EEG kayıt yazılımına kaydedilecek dosyayı belirtin ve Kaydı Başlat düğmesine basın. EEG kaydı başlatıldıktan hemen sonra uyaran sunumu için komut dosyasını çalıştırın. Tüm kayıtları sonlandırmak için uyaran sunum komut dosyası yürütme tamamlandığında EEG kaydındaki durdur düğmesine basın. Kayıt tamamlandığında elektrotları ve kafa maskesini çıkarın.
- Hayvanları yakalayın ve onları taşıma kafeslerine geri koyun. Tüpleri kafa derisinde bırakın; Tüm tüpler yaklaşık 1 gün içinde doğal olarak düştü.
NOT: İlk dönemlerde, kayıt seanslarından sonra yapışkan yapıştırıcıyı çözmek ve tüpü çıkarmak için aseton kullandık; Bununla birlikte, cilt yaralanması vakaları vardı; Bu nedenle, daha sonra hayvanları tüpü çıkarmadan ev kafeslerine geri koyduk. Şimdiye kadar yaptığımız onlarca deneyde, marmosetler çıkarılan tüplere herhangi bir ilgi göstermedi ve kazara yutulması hiç olmadı. - Uyarıcı
- Sonraki EEG kayıtlarında kullanılmayan marmosetlerden tutsak veya deney odasında doğal, basit ve bileşik çağrıları kaydedin. Kaydedilen dosyalardan türe özgü üç basit ve bileşik çağrıyı (Phee, Tsik-Ek ve Tsik-String5 çağrıları) ayıklayın.
- Çağrı uyaranlarına ek olarak, programlama yazılımındaki bir işlevi kullanarak beyaz gürültü oluşturun ve bunu bir uyaran olarak kullanın.
- Bu protokolü takip etmek için, deneyde üç işitsel dosya (16 bit, 48 kHz) marmoset çağrısı kullanın. Özel bir komut dosyası kullanarak görevi kontrol edin.
NOT: Her blok, her uyaran için toplam 200 çağrı olmak üzere 50 çağrı içerir. Her kayıt bloğu yaklaşık 10 dakika sürecektir. Her katılımcı iki blok gerçekleştirmelidir. Aramalar arası aralık 3 saniyedir. Dört sesli uyaran dosyasından (Ek Dosya 1'e bakınız), Phee çağrı uyarıcısı yaklaşık 2 s uzunluğundayken, diğer üçü yaklaşık 1 s uzunluğundaydı. Bunun nedeni, tek bir Phee çağrısının hala uzun süreli bir çağrı olmasıdır (Şekil 1D). - Her ses uyaranı dosyasında, sağ kanal marmoset çağrısını veya gürültü verilerini içerir ve sol kanal uyaranın başlangıcı için tetikleme sinyalini içerir. Bu tetikleme sinyalini bir senkronizasyon cihazı aracılığıyla EEG kayıt sistemine gönderin ve olay zamanı olarak kaydedin.
8. Veri analizi
NOT: Programlama yazılımında ve araç kutusunda yazılan orijinal kod, aşağıda belirtildiği gibi EEG verilerini sonradan işlemek için kullanılmıştır (Ek Dosya 2)37.
- Ön
- Bağlantılı kulak referansına yeniden referans.
- 2 Hz'de yüksek geçiren filtre.
- Uyaran başlangıcından 100 ms öncesinden 1000 ms sonrasına kadar olan dönem.
- 100 ms'lik ön uyaran döneminin ortalamasına göre taban çizgisi. ±150 μV'lik bir kriter kullanarak artefaktları reddedin.
- Olayla ilgili potansiyelin çizimi (ERP)
- Her denek için tüm deneme verilerinin ortalamasını alın.
- Tüm deneklerin ortalamasını alarak grup ortalamalı dalga formları elde edin.
- Çağrı türleri ve gürültü uyaranları arasındaki ortalama ERP'leri karşılaştırmak için, Cz yanıtında denekler arası faktör olarak uyaranlarla tek yönlü bir varyans analizi (ANOVA) uygulayın.
- Tukey'in yöntemi ile post hoc çoklu karşılaştırma analizi uygulayın.
- Olayla ilgili spektral bozulma (ERSP) çizimi
- Denklem (1)'i kullanarak geniş bir frekans aralığında zaman içinde spektral güçteki ortalama olayla ilgili değişimi görselleştirmek için ERSP'yi hesaplayın. Fk (f,t), f frekansında ve t zamanında k denemesinin spektral tahminidir:
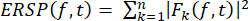 (1)
(1) - En düşük frekansta (10 Hz) üç döngü uzunluğunda, en yüksek frekansta (120 Hz) 32 döngüye kadar frekansla doğrusal olarak artan sinüzoidal dalgacık dönüşümlerini kullanarak aktivitelere zaman-frekans ayrıştırması uygulayın.
- 2-30 Hz'de uyaran başlangıcından sonra 150 ms'lik bir dönemde ilk ve geçici tepkileri ve 40-100 H'de uyaran başlangıcından sonra 151 ila 950 ms arasında 800 ms'lik bir dönemde sürekli tepkileri tanımlayın.
- Denek yaşları ve çağrı türleri arasında Fz ve Cz'deki ilk ve sürekli yanıtlardaki farklılıkları test etmek için, denek içi faktör olarak çağrı türünü ve denekler arası faktör olarak yaşları kullanarak iki yönlü bir ANOVA gerçekleştirin.
- Denklem (1)'i kullanarak geniş bir frekans aralığında zaman içinde spektral güçteki ortalama olayla ilgili değişimi görselleştirmek için ERSP'yi hesaplayın. Fk (f,t), f frekansında ve t zamanında k denemesinin spektral tahminidir:
Sonuçlar
İlk olarak, marmosetlerdeki her bir işitsel uyaran için ortalama olayla ilgili potansiyelleri (ERP'ler) çizdik (Şekil 2). İşitsel uyarılmış potansiyel (AEP), uyaranların net başlangıcını yansıtan Gürültü durumunda belirgindi. Çağrı türleri ve gürültü uyaranları arasındaki ortalama ERP'leri karşılaştırmak için, Cz yanıtında denekler arası faktör olarak uyaranlarla tek yönlü bir varyans analizi (ANOVA) uyguladık. Uy...
Tartışmalar
Anestezi ile ilgili dikkat edilmesi gereken noktalar
Hem ketamin hem de ksilazin uygulaması denenmiştir ve bunlar analjezik iken ve bu nedenle uzun ağrılı görevler için uygun olsa da, marmosetler oksijen solunması olmadan kan oksijen seviyelerinde azalma yaşama eğilimindedir44. Kısacası, alfaxalon muhtemelen tıraş veya maske yapımı gibi ağrısız görevler için en uygun olanıdır. Ayrıca sadece 10-15 dakika süren tıraş için inhalasyon anestezisi en uygun...
Açıklamalar
Yazarların açıklanacak herhangi bir çıkar çatışması yoktur.
Teşekkürler
Bu çalışma, Kyoto Üniversitesi'nin Hakubi Projesi, Zorlu Araştırmalar için Yardım Hibesi (Öncülük) (No.22K18644), Bilimsel Araştırma Hibesi (C) (No. 22K12745), Bilimsel Araştırma Hibesi (B) (No. 21H02851) ve Bilimsel Araştırma için Yardım Hibesi (A) (No. 19H01039) tarafından desteklenmiştir. İngilizce dil düzenlemesi için Editage'a (www.editage.jp) teşekkür ederiz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Alfaxalone | Meiji Animal Health | Alfaxan | |
| Amplifier | Brain Products | BrainAmp | |
| Atropine | Fuso Pharmaceutical Industries | Atropine Sulfate Injection | |
| Audio editor | Adobe | Adobe Audition | |
| Data processing software | MathWorks | MATLAB | version R2023a |
| Data processing toolbox | University of California-SanDiego | EEGLAB | |
| Data processing toolbox | University of California-Davis | ERPLAB | |
| Electric shaver | Panasonic | ER803PPA | |
| Electrode | Unique Medical | UL-3010 | AgCl coated (custom) |
| Electrode gel | Neurospec AG | V16 SuperVisc | |
| Electrode input box | Brain Products | EIB64-DUO | 64ch |
| Glue | 3M | Scotch 7005S | |
| Hair removering cream | Kracie | epilat for sensitive skin | |
| Isoflurane | Bussan Animal Health | ds isoflurane | |
| Liquid gum | San-ei Yakuhin Boeki | Arabic Call SS | Gum arabic+water |
| Liquid nutrition | Nestlé Health Science Company | Isocal 1.0 Junior | Polymeric formula |
| Maropitant | Zoetis | Cerenia injectable solution | |
| Monitor Camera | Intel | RealSense LiDAR Camera L515 | |
| Monkey pellets | Oriental Yeast | SPS | |
| Primate chair | Natsume Seisakusho | Order made | |
| Pulse oximeters | Covident | Nellcor | PM10N |
| Skin prepping pasta | Mammendorfer Institut für Physik und Medizin | NeuPrep | |
| Slicon tube | AsONE | Φ4 x 7mm | |
| Speaker | Fostex | PM0.3 | |
| Synchronization device | Brain Vision | StimTrak | |
| Thermoplastic mask | CIVCO | MTAPU Type Uniframe Thermoplastic Mask 2.4mm |
Referanslar
- Miller, C. T., et al. Marmosets: A neuroscientific model of human social behavior. Neuron. 90 (2), 219-233 (2016).
- Okano, H., Hikishima, K., Iriki, A., Sasaki, E. The common marmoset as a novel animal model system for biomedical and neuroscience research applications. Semin Fetal Neonatal Med. 17 (6), 336-340 (2012).
- t'Hart, B. A., Abbott, D. H., Nakamura, K., Fuchs, E. The marmoset monkey: a multi-purpose preclinical and translational model of human biology and disease. Drug Discov Today. 17 (21-22), 1160-1165 (2012).
- Bezerra, B. M., Souto, A. Structure and usage of the vocal repertoire of Callithrix jacchus. Int J Primatol. 29 (3), 671-701 (2008).
- Agamaite, J. A., Chang, C. J., Osmanski, M. S., Wang, X. A quantitative acoustic analysis of the vocal repertoire of the common marmoset (Callithrix jacchus). J Acoust Soc Am. 138 (5), 2906-2928 (2015).
- Pistorio, A. L., Vintch, B., Wang, X. Acoustic analysis of vocal development in a New World primate, the common marmoset (Callithrix jacchus). J Acoust Soc Am. 120 (3), 1655-1670 (2006).
- Grijseels, D. M., Prendergast, B. J., Gorman, J. C., Miller, C. T. The neurobiology of vocal communication in marmosets. Ann N. Y. Acad Sci. 1528 (1), 13-28 (2023).
- Eliades, S. J., Wang, X. Neural substrates of vocalization feedback monitoring in primate auditory cortex. Nature. 453 (7198), 1102-1106 (2008).
- Eliades, S. J., Wang, X. Comparison of auditory-vocal interactions across multiple types of vocalizations in marmoset auditory cortex. J Neurophysiol. 109 (6), 1638-1657 (2013).
- Eliades, S. J., Wang, X. Contributions of sensory tuning to auditory-vocal interactions in marmoset auditory cortex. Hear Res. 348, 98-111 (2017).
- Eliades, S. J., Wang, X. Neural correlates of the lombard effect in primate auditory cortex. J Neurosci. 32 (31), 10737-10748 (2012).
- Tsunada, J., Wang, X., Eliades, S. J. Multiple processes of vocal sensory-motor interaction in primate auditory cortex. Nat Commun. 15 (1), 3093 (2024).
- Miller, C. T., Thomas, A. W., Nummela, S. U., de la Mothe, L. A. Responses of primate frontal cortex neurons during natural vocal communication. J Neurophysiol. 114 (2), 1158-1171 (2015).
- Roy, S., Zhao, L., Wang, X. Distinct neural activities in premotor cortex during natural vocal behaviors in a New World Primate, the common marmoset (Callithrix jacchus). J Neurosci. 36 (48), 12168-12179 (2016).
- Wang, X., Merzenich, M. M., Beitel, R., Schreiner, C. E. Representation of a species-specific vocalization in the primary auditory cortex of the common marmoset: temporal and spectral characteristics. J Neurophysiol. 74 (6), 2685-2706 (1995).
- Zeng, H. -. h., et al. Distinct neuron populations for simple and compound calls in the primary auditory cortex of awake marmosets. National Science Review. 8 (11), nwab126 (2021).
- Sadagopan, S., Temiz-Karayol, N. Z., Voss, H. U. High-field functional magnetic resonance imaging of vocalization processing in marmosets. Sci Rep. 5, 10950 (2015).
- Kato, M., et al. Individual identity and affective valence in marmoset calls: in vivo brain imaging with vocal sound playback. Anim Cogn. 21 (3), 331-343 (2018).
- Jafari, A., et al. A vocalization-processing network in marmosets. Cell Rep. 42 (5), 112526 (2023).
- Papanicolaou, A. C., et al. Differential brain activation patterns during perception of voice and tone onset time series: a MEG study. Neuroimage. 18 (2), 448-459 (2003).
- Capilla, A., Belin, P., Gross, J. The early spatio-temporal correlates and task independence of cerebral voice processing studied with MEG. Cereb Cortex. 23 (6), 1388-1395 (2012).
- Belin, P., Zatorre, R. J., Lafaille, P., Ahad, P., Pike, B. Voice-selective areas in human auditory cortex. Nature. 403 (6767), 309-312 (2000).
- Perrodin, C., Kayser, C., Abel, T. J., Logothetis, N. K., Petkov, C. I. Who is that? Brain networks and mechanisms for identifying individuals. Trends Cogn Sci. 19 (12), 783-796 (2015).
- Pernet, C. R., et al. The human voice areas: Spatial organization and inter-individual variability in temporal and extra-temporal cortices. Neuroimage. 119, 164-174 (2015).
- Chen, X., Pan, Z., Wang, P., Zhang, L., Yuan, J. EEG oscillations reflect task effects for the change detection in vocal emotion. Cogn Neurodyn. 9 (3), 351-358 (2015).
- Hiyoshi-Taniguchi, K., et al. EEG correlates of voice and face emotional judgments in the human brain. Cogn Comput. 7 (1), 11-19 (2015).
- Lévêque, Y., Schön, D. Listening to the human voice alters sensorimotor brain rhythms. PloS One. 8, e80659 (2013).
- Liu, T., et al. Electrophysiological insights into processing nonverbal emotional vocalizations. NeuroReport. 23, 108-112 (2012).
- Bruneau, N., et al. Early neurophysiological correlates of vocal versus non-vocal sound processing in adults. Brain Res. 1528, 20-27 (2013).
- Flinker, A., et al. Single-Trial speech suppression of auditory cortex activity in humans. J Neurosci. 30, 16643-16650 (2010).
- Greenlee, J. D. W., et al. Human auditory cortical activation during self-vocalization. PloS One. 6 (3), e14744 (2011).
- Itoh, K., Konoike, N., Iwaoki, H., Igarashi, H., Nakamura, K. A novel "dip-in electrode" method for electrode application to record noninvasive scalp electroencephalograms and evoked potentials in an awake common marmoset. Neuroimage: Reports. 2 (3), 100116 (2022).
- Itoh, K., et al. Cerebral cortical processing time is elongated in human brain evolution. Sci Rep. 12 (1), 1103 (2022).
- Itoh, K., Nejime, M., Konoike, N., Nakamura, K., Nakada, T. Evolutionary elongation of the time window of integration in auditory cortex: macaque vs. human comparison of the effects of sound duration on auditory evoked potentials. Front Neurosci. 13, 630 (2019).
- Itoh, K., Iwaoki, H., Konoike, N., Igarashi, H., Nakamura, K. Noninvasive scalp recording of the middle latency responses and cortical auditory evoked potentials in the alert common marmoset. Hear Res. 405, 108229 (2021).
- Itoh, K., Nejime, M., Konoike, N., Nakada, T., Nakamura, K. Noninvasive scalp recording of cortical auditory evoked potentials in the alert macaque monkey. Hear Res. 327, 117-125 (2015).
- Konoike, N., et al. Comparison of noninvasive, scalp-recorded auditory steady-state responses in humans, rhesus monkeys, and common marmosets. Sci Rep. 12 (1), 9210 (2022).
- Eliades, S. J., Miller, C. T. Marmoset vocal communication: Behavior and neurobiology. Dev Neurobiol. 77 (3), 286-299 (2017).
- Ray, S., Hsiao, S. S., Crone, N. E., Franaszczuk, P. J., Niebur, E. Effect of stimulus intensity on the spike-local field potential relationship in the secondary somatosensory cortex. J Neurosci. 28 (29), 7334-7343 (2008).
- Leonard, M. K., et al. Large-scale single-neuron speech sound encoding across the depth of human cortex. Nature. 626 (7999), 593-602 (2024).
- Dubey, A., Ray, S. Comparison of tuning properties of gamma and high-gamma power in local field potential (LFP) versus electrocorticogram (ECoG) in visual cortex. Sci Rep. 10 (1), 5422 (2020).
- Ray, S., Crone, N. E., Niebur, E., Franaszczuk, P. J., Hsiao, S. S. Neural correlates of high-gamma oscillations (60-200 Hz) in Macaque local field potentials and their potential implications in electrocorticography. Journal Neurosci. 28 (45), 11526-11536 (2008).
- Buzsáki, G., Anastassiou, C. A., Koch, C. The origin of extracellular fields and currents--EEG, ECoG, LFP and spikes. Nat Rev Neurosci. 13 (6), 407-420 (2012).
- Konoike, N., Miwa, M., Ishigami, A., Nakamura, K. Hypoxemia after single-shot anesthesia in common marmosets. J Med Primatol. 46 (3), 70-74 (2017).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır