Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Mekanik Ventilasyonlu Farelerde Hiperpolarize 129Xe Akciğer MRG ve Spektroskopi
Bu Makalede
Özet
Hiperpolarize ksenon MRG, translasyonel araştırma ve klinik bakımda bölgesel akciğer mikroyapısını (hava boşluğu boyutları) ve fizyolojisini (ventilasyon ve gaz değişimi) ölçebilir. Zor olmasına rağmen, klinik öncesi çalışmalarda karşılaştırılabilir pulmoner içgörüler sağlayabilir. Bu protokol, farelerde rutin ksenon akciğer MRG'si gerçekleştirmek için gereken altyapıyı ve prosedürleri açıklar.
Özet
Hiperpolarize (HP) ksenon-129 (129Xe), ventilasyon, kısıtlı difüzyon (alveolar-hava sahası boyutu) ve gaz değişimi dahil olmak üzere pulmoner fizyolojiyi ölçmek için kullanılabilecek benzersiz spektral ve fiziksel özelliklere sahip, inhale edilmiş bir manyetik rezonans görüntüleme (MRI) kontrast maddesidir. İnsanlarda, çeşitli pulmoner bozukluklarda hastalık şiddetini ve ilerlemesini değerlendirmek için kullanılmıştır ve Amerika Birleşik Devletleri ve Birleşik Krallık'ta klinik kullanım için onaylanmıştır. Klinik uygulamalarının ötesinde, 129Xe MRG'nin pulmoner patofizyolojiyi noninvaziv olarak değerlendirme ve mekansal olarak çözülmüş bilgi sağlama yeteneği, klinik öncesi araştırmalar için değerlidir. Hayvan modelleri arasında, genetiği değiştirilmiş hastalık modellerinin erişilebilirliği nedeniyle fareler en yaygın kullanılanlardır. Burada, 129Xe MRG, akciğer hastalığının ilerlemesini ve tedavi yanıtını uzunlamasına izlemek için minimal invaziv, radyasyonsuz ve hassas bir teknik olarak umut vericidir (ör., ilaç keşfinde). Bu teknik, gaz vermek için MRG ile tetiklenen, serbest solunum cihazı veya mekanik ventilatör dahil ederek klinik öncesi uygulamalara kadar uzanabilir. Burada, kalite kontrol için termal olarak polarize bir ksenon gazı fantomu oluşturma, polarizasyonu optimize etme, hayvan işleme (sedasyon, entübasyon, ventilasyon ve fareler için bakım) ve ventilasyon, kısıtlı difüzyon ve gaz değişim verileri için protokoller dahil olmak üzere sağlam veri toplama ve analizini sağlamak için adımları açıklıyor ve kontrol listeleri sağlıyoruz. Klinik öncesi 129Xe MRG çeşitli hayvan modellerinde (örneğin sıçanlar, domuzlar, koyunlar) uygulanabilirken, bu protokol, satın alınabilirlikleri ve birçok hastalık modelinin mevcudiyeti ile dengelenen küçük anatomilerinin yarattığı zorluklar nedeniyle farelere odaklanır.
Giriş
Pulmoner bozukluklar küresel morbidite ve mortalitenin önde gelen nedenleri olmaya devamederken1, son on yılda hasta sonuçlarında dramatik iyileşmeler görülmüştür. Bu gelişmeler kısmen iki faktör tarafından yönlendirilmektedir. İlk olarak, Faz III klinik çalışmalar artık mortaliteden ziyade son nokta olarak akciğer fonksiyonundaki değişikliklere öncelik vermekte ve ilaç denemelerini hızlandırmaktadır 2,3,4,5. İkinci olarak, geliştirilmiş hayvan modellerindeki ilerlemeler, hastalık mekanizmaları hakkında bilgi sağlamış ve tedavi geliştirmeye yardımcı olmuştur 6,7. Fare modelleri, insanlarla fizyolojik paralellikler, satın alınabilirlik ve hızlı hastalık gelişimi sundukları için genellikle translasyonel araştırmalar için tercih edilir. Genetik mühendisliği, mevcut modellerin yelpazesini ve kalitesini genişletti, Uluslararası Fare Türü Kaynağı şu anda sadece 4.218 sıçan türüne kıyasla 32.000'den fazla fare türüne8 sahiptir (Sıçan Genom Veritabanı9). Bu modeller, kronik obstrüktif akciğer hastalığı (KOAH)10, kistik fibroz (KF)11, pulmoner fibroz12,13, pulmoner hipertansiyon14,15 ve astım16 dahil olmak üzere bir dizi akciğer hastalığı için mekanik itici güçleri ve tedavi yanıtlarını araştırmak için yeni yollar açmıştır.
Ne yazık ki, fareleri içeren akciğer araştırmaları, hastalık yükünü ölçmek için mevcut tekniklerle sınırlıdır. Çalışmalar genellikle 1) tüm akciğer bilgisi (biyokimyasal tahliller) veya lokalize bilgi (histoloji) sağlayan ve 2) kesitsel tasarımlar ve büyük örneklem boyutları talep eden terminal prosedürlere dayanır. Bu nedenle, ne mekansal ne de zamansal hastalık dinamiklerini yakalarlar. Buna karşılık, non-invaziv, üç boyutlu görüntüleme, zaman içinde akciğerlerdeki yapıyı, moleküler süreçleri ve işlevi değerlendirebilir.
Akciğer yapısı (örneğin, hava yolu anormallikleri ve interstisyel fibroz), ultra kısa eko-time (UTE) MRI ve yüksek çözünürlükte mikrobilgisayarlı tomografi (μBT) ile görüntülenebilir. Fonksiyonel ve mekanik bilgiler (ör.ventilasyon, perfüzyon, tümör metabolizması ve enflamatuar süreçler) ekzojen kontrast ajanlar (ör., ksenon ile zenginleştirilmiş BT ve oksijenle güçlendirilmiş UTE) ve iyonlaştırıcı nükleer tıp yaklaşımları (ör., pozitron emisyon tomografisi [PET] ve tek foton emisyonlu bilgisayarlı tomografi [SPECT]). Bununla birlikte, normalden daha yüksek radyasyon seviyelerine sahip iyonlaştırıcı modaliteler kullanılmadan elde edilen mütevazı kontrast-gürültü (özellikle T1'in uzatıldığı klinik öncesi MRG için kullanılan yüksek manyetik alan kuvvetlerinde oksijenle güçlendirilmiş UTE için) nedeniyle fonksiyonel görüntüleme zordur. Bu modalitelerle görüntüleme, geleneksel dozlar kullanan hayvan modellerinde iyi tolere edilirken, kümülatif radyasyon, immünoloji, inflamasyon ve akciğer kanseri ile ilgili çalışmalarda sonuçları karıştırabilir17. Bununla birlikte, hiperpolarize (HP) ksenon-129 (129Xe) manyetik rezonans görüntüleme (MRG) minimal invaziv, ışınlayıcı olmayan ve oldukça hassas yapısal ve fonksiyonel bilgi sağlar. Bu teknik, amfizem 18,19, fibroz20, akciğer kanseri21, KOAH22 ve radyasyona bağlı akciğer hasarı23 gibi durumları tek veya çoklu zaman noktalarında karakterize etmek için klinik öncesi araştırmalarda kullanılmış olsa da, klinik öncesi ortamda yeterince kullanılmamaktadır.
Rutin, klinik öncesi 129Xe MRG'yi etkinleştirmek için, kurumsal düzenleyici destek, bir hiperpolarizasyon cihazı, bir 129Xe ayarlı radyo frekansı (RF) bobini ve çoklu nükleer özellikli bir tarayıcı dahil olmak üzere çeşitli ön koşullar gereklidir. Gelişmiş uygulamalar 24,25,26,27,28,29,30,31,32,33, bu protokolün kapsamı dışında kalan satıcıya özel darbe programlaması gerektirse de, temel uygulamalar mütevazı yazılım değişiklikleri ile elde edilebilir. Bu nedenle, klinik öncesi 129Xe MRG'ye özgü kalite kontrol, manyetizasyon işleme, veri toplama ve mekanik ventilasyon dahil olmak üzere hayvan işleme prosedürlerine odaklanıyoruz (Şekil 1).
Bugüne kadar, küçük hayvan 129Xe görüntüleme, her biri avantaj ve dezavantajlara sahip üç MR güvenli gaz verme yaklaşımı kullanmıştır: serbest nefes alma, piston tahrikli ve basınç düşüşü. Serbest solunum, entübasyon veya trakeostomiden yaralanma riski olmadan spontan solumaya izin verir, ancak önemli ölçüde daha fazla HP gazı tüketir ve hareket artefaktlarına neden olabilir34,35. Ticari piston tahrikli cihazlar kendi kendini kalibre eder ve kutudan çıkar çıkmaz kullanımı kolaydır, ancak aşırı derecede pahalı olabilir36. Burada kullanılan basınç düşüşü tabanlı yaklaşım literatürde iyi tanımlanmıştır, modüler, özelleştirilebilir ve açık kaynak kodu 37,38,39,40 tarafından çalıştırılır. Ayrıca, uygun maliyetlidir, tipik olarak toplam 10 bin dolardan az ve birkaç haftalık özel yapım süresidir. Basınç düşüşü ventilatörü, entübe edilmiş bir farenin hava yolu basıncını izlerken basınçlı bir teneke kutu içindeki bir doz torbasından 129Xe verir.
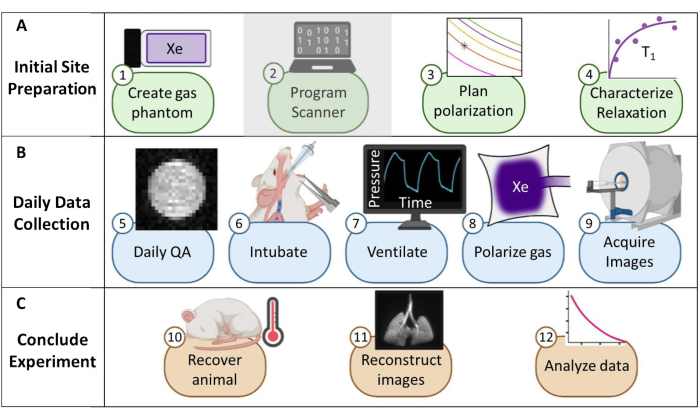
Şekil 1: Farelerde rutin ksenon-129 (129Xe) manyetik rezonans görüntüleme (MRG) toplama protokolüne genel bakış. (A) İlk kurulum adımları. (Not: tarayıcı programlaması her satıcı için benzersizdir ve bu protokolde açıklanmamıştır). (B) Günlük kalite güvencesi (QA) ve hayvan verilerini toplama adımları. (C) Başarılı deney sonucu ve veri analizi için adımlar. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Burada, 129Xe MRI verisinin üç yaygın sınıfını topluyor ve analiz ediyoruz: ventilasyon, difüzyon ağırlıklı görüntüleme (alveolar-hava sahası boyutu) ve gaz değişimi. Ventilasyon görüntüleri, solunan 129Xe gazının dağılımını göstermektedir. Akciğerlerin hava akımının azaldığı bölgeler HP gaz görüntülerinde karanlık görünür ve patoloji kusurlu ventilasyon hacmi ile ölçülür. İnsanlarda, ventilasyon kusuru yüzdesi (VDP), KOAH43,44,45 ve astım46,47 gibi hastalıklarda güçlü tekrarlanabilirlik 41,42 ve akciğer tıkanıklığına karşı yüksek duyarlılık göstermiştir.
Hava sahasındaki 129Xe atomunun kısıtlı difüzyonu, görünür difüzyon katsayısı (ADC) ile ölçülebilir ve hava boşluğu boyutu için bir vekil görevi görür. ADC, difüzyon ağırlığı olmadan bir temel görüntü (b0) ve bipolar gradyan kaynaklı difüzyon ağırlığı (bN) varlığında elde edilen bir veya daha fazla görüntü elde edilerek hesaplanır. Yüksek bir ADC, yaşlanma veya amfizematöz yeniden şekillenme nedeniyle hava sahası boyutundaki bir artışı yansıtır18,48. Ayrıca, çoklu b-değeri görüntülerinin (≥4) kullanılması, daha ayrıntılı morfometrik bilgilerin (örneğin, ortalama doğrusal kesişim) hesaplanmasına izin verir49,50.
Gaz değişimi, 1) kılcal zar dokusunda, plazmada ve RBC'lerde (kırmızı kan hücreleri) 129Xe'nin çözünürlüğü ve 2) bu bölmelerde çözündüğünde 129 Xe'nin >200ppm aşağı alan kimyasal kayması nedeniyle karakterize edilebilir. Hem spektroskopik hem de görüntüleme verileri, kardiyopulmoner hastalıklar (örneğin, pulmoner hipertansiyon ve sol kalp yetmezliği 51,52,53) hakkında bilgi sağlar. Birçok tür (insanlar, köpekler ve sıçanlar) her bölmeden kaynaklanan benzersiz spektral zirveler sergilerken, fareler hemoglobin-ksenon bağlanma bölgesi etkileşimlerindeki farklılıklar nedeniyle benzersiz bir RBC sinyalinden yoksundur. Bunun yerine, tüm çözünmüş bileşenler farelerde54 tek bir sinyalde birleştirilir. Bununla birlikte, orak hücre hastalığı54 modellerinde kullanılanlar gibi, insan hemoglobini eksprese eden transgenik farelerde belirgin bir RBC rezonansı gözlemlemek mümkündür. Genel olarak, çözünmüş 129Xe spektroskopisi ve görüntüleme, farelerde kardiyopulmoner patofizyoloji hakkında benzersiz bilgiler sağlar55,56.
Bu protokolü denemeden önce, fare çalışmaları için gerekli olan MRI tarayıcısı, mekanik ventilasyon ve fare işleme teknikleri hakkında arka plan bilgilerini anlamak gerekir. Hayvan çalışmalarına başlamadan önce, tüm prosedürler yerel Kurumsal Hayvan Bakımı ve Kullanımı Komitesi (IACUC) tarafından onaylanmalıdır57. Fare akciğerinde bulunan toplam manyetik moment doğası gereği düşük olduğundan (yani, tidal hacim ~ 250 μL), anatomik olarak eşdeğer çözünürlük elde etmek için voksel boyutunun insanlardan 1000 kat daha küçük olması gerekir. Murin solunum hızı da son derece hızlıdır (>100 nefes/dakika). Bu nedenle, tipik olarak insan görüntülemesi için kullanılan tek nefes tutma prosedürleri uygulanabilir değildir. Bunun yerine, her nefeste yalnızca birkaç RF uyarımı uygulanabilir, bu nedenle 129Xe görüntüsünün onlarca ila yüzlerce nefes boyunca kodlanması gerekir. Sinyal-gürültü oranını (SNR), çözünürlüğü ve tarama süresini dengelerken, alımların harici olarak tetiklenmesine izin vermek ve dilimleri, faz kodlamalarını ve/veya difüzyon ağırlıklı görüntüleri düzgün bir şekilde döngüye sokmak için darbe programlama gerekebilir. Burada ventilatör, veri toplamayı tetiklemek için nefes başına bir kez bir transistör-transistör mantığı (TTL) darbesi verir (Şekil 2).
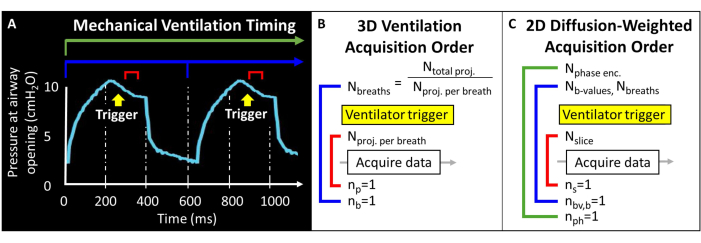
Şekil 2: Temsili mekanik ventilasyon ve veri toplama zamanlaması. (A) Kullanıcı kontrollü ventilasyon, inspirasyon sonunda, nefes tutma sırasında veya son kullanma sonunda veri alımını tetikleyebilir. (B) Bu 3D radyal ventilasyon dizisi için kullanıcı, elde edilen toplam projeksiyon sayısını ve nefes başına projeksiyon sayısını tanımlar. (C) Dilim seçici, 2B difüzyon ağırlıklı bir görüntü için kullanıcı, dilimlerin, b-değeri görüntülerin ve faz kodlamalarının sırasını tanımlar. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Güvenilir ventilasyon ve 129Xe iletimi sağlamak için sağlam sedasyon ve entübasyon prosedürleri gereklidir. Her çalışma için, dakika ventilasyonu, kalp atış hızı (HR) ve kan basıncındaki değişiklikler dahil olmak üzere her anestezinin aşağı yönlü etkileri dikkate alınmalıdır 58,59,60,61,62,63,64,65,66. Klinik öncesi HP gaz MRG için çeşitli sakinleştiriciler kullanılmış olsa da, kullanılabilirliği, maliyet etkinliği, güvenilirliği vesüresi nedeniyle ketamin, ksilazin ve asepromazin karışımı kullanıyoruz 67,68. Sakinleştirildikten sonra, etkili mekanik ventilasyon için hayvanlar entübe edilmelidir. Farelerin entübasyonu, anatomilerinin küçük boyutu nedeniyle zordur ve bu nedenle, bu teknikte kapsamlı bir şekilde eğitilmesi önemlidir. Araştırmacıları yayınlanmış video protokollerini incelemeye teşvik ediyoruz 69,70. Ticari entübasyon kanüllerinin çoğu paslanmaz çelik içerdiğinden, fare trakeal duvarı ile hava geçirmez bir sızdırmazlık oluşturmak için hava yolu çapına uyacak şekilde özelleştirilebilen metal içermeyen (yani MRI ve HP gazı uyumlu), kama şeklindeki kanüller yapmak için bir teknik sunuyoruz.
129Xe görüntüsü birçok nefeste toplandığından, ventilatör ayarları kritik öneme sahiptir. Akciğer hasarını önlemek için koruyucu ventilasyon stratejileri dikkatlice düşünülmelidir 71,72,73,74. Özellikle, düşük tidal hacim (TV), orta derecede pozitif ekspirasyon sonu basıncı (PEEP) ve alveolar işe alım manevralarının (RM'ler) kullanımı, insan hastalarda ve hayvan modellerinde ventilatöre bağlı akciğer hasarı riskini azaltır 75,76,77,78,79,80,81. Burada, basınç düşüşü 129Xe mekanik ventilasyon ile uyumlu, koruyucu olan ve yeterli 129Xe görüntü SNR sağlayan basit bir teknik öneriyoruz. Spesifik olarak, ventilatörün nefes verme hattına ticari bir PEEP valfi ekleyerek PEEP uyguluyoruz. RM'leri gerçekleştirmek için, ekshalasyon hattı kapatılmalıdır, böylece hayvan, hedef basınç ve süreye ulaşılana kadar ekshalasyon olmadan birden fazla inhalasyon alır.
Baştan sona genel ventilasyon ayarları sağlıyoruz, ancak belirli çalışma hedeflerini82,83 ele almak için literatürü gözden geçirmeniz tavsiye edilir. Mekanik ventilasyon sırasında en yüksek inspiratuar basıncın izlenmesine ek olarak, standart fare sıcaklığı izleme yöntemleri kullanılarak yapılabilen hayvanın sıcaklığının izlenmesi önemlidir. Görüntüleme için gerekli olmasa da, elektrokardiyogram (EKG) yoluyla kalp atış hızının izlenmesi avantajlı olabilir; EKG, bir hayvanın sedasyondan mı yoksa aşırı dozdan mı yoksa sıkıntılı mı uyandığını gösterebilir ve araştırmacının müdahale etmesine izin verebilir.
Tanımladığımız protokol, 129Xe 3D radyal ventilasyon verisi61, 2D GRE difüzyon ağırlıklı veri76 ve dinamik darbe elde eden spektroskopi gaz değişim verilerini toplamak için tasarlanmıştır. Bu protokol, küçük hayvan modellerinde yapılan klinik öncesi araştırmalar ile 129Xe MRG'nin pulmoner bozukluklar hakkındaki anlayışımızı ilerletme potansiyeli arasındaki boşluğu doldurmayı amaçlamaktadır.
Protokol
Burada açıklanan tüm yöntemler, Cincinnati Çocuk Hastanesi Tıp Merkezi Kurumsal Hayvan Bakımı ve Kullanımı Komitesi (IACUC) tarafından onaylanmıştır.
1. İlk saha hazırlığı
- Termal olarak polarize edilmiş bir 129Xe gaz fantomu oluşturun ve test edin (Şekil 3).
- Tümü 60 psig'ye kadar derecelendirilmiş bir borosilikat cam kap (~ 150 mL), önden sızdırmaz O-ringli bir piston valfi ve bir öğütülmüş borosilikat cam gövde elde edin. Manyetik parça olmadığından emin olun. Cam gövdeye bir sıkıştırma bağlantısı takın. Gaz geçirmez bir conta oluşturmak için sıkın.
- Kabı Şekil 3A'ya göre bir vakum pompasına ve oksijen rezervuarına bağlayın. Kabı 100 mTorr mutlak basıncın altına kadar vakumlayın.
- 129Xe T1'i > 30 dakikadan ~2 saniyeye düşürmek için kabı 1,5 atm basınca kadar oksijenle doldurun (7 T manyetik alan gücünde; 9.4 T tarayıcı için 1.6 atm oksijen kullanın). Mühür kabı.
NOT: Daha yüksek alan kuvvetleri için, T1≤ 2 s84'ü elde etmek için biraz daha yüksek oksijen kısmi basıncı gerekecektir. - Gaz geçirimsiz bir rezervuarı 400 mL izotopik olarak zenginleştirilmiş ksenon (%85 129Xe) ile doldurun.
NOT: Doğal bolluk ksenonu (%26 129Xe) da kullanılabilir, ancak SNR'deki ~3 kat azalmayı azaltmak için sinyal güçlendirmenin artırılması gerekecektir. - Gemiyi 129Xe rezervuarına bağlayın. 100 mTorr mutlak basıncın altına kadar vakum boruları.
- Ağzı açık, tezgah üstü sıvı N2 Dewar'ı ~%90'a kadar doldurun. O2'yi yoğunlaştırmak ve bir vakum oluşturmak için kabın tabanını (~ 5 cm) sıvı nitrojene batırın (Şekil 3B). Su altındayken, rezervuardan 129Xe'nin kaba akmasına izin vermek için valfi açın (Şekil 3C).
- Pistondaki giriş deliği O-ringi geçecek şekilde çekilene kadar gövdeyi yavaşça çekerek piston valfini kapatın. Delik O-ringi geçtikten hemen sonra, kabı kapatmak için elle sıkın. Kabı sıvı nitrojenden çıkarın ve çözülmesine izin verin.
NOT: Çözüldükten sonra, kap ~ 4.5 atm'ye (2 atm O2 + 2.5 atm 129Xe) kadar basınç uygulayacaktır. - Cam eşyaları koruyun (örneğin, kabı yastıklı polivinil klorür (PVC) boru kabına yerleştirin, Şekil 3D).
NOT: Düzgün bir şekilde bakımı yapılırsa, fantom basıncı on yıl veya daha uzun süre koruyabilir. - Fantomun T1'ini ölçün (örneğin, spektroskopik bir inversiyon kurtarma dizisi kullanarak). 7 T tarayıcılar için T1 < 2 sn onaylayın. Kalite güvencesi (QA) için zaman içinde sinyali ve T1'i takip edin.
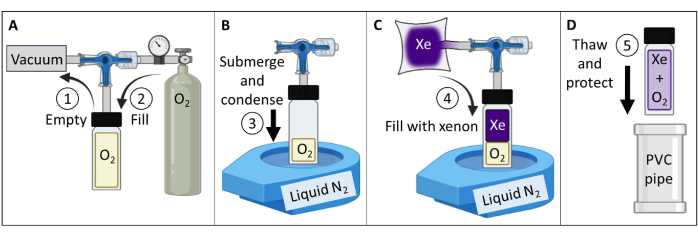
Şekil 3: Adım 1.1'de ayrıntıları verilen protokol tarafından yönlendirilen termal olarak polarize bir 129Xe gaz fantomunun oluşturulması. O2 ve 129Xe kısmi basınçları, T1'i uygun 129Xe T1 katı ve belirli bir alan kuvvetinde84 sinyal gücü verecek şekilde özelleştirmek için değiştirilebilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
- Termal olarak polarize gaz fantomu ile kalite güvencesi gerçekleştirin (Tablo 1 ve Şekil 4).
- 129Xe bobinini mıknatısın izomerkezine yerleştirin ve 129Xe gaz fantomunu bobin içinde ortalayın. Tek bir darbe ve alma dizisinde ("tek darbe"), çalışma frekansını fantomdaki yaklaşık 129Xe gaz frekansıyla eşleşecek şekilde ayarlayın (7T'de ~ 83.07 MHz).
- Alım ve uyarma frekanslarını 129Xe Larmor frekansına ortalayın ve bu frekansı tüm fantom kalibrasyonu ve kalite kontrol 129Xe taramaları için kullanın. Tüm QA taramaları için deneysel parametreler için Tablo 1'e bakın. Fantomun bir fantom yerelleştirici ile ortalandığını onaylayın (Şekil 4A).
- Çevirme açısını kalibre etmek için nütasyon deneyi yapın: SNR'nin yeterli olduğunu varsayarsak, tekrarlama süresi (TR) aralığı 5 x T1 > olan tek RF darbeleri kullanın. Her alım için, sinyal boşa çıkana ve tersine dönmeye başlayana kadar RF gücünü kademeli olarak artırın. Burada kullanılan standart şudur: darbe sayısı = 65; TR = 10 sn; darbe süresi = 125 μs; RF gücü = 1-13,8 W, 0,2 W artırıldı
- Fourier dönüşümü ve fazı ilk spektrumu (yani, en düşük RF gücüyle elde edilen spektrum). Tüm spektrumlar için aynı fazlamayı uygulayın. Gerçek spektrumları RF darbe gücünün bir fonksiyonu olarak çizin (Şekil 4B).
- Boş bir tepe üreten güç (yani minimum tepe yüksekliği) 180° çevirme açısına karşılık gelir. 180° çevirme açısını üretmek için gereken darbe uzunluğunun yarısında aynı gücü kullanarak 90° çevirme açısı elde edin. Tarayıcı yazılımının izin verdiğini varsayarsak, sonraki çevirme açısı ölçeklendirmesi için bu 90° referans gücünü ve darbe uzunluğunu ayarlayın.
- 129Xe spektrumunun (TR ~ 1 s) maksimum yarısında tam genişliği en aza indirerek şim yapmak için tek bir darbe kullanın. Gerekirse, şimlemeden sonra frekansı yeniden ortalayın. Tam genişlikte yarım maksimumu kaydedin.
- 129Xe QA taramasını çalıştırın (Tablo 1 ve Şekil 4C). QA verilerini kaydedin: SNR, ortalama hayalet sinyal ve gürültünün standart sapması.
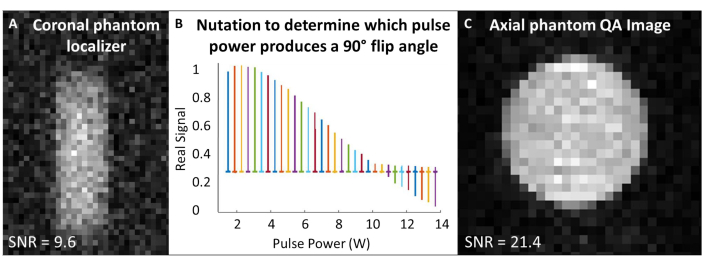
Şekil 4: Ön tarama kalite güvencesi. (A) Düşük çözünürlüklü bir 2D GRE koronal fantom yerelleştirici, fantomun mıknatısta ortalanmasını sağlar. (B) 90°'lik bir darbe ayarlamak için yapılan bir nütasyon deneyi, 180°'lik darbede boş bir tepe noktası gösterir. (C) Çevirme açısını yerelleştirdikten ve kalibre ettikten sonra, daha yüksek çözünürlüklü bir 2D GRE QA görüntüsü elde edin. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| Protokol Kısa Adı | Sıra Açıklaması | GİRİŞ (ms) | TE (ms) | Ortalamalar / Tekrarlar | Çevirme Açısı (°) | Matris Boyutu veya Nnokta | Görüş Açısı (mm2) | RF Siyah Beyaz (kHz) | Dilim / Döşeme Kalınlığı (mm) | Tarama Süresi |
| Tek nabız | Nabız edinme | 1000 | 1 / 1 | 60 | 2048 | 10 | 1 Saniye | |||
| Fantom yerelleştirici | 2D GRE (Türkçe) | 200 | 3.7 | 20 / 1 | 48 | 60 × 32 | 120 × 48 | 3 | 60 | 2 dk |
| Çevirme açısı kalibrasyonu | Nabız edinme | 7000 | 1 / 65 | 20 | 2048 | 5.12 | 7,5 dk | |||
| 129Xe Kalite Güvencesi | 2D GRE (Türkçe) | 5000 | 3.3 | 8 / 1 | 90 | 322 | 322 | 3 | 40 | 21 dk |
Tablo 1: Fantom kalibrasyon kalite güvence dizisi parametreleri. TR = tekrarlama süresi, TE = yankı süresi, Npts = nokta sayısı, FOV = görüş alanı, BW = bant genişliği. Bu Tabloyu indirmek için lütfen buraya tıklayın.
- Polarizasyonu planlayın (Şekil 5A, B).
- Polarize 129Xe hacim ve biriktirme süresini seçin: 15 dakikada 400 mL bu protokol için idealdir (Şekil 5) ancak diğer uygulamalar ve ekipmanlar için kolayca ayarlanabilir.
- Hiperpolarizör içinde bilinen bir ölü hacim olduğunu varsayarsak (örneğin, Völü hacim = 80 mL), istenen dağıtılan bir hacim V için akış hızını (SLM'de FXe), 129Xe gaz fraksiyonu f ve biriktirme süresi tacc'yi hesaplayın:
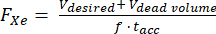 (1)
(1)
NOT: Daha uzun üretim süreleri tipik olarak daha yüksek polarizasyona neden olurken, in vivo görüntüleme için pratik olmayabilir. Üretim süresini ve polarizasyonu dengeleyecek bir akış hızı belirlemek için hiperpolarizör 85,86,87,88 için uygun bir model kullanın. Burada J. W. Plummer ve ark.89'un modeli (Şekil 5A) kullanılmıştır. Bu, sürekli akışlı polarizörler için geçerlidir ve durdurulmuş akışlı hiperpolarizörler90 için geçerli değildir. - Gazı bu parametrelere göre polarize edin, polarizasyonu ticari veya ev yapımı bir cihazla ölçün ve QA için öngörülen polarizasyonla karşılaştırın.
- Taşıma sırasında polarizasyon kaybını ölçün. Polarizasyon yeterince büyük bir miktarda azalırsa (örneğin, %>10), nakliye sırasında polarizasyonu korumak için manyetik bir taşıma çantası oluşturun. Bkz. Ek Dosya 1: Taşıma sırasında polarizasyonun yönetilmesi ve Ek Şekil 1.
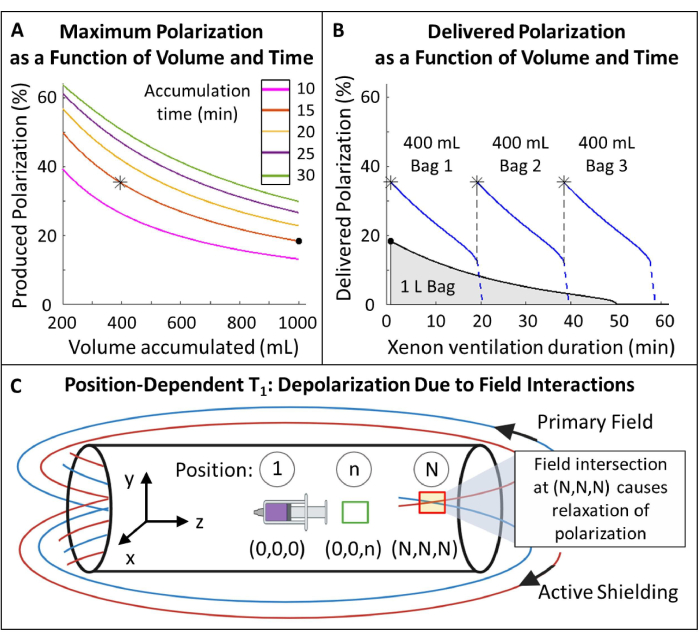
Şekil 5: Polarizasyon yönetimi. (A) Polarizasyon ve üretilen hacim, birikim süresi ve akış hızının bir fonksiyonudur. 400 mL'lik bir gaz torbası, 20 dakika boyunca yüksek başlangıç polarizasyonu (~% 35) sağlar. 1 L gaz kullanmak çekici görünse de, daha düşük bir başlangıç polarizasyonuna (~%20) sahip olacaktır. (B) ~ 15 dakikalık havalandırmadan sonra, 1 litrelik bir HP 129Xe partisi %<10 polarizasyona kadar tükenirken, 600 mL gaz116 olarak kalır. Bu nedenle, 129Xe'nin birden fazla 400 mL'lik torba kullanılması, daha yüksek ortalama iletilen polarizasyonu korur. C) Birincil alan ile aktif koruma alanının kesiştiği konumlar ((N,N,N)) konumundaki kırmızı kutu) HP 129Xe'nin hızlı bir şekilde gevşemesine neden olabilir. Mıknatısın saçak alanının karakterize edilmesi, HP 129Xe rezervuarlarının hızlı bir gevşeme olmadan yerleştirilebileceği güvenli bölgelerin belirlenmesine yardımcı olur ((0,0,n) konumunda yeşil kutu). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Ek Dosya 1: Taşıma sırasında polarizasyonun yönetilmesi. Bu dosyayı indirmek için lütfen buraya tıklayın.
- Kenar alanı içinde HP 1Xe'nin konuma bağlı T 129'iniölçün (Şekil 5C).
- X, Y ve Z boyutları boyunca mıknatıs izomerkezine göre bilinen mesafelere ve konumlara sahip referans noktaları oluşturun. İzomerkezi etiketleyin ve n'den N'ye kadar olan diğer konumları etiketleyin. Araştırılacak pozisyonların sayısı mevcut alana bağlı olacaktır.
- 129Xe'lik (~ 250 mL) küçük bir hacmi hiperpolarize edin ve MRI kontrol odasına taşıyın. Büyük bir şırıngayı (50-100 mL) 129Xe ile doldurun ve mıknatıs içindeki izomerkeze yerleştirin (Şekil 1C'deki Konum 5). Sinyali ölçmek için ~1° çevirme açısı darbesi çalın.
- Şırıngayı ~ 10 dakika boyunca yerinde bırakın, ardından başka bir spektrum elde edin. Sinyal en az 1 T1 bozulana kadar (yani, sinyal başlangıç değerinin ~1/3'üne düşene kadar) sinyali her 10 dakikada bir yeniden ölçün.
- Adım 1.4.2'yi tekrarlayarak yeni bir 129Xe şırınga ile yeni bir T 1 deneyi başlatın.
- Şırıngayı yeni bir konuma getirin (örneğin, Şekil 5C'deki Konum n) ve 10 dakika orada bırakın. Ek bir ~ 1 ° çevirme açısı spektrumu elde etmek için şırıngayı izo merkezine geri koyun.
- Bu işlemi tekrarlayın: şırıngayı Konum n'ye getirin, 10 dakika bekleyin, tekrar izomerkeze koyun ve sinyali en az 1 T1 bozulana kadar yeniden ölçün.
- X, Y ve Z yönlerini kapsayan kalan referans konumları için Adım 1.4.4 - 1.4.6'yı tekrarlayın.
- İlk sinyal (S0), θ çevirme açısına sahip n RF darbesi üzerinde monoüstel olarak bozunacaktır. Her konumdaki T1'i hesaplamak için sinyali (S) zamanın (t) bir fonksiyonu olarak saçak alanına yerleştirin:
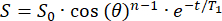 (2)
(2) - 129Xe rezervuar yerleşimi için yeterli T1 (>20 dk) olan bir konum belirleyin.
- Metal içermeyen entübasyon kanülleri oluşturun (Şekil 6).
- Luer konektörlü iki damarlı kalıcı politetrafloroetilen (PTFE) kateter edinin. İğneleri keskin bir atık kabına atın.
NOT: >25 g fareler için 18 G ve 20 G kateter kullanın. Daha küçük hayvanlar için 20 G ve 22 G kateterler kullanın. - Luer konektörünü kateterlerden kesin. Daha keskin bir şekilde sivrilen ve daha uzun bir kanül oluşturmak için daha küçük kateteri daha büyük kateterin üst ucuna besleyin. Kompozit kanülü, Luer tabanı dahil değil, eğimli bir uçla ~ 4.6 cm'ye kadar kesin (Şekil 6A, B).
- 200 μL'lik bir pipet ucunun geniş ucunu ~2,6 cm uzunluğunda kesin (Şekil 6C).
- Pipet ucunun içini genel kalıp ayırıcı yağlayıcı ile kaplayın. Kayganlaştırıcıyı ince bir şekilde dağıtmak için içine yerleştirilmiş başka bir pipet ucu kullanın. Pipet ucunu asetoksi silikon vulkanize edici macun epoksi ile doldurun (Şekil 6D, E).
- Kanülü her iki ucundan dışarı uzanan 22 G tel ile takın. Kanül tüpünü pipet ucundaki silikondan geçirin. Tüpü pipet ucunun ucunu ~7 mm geçecek şekilde uzatın (Şekil 6F, G).
- Pipet ucunun daha geniş tarafındaki kanül tüpünü plastik bir erkek slip Luer konektöründen geçirin ve parçaları epoksi ile birbirine yapıştırın. Luer konektörünü geçen boruyu kesin (Şekil 6H).
- Epoksinin kurumasını bekleyin (>24 saat), ardından silikon entübasyon kanülünü pipet ucu kalıbından dikkatlice çıkarın. Tüpün tıkanmadığından emin olarak teli kanülden çıkarın (Şekil 6I).
- Kolay entübasyon için bir tutamak yapmak için, boruyu (1/16" veya 1/8") bir dişi Luer konektörüne bağlayın. Entübasyon için hazır olduğunuzda, bu dişi Luer konektörünü erkek Luer entübasyon kanülüne bağlayın. Bu parça entübasyon sonrası kolayca çıkarılabilir (Şekil 6J).
- Hayvanlarda her kullanımdan önce sterilize edin: kanülün dışını %70 alkolle silin. 20 G teli dezenfektanla silin, ardından içini sterilize etmek ve tıkanıklık olmadığından emin olmak için teli kanülden geçirin.
- Luer konektörlü iki damarlı kalıcı politetrafloroetilen (PTFE) kateter edinin. İğneleri keskin bir atık kabına atın.
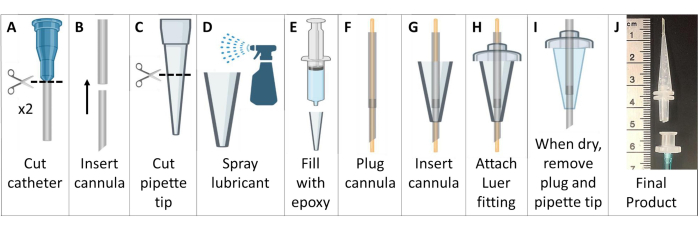
Şekil 6: MRG ve HP 129Xe uyumlu fare entübasyon kanülleri oluşturma. Bu kanüller, Adım 1.5'te açıklandığı gibi venöz kateterler, pipet uçları ve silikon sızdırmazlık maddesinden yapılmıştır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
2. Günlük veri toplama
NOT: Bkz. Ek Dosya 2: Klinik öncesi tarama QA kontrol listesi.
Ek Dosya 2: Klinik öncesi tarama QA kontrol listesi. Bu dosyayı indirmek için lütfen buraya tıklayın.
- Günlük tarayıcı kalite kontrolünü tamamlayın ve ventilatör kurun (Şekil 4).
- Fantomlarla, tarayıcıda QA protokollerini çalıştırın (QA tarama parametreleri için Tablo 1'e ve günlük kalite kontrol adımları için Adım 1.2'ye bakın).
- Ventilatörü J. Nouls ve ark.38'in yöntemine göre kalibre edin. Bkz. Ek Dosya 3: Ventilatör kalibrasyonu , Ek Şekil 2 ve Ek Şekil 3.
- İnspirasyon sonunda görüntüleme için ventilatör ayarlarını yapın (Tablo 2). Hayvan yatağını tarayıcı rafına ve yaşam destek modülünü (yani mekanik ventilatör parçaları) tarayıcının yanındaki masaya yerleştirin.
- Sahaya özel hayvan ısıtma sistemini etkinleştirin. Bir ısıtıcıyı 35.5 - 40 °C'ye ayarlayın, sirkülasyon havasını açın ve tarayıcının deliğini önceden ısıtmak için hava hortumunu hayvanın başının dayanacağı yerin ~5" yakınına yerleştirin.
| Havalandırma Ayarı | Şunun için öneri: HP 129Xe MRI | Notlar |
| Gelgit hacmi (TV) | 8–10 mL/kg ideal vücut ağırlığı | ılımlı TV; düşük TV, görüntülerde hareket artefaktlarına neden olabilecek daha yüksek BR gerektirir |
| Pozitif ekspirasyon sonu basıncı (PEEP) | 2–6 cmH2O | |
| Nefes hızı (BR) | 80–120 br/dk | |
| İşe alım manevraları (RM'ler) | ~35 cmH2O her 6 saniyede bir 5 dakikada bir | |
| Havalandırma süresi; Konum | < 6 saat; sırtüstü | Göğüs hareketini daha iyi görmek için sırtüstü |
| İnspire edilen oksijen oranı (FIO2) | 0.3–0.5 | Anestezi uygulanmış farelerde hipoksiyi önleyin |
| İnspiratuar-ekspiratuar oran (I:E) | 1:2–1:4 | |
| Toplam döngü süresine inspiratuar | 0.2–0.4 | |
| Dakika havalandırması | ≥0.57 mL·g-1·min-1 | |
| Standartlarımız: | ||
| BR = 80 br/dk, inspirasyon süresi = 200 ms, FIO2 = 0.3 | ||
| İnspirasyon sonunda görüntüleme: nefes tutma = 200 ms, tetikleme gecikmesi = inspirasyonun başlamasından 200 ms sonra | ||
| Nefes tutma sırasında görüntüleme: nefes tutma = 250 ms, tetikleme gecikmesi = inspirasyonun başlamasından 250 ms sonra | ||
| Sona erme sonunda görüntüleme: nefes tutma = 200 ms, tetikleme gecikmesi = inspirasyonun başlamasından 650 ms sonra | ||
Tablo 2: 129Xe görüntüleme için önerilen ventilatör ayarları. Parametreler, belirli çalışma hedefleri ve deney koşulları 117,118,119,120,121,122,123,124 için ince ayar yapılabilir. Bu Tabloyu indirmek için lütfen buraya tıklayın.
Ek Dosya 3: Ventilatör kalibrasyonu. Bu dosyayı indirmek için lütfen buraya tıklayın.
- Hayvanı sakinleştirin ve entübe edin.
- İnkübatörü 27.7 °C'ye ve/veya elektrikli ısıtma yastığını 37.7 °C'ye getirin. Hayvanın vücut kütlesini ölçün ve kaydedin. Kütleye göre yatıştırıcı dozu hesaplayın. Tipik bir doz rejimi için Tablo 3'e bakınız.
- Sakinleştiriciyi intraperitoneal olarak enjekte edin. Enjeksiyon zamanını not edin ve bir sonraki sakinleştirici dozu için zamanlayıcıyı ayarlayın.
NOT: Sedasyon altındaki süreyi ve aşırı doz riskini en aza indirmek için Bölüm 2'deki (Günlük veri toplama) kalan adımları mümkün olan en kısa sürede tamamlayın. - Hayvanın gözlerine göz kayganlaştırıcı sürün ve hipotermiyi önlemek için hayvanı ısıtma yastığı üzerindeki bir kafese veya bir kuluçka makinesine yerleştirin.
- Sakinleştirici enjeksiyondan 10-15 dakika sonra bir ayak parmağı çimdikleme testi yaparak hayvanın tamamen yatıştırıldığını onaylayın68. Das ve ark.69'da belirtilen prosedürleri takip ederek entübe edin.
NOT: Das ve ark.69'un makalesine, tekniğin kapsamlı bir video gösterimi eşlik etmektedir. Adımlar aşağıdaki gibidir: - Hayvanı sırtüstü dişlerinden eğimli bir tahtaya asın. Dili çıkarmak için bir kemirgen dil bastırıcı kullanın.
- Ses tellerinin görünür olduğundan emin olmak için, entübasyon kanülü içindeki bir fiber optik kablo veya boğazın dışına yerleştirilen parlak bir ışık aracılığıyla beyaz ışık sağlayın. Kanülü ses tellerinin 5 mm'den daha az bir ötesine yerleştirin.
- Kanülü, içinde küçük bir su damlası bulunan bir boru parçasına bağlayarak yemek borusunda değil trakeada olduğundan emin olun. Su damlası hayvanın nefesleriyle birlikte hareket ederse, konumlandırma muhtemelen doğrudur.
| Aracı | Doz | Rota | Süre | Yorum | |||
| Solunan Ajanlar | |||||||
| İzofluran | İndüksiyon: %4-%5 Bakım: %1– %3 veya etkili olmak için | Inhale | Sürekli akış sırasında | • Kalibre edilmiş buharlaştırıcı kullanımı gerektirir | |||
| Enjekte Edilebilir Ajanlar | |||||||
| Önerilen: Ketamin + ksilazin + asepromazin | 90 + 9 + 3 mg / kg | İntraperitoneal | 20-60 dk | • Hipotermiye yatkınlık yaratır | |||
| • Tekrarlanan dozlama için, aşırı dozu önlemek için bir ketamin + ksilazin karışımına geçilmesi önerilir. | |||||||
| • Yıprandıkça sallanmaya neden olur. Görüntüleme için kesinlikle doz programına uyun | |||||||
| • Bradikardiye neden olabilir | |||||||
| Ketamin + ksilazin | 90 + 9 mg / kg | İntraperitoneal | 20-40 dk | • Yukarıya bakın (Ketamin + ksilazin + asepromazin) | |||
| Pentobarbital | 50 - 70 mg / kg | İntraperitoneal | 20-60 dk | • Solunum hızını ve hareketini bastırır | |||
| • Gider maliyet engelleyici olabilir | |||||||
| • Farmasötik sınıf mevcut olmayabilir | |||||||
| Yasal Uyarı: Bunlar genel yönergelerdir. Uygulamadan önce daha fazla bilgi için bir veterinere danışın. | |||||||
Tablo 3: Fareler için ortak anestezik formüler. Bu Tabloyu indirmek için lütfen buraya tıklayın.
- Hayvanı havalandırın (Tablo 2).
- Hayvanı entübasyon kanülü üzerindeki Luer konektörü ile ventilatöre bağlayın. Diyafram hareketini ve tepe inspiratuar basıncı izleyin (10 mL / kg vücut ağırlığı tidal hacmi için ~ 10-12 cm H2O). Basınç veya solunum hareketi anormal ise, kanülün boyun açısını ve derinliğini gerektiği gibi dikkatlice ayarlayın.
- Bir işe alım manevrası yaparak entübasyon kanülünün hava geçirmez olduğundan emin olun: ekshalasyonu önleyin (örneğin, bir parmakla, nefes verme portunu bloke edin), böylece hayvan nefes vermeden birden çok kez nefes alır.
NOT: Hava yolu basıncı ~ 6 s'nin üzerinde 35 cmH2O tepe inspiratuar basıncına ulaşırsa, hava yolu contası yeterince sıkıdır. Değilse, sorun giderme için tartışmaya bakın. - Normal ekshalasyonun devam etmesine izin verin. Akciğer uyumunu korumak ve atelektaziyi önlemek için taramalar arasında ve tarama yapılmadığında her ~ 5 dakikada bir işe alım manevraları yapın. PEEP valfini nefes verme hattına bağlayın. PEEP'i 4 cmH2O'ya ayarlayın. En yüksek inspiratuar basıncın bu miktarda artmasını izleyin.
- Başarılı bir entübasyondan sonra, hayvanın tarama sırasında uyanmasını önlemek için HP 129Xe üretimini sedatif yeniden doz programına göre planlayın ve başlatın. Deney boyunca vücut ısısını izleyin.
- Veri toplama: Havalandırma görüntülerini toplayın.
NOT: Veri Toplama Adımları 2.4, 2.5 ve 2.6 herhangi bir sırayla yapılabilir- Son inspirasyonda görüntüleme için ventilatörü Tablo 2'ye göre ayarlayın.
- Aşağıdaki kurulum protokollerini yükleyin: proton hayvan lokalizatörü, fare akciğerlerindeki gaz frekansını merkeze almak için tek darbe ve 129Xe hayvan lokalizatörü. Tarama parametreleri için Tablo 4'e bakın.
- Hayvanı izomerkeze yerleştirin ve torasik boşluğun proton lokalizasyonu ile görüş alanının merkezinde olduğunu onaylayın. Tek frekanslı bobinler kullanıyorsanız, proton bobinini 129Xe ayarlı bir RF bobini ile değiştirin.
- 129Xe polarizasyonunu kaydedin ve MRI tarayıcısına taşıyın. Bkz. Ek Dosya 4: Ksenon polarizasyonu QA kontrol listesi.
- Ventilatör kabının içine 129Xe'lik bir torba yerleştirin ve kapatın. Kutuyu ventilatör ile aynı hizada bağlayın ve kutunun basınçlanmasına izin verin (3 - 6 psig).
- 129Xe mekanik ventilasyonu başlatın. 129Xe ventilasyonu her etkinleştirildiğinde, akciğerlerin işlevsel kalıntı kapasitesini tersine çevirmek için bir taramaya başlamadan önce hayvanın ~ 5 nefes almasına izin verin.
NOT: Hiperpolarize gazı korumak için 2 Xe taraması arasında N 129/O 129karışımına geçin. - Tek bir darbe kullanarak, çalışma frekansını gazlı 129Xe'nin (7 T'de ~83.07 MHz) in vivo rezonans frekansına uyacak şekilde ayarlayın. Frekansı sonraki tüm gaz fazı 129Xe taramalarına kopyalayın. Akciğerlerin izomerkezde olduğunu doğrulamak için 129Xe lokalizasyonu gerçekleştirin.
- 129Xe radyal havalandırma sırasını yükleyin ve çalıştırın. En yüksek inspiratuar basıncı izleyin.
NOT: Protokol tamamlanmadan önce 129Xe gazı biterse, tepe inspiratuar basınç hızla düşecektir. 400 mL'lik 129Xe'lik bir torba, ideal vücut ağırlığının 10 mL/kg'lık bir tidal hacmi ile dakikada 80 nefeste %70 129Xe ile havalandırıldığında 30 g'lık bir fareyi ~24 dakika boyunca havalandırabilir. - Tarama bittiğinde, N2/O2 karışımı ile havalandırmaya geçin ve boş 129Xe torbasını çıkarın.
- Ekspirasyon sonunda görüntüleme için, nefes tutma süresini değiştirin ve gecikmeyi Tablo 2'ye göre değiştirin ve Adım 2.4.2 - 2.4.9'u tekrarlayın.
- Ham verileri tarayıcıdan dışa aktarın.
| Protokol Kısa Adı | Sıra Açıklaması | Tetiklemek | GİRİŞ (ms) | TE (ms) | Tekrarlamaların | Çevirme Açısı (°) | Matris Boyutu veya Nnokta | Görüş Açısı (mm2) | RF Siyah Beyaz (kHz) | Dilim/Döşeme Kalınlığı (mm) | Tarama Süresi |
| Tek nabız | Nabız alımı (gaz fazı) | Opsiyonel | 1000 | 1 | 60 | 2048 | 10 | 1 Saniye | |||
| Hayvan yerelleştirici | 2D GRE (Türkçe) | Evet | 50 | 1.7 | 1 | 60 | 642 | 322 | 3 | 25 | 60 Saniye |
| Radyal Havalandırma | 3D Çoklu yankı radyal | Evet | 20 | Başlığa bakın | 1 | 30 | 613 | 223 | 32.05 | 30 | 16 dk |
| Çözünmüş faz tek darbe | Nabız edinme (çözünmüş faz) | Hayır | 80 | 1 | 90 | 512 | 10.35 | 80 ms | |||
| Çözünmüş faz dinamiği özelliği. | Nabız edinme (çözünmüş faz) | Hayır | 50 | 1000 | 90 | 512 | 10.5 | 50 Saniye | |||
| Difüzyon ağırlıklı | 2D GRE (Türkçe) | Evet | 12.2 | 8.1 | 4 | 45 | 642 | 322 | 3 | 1.5 | 18 dk |
Tablo 4: İn vivo dizi parametreleri. Daha önce açıklanan 3D çok yankılı radyal ventilasyon dizisi39 , 6 yankı süresinde görüntü alır. Sonuçlar ilk yankı görüntüsü için gösterilmiştir (TE = 1.12 ms, Şekil 7). Bu Tabloyu indirmek için lütfen buraya tıklayın.
Ek Dosya 4: Ksenon polarizasyonu QA kontrol listesi. Bu dosyayı indirmek için lütfen buraya tıklayın.
- Veri toplama: Dinamik çözünmüş faz spektroskopisini çalıştırın.
- Nefes tutma sırasında görüntüleme için ventilatörü Tablo 2'ye göre ayarlayın. BR'yi 100 nefes/dk'ya ayarlayın. Adım 2.4.2 - 2.4.5'teki gibi yeni bir 129Xe çantası hazırlayın.
- 129Xe mekanik ventilasyonu başlatın. Çalışma frekansını çözünmüş frekansla (83.084 T'de ~7 MHz) eşleşecek şekilde ayarlamak için tek bir darbe yükleyin ve çalıştırın. Çalışma frekansını çözünmüş faz dinamik spektroskopisine kopyalayın.
NOT: Bu, vahşi tip hemoglobin54 olan farelerde tek bir tepe olacaktır. - Hayvan akciğerlerindeki çözünmüş frekansa odaklanan dinamik spektroskopi dizisini yükleyin ve çalıştırın. Tarama bittiğinde, N2/O2 karışımı ile havalandırmaya geçin ve boş 129Xe torbasını çıkarın. Ham verileri tarayıcıdan dışa aktarın.
- Veri toplama: Difüzyon ağırlıklı görüntüleri toplayın.
- Nefes tutma sırasında görüntüleme için ventilatörü Tablo 2'ye göre ayarlayın. Adım 2.4.2 - 2.4.7'deki gibi 129Xe'lik yeni bir çanta için hazırlanın.
- Difüzyon ağırlıklı diziyi yükleyin ve çalıştırın. Tarama bittiğinde, N2/O2 karışımı ile havalandırmaya geçin ve boş 129Xe torbasını çıkarın. Ham verileri tarayıcıdan dışa aktarın.
3. Deneyin sonuçlandırılması
- Hayvanı kurtarın.
- Entübasyon kanülünü hayvanın ağzından düz bir şekilde çekin. Hayvan hemen kendiliğinden nefes almaya başlamazsa, hafif göğüs kompresyonları uygulayın. Varsa, sedasyon iyileşmesini desteklemek için hayvanın yüzüne yakın hafif bir tıbbi sınıf oksijen akışı uygulayın.
- Hayvan kendi kendine sürekli nefes aldığında ve hayvan >2 saat boyunca sakinleştirilmişse, dehidrasyonu önlemek için deri altına 0.5 - 1 mL normal salin uygulayın.
- Hayvanı kendi başına bir kafese geri koyun. Kafesi bir kuluçka makinesine veya bir ısıtma yastığına yerleştirin.
NOT: Sedasyonlu hayvanlar yamyamlığa karşı savunmasızdır ve tamamen iyileşene kadar (yani bağımsız olarak yürüyene) kafes arkadaşlarıyla birlikte bir kafese yerleştirilemez. Sedasyonlu hayvanlar vücut ısılarını düzenleyemezler. Hayvanın sıcaklığını birkaç dakikada bir hissetmek için elinizin arkasını kullanın. - Hayvanı, düzeltme refleksi geri dönene kadar yakından izleyin (yani, bağımsız olarak sırtüstü pozisyondan yüzüstü pozisyona geçebilir).
- Hayvanı bağımsız olarak yürüyebildiğinde ısı desteğinden çıkarın. Hayvanı kafes arkadaşlarıyla birlikte bir kafese geri koyun.
NOT: Hayvanın kafes arkadaşı yoksa, sedasyona bağlı hipotermiye karşı daha hassastır. Hayvana ekstra yatak takımı sağlayın ve varsa hayvanı gece boyunca bir kuluçka makinesinde bırakın. - Sağlığını izlemek için hayvanın ağırlığını 2 hafta boyunca haftada bir kez kaydedin.
NOT: Hayvan entübasyon nedeniyle ağızda veya yemek borusunda bir yaralanma meydana gelirse, yemek yemeyi bırakabilir. Hayvan başlangıçtaki vücut ağırlığının% >20'sini kaybederse, ötenazi hakkında bir veterinere danışın.
- Ventilasyon görüntülerini analiz edin (Şekil 7).
- Ham verileri bir programlama platformuna yükleyin. Kartezyen olmayan Görüntüler için açık kaynaklı yeniden yapılandırma çerçevesini indirin91.
- Görüntüleri açık kaynak çerçeve talimatlarına göre yeniden oluşturun. Her radyal projeksiyondaki ilk noktayı normalleştirin39.
- Düşük veya hiç 129Xe sinyali olmayan vokseller de dahil olmak üzere görüntülerde akciğer parankimini segmentlere ayırın. Büyük hava yollarını dahil etmeyin. Akciğerler, solunum yolları ve görüntüleme artefaktları hariç olmak üzere görüntüdeki arka plan gürültüsünü bölümlere ayırın.
NOT: Proton lokalizatör görüntüsü, parankimal sınırların belirlenmesine yardımcı olabilir. - Aşağıdaki formülü kullanarak SNR'yi hesaplayın:
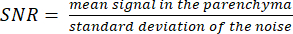 (3)
(3) - Arızalı havalandırmayı ölçün.
NOT: Küçük hayvan modellerinde bozulmuş ventilasyonu ölçmek için çeşitli yöntemler önerilmiştir. Analiz yöntemleri açık bir araştırma alanı olmaya devam etmektedir, ancak kolayca uygulanan yaklaşımlar şunları içerir: (i) Yarı kantitatif manuel segmentasyon92, (ii) Parankimal sinyali47 normalleştirmek için trakeadan gelen sinyali kullanan histogram yaklaşımı ve (iii) Toplam akciğer hacmini (TLV) segmentlere ayırmak ve akciğerleri kusurlu hacim ve ventilasyonlu akciğer hacmine (VV) bölmek için bir sinyal eşiği (örneğin, tüm akciğer ortalamasının %<60'ı) tanımlama. VDP 93,94'ü aşağıdakilere göre ölçün:
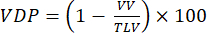 (4)
(4)
- Çözünmüş faz dinamik spektroskopisini analiz edin (Şekil 8).
- Ham verileri bir programlama platformuna yükleyin. Hızlı bir Fourier dönüşümü gerçekleştirin ve spektrumları fazlandırın (bu uygulama için eşzamanlı manuel, spektrumların sıfır dereceli fazlaması yeterlidir.)
- Standart nükleer manyetik rezonans (NMR) verilerini hesaplayın95,96: SNR, tam genişlik yarım maks, entegre alan, kimyasal kayma ve her iki tepe noktasının fazı.
- Büyüklük verilerinden, zaman içinde çözünmüş-gaz oranını bulmak için her tekrarlama için çözünmüş spektrumun sinyal genliğini gaz spektrumununkine bölün.
- Difüzyon ağırlıklı görüntüleri analiz edin (Şekil 9).
- Ham verileri bir programlama platformuna yükleyin. B0 görüntüsünün akciğer parankimini Adım 3.2.3'teki gibi segmentlere ayırın. Her b değeri görüntüsü için SNR'yi hesaplayın.
- b0 görüntüsünün her bir vokselindeki sinyali görüntü parazitinin standart sapmasına bölerek sinyal-değer-gürültü oranını (SVNR0 ) hesaplayın. SVNR0 < görüntü gürültüsünün2,5 katı 97 ile vokselleri hariç tutun.
NOT: SVNR0 ayrı bir voksel metriğidir, parankimal SNR ise bir tüm akciğer metriğidir. - Denklem 5 98,99'a göre sinyal bozulmasını b-değerleri (bi) üzerine uydurarak ADC'yi hesaplayın:
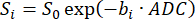 (5)
(5)
Sonuçlar
Havalandırma Görüntüleri
Hayvan hazırlama ve ventilasyon prosedürleri uygun şekilde uygulanırsa, 3D radyal görüntüleme, veri toplama inspirasyon veya ekspirasyon sırasında gerçekleştirildiğinde ventilasyon modellerini başarılı bir şekilde yakalayabilir (Şekil 7). Bu görüntüler birçok nefes üzerinden toplanırken, burada anlatılan yöntem insanlarda kullanılan tek nefesli görüntüleme ...
Tartışmalar
Hiperpolarize 129Xe MRG, küçük hayvan modellerinde akciğer mikroyapısını ve işlevini incelemek için sofistike ve güçlü bir teknik olarak ortaya çıkmaktadır. Bu protokol, ilk saha hazırlığına rehberlik etmeyi ve HP 129Xe ile fare akciğerlerinde ventilasyon, difüzyon ve gaz değişimini ölçmek için gereken deneysel prosedürleri tanımlamayı amaçlamaktadır. Deneyler için temel ön koşullar arasında bir 129Xe gaz fantomu kurulma...
Açıklamalar
Peter Niedbalski, Polarean Imaging, Plc'de danışman olarak görev yapmaktadır.
Teşekkürler
Yazarlar, ventilatör yapımında yol gösterici bir ışık olduğu için Jerry Dalke'ye yürekten şükranlarını sunarlar. HP 129Xe gazını hazırladığı için Carter McMaster'a teşekkür ederiz. Ayrıca Dr. Matthew Willmering ve Dr. Juan Parra-Robles'e düşündürücü bilimsel tartışmaları için teşekkür ederiz. BioRender.com ile oluşturulan figürler. Bu çalışma Ulusal Sağlık Enstitüleri tarafından finanse edilmiştir (Hibe Nos: NHLBI R01HL143011, R01HL151588)
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1 mL syringe | fisher scientific | Catalog No.14-955-464 | https://www.fishersci.com/shop/products/sterile-syringes-single-use-12/14955464 |
| 10 mL graduated cylinder | Cole-Parmer | UX-34502-69 | https://www.coleparmer.com/i/cole-parmer-essentials-graduated-cylinder-glass-hexagonal-base-10-ml-2-pk/3450269?PubID=UX&persist=true&ip=no& gad_source=1&gclid=CjwKCAi A6KWvBhAREiwAFPZM7h3do -ssjascARuVviKd7V7kC5ztdIB6 _70DnMr-K3qk9RKeJ7-IrhoCeT 0QAvD_BwE |
| 18 G - veinous PFTE catheters (nonsterile) | Terumo Surflo | SROX1832CA | https://www.shopmedvet.com/product/iv-catheter-18-x-1-25inch?r=GSS17&p=GSS17&utm_source= google&utm_medium=google_ shopping&gad_source=1&gclid= CjwKCAiA0bWvBhBjEiwAtEsoW 4oTvZkAgWQCda6ocVtQlulVrG 2536FNbu5soMVSFN8xK_g1Uh pXIRoCGwoQAvD_BwE |
| 20 G - veinous PFTE catheters (nonsterile) | Terumo Surflo | SROX2051CA | https://www.shopmedvet.com/product/iv-catheter-20-x-2inch?r=GSS17&p=GSS17&utm_source =google&utm_medium=google_ shopping&gad_source=1&gclid= CjwKCAiA0bWvBhBjEiwAtEsoW 87ggCkgToD_XF_UgpQBTpmN dgSNfCml6TkDKlW8k27Dq_daR itPuhoCnBQQAvD_BwE |
| 22 G - veinous PFTE catheters (nonsterile) | Terumo Surflo | SROX2225CA | https://www.shopmedvet.com/product/iv-catheter-22-x-1inch?r=GSS17&p=GSS17&utm_source= google&utm_medium=google_ shopping&gad_source=1&gclid =CjwKCAiA0bWvBhBjEiwAtEso W9IM6mpee6m7e-lBfR8dZhSN KYbMUs7qgEU4gYCRTW_rJAs W_lGkthoCm30QAvD_BwE |
| 400 mL tedlar bags | Jensen Inert Products | GST-001S-3507TJC | NA |
| 60 mL syringe | fisher scientific | Catalog No.14-955-461 | https://www.fishersci.com/shop/products/sterile-syringes-single-use-12/14955461 |
| 70% alcohol | Cole-Parmer | UX-80024-34 | https://www.coleparmer.com/i/labchem-isopropyl-alcohol-70-v-v-500-ml/8002434?PubID=UX&persist=true&ip= no&gad_source=1&gclid=CjwKC AiA6KWvBhAREiwAFPZM7gGh p8g7MBHBBKadaRCAwfEMgV gna5fhYRsuXIuqoqOiToCC4fem nhoCGMEQAvD_BwE |
| Dewar for liquid nitrogen | Terra Universal | 4LDB | https://www.laboratory-equipment.com/tw-4ldb-liquid-nitrogen-dewar-ic-biomedical.html?srsltid=AfmBOooxwMtOA1Z2TweR P8V5Iy5EvYT3alZuzoiY 3UF3Ib9RgFnDxVTfWP0 |
| Eye lubricant | Refresh | REFRESH P.M. | https://www.refreshbrand.com/Products/refresh-pm |
| Fiber optic light | AmScope | HL250-AY | https://amscope.com/products/hl250-ay?tw_source=google &tw_adid=&tw_campaign= 16705014684&gad_source= 1&gclid=CjwKCAiA6KWvBhA REiwAFPZM7p-DpyvHJaGxR pAD1385hzGf1oPdKHHLFDR Sp8yrtxry11SNJeJnKxoCtAoQ AvD_BwE |
| Gaussmeter | Apex Magnets | GMHT201 | https://www.apexmagnets.com/magnets/accessories/ht-digital-gaussmeter-with-peak-hold-can-display-gauss-or-tesla |
| Glass vessel (phantom) | Ace Glass | 8648-24 | https://aceglass.com/results.php?t=8648-24&t=8648-24 |
| Heating pad | Office Depot | 9206211 | Pure Enrichment PureRelief Express Designer Series Heating Pad 12 x 15 Palm Aqua - Office Depot |
| Hyperpolarizer | Polarean | 9820 | https://polarean.com/xenon-mri-platform/ |
| Intubation board | Hallowell EMC | 000A3467 | https://hallowell.com/product/rodent-tilting-workstand/ |
| Intubation supplies | Parts list published elsewhere | NA | https://app.jove.com/t/50318/a-simple-method-of-mouse-lung-intubation |
| Isotopically enriched xenon cylinder | Linde Isotopes | XE-129(1%)N2(10%)HE CGMP 302SZ | NA |
| Liquid nitrogen | Linde | NI LC160-22 | https://www.lindedirect.com/store/product-detail/nitrogen_n2_nitrogen_liquid _lc160_22_psi_ni_lc160_22 /ni-lc160-22?cat_id=shop&node=b89 |
| Male slip luer | Cole-Parmer | UX-21943-27 | https://www.coleparmer.com/i/diba-omnifit-t-series-solvent-waste-cap-adapter-polypropylene-male-luer-slip-x-1-16-id-hose-barb-5-pk/2194327 |
| Manometer | Grainger | 3T294 | https://www.grainger.com/product/3T294?gucid=N:N:PS: Paid:GGL:CSM-2295:4P7A1P: 20501231&gad_source=1&gclid =CjwKCAiAi6uvBhADEiwAWiyR dltxrPJmmcm0bFiYLuPrB25HV QFdEfKMBqvgJBNdQUs3DZ7b TLr8CRoCanAQAvD_BwE& gclsrc=aw.ds |
| Minivent ventilator | harvard apparatus | 73-0044 | https://www.harvardapparatus.com/minivent-ventilator-for-mice-single-animal-volume-controlled-ventilators.html |
| Mouse ear puncher | fisher scientific | 13-812-201 | https://www.fishersci.com/shop/products/fisherbrand-animal-ear-tag-punch/13812201 |
| Mouse tongue depressor | Medical Tools | VRI-617 | https://medical-tools.com/shop/rodent-tongue-depressor.html |
| Mouse weight scale | Cole-Parmer | UX-11712-12 | https://www.coleparmer.com/i/adam-equipment-cqt2000-core-portable-balance-2000g-x-1g-220-v/1171212?PubID=UX&persist=true&ip=no&gad _source=1&gclid=CjwKCAiA6K WvBhAREiwAFPZM7iYnAG5Ilc Z5DZWrdJ6wcLDZSCSfNJHOH m2PQOpyyWe0TjFa75R3tBoCjB sQAvD_BwE |
| MRI scanner | Bruker | 7T Biospec horizontal system | https://www.bruker.com/de/products-and-solutions/preclinical-imaging/mri/biospec.html |
| Multimeter | Home Depot | 1007898529 | https://www.homedepot.com/p/Klein-Tools-600-Volt-Digital-Multi-Meter-Manual-Ranging-MM325/320822947 |
| Natural abundance xenon | Linde Isotopes | UN 2036 | NA |
| Needle | fisher scientific | 305194 | https://www.fishersci.com/shop/products/bd-general-use-precisionglide-hypodermic-needles-20/148266C?keyword=true |
| Needle safe syringe holder | fisher scientific | NC2703873 | https://www.fishersci.com/shop/products/ndlsafe-ii-syr-uncap-deca/NC2703873#?keyword=needlesafe |
| Nitrogen cylinder | Linde | NI M-K | https://www.lindedirect.com/store/product-detail/nitrogen_n2_nitrogen_nf_k/ni-m-k?cat_id=shop&node=b89 |
| Oxygen cylinder | Linde | OX M-K | https://www.lindedirect.com/store/product-detail/oxygen_o2_oxygen_usp_k/ox-m-k?cat_id=shop&node=b90 |
| Oxygen sensor | Apogee instruments | MO-200 | https://www.apogeeinstruments.com/mo-200-oxygen-sensor-with-handheld-meter/ |
| Oxygen sensor inline flowhead | Apogee instruments | AO-002 | https://www.apogeeinstruments.com/ao-002-oxygen-meter-sensor-flow-through-head/ |
| PEEP valve | Hallowell EMC | 000A6556A | https://hallowell.com/product/adjustable-peep-valve-with-exhaust-port-range-5-20cm-disposable/ |
| Pipette tips | fisher scientific | Catalog No.02-707-108 | Fisherbrand Stack-Rack Space-Saver Tips: 101-1000 L Standard; Blue; Volume: | Fisher Scientific |
| Plunger valve | Ace glass | 8648-20 | https://www.aceglass.com/results.php?t=8648 |
| Preclinical coil | Doty scientific | custom built | https://dotynmr.com/products/bmax-xy-low-e/ |
| Pressure regulators | Cole-Parmer | UX-98202-11 | https://www.coleparmer.com/i/cole-parmer-single-stage-regulator-1500-scfh-capacity-346-cga-fitting/9820211?PubID=UX&persist=true&ip=no& gad_source=1&gclid=CjwKCAi A6KWvBhAREiwAFPZM7pruR xCAiaj52nA_8Y1nveQZRsD6B f0QO65o2DKFYqRoz0PopSkX QxoCxqcQAvD_BwE |
| Pressure-drop ventilator | Parts list published elsewhere | NA | https://sites.duke.edu/driehuyslab/resources/ |
| PVC pipe for phantom | Home Depot | 193682 | https://www.homedepot.com/p/IPEX-1-2-in-x-10-ft-White-PVC-SCH-40-Potable-Pressure-Water-Pipe-30-05010HD/319692959 |
| SAI animal heating system | SAII | Model 1030 | https://i4sa.com/product/model-1030-monitoring-gating-system/ |
| Saline | Farris Laboratories Inc. | 0409488820-1 | https://www.farrislabs.com/products/bacteriostatic-sodium-chloride-0-9-30ml-bottle?variant=42807174824167¤cy =USD&utm_medium=product_ sync&utm_source=google&utm_ content=sag_organic&utm_ campaign=sag_organic&utm_ campaign=gs-2021-09-24&utm _source=google&utm_medium =smart_campaign&gad_source =1&gclid=CjwKCAiA6KWvBh AREiwAFPZM7oS3-hFDETO_2f6OWOoKyBMb WuDuWqYxdWRYUWEkY M2Py73VfGzVtRoC2FQQAvD_BwE |
| Sharps container | fisher scientific | 22-730-455 | https://www.fishersci.com/shop/products/sharps-container-47/p-7250579#?keyword=needle%20safe |
| Silicone epoxy | Grainger | 3KMY7 | https://www.grainger.com/product/3KMY7?gucid=N:N:PS:Paid:GGL:CSM- 2295:4P7A1P:20501231&gad_ source=1&gclid=CjwKCAiA6KW vBhAREiwAFPZM7voahkm8tda t1Euql1A8DFhC6AZVJ0wXzCE PfE6iUzrIJXV-Hl8o4xoCQLYQA vD_BwE&gclsrc=aw.ds |
| Silicone mold release lubricant | Grainger | 19MW95 | https://www.grainger.com/product/CRC-Mold-Release-Agent-16-oz-19MW95 |
| Spirometer | ADInstruments | FE141 | https://www.adinstruments.com/products/spirometer |
| Spirometer - mouse flowhead | ADInstruments | MLT1L | https://www.adinstruments.com/products/respiratory-flow-heads |
| Tubing - 1/4 OD | Clippard | URH1-0402-CLT-050 | https://www.clippard.com/part/URH1-0402-CLT-050 |
| Tubing - 1/8 OD | Clippard | URH1-0804-CLT-050 | https://www.clippard.com/part/URH1-0402-CLT-050 |
| Vacuum pump | Cole-Parmer | UX-60062-11 | https://www.coleparmer.com/i/environmental-express-diaphragm-pump-high-volume-120v/6006211?PubID=UX&persist=true&ip=no&gad _source=1&gclid=CjwKCAiA6K WvBhAREiwAFPZM7uFGwmW pRelHNFgZVvJJV09vDUVyfyG HoKeZTiFNIiVTe-05IpJJPxoCO PoQAvD_BwE |
| Wire - 18 gauge | Digikey | 2328-18H240-ND | https://www.digikey.com/en/products/detail/remington-industries/18H240/15202027?s=N4 IgjCBcoOwBxVAYygMwIYBsDOB TANCAPZQDa4YATPAGwgC6h ADgC5QgDKLATgJYB2AcxAB fQmAAMAFkqIQKSBhwFiZEA GZNATi0SGzNpE48BwsSErqw 6uQqV5CJSOQCsMF%2Bq11 GIVuy58QqLmss4gALbogvy4L AAEAO683LgMIkA |
| Xenon polarization measurement station | Polarean | NA | https://polarean.com/xenon-mri-platform/ |
Referanslar
- World Health Organization. Global health estimates 2020: Deaths by cause, age, sex, by country and by region, 2000-2019. World Health Organization. , (2020).
- Middleton, P. G., et al. Elexacaftor-Tezacaftor-Ivacaftor for cystic fibrosis with a single Phe508del allele. N Engl J Med. 381 (19), 1809-1819 (2019).
- Taylor-Cousar, J. L., et al. Tezacaftor-Ivacaftor in patients with cystic fibrosis homozygous for Phe508del. N Engl J Med. 377 (21), 2013-2023 (2017).
- Richeldi, L., et al. Efficacy and safety of nintedanib in idiopathic pulmonary fibrosis. N Engl J Med. 370 (22), 2071-2082 (2014).
- King, T. E., et al. A phase 3 trial of pirfenidone in patients with idiopathic pulmonary fibrosis. N Engl J Med. 370 (22), 2083-2092 (2014).
- Yong, K. S. M., Her, Z., Chen, Q. Humanized mice as unique tools for human-specific studies. Arch Immunol Ther Exp (Warsz. 66 (4), 245-266 (2018).
- Li, H., Auwerx, J. Mouse systems genetics as a prelude to precision medicine. Trends Genet. 36 (4), 259-272 (2020).
- Eppig, J. T., Motenko, H., Richardson, J. E., Richards-Smith, B., Smith, C. L. The International Mouse Strain Resource (IMSR): cataloging worldwide mouse and ES cell line resources. Mamm Genome. 26 (9-10), 448-455 (2015).
- Vedi, M., et al. 2022 updates to the rat genome database: A Findable, Accessible, Interoperable, and Reusable (FAIR) resource. Genetics. 224 (1), 042 (2023).
- Ghorani, V., Boskabady, M. H., Khazdair, M. R., Kianmeher, M. Experimental animal models for COPD: a methodological review. Tob Induc Dis. 15, 25 (2017).
- Semaniakou, A., Croll, R. P., Chappe, V. Animal models in the pathophysiology of cystic fibrosis. Front Pharmacol. 9, 1475 (2018).
- Moore, B. B., et al. Animal models of fibrotic lung disease. Am J Respir Cell Mol Biol. 49 (2), 167-179 (2013).
- Jenkins, R. G., et al. An official American thoracic society workshop report: Use of animal models for the preclinical assessment of potential therapies for pulmonary fibrosis. Am J Respir Cell Mol Biol. 56 (5), 667-679 (2017).
- Gomez-Arroyo, J., et al. A brief overview of mouse models of pulmonary arterial hypertension: problems and prospects. Am J Physiol Lung Cell Mol Physiol. 302 (10), L977-L991 (2012).
- Dignam, J. P., Scott, T. E., Kemp-Harper, B. K., Hobbs, A. J. Animal models of pulmonary hypertension: Getting to the heart of the problem. Br J Pharmacol. 179 (5), 811-837 (2022).
- Woodrow, J. S., Sheats, M. K., Cooper, B., Bayless, R. Asthma: The use of animal models and their translational utility. Cells. 12 (7), 1091 (2023).
- Van de Velde, G., et al. Longitudinal in vivo microcomputed tomography of mouse lungs: No evidence for radiotoxicity. Am J Physiol Lung Cell Mol Physiol. 309 (3), L271-L279 (2015).
- Mata, J. F., et al. Evaluation of emphysema severity and progression in a rabbit model: comparison of hyperpolarized 3He and 129Xe diffusion MRI with lung morphometry. J Appl Physiol (1985). 102 (1985), 1273-1280 (2007).
- Boudreau, M., Xu, X., Santyr, G. E. Measurement of 129Xe gas apparent diffusion coefficient anisotropy in an elastase-instilled rat model of emphysema. Magn Reson Med. 69 (1), 211-220 (2013).
- Cleveland, Z. I., et al. 3D MRI of impaired hyperpolarized 129Xe uptake in a rat model of pulmonary fibrosis. NMR Biomed. 27 (12), 1502-1514 (2014).
- Kimura, A., et al. Inflammation during lung cancer progression and ethyl pyruvate treatment observed by pulmonary functional hyperpolarized 129Xe MRI in mice. Contrast Media Mol Imaging. 2021, 9918702 (2021).
- Kimura, A., et al. Treatment response of ethyl pyruvate in a mouse model of chronic obstructive pulmonary disease studied by hyperpolarized 129Xe MRI. Magn Reson Med. 78 (2), 721-729 (2017).
- Ouriadov, A., et al. Early stage radiation-induced lung injury detected using hyperpolarized 129Xe Morphometry: Proof-of-concept demonstration in a rat model. Magn Reson Med. 75 (6), 2421-2431 (2016).
- Willmering, M. M., et al. Improved pulmonary 129Xe ventilation imaging via 3D-spiral UTE MRI. Magn Reson Med. 84 (1), 312-320 (2020).
- Kaushik, S. S., et al. Single-breath clinical imaging of hyperpolarized 129Xe in the airspaces, barrier, and red blood cells using an interleaved 3D radial 1-point Dixon acquisition. Magn Reson Med. 75 (4), 1434-1443 (2016).
- Zanette, B., Munidasa, S., Friedlander, Y., Ratjen, F., Santyr, G. A 3D stack-of-spirals approach for rapid hyperpolarized 129Xe ventilation mapping in pediatric cystic fibrosis lung disease. Magn Reson Med. 89 (3), 1083-1091 (2023).
- Zanette, B., Stirrat, E., Jelveh, S., Hope, A., Santyr, G. Physiological gas exchange mapping of hyperpolarized 129Xe using spiral-IDEAL and MOXE in a model of regional radiation-induced lung injury. Med Phys. 45 (2), 803-816 (2018).
- Collier, G. J., et al. Dissolved 129Xe lung MRI with four-echo 3D radial spectroscopic imaging: Quantification of regional gas transfer in idiopathic pulmonary fibrosis. Magn Reson Med. 85 (5), 2622-2633 (2021).
- Qing, K., et al. Assessment of lung function in asthma and COPD using hyperpolarized 129Xe chemical shift saturation recovery spectroscopy and dissolved-phase MRI. NMR Biomed. 27 (12), 1490-1501 (2014).
- Ruppert, K., Brookeman, J. R., Hagspiel, K. D., Mugler, J. P. Probing lung physiology with xenon polarization transfer contrast (XTC). Magn Reson Med. 44 (3), 349-357 (2000).
- Kern, A. L., et al. Investigating short-time diffusion of hyperpolarized 129Xe in lung air spaces and tissue: A feasibility study in chronic obstructive pulmonary disease patients. Magn Reson Med. 84 (4), 2133-2146 (2020).
- Amzajerdian, F., et al. Simultaneous quantification of hyperpolarized xenon-129 ventilation and gas exchange with multi-breath xenon-polarization transfer contrast (XTC) MRI. Magn Reson Med. 90 (6), 2334-2347 (2023).
- Perron, S., et al. Application of a 2D frequency encoding sectoral approach to hyperpolarized 129Xe MRI at low field. J Magn Reson. 336, 107159 (2022).
- Loza, L. A., et al. Quantification of ventilation and gas uptake in free-breathing mice with hyperpolarized 129Xe MRI. IEEE Trans Med Imaging. 38 (9), 2081-2091 (2019).
- Imai, H., et al. Regional fractional ventilation mapping in spontaneously breathing mice using hyperpolarized 129Xe MRI. NMR Biomed. 28 (1), 24-29 (2015).
- Friedlander, Y., et al. Effect of inhaled oxygen concentration on 129Xe chemical shift of red blood cells in rat lungs. Magn Reson Med. 86 (3), 1187-1193 (2021).
- Virgincar, R. S., et al. A portable ventilator with integrated physiologic monitoring for hyperpolarized 129Xe MRI in rodents. J Magn Reson. 295, 63-71 (2018).
- Nouls, J., Fanarjian, M., Hedlund, L., Driehuys, B. A constant-volume ventilator and gas recapture system for hyperpolarized gas MRI of mouse and rat lungs. Concepts Magn Reson Part B Magn Reson Eng. 39B (2), 78-88 (2011).
- Niedbalski, P. J., et al. Preclinical hyperpolarized 129Xe MRI: ventilation and T2* mapping in mouse lungs at 7 T using multi-echo flyback UTE. NMR Biomed. 33 (7), e4302 (2020).
- Akinyi, T. G. . An Affordable Open-Source Small Animal MR and Hyperpolarized Gas Compatible Ventilator: Feasibility in Preclinical Imaging. , (2017).
- Smith, L. J., et al. The assessment of short and long term changes in lung function in CF using 129Xe MRI. Eur Respir J. 6, 2000441 (2020).
- Svenningsen, S., et al. Reproducibility of hyperpolarized 129Xe MRI ventilation defect percent in severe asthma to evaluate clinical trial feasibility. Acad Radiol. 28 (6), 817-826 (2021).
- Kirby, M., et al. Hyperpolarized 3He and 129Xe MR imaging in healthy volunteers and patients with chronic obstructive pulmonary disease. Radiology. 265 (2), 600-610 (2012).
- Virgincar, R. S., et al. Quantitative analysis of hyperpolarized 129Xe ventilation imaging in healthy volunteers and subjects with chronic obstructive pulmonary disease. NMR Biomed. 26 (4), 424-435 (2013).
- Ebner, L., et al. Multireader determination of clinically significant obstruction using hyperpolarized 129Xe-ventilation MRI. AJR Am J Roentgenol. 212 (4), 758-765 (2019).
- Driehuys, B., et al. 3He MRI in mouse models of asthma. Magn Reson Med. 58 (5), 893-900 (2007).
- Mistry, N. N., Thomas, A., Kaushik, S. S., Johnson, G. A., Driehuys, B. Quantitative analysis of hyperpolarized 3He ventilation changes in mice challenged with methacholine. Magn Reson Med. 63 (3), 658-666 (2010).
- Costa, M., et al. Noninvasive assessment of in vivo mouse lung microstructural changes due to aging and PEEP. Am J Respir Crit Care Med. 207, A4713 (2023).
- Sukstanskii, A. L., Yablonskiy, D. A. Lung morphometry with hyperpolarized 129Xe: theoretical background. Magn Reson Med. 67 (3), 856-866 (2012).
- Chan, H. F., Stewart, N. J., Norquay, G., Collier, G. J., Wild, J. M. 3D diffusion-weighted 129Xe MRI for whole lung morphometry. Magn Reson Med. 79 (6), 2986-2995 (2018).
- Bier, E. A., et al. Noninvasive diagnosis of pulmonary hypertension with hyperpolarised 129Xe magnetic resonance imaging and spectroscopy. ERJ Open Res. 8 (2), 00035 (2022).
- Bier, E. A., et al. A protocol for quantifying cardiogenic oscillations in dynamic 129Xe gas exchange spectroscopy: The effects of idiopathic pulmonary fibrosis. NMR Biomed. 32 (1), e4029 (2019).
- Wang, Z., et al. Diverse cardiopulmonary diseases are associated with distinct xenon magnetic resonance imaging signatures. Eur Respir J. 54 (6), 1900831 (2019).
- Freeman, M. S., Cleveland, Z. I., Qi, Y., Driehuys, B. Enabling hyperpolarized 129Xe MR spectroscopy and imaging of pulmonary gas transfer to the red blood cells in transgenic mice expressing human hemoglobin. Magn Reson Med. 70 (5), 1192-1199 (2013).
- Iguchi, S., et al. Direct imaging of hyperpolarized 129Xe alveolar gas uptake in a mouse model of emphysema. Magn Reson Med. 70 (1), 207-215 (2013).
- Imai, H., et al. Noninvasive detection of pulmonary tissue destruction in a mouse model of emphysema using hyperpolarized 129Xe MRS under spontaneous respiration. Magn Reson Med. 64 (4), 929-938 (2010).
- Silk, S. B., Hampton, L. L., Brown, P. A. What investigators need to know about the use of animals. ILAR J. 54 (3), 324-328 (2014).
- Cereda, M., et al. Mild loss of lung aeration augments stretch in healthy lung regions. J Appl Physiol. 120 (1985), 444-454 (2016).
- Constantinides, C., Murphy, K. Molecular and integrative physiological effects of isoflurane anesthesia: The paradigm of cardiovascular studies in rodents using magnetic resonance imaging. Front Cardiovasc Med. 3, 23 (2016).
- Irwin, M. R., Curay, C. M., Choi, S., Kiyatkin, E. A. Basic physiological effects of ketamine-xylazine mixture as a general anesthetic preparation for rodent surgeries. Brain Res. 1804, 148251 (2023).
- Roth, D. M., Swaney, J. S., Dalton, N. D., Gilpin, E. A., John Ross, J. Impact of anesthesia on cardiac function during echocardiography in mice. Am J Physiol Heart Circ Physiol. 282 (6), H2134-H2140 (2002).
- Massey, C. A., Richerson, G. B. Isoflurane, ketamine-xylazine, and urethane markedly alter breathing even at subtherapeutic doses. J Neurophysiol. 118 (4), 2389-2401 (2017).
- Janssen, B. J. A., et al. Effects of anesthetics on systemic hemodynamics in mice. Am J Physiol Heart Circ Physiol. 287 (4), H1618-H1624 (2004).
- Lenzarini, F., Di Lascio, N., Stea, F., Kusmic, C., Faita, F. Time course of isoflurane-induced vasodilation: A Doppler ultrasound study of the left coronary artery in mice. Ultrasound Med Biol. 42 (4), 999-1009 (2016).
- Mondonedo, J. R., et al. Volatile anesthetics and the treatment of severe bronchospasm: A concept of targeted delivery. Drug Discov Today Dis Models. 15, 43-50 (2015).
- Nolan, J. P. Anaesthesia and Neuromuscular Block. Clinical Pharmacology. , 295-310 (2012).
- Arras, M., Autenried, P., Rettich, A., Spaeni, D., Rülicke, T. Optimization of intraperitoneal injection anesthesia in mice: drugs, dosages, adverse effects, and anesthesia depth. Comp Med. 51 (5), 443-456 (2001).
- Navarro, K. L., et al. Mouse anesthesia: The art and science. ILAR J. 62 (1-2), 238-273 (2021).
- Das, S., MacDonald, K., Chang, H. Y., Mitzner, W. A simple method of mouse lung intubation. J Vis Exp. (73), e50318 (2013).
- Thomas, J. L., et al. Endotracheal intubation in mice via direct laryngoscopy using an otoscope. J Vis Exp. (86), e50269 (2014).
- Slutsky, A. S., Ranieri, V. M. Ventilator-induced lung injury. N Engl J Med. 369 (22), 2126-2136 (2013).
- Matute-Bello, G., et al. An official American thoracic society workshop report: features and measurements of experimental acute lung injury in animals. Am J Respir Cell Mol Biol. 44 (5), 725-738 (2011).
- Kulkarni, H. S., et al. Update on the features and measurements of experimental acute lung injury in animals: An official American thoracic society workshop report. Am J Respir Cell Mol Biol. 66 (2), e1-e14 (2022).
- Tsuchida, S., et al. Atelectasis causes alveolar injury in nonatelectatic lung regions. Am J Respir Crit Care Med. 174 (3), 279-289 (2006).
- Fan, E., et al. An official American thoracic society/European society of intensive care medicine/society of critical care medicine clinical practice guideline: Mechanical ventilation in adult patients with acute respiratory distress syndrome. Am J Respir Crit Care Med. 195 (9), 1253-1263 (2017).
- Santos, R. S., Silva, P. L., Pelosi, P., Rocco, P. R. Recruitment maneuvers in acute respiratory distress syndrome: The safe way is the best way. World J Crit Care Med. 4 (4), 278-286 (2015).
- Mekontso Dessap, A., et al. Conflicting physiological and genomic cardiopulmonary effects of recruitment maneuvers in murine acute lung injury. Am J Respir Cell Mol Biol. 46 (4), 541-550 (2012).
- García-Fernández, J., et al. Recruitment manoeuvres in anaesthesia: How many more excuses are there not to use them. Rev Esp Anestesiol Reanim (Engl Ed). 65 (4), 209-217 (2018).
- Allen, G. B., Suratt, B. T., Rinaldi, L., Petty, J. M., Bates, J. H. Choosing the frequency of deep inflation in mice: balancing recruitment against ventilator-induced lung injury. Am J Physiol Lung Cell Mol Physiol. 291 (4), L710-L717 (2006).
- da Silva, A. C. L., et al. Sigh maneuver protects healthy lungs during mechanical ventilation in adult Wistar rats. Exp Biol Med. 245 (15), 1404-1413 (2020).
- Riva, D. R., et al. Recruitment maneuver: RAMP versus CPAP pressure profile in a model of acute lung injury. Respir Physiol Neurobiol. 169 (1), 62-68 (2009).
- Schwarte, L. A., Zuurbier, C. J., Ince, C. Mechanical ventilation of mice. Basic Res Cardiol. 95 (6), 510-520 (2000).
- Joelsson, J. P., Ingthorsson, S., Kricker, J., Gudjonsson, T., Karason, S. Ventilator-induced lung-injury in mouse models: Is there a trap. Lab Anim Res. 37 (1), 30 (2021).
- Jameson, C. J., Jameson, A. K., Hwang, J. K. Nuclear spin relaxation by intermolecular magnetic dipole coupling in the gas phase. 129Xe in oxygen. J Chem Phys. 89 (7), 4074-4081 (1988).
- Kelley, M., Branca, R. T. Theoretical models of spin-exchange optical pumping: Revisited and reconciled. J Appl Phys. 129 (15), 1-16 (2021).
- Norquay, G., Leung, G., Stewart, N. J., Wolber, J., Wild, J. M. 129Xe chemical shift in human blood and pulmonary blood oxygenation measurement in humans using hyperpolarized 129Xe NMR. Magn Reson Med. 77 (4), 1399-1408 (2017).
- Norquay, G., Collier, G. J., Rao, M., Stewart, N. J., Wild, J. M. 129Xe-Rb spin-exchange optical pumping with high photon efficiency. Phys Rev Lett. 121 (15), 153201 (2018).
- Ball, J. E., Wild, J. M., Norquay, G. Investigating Rubidium density and temperature distributions in a high-throughput 129Xe-Rb spin-exchange optical pumping polarizer. Molecules. 28 (1), 11 (2022).
- Plummer, J. W., et al. A semi-empirical model to optimize continuous-flow hyperpolarized 129Xe production under practical cryogenic-accumulation conditions. J Magn Reson. 320, 106845 (2020).
- Nikolaou, P., et al. Near-unity nuclear polarization with an open-source 129Xe hyperpolarizer for NMR and MRI. Proc Natl Acad Sci U S A. 110 (35), 14150-14155 (2013).
- Robertson, S. H., et al. Optimizing 3D noncartesian gridding reconstruction for hyperpolarized 129Xe MRI-focus on preclinical applications. Concepts Magn Reson Part A Bridg Educ Res. 44 (4), 190-202 (2015).
- Thomas, A. C., et al. A robust protocol for regional evaluation of methacholine challenge in mouse models of allergic asthma using hyperpolarized 3He MRI. NMR Biomed. 22 (5), 502-515 (2009).
- Niedbalski, P. J., et al. Protocols for multi-site trials using hyperpolarized 129Xe MRI for imaging of ventilation, alveolar-airspace size, and gas exchange: A position paper from the 129Xe MRI clinical trials consortium. Magn Reson Med. 86 (6), 2966-2986 (2021).
- Woodhouse, N., et al. Combined helium-3/proton magnetic resonance imaging measurement of ventilated lung volumes in smokers compared to never-smokers. J Magn Reson Imaging. 21 (4), 365-369 (2005).
- Brown, R. W., Cheng, Y. C. N., Haacke, E. M., Thompson, M. R., Venkatesan, R. . Magnetic Resonance Imaging: Physical Principles and Sequence Design. , (2014).
- Levitt, M. H. . Spin Dynamics: Basics of Nuclear Magnetic Resonance. , (2013).
- Salerno, M., et al. Emphysema: hyperpolarized helium 3 diffusion MR imaging of the lungs compared with spirometric indexes—initial experience. Radiology. 222 (1), 252-260 (2002).
- Niedbalski, P. J., et al. Validating in vivo hyperpolarized 129Xe diffusion MRI and diffusion morphometry in the mouse lung. Magn Reson Med. 85 (4), 2160-2173 (2021).
- Bdaiwi, A. S., et al. Improving hyperpolarized 129Xe ADC mapping in pediatric and adult lungs with uncertainty propagation. NMR Biomed. 35 (3), e4639 (2022).
- Ruppert, K., Brookeman, J. R., Hagspiel, K. D., Driehuys, B., Mugler, J. P. NMR of hyperpolarized 129Xe in the canine chest: spectral dynamics during a breath-hold. NMR Biomed. 13 (4), 220-228 (2000).
- Driehuys, B., et al. Imaging alveolar-capillary gas transfer using hyperpolarized 129Xe MRI. Proc Natl Acad Sci U S A. 103 (48), 18278-18283 (2006).
- Nakamura, K., et al. 129Xe spectra from the heads of rats with and without ligation of the external carotid and pterygopalatine arteries. Magn Reson Med. 53 (3), 528-534 (2005).
- Kershaw, J., et al. Confirming the existence of five peaks in 129Xe rat head spectra. Magn Reson Med. 57 (4), 791-797 (2007).
- Chen, R. Y., et al. Tissue-blood partition coefficient for xenon: temperature and hematocrit dependence. J Appl Physiol. 49 (2), 178-183 (1980).
- Möller, H. E., et al. Magnetic resonance angiography with hyperpolarized 129Xe dissolved in a lipid emulsion. Magn Reson Med. 41 (5), 1058-1064 (1999).
- Norquay, G., et al. Relaxation and exchange dynamics of hyperpolarized 129Xe in human blood. Magn Reson Med. 74 (2), 303-311 (2015).
- Zhang, L., et al. Absolute thermometry of human brown adipose tissue by magnetic resonance with laser polarized 129Xe. Commun Med. 3 (1), 147 (2023).
- Barshishat-Kupper, M., et al. Protein oxidation in the lungs of C57BL/6J mice following X-irradiation. Proteomes. 3 (3), 249-265 (2015).
- Olsson, L. E., et al. Measurement of MR signal and T2* in lung to characterize a tight skin mouse model of emphysema using single-point imaging. J Magn Reson Imaging. 25 (3), 488-494 (2007).
- Crowle, A. J. Delayed hypersensitivity in mice. J Allergy. 30 (2), 151-164 (1959).
- Guo, J., Cao, X., Cleveland, Z. I., Woods, J. C. Murine pulmonary imaging at 7T: T2* and T1 anisotropic UTE. Magn Reson Med. 79 (4), 2254-2264 (2018).
- Sonobe, T., et al. Imaging of the closed-chest mouse pulmonary circulation using synchrotron radiation microangiography. J Appl Physiol. 111 (1), 75-80 (2011).
- Wang, W., et al. Imaging lung microstructure in mice with hyperpolarized 3He diffusion MRI. Magn Reson Med. 65 (3), 620-626 (2011).
- Ouriadov, A. V., et al. Application of a stretched-exponential model for morphometric analysis of accelerated diffusion-weighted 129Xe MRI of the rat lung. Magn Reson Mater Phy. 34 (1), 73-84 (2021).
- O'Halloran, R. L., Holmes, J. H., Altes, T. A., Salerno, M., Fain, S. B. The effects of SNR on ADC measurements in diffusion-weighted hyperpolarized He-3 MRI. J Magn Reson. 185 (1), 42-49 (2007).
- Moller, H. E., Cleveland, Z. I., Driehuys, B. Relaxation of hyperpolarized 129Xe in a deflating polymer bag. J Magn Reson. 212 (1), 109-115 (2011).
- Reiss, L. K., Kowallik, A., Uhlig, S. Recurrent recruitment manoeuvres improve lung mechanics and minimize lung injury during mechanical ventilation of healthy mice. PLoS One. 6 (9), e24527 (2011).
- Cagle, L. A., et al. Effects of positive end-expiratory pressure and recruitment maneuvers in a ventilator-induced injury mouse model. PLoS One. 12 (11), e0187419 (2017).
- Cannizzaro, V., et al. Lung volume recruitment maneuvers and respiratory system mechanics in mechanically ventilated mice. Respir Physiol Neurobiol. 169 (3), 243-251 (2009).
- Hohlbaum, K., et al. Impact of repeated anesthesia with ketamine and xylazine on the well-being of C57BL/6JRj mice. PLoS One. 13 (9), e0203559 (2018).
- Blevins, C. E., Celeste, N. A., Marx, J. O. Effects of oxygen supplementation on injectable and inhalant anesthesia in C57BL/6 mice. J Am Assoc Lab Anim Sci. 60 (3), 289-297 (2021).
- Cannizzaro, V., et al. Impact of supplemental oxygen in mechanically ventilated adult and infant mice. Respir Physiol Neurobiol. 165 (1), 61-66 (2009).
- Sembroski, E., Sanghavi, D. K., Bhardwaj, A. Inverse Ratio Ventilation. StatPearls Publishing. , (2023).
- Boros, S. J. Variations in inspiratory:expiratory ratio and airway pressure wave form during mechanical ventilation: the significance of mean airway pressure. J Pediatr. 94 (1), 114-117 (1979).
- Zheng, W., Cleveland, Z. I., Moller, H. E., Driehuys, B. Gradient-induced longitudinal relaxation of hyperpolarized noble gases in the fringe fields of superconducting magnets used for magnetic resonance. J Magn Reson. 208 (2), 284-290 (2011).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır