Yetişkin farelerde lateral kuyruk veni enjeksiyonu yoluyla adeno ilişkili virüsün tutarlı bir şekilde verilmesi
Bu Makalede
Özet
Burada, yetişkin farelerde adeno-ilişkili virüsü (AAV) sistemik olarak uygulamak için fare lateral kuyruk veni enjeksiyonu için optimize edilmiş bir protokolü detaylandırıyoruz. Ek olarak, AAV transdüksiyonunu değerlendirmek için yaygın olarak kullanılan tahlillerin protokollerini açıklıyoruz.
Özet
Birçok bozukluk birden fazla organı etkiler veya vücudun farklı bölgelerini içerir, bu nedenle farklı bölgelerde bulunan etkilenen hücreleri hedeflemek için terapötiklerin sistemik olarak verilmesi çok önemlidir. İntravenöz enjeksiyon, vücut çapında uygulamaya yönelik tedavileri değerlendiren klinik öncesi çalışmalarda yaygın olarak kullanılan bir sistemik uygulama yoludur. Yetişkin farelerde, terapötik ajanın farenin lateral kuyruk damarlarına intravenöz olarak uygulanmasını içerir. Ustalaşıldığında, kuyruk damarı enjeksiyonları güvenli ve hızlıdır ve yalnızca basit ve yaygın olarak bulunan aletler gerektirir. Bununla birlikte, kuyruk damarı enjeksiyonları teknik olarak zordur ve amaçlanan dozun doğru bir şekilde verilmesini sağlamak için kapsamlı eğitim ve sürekli uygulama gerektirir.
Burada, deneyimlerimize ve daha önce diğer gruplar tarafından bildirilen önerilere dayanarak geliştirdiğimiz ayrıntılı, optimize edilmiş, lateral kuyruk veni enjeksiyon protokolünü açıklıyoruz. Fare kısıtlayıcıları ve insülin şırıngaları dışında, bu protokol yalnızca çoğu laboratuvarda kolayca bulunabilen reaktifler ve ekipman gerektirir. Bu protokolün izlenmesinin, adeno-ilişkili virüsün (AAV) sedasyonsuz 7-9 haftalık farelerin kuyruk damarlarına tutarlı bir şekilde başarılı intravenöz iletimi ile sonuçlandığını bulduk. Ek olarak, AAV transdüksiyonunu ve biyodağılımını değerlendirmek için kullanılan diploid genom (vg/dg) kantifikasyonu başına floresan raportör proteinlerin ve vektör genomunun histolojik tespiti için optimize edilmiş protokolleri açıklıyoruz. Bu protokolün amacı, deneycilerin kuyruk-damar enjeksiyonlarını başarılı ve tutarlı bir şekilde kolayca gerçekleştirmelerine yardımcı olmaktır, bu da tekniğe hakim olmak için gereken uygulama süresini azaltabilir.
Giriş
Monogenik bozukluklar, dünya çapında 300 milyon kişiyi toplu olarak etkileyen nadir hastalıkların %80'ini oluşturmaktadır 1,2. Şu anda bu büyük ölçüde zayıflatıcı nadir bozuklukların çoğu için onaylanmış bir iyileştirici tedavi yoktur 1,2,3. Bununla birlikte, monogenik bozukluklar, işlevsiz genleri değiştirebilen, tamamlayabilen, düzeltebilen veya susturabilen gen tedavileri için ideal adaylardır 4,5. Şu anda, belirli hücre tiplerine gen terapileri sağlamak için çoklu vektörler geliştirilmekte ve kullanılmaktadır 4,6. Bu vektörlerden biri adeno-ilişkili virüstür (AAV). AAV, gen terapisi vektörü7 olarak giderek daha fazla kullanılan patojenik olmayan bir parvovirüstür. Diğer viral vektörlerle karşılaştırıldığında, AAV daha düşük immünojenisiteye, konakçı genomuna entegrasyon potansiyelinden daha düşük ve çeşitli dokularda bölünen ve bölünmeyen hücreleri verimli bir şekilde dönüştürme yeteneğine sahiptir 7,8. Ek olarak, spesifik doku tropizmi veya daha da azaltılmış immünojenisite gibi arzu edilen özelliklere sahip AAV'leri tasarlamak ve tanımlamak için çoklu yaklaşımlar geliştirilmiştir, bu da AAV'nin farklı endikasyonlar için viral bir vektör olarak çok yönlülüğünü büyük ölçüde artırır9. Bu faktörler, AAV'yi yaygın olarak araştırılan bir gen terapisi vektörü haline getirmiş ve FDA onaylı çoklu AAV bazlı gen terapilerinin geliştirilmesine yol açmıştır10.
Fare modelleri, potansiyel gen terapilerini in vivo olarak test etmek ve monogenik bozuklukların patomekanizmalarını daha iyi anlamak için yaygın olarak kullanılır. Bunun nedeni, fare modellerinin farklı koşulların patolojilerini özetlemesi, genomlarının insan genomuna benzerliği ve fare kullanımı, bakımı ve 11,12,13 neslinin göreceli kolaylığıdır. İn vivo test, kas distrofileri gibi vücudun birden fazla sistemini veya bölgesini etkileyen bozuklukları incelerken özellikle önemlidir. Bu bozukluklar için, in vitro testler, sistemik uygulamadan sonra farklı vücut bölgelerine ulaşması amaçlanan terapötiklerin güvenliğini, etkinliğini, farmakokinetiğini ve farmakodinamiğini kapsamlı bir şekilde değerlendirmek için yeterli olmayabilir14.
İlaçları vermek için çeşitli sistemik uygulama yolları kullanılabilir. Her rotanın avantajları, dezavantajları ve araştırılan hayvan modeli ve ilaçla uyumluluk derecesi vardır15. İntravenöz (IV) lateral tail-ven enjeksiyonu, farelerde AAV'nin sistemik olarak verilmesi için yaygın olarak kullanılan bir yoldur16. Lateral kuyruk veni enjeksiyonları, enjekte edilen maddenin fare kan dolaşımına hızlı ve doğrudan uygulanmasına izin vererek sistemik dolaşımda yüksek ilaç biyoyararlanımı sağlar17. Ayrıca, gerçekleştirilmesi için nispeten basit ve yaygın olarak bulunan araçlar gerektirirler. Bununla birlikte, esas olarak küçük kuyruk damar çapı ve damarın yerinin belirlenmesindeki zorluk nedeniyle, lateral kuyruk veni enjeksiyonları teknik olarak zordur ve başarısız enjeksiyon girişimlerinden veya eksik doz dağıtımından kaçınmak için yüksek derecede beceri ve sürekli uygulama gerektirir 16,17,18,19. Bunlar, özellikle enjeksiyon gerçekleştirilirken eksik enjeksiyon tanınmazsa, pahalı reaktiflerin kaybına veya yanlış sonuçlara neden olabilir. Burada özetlenen deneyimimiz, kullanımımız için uyarladığımız, iyi belgelenmiş makalelerde bildirilen protokollere dayanmaktadır ve enjeksiyonların tutarlı bir şekilde başarılı olmasını sağlamak için lateral kuyruk-ven enjeksiyon prosedürünün çeşitli adımlarını optimize etmektedir 20,21,22,23,24,25,26,27.
Burada, basit ve yaygın olarak bulunan araçları kullanarak AAV'yi sedasyonsuz 7-9 haftalık farelere iletmek için bu ayrıntılı optimize edilmiş yanal kuyruk damarı enjeksiyon protokolünü açıklıyoruz. Ek olarak, AAV dağıtımını ve biyodağıtımını değerlendirmek için kullanılan yöntemler için protokoller sağlıyoruz. Bu protokoller, enjeksiyon sonrası doku toplama, doku fiksasyonu, DNA ekstraksiyonu ve diploid genom (vg/dg) ölçümü başına dijital polimeraz zincir reaksiyonu (dPCR) vektör genomunu kapsar. Burada sağlanan IV enjeksiyon protokolü ve işaretçileri, lateral kuyruk veni enjeksiyonlarının başarılı bir şekilde gerçekleştirilmesinin kolaylığını artırmayı amaçlamaktadır. Bu, potansiyel olarak enjeksiyon becerilerinde ustalaşmak için gereken süreyi azaltmaya yardımcı olurken, aynı zamanda enjeksiyonların doğruluğunu ve tutarlılığını da iyileştirecektir.
Protokol
Tüm hayvan işleme ve enjeksiyon prosedürleri NINDS'deki Hayvan Bakım Komitesi tarafından onaylandı. Tüm hayvan prosedürleri, NINDS hayvan bakımı ve kullanım yönergelerine uygun olarak gerçekleştirilmiştir.
1. Enjeksiyon öncesi hazırlık
- AAV dozunun hazırlanması
- Enjekte edilecek farelerin ortalama ağırlığını belirleyin.
- Denklem (1)'de gösterildiği gibi kurumun hayvan bakım yönergelerine göre izin verilen maksimum enjeksiyon hacmini hesaplayın. Maksimum enjeksiyon hacmi tipik olarak bir hacim (μL)/fare ağırlığı (g) değeridir (ör., 10 μL/g.).
Maksimum enjeksiyon hacmi (μL)/fare= (maksimum enjeksiyon hacmi (μL/g)) × (ortalama fare ağırlığı (g)) (1)
NOT: Örnek Hesaplama: Maksimum enjeksiyon hacmi/fare= 10 μL/g × 20 g/fare= 200 μL/fare - Fare başına verilecek AAV vektör genom (vg) dozunu ayarlayın.
NOT: Bu, farklı fareler arasında aynı mutlak değer olabilir (örneğin, her farenin ağırlığına bakılmaksızın tüm fareler 1,5 ×10 12 vg alır). Veya doz vg / kg cinsinden olabilir, bu nedenle fare başına enjekte edilecek toplam vg, o farenin enjeksiyon günündeki ağırlığına göre her fare için hesaplanmalıdır.- Doz vg / kg ise, doz hazırlığından önceki enjeksiyon gününde her fareyi tartın.
- Denklem (2)'yi kullanarak her fare için ağırlığına göre verilecek vektör genomlarını hesaplayın:
Belirli bir farede verilecek vektör genomları (vg) = Önceden belirtilen vg/kg değeri (vg/kg) ×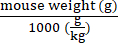 (2)
(2)
NOT: Enjekte edilen dozlar arasında geçerli karşılaştırmalar sağlamak için bazı preklinik çalışmalarda doz birimi olarak vg / fare yerine vg / kg kullanmak daha uygun olabilir. Bu, aynı yaştaki erkek ve dişi fareler arasındaki veya muhtemelen aynı cinsiyetteki fareler arasındaki ağırlık farklılıklarından kaynaklanmaktadır. - Gerekli dozu hazırlamak için gerekli olan stok AAV ve steril fosfat tamponlu salin (PBS) hacimlerini hesaplamak için maksimum enjeksiyon hacmini ve AAV (vg) dozunu kullanın (bkz. denklem (3-6)). Enjekte edilecek hacmin izin verilen maksimum enjeksiyon hacmine eşit veya daha az olduğundan emin olun. Pipetleme hatalarını ve şırınganın ölü alanını hesaba katmak için her zaman enjekte edilecek hacimden en az 15 μL daha büyük bir enjeksiyon hacmi hazırlayın.
Enjekte konsantrasyonu (vg/μL) =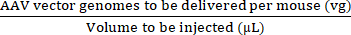 (3)
(3)
Enjeksiyonu hazırlamak için eklenecek toplam AAV vektör genomları (vg) = Enjekte konsantrasyonu (vg/μL) × hazırlanacak hacim (μL) (4)
Enjeksiyonu hazırlamak için eklenecek AAV stoğunun hacmi) (μL) =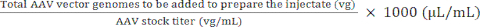 (5)
(5)
Enjeksiyonu hazırlamak için eklenecek PBS hacmi (μL) = Hazırlanacak hacim (μL) - Enjeksiyonu hazırlamak için eklenecek AAV stoğunun hacmi (μL) (6)
NOT: Örnek hesaplama:
6 ×10 13 vg/kg (doz), 25 g ağırlığındaki bir farede 200 μL/fare (enjekte edilecek hacim) olarak verilecektir. AAV stok titresi 3.0 ×10 13'tür (vg/mL)
Bu özel farede verilecek vektör genomları (vg) = 6 × 1013 (vg/kg) ×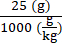 = 1.5 × 1012 vg bu fare için
= 1.5 × 1012 vg bu fare için
Enjekte konsantrasyonu=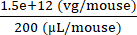 = 7.5 × 109 (vg / μL)
= 7.5 × 109 (vg / μL)
Enjeksiyonu hazırlamak için eklenecek toplam AAV vektör genomları = 7.5 × 109 (vg/μL) × (200 (μL) + 15 (μL)) = 1.6125 × 1012 (vg)
Enjeksiyonu hazırlamak için eklenecek AAV stoğunun hacmi =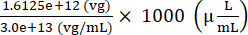 = 53.75 (μL)
= 53.75 (μL)
Enjeksiyonu hazırlamak için eklenecek PBS hacmi = 215 (μL) - 53.75 (μL) = 161.25 (μL)
- AAV doz hazırlama prosedürü
NOT: Otoklavlanmış steril RNaz içermeyen ve DNaz içermeyen 1.7 mL mikrosantrifüj tüpünde AAV'nin işlenmesi için kurumun biyogüvenlik ve KKD yönergelerini izleyerek, AAV enjeksiyonunu adım 1.1.3.3'teki hesaplamalara göre AAV stoğu ve steril PBS kullanarak hazırlayın. Stok AAV ve AAV enjeksiyonunu her zaman buz üzerinde tutun. Steriliteyi sağlamak için temiz mikropipetler ve yeni mikropipet ucu kutuları kullanın. AAV ile kirlenmiş mikropipet uçlarını kurumun atık yönetimi yönergelerine göre atın.- Stok AAV'yi buz üzerinde çözün.
NOT: AAV stoğunu çözdürmekten ve yeniden dondurmaktan kaçının. Yeniden dondurulması gereken doz hazırlığından sonra fazla AAV olmasını önlemek için AAV stoğunu 100-200 μL'lik alikotlar halinde sipariş edin veya hazırlayın.
- Stok AAV'yi buz üzerinde çözün.
- Enjeksiyon istasyonu hazırlığı
- Temizleme
- Çalışma alanını %70 etanol (EtOH) ile temizleyin.
- Çalışma alanını bakteri yok edici, mantar öldürücü ve virüsidal reaktif(ler) kullanarak dezenfekte edin.
- Fare tüpü tutucusunu su ve sabunla temizleyin.
- İstasyon araçlarının kurulumu
- Temiz, boş 15 mL'lik bir konik tüpü bir tüp tutucusuna/rafına yerleştirin.
- Fare tüpü sınırlayıcısının yerleştirileceği yükseltilmiş bir platform kurun (Şekil 1A,B).
- Temiz fare tüpü tutucusunu çalışma alanına yerleştirin.
- Mevcut fare tüpü süzgecinden çok daha küçük fareler enjekte ediyorsanız, bir kısıtlama manşonu yapmak için plastik bir kemirgen tutucu koni kullanın. 2.1.3-4 adımlarına bakın.
- Enjeksiyonlar için kullanılacak şırıngaları çalışma alanına yerleştirin. 29 G iğneli 0,3 mL insülin şırıngaları kullanın.
- AAV ile kontamine olmuş aletlerin hemen atılmasını sağlamak için atık kabını enjeksiyon istasyonuna mümkün olduğunca yakın yerleştirin.
- Pistonun düzgün hareket ettiğinden emin olmak için her bir şırınganın pistonunu birkaç kez çekin ve itin, böylece enjeksiyon sırasında şırınganın neden olduğu bir direnç olmaz. Piston düzgün hareket etmezse, bu şırıngayı atın ve yenisiyle değiştirin.
- Enjeksiyon alanının yanında bir fare ölçeği ve mini santrifüj bulundurun.
- Hazırlanan AAV'yi enjeksiyon alanında buz üzerinde hazır bulundurun.
- Ilık su hazırlayın (38-40 °C). Fare kuyruğunda yanıklara neden olmamak için su sıcaklığının 40 °C'yi geçmemesine dikkat edin.
- Temizleme
2. Enjeksiyon prosedürü
- Fare kısıtlama
- Gerekirse dozu vg / kg cinsinden hesaplamak için her fareyi tartın.
- Farenin tamamen kısıtlandığından ve hareket edemediğinden emin olun.
NOT: Fare tam olarak kısıtlanmazsa, IV uygulaması sırasında hareket edebilir ve bu da iğnenin yer değiştirmesine neden olabilir. Bu, iğnenin damardan çıkmasına ve/veya farenin yaralanmasına neden olabilir. - Tüp süzgeci için:
- Tutucuyu temizlemek ve ısıtmak için tutucuyu fareler arasında ılık su ve sabunla yıkayın.
- Fareyi kuyruğundan tutun. Farenin kuyruğunu tüpün üst açıklığına sokun; Ardından, fareyi yavaşça tüp tutucuya çekin. Tüp tutucunun boyutu farenin boyutuna uygunsa, farenin kaçmasını önlemek için fişi farenin önüne yerleştirin.
NOT: Farenin tüpün içinde hareket etmesini veya dönmesini önlemek için fiş fareye yeterince yakın olmalıdır, ancak fiş, farenin serbestçe nefes almasını sağlamak için farenin burnunu engellememelidir. Fare, tüp tutucu boyutundan daha küçükse, aşağıda adım 2.1.4'te açıklandığı gibi tüp tutucuya ek olarak esnek bir tek kullanımlık tutucu koni kullanın.
- Gerekirse esnek tek kullanımlık tutucu koniler için (daha küçük fareler için bir sınırlama kılıfı yapmak için):
- Farenin burnunun tıkalı olmadığından ve farenin nefes almak için yeterli alana sahip olduğundan emin olmak için koninin burun ucunda bir kesim yapın.
- Koninin arkasını, koni fare ile hemen hemen aynı uzunlukta olacak şekilde kesin (böylece koni tüpün içine sığacaktır) (Şekil 1A,B).
- Fareyi yukarıda 2.1.3 adımlarında açıklandığı gibi tüp tutucuya yerleştirin. Farenin kuyruğunu tutarken, önce daha geniş açılan tarafı olan tutucu koniyi tüpe yerleştirin.
- Farenin kuyruğunu tutarken, farenin koninin içine girmesine izin verin; Ardından, koninin geri kalanını tüpün içine kaydırın. Farenin kuyruğunun tüpün arkasından tamamen dışarı çıktığından ve farenin koninin içinde nefes almak için yeri olduğundan emin olun.
- Farenin tamamen kısıtlandığından ve nefes almak için yeterli alana sahip olduğundan emin olurken, tüp tapasını koninin burun açıklığının hemen önüne sabitleyin.
- Fareyi enjekte etmek
- 15 mL konik boruyu ılık suyla doldurun.
- Tüp tutucuyu, fare içindeyken yükseltilmiş platforma yerleştirin (Şekil 1B).
- Kısıtlanmış farenin kuyruğunu mümkün olduğunca ılık suya batırın, ta ki yan damarlar belirgin bir şekilde genişleyene ve görünür hale gelene kadar en az 1 dakika (Şekil 1B).
- Kuyruk ısıtma adımı sırasında, AAV dozunu şırıngaya yükleyin.
- Kapaksız AAV içeren 1.7 mL mikrosantrifüj tüpünü bir tüp rafına yerleştirin. İğneyi baskın elinizle tüpe dikey olarak yerleştirin. İğne tüpün içine girdikten sonra, tüpü baskın olmayan elinizle tutun.
NOT: İğnenin dikey olarak yerleştirilmesi, tüp duvarına dokunmaktan kaynaklanabilecek iğnenin zarar görmesini önler. Diğer alternatif şırınga yükleme yöntemleri kullanılabilir, ancak deneycinin ve enjekte edilen farenin güvenliği sağlanmalıdır. Tüpü baskın olmayan el ile tutmak, tüpü tutarken iğne sokulursa kazara iğne delinmesi yaralanmalarına karşı koruma sağlar. - İğne tüpün içindeyken, iğnenin tüp duvarına temas etmediğinden emin olarak tüpü ve şırıngayı aynı anda göz hizasına kaldırın. Sabitlemek için her iki kolunuzu da masanın üzerine koyun. Dozu yavaşça şırınganın içine çekin.
NOT: Yavaş aspirasyon, ince hava kabarcıklarının şırınga namlusunun kenarlarına yapışmasını engeller. - Şırıngadaki hava kabarcıklarını dışarı atın. AAV enjekte ediliyorsa, hava kabarcıklarının, biyolojik tehlike kutusuna atılacak tek kullanımlık bir emici ped üzerinden şırıngadan dışarı atıldığından emin olun.
- Enjeksiyonu ısıtmak için en az 40 saniye tutun.
NOT: Enjeksiyondan önce daima enjeksiyonun sıcak olduğundan emin olun. Soğuk enjeksiyon uygulanırsa, enjeksiyon ilk birkaç μL dışında damardan akmayabilir. - Kuyruk damarlarını her dakika kontrol edin.
NOT: Damarlar, enjeksiyon bölgesine kadar ÇOK görünür olmalıdır (kuyruk ısınma süresi ekleyin ve damar açıkça görünene kadar gerektiği kadar taze ılık su ile değiştirin, ancak kurumun hayvan işleme protokolü tarafından izin verilen fare kısıtlama süresini aşmamalıdır). - Damarların net bir şekilde göründüğünden emin olduktan sonra, tüp tutucuyu yükseltilmiş platformun üstünden çıkarın ve tüp tutucuyu doğrudan masanın üzerine yerleştirin. Kuyruğun kolay tutulması için fareyi ayakları aşağı bakacak ve yana doğru olmayacak şekilde kısıtlayıcıya yerleştirin.
NOT: Fare, sınırlayıcının içinde yan veya arka tarafında olmamalıdır. Fare tamamen kısıtlanmalı ve sınırlayıcı içinde hareket edememeli veya dönememeli veya kuyruğunu hareket ettirememeli/çekememelidir. - Kuyruğu kurutmak için kuyruğu bir gazlı bezle hızlıca silin; Kuyruğu alkollü bir bezle silin ve ardından kuru bir gazlı bezle kurulayın.
NOT: Kuyruğun, kuyruğun güvenli bir şekilde kavranmasına izin verecek kadar kuru hale getirmek için kuru gazlı bez kullanın, ancak tamamen kuru değil. Kuyruk tamamen kuruduğunda damarı görmek daha zor olabilir. - Kuyruğu yaklaşık 90° sola veya sağa, iki yan damardan biri yukarı bakacak şekilde döndürün. Kuyruğun orta üçte birlik kısmında uygun bir enjeksiyon bölgesi bulun. İlk enjeksiyonu distal olarak (kuyruğun ucuna daha yakın) başlatın ve başarısız denemeler nedeniyle ek enjeksiyonlar gerekiyorsa veya deneysel tasarım gerektiriyorsa proksimal olarak hareket edin.
NOT: Enjeksiyon önceki enjeksiyon bölgesinden dışarı sızabileceğinden, önceki bir enjeksiyon bölgesine distal enjekte etmeye çalışmayın. İsteğe bağlı: Baskın olmayan elin başparmağını ve işaret parmağını kullanarak enjeksiyon bölgesine 10 saniye boyunca proksimal (fare gövdesine yukarı/yakın) basınç uygulayın. Parmaklar, enjeksiyon bölgesindeki damarı daha da genişletmek için turnike görevi görür. 10 sn turnikeden hemen sonra, turnike parmaklarını serbest bırakın ve iki yan damardan birinin yukarı baktığından ve açıkça görülebildiğinden emin olun. - Kuyruğu baskın olmayan elinizle baş parmağınızı ve işaret parmağınızı enjeksiyon bölgesinin hemen distalinde tutarak tutun. Kuyruğu işaret parmağının üzerine katlayın, böylece enjeksiyon bölgesi işaret parmağı üzerinde düz durur. Kuyruğu geri çekin, böylece kuyruk gerilir ve enjeksiyon bölgesi tamamen yatay (0°'de) (yatay tablaya paralel) olur (Şekil 1C).
- Şırıngayı, şırınganın namlu flanşının her iki yanındaki baskın elin işaret ve orta parmaklarını kullanarak şırıngayı tutun ve başparmağınızı pistonda hazır tutun.
NOT: Bu, iğne damarın içindeyken başparmağı veya iğneyi hareket ettirmemeyi kolaylaştıracaktır (Şekil 1C). - Sabitlemek için her iki elinizi de masanın üzerine koyun ve eğim yukarı bakacak şekilde iğneyi doğrudan kuyruğa ve damara paralel olarak yerleştirin. Enjeksiyon bölgesinin kontrolünü ve stabilitesini artırmak için kuyruğu tutarak enjeksiyon bölgesini işaret parmağına yakın tutun.
NOT: Tüp tutucu, her iki elin de masada desteklenmesi için masada yeterince derin olmalıdır. - İğneyi kuyruk damarına paralel tutarken ve iğne üzerine aşağı doğru baskı uygularken, iğneyi damarın içine doğru ileri doğru kaydırın.
NOT: Aşağı doğru basınç, iğneyi damara doğru açıyla sokmak için yeterli olmalıdır. Damar son derece sığdır, bu nedenle damara girmeye çalışırken iğne mümkün olduğunca düz olmalıdır. - Solüsyonu yavaşça damar içine enjekte edin. Dozu uyguladıktan sonra, iğneyi yavaşça geri çekin ve kanamayı durdurmak için enjeksiyon bölgesinde en az 10 saniye boyunca bir gazlı bezle hemen baskı uygulayın.
NOT: Enjekte edilen reaktifin olası kaybını önlemek için kanama tamamen durana kadar basıncı gerektiği kadar uygulayın. İğne çekildikten sonra genellikle iğnenin damara girdiğini gösteren bir kan damlası belirir. Bazen, başarılı bir enjeksiyonla bile kan damlası görünmez. Kan damlası enjeksiyonun başarılı olduğunu göstermez; sadece iğnenin damara girdiğini gösterir. Güvenilir başarılı enjeksiyon göstergesi, enjeksiyon sırasında piston direncinin tamamen olmamasıdır. İğne damarın içindeyse, enjeksiyonun enjeksiyonu sırasında iğne pistonunda herhangi bir direnç olmamalıdır ve enjeksiyon bölgesine yakın olan damar anlık olarak biraz daha açık renkli görünecektir (beyazlar) (damar ağarması bazı fare suşlarında çok net olmayabilir). Direnç varsa ve/veya enjeksiyon bölgesinde bir şişkinlik oluşmaya başlarsa, iğne damarın içine doğru şekilde yerleştirilmemiştir. Böyle bir durumda, iğneyi kuyruktan tamamen çıkarın ve damarı, başarısız enjeksiyon bölgesine (fare gövdesine daha yakın) proksimaldeki yeni bir enjeksiyon bölgesine enjekte etmeye çalışın. - AAV ile kontamine olmuş şırıngaları ve tüpleri kurumun atık yönetimi yönergelerine göre atın.
- Fareyi sınırlayıcılardan kurtarın ve enjekte edilmemiş farelerden ayrı yeni bir kafese geri koyun. Enjeksiyondan sonra normal aktivite seviyelerini sağlamak için fareleri 10 dakika izleyin.
NOT: Bu, bulaşıcı ajanlar uygulanırsa, enjekte edilen ajanların enjekte edilmemiş farelere potansiyel bulaşmasını önler. - Bakterisit, mantar öldürücü ve virüsidal reaktif(ler) ve %70 EtOH kullanarak çalışma alanını dezenfekte edin. Fare tüpü tutucusunu su ve sabunla temizleyin.
- Kapaksız AAV içeren 1.7 mL mikrosantrifüj tüpünü bir tüp rafına yerleştirin. İğneyi baskın elinizle tüpe dikey olarak yerleştirin. İğne tüpün içine girdikten sonra, tüpü baskın olmayan elinizle tutun.
3. Diseksiyon ve doku toplama ve fiksasyon27
- Doku toplama istasyonu hazırlığı
- Çalışma alanında bulunabilecek kirletici DNA'yı parçalamak için çalışma istasyonunu üreticinin talimatlarına göre bir DNA bozunma reaktifi ile temizleyin.
- Metilbütanı metal bir kaba koyun. Metilbütan metal kabı bir Strafor kutunun içine yerleştirin; Ardından, metal kabı kuru buzla çevreleyin, böylece kabı çevreleyen kuru buz seviyesi, kabın içindeki metilbütan seviyesinden daha yüksek olur.
- Boş 2 mL mikrosantrifüj doku saklama tüplerini etiketleyin ve kuru buzun üzerine yerleştirin. Dokuları dondurmaya başlamadan önce metilbütan ve doku saklama tüplerini en az 20 dakika kuru buz üzerinde soğumaya bırakın. Doku transfer forsepslerini kuru buz üzerine yerleştirin.
- Başka bir 2 mL mikrosantrifüj doku saklama tüpü setini etiketleyin ve taze %4 paraformaldehit (PFA) ile doldurun ve oda sıcaklığında tutun. Tüpe yerleştirilecek dokuları tamamen batırmak için her tüpe yeterli miktarda %4 PFA ekleyin.
- Doku toplama ve fiksasyon
- Fareyi kurumun hayvan bakım yönergelerine göre ötenazi yapın.
NOT: Burada, farelere servikal çıkık kullanılarak ötenazi yapıldı. - Fareyi %70 EtOH ile tamamen püskürtün.
- Gerekli dokuları toplayın.
NOT: Burada açıklanan toplama ve fiksasyon protokolü iskelet kasları ve karaciğer üzerinde test edilmiştir. - DNA ekstraksiyonu için kullanılacak dokular için:
- Dokuyu kuru buz üzerinde önceden soğutulmuş metilbütan içine bırakın ve dokuyu en az 1 dakika metilbütan içinde bırakın. Donmuş dokuları metilbütandan önceden soğutulmuş boş 2 mL mikrosantrifüj doku saklama tüplerine aktarmak için önceden soğutulmuş transfer forsepslerini kullanın. Dokuyu -80 °C'de saklayın.
NOT: İsteğe bağlı: Doku, adım 4.1.4'te kullanılmaya hazır olması için metilbütan içine atılmadan önce 20 mg'lık parçalar halinde kesilebilir.
- Dokuyu kuru buz üzerinde önceden soğutulmuş metilbütan içine bırakın ve dokuyu en az 1 dakika metilbütan içinde bırakın. Donmuş dokuları metilbütandan önceden soğutulmuş boş 2 mL mikrosantrifüj doku saklama tüplerine aktarmak için önceden soğutulmuş transfer forsepslerini kullanın. Dokuyu -80 °C'de saklayın.
- Histolojik analiz ve raportör proteinlerin floresansını korumak için kullanılacak dokular için:
- Oda sıcaklığında tutulan PFA tarafından belirlenmiş bir forseps kullanarak, dokuları %4 PFA (oda sıcaklığında tutulur) içeren ilgili mikrosantrifüj tüpüne bırakın ve dokunun %4 PFA çözeltisine tamamen batırıldığından emin olun.
NOT: PFA kontaminasyonu, farklı aşağı akış moleküler tahlillerini olumsuz etkileyebilir. Diğer dokuların veya aletlerin PFA kontaminasyonunu önlemek için PFA'yı tutarken yalnızca PFA tarafından belirlenmiş forseps kullanın. - Mikrosantrifüj tüplerini bir rafa yerleştirin ve tüpleri karanlıkta tutmak için rafı folyo kağıtla örtün. Kapalı rafı 4 °C'de bir çalkalayıcı üzerinde gece boyunca hafifçe çalkalayarak inkübe edin.
- Gece boyunca inkübasyondan sonra, 5.0 g'ı çözerek 1x PBS'de% 5 sükroz (% a/h) hazırlayın. sükrozu 70 mL 1x PBS'de kuvvetli çalkalayarak karıştırın. % 5'lik bir sükroz çözeltisi (% a/h) elde etmek için 100 mL'lik nihai toplam hacme yeterli miktarda 1x PBS ekleyin.
- 0.22 μm şırınga filtresini kullanarak% 5 sükroz çözeltisini sterilize edin. 2.0 mL mikrosantrifüj tüplerini etiketleyin ve taze hazırlanmış% 5 sükroz ile doldurun.
- Dokuları %4 PFA'dan %5 sakaroz içeren (oda sıcaklığında tutulur) ilgili mikrosantrifüj tüpüne aktarın ve dokunun %5 sükroz çözeltisine tamamen batırıldığından emin olun.
- Mikrosantrifüj tüplerini bir rafa yerleştirin ve tüpleri karanlıkta tutmak için rafı folyo kağıtla örtün. Kapalı rafı 4 °C'de bir çalkalayıcı üzerinde gece boyunca hafifçe çalkalayarak inkübe edin.
- Gece boyunca inkübasyondan sonra, 20.0 g'ı çözerek 1x PBS'de% 20 sükroz (% a/h) hazırlayın. sükrozu 70 mL 1x PBS'de kuvvetli çalkalama ile çözün. % 20'lik bir sükroz çözeltisi (% a / h) elde etmek için 100 mL'lik nihai toplam hacme yeterli miktarda 1x PBS ekleyin.
- % 20'lik sükroz çözeltisini 0.22 μm'lik bir şırınga filtresi kullanarak sterilize edin. 2.0 mL mikrosantrifüj tüplerini etiketleyin ve taze hazırlanmış% 20 sükroz ile doldurun.
- Dokuları %5 sakarozdan %20 sakaroz içeren (oda sıcaklığında tutulur) ilgili mikrosantrifüj tüpüne aktarın ve dokunun %20 sükroz çözeltisine tamamen batırıldığından emin olun.
- Mikrosantrifüj tüplerini bir rafa yerleştirin ve tüpleri karanlıkta tutmak için rafı folyo kağıtla örtün. Kapalı rafı 4 °C'de bir çalkalayıcı üzerinde gece boyunca hafifçe çalkalayarak inkübe edin.
- Gece boyunca inkübasyondan sonra, metilbütanı metal bir kaba koyun ve metilbütan metal kabı bir Strafor kutusunun içine yerleştirin. Metal kabı kuru buzla çevreleyin, böylece kabı çevreleyen kuru buz seviyesi, kabın içindeki metilbütan seviyesinden daha yüksek olur.
- Boş 2 mL mikrosantrifüj doku saklama tüplerini etiketleyin ve kuru buz üzerine yerleştirin. Dokuları dondurmaya başlamadan önce metilbütan ve doku saklama tüplerini en az 20 dakika kuru buz üzerinde soğumaya bırakın. Transfer forsepslerini kuru buzun üzerine yerleştirin.
- Fazla %20 sakarozdan kurtulmak için hassas mendiller kullanarak dokuları hızla kurulayın. Dokuyu kuru buz üzerinde önceden soğutulmuş metilbütan içine bırakın. Dokuyu en az 1 dakika metilbütan içinde bırakın.
- Donmuş dokuları metilbütandan önceden soğutulmuş boş 2 mL mikrosantrifüj doku saklama tüplerine aktarmak için önceden soğutulmuş transfer forsepslerini kullanın. Dokuyu -80 °C'de saklayın.
- Oda sıcaklığında tutulan PFA tarafından belirlenmiş bir forseps kullanarak, dokuları %4 PFA (oda sıcaklığında tutulur) içeren ilgili mikrosantrifüj tüpüne bırakın ve dokunun %4 PFA çözeltisine tamamen batırıldığından emin olun.
- Fareyi kurumun hayvan bakım yönergelerine göre ötenazi yapın.
4. vg/dg miktar tayini için dPCR
- Dokulardan DNA ekstraksiyonu ve ilk RNA sindirimi
NOT: Bu DNA ekstraksiyon protokolünü türetmek için Malzeme Tablosunda listelenen DNA ekstraksiyon kitinin el kitabı kullanılmıştır. Donmuş doku parçalarını içeren tüpleri daima kuru buz üzerinde tutun.- Bir kova buz hazırlayın.
- Her DNA örneği için bir adet 1.5 mL lizis boncuk tüpü ve iki adet boş RNaz içermeyen ve DNaz içermeyen 1.7 mL mikrosantrifüj tüpünü etiketleyin.
- Her boncuk tüpüne 180 μL ilk DNA ekstraksiyon kiti tamponu ekleyin. Tampon içeren ilk boncuk tüpünün darasını alın.
NOT: Dokular adım 3.2.4.1'de önceden kesilmemişse, dokuyu 20 mg'lık parçalar halinde kesmek için kuru buz üzerinde önceden soğutulmuş bir tıraş bıçağı kullanın. Bu adım, -20 °C veya daha soğukta tutulan temiz bir kriyostat içinde yapılmalıdır. - Tüpe bir parça doku ekleyin; dokunun ağırlığını tartın ve kaydedin (~ 20 mg olacak).
- Lizis boncuk tüpünü içindeki doku ile hemen buzun üzerine yerleştirin. Tampon kristalleşebilir.
- Her doku örneği için önceki adımları tekrarlayın.
- Tüpleri lizis boncuk tüpü karıştırıcısına aktarın ve 1 ° C'de maksimum hızda (hız 10) 4 dakika çalıştırın.
- Numuneleri santrifüje aktarmak için buzun üzerine yerleştirin. 4 ° C'de 20.000 × g'da 1 dakika santrifüjleyin.
- Santrifüjleme aşaması sırasında, 1.7 mL'lik mikrosantrifüj tüplerinin ilk serisine 20 μL proteinaz K ekleyin. Santrifüjleme adımından sonra, homojenatların süpernatantını proteinaz K içeren 1.7 mL'lik tüplere aktarın ve iyice karıştırın. 56 ° C'de 15 dakika inkübe edin, 500 RPM karıştırın.
- Tüpü bir mini santrifüj kullanarak 1-2 saniye santrifüj ederek tüpün duvarlarından ve kapağından damlaları toplayın. Oda sıcaklığında 2 dakika inkübe edin.
- 4 μL RNase A ekleyin ve kısa darbe girdabı ile karıştırın. Oda sıcaklığında 2 dakika inkübe edin. 15 saniye boyunca nabız girdabı.
- Tüpü bir mini santrifüj kullanarak 1-2 saniye santrifüj ederek tüpün duvarlarından ve kapağından damlaları toplayın. 200 μL ikinci DNA ekstraksiyon kiti tamponu ekleyin. 15 saniye boyunca nabız girdabı.
- Tüpü bir mini santrifüj kullanarak 1-2 saniye santrifüj ederek tüpün duvarlarından ve kapağından damlaları toplayın. 200 μL %100 EtOH ekleyin. 15 saniye boyunca nabız girdabı.
- Tüpü bir mini santrifüj kullanarak 1-2 saniye santrifüj ederek tüpün duvarlarından ve kapağından damlaları toplayın. Lizatları DNA ekstraksiyon spin kolonuna aktarın. 6.000 × g'da 1 dakika döndürün.
- Döndürme sütununu yeni bir toplama tüpüne yerleştirin. Döndürme kolonuna 500 μL üçüncü DNA ekstraksiyon kiti tamponu ekleyin. 6.000 × g'da 1 dakika döndürün.
- Döndürme sütununu yeni bir toplama tüpüne yerleştirin. Döndürme kolonuna 500 μL dördüncü DNA ekstraksiyon kiti tamponu ekleyin. 20.000 × g'da 3 dakika döndürün.
- Döndürme kolonunu yeni bir 1.7 mL mikrosantrifüj tüpüne yerleştirin. Döndürme kolonuna 100 μL moleküler dereceli su ekleyin. Oda sıcaklığında 1 dakika inkübe edin. Oda sıcaklığında 1 dakika boyunca 6.000 × g'da döndürün.
- Gerekirse DNA konsantrasyonunu ölçün. Kısa süreli depolama için 4 °C'de veya uzun süreli depolama için -20 °C'de saklayın.
- FACS ile sıralanmış hücrelerden DNA ekstraksiyonu
NOT: Bu DNA ekstraksiyon protokolünü türetmek için Malzeme Tablosunda listelenen DNA ekstraksiyon kitinin el kitabı kullanılmıştır.- Hücreleri sıraladıktan sonra, yanlardaki ve kapaktaki tüm damlaları toplamak için numuneleri 5 saniye boyunca 300 × g'da santrifüjleyin. Tüm damlaların toplandığından emin olun.
NOT: Numune hacmi 1.5 mL'den azsa, doğrudan bir sonraki adıma geçin. Numune hacmi 1.5 mL'den büyükse, süpernatantın üst kısmını bir mikropipet kullanarak dikkatlice çıkarın ve atın, geriye 1-1.5 mL numune bırakın. - Numuneyi birkaç kez yukarı ve aşağı pipetleyerek karıştırın ve numuneyi 1,7 mL'lik bir mikrosantrifüj tüpüne aktarın. Oda sıcaklığında 1 dakika boyunca 515 × g'da santrifüjleyin.
- Son 50 μL hariç süpernatanı atın. Pelet, 100 μL'lik bir son hacim için ilk DNA ekstraksiyon kiti tamponunun 50 μL'sinde yeniden süspanse edin.
- Genomik DNA'nın küçük hacimlerde kandan izolasyonu için üreticinin protokolünü takip edin (bkz.
- 10 μL proteinaz K ve 100 μL ikinci DNA ekstraksiyon kiti tamponu ekleyin; 15 saniye boyunca nabız girdabı ile karıştırın. Numuneleri 56 °C'de 300 RPM karıştırma ile 10 dakika inkübe edin. Bu inkübasyon süresi boyunca numuneleri hafifçe ters çevirerek iki kez karıştırın.
- Tüpü bir mini santrifüj kullanarak 1-2 saniye santrifüj ederek tüpün duvarlarından ve kapağından damlaları toplayın. 50 μL %100 EtOH ekleyin ve 15 saniye boyunca nabız girdabı ile karıştırın. Numuneleri oda sıcaklığında 5 dakika inkübe edin.
- Tüpü bir mini santrifüj kullanarak 1-2 saniye santrifüj ederek tüpün duvarlarından ve kapağından damlaları toplayın. Numuneleri, kenarı ıslatmadan DNA ekstraksiyon kolonuna (kolon 2 mL'lik bir toplama tüpü içindedir) aktarın. 6.000 × g'da 1 dakika santrifüjleyin.
- Kolonu temiz bir 2 mL toplama tüpüne yerleştirdikten sonra, akışı içeren toplama tüpünü atın. Kenarı ıslatmadan kolona 500 μL üçüncü DNA ekstraksiyon kiti tamponu ekleyin ve 6.000 × g'da 1 dakika santrifüjleyin.
- Yine, kolonu temiz bir 2 mL toplama tüpüne yerleştirdikten sonra, akışı içeren toplama tüpünü atın. Kenarı ıslatmadan kolona 500 μL dördüncü DNA ekstraksiyon kiti tamponu ekleyin ve 1 dakika boyunca 6.000 × g'da santrifüjleyin.
- Kolonu 2 mL'lik temiz bir toplama tüpüne yerleştirin ve akış içeren toplama tüpünü atın. 20.000 × g'da 3 dakika santrifüjleyin.
- Kolonu temiz bir 1.7 mL mikrosantrifüj tüpüne yerleştirin ve akış içeren toplama tüpünü atın. Elüsyon için kolon zarının merkezine 20 μL moleküler dereceli su ekleyin; Kapağı kapatın ve numuneleri moleküler dereceli su ile oda sıcaklığında 5 dakika inkübe edin.
- 20.000 × g'da 1 dakika santrifüjleyin. Ayrıştırılan DNA'yı kısa süreli depolama için 4 °C'de veya uzun süreli saklama için -20 °C'de saklayın.
- Hücreleri sıraladıktan sonra, yanlardaki ve kapaktaki tüm damlaları toplamak için numuneleri 5 saniye boyunca 300 × g'da santrifüjleyin. Tüm damlaların toplandığından emin olun.
- RNA sindirimi ve temizlenmesi
NOT: Bu DNA temizleme protokolünü türetmek için Malzeme Tablosunda listelenen DNA ekstraksiyon kitinin el kitabı kullanılmıştır. dPCR koşullarına, reaktiflere ve primer ve prob tasarımlarına bağlı olarak, dPCR vg/dg miktar tayinine geçmeden önce DNA numunesinde RNA'nın tamamen yokluğundan emin olmak gerekebilir. RNA kontaminasyonu, belirli dPCR koşulları altında çeşitli derecelerde yanlış vg/dg değerlerine neden olabilir.- 0.2 mL'lik bir PCR tüpünde veya 1.7 mL'lik bir mikrosantrifüj tüpünde, her DNA örneğine en fazla 20 μL ekstrakte edilmiş DNA örneği ve 1.5 μL DNaz içermeyen RNaz ekleyin. DNA / RNaz karışım hacmi 21.5 μL'den azsa, 21.5 μL'lik nihai hacme yeterli miktarda moleküler dereceli su ekleyin ve tüpleri ters çevirerek 25x karıştırın. 37 ° C'de 30 dakika inkübe edin ve tüpleri ters çevirerek her 10 dakikada bir periyodik olarak karıştırın.
NOT: Tüpe eklenen toplam nükleik asit miktarı 175 ng ile 700 ng arasında olmalıdır. DNA örnekleri bu aralığın dışında hacimler veya nükleik asit miktarları içeriyorsa veya DNA örnekleri farklı şekilde izole edilmişse modifikasyonlar gerekebilir. - 2 dakika buzun üzerine koyun. Her DNA / RNaz karışımına 100 μL'lik bir nihai hacme kadar yeterli moleküler dereceli su ekleyin.
NOT: Burada listelenen RNaz, hedef DNA'yı veya aşağı akış PCR testlerini olumsuz etkilemeden kirletici RNA'yı sindirdiği için önerilir. - Genomik DNA'nın temizlenmesi için üreticinin protokolünü takip edin (bkz. Malzeme Tablosu).
- 10 μL birinci DNA ekstraksiyon kiti tamponu ve 250 μL ikinci DNA ekstraksiyon kiti tamponu ekleyin. 10 saniye boyunca nabız girdabı ile karıştırın.
- Numuneleri, kenarı ıslatmadan 2 mL'lik bir toplama tüpünde DNA ekstraksiyon kolonuna aktarın. 6.000 × g'da 1 dakika santrifüjleyin.
- Kolonu temiz bir 2 mL toplama tüpüne yerleştirdikten sonra, akışı içeren toplama tüpünü atın. 500 μL'lik ikinci DNA ekstraksiyon kiti tamponunu, kenarı ıslatmadan kolona ekleyin. 6.000 × g'da 1 dakika santrifüjleyin.
- Kolonu 2 mL'lik temiz bir toplama tüpüne yerleştirin ve akış içeren toplama tüpünü atın. 20.000 × g'da 6 dakika santrifüjleyin.
- Kolonu temiz bir 1.7 mL mikrosantrifüj tüpüne yerleştirin ve akışı içeren toplama tüpünü atın. Elüsyon için kolon zarının ortasına 20 μL moleküler dereceli su ekleyin, kapağı kapatın ve numuneleri moleküler dereceli su ile oda sıcaklığında 5 dakika inkübe edin.
- 20.000 × g'da 1 dakika santrifüjleyin. Kısa süreli depolama için 4 °C'de veya uzun süreli depolama için -20 °C'de saklayın.
- Yalnızca tek bir ekzonu değil, birden fazla ekzonu kapsayan bir mRNA bölgesini amplifiye edecek bir PCR primer çifti kullanarak son nokta PCR veya dPCR veya kantitatif PCR (qPCR) ile RNaz ile sindirilmiş numunede RNA kontaminasyonunun olmadığını doğrulayın.
NOT: Varsa mRNA kontaminasyonunun doğru bir şekilde tanımlanmasını sağlamak için mRNA hedefi, hedef doku/hücre tipinde yüksek oranda eksprese edilen bir gene sahip olmalıdır. Birden fazla ekzonu kapsayan amplikonlar, mRNA'yı kirleten mRNA'ya karşı genomik DNA'dan kaynaklanan bantlar arasında ayrım yapar. Varsa mRNA kontaminasyonunun tespit edilmesini sağlamak için PCR reaksiyonu için pozitif kontrol olarak her zaman RNaz sindirilmemiş bir DNA örneğine sahip olun.
- 0.2 mL'lik bir PCR tüpünde veya 1.7 mL'lik bir mikrosantrifüj tüpünde, her DNA örneğine en fazla 20 μL ekstrakte edilmiş DNA örneği ve 1.5 μL DNaz içermeyen RNaz ekleyin. DNA / RNaz karışım hacmi 21.5 μL'den azsa, 21.5 μL'lik nihai hacme yeterli miktarda moleküler dereceli su ekleyin ve tüpleri ters çevirerek 25x karıştırın. 37 ° C'de 30 dakika inkübe edin ve tüpleri ters çevirerek her 10 dakikada bir periyodik olarak karıştırın.
- Dijital PCR (dPCR)
- Primerlerin özgüllüğünü ve optimal PCR koşullarını kontrol etmek için son nokta PCR (isteğe bağlı)
- Vektör genomu için dPCR primer çiftleri ve probları ve numunedeki diploid genomları ölçmek için kullanılacak fare referans geni için dPCR primer çiftleri ve probları tasarlayın.
NOT: 60 bp ile 150 bp arasında amplikon boyutunu hedefleyin. Fare referans geni, diploid genom başına sabit bir gen kopya sayısına sahip bir gen olmalıdır. Burada listelenen hesaplamalar için, referans genin (Polr2a) diploid genom başına iki kopyası vardır. - 10 μL uç nokta PCR reaksiyonu için, daha sonra dPCR reaksiyonu için kullanılacak reaktifleri ve nihai konsantrasyonları kullanarak PCR karışımını hazırlayın. RNaz ile sindirilmiş şablon DNA örneğini (nükleik asitler miktar aralığı 56-223 ng), DNA polimeraz ve dNTP'leri, her bir ileri primerin 0.8 μM'sini, her bir ters primerin 0.8 μM'sini, her probun 0.4 μM'sini ve 0.025 U/μL restriksiyon enzimini içeren 1x dPCR ana karışımının nihai konsantrasyonuna ekleyin (restriksiyon enziminin nihai konsantrasyonu, kullanılan restriksiyon enzimine ve markaya bağlıdır). 10 μL'lik bir nihai hacme ulaşmak için moleküler dereceli su ekleyin.
NOT: PCR karışımında en az iki primer çifti ve iki prob bulunmalıdır: vektör genomunu tespit etmek için bir primer çifti ve bir prob ve fare genomunu tespit etmek için bir primer çifti ve bir prob. - PCR termal döngü koşulları: 95 °C'de 2 dakika boyunca ilk ısı aktivasyon adımı, ardından 25 saniye boyunca 95 °C'de 35-45 döngü denatürasyon adımı ve 58-62 °C'de 1 dakika boyunca birleşik tavlama/uzatma adımı.
NOT: Her amplikon ve astar çifti için optimum tavlama sıcaklığı belirlenmelidir. Döngü sayısı, numunedeki şablon DNA miktarına göre ayarlanabilir. - Hedef amplikon bantlarının ve olası spesifik olmayan amplifikasyon bantlarının varlığını belirlemek için jel elektroforezi kullanarak PCR ürününü bir agaroz jel üzerinde görselleştirin.
- Primer çiftlerinin ve döngü koşullarının hedef dizilerin spesifik amplifikasyonu ile sonuçlandığını onayladıktan sonra bir sonraki dPCR adımına geçin.
- Vektör genomu için dPCR primer çiftleri ve probları ve numunedeki diploid genomları ölçmek için kullanılacak fare referans geni için dPCR primer çiftleri ve probları tasarlayın.
- dPCR reaksiyonu
- 40 μL'lik bir dPCR reaksiyonu için, DNA polimeraz ve dNTP'leri içeren 1x dPCR ana karışımının nihai konsantrasyonuna 4 μL'ye kadar RNaz ile sindirilmiş şablon DNA numunesi (nükleik asitler miktar aralığı 50-330 ng), her bir ileri primerin 0.8 μM'si, her bir ters primerin 0.8 μM'si, her probun 0.4 μM'si, ve 0.025 U/μL restriksiyon enzimi (restriksiyon enziminin nihai konsantrasyonu, restriksiyon enzimine ve kullanılan markaya bağlıdır). 40 μL'lik nihai hacme ulaşmak için moleküler dereceli su ekleyin.
- dPCR termal döngü koşulları: 95 °C'de 2 dakika boyunca ilk ısı aktivasyon adımı, ardından 25 saniye boyunca 95 °C'de 40-50 döngü denatürasyon adımı ve 58-62 °C'de 1 dakika boyunca birleşik tavlama/uzatma adımı.
NOT: Her amplikon ve astar çifti için optimum tavlama sıcaklığı belirlenmelidir. Döngü sayısı, numunedeki şablon DNA miktarına göre ayarlanabilir. Burada listelenen hacimler, konsantrasyonlar ve koşullar, Malzeme Tablosunda listelenen dPCR plakaları, reaktifler ve cihaz için optimize edilmiştir. Bu koşullar, reaksiyonun doğruluğunu azaltabilecek herhangi bir potansiyel dPCR inhibitörünün etkisini azaltır. - dPCR reaksiyonunu çalıştırdıktan ve vektör genomları ve fare referans geni için mutlak değerleri elde ettikten sonra, denklemleri (7-8) kullanarak numunede vg/dg'yi hesaplayın.
İki gen kopyası/diploid genomu olan referans genler için:
Diploid genomların mutlak değeri (dg) =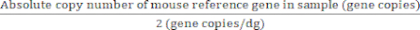 (7)
(7)
vg/dg =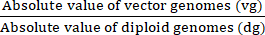 (8)
(8) - Testin ve miktar tayininin geçerliliğini doğrulamak için dPCR reaksiyonunun 1D dağılım grafiğini kontrol edin (Şekil 3A,C). Tahlilin geçerli olması için, 1B dağılım grafiğinin aşağıdaki tüm kriterleri karşıladığını onaylayın: pozitif ve negatif bölümlerin varlığı; doğru eşik belirlemesine izin vermek için pozitif ve negatif bölümler arasında net ayrım; ve pozitif ve negatif bölümler (yağmur olarak da bilinir) arasında dPCR nicelemesinin doğruluğunu azaltabilen az veya birkaç damlacıkların varlığı.
- Primerlerin özgüllüğünü ve optimal PCR koşullarını kontrol etmek için son nokta PCR (isteğe bağlı)
Temsili Sonuçlar
Yedi ila dokuz haftalık erkek farelere, 150-200 μL enjeksiyon hacminde verilen 1.5 ×10 12 vg / farede lateral kuyruk ven enjeksiyonu yoluyla AAV enjekte edildi. Burada kullanılan ssDNA AAV, CMV promotörü tarafından yönlendirilen Cre rekombinaz transgeni sağladı. Enjekte edilen fareler, Cre muhabiri Ai14 aleli için homozigottu. Cre rekombinaza maruz kaldığında, Ai14 alel içeren hücreler floresan tdTomato proteinini eksprese eder. tdTomato ekspresyonu, Cre'nin neden olduğu genomik rekombinasyondan kaynaklandığından, tdTomato eksprese eden hücreler, ya doğrudan AAV tarafından transdüksiyona uğramış ya da transdüksiyonlu hücrelerin döl hücreleri olan hücreleri gösterir. Burada gösterilen veriler, 160 μL'de (5.8-5.9 × 1013 vg / kg) 1.5 ×12 vg / farede AAV9-CMV-Cre enjekte edilen farelere aittir. Fareler enjeksiyondan 28 gün sonra sakrifiye edildi ve dokular yukarıda tarif edildiği gibi toplandı. Birkaç iskelet kası ve karaciğer lobu sindirildi ve hücreleri FACS kullanılarak toplandı. Birkaç karaciğer lobu, nükleik asit ekstraksiyonu için önceden soğutulmuş metilbütan kullanılarak hemen donduruldu. Birkaç iskelet kası ve karaciğer lobu floresan tdTomato'nun histolojik görüntülemesi için fiks-donduruldu. tdTomato, karaciğer (Şekil 2A) ve kuadriseps (Şekil 2C) boyunca yaygın olarak eksprese edildi, bu da AAV9'un her iki dokunun farklı bölgelerine geniş ölçüde ulaştığını ve transdüksiyon yaptığını gösteriyor.
Taze donmuş karaciğer ve FACS ile sıralanmış hücrelerden ekstrakte edilen DNA, dPCR kullanılarak vg/dg'yi ölçmek için kullanıldı. Vg/dg miktar tayini, analiz edilen numunede enjeksiyon tutarlılığını ve AAV'nin transdüksiyon verimliliğini değerlendirmek için kullanılabilir. Testin geçerliliğini sağlamak için taze donmuş karaciğer dokusu örneğinden ve FACS ile sıralanmış hücrelerden elde edilen 1D damlacık dağılım grafikleri kullanıldı (Şekil 3A, C). Dağılım grafiği, pozitif ve negatif bölümlerin varlığını, algılama eşiğinin doğru bir şekilde belirlenmesini sağlayan pozitif ve negatif bölümler arasında net bir ayrım olduğunu ve pozitif ve negatif bölümler arasında dPCR testinin doğruluğunu azaltabilecek az veya birkaç damlacıkların varlığını gösterdi. Tüm bu kriterlerin karşılanması, dPCR test sonuçlarının geçerli olduğunu gösterdi. Her numunedeki Polr2a gen kopyalarının sayısı, fare diploid genomlarının sayısını belirlemek için ölçüldü (2 Polr2a gen kopyası / fare diploid genomu) ve viral genomu ölçmek için Cre rekombinaz transgen dizisine karşı primerler / prob kullanıldı (1 transgen kopyası / viral genom, Tablo 1). Vg/dg değeri, taze donmuş karaciğer dokusu örneği ve FACS'a göre sıralanmış hücreler için ölçüldü ve her örnekte sırasıyla 187.7 vg/dg ve 4.7 vg/dg varlığını gösterdi (Şekil 3B,D). PBS enjekte edilen farelerden ve nükleik asit içermeyen şablon olmayan kontrollerden alınan numuneler negatif kontroller olarak kullanıldı.

Şekil 1: İntravenöz enjeksiyon istasyonuna genel bakış. (A) IV enjeksiyonu gerçekleştirmek için gerekli aletler. Burada gösterilen (1) zamanlayıcı, (2) fare tüpü sınırlayıcı, (3) kesilmemiş ve (4) kesilmiş plastik kısıtlayıcı koniler, (5) alkollü çubuk, (6) fare tüpü tutucuyu yükseltmek için bir platform olarak kullanılan boş pipet uçları kutusu, (7) tek kullanımlık emici pedler, (8) ılık su ile 15 mL konik tüp, (9) 15 mL tüp tutucu, (10) gazlı bez ve (11) insülin şırıngası. (B) Fare önce tüp tutucunun içine yerleştirilir. Ardından, fare yalnızca tüp tutucu tarafından kısıtlanamayacak kadar küçükse, farenin etrafında bir sınırlama manşonu oluşturmak için kesilmiş tutucu koni yerleştirilir. Farenin solunumunun sınırlayıcılar tarafından engellenmediğinden emin olun. Tüp tutucu, fare kuyruğunun ılık suya yerleştirilmesine izin vermek için yükseltilmiş platformun üzerine yerleştirilir. (C) Enjeksiyonu gerçekleştirmeden hemen önce fare kuyruğu konumlandırması ve iğne tutma açısı. Kuyruğu geri çekin, böylece kuyruk gerilir ve enjeksiyon bölgesi tamamen yatay olur. İğne kuyruğa ve damara paraleldir ve eğim yukarı bakmaktadır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
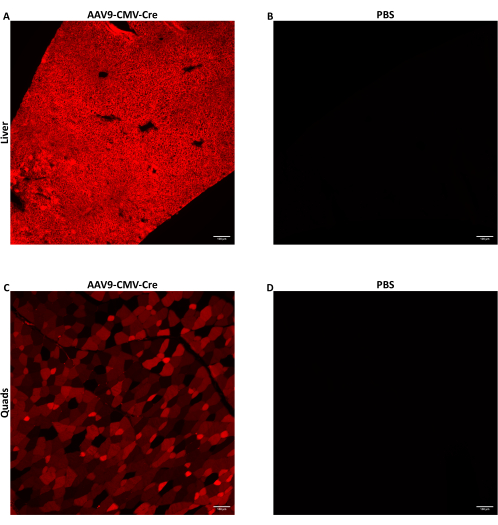
Şekil 2: IV enjeksiyon sonrası floresan raportör proteinin tespiti. Cre raportörü Ai14 alelini barındıran yedi ila dokuz haftalık erkek farelere, 160 μL (5.8-5.9 × 1013 vg / kg) veya PBS'de verilen 1.5 ×10 12 vg / farede AAV9-CMV-Cre IV enjekte edildi. Cre IV enjeksiyonu yapan AAV9 sonrası fare (A) karaciğer veya (C) kuadriseps bölümlerinin temsili floresan görüntüleri. (B) PBS enjekte edilen farelerden karaciğer veya (D) kuadriseps kesitleri, negatif kontroller olarak hizmet etmek üzere görüntülendi. Dokular IV enjeksiyondan 28 gün sonra toplandı ve sabitlendi. Cre maruziyeti sonrası, floresan tdTomato proteini, transdüksiyona uğrayan hücrelerde ve transdüksiyona uğrayan hücrelerin döl hücrelerinde eksprese edilir. 10 μm kalınlığındaki kesitler 10x büyütmede görüntülendi. Ölçek çubukları = 100 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
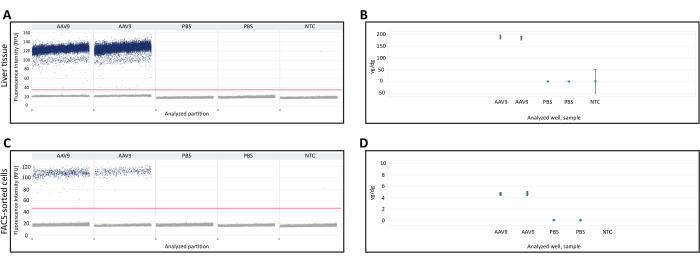
Şekil 3: Diploid genom başına vektör genomu (vg/dg) miktar tayini . AAV9-CMV-Cre veya PBS enjekte edilen farelerden toplanan (A) karaciğer dokusu veya (C) FACS ile sıralanmış hücrelerde dPCR vektör genomlarının kantifikasyonunun 1D dağılım grafiği. Dağılım grafikleri, pozitif ve negatif dPCR bölümlerinin yanı sıra numuneler boyunca yatay çizgi ile gösterilen algılama eşiğini gösterir. (B,D) vg/dg miktar tayini, (B) karaciğer dokusunda veya (D) FACS'ta sıralanmış hücre örneklerinde fare diploid genomlarının ve vektör genomlarının ölçülmesinden sonra. Burada gösterilen sonuçlar, tek bir AAV9 enjekte edilmiş fareden ve her fare için teknik bir dPCR kopyasına sahip tek bir PBS enjekte edilmiş fareden alınmıştır. Hata çubukları, her numune için %95 güven aralığını gösterir. Kısaltmalar: NTC = Şablon olmayan kontrol; dPCR = dijital PCR; FACS = floresanla aktive edilen hücre sıralaması. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| Astar | Sıra |
| Cre ileri astar | CTGACGGTGGGAGAATGTTAAT |
| Cre ters astar | CATCGCTCGACCAGTTTAGTT |
| Cre sondası | /56-FAM/CGCAGGTGT/ZEN/AGAGAAGGCACTTAGC/3IABkFQ/ |
| Polr2a ileri astar | GACTCCTTCACTCACTGTCTTC |
| Polr2a ters astar | TCTTGCTAGGCAGTCCATTATC |
| Polr2a sondası | /5HEX/ACGAGATGC/ZEN/TGAAAGAGCCAAGGT/3IABkFQ/ |
Tablo 1: vg/dg miktar tayini için kullanılan primer ve prob dizileri. Vektör genomunu ölçmek için Cre primerleri ve prob kullanıldı. Fare diploid genomunu ölçmek için Polr2a primerleri ve probu kullanıldı.
Tartışmalar
AAV bazlı tedaviler, AAV'nin bir gen terapisi vektörü olarak çok yönlülüğü nedeniyle monogenik bozukluklar için büyük bir potansiyele sahiptir, bu da AAV'leri farklı bozuklukların çeşitli dağıtım ihtiyaçlarını karşılayacak şekilde özelleştirmeyi mümkün kılar 4,5,7,9. AAV'ler, potansiyel terapötiklerin güvenliğini ve etkinliğini test etmek için klinik öncesi fare modellerinde yaygın olarak IV enjeksiyon yoluyla uygulanır16. Enjekte edilen farklı AAV dozları deneysel sonuçlarda belirgin farklılıklara neden olabileceğinden, üretilen in vivo verilerin geçerliliğini ve sağlamlığını sağlamak için deneycilerin amaçlanan AAV dozunu tutarlı bir şekilde enjekte edebilmeleri kritik öneme sahiptir28. IV enjeksiyonlar yaygın olarak kullanılmaktadır, ancak teknik olarak zordur ve sürekli olarak başarılı enjeksiyonlar sağlayan bir beceri düzeyi geliştirmek ve sürdürmek için kapsamlı eğitim ve sürekli uygulama gerektirir 16,17,18,19. AAV'nin doğru bir şekilde enjekte edilmesine ek olarak, genellikle enjekte edilen AAV'nin biyolojik dağılımını ve hedef dokulara veya hücrelere iletim verimliliğini değerlendirmek için tahlillerin kullanılması arzu edilir29,30.
Bu protokol, 7-9 haftalık, sedasyonsuz farelerde AAV'yi uygulamak için optimize edilmiş bir IV enjeksiyon protokolünün ayrıntılarını ayrıntılı bir şekilde açıklayarak, deneycilerin IV enjeksiyonlarını başarılı ve tutarlı bir şekilde kolayca gerçekleştirmelerine yardımcı olmayı amaçlamaktadır. Burada kullanılan yaş aralığındaki vahşi tip farelerden belirgin şekilde daha küçük veya daha büyük olan farelerin, damarların görünürlüğünün azalması veya bu yöntemde kullanılan kısıtlayıcılarla uyumsuzluk nedeniyle daha büyük bir zorluk teşkil edebileceğini unutmamak önemlidir. Daha önce, kuyruk IV enjeksiyonlarının, küçük damar boyutu31 nedeniyle 6 haftalıktan küçük farelerde intravenöz olarak reaktiflerin uygulanması için uygun olmadığı bildirilmiştir. Mümkün olsa da, 22.0 g'dan daha hafif fareleri tutarlı bir şekilde enjekte etmek zor olabilir. başarılı bir şekilde. Atipik büyüklükte fareler kullanan araştırmacıların prosedüre uyarlamalar yapması gerekebilir. Bu protokol ayrıca AAV biyodağılımını ve transdüksiyon verimliliğini değerlendirmek için kullanılabilecek çeşitli testleri de özetlemektedir.
Bu protokolü takip ederken bazı kritik noktaların akılda tutulması gerekir. Enjeksiyon sırasında, iğne damar içinde değilse 29 G iğneler daha fazla direnç sağlar. Bu, başarısız enjeksiyon girişimleri sırasında çözeltinin yanlışlıkla perivasküler enjeksiyonundan kaybedilen hacmi azaltır. İnsülin şırıngaları, normal şırıngalardan daha küçük ölü hacimlere sahiptir. Burada listelenenlerden farklı bir şırınga ve / veya iğne kullanılıyorsa, daha büyük ölü alan hacmini hesaba katmak için protokol adımları 1.1.3.3'te ek enjeksiyon hacminin hazırlanması gerekebilir (ör., amaçlanan doza 15 μL yerine 30 μL ekleyin).
AAV dozunu şırıngaya aspire ederken şırınga kenarlarında ince aspirasyona bağlı hava kabarcıkları oluşursa, enjeksiyonu yavaşça şırınganın yukarısına doğru çekin. Bu, çoğu küçük hava kabarcığını ortadan kaldıracaktır. Enjekte edilecek istenen hacme en az 10-15 μL daha AAV yükleyin. Bu ek hacim, hava kabarcıklarının dışarı atılması veya olası başarısız enjeksiyon girişimleri sırasında kaybedilebilecek herhangi bir hacmi hesaba katmak içindir. (örneğin, enjekte edilecek hedef hacim 150 μL ise, şırıngaya 165 μL yükleyin (şırınga ölçeğindeki 160 μL ile 170 μL işaretlerinin yarısı). İğne damarın içine doğru bir şekilde yerleştirilmişse ve şırıngadaki hacim başarılı enjeksiyon girişiminden hemen önce 165 μL ise, reaktifi şırıngada 15 μL kalana kadar verin (10 μL ve 20 μL işaretlerinin yarısı), böylece 150 μL (165 μL - 150 μL = 15 μL)). Eğim lümeninin (eğim yukarı bakacak şekilde) şırınga ölçeği ile hizalanması, enjeksiyon sırasında verilen hacmin izlenmesini sağlar.
Bazı deneyciler, fareyi, ayakları üzerindeki bir fareye kıyasla damarlarından biri düz ve kolay erişilebilir olacak şekilde yan yatırmayı tercih edebilir. Bununla birlikte, bir farenin yan tarafındaki kuyruğu, fare boyutuna bağlı olarak farklı açılarda eğimli olacaktır ve farklı boyutlarda fareler enjekte edilirken enjeksiyon açısı ayarı gerektirecektir. Bu, prosedürün başarısının tutarlılığını olumsuz yönde etkileyebilir. İlk uygulama denemeleri sırasında, deneyciler tercih ettikleri yaklaşımı belirlemek için her iki fare kısıtlama yönelimini de deneyebilirler. Fareyi ayakları üzerinde tutmak, her iki yan kuyruk damarına hızlı ve kolay erişim sağlar. Bu, birden fazla başarısız enjeksiyon girişimi durumunda her iki damara erişim gerektiğinde kısıtlama süresini azaltır.
Lateral ven kuyruk tabanına yakın (fare gövdesine daha yakın) enjekte ediliyorsa (özellikle >30 g ağırlığındaki fareler için), enjeksiyon açısını damara paralel olarak damara 5°-10° olarak ayarlayın çünkü kuyruk tabanındaki damar distal olarak olduğundan biraz daha derindir.
Burada listelenen RNaz sindirimi ve RNA kontaminasyon kontrol protokolleri, 20 μL'de toplam 175-700 ng nükleik asit içeren taze dondurulmuş karaciğer dokularından izole edilen DNA örneklerinde doğrulanmıştır. RNaz sindirim protokolü, RNaz sindiriminden sonra vektör genomunun ve fare genomunun varlığını doğrulamak için taze donmuş karaciğer dokularından ve FACS'a göre sıralanmış hücrelerden izole edilen DNA örnekleri üzerinde de test edildi. Sonuçlar, hedef amplikonların son nokta PCR amplifikasyonunun agaroz jel elektroforezi kullanılarak görselleştirildi.
Açıklanan metodolojiyi takip etmek, IV enjeksiyonlarında ustalaşmak için gereken eğitim ve uygulama süresini azaltabilir ve reaktifleri kurtaracak daha yüksek bir başarılı enjeksiyon oranı ile sonuçlanabilir. Bu protokol, hazır bulunmayabilecek gelişmiş ekipman veya kurulumlara ihtiyaç duymadan basit ve yaygın olarak kullanılan araçları kullanır. Ayrıca, burada listelenen IV enjeksiyon adımları, enjeksiyona bağlı olarak enjeksiyon hazırlama adımlarında yapılan uygun modifikasyonlarla, antisens oligonükleotidler (ASO'lar) gibi intravenöz olarak uygulanması gereken çok çeşitli enjeksiyonlara uygulanabilir.
Açıklamalar
Yazarların bu makalede yayınlanan çalışma ile ilgili herhangi bir açıklaması yoktur.
Teşekkürler
Yazarlar, destekleri için NINDS hayvan bakım tesisi personeline teşekkür eder. Bu çalışma, NIH, NINDS (Yıllık Rapor Numarası 1ZIANS003129) Intramural Araştırma Bölümü tarafından desteklenmiştir. İçerik yalnızca yazarların sorumluluğundadır ve Ulusal Sağlık Enstitüleri'nin resmi görüşlerini temsil etmek zorunda değildir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 0.22 µm syringe filter | Millipore | SLGVM33RS | |
| 0.3 mL insulin syringes with 29G needle | BD Biosciences | 324702 | |
| 1.7 mL microcentrifuge tube | Crystalgen | 23-2051 | |
| 10 mL syringe | BD Biosciences | 302995 | |
| 100% EtOH | The Warner Graham Company | 201096 | |
| 10x phosphate-buffered saline (PBS) | Corning | 46-013-CM | Used to prepare 1x PBS for tissue fixation |
| 15 mL conical tube | Corning | 430766 | |
| 15 mL conical tube holder | Multiple sources | N/A | |
| 190 proof ethyl alcohol | The Warner Graham Company | 6810-01-113-7320 | Used to prepare 70% ethanol |
| 1x sterile PBS | Gibco | 10010023 | |
| 2 mL microcentrifuge tissue storage tubes | Eppendorf | 022363344 | |
| 4% paraformaldehyde (PFA) | Electron Microscopy Sciences | 157-4 | |
| Adeno-associated virus (AAV) | Charles River | N/A | Single-stranded DNA (ssDNA) AAV was packaged to deliver Cre recombinase as the transgene driven by CMV promoter |
| Alcohol swab | BD Biosciences | 326895 | |
| Bead lysis tube | Next Advance | GREENE5 | |
| BsuRI (HaeIII) restriction enzyme | Thermo Fisher Scientific | ER0151 | |
| Bullet blender | Next Advance | BBX24B | |
| Ai14-derived mice from JAX 007914 strain (genetic background: C57BL/6J) | N/A | N/A | Mice containing Ai14 Cre-reporter allele were purchased from JAX (catalog number: 007914) |
| Disposable absorbent pads | Fisherbrand | 1420662 | |
| Dissection forceps | Fine Science Tools (F.S.T) | 11251-35 | |
| Dissection scissors | Fine Science Tools (F.S.T) | 14085-08 | |
| DNA degradation reagent (DNAZap) | Invitrogen | AM9890 | |
| DNA-Extraction RNase A | Qiagen | 19101 | For RNA digestion during nucleic acid extraction |
| DNase-free RNase for DNA cleanup | F. Hoffmann-La Roche | 11119915001 | For RNA digestion after nucleic acid extraction |
| dPCR Probe PCR Kit | Qiagen | 250102 | |
| dPCR software | Qiagen | N/A | QIAcuity Software Suite |
| Elevated platform | Multiple sources | N/A | An empty pipette tips box was used to elevate the mouse restrainer during tail warming up |
| Fluorescence microscope | Multiple sources | N/A | Model used here: Nikon Eclipse Ti |
| Fluorescence microscope software | Multiple sources | N/A | Software used here: NIS-Elements |
| Gauze | Covidien | 9022 | |
| Heat block | Eppendorf | Thermomixer 5350 | |
| High-speed centrifuge | Eppendorf | 22620689 | |
| Metal container | Vollrath | 80125 | |
| Methylbutane | J.T. Baker | Q223-08 | |
| Molecular grade water | Quality Biological | 351-029-131 | |
| Mouse tube restrainer | Braintree Scientific | TV-RED-150-STD | |
| Myfuge mini centrifuge | Benchmark Scientific | C1012 | |
| Polymerase chain reaction thermal cycler | Bio-Rad Laboratories | 1851148 | Model: C1000 Touch |
| Precision wipes | Kimberly-Clark Professional | 7552 | |
| Proteinase K | Qiagen | 19131 | |
| QIAcuity dPCR Nanoplate 26k 24-well | Qiagen | 250001 | |
| QIAcuity One dPCR system | Qiagen | 911020 | |
| Qiagen DNeasy Blood & Tissue Kit | Qiagen | 69504 | Used for DNA extraction from tissues |
| Qiagen QIAamp DNA Micro Kit | Qiagen | 56304 | Used for cleanup of genomic DNA, and the isolation of DNA from small volumes of blood prtocotol was used for DNA extraction from FACS-sorted cells |
| Rodent restrainer cone | Braintree Scientific | MDC-200 | |
| Scale | Ohaus | 72212663 | |
| Styrofoam box | Multiple sources | N/A | |
| Sucrose | Sigma-Aldrich | S9378-1kg | |
| Surface cleaner and disinfectant | Peroxigard | 29101 | |
| Timer | Multiple sources | N/A | |
| Transfer forceps | Fine Science Tools (F.S.T) | 91113-10 | |
| Vortex | Daigger & Company | 22220A | Model: Daigger Vortex Genie 2 |
Referanslar
- Tisdale, A., et al. The ideas initiative: Pilot study to assess the impact of rare diseases on patients and healthcare systems. Orphanet J Rare Dis. 16 (1), 429 (2021).
- Condo, I. Rare monogenic diseases: Molecular pathophysiology and novel therapies. Int J Mol Sci. 23 (12), 6525 (2022).
- Vaisitti, T., et al. The frequency of rare and monogenic diseases in pediatric organ transplant recipients in italy. Orphanet J Rare Dis. 16 (1), 374 (2021).
- Bulcha, J. T., Wang, Y., Ma, H., Tai, P. W. L., Gao, G. Viral vector platforms within the gene therapy landscape. Signal Transduct Target Ther. 6 (1), 53 (2021).
- Lundstrom, K. Viral vectors in gene therapy: Where do we stand in 2023. Viruses. 15 (3), 698 (2023).
- Wang, C., et al. Emerging non-viral vectors for gene delivery. J Nanobiotechnology. 21 (1), 272 (2023).
- Naso, M. F., Tomkowicz, B., Perry, W. L., Strohl, W. R. Adeno-associated virus (aav) as a vector for gene therapy. BioDrugs. 31 (4), 317-334 (2017).
- Ghosh, S., Brown, A. M., Jenkins, C., Campbell, K. Viral vector systems for gene therapy: A comprehensive literature review of progress and biosafety challenges. Appl Biosaf. 25 (1), 7-18 (2020).
- Wang, D., Tai, P. W. L., Gao, G. Adeno-associated virus vector as a platform for gene therapy delivery. Nat Rev Drug Discov. 18 (5), 358-378 (2019).
- Srivastava, A. Rationale and strategies for the development of safe and effective optimized aav vectors for human gene therapy. Mol Ther Nucleic Acids. 32, 949-959 (2023).
- Mukherjee, P., Roy, S., Ghosh, D., Nandi, S. K. Role of animal models in biomedical research: A review. Lab Anim Res. 38 (1), 18 (2022).
- Jucker, M. The benefits and limitations of animal models for translational research in neurodegenerative diseases. Nat Med. 16 (11), 1210-1214 (2010).
- Vandamme, T. F. Use of rodents as models of human diseases. J Pharm Bioallied Sci. 6 (1), 2-9 (2014).
- Anders, H. J., Vielhauer, V. Identifying and validating novel targets with in vivo disease models: Guidelines for study design. Drug Discov Today. 12 (11-12), 446-451 (2007).
- Turner, P. V., Brabb, T., Pekow, C., Vasbinder, M. A. Administration of substances to laboratory animals: Routes of administration and factors to consider. J Am Assoc Lab Anim Sci. 50 (5), 600-613 (2011).
- Prabhakar, S., Lule, S., Da Hora, C. C., Breakefield, X. O., Cheah, P. S. Aav9 transduction mediated by systemic delivery of vector via retro-orbital injection in newborn, neonatal and juvenile mice. Exp Anim. 70 (4), 450-458 (2021).
- Hauff, P., Nebendahl, K., Kiessling, F., Pichler, B. J., Hauff, P. Drug administration. Small Animal Imaging: Basics and Practical. , 127-152 (2017).
- Saleem, M., et al. A new best practice for validating tail vein injections in rat with near-infrared-labeled agents. J Vis Exp. (146), (2019).
- Resch, M., Neels, T., Tichy, A., Palme, R., Rulicke, T. Impact assessment of tail-vein injection in mice using a modified anaesthesia induction chamber versus a common restrainer without anaesthesia. Lab Anim. 53 (2), 190-201 (2019).
- Glascock, J. J., et al. Delivery of therapeutic agents through intracerebroventricular (icv) and intravenous (iv) injection in mice. J Vis Exp. (56), 2968 (2011).
- Grames, M. S., Jackson, K. L., Dayton, R. D., Stanford, J. A., Klein, R. L. Methods and tips for intravenous administration of adeno-associated virus to rats and evaluation of central nervous system transduction. J Vis Exp. (126), 55994 (2017).
- Yano, J., Lilly, E. A., Noverr, M. C., Fidel, P. L. A contemporary warming/restraining device for efficient tail vein injections in a murine fungal sepsis model. J Vis Exp. (165), 61961 (2020).
- Warren, J. S. A., Feustel, P. J., Lamar, J. M. Combined use of tail vein metastasis assays and real-time in vivo imaging to quantify breast cancer metastatic colonization and burden in the lungs. J Vis Exp. (154), 60687 (2019).
- JoVE Science Education Database. . Lab Animal Research. Compound administration I. , (2023).
- UCSF Office of Research, Institutional Animal Care and Use Program. Lateral tail vein injection in mice and rats (preferred technique for vascular access in mice Available from: https://iacuc.ucsf.edu/sites/g/files/tkssra751/f/wysiwyg/STD%20PROCEDURE%20-%20Misc%20Rodent%20Procedures%20-%20Lateral%20Tail%20Vein%20Injection%20in%20Mice%20and%20Rats.pdf (2023)
- Jones, K. Tail vein injections in the mouse and rat sop. UBC Animal Care Guidelines SOP: ACC-2012-Tech03. , (2012).
- Liadaki, K., Luth, E. S., Kunkell, L. M. Co-detection of gfp and dystrophin in skeletal muscle tissue sections. Biotechniques. 42 (6), 699-700 (2007).
- Burr, A., et al. Allometric-like scaling of aav gene therapy for systemic protein delivery. Mol Ther Methods Clin Dev. 27, 368-379 (2022).
- Lang, J. F., Toulmin, S. A., Brida, K. L., Eisenlohr, L. C., Davidson, B. L. Standard screening methods underreport aav-mediated transduction and gene editing. Nat Commun. 10 (1), 3415 (2019).
- Rodriguez-Estevez, L., Asokan, P., Borras, T. Transduction optimization of aav vectors for human gene therapy of glaucoma and their reversed cell entry characteristics. Gene Ther. 27 (3-4), 127-142 (2020).
- Hatakeyama, S., Yamamoto, H., Ohyama, C. Tumor formation assays. Methods Enzymol. 479, 397-411 (2010).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır