Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Doğal Mikrobiyomlu Laboratuvar Fareleri için Bir Tesisin İşletilmesi ve Biyolojik Muhafaza Prosedürleri: İmmünofenotipleme Prosedürü
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Burada, örnek olarak immünofenotipleme için kan örneklemesini kullanarak "Yabani fareler" için bir tesisin mikrobiyal muhafaza önlemleri de dahil olmak üzere yapısını ve işletme prosedürlerini açıklıyoruz.
Özet
"Yabani fareler" gibi doğal bir mikrobiyom ile laboratuvar farelerinin kullanılması, insan süper organizmasına yakın benzerlikleri nedeniyle hem temel hem de uygulamalı bilim için umut verici bir araştırma aracı sunmaktadır. Bununla birlikte, bakteriler, virüsler ve parazitler dahil olmak üzere çeşitli mikrobiyomları barındıran bu farelerin yetiştirilmesi ve bakımı, araştırma kurumlarındaki hayvancılık tesisleri için önemli zorluklar doğurmaktadır. Bu zorlukların üstesinden gelmek için, Charité - Universitätsmedizin Berlin'de "Yabani fareleri" barındırmak için özel bir tesis konsepti geliştirildi. Bu yaklaşım, doğal mikrobiyomu etkin bir şekilde içermek ve böylece daha yüksek hijyen standartlarına sahip alanları korumak için belirli yapısal özelliklere ve operasyonel protokollere sahip bir tesis tasarlamayı içeriyordu.
İmmünofenotipleme için hem belirlenmiş patojen içermeyen (SPF) hem de "Wildling farelerinden" kan örneklemesi için bir metodoloji gösterilmekte ve tesiste uygulanan iş akışı ve biyolojik sınırlama önlemleri vurgulanmaktadır. Dikkate değer sonuçlar, doğal bir mikrobiyoma maruz kalan "yabani farelerin", sıkı hijyen koşulları altında yetiştirilen ve bakımı yapılan farelerde önemli ölçüde azalan farklı bağışıklık hücresi popülasyonları geliştirdiğini ortaya koymaktadır.
Bu çalışmanın önemi, araştırmacılara doğal bir mikrobiyoma ve insan yetişkinlerininkine benzer olgun bir bağışıklık sistemine sahip farelere erişim sağlama potansiyelinde yatmaktadır. Bu yaklaşım, klinik öncesi bulguların klinik uygulamaya çevrilebilirliğini artırabilir ve böylece biyomedikal araştırma alanını ilerletebilir.
Giriş
Farelerde deney yapmak, klinik öncesi ve toksikolojik araştırmalar gibi temel ve uygulamalı bilimlerde hala vazgeçilmezdir. Ancak biyolojik gürültüyü azaltmayı ve deney sonuçlarındaki değişkenliği en aza indirmeyi amaçlayan laboratuvar ortamlarında hijyenin standardizasyonu, doğal mikrobiyotanın büyük ölçüde dışlanmasına yol açmıştır. Bu nedenle, hijyenik olarak standartlaştırılmış, belirlenmiş patojen içermeyen (SPF) laboratuvar farelerinin doğduğu ve tutulduğu koşullar, insanların ve hayvanların normalde maruz kaldığı gerçek dünya koşullarından farklıdır. Laboratuvar koşulları ile insan hastalıklarının meydana geldiği doğal ortamlar arasındaki bu uyumsuzluk, "standardizasyon yanılgısına" yol açmaktadır: deneysel koşullardaki varyasyonun en aza indirilmesinin translasyonel sonuçları iyileştirdiğini varsaymak. Bununla birlikte, gerçekte, bulguların biyolojik alaka düzeyini sınırlar 1,2. Örneğin, araştırmalar, SPF farelerinde mikrobiyal ve çevresel çeşitliliğin olmamasının, immünolojik ve klinik öncesi çalışmaların geçerliliğini baltalayarak az gelişmiş bir bağışıklık sistemine yol açabileceğini göstermiştir3.
Fare modellerindeki biyolojik çeşitliliği ele almak için, yabani ve evcil hayvan dükkanı fareleri 3,4,5,6,7,8 ile birlikte barınma, kommensallere sıralı maruz kalma9, hayvanları dış mekan muhafazalarında 10 veya büyük hayvanlardanyatak takımlarında11 ve vahşi farelerden dışkı nakli12 dahil olmak üzere, her biri kendi avantajları ve sınırlamaları olan çeşitli yaklaşımlar önerilmiştir. Klinik öncesi ve toksikolojik araştırmalar için umut verici yeni bir fare modeli, doğal bir mikrobiyom barındıran standart laboratuvar faresi suşlarından oluşan "Wildling fareleri" modelidir13. Bu "Yabani fareler", laboratuvar faresi türlerinden elde edilen embriyoların doğada yakalanan farelere nakledilmesiyle üretilir. Doğum sırasında, laboratuvar faresi suşları, insan doğumu sırasında meydana gelen doğal aşılamayı taklit ederek taşıyıcı annelerinin doğal mikrobiyomunu edinir13. "Yabani fareler", doğal mikrobiyomları nesiller boyunca korunarak diğer laboratuvar faresi türleri gibi yetiştirilebilir.
"Yabani fareler", tipik olarak SPF fare tesislerinden dışlanan bakteriler, virüsler ve parazitler dahil olmak üzere çeşitli bir mikrobiyotaya ev sahipliği yapar. Sonuç olarak, araştırma tesislerinde doğal bir mikrobiyomun korunması, bu mikropların genel SPF hijyen standartlarından ödün vermeden kontrol altına alınması gerektiğinden, zorluklar ortaya çıkarmaktadır.
Charité - Universitätsmedizin Berlin'de, "Yabani fareler" için özel bir tesis kuruldu ve SPF alanlarından sıkı biyolojik sınırlama önlemleriyle ayrıldı. Tesis, SPF alanları korunurken "Yabani farelerin" doğal mikrobiyomunun korunmasını sağlayan üreme ve deney odalarını içermektedir (Şekil 1).
Charité'nin kolonisinin kurucu çiftleri, Almanya'daki Friedrich-Alexander-Universität Erlangen-Nürnberg (FAU), Erlangen Üniversite Hastanesi, Mikrobiyom Araştırma Bölümü'nde kurulan "Yabani fareler" kolonisinden ithal edildi. Onlara bir sağlık sertifikası verilir ve koloni kurucularının ithalatından önce zoonotik patojenler için genişletilmiş bir panel ile izlenirler. Sentineller, zaman içinde mikrobiyomu izlemek için kullanılacaktır. Hem SPF hem de "Yabani fareler" aynı koşullar altında barındırılır. Fareler, tercihen beş fareden oluşan gruplar halinde tip II uzunluğunda, ayrı ayrı havalandırılan kafeslerde (IVC) yetiştirilir ve tutulur. Tesis içi sıcaklık 22 °C, aydınlık/karanlık döngüsü ise 12 saattir. Fareler standart tahıl bazlı yemek ve musluk suyu alır. "Yabani fareler" için yatak takımlarının ve zenginleştirme öğelerinin sterilizasyonu gereksizdir. Bununla birlikte, bu öğelerin otoklavlanması, SPF farelerinin bulunduğu alanlarda malzemelerin karışmasını önler.
Bu protokolde, hem SPF hem de "Wildling fareleri" için immünofenotipleme prosedürleri gösterilmekte ve "Wildling faresi" tesisindeki katı mikrobiyal muhafaza protokolleri vurgulanmaktadır. Bu önlemler, doğal bir mikrobiyom taşıyan farelerle çalışmanın faydalarını sağlarken SPF ortamlarının bütünlüğünü sağlar.
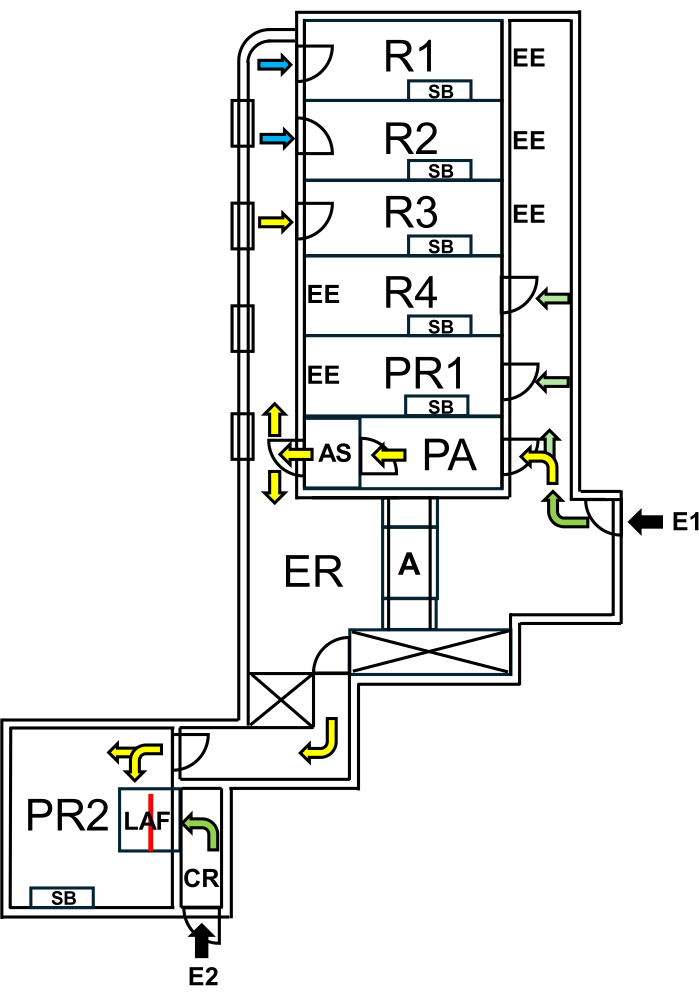
Şekil 1: Yabani fareler için tesisin yerleşimi. E1 = tesise erişim. Oklar tesise giriş rotasını gösterir. E2 = tesis dışından laminer hava akımı kabinine erişim. PA = hava duşlu personel hava kilidi. AS = hava duşu. R1, R2 = Yabani farelerin yetiştirilmesi için odalar. R3 = Yabani fareleri tutmak için oda. R4 = SPF farelerini tutmak için yer. PR1 = SPF fareleri için prosedür odası. PR2 = Yabani fareler için prosedür odası. SB = steril çalışma tezgahı. EE = acil çıkışlar. CR = LAF kabininin önündeki soyunma odası. LAF = koruyucu hava akımı altındaki müdahaleler için laminer hava akışı kabini. A = otoklav. ER = ekipman odası. Yeşil oklar, SPF hayvanlarıyla çalışırken erişilebilen rotaları temsil eder ve sarı oklar, hava duşundan sonra Wildling fareleriyle çalışmak için mevcut yolları gösterir. Mavi oklar sadece hayvancılık personelinin erişimini gösterir. Kırmızı çizgi, alanı E1'den PR2 üzerinden veya E2'den CR üzerinden erişilebilen iki bölüme ayıran LAF kabininin içindeki cam duvarı işaretler. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Protokol
"Yabani fareler" tesisi ve canlı hayvanları içeren prosedürler, hayvan deneylerinden sorumlu devlet dairesi "Landesamt für Gesundheit und Soziales Berlin" (LAGeSo) tarafından onaylandı. Protokolün en önemli adımları Şekil 2'de özetlenmiştir.
1. Wilding tesisine erişim sağlama
- Sorumlu hayvan refahı görevlisinden tesisin işletme ve biyolojik muhafaza prosedürleri hakkında kişisel bir giriş yapın.
- "Yabani fareler" tesisine girmek için transponder anahtarını alın ve çevrimiçi rezervasyon sistemi üzerinden prosedür odalarını ayırtın.
2. "Yabani fareler" için tesise giriş
- Giysileri soyunma odasına bırakın.
- Alan kıyafetlerine geçin: pantolon, kasak ve tek kullanımlık ayakkabı kılıfları (Şekil 3).
3. SPF alanındaki SPF farelerinden kan örneklemesi
- SPF farelerini (erkek ve dişi, 8-20 hafta) tutuldukları odadan (R4) kapalı bir IVC kafesinde SPF hayvanları için prosedür odasına (PR1) aktarın.
- Laminer akış tezgahını açın ve çalışma alanı yüzeyini %70 Vol. etanol ile dezenfekte edin. Tezgahın içinde çalışın.
- Kırılma veya zarar görme riskinin artmasını önlemek için kılcal borularda kırık veya yontulmuş bölümler olup olmadığını kontrol edin.
- İzofluran ile kısa bir genel anestezi altında (oksijenle zenginleştirilmiş tıbbi havada% 5 izofluranda indüksiyon, ardından bakım için% 1.5 -% 2.0), pedal çekme refleksinin kaybından sonra (ayak parmağı sıkışması ile belirtildiği gibi), boynun tırnağını kavrayarak farelerin boyun damarlarını sıkıştırın.
- Bir elinizi kullanarak, başparmağınızı ve işaret parmağınızı kullanarak hayvanın kafasını sabitleyin. Gözün medial kantusuna 45°'lik bir açıyla güzel zarın altına yeni bir kılcal damar yerleştirin. Kılcal damarın göz küresi ile gözün kemikli yörüngesi arasında yer aldığından emin olun.
NOT: Travmayı önlemek için kılcal borunun ucunun göz yüzeyine temas etmesine izin vermeyin. - Kılcal damarı hafif bir eksenel dönme hareketiyle sinüs zarından geçirin. Kan akana kadar yörüngenin arkasındaki tüpü döndürmeye devam edin. Etilendiamintetraasetik asit (EDTA) (yaklaşık 1 damla) içeren bir kan alma tüpünde en az 15 μL kan toplayın.
- Kılcal damarı çıkarmadan önce, dokuya kanamayı minimumda tutmak için boynun tırnağındaki tutuşu gevşetin. İyi bir hemostaz sağlamak için, kanamayı durdurmak için temiz bir gazlı bez veya bez kullanın.
- Kan ve EDTA'yı karıştırmak için tüpü hafifçe döndürün. Tüpü sallamayın. Kan örneğini buz üzerinde saklayın.
- Çalışma yüzeyini dezenfekte edin ve laminer akış tezgahını kapatın. SPF farelerini kapalı bir IVC'de SPF muhafaza odasına (R4) geri koyun.
4. "Yabani fareler" için alana giriş
- Hava duşunun (PA) antresindeki ayakkabıları ve çorapları çıkarın. Alan çorapları ve Tyvek tulumu, saç filesi, gerekirse pamuklu eldivenler, nitril eldivenler ve yüz maskelerinden oluşan tam vücut kişisel koruyucu ekipman (KKD) giyin (Şekil 3).
- Yapışkanlı zemin kaplaması ile çoraplarla hava duşuna girin. Hava duşu yaparken kolları kaldırın ve 360° dönüş yapın.
- Hava duşundan çıkın ve diğer taraftaki alan ayakkabılarını giyin.
5. "Yabani farelerden" kan örneklemesi
- "Yabani fareleri" (erkek ve dişi, 8 - 20 hafta) kapalı bir IVC kafesinde tutuldukları odadan (R3) prosedür odasına (PR2) aktarın.
- Laminer akış tezgahını açın ve çalışma alanı yüzeyini dezenfekte edin.
- Bölüm 3, adım 2-8'de SPF farelerinden numune almak için açıklanan prosedürleri izleyin.
- Kan örneklemesini tamamladıktan sonra eldivenleri değiştirin. Tüm malzemeleri ve yüzeyleri dezenfekte edin. Laminer akış tezgahını kapatın.
6. "Yabani fareler" bölgesinden kan örneklerinin laminer hava akımı (LAF) kabini aracılığıyla dışa aktarılması
NOT: Prosedür odası (PR2), malzeme kilidi ve steril müdahale odası olarak hizmet veren bir LAF kabini içerir. Numuneler LAF kabini aracılığıyla dışarı aktarılır. İç mekana hem içeriden (E1 ve PR2 üzerinden) hem de dışarıdan (E2 ve CR üzerinden) Wildling alanına erişilebilir ve ortadan sürgülü kapılı bir cam duvar ile bölünmüştür (Şekil 1). Malzemeleri dışa aktarmak için iki kişi gereklidir: Kişi 1 (Wildling alanının içinde [PR2 aracılığıyla]) 6.1 ve 6.2 adımlarını gerçekleştirecektir. Kişi 2 (Wildling alanının dışında [E2 üzerinden] ) 6.3-6.5 adımlarını gerçekleştirecektir.
- Numune kaplarını dezenfekte edin. Numune kaplarını LAF kabininin cam duvarındaki sürgülü kapıdan çıkarın.
- Numune kaplarının 2 numaralı kişiye transferi tamamlandıktan sonra, LAF kabininin diğer tarafındaki 2 numaralı kişiden (kabinin önlük kilidinde koruyucu giysi giyen) koruyucu giysi alın ve atın. Tüm yüzeyleri dezenfekte edin.
- LAF kabininin önündeki erişim LAF'ında koruyucu giysi giyin (CR, Şekil 1).
- Wildling bölgesinden dezenfekte edilmiş numune kaplarını LAF kabininin cam duvarındaki sürgülü kapıdan temas etmeden alın.
- Koruyucu giysileri çıkarın ve bertaraf etmek için sürgülü kapıdan LAF kabininin iç alanına geçirin.
7. "Yabani fareler" için tesisten çıkış
- Tek kullanımlık tulumları ve alan ayakkabılarını alanın içinde bırakın. Saç filesini, lastik eldivenleri ve yüz maskesini atın.
NOT: Ayakkabılar ve tulumlar tekrar kullanılabilir. - Alan çoraplarıyla hemen hava duşuna girin. Hava duşu yaparken kollarınızı kaldırın ve 360° dönüş yapın.
- Hava duşundan çıkın ve alan çoraplarını çamaşır toplayıcıya yerleştirin. Çorapları, ayakkabıları ve tek kullanımlık galoşları giyin. Çamaşırhane toplayıcısındaki soyunma odasında alan kıyafetlerini yatırın. Soyunma odasındaki kıyafetleri değiştirin
8. Kan örneklerinin işlenmesi ve analiz edilmesi
- Kan örneklerini laboratuvara getirin.
- Florofor konjuge antikor boyama kokteyli hazırlayın: Her örnek için 0.25 μL Alexa Fluor 700 anti-fare CD45, 0.25 μL Brilliant Violet 605 anti-fare TCR-β zinciri, 0.25 μL APC anti-fare CD4, 0.25 μL Brilliant Violet 785 anti-fare CD8, 0.25 μL FITC anti-fare CD44 ve 0.25 μL PerCP / Cyanine5.5 anti-fare CD62L antikoru 50 μL akış sitometrisi tamponuna ekleyin (fosfat tamponlu tuzlu su, 2 mM EDTA,% 0.1 sığır serum albümini, 4 ° C). Adım 8.8'e kadar buz üzerinde karanlıkta kalın.
NOT: Kullanılan floroforlar, numune alımı için kullanılacak akış sitometresinin konfigürasyonuna uyarlanabilir.
- Florofor konjuge antikor boyama kokteyli hazırlayın: Her örnek için 0.25 μL Alexa Fluor 700 anti-fare CD45, 0.25 μL Brilliant Violet 605 anti-fare TCR-β zinciri, 0.25 μL APC anti-fare CD4, 0.25 μL Brilliant Violet 785 anti-fare CD8, 0.25 μL FITC anti-fare CD44 ve 0.25 μL PerCP / Cyanine5.5 anti-fare CD62L antikoru 50 μL akış sitometrisi tamponuna ekleyin (fosfat tamponlu tuzlu su, 2 mM EDTA,% 0.1 sığır serum albümini, 4 ° C). Adım 8.8'e kadar buz üzerinde karanlıkta kalın.
- Kan alma tüplerini dezenfekte edin. 5 mL yuvarlak tabanlı polistiren tüpe 2 mL buz gibi soğuk akış sitometri tamponu ekleyin. Tüpü buzun üzerine yerleştirin.
- Kan alma tüpünü açın. Akış sitometrisi, tampon ve nabız girdabı içeren tüpe 10 μL kan ekleyin.
- 4 ° C'de 5 dakika boyunca 400 x g'da döndürün.
- Süpernatanı aspire edin. 1 mL kırmızı kan hücresi (RBC) lizis tamponu, nabız girdabı ekleyin ve oda sıcaklığında (RT) 3 dakika inkübe edin.
- 100 μL 10x PBS ekleyin. 4 ° C'de 5 dakika boyunca 400 x g'da döndürün.
- 8.5-8.6 adımlarını tekrarlayın.
- Süpernatanı aspire edin. 50 μL antikor boyama kokteyli, girdap ekleyin ve karanlıkta buz üzerinde 20 dakika inkübe edin.
- 1 mL akış sitometrisi tamponu ekleyin. 4 ° C'de 5 dakika boyunca 400 x g'da döndürün.
- Süpernatanı aspire edin. 180 μL akış sitometrisi tamponu ekleyin.
- Canlı/ölü ayrımı için 20 μL SYTOX Blue Dead Cell Stain (son konsantrasyon 1:1000) ekleyin.
- Bir akış sitometresinde örnekler alın ve akış sitometresi toplama yazılımını veya akış sitometrisi veri analiz programını kullanarak verileri analiz edin.
Sonuçlar
"Yabani fareler" potansiyel olarak SPF tesislerinden dışlanan mikroorganizmaları barındırır ve bu da sıkı hijyen standartlarını destekleyen araştırma kurumlarındaki hayvancılık uygulamaları için bir zorluk teşkil eder. Geçtiğimiz 4 yıl boyunca, Charité - Universitätsmedizin Berlin ve Alman Laboratuvar Hayvanlarını Koruma Merkezi'ndeki (Bf3R) bilim adamları ve veterinerler, işbirlikçi bir çaba yoluyla sıkı biyolojik sınırlama önlemlerini içeren, doğal b...
Tartışmalar
Doğal bir mikrobiyomlu fareler, insan süper organizmasına daha yakın benzerlikleri nedeniyle temel ve uygulamalı bilim için umut verici bir araştırma aracıdır 3,9,10,11,12. Biyolojik karmaşıklığı fare modellerine dahil etme girişimleri, her biri kendi avantajları ve sınırlamaları olan çeşitli yaklaşımla...
Açıklamalar
Yazarların açıklanacak herhangi bir çıkar çatışması yoktur.
Teşekkürler
Bu çalışma Charité 3R| Değiştir - Azalt - İyileştir. S.P.R., Deutsche Forschungsgemeinschaft (DFG, Alman Araştırma Vakfı) Emmy Noether-Programm RO 6247/1-1 (proje ID 446316360), DFG SFB1160 IMPATH (proje ID 256073931) ve TRR 359 PILOT (proje ID 491676693) tarafından desteklenmiştir. S.J., Deutsche Forschungsgemeinschaft (DFG, Alman Araştırma Vakfı) JO 1216/2-1 ve Alman Multipl Skleroz Derneği (DMSG e.V.) tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Alexa Fluor 700 anti-mouse CD45 antibody | BioLegend | 103127 | Clone 30F-11 |
| Animal Chow | Altromin | 1324 | |
| APC anti-mouse CD4 antibody | BioLegend | 100515 | Clone RM4-5 |
| Blood collection tube | Greiner | 450475 | MiniCollect K3E, K3EDTA |
| Bovine Serum Albumin | Sigma-Aldrich | A9647-100G | |
| Brilliant Violet 605 anti-mouse TCR-beta chain antibody | BioLegend | 109241 | Clone H57-597 |
| Brilliant Violet 785 anti-mouse CD8 antibody | BioLegend | 100749 | Clone 53-6.7 |
| Capillary | Hirschmann | 9000210 | Hirschmann minicaps, Na-hep |
| EDTA | Corning | 46-034-CI | |
| FITC anti-mouse CD44 antibody | BioLegend | 103021 | Clone IM7 |
| PerCP/Cyanine5.5 anti-mouse CD62L antibody | BioLegend | 104431 | Clone MEL-14 |
| Phosphate-buffered Saline (10x) | Gibco | 12579099 | |
| Phosphate-buffered Saline (1x) | Gibco | 14190094 | |
| RBC lysing buffer | BioLegend | 420302 | |
| Round Bottom Polystyrene Tube | Sarstedt | 55.476.005 | |
| SYTOX Blue Dead Cell Stain | Invitrogen | S34852 | |
| Tyvek overall (DuPont) | Fisher Scientific | 11371633 |
Referanslar
- Voelkl, B., Wurbel, H., Krzywinski, M., Altman, N. The standardization fallacy. Nat Methods. 18 (1), 5-7 (2021).
- Voelkl, B., et al. Reproducibility of animal research in light of biological variation. Nat Rev Neurosci. 21 (7), 384-393 (2020).
- Beura, L. K., et al. Normalizing the environment recapitulates adult human immune traits in laboratory mice. Nature. 532 (7600), 512-516 (2016).
- Caruso, R., Ono, M., Bunker, M. E., Nunez, G., Inohara, N. Dynamic and asymmetric changes of the microbial communities after cohousing in laboratory mice. Cell Rep. 27 (11), 3401-3412.e3 (2019).
- Labuda, J. C., Fong, K. D., Mcsorley, S. J. Cohousing with dirty mice increases the frequency of memory T cells and has variable effects on intracellular bacterial infection. Immunohorizons. 6 (2), 184-190 (2022).
- Martin, M. D., et al. Cd115(+) monocytes protect microbially experienced mice against e. Coli-induced sepsis. Cell Rep. 42 (11), 113345 (2023).
- Burger, S., et al. Natural microbial exposure from the earliest natural time point enhances immune development by expanding immune cell progenitors and mature immune cells. J Immunol. 210 (11), 1740-1751 (2023).
- Tabilas, C., et al. Early microbial exposure shapes adult immunity by altering cd8+ t cell development. Proc Natl Acad Sci U S A. 119 (49), e2212548119 (2022).
- Reese, T. A., et al. Sequential infection with common pathogens promotes human-like immune gene expression and altered vaccine response. Cell Host Microbe. 19 (5), 713-719 (2016).
- Leung, J. M., et al. Rapid environmental effects on gut nematode susceptibility in rewilded mice. PLoS Biol. 16 (3), e2004108 (2018).
- Sbierski-Kind, J., et al. Distinct housing conditions reveal a major impact of adaptive immunity on the course of obesity-induced type 2 diabetes. Front Immunol. 9, 1069 (2018).
- Rosshart, S. P., et al. Wild mouse gut microbiota promotes host fitness and improves disease resistance. Cell. 171 (5), 1015-1028.e13 (2017).
- Rosshart, S. P., et al. Laboratory mice born to wild mice have natural microbiota and model human immune responses. Science. 365 (6452), eaaw4361 (2019).
- Dirnagl, U., Kurreck, C., Castanos-Velez, E., Bernard, R. Quality management for academic laboratories: Burden or boon? Professional quality management could be very beneficial for academic research but needs to overcome specific caveats. EMBO Rep. 19 (11), e47143 (2018).
- . Premier Available from: https://premier-qms.org/ (2024)
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır