Sıçanlarda Orta Hat Laparotomi ile Kontrollü Geri Dönüşümlü Viseral Arteriyel İskemi, Venöz Konjeksiyon ve Kombine Malperfüzyon
Bu Makalede
Özet
Bu makale, sıçan modellerinde viseral organların kontrollü, geri dönüşümlü malperfüzyonu için standart bir prosedür sunmaktadır. Amaç, teknik basitliği ve hata direncini korurken, bu malperfüzyon durumlarını yüksek derecede metodolojik kesinlik ve kontrol ile indüklemektir.
Özet
Sepsis ve malignitenin yanı sıra, malperfüzyon doku bozulmasının üçüncü önde gelen nedenidir ve çeşitli tıbbi ve cerrahi durumlar için önemli bir patomekanizmadır. Bypass cerrahisi, endovasküler prosedürler, ekstrakorporeal membran oksijenasyonu ve yapay kan ikameleri gibi önemli gelişmelere rağmen, özellikle viseral organların doku malperfüzyonu hasta bakımında acil bir sorun olmaya devam etmektedir. Biyomedikal süreçler ve olası müdahaleler hakkında daha fazla araştırma yapılması talebi yüksektir. Bu tür araştırmaları mümkün kılmak için geçerli biyolojik modeller son derece önemlidir. Doku perfüzyon araştırmasının sadece hücre biyolojisini değil, aynı zamanda vasküler mikroanatomi ve reolojiyi de içeren çok faktörlü yönleri nedeniyle, uygun bir model, yalnızca bir hayvan modelinin sağlayabileceği bir biyolojik karmaşıklık derecesi gerektirir ve bu da kemirgenleri tercih edilen bariz model haline getirir. Doku malperfüzyonu üç farklı duruma ayrılabilir: (1) izole arteriyel iskemi, (2) izole venöz tıkanıklık ve (3) kombine malperfüzyon. Bu makale, sıçanlarda orta hat laparotomi ve abdominal aort ve kaval venin klemplenmesi yoluyla bu üç tip viseral malperfüzyonun kontrollü ve geri dönüşümlü indüksiyonu için ayrıntılı bir adım adım protokol sunmakta ve tek tip ve güvenilir sonuçları garanti etmek için hassas cerrahi metodolojinin önemini vurgulamaktadır. Bu modelin olası uygulamalarının başlıca örnekleri arasında, gastrointestinal, jinekolojik ve ürolojik organların malperfüzyonunu objektif olarak görselleştirmek ve ayırt etmek için Hiperspektral Görüntüleme (HSI) gibi yenilikçi intraoperatif görüntüleme modalitelerinin geliştirilmesi ve doğrulanması yer alır.
Giriş
Doku perfüzyon yoksunluğunun lokal veya sistemik doku malperfüzyon koşulları şeklindeki etkileri uzun zamandır bilinmekle birlikte, hem Amerika Birleşik Devletleri'nde hem de Avrupa'da morbidite ve mortalitenin birincil nedenlerinden biri olarak devam etmektedir1. Bu malperfüzyon koşulları, malignite ve septik inflamasyondan sonra doku bozulmasının üçüncü önde gelen nedenidir, ancak son ikisine kıyasla çok daha geniş bir köken spektrumuna sahiptir2.
Bu spektrum, tromboembolik oklüzyon ile atriyal fibrilasyon, vazokonstriksiyon ve iyatrojenik veya travmatik diseksiyon gibi lokal mekanizmalardan, kardiyak yetmezlik veya şok, sepsis, hipovolemi ve çalma fenomenleri gibi sistemik mekanizmalara kadar uzanır. Bu çeşitli mekanizmalar, çeşitli tıbbi ve cerrahi durumların temelini oluşturur. Bu koşullarla ilişkili önemli morbidite ve mortalite, on yıllar boyunca nekrozu önlemek ve organ fonksiyonunu eski haline getirmek için malperfüze dokulara kan akışını eski haline getirme prosedürlerine tıbbi dikkati yönlendirmiştir3.
Bu araştırma çabası, baypas cerrahisi4, endovasküler prosedürler5, ekstrakorporeal membran oksijenasyonu 6,7, transplantasyon sırasında organ makinesi perfüzyonu8 ve yapay kan ikameleri9'daki gelişmeler dahil olmak üzere fizyolojik organ perfüzyonunu eski haline getirmek için çeşitli farmasötik, tıbbi ve cerrahi çözümlerle sonuçlanmıştır.
Ancak, bu önemli gelişmelere rağmen, özellikle iç organların malperfüzyonu, hasta bakımında acil bir sorun olmaya devam etmektedir ve biyomedikal süreçler ve kurtarma stratejileri hakkında daha fazla araştırmaya olan talep yüksektir. Bu tür araştırmaları mümkün kılmak için geçerli biyolojik modeller son derece önemlidir. Doku perfüzyon araştırmasının sadece hücre biyolojisini değil, aynı zamanda vasküler mikroanatomi ve reolojiyi de içeren çok faktörlü yönleri nedeniyle, uygun bir model, yalnızca tam bir model organizmanın sağlayabileceği bir biyolojik karmaşıklık derecesi gerektirir ve bu da kemirgenleri bariz bir tercih modeli haline getirir.
Doku malperfüzyonu üç farklı duruma ayrılabilir: izole arteriyel iskemi, izole venöz tıkanıklık ve kombine malperfüzyon10. Bu durumlar için klinik olarak ilgili senaryolar şunları içerir: (1) Arteriyel iskemi: Tromboembolik oklüzyonlu atriyal fibrilasyon, septik emboli, vazokonstriksiyon, iyatrojenik veya travmatik vasküler diseksiyon veya klempleme, kalp yetmezliği veya şok, aort diseksiyonu, sepsis ve hipovolemi, dış daralmaya bağlı aşırı arteriyel tıkanıklık, pulmoner arter embolisi, kronik arteriyel vasküler tıkayıcı hastalıklar veya çalma olayları; (2) Venöz tıkanıklık: İyatrojenik veya travmatik vasküler diseksiyon veya klempleme, kalp yetmezliği, karaciğer fibrozu veya siroz, dış daralmaya bağlı venöz tıkanıklık, venöz tromboz, venöz yetmezlik ve Budd-Chiari sendromu; (3) Kombine malperfüzyon: İskemiye bağlı fibroza bağlı sekonder venöz tıkanıklık veya tıkanıklığa bağlı retansiyona bağlı sekonder arteriyel iskemi gibi yukarıdaki koşulların ve yukarıda belirtilen durumların ileri aşamalarının kombinasyonları ve ayrıca iskemik inflamasyon gibi spesifik organ durumları (ör., iskemik kolit)11,12.
Bu nedenle bu makale, Şekil 1'de gösterildiği gibi, hem sağkalım hem de sağkalım dışı uygulamalar için sıçanlarda orta hat laparotomi yoluyla kontrollü, geri dönüşümlü viseral arteriyel iskemi, venöz tıkanıklık ve kombine malperfüzyonu indüklemek için adım adım bir model sağlamayı amaçlamaktadır. Deneysel model, arteriyel iskeminin, venöz tıkanıklığın ve bunların kombine sekellerinin çok yönlü dinamiklerini incelemek için kontrollü bir ortam sunar ve çeşitli koşullarda karşılaşılan klinik olarak ilgili senaryoları taklit eder.
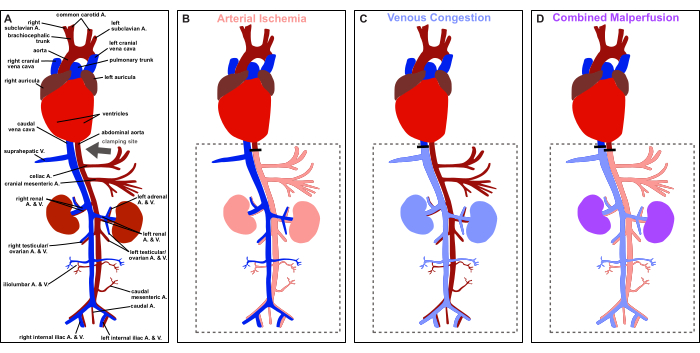
Şekil 1: Protokole genel bakış. Vasküler sıçan anatomisinin şematik tasviri ve klempleme bölgesinin tasviri (gri ok). (A) Fizyolojik perfüzyon. (B) Arteriyel iskemi. (C) venöz tıkanıklık. (D) Kombine malperfüzyon. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Protokol
Burada açıklanan tüm hayvan faaliyetleri, akredite tesislerde gerçekleştirilmiş ve Almanya'nın Karlsruhe kentindeki Baden-Württemberg Bölge Konseyi'nin Kurumsal Hayvan Bakımı ve Kullanımı Komitesi (IACUC) tarafından onaylanmıştır (35-9185.81/G-62/23). Deney hayvanları, kurumsal standartlara, hayvan kullanımı ve bakımına ilişkin Alman yasalarına, Avrupa Topluluk Konseyi direktiflerine (2010/63/EU) ve ARRIVE yönergelerine göre yönetilmiştir. Sipariş ağırlığı 400 gram olan erkek Sprague Dawley cinsi sıçanlar bir hafta süreyle iklimlendirildikten sonra kullanıldı. Bu çalışmada kullanılan reaktiflerin ve ekipmanların detayları Malzeme Tablosunda listelenmiştir.
1. Anestezi ve analjezi
- Fareyi kurumsal protokollere uygun olarak ilaçla uyuşturun. Sedasyon indüksiyonu için izofluran önerilir, ardından 100 mg / kg vücut ağırlığı ketamin ve 4 mg / kg vücut ağırlığı ksilazin enjeksiyonu yapılır. Ek analjezi, 5 mg / kg vücut ağırlığı carprofen sc enjeksiyonu ile elde edilebilir. Ayrıntılar için lütfen Studier-Fischer ve ark.13'e bakınız.
- Kuruluğu önlemek için gözlere oftalmik merhem sürün.
- Cerrahi forseps ile ayak parmağı sıkıştırma testini kullanarak uygun analjetik derinliği garanti edin.
- Ameliyat sırasında anestezi derinliğini düzenli olarak yeniden değerlendirin ve ayarlayın.
2. Prosedür hazırlığı
- Fırçalama masasını, serbest bırakılabilir mikrovasküler klempler ve aplikatör (Şekil 2A-C), künt üst kol klemp, ince hazırlık makası ve forseps dahil olmak üzere gerekli tüm malzeme ve aletlerle hazırlayın.
- Kanülleri uca 1 cm olacak şekilde 135° açıyla katlayarak cerrahi hazırlık kancalarını hazırlayın ve bunları cerrahi sivrisinek kelepçesi kullanarak gerginlik uygulamaya hazır Luer-lock ile plastik perfüzyon tüplerine bağlayın (Şekil 2D,E).
- Studier-Fischer ve ark.13'te belirtildiği gibi, Y şeklinde sabitleme çubukları ve bir ısıtma yastığı dahil olmak üzere bir kemirgen cerrahi maruz kalma aparatı hazırlayın.
- Yenidoğan yüz maskesi kullanılarak %100 oksijenin solunması yoluyla uygun oksijenasyonun sağlandığından emin olun (Şekil 2F).
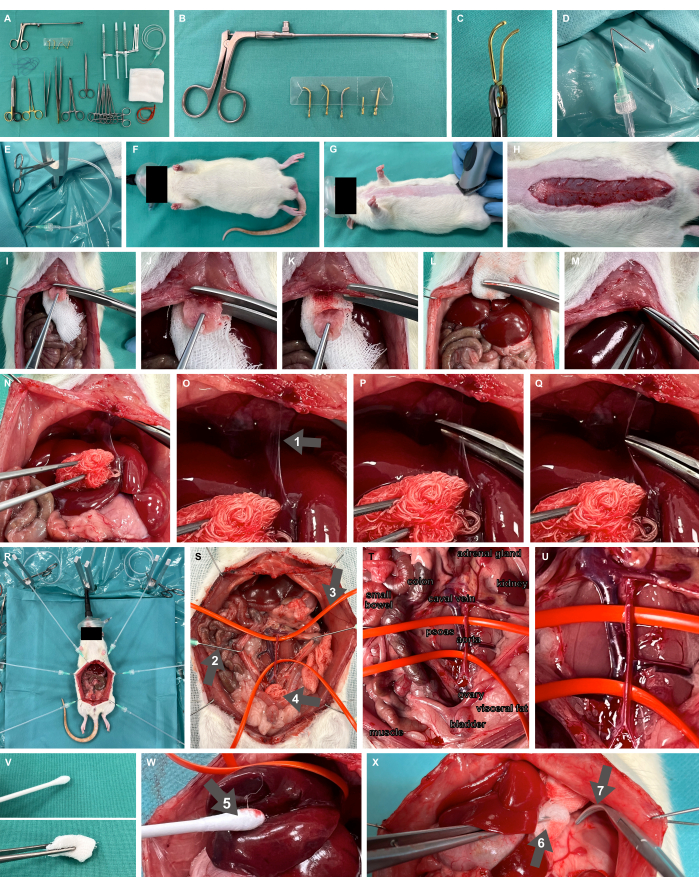
Şekil 2: Deney ve hayvan düzeneği. (A) Gerekli cerrahi aletler ve malzemeler. (B,C) Serbest bırakılabilir mikrovasküler klemp ve aplikatör. (D,E) Bir perfüzyon tüpüne bağlı katlanmış bir kanül, cerrahi hazırlık kancası olarak kullanılır. (F,G) Sıçan modeli bir yüz maskesi ile oksijenlendirildi ve traş edildi. (H) Tam karın uzunluğu boyunca kutanöz insizyon. (I-M) ksifoid rezeksiyonu ve hemostaz. (N-Q) Falsiform ligamanın hepatik mobilizasyonu ve diseksiyonu (ok 1). ( R ) Laparotomi sonrası organların açığa çıkması için hazırlık kancaları ve metal standların uygulanması. (S) Künt kancalar (ok 2), silikon damar halkaları (ok 3) ve cerrahi kompres (ok 4) kullanılarak abdominal ana damarların tam viseral maruziyeti. (T,U) Abdominal aort ve kaval ven. (V) Atravmatik hazırlık aletleri. (W) Nemlendirilmiş pamuk takası (ok 5). (X) Forsepslerde nemlendirilmiş kompres (ok 6) ve künt overholt kelepçeleri (ok 7). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
3. Cerrahi hazırlık
- Orta hat laparotomi için cerrahi erişim bölgesini tıraş edin (Şekil 2G). İstenilen karın uzunluğunda, yani yaklaşık 7 cm'lik bir kutanöz insizyon yapın (Şekil 2H), fasyayı diseke ederek laparotomi ile ilerleyin ve cerrahi hazırlık kancalarını takılı plastik tüpler ve cerrahi sivrisinek klempleri ile deriden dikin. Cerrahi hazırlık kancalarını kullanarak cerrahi durumu açığa çıkarın ve dokuya gerginlik uygulayın.
- Peritonun, sternumun başlangıcının sadece birkaç milimetre altına kadar kraniyal olarak diseke edildiğinden ve peritonun bir kısmını sağlam bıraktığından emin olun. Sternumun altına cerrahi kompresin bir parçasını yerleştirin (Şekil 2I) ve ksifoidi güçlü malzeme makasıyla rezeke edin. Bu iyi perfüze edilmiş bölgenin yeterli hemostazını elde etmek için cerrahi kompres kullanarak rezeksiyon alanına basınç uygulayın (Şekil 2I-M).
- Falsiform ligamenti ortaya çıkarmak için karaciğeri dorso-kaudal olarak mobilize edin (Şekil 2N) ve ligamenti inceleyin (Şekil 2O-Q).
- Hemostatik kontrol için, ana damarların klemplenmesinin nerede yapılması gerektiğine bağlı olarak, abdominal ana damarların (Şekil 2R) ve silikon damar halkaları ile asılan damarların (Şekil 2S-U) tam bir viseral pozlamasını gerçekleştirin. Nemlendirilmiş pamuk takasları (Şekil 2W), forsepslerde nemlendirilmiş kompres ve künt overholt kelepçeleri (Şekil 2X) gibi sadece atravmatik hazırlama aletleri kullanılmalıdır (Şekil 2V).
4. Arteriyel iskemi için abdominal aortun hazırlanması ve klemplenmesi
- Sol adrenal artere erişim sağlamak için atravmatik hazırlık aletleri kullanarak üst karın organlarının sol medializasyonunu gerçekleştirin (Şekil 3A-D).
- Tipik olarak sol adrenal arterin kraniyal uzantısına medial olan ve aortun seyrini gösteren nabız bölgesini tanımlayın (Şekil 3E). Abdominal aorta erişmek için künt diseksiyon için overholt klempler kullanarak yumuşak dokuda ilerleyin (Şekil 3F,G).
- Künt overholt klempler kullanarak abdominal aortu en kraniyal uçta tünelleyin (Şekil 3H-L) ve aortu bir silikon damar halkası kullanarak sarkıtın (Şekil 3M-T).
- Aortu ventral olarak hafifçe lüksleştirmek için silikon halkayı kullanarak uygun bir anevrizma mikrovasküler klemp uygulayın ve izole aort klemplemesini garanti etmek için anevrizma mikrovasküler klempini silikon halka boyunca yönlendirin (Şekil 3U). Araştırma sorusuna bağlı olarak, mikrovasküler klemp tekrar serbest bırakılabilir.
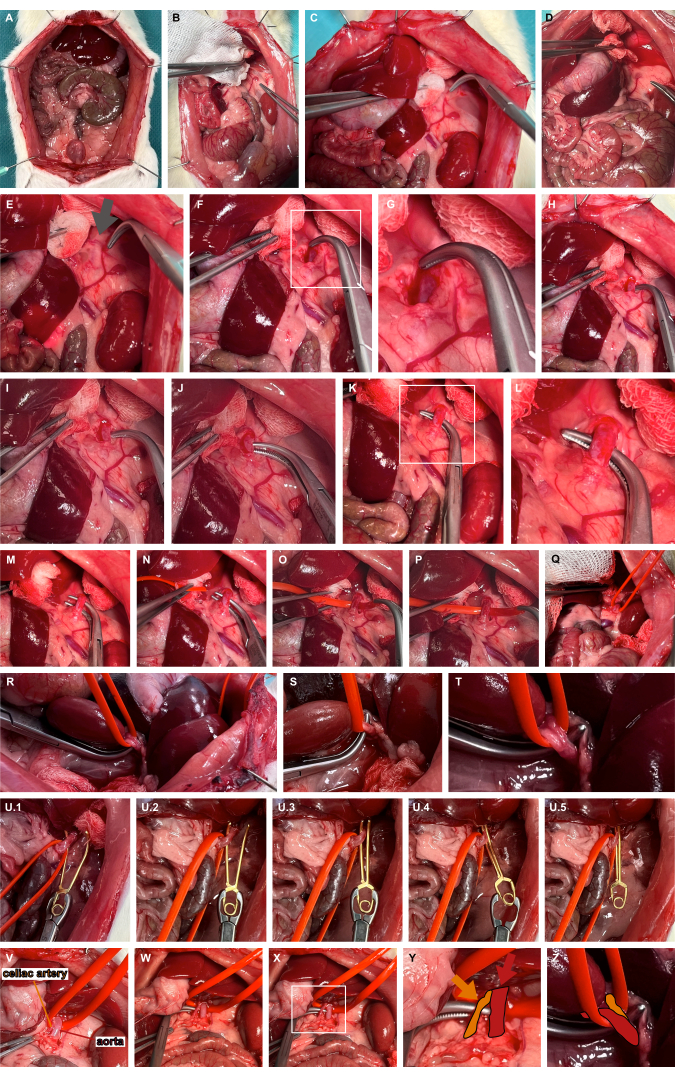
Şekil 3: Abdominal aortun hazırlanması ve klemplenmesi. (A) Viseral organların açığa çıkması. (B-E) Sol adrenal artere erişim sağlamak için atravmatik hazırlık aletleri kullanılarak üst karın organlarının sol medializasyonu. (F,G) Abdominal aorta erişmek için nabız atan bölgede (gri ok) sol adrenal arterin medialinin künt diseksiyonu. (H-L) Abdominal aortun künt overholt klempler kullanılarak tünellenmesi. (M-T) Silikon bir damar halkası kullanarak aortu asmak. (U) Silikon halkayı kılavuz olarak kullanarak serbest bırakılabilir bir anevrizma mikrovasküler klempinin uygulanması. (V-Z) Çölyak arterinin (turuncu) aort (kırmızı) ve silikon damar halkasına göre görselleştirilmesi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
5. Venöz tıkanıklık için suprahepatik abdominal kaval venin hazırlanması ve klemplenmesi
- Atravmatik hazırlık aletleri kullanarak karaciğeri sağa doğru mobilize edin, karaciğer bağlarını keskin bir şekilde inceleyin ve karaciğeri daha da lateralize edin (Şekil 4A-C).
- Künt overholt klempleri kullanarak diyaframın sol kıvrımındaki retrohepatik boşluğu açın (Şekil 4D-G).
- Künt overholt klempleri kullanarak kaval damarını tünelleyin (Şekil 4H-K) ve silikon damar halkaları kullanarak kaval damarını asın (Şekil 4L-O).
- Kaval veni ventral olarak hafifçe lüksleştirmek için silikon halkayı kullanarak uygun bir anevrizma mikrovasküler klemp uygulayın ve kaval venin izole klemplenmesini garanti etmek için anevrizma mikrovasküler klempini silikon halka boyunca yönlendirin (Şekil 4R).
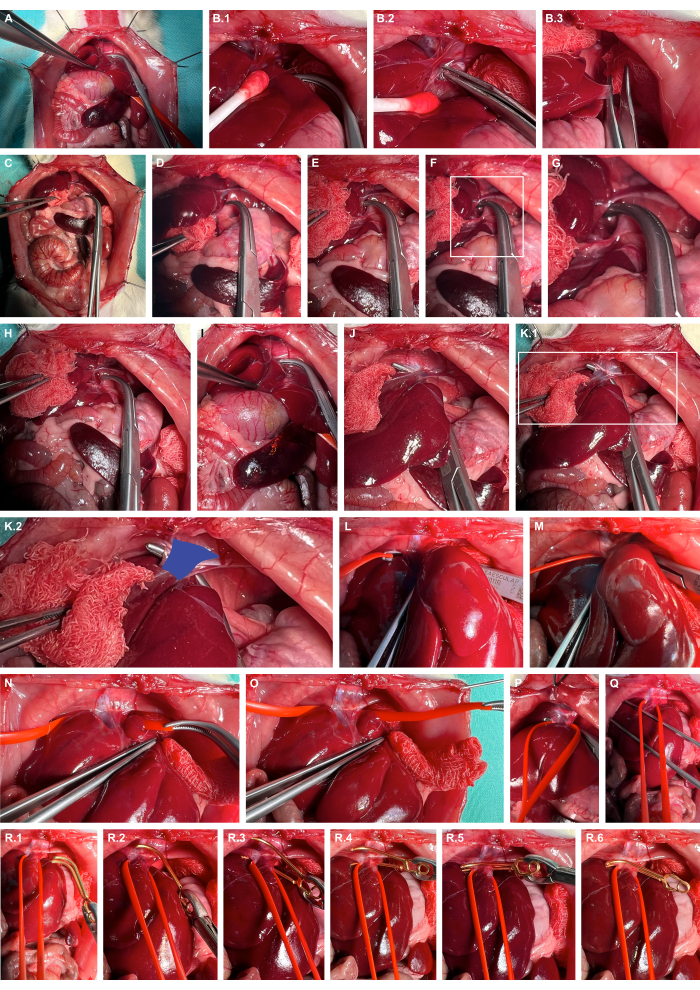
Şekil 4: Suprahepatik abdominal kaval venin hazırlanması ve klemplenmesi. (A) Kraniyal iç organların açığa çıkması. (B) Karaciğerin doku koruyucu mobilizasyonu ve atravmatik hazırlık aletleri kullanılarak karaciğer bağlarının keskin diseksiyonu. (C) Karaciğerin lateralizasyonu. (D-G) Retrohepatik boşluğun açılması ve diyaframın sol kıvrımında hazırlık. (H-K) Kaval damarının (mavi) künt overholt kelepçeleri kullanılarak tünellenmesi. (L-O) Silikon damar halkaları kullanarak kaval damarını asmak. (P,Q) Süvari kan akışını geçici olarak kısıtlamak için gerginlik uygulanması. ( R ) Silikon halkayı kılavuz olarak kullanarak serbest bırakılabilir bir anevrizma mikrovasküler klempinin uygulanması. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
6. Kombine malperfüzyon için abdominal aort ve suprahepatik abdominal kaval venin klemplenmesi
- Hem aort hem de kaval veni silikon damar halkaları ile asılana kadar yukarıdaki adımları uygulayın. Her iki damar için anevrizma mikrovasküler klempinin uygulanmasıyla ilerleyin, yine rehberlik için silikon halkayı kullanın. Önce aortun klemplenmesi ve sonraki kaval klemplemesine kadar gereken sürenin sadece birkaç saniyeye indirilmesi önerilir.
NOT: İstenen senaryoya ve araştırma amacına bağlı olarak, malperfüzyon belirli bir zaman aralığından sonra devam ettirilebilir veya serbest bırakılabilir ve hayvanlara sağkalım dışı uygulamalar için keskin kardiyoloji (kurumsal olarak onaylanmış protokoller izleyerek) ile ötenazi yapılabilir veya planlı takipler ve sağkalım deneyleri durumunda cerrahi dikişler kullanılarak kademeli karın kapatma işlemi yapılabilir. Bu çalışma için hayvanlara ötenazi uygulandı.
Temsili Sonuçlar
Bu protokol, hayatta kalmayan bir ortamda 10 erkek sıçanda (ortalama ağırlık 403 g ± 26 g) gerçekleştirildi. Başarı oranı, arteriyel klempleme, venöz klempleme ve kombine klemplemeden sonra 5 dakika boyunca 10 dakika reperfüzyon ile 20 dakikadan fazla sağkalım ile tanımlandı ve her biri %100 idi. Cilt insizyonundan her iki damar silikon halkalarla asılana kadar preparatın ortalama süresi 11 dk 45 sn ± 3 dk 23 sn idi.
4 farklı malperfüzyon durumunun doğrulanması için, oksijenasyon (StO2) ve perfüzyon (NIR) için indeks parametreleri 5 viseral organda hiperspektral görüntüleme (HSI) kullanılarak ölçüldü (Şekil 5).
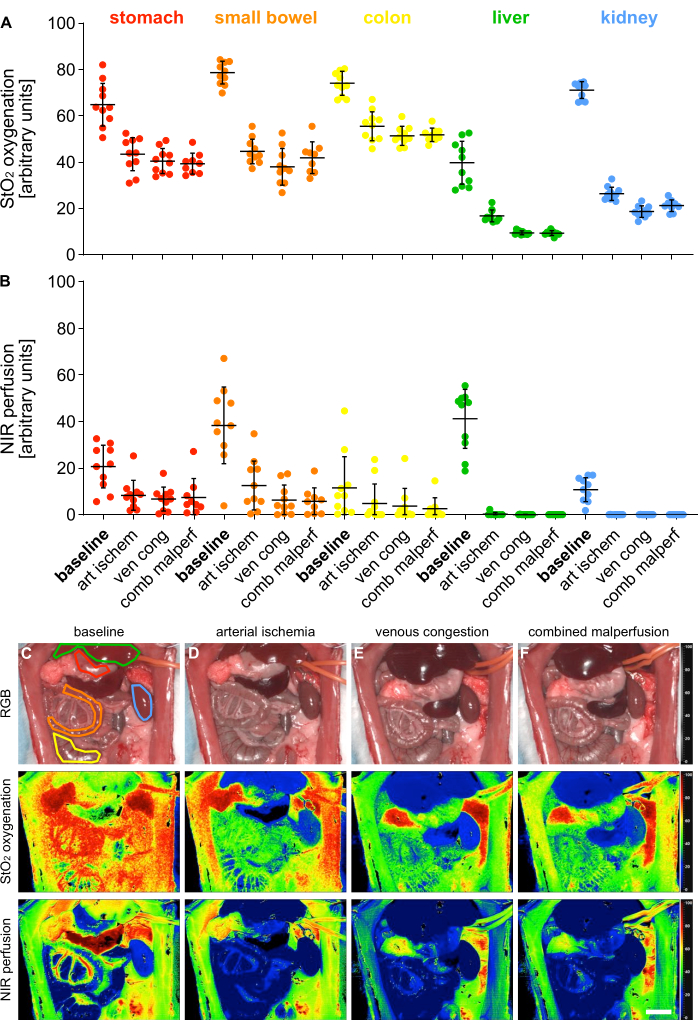
Şekil 5: Malperfüzyon modelinin doğrulanması. (A,B) HSI oksijenasyon ve perfüzyon değerlerinin dört farklı perfüzyon durumunda ve beş farklı iç organda n = 10 hayvanla ölçülmesi. (C-F) 4 farklı perfüzyon durumunda viseral organları içeren HSI kayıtlarının RGB ve renk kodlu indeks resimleri. Hata çubukları standart sapmayı gösterir. Ölçek çubuğu 5 cm'yi göstermektedir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Değerler keyfi birimlerde sağlandı ve fizyolojik organ durumuna kıyasla malperfüzyon durumlarında önemli bir azalma gösterdi (Tablo 1). Hiperspektral sonuçlar, dokunun canlılığının ve perfüzyonunun, bu çalışmada görülen değerlerle eşleşen organa özgü HSI StO2 kesme değerleri kullanılarak değerlendirilebileceğini gösteren son yayınlarla uyumluydu14,15. Mide için örnek olarak fizyolojik perfüzyon için %64.1 (%±9.4), arteriyel iskemi için %43.1 (%±7.4), venöz konjesyon için %40.5 (%±5.4) ve kombine malperfüzyon için %39.3 (%±4.5) idi.
Bunlar hayatta kalma dışı deneyler olduğundan, hayvanların uzun vadeli sonuçları hakkında deneysel bir veri yoktur. Bununla birlikte, diğer çalışmalar, 30 dakika ve 60 dakika superior mezenterik arter klemplemesi 16,17 uygulanan sıçanlar için 24 saat boyunca%100 ve% 57 sağkalım bildirmektedir ve bunu serum Isı Şoku Proteini 70 seviyeleri ile başarılı bir şekilde ilişkilendirmiştir. Sonuç olarak, bu, farklı kenetleme sürelerine göre gelecekteki sağkalım çalışmalarında sonuçları değerlendirmek için olası bir yöntem olabilir.
| parametre | org | taban çizgisi | arteriyel iskemi | venöz tıkanıklık | Kombine Malperfüzyon |
| StO2 | mide | %64,1 (%±9,4) | %43,1 (%±7,4) | %40,5 (%±5,4) | %39,3 (%±4,5) |
| İnce bağırsak | %78,4 (%±5,1) | %44,8 (%±5,5) | %38,0 (±7,9%) | %41,9 (%±6,9) | |
| iki nokta üst üste | %74,6 (%±5,0) | %56,0 (±%6,3) | %51,3 (%±4,1) | %51,8 (%±2,9) | |
| karaciğer | %39,5 (%±9,7) | %16,9 (%±2,6) | %9,5 (%±0,8) | %9.3 (%±1.1) | |
| böbrek | %71,0 (±3,8%) | %26,3 (%±3,0) | %18,6 (%±2,5) | %21,2 (%±2,6) | |
| NIR (Sıfır Sayıda | mide | %20,0 (±9,3%) | %8,3 (%±6,7) | %6,8 (%±5,1) | %7,5 (%±8,1) |
| İnce bağırsak | %38,6 (%±17,4) | %12,9 (%±11,0) | %6,3 (%±6,5) | %5.7 (%±5.9) | |
| iki nokta üst üste | %12,6 (%±13,7) | %5,3 (%±8,7) | %3.8 (%±7.5) | %2,6 (%±4,7) | |
| karaciğer | %40,4 (%±13,1) | %0.3 (±%0.7) | % 0.0 (±% 0.1) | %0.0 (±0.0%) | |
| böbrek | %10.4 (±5.2%) | %0.0 (±0.0%) | % 0.0 (±% 0.1) | %0.0 (±0.0%) |
Tablo 1: Doku parametreleri. HIS: StO2 oksijenasyonu ve NIR perfüzyon değerleri, 5 viseral organ ve 4 farklı perfüzyon durumunda rastgele birimlerde.
Tartışmalar
Doku malperfüzyon koşullarının en belirgin temsilcisi olan periferik arteriyel tıkayıcı hastalık (PAOD) tek başına, yalnızca Amerika Birleşik Devletleri'nde tahmini 8,5 milyon yetişkini etkileyen yaklaşık %7'lik bir prevalansasahipken18, genel olarak doku malperfüzyonu cerrahi ve tıbbi durumların çoğunda ilgili bir patomekanizmadır. Sonuç olarak, bu alandaki yeni araştırma sorularını ele almak için uygun ve tekrarlanabilir hayvan modelleri kesinlikle gereklidir.
Ayırıcı inceleme gerektiren üç vasküler dinamik durum arteriyel iskemi, venöz konjesyon ve kombine malperfüzyondur. Bilim adamları, izole arteriyel iskemiyi indükleyerek, doku hipoksisinin zamansal ve mekansal ilerlemesini kesin olarak tanımlayabilir, iskemi-reperfüzyon hasarı, hücresel apoptoz ve inflamatuar yanıtlarda rol oynayan moleküler kaskadları araştırabilir. Bilim adamları, vasküler patolojinin çoğu zaman gözden kaçan bir yönü olan venöz drenajı tehlikeye atarak, arteriyel akış ve venöz çıkış tutarsızlıkları arasındaki etkileşimi araştırabilir, venöz tromboz, tıkanıklıkla ilişkili doku ödemi ve mikro dolaşım disfonksiyonunun patofizyolojisine ışık tutabilir. Bu patolojik durumların her ikisi birleştirildiğinde, akut mezenterik iskemi ve iskemik kolit gibi klinik sendromlarda karşılaşılan karmaşık patofizyolojiyi yansıtan kombine malperfüzyonun dis-sinerjik ortamı araştırılabilir.
Temel patofizyolojik mekanizmaların aydınlatılmasının ötesinde, sıçanlarda viseral arteriyel iskemi, venöz tıkanıklık ve kombine malperfüzyonu indükleme yeteneği, farmakolojik girişimlerin, cerrahi tekniklerin, yeni terapötik stratejilerin ve özellikle HSI 14,19,20,21,22 gibi yenilikçi görüntüleme yöntemlerinin etkinliğini değerlendirmek için vazgeçilmez bir platform görevi görür . Bu nedenle, bu model, doku değerlendirmesinde ve perfüzyon durumlarının tanımlanmasında HSI'nin tam potansiyelinden yararlanmak için gereken gerekli biyolojik doku temel gerçeğini sağlamada kilit bir bileşendir. Araştırmacılar, bu deney düzeneğinden yararlanarak, klinik öncesi bulguların klinik olarak uygulanabilir stratejilere dönüştürülmesini hızlandırabilir ve sonuçta çeşitli vasküler ve perfüzyon bozukluklarıyla ilişkili morbidite ve mortaliteyi azaltabilir.
Örnek olarak, araştırmacılar bu modeli, antioksidanlar, antienflamatuar ajanlar ve vazodilatörler gibi iskemi-reperfüzyon yaralanma yollarını hedefleyen farmakolojik ajanların etkinliğini araştırmak ve böylece klinik uygulamada potansiyel faydalarını tanımlamak için kullanabilirler23,24. Ek olarak, bu model, mezenterik revaskülarizasyon teknikleri ve venöz dekompresyon prosedürleri gibi yeni cerrahi yaklaşımların değerlendirilmesini kolaylaştırarak, bunların fizibilitesi, güvenliği ve uzun vadeli etkinliği hakkında paha biçilmez bilgiler sağlar25,26.
Ayrıca, bu deneysel çerçeve, araştırmacıların vasküler disfonksiyon ile diyabet, hipertansiyon ve ateroskleroz gibi sistemik komorbiditeler arasındaki karmaşık etkileşimi keşfetmelerini sağlar ve böylece vasküler hastalık ilerlemesini düzenleyen birbirine bağlı patofizyolojik yolların karmaşık ağını gösterir27,28.
Sıçanlarda karaciğer 29,30,31 veya böbrek gibi tek organların seçici malperfüzyonu ile ilgili çeşitli yayınlar olmasına rağmen, sıçanlarda tüm iç organların malperfüzyonunu ele alan bilimsel literatür eksikliği vardır ve açıkça metodik bir protokol yoktur. Bu nedenle, bu el yazmasının iddiası budur. Sunulan tekniğin sınırlamaları esas olarak prosedürün invazivliğini ve malperfüzyon süresine bağlı olarak, ardışık organ trombozu ve disfonksiyonu içerir, bu da muhtemelen çoklu organ yetmezliği veya abdominal kompartman sendromu yoluyla postoperatif acıya yol açar 34,35,36. Araştırma sorusuna bağlı olarak dikkatli planlama ve tasarım, gerekli malperfüzyon süresini ve patofizyolojik sonuçlarını dengelemeye yardımcı olabilir.
Prosedür sırasında karşılaşılan yaygın zorlukları giderirken, aşağıdaki noktalara ve tavsiyelere dikkat edilmelidir: (1) Prosedür sırasındaki kesintileri en aza indirmek için ekipman ve ilaçların önceden kapsamlı bir şekilde hazırlandığından emin olun; (2) Avasküler düzlemleri dikkatlice hazırlayarak ve diseksiyon yaparak hemostatik kontrolü titizlikle gerçekleştirin. Varsa, elektrik hemostazı için bipolar hemostatik forseps kullanmayı düşünün; (3) Karaciğer parankimi ile temas ederken nemlendirilmiş pamuklu çubuklar veya forseps ile nemlendirilmiş cerrahi kompres gibi travmatik olmayan aletler kullanarak dokulara travmayı en aza indirin; (4) Hayvanların yaklaşık% 20'sinde hassas doku koşulları nedeniyle yaygın yüzeysel karaciğer parankimi kanaması görülmüştür. Bununla birlikte, kanama tüm vakalarda hafif kompresyon ve sabırla durdu. Bu öneriler, sıçan modellerinde malperfüzyon indüksiyonu sırasında prosedürel verimliliği artırmayı ve komplikasyonları en aza indirmeyi amaçlamaktadır.
Kaval venine daha iyi erişim için ksifoidi rezeke ederken, ksifoid ve sternum arasındaki geçişe kadar olan periton dorsalinin birkaç milimetre boyunca sağlam kaldığından emin olun. Ksifoidin rezeksiyon bölgesi sert ve keskin olacak ve potansiyel olarak yüzeysel karaciğer parankiminde travmaya neden olacaktır. Bu nedenle retrosternal peritonun forseps kullanılarak kaudal olarak mobilize edilmesi ve kemik güdüğünün etrafına etkili bir şekilde sarılması, üzerinin örtülmesi ve hemostazı desteklemesi önerilir. Cerrahi hazırlık kancaları, ksifoid kütüğün peritoneal kapsama alanı yerinde kalacak şekilde kraniyal gerginlik ile kraniyal ventral karın duvarından dikilmelidir.
Falsiform ligamanı diseksiyon yaparken, hayvan için ölümcül olabileceğinden, karaciğer veninde yanlışlıkla iyatrojenik yaralanmaya neden olmamak için özen gösterilmelidir. Damar hazırlığı sırasında kanama riskinin yüksek olması nedeniyle, cerrahi hazırlığın büyük çoğunluğunun keskin diseksiyon aletleri kullanmak yerine, künt overholt klemplerle yayılarak yapılması önerilmektedir. Ek olarak, yüzey sürtünmesini azaltmak ve doku travması riskini en aza indirmek için silikon damar halkaları kullanımdan önce nemlendirilmelidir.
Anevrizma mikrovasküler klempini uygularken, tam vasküler anatomiyi görselleştirmek çok önemlidir. Örneğin, çölyak arteri çok kraniyal olarak abdominal aorttan köken alır. Hepatik malperfüzyonu araştırmak gibi çölyak tıkanıklığı isteniyorsa, çölyak arter aort ve silikon damar halkasına göre görüntülenmelidir. Bu, çölyak arterin klemplenmiş vasküler dokuya dahil edilmesini sağlar (Şekil 2V-Z). Klempin başlangıçta kazara çölyak arterine kaudal yerleştirildiği bir vaka vardı. Bununla birlikte, StO2 karaciğer değerlerindeki eksik düşüş nedeniyle bu hemen fark edildi ve uygun reklempleme başarıyla gerçekleştirildi.
En tehlikeli hazırlık adımı, süvari damarının tünel açmasıdır. Bu adım nazik hareketler ve sabır gerektirir ve overholt klempleri yalnızca kaval damarı ile temas olmadığından emin olunduğunda yayılmalıdır. Kaval damarı hafif bir kompresyon uygulandığında ince avasküler bağ dokusu olarak görüneceğinden ve içerdiği kanın her iki yönde de kaybolmasına neden olacağından, bunu değerlendirmek zor olabilir. Kaval veni çok kraniyal olarak tünellerken kazara plevral açılma ve pnömotoraks oluşturma riski de vardır. Bu, özellikle hayvan kendiliğinden nefes aldığından ve invaziv solunum önlemleri alınamadığından ciddi ve yaşamı tehdit eden bir komplikasyon olabilir. Bu komplikasyonu önlemek için hazırlık aletlerini hafifçe geri çekmenin ve daha kaudal olarak devam etmenin yararlı olduğu bulunmuştur. Hepatik diyaframın şişmesi ile hemodinamik olarak anlamlı ve görünür pnömotoraks vakalarında, bir kurtarma stratejisi olarak 30 G'lık bir iğne ve küçük bir şırınga kullanılarak trans-diyafragma tek seferlik bir ponksiyon ve sıkışan havanın aspirasyonu önerilebilir. Bu teknik, intraoperatif olarak kurtarmak için bir hayvanda başarıyla uygulandı.
Son olarak, mikrovasküler klempleri uygularken, istenen damarın yetersiz tıkanmasına yol açabilecek çevredeki bağ dokusunu dahil etmekten kaçınmak için özel dikkat gösterilmelidir.
Bu protokol global viseral malperfüzyon için adım adım bir kılavuz olarak tasarlanmış olsa da, Şekil 1T-V'de gösterilen kapsamlı vasküler hazırlık ve mobilizasyon nedeniyle klempleme bölgesi spesifik araştırma sorusuna göre ayarlanabilir. Bu nedenle, hepatik iskemi için çölyak gövdesinin seçici olarak klemplenmesi gibi, vasküler ağaç boyunca daha distal olarak klempleme bölgesini seçerken, organ gruplarının veya tek organların seçilmiş malperfüzyonu da bir seçenektir. Ayrıntılı ve tekrarlanabilir bir metodoloji sunan bu protokol, sıçan modellerinde kontrollü geri dönüşümlü arteriyel iskemi, venöz tıkanıklık ve kombine malperfüzyon için standartlaştırılmış bir yaklaşımı kolaylaştırır ve gelecekteki hayvan çalışmalarında gelişmiş veri güvenilirliği, sağlamlık, araştırmacı bağımsızlığı ve karşılaştırılabilirlik sağlar. Sonuç olarak, vasküler uzlaşma, doku hasarı ve terapötik müdahaleler arasındaki karmaşık etkileşime dair içgörüler sunan biyomedikal araştırma ekipmanı içinde vazgeçilmez bir araçtır. Araştırmacılar, bu deney düzeneğinin çok yönlülüğünden yararlanarak, vasküler patofizyoloji etrafındaki gizemleri araştırabilir, translasyonel tıpta yeni sınırlar oluşturabilir ve nihayetinde vasküler sağlık alanında hasta sonuçlarını iyileştirebilir.
Açıklamalar
Hiç kimse.
Teşekkürler
Yazarlar, Baden-Württemberg Bilim, Araştırma ve Sanat Bakanlığı (MWK) ve Alman Araştırma Vakfı (DFG) tarafından INST 35/1314-1 FUGG ve INST 35/1503-1 FUGG hibeleri aracılığıyla desteklenen veri depolama hizmetine minnetle SDS@hd teşekkür eder. Ayrıca yazarlar, yapılandırılmış doktora sonrası programı ve Cerrahi Onkoloji programı aracılığıyla NCT'nin (Heidelberg, Almanya'daki Ulusal Tümör Hastalıkları Merkezi) desteğini minnetle kabul ederler. Ayrıca, Baden-Württemberg Eyalet Parlamentosu tarafından onaylanan Devlet Fonları aracılığıyla onaylanan Devlet Fonları aracılığıyla sağlanan desteği de kabul ediyoruz. Alexander Studier-Fischer için yapılandırılmış doktora sonrası programından Kampüs Sağlık + Yaşam Bilimleri İttifakı Heidelberg Mannheim: Sağlıkta Yapay Zeka (AIH) - DKFZ, EMBL, Heidelberg Üniversitesi, Heidelberg Üniversite Hastanesi, Mannheim Üniversite Hastanesi, Ruh Sağlığı Merkez Enstitüsü, ve Max Planck Tıbbi Araştırma Enstitüsü. Ayrıca, Mannheim Üniversitesi Tıp Merkezi'ndeki DKFZ Hector Kanser Enstitüsü aracılığıyla verilen desteği de kabul ediyoruz. Yayın ücreti için, Deutsche Forschungsgemeinschaft'ın "Açık Erişim Publikationskosten" finansman programı kapsamında ve Heidelberg Üniversitesi'nden mali destek alıyoruz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Atraumatic preparation forceps | Aesculap | FB395R | DE BAKEY ATRAUMATA atraumatic forceps, straight |
| Blunt overholt clamp | Aesculap | BJ012R | BABY-MIXTER preparation and ligature clamp, bent, 180 mm |
| Cannula | BD (Beckton, Dickinson) | 301300 | BD Microlance 3 cannula 20 G |
| Fixation rods | legefirm | 500343896 | tuning forks used as y-shaped metal fixation rods |
| Heating pad | Royal Gardineer | IP67 | Royal Gardineer Heating Pad Size S, 20 Watt |
| Plastic perfusor tube | M. Schilling GmbH | S702NC150 | connecting tube COEX 150 cm |
| Preparation scissors | Aesculap | BC177R | JAMESON preparation scissors, bent, fine model, blunt/blunt, 150 mm (6") |
| Silicone vessel loop tie | SERAG WIESSNER | SL26 | silicone vessel loop tie 2,5 mm red |
| Spraque Dawley rat | Janvier Labs | RN-SD-M | Spraque Dawley rat |
| Steel plate | Maschinenbau Feld GmbH | C010206 | Galvanized sheet plate, 40 x 50 cm, thickness 4.0 mm |
| Yasargil clip | Aesculap | FE795K | YASARGIL Aneurysm Clip System Phynox Temporary (Standard) Clip |
| Yasargil clip applicator | Aesculap | FE558K | YASARGIL Aneurysm Clip Applicator Phynox (Standard) |
Referanslar
- Carden, D. L., Granger, D. N. Pathophysiology of ischemia-reperfusion injury. J Pathol. 190 (3), 255-266 (2000).
- Balkwill, F., Mantovani, A. Inflammation and cancer: Back to Virchow. Lancet. 357 (9255), 539-545 (2001).
- Cruz, R. J., Garrido, A. G., Ribeiro, C. M., Harada, T., Rocha-E-Silva, M. Regional blood flow distribution and oxygen metabolism during mesenteric ischemia and congestion. J Surg Res. 161 (1), 54-61 (2010).
- Leng, G. C., Davis, M., Baker, D. Bypass surgery for chronic lower limb ischemia. Cochrane Database Syst Rev. 3, (2000).
- Droc, I., Calinescu, F. B., Droc, G., Blaj, C., Dammrau, R. Aortic stenting. Minim Invasive Ther Allied Technol. 24 (5), 296-304 (2015).
- Le Gall, A., et al. Veno-arterial-ecmo in the intensive care unit: From technical aspects to clinical practice. Anaesth Crit Care Pain Med. 37 (3), 259-268 (2018).
- Napp, L. C., Kühn, C., Bauersachs, J. ECMO in cardiac arrest and cardiogenic. Herz. 42 (1), 27-44 (2017).
- Sousa Da Silva, R. X., Weber, A., Dutkowski, P., Clavien, P. A. Machine perfusion in liver transplantation. Hepatology. 76 (5), 1531-1549 (2022).
- Sen Gupta, A. Bio-inspired nanomedicine strategies for artificial blood components. Wiley Interdiscip Rev Nanomed Nanobiotechnol. 9 (6), 1464 (2017).
- Lu, D., et al. Intramuscular microvascular flow sensing for flap monitoring in a porcine model of arterial and venous occlusion. J Reconstr Microsurg. 39 (3), 231-237 (2023).
- Nguyen, G. K., et al. Novel biomarkers of arterial and venous ischemia in microvascular flaps. PLoS One. 8 (8), e71628 (2013).
- Redlin, M., et al. How near-infrared spectroscopy differentiates between lower body ischemia due to arterial occlusion versus venous outflow obstruction. Ann Thorac Surg. 91 (4), 1274-1276 (2011).
- Studier-Fischer, A., et al. Endotracheal intubation via tracheotomy and subsequent thoracotomy in rats for non-survival applications. J Vis Exp. 205, e66684 (2024).
- Nickel, F., et al. Optimization of anastomotic technique and gastric conduit perfusion with hyperspectral imaging and machine learning in an experimental model for minimally invasive esophagectomy. Eur J Surg Oncol. 106908, (2023).
- Barberio, M., et al. Quantitative fluorescence angiography versus hyperspectral imaging to assess bowel ischemia: A comparative study in enhanced reality. Surgery. 168 (1), 178-184 (2020).
- Doukas, P., et al. Onset of adverse abdominal events due to intestinal ischemia-reperfusion injury after aortic cross-clamping is associated with elevated hsp70 serum levels in the early postoperative phase. Int J Mol Sci. 23 (23), 15063 (2022).
- Mine, Y., et al. Heat shock protein 70 messenger RNA in rat leukocytes elevates after severe intestinal ischemia-reperfusion. J Surg Res. 242, 342-348 (2019).
- Criqui, M. H., et al. Lower extremity peripheral artery disease: Contemporary epidemiology, management gaps, and future directions: A scientific statement from the American Heart Association. Circulation. 144 (9), e171-e191 (2021).
- Seidlitz, S., et al. Robust deep learning-based semantic organ segmentation in hyperspectral images. Med Image Anal. 80, 102488 (2022).
- Studier-Fischer, A., et al. Icg-augmented hyperspectral imaging for visualization of intestinal perfusion compared to conventional icg fluorescence imaging: An experimental study. Int J Surg. 109 (12), 3883-3895 (2023).
- Studier-Fischer, A., et al. Heiporspectral - the heidelberg porcine hyperspectral imaging dataset of 20 physiological organs. Scientific Data. 10 (1), 414 (2023).
- Studier-Fischer, A., et al. Spectral organ fingerprints for machine learning-based intraoperative tissue classification with hyperspectral imaging in a porcine model. Sci Rep. 12 (1), 11028 (2022).
- Mallick, I. H., Yang, W., Winslet, M. C., Seifalian, A. M. Ischemia-reperfusion injury of the intestine and protective strategies against injury. Dig Dis Sci. 49 (9), 1359-1377 (2004).
- Malekinejad, Z., et al. Prazosin treatment protects brain and heart by diminishing oxidative stress and apoptotic pathways after renal ischemia-reperfusion. Drug Res (Stuttg). 72 (6), 336-342 (2022).
- Feldman, Z. M., et al. Inferior mesenteric artery revascularization can supplement salvage of mesenteric ischemia. J Vasc Surg Cases Innov Tech. 9 (3), 101041 (2023).
- Munley, J. A., et al. Chronic mesenteric ischemia-induced intestinal dysbiosis resolved after revascularization. J Vasc Surg Cases Innov Tech. 9 (2), 101084 (2023).
- Lejay, A., et al. Ischemia reperfusion injury, ischemic conditioning and diabetes mellitus. J Mol Cell Cardiol. 91, 11-22 (2016).
- Huang, D., et al. Macrovascular complications in patients with diabetes and prediabetes. Biomed Res Int. 2017, 7839101 (2017).
- Liu, A., et al. Hmgb1 in the ischemic and non-ischemic liver after selective warm ischemia/reperfusion in rats. Histochem Cell Biol. 135 (5), 443-452 (2011).
- Koc, S., Dogan, H. O., Karatas, O., Erdogan, M. M., Polat, V. Mitochondrial homeostasis and mast cells in experimental hepatic ischemia-reperfusion injury of rats. Turk J Gastroenterol. 33 (9), 777-784 (2022).
- Chu, M. J., Vather, R., Hickey, A. J., Phillips, A. R., Bartlett, A. S. Impact of ischaemic preconditioning on experimental steatotic livers following hepatic ischemia-reperfusion injury: A systematic review. HPB (Oxford). 17 (1), 1-10 (2015).
- Chang, M. W., et al. Sitagliptin protects rat kidneys from acute ischemia-reperfusion injury via upregulation of GLP-1 and GLP-1 receptors. Acta Pharmacol Sin. 36 (1), 119-130 (2015).
- Boys, J. A., Toledo, A. H., Anaya-Prado, R., Lopez-Neblina, F., Toledo-Pereyra, L. H. Effects of dantrolene on ischemia-reperfusion injury in animal models: A review of outcomes in heart, brain, liver, and kidney. J Investig Med. 58 (7), 875-882 (2010).
- Orihashi, K. Mesenteric ischemia in acute aortic dissection. Surg Today. 46 (5), 509-516 (2016).
- Byard, R. W. Acute mesenteric ischemia and unexpected death. J Forensic Leg Med. 19 (4), 185-190 (2012).
- Łagosz, P., Sokolski, M., Biegus, J., Tycinska, A., Zymlinski, R. Elevated intra-abdominal pressure: A review of current knowledge. World J Clin Cases. 10 (10), 3005-3013 (2022).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır