Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
İnsan kimerik antijen reseptörü düzenleyici T hücrelerinin üretimi
Bu Makalede
Özet
Bu protokol, insan kimerik antijen reseptörü düzenleyici T hücreleri (CAR Treg'ler) oluşturmak ve test etmek için kolaylaştırılmış bir iş akışı sağlar.
Özet
Kimerik antijen reseptörü (CAR) T hücresi tedavisi, kanser tedavisinin çehresini yeniden şekillendirdi ve daha önce tedavi edilemeyen hematolojik kanserlerde rekor remisyon oranlarına yol açtı. Bu başarılar, CAR platformunu, öncelikle bağışıklık tepkisini, düzenleyici T hücrelerini (Treg'ler) düzenlemekten ve inhibe etmekten sorumlu olan CD4 + T hücrelerinin küçük ama önemli bir alt kümesine uyarlamaya olan ilgiyi artırdı. Tregs'in immünosüpresif aktivitesini herhangi bir hücre dışı hedefe yönlendirme yeteneği, otoimmün hastalık, organ nakli reddi ve graft-versus-host hastalığı için hücre tedavileri oluşturmak için çok büyük etkilere sahiptir. Burada, insan periferik kanından iyi niyetli Treg izolasyonu, adeno ilişkili virüs aracılı homolog yönlendirilmiş onarım (HDR) şablonu teslimi kullanılarak lentivirüs veya CRISPR/Cas9 destekli knock-in kullanılarak insan Treg'lerinin genetik modifikasyonu ve kararlı insan CAR Treg'lerinin ex vivo genişlemesi için ayrıntılı metodolojileri açıklıyoruz. Son olarak, insan CAR Treg'lerinin klinik öncesi ve klinik uygulamalarda nasıl davranacağına dair içgörüler sağlayan insan CAR Treg fenotipik stabilitesinin ve in vitro baskılayıcı fonksiyonunun değerlendirmesini açıklıyoruz.
Giriş
Kimerik antijen reseptörü (CAR) T hücresi tedavileri, hematolojik malignitelerin tedavisinde devrim yaratmış ve daha önce tedavi edilemeyen kanserlerde oldukça yüksek remisyon oranları elde etmiştir 1,2. Glioblastoma 3,4,5'i tedavi etmek için CAR T hücrelerini kullanan cesaret verici erken sonuçlar, CAR teknolojisinin çok yönlülüğünü ve çok çeşitli maligniteleri hedefleme potansiyelini vurgulamaktadır. Alan, CAR'ların daha fazla uygulamasını araştırırken, düzenleyici T hücreleri (Treg'ler) umut verici bir hücre tipi olarak ortaya çıkmıştır. Treg'ler, immün homeostazın korunmasında ve IL-2'nin sekestrezonu, immünosupresif sitokinlerin salgılanması ve antijen sunan hücrelerin modüle edilmesi dahil olmak üzere çeşitli mekanizmalar yoluyla immün yanıtların düzenlenmesinde çok önemli bir rol oynar 6,7.
CAR teknolojisi ile Tregs, organ nakli reddi, otoimmün hastalık ve alerji ve astım gibi inflamatuar bozuklukların tedavisi için kullanılabilir 6,8,9. CAR Treg'ler, bağışıklık sistemini bir bütün olarak inhibe eden ve zararlı yan etkilerle ilişkili olan immünosupresif ilaçların kullanımını azaltarak hasta sonuçlarında ve yaşam kalitesinde önemli iyileşmelere yol açabilir10,11. Klinik öncesi modeller, tip 1 diyabet, multipl skleroz, graft-versus-host hastalığı ve inflamatuar bağırsak hastalığı gibi hastalıklarda başarılı uygulamalarla CAR teknolojisinin Tregs'e çevrilmesinde umut verici sonuçlar göstermiştir 9,12,13,14,15. Klinikte, katı organ nakli reddini önlemek için CAR Treg'ler şu anda araştırılmaktadır16.
Bu makale, insan kimerik antijen reseptörü düzenleyici T hücreleri (CAR Treg'ler) oluşturmak için ayrıntılı bir metodoloji sunmaktadır. Bu protokol, Treg'lerin insan periferik kanından izole edilmesini ve CRISPR/Cas9 gen düzenleme ve adeno-ilişkili virüs (AAV) vektörleri kullanılarak lentiviral transdüksiyon ve hassas gen knock-in gibi teknikler kullanılarak genetik olarak değiştirilmesini içerir. Ayrıca, terapötik potansiyellerini doğrulamak için çok önemli adımlar olan bu tasarlanmış Treg'lerin fenotipik stabilitesi ve baskılayıcı işlevinin değerlendirmesini de açıklıyoruz 17,18,19. Bu yaklaşım, bağışıklık sistemini düzenlemek için CAR T hücresi tedavisinin dönüştürücü etkisini genişletme potansiyeline sahip olan CAR Treg tedavilerinin tasarımını ve erken testini kolaylaştırır. Metodolojimizi paylaşarak, gelişmekte olan CAR Treg terapi alanında 9,20 daha fazla araştırma ve yeniliğe ilham vermeyi umuyoruz.
Protokol
1. İnsan Treg izolasyonu
- Lökopak işleme
- Lökopak içeriğini 50 mL'lik konik bir tüpe aktarın. Bir pipetle hafifçe karıştırarak eşit hacimde Dulbecco'nun fosfat tamponlu salin (DPBS) +%2 fetal sığır serumu (FBS) ekleyin.
- Oda sıcaklığında (RT) 10 dakika boyunca 300 × g'da döndürün. Süpernatanı dikkatlice aspire edin. Hücre peletini 2 mL DPBS +% 2 FBS'de sulandırın. Hücre süspansiyonuna 4: 1 oranında pipet ile 8 mL amonyum klorür çözeltisi ekleyin, hafifçe ters çevirerek karıştırın ve kalan kırmızı kan hücrelerinin buz üzerinde 15 dakika parçalanmasına izin verin.
- RT'de 10 dakika boyunca 300 × g'da döndürün. Süpernatanı dikkatlice aspire edin. Hücreleri yıkamak için 30 mL DPBS +% 2 FBS ekleyin. Fren kapalıyken, yıkanmış hücreleri RT'de 10 dakika boyunca 150 × g'da döndürün. Süpernatanı dikkatlice aspire edin. Hücre peletini 30 mL DPBS +% 2 FBS'de yeniden süspanse edin.
- Şimdi izole edilmiş periferik kan mononükleer hücrelerini (PBMC'ler) tripan mavisi ile 1: 1 oranında sayın.
- Yüksek hücre konsantrasyonu nedeniyle, başlangıçta 10 μL hücreyi DPBS ile 1:100 oranında seyreltin; daha sonra, son 1: 1 seyreltme için 10 μL 1: 100 seyreltilmiş hücreyi 10 μL tripan mavisi çözeltisi ile karıştırın. Otomatik bir hücre sayacı kullanırken, çoğu sayaç 2 kat seyreltme varsaydığından, rapor edilen konsantrasyonu 100 ile çarparak hücre sayısını 200 kat seyreltmeyi yansıtacak şekilde düzeltin. 1/10 lökopaktan 109 PBMC × 1-2.5 verim almayı bekleyin.
- CD4+ T hücre izolasyonu (negatif seçim)
- RT'de 5 dakika boyunca 500 × g'da 108-10 9 PBMC'yi döndürün ve 5 × 107 hücre / mL'de Hücre Ayırma Tamponunda (DPBS + 1 mM EDTA +% 2 FBS) yeniden süspanse edin.
NOT: Genetik modifikasyon için yeterli insan Treg'i elde etmek için 1 × 109 PBMC ile başlamanızı öneririz. - CD4+ T hücresi zenginleştirme kiti için üreticinin talimatlarına göre manyetik ayırma işlemi gerçekleştirin.
- Tripan mavisi (10 μL hücre + 10 μL tripan mavisi) ile sayarak izole edilen CD4+ T hücrelerinin miktarını belirleyin.
- RT'de 5 dakika boyunca 500 × g'da 108-10 9 PBMC'yi döndürün ve 5 × 107 hücre / mL'de Hücre Ayırma Tamponunda (DPBS + 1 mM EDTA +% 2 FBS) yeniden süspanse edin.
- CD8+ T hücre izolasyonu (negatif seçim)
- RT'de 5 dakika boyunca 500 × g'da 5 × 107 PBMC'yi döndürün. 5 × 107 hücre / mL'de Hücre Ayırma Tamponunda (DPBS + 1 mM EDTA +% 2 FBS) yeniden süspansiyon edin.
NOT: 2-5 × 106 CD8+ T hücresi elde etmek için 5 × 107 PBMC ile başlamanızı öneririz. - CD8+ T hücre zenginleştirme kiti için üreticinin talimatlarına göre manyetik ayırma işlemi gerçekleştirin.
- Tripan mavisi (10 μL hücre + 10 μL tripan mavisi) ile sayarak izole edilen CD8 + T hücrelerinin sayısını belirleyin.
- RT'de 5 dakika boyunca 500 × g'da 5 × 107 PBMC'yi döndürün. 5 × 107 hücre / mL'de Hücre Ayırma Tamponunda (DPBS + 1 mM EDTA +% 2 FBS) yeniden süspansiyon edin.
- Treg floresan destekli hücre sıralama (FACS)
- CD4 + T hücrelerini adım 1.2'de tarif edildiği gibi izole edin ve ertesi gün FACS için 4 ° C'de% 2 FBS ile (hücre sayısı ve canlılıkta minimum kayıp) gece boyunca DPBS'de saklayın. Tripan mavisi (10 μL hücre + 10 μL tripan mavisi) ile sayarak adım 1.2'den itibaren CD4 + T hücrelerinin sayısını belirleyin.
- CD4 + hücrelerini 5 dakika boyunca 500 × g'da döndürün. Hücreleri 200 μL DPBS'de sulandırın.
- 1 × 106 hücre başına 1 μL anti-insan CD4 FITC, 1 μL anti-insan CD25 APC ve 1 μL anti-insan CD127 PE ekleyin. Yavaşça girdap yapın ve 4 ° C'lik karanlık buzdolabında 30 dakika bekletin.
- Hücreleri %2 FBS ile 10 mL DPBS ile yıkayın. 5 dakika boyunca 500 × g'da döndürün. Lekeli hücreleri% 2 FBS ile DPBS'de 1.5 × 107 hücre / mL'de nazikçe yeniden süspanse edin. Bu, floresanla aktive edilen hücre sınıflandırması (FACS) yoluyla sıralama yapmak için önerilen hücre konsantrasyonudur.
- Lekeli hücre süspansiyonunu 40 μm'lik bir filtre kapağından FACS tüplerine geçirin ve ardından tüpleri buz üzerinde tutun.
- 3 mL RPMI10 ortamı içeren 15 mL toplama tüpleri hazırlayın ve buzun üzerine yerleştirin.
NOT: Bu besiyeri RPMI1640 bazal besiyeri, %10 FBS, 1x penisilin-streptomisin, 1x L-alanil-L-glutamin, 1x esansiyel olmayan amino asit, 1x sodyum piruvat ve 1x HEPE'den oluşur. - Şekil 1A'da gösterildiği gibi FACS kullanarak CD4 + CD25yüksekCD127- düzenleyici T hücrelerini (Treg'ler) ve CD4 + CD25düşükCD127 + konvansiyonel T hücrelerini (Tconv) sıralayın.
- Hücre verimini ve canlılığını belirleyin; daha sonra aşağı akış analizi veya T hücresi aktivasyonu ile devam edin.
2. T hücresi aktivasyonu
- İzole edilmiş T hücrelerini tripan mavisi ile sayın (10 μL hücre + 10 μL tripan mavisi).
- Elde edilen her 1 × 106 T hücresi için 25 μL anti-CD3 / CD28 boncuk (106 boncuk) yıkayın ve boncukların T hücrelerine 1: 1 oranını koruyun. Anti-CD3 / CD28 boncuklarını DPBS ekleyerek, bir mıknatıs üzerinde 3 dakika inkübe ederek ve hücreler için toksik olabilen şimdi seyreltilmiş anti-CD3 / CD28 boncuk tamponunu çıkararak yıkayın.
- Tüpü mıknatıstan çıkarın ve yıkanmış boncukları 1 × 106 boncuk / 1 mL RPMI10 olacak şekilde RPMI10 ortamında yeniden süspanse edin.
- T hücrelerini, 1 × 106 T hücre / mL konsantrasyonda RPMI10 ortamında anti-CD3 / CD28 boncukları ile yeniden askıya alın. Daha sonra, Treg hücrelerine 1.000 IU / mL IL-2, CD4 + Tconv hücrelerine 100 IU / mL IL-2 ve CD8 + T hücrelerine 300 IU / mL IL-2 ekleyin.
- Farklı miktarlarda anti-CD3 / CD28 boncukları ve IL-2 içeren 24 oyuklu bir plakanın oyuğu başına 1 ×10 6 hücrede T hücrelerini kültürleyin. 24 oyuklu plakayı 37 °C,% 5 CO2 doku kültürü inkübatörüne yerleştirin.
- Aktive edilmiş T hücrelerini, deneyler için kullanılana veya ek genişleme için anti-CD3 / CD28 boncukları ile yeniden aktivasyon için kullanılana kadar IL-2 varlığında 9-12 gün boyunca genişletin. Ortamı her 2-3 günde bir değiştirin ve her taze ortam eklendiğinde IL-2 ekleyin. Treg'lerin hücre yoğunluğunu, hücreleri sayarak veya bölünmeden önce görsel inceleme ile genleşme sırasında mL başına 5 ×10 5 ila 1 ×10 6 hücre arasında tutun.
3. İnsan Treg lentiviral iletimi
- Aktivasyondan 48 saat sonra Treg'leri yeniden askıya alın ve sayın. RT'de 5 dakika boyunca 500 ×g'da döndürün. 1.000 IU / mL IL-2 ile 1.25 ×10 6 hücre / mL'de RPMI10'da Treg'leri yeniden askıya alın.
- Santrifüjü önceden 32 °C'ye ısıtın.
- Lentivirüs içeren CAR yapısını buz üzerinde çözün.
NOT: -80 ° C'de 1'lik bir MOI'de 2,5 × 105 hücreyi dönüştürmek için yeterli lentivirüs içeren tek kullanımlık lentivirüs alikotlarını saklıyoruz. - Her lentivirüs alikotunu bir mikrosantrifüj tüpünde 200 μL'de 2.5 ×10 5 Treg'e ekleyin, her tüp bir reaksiyonu gösterir. 32 ° C'de 1 saat boyunca 1.000 × g'da spinokülat.
- Her 200 μL reaksiyonu 24 oyuklu bir plakaya taşıyın. Ortamın tüm kuyuyu kapladığından emin olun. 24 oyuklu plakayı, transdüksiyonlu Tregs ile gece boyunca (16-18 saat) bir doku kültürü inkübatöründe inkübe edin. Son IL-2 konsantrasyonu 1.000 IU / mL olacak şekilde her bir kuyucuğu RPMI10 ortamı ile 2 mL'ye kadar doldurun.
- Hücreleri bölerek ve gerektiğinde (her 2-3 günde bir) taze önceden ısıtılmış RPMI10 ve IL-2 ile takviye ederek aktivasyondan 9-12 gün sonra transdüksiyonlu Treg'leri genişletmeye devam edin. İdeal hücre konsantrasyonu 5 × 105-1 × 106 hücre/mL'dir.
- Şekil 2'de gösterildiği gibi akış sitometrisi kullanarak gen modifikasyon verimliliğini değerlendirin.
NOT: Lentiviral CAR yapılarımız, CAR geninin N-terminali üzerinde bir Myc-etiketi ve bir 2A peptit ile CAR genine bağlı bir GFP raportör geni içerir, bu da antikor boyaması (GFP) olmadan transdüksiyon verimliliğinin ölçülmesine ve CAR yüzey ekspresyonunun doğrulanmasına (Myc-etiketi) izin verir. Transdüksiyondan 5 gün sonra gen modifikasyon verimliliğini değerlendiriyoruz. Transdüksiyon verimlilikleri, donöre ve kullanılan CAR yapısına bağlı olarak %30 ile %70 arasında değişebilir. İstenirse CAR+ hücreleri sıralanabilir. - Modifiye edilmiş Treg'lerin aktivasyon döngüsünü (9-12 gün) tamamladığından ve herhangi bir deneyde kullanılmadan önce IL-2 yokluğunda 24 saat dinlendiğinden emin olun.
4. İnsan Treg'lerinde CRISPR/Cas9 aracılı gen vuruşu
- Treg'leri yeniden askıya alın ve aktivasyondan 48 saat sonra 15 mL'lik bir konik tüpe aktarın. Hücre süspansiyonunu bir mıknatıs içinde 3 dakika inkübe edin.
- Mıknatısın içindeyken, ortamdaki hücreleri pipet aracılığıyla yeni bir tüpe aktarın. Anti-CD3 / CD28 boncukları tüp duvarına bağlı kalacaktır. Boncuk çıkarma işleminden sonra boncuk çıkarmanın ani stresinden kurtulmak, gelecekteki transdüksiyon verimliliğini artırmak ve elektroporasyondan geri kazanımı artırmak için boncukları alınmış Treg'lerin 10 saat boyunca RPMI2'da dinlenmesine izin verin.
- Tripan mavisi ile boncukları çıkarılmış Treg'leri sayın.
- FBS içermeyen indirgenmiş serum ortamını 37 ° C'ye önceden ısıtın.
- Antibiyotiksiz (penisilin-streptomisin) 2.5 mL RPMI10 ortamı ve oyuk başına 1.000 IU / mL IL-2 içeren 6 oyuklu bir plaka hazırlayın. Plakayı bir doku kültürü inkübatöründe 37 °C'ye ısıtın.
- Adeno-ilişkili virüs (AAV) içeren CAR homolojiye yönelik onarım (HDR) şablonunu buz üzerinde çözün.
NOT: -80 ° C'de 20.000'lik bir MOI'de 4 × 106 hücreyi enfekte etmek için yeterli AAV içeren tek kullanımlık alikotları saklıyoruz. - Treg'leri 5 dakika boyunca 500 × g'da döndürün. Süpernatanı boşalttıktan sonra, hücreleri önceden ısıtılmış indirgenmiş serum ortamında 4 × 107 hücre / mL'de yeniden süspanse edin.
- Düşük protein bağlayıcı 1.5 mL santrifüj tüplerinde 100 μL'lik alikot hücreleri. Her numuneye 20.000'lik bir MOI'de CAR AAV ekleyin ve yeniden askıya alın. Reaksiyon tüplerini doku kültürü inkübatöründe 1 saat inkübe edin.
- 1 saatlik inkübasyon sırasında, TRAC gen lokusunu hedefleyen 2,5 μL sgRNA'ya 8,3 μL Cas9 proteini (1 mg/mL stok) (1 mg/mL stok) yavaşça ekleyerek CRISPR/Cas9 ribonükleoprotein (RNP) komplekslerini hazırlayın ve birleştirin (100 μM stok) Cas9 ila sgRNA'nın molar oranı 1: 1 ve numune başına toplam 10,8 μL RNP hacmi için. Karıştırmak için hafifçe yukarı ve aşağı pipetleyin. RNP karışımını doku kültürü inkübatöründe 37 ° C'de 15 dakika inkübe edin.
NOT: RNP kompleksleri, kullanıma hazır olana kadar daha sonra RT'de kalabilir. - Yeni bir elektroporasyon tüpünü (E tüpü) 3 mL yüksek ozmolariteli elektroporasyon tamponu ile doldurun. Doldurulmuş E Tüpünü, bir tık sesi duyulana kadar elektroporasyon sisteminin pipet istasyonuna yerleştirin. Elektroporasyon sisteminde elektroporasyon koşullarını 2.200 V, 20 ms, 1 darbe olarak ayarlayın.
- AAV ile 1 saatlik inkübasyon tamamlandığında, hücreleri RT'de 5 dakika boyunca 300 × g'da AAV ile döndürün. Süpernatanı dikkatlice aspire edin ve hücre peletini, numune başına elektroporasyon sistemi tarafından sağlanan 100 μL hücre yeniden süspansiyon tamponunda yeniden süspanse edin.
NOT: Hızlı çalışın ve hücreleri arabellekte 15 dakikadan daha uzun süre bırakmaktan kaçının. Baloncuk oluşturmaktan kaçının. - Örnek başına 10.8 μL RNP kompleksi ekleyin. Kabarcık oluşturmadan bir pipetle iyice karıştırın.
- Kelepçeyi açmak için pipeti ikinci durağına iterek 100 μL'lik bir elektroporasyon ucu yerleştirin. Pipetin üst kafasını, kelepçe pistonun montaj mili ile güvenli bir şekilde yerine oturana kadar elektroporasyon ucuna yerleştirin. Ucun herhangi bir boşluk olmadan sıkıca oturduğundan emin olmak için pipet üzerindeki aşağı doğru basıncı korurken düğmeyi kademeli olarak bırakın.
- Pipeti ilk durağa kadar bastırın ve elektroporasyon ucunu hücre-RNP karışımına daldırın. Numuneyi herhangi bir kabarcık olmadan yavaşça pipetin içine çekin.
NOT: Elektroporasyon sırasında ucun içinde kabarcık bulunamaz. - Pipeti, numuneyi içeren monte edilmiş elektroporasyon ucu ile birlikte bir tık sesi duyulana kadar dikey olarak E Tüpüne yerleştirin. Baloncuk oluşturmaktan kaçının.
- İnsan Treg'leri için en uygun ayarların girildiğini onaylayın (2.200 V, 20 ms, 1 Darbe) ve hücreleri elektroporate etmek için dokunmatik ekranda başlat düğmesine basın.
- Elektroporasyonun tamamlanmasının ardından dokunmatik ekranın Tamamlandı mesajının görüntülenmesini bekleyin. Pipeti nazikçe çıkarın ve numuneyi hemen oyuk başına 1.000 IU/mL IL-2 ile 2,5 mL önceden ısıtılmış, antibiyotik içermeyen RPMI10 ortamı içeren hazırlanmış 6 oyuklu plakaya aktarın. Kalan örneklerle tekrarlayın. Her bir oyuktaki hücrelerin eşit dağılımını sağlamak için plakayı doğrusal hareketlerle (soldan sağa, yukarıdan aşağıya) hafifçe sallayın ve doku kültürü inkübatörüne yerleştirin.
NOT: Aynı hücreler ve RNP kompleksi kullanılıyorsa, bir elektroporasyon ucunun yeniden kullanılması 3 kata kadar kabul edilebilir. Hücreleri saymadan veya istenirse bir HDR geliştirici eklemek gibi herhangi bir şekilde rahatsız etmeden önce 30 dakikalık bir iyileşme süresine izin verin. - Ertesi gün, 16-18 saat sonra, ortamı antibiyotik içeren ortamla değiştirin, elektropore Treg'leri tripan mavisi ile sayın ve 1.000 IU / mL IL-2 ile 106 hücre / mL'de kültürleyin. Hücreleri bölerek ve adım 2.6'da açıklandığı gibi taze RPMI10 ve IL-2'yi takviye ederek elektropore Treg'leri genişletmeye devam edin.
- Akış sitometrisi ile analiz için numuneleri buz üzerinde tutun.
- Tek renk telafisi kontrollerini ayarlayın ve deney dosyasına uygulayın.
- FSC ve SSC kazançlarını, lenfosit popülasyonu 'Tüm olaylar' nokta grafiğinin ortasında olacak şekilde ayarlamak için önce boyanmamış numuneyi okuyun.
- Şekil 3C'de gösterildiği gibi, lenfositlerin enkaz bırakmayan/tek hücrelere canlı hücrelere CD4+ hücrelerine geçit stratejisini ayarlayın.
- Akış sitometrisi kullanarak gen modifikasyon verimliliğini değerlendirin.
NOT: AAV CAR yapılarımız, TRAC lokus homoloji kollarına ek olarak, Şekil 3'te gösterildiği gibi bir 2A peptid ile CAR genine bağlı kesilmiş bir epidermal büyüme faktörü reseptörü (EGFRt) raportör geni içerir. Gen knock-in verimliliği, kaybı TCR yüzey ekspresyonunun kaybını ve dolayısıyla TRAC lokusunun CRISPR/Cas9 ile başarılı bir şekilde hedeflenmesini ve ekspresyonu CAR transgeninin başarılı entegrasyonunu gösteren EGFRt için CD3 için yüzey boyama ile belirlenir. CAR knock-in Treg'ler CD3-EGFRt+ hücreleridir. Elektroporasyondan 5 gün sonra gen modifikasyon verimliliğini değerlendiriyoruz. - Modifiye edilmiş Treg'lerin aktivasyon döngüsünü (9-12 gün) tamamladığından ve herhangi bir deneyde kullanılmadan önce IL-2'nin yokluğunda 24 saat dinlendiğinden emin olun.
5. İnsan CAR Treg aktivasyonu
- Ortak kültür kurulumu (Gün 0)
- CAR antijen eksprese eden hedef hücre hattını konik bir tüpe toplayın.
NOT: CAR Treg aktivasyonu için hedef hücreler olarak HLA, CD80 ve CD86 ekspresyonu olmayan bir insan miyeloid lösemi hücre hattı olan K562 hücrelerini kullanıyoruz. Ebeveyn K562 hücreleri negatif kontrol olarak kullanılır ve CAR antijen eksprese eden K562, CAR Tregs 17,21'i aktive etmek için kullanılır. - Hedef hücre hatlarını bir Sezyum-137 veya X-ışını ışınlayıcısında 4.000 rad ile ışınlayın. Bir ışınlayıcıya erişim olmaması durumunda, hedef hücrelerde yüzey antijen ekspresyonunu korurken hücre proliferasyonunu durdurmak için mitomisin C tedavisi uygulayın22.
- Henüz yapılmadıysa, anti-CD3 / CD28 boncuklarına bağlı Treg'leri yeniden süspanse ederek ve bunları 15 mL'lik bir konik tüpe aktararak Treg'leri temizleyin. Hücre süspansiyonunu bir mıknatıs içinde 3-5 dakika inkübe edin. Hala mıknatısın içindeyken, ortamdaki hücreleri pipet yoluyla yeni bir tüpe aktarın; anti-CD3 / CD28 boncukları tüp duvarına bağlı kalacaktır.
- Tripan mavisi ile ışınlanmış hedef hücreyi ve boncuksuz CAR Treg konsantrasyonlarını belirleyin.
- Işınlanmış hedef hücreleri ve CAR Treg'leri 500 × g'da 5 dakika döndürün. Önceden ısıtılmış RPMI10 ile 106 hücre / mL'de ayrı tüplerinde yeniden süspanse edin. 2.000 IU / mL'lik bir konsantrasyon için IL-2'yi CAR Treg'lere ekleyin.
NOT: Bu IL-2 miktarı, CAR Treg'leri 1.000 IU / mL'lik bir nihai IL-2 konsantrasyonu için hedef hücrelerle birleştirildiğinde 2 kat seyreltilecektir. - 1 × 105 (100 μL) CAR antijen negatif, ışınlanmış hedef hücreler (aktivasyon için negatif kontrol), 1 × 10 5 (100 μL) CAR antijen pozitif, ışınlanmış hedef hücreler (deney) veya 2.5 μL anti-CD3 / CD28 boncukları (aktivasyon için pozitif kontrol) ve 97.5 μL RPMI10 ortamı ×ile 96 oyuklu yuvarlak bir alt plakada ko-kültür. Plakayı 48 saat boyunca 37 °C,% 5 CO2 doku kültürü inkübatörüne yerleştirin.
NOT: Oyuk başına son hacim 200 μL'dir. Her koşulun üç kopyası olduğundan emin olun.
- CAR antijen eksprese eden hedef hücre hattını konik bir tüpe toplayın.
- Akış sitometrisi okuması
- Bir plaka okuyucu kullanmadıkça, her bir oyuğun içeriğini 96 kuyulu yuvarlak tabanlı plakadan yeniden süspanse edin ve bunları bir FACS tüpüne aktarın. 5 dakika boyunca 500 x g'da döndürün. Süpernatanı boşaltın ve hücre peletini nazikçe girdaplayın.
- Akış sitometrisi antikor ana karışımını hazırlayın: DPBS, anti-insan CD4 PE / Cy7 1:200, anti-insan CD71 PE 1:100 ve Hayalet Canlılık Boyası BV510 1:2000 içeren 100 μL/örnek.
NOT: Bu panel, CAR raportör geni GFP ise iyi çalışır. Bir raportör gen, EGFRt gibi antikor boyaması gerektiren bir yüzey proteinini kodlarsa, örneğin bir FITC konjuge antikor kullanılabilir. - Her numuneye 100 μL antikor ana karışımını pipetleyin, nazikçe karıştırın ve 4 ° C'lik buzdolabında 30 dakika inkübe edin.
- 500 μL DPBS ile 500 × g'da 5 dakika döndürerek yıkayın. Hücre peletini 200 μL DPBS'de yeniden süspanse edin.
- Akış sitometrisi ile analiz için numuneleri buz üzerinde tutun.
- Tek renk telafisi kontrollerini ayarlayın ve deney akışı dosyasına uygulayın.
- Lenfosit popülasyonu 'Tüm olaylar' nokta grafiğinin ortasında olacak şekilde SSC ve FSC kazançlarını ayarlamak için boyanmamış örnekleri okuyun.
- Şekil 3C'de gösterildiği gibi, lenfositlerin enkaz bırakmayan/tek hücrelere canlı hücrelere CD4+ hücrelerine geçit stratejisini ayarlayın (Kullanılan farklı floroforlar).
- Treg aktivasyonunu değerlendirmek için örnekleri yaklaşık 1.500 olay/sn'lik bir olay hızında okuyun.
NOT: Beklenen sonuç, Şekil 4'te gösterildiği gibi CAR antijeni varlığında CAR Treg'lerde CD71 yüzey ekspresyonunun yukarı regülasyonudur. CAR antijeninin varlığında yukarı regülasyon görülmezse, tonik sinyalleme mevcut olabilir.
6. İnsan CAR Treg kararlılığı
- Ortak kültür kurulumu ve genişlemesi (0-9. Gün)
- Adım 5.1'de açıklandığı gibi CAR Treg'leri etkinleştirmek için ortak kültürleri ayarlayın.
- 48 saat sonra, her 96 oyuklu yuvarlak tabanlı plaka kuyusundan kokültürü, hücre genişlemesine izin vermek için 1.000 IU / mL IL-2 ile önceden ısıtılmış 2 mL RPMI10 içeren 24 oyuklu bir plaka kuyusuna aktarın.
- 1.000 IU / mL IL-2 ile taze önceden ısıtılmış RPMI10 ekleyin ve gerektiği gibi ek 24 oyuklu plakalara bölün.
- Akış sitometrisi okuması
- Her bir kopyanın içeriğini 15 mL veya 50 mL'lik bir konik tüpe yeniden süspanse edin ve aktarın. Hücre konsantrasyonlarını belirleyin.
- Her çoğaltma için 5 × 10,5 ve 1 × 106 hücrelerini bir FACS tüpüne aktarın. 5 dakika boyunca 500 × g'da döndürün.
- Yüzey boyama için akış sitometrisi antikor ana karışımını hazırlayın: DPBS, anti-insan CD4 PE/Cy7 1:200, anti-insan CD25 APC 1:200 ve Ghost Viability Dye BV510 1:2000 içeren 100 μL/numune. Gerekirse CAR raportör proteini için FITC ile konjuge antikor ekleyin.
- Süpernatanı adım 6.2.2'den boşaltın ve hücre peletini nazikçe girdaplayın. Her bir FACS tüpüne 100 μL yüzey boyama antikor ana karışımını pipetleyin. Kısa bir süre girdap yapın ve karanlıkta 30 dakika boyunca 4 ° C'lik bir buzdolabına koyun.
- Bir transkripsiyon faktörü boyama tamponu seti kullanarak, 1 hacim Fiksasyon/Geçirgenleştirme konsantresine 3 hacim Fiksasyon/Geçirgenleştirme seyrelticisi ekleyerek Fiksasyon/Geçirgenleştirme tamponu hazırlayın. Her numune 100 μL Fiksasyon/Geçirgenleştirme tamponu gerektirir.
- Yüzeyi lekelenmiş hücreleri 500 μL DPBS ile yıkayın. 5 dakika boyunca 500 × g'da döndürün ve süpernatanı boşaltın. Her tüpe 100 μL hazırlanmış Fiksasyon/Geçirgenleştirme tamponu pipetleyin. Kısaca girdap yapın ve karanlıkta 30-60 dakika boyunca 4 ° C'de fiksasyonun gerçekleşmesine izin verin.
- Bir transkripsiyon faktörü boyama tamponu seti kullanarak, 1 hacim Geçirgenleştirme Tamponu 10x konsantresine 9 hacim damıtılmış su ekleyerek 1x Geçirgenleştirme Tamponu hazırlayın. Her numune, yıkama için 1.000 μL Geçirgenleştirme tamponu ve hücre içi proteinleri hedef alan antikorlarla boyama için 100 μL Geçirgenleştirme tamponu gerektirir.
- Sabit/geçirgen hücreleri 500 μL 1x Geçirgenleştirme tamponu ekleyerek yıkayın. RT'de 5 dakika boyunca 500 × g'da döndürün.
- 1x Geçirgenlik tamponu, anti-insan FOXP3 eFluor 450 1:50, anti-insan HELIOS PE 1:50 ve anti-insan CTLA-4 PerCP-e710 1:50 ile hücre içi boyama antikor ana karışımını hazırlayın. Her numune 100 μL antikor ana karışımı gerektirecektir.
NOT: Bu panel, CAR raportör geni GFP ise veya CAR raportör proteini (örneğin, EGFRt) bir FITC konjuge antikor ile boyanmışsa çalışır. - Süpernatanı adım 6.2.8'den boşaltın. 100 μL hücre içi boyama antikoru ana karışımı ekleyin, kısaca girdap yapın ve karanlıkta 30 dakika boyunca RT'de inkübe edin.
- Lekeli sabit/geçirgen hücreleri 500 μL 1x Geçirgenleştirme tamponu ekleyerek yıkayın. 5 dakika boyunca 500 × g'da döndürün. Süpernatanı boşaltın, hücre peletini 300 μL DPBS'de yeniden süspanse edin ve buz üzerinde saklayın.
- Şekil 5'te gösterildiği gibi akış sitometrisi ile analiz edin. Beklenen sonuç, çoğu CAR Treg'in FOXP3+HELIOS+ hücreleri olacağıdır. FOXP3 ve HELIOS boyama için negatif kontrol olarak CD4 + Tconv hücrelerini kullanın.
7. İnsan CAR Treg bastırma
- Yanıtlayıcı T hücresi (Tresp) hücresi iz boya boyama ve gece boyunca aktivasyon
- Genişletilmiş CAR Treg hücrelerini, yeni izole edilmiş CD4 + Tconv hücrelerini ve yeni izole edilmiş CD8 + T hücrelerini ayrı 15 mL konik tüplere toplayın ve henüz yapılmadıysa anti-CD3 / CD28 boncuklarını debead edin.
- Işınlanmış CAR antijeni eksprese eden hedef hücreleri adım 5.1'de açıklandığı gibi hazırlayın.
- Aktive edilmemiş T hücresi ve ışınlanmış hedef hücre konsantrasyonlarını belirleyin.
- 5 × 106 CD4 + Tconv hücrelerini 5 × 106 CD8 + T hücresi (1: 1 oranında) ile birleştirin. Bunlar, tahlilde CAR Treg'ler tarafından inhibe edilecek yanıtlayıcı T hücreleridir (Tresp ). Tresp hücrelerini RT'de 5 dakika boyunca 500 × g'da döndürün. Süpernatanı dikkatlice aspire edin ve Tresp hücrelerini 1 mL DPBS'de yeniden süspanse edin.
- 5 μM CTV'lik bir nihai konsantrasyon için 1 mL DPBS'deki 107 Tresp hücresine DMSO'da sulandırılan 1 mL 5 mM CellTrace Violet (CTV) boyası ekleyin. 37 °C'de 20 dakika su banyosuna koyun. 10 dakikada, yerleşmiş CTV'yi yeniden dağıtmak için hafifçe girdap yapın.
- 9 mL önceden ısıtılmış RPMI10 tam ortam ile yıkayın. 5 dakika boyunca 500 × g'da döndürün. 5 mL önceden ısıtılmış RPMI10 tam ortamında yeniden süspanse edin.
- CTV etiketli Tresp hücre konsantrasyonunu belirleyin. Minimum proliferasyon kontrolleri olarak 96 oyuklu yuvarlak tabanlı bir plakanın 3-6 oyuğunda 200 μL RPMI10 ortamında 5 ×10 4 CTV etiketli aktive edilmemiş Tresp hücresi ekleyin.
- RPM10 ortamında IL-2 olmadan 1:10 boncuk / Tresp hücre oranında anti-CD3 / CD28 boncuklu CTV etiketli Tresp hücrelerini aktive edin. Gece boyunca doku kültürü inkübatöründe 24 oyuklu bir plakanın oyuğu başına 1 mL RPMI10 ortamında 106 CTV etiketli Tresp hücresi dağıtın.
- Paralel olarak, 10adet 6 CAR+ Treg elde edin. Bu miktar, 5 × 10 4 hedef hücrede, 5 × 10 4 hedef hücrede, 5 104 × 3 + 2.5 × 104 × 3 + 1.25 × 104 × 3 + 0.625 × 104 × 3 = 2.81 × 105 CAR Treg, iki CAR Treg aktivasyon koşulunda, dört CAR Treg:Tresp oranının üçlüsünü kapsar: ışınlanmış CAR antijen negatif hedef hücreleri (negatif kontrol, aktivasyon yok) ve ışınlanmış CAR antijen pozitif hedef hücreler (deney, CAR aktivasyonu).
- 3 × 105 CAR Treg'leri 3 × 105 ışınlanmış CAR antijen negatif hücre (1: 1 oranında) ve 3 × 105 CAR Tregs ile 3 × 105 ışınlanmış CAR antijen pozitif hedef hücre (1: 1 oranında), iki ayrı 15 mL konik tüpte birleştirin ve RT'de 5 dakika boyunca 500 × g'da döndürün. Süpernatanı dikkatlice aspire edin.
- 600 μL önceden ısıtılmış RPMI10 ortamında adım 7.1.10'dan itibaren her tüpteki peleti yeniden süspanse edin. Bu, 1:1 Treg'in her biri için 200 μL ile sonuçlanır: Tresp üçe katlanır. 96 oyuklu yuvarlak tabanlı bir plaka üzerinde aşağıdaki gibi seri seyreltme gerçekleştirin:
- Hazırlanan 600 μL Treg + hedef hücre süspansiyonundan, 3 1:1 oranlı oyukların her birine 200 μL hücre süspansiyonu pipetleyin.
- Boş 1:2, 1:4 ve 1:8 oranlı kuyucukların her birine 100 μL önceden ısıtılmış RPMI10 tam ortamı ekleyin.
- Üçlülerin her biri için, 1:1 oyuklardan 100 μL hücre süspansiyonunu ilgili 1:2 oranlı oyuklara pipetleyin.
- Üçlülerin her biri için, 1:2 oyuklardan 100 μL hücre süspansiyonunu ilgili 1:4 oranlı kuyucuklara pipetleyin.
- Üçlülerin her biri için, 1: 4 oyuklardan 100 μL hücre süspansiyonunu ilgili 1: 8 oranlı kuyucuklara pipetleyin.
- Kalan 100 μL'lik hücre süspansiyonunu 1:8 oranındaki kuyucuklardan bir atık kabına pipetleyin.
NOT: Her kuyucuk, 5 × 104 (1:1), 2,5 × 104 (1:2), 1,25 × 104 (1:4) veya 0,625 × 104 (1:8) CAR Tregs ve eşit sayıda ışınlanmış hedef hücre ile 100 μL hücre süspansiyonu içermelidir.
- CAR Treg ve Tresp hücre ko-inkübasyonu
- Aktivasyondan 16-18 saat sonra, 24 oyuklu plakadan aktive edilmiş Tresp hücrelerini konik bir tüpe toplayın ve anti-CD3 / CD28 boncuklarını mıknatıs aracılığıyla çıkarın.
- Boncuksuz CTV etiketli Tresp hücre sayımlarını belirleyin.
- 2 × 106 Tresp hücrelerini 500 × g'da 5 dakika boyunca yıkayın ve döndürün. Süpernatanı dikkatlice aspire edin. Hücreleri 4 mL RPMI10 tam ortamda yeniden süspanse edin.
- CAR Tregs ile her bir oyuğa 100 μL T hücresi süspansiyonu (5 × 104 T hücresi) ve ayrıca maksimum proliferasyon kontrolleri için tek başına 100 μL RPMI10 ortamı ile 3-6 kuyuya ekleyin. Plakayı 72 saat boyunca 37 °C,% 5 CO2 doku kültürü inkübatörüne yerleştirin.
NOT: 96 oyuklu yuvarlak tabanlı plaka artık tek başına aktive edilmemiş Tresp hücreleri ile 3-6 kuyucuk (minimum proliferasyon kontrolü), tek başına aktive edilmiş Tresp hücreleri ile 3-6 kuyu (maksimum proliferasyon kontrolü) ve azalan CAR Treg sayılarının varlığında aktive edilmiş Tresp hücrelerine sahiptir.
- Akış sitometrisi okuması
- Her 96 oyuklu yuvarlak alt plakanın içeriğini yeniden askıya alın ve etiketli bir FACS tüpüne aktarın. Alternatif olarak, plaka okuma moduna sahip bir akış sitometresi mevcutsa, 96 oyuklu bir V-alt plakaya aktarın. 5 dakika boyunca 500 × g'da döndürün.
- Bu arada, DPBS, anti-insan CD4 PE / Cy7 1:200 ve anti-insan CD8 PerCP 1:200 ile antikor ana karışımı hazırlayın. Her numune 100 μL antikor ana karışımı gerektirecektir.
- Hücre peletini nazikçe girdaplayın. Her bir FACS tüpüne 100 μL antikor ana karışımı pipetleyin. Kısa bir süre girdap yapın ve karanlıkta 30 dakika boyunca 4 ° C'de inkübe edin.
- 500 μL DPBS ile yıkayın. 96 oyuklu bir V-taban kullanıyorsanız 2x'i 100 μL DPBS ile yıkayın. 5 dakika boyunca 500 × g'da döndürün. Süpernatanı boşaltın, hücre peletini 200 μL DPBS'de yeniden süspanse edin ve tüpleri karanlıkta buz üzerinde saklayın.
- Şekil 6'da gösterildiği gibi akış sitometrisi ile analiz edin. Beklenen sonuç, tek tip bir yüksek CTV floresan zirvesi göstermek için tek başına aktive edilmemiş Tresp hücreleridir (minimum proliferasyon), her hücre bölünmesine karşılık gelen bir tane olmak üzere birden fazla CTV yoğunluğu zirvesi gösteren aktive edilmiş Tresp hücreleri (maksimum proliferasyon) ve CTV piklerinin sayısında ve yüksekliğinde bir azalma gösteren aktive edilmiş CAR Treg'lerin varlığında aktive edilmiş CD4 + ve CD8 + T hücreleri, bu nedenle, çoğalmada.
- Treg hücre aracılı baskılamayı aşağıdaki gibi hesaplayın:
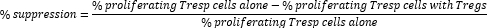
NOT: FlowJo yazılımı kullanılıyorsa, her numune için bölünme indeksini (DI) hesaplamak için hücre proliferasyon modellemesini kullanmak ve yukarıdaki formülde yer alan çoğalan hücrelerin yüzdesi yerine DI kullanarak bastırma yüzdesini hesaplamak da mümkündür.
Sonuçlar
Burada açıklanan protokol, otoimmün hastalık, graft-versus-host hastalığı, organ nakli reddi ve alerji için canlı terapötikler oluşturmak amacıyla insan düzenleyici T hücrelerinde (Treg'ler) yeni kimerik antijen reseptörü (CAR) yapılarını değerlendirmek için kolaylaştırılmış ve standartlaştırılmış bir boru hattı sağlar. Şekil 1, ex vivo genişlemeden sonra Treg soy transkripsiyon faktörleri FOXP3 ve HELIOS'un yüks...
Tartışmalar
Bu protokol, insan kimerik antijen reseptörü düzenleyici T hücrelerinin (CAR Treg'ler) üretilmesi ve değerlendirilmesi için kolaylaştırılmış ve kapsamlı bir metodoloji sağlar. CAR teknolojisinin hematolojik kanserlerin tedavisindeki başarısı, T hücrelerinin immünosupresif alt kümesi olan Tregs'e uygulanmasına ilham vermiştir. Geleneksel T hücrelerinin aksine, Treg'ler bağışıklık tepkilerini inhibe ederek otoimmün hastalık, organ nakli reddi, graft-versus-hos...
Açıklamalar
LMRF bir mucittir ve mühendislik ürünü bağışıklık hücreleri üzerindeki patentlerden telif hakkı almıştır ve Guidepoint Global ve McKesson için danışmanlık yapmıştır. Kalan yazarlar hiçbir rakip çıkar beyan etmezler.
Teşekkürler
LMRF, İnsan Adacığı Araştırma Ağı (HIRN) Tip 1 Diyabette Yükselen Lider hibesi U24DK104162-07, Amerikan Kanser Derneği (ACS) Kurumsal Araştırma Hibesi IRG-19-137-20, Güney Carolina Klinik ve Translasyonel Araştırma (SCTR) Pilot Proje Keşif Hibesi 1TL1TR001451-01, Diyabet Araştırma Bağlantısı (DRC) Hibesi IPF 22-1224 ve Amerika'da Yüzme Hibesi 23-1579 tarafından finanse edilmektedir. RWC, Hücresel, Biyokimyasal ve Moleküler Bilimler eğitim hibesi T32GM132055 ve Hollings Kanser Merkezi Lowvelo Lisansüstü Bursu tarafından desteklenmektedir. Bu çalışma kısmen Akış Sitometrisi ve Hücre Sıralama Ortak Kaynağı, Hollings Kanser Merkezi, Güney Carolina Tıp Üniversitesi (P30 CA138313) tarafından desteklenmiştir. Kaliforniya Üniversitesi, San Francisco'dan (UCSF) Dr. Qizhi Tang'a CAR mutant plazmitlerini hediye ettiği için özel teşekkürler.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Adeno-associated virus (AAV) | Charles River Laboratories | ||
| CAR target-expressing K562 cells | e.g., CD19-K562 | ||
| Cesium-137 irradiator | |||
| Anti-human CD8 PerCP (clone SK1) | Biolegend | 344708 | |
| Anti-human CD4 PE/Cy7 (clone SK3) | Biolegend | 344612 | |
| DynaMag-15 magnet | ThermoFisher | 12301D | |
| Ghost BV510 viability dye | TONBO | 13-0870-T100 | |
| K562 cells | American Type Culture Collection | CCL-243 | |
| 0.5 M EDTA, pH 8.0 | Gibco | 15575020 | |
| 1 M HEPES | Gibco | 15630080 | |
| Ammonium chloride solution | STEMCELL Technologies | 7850 | |
| Anti-human CD127 PE (clone hIL-7R-M21) | BD Biosciences | 557938 | |
| Anti-human CD25 APC (clone BC96) | Biolegend | 302610 | |
| Anti-human CD4 FITC (clone SK3) | Biolegend | 344604 | |
| Anti-human CD71 PE (clone SK1) | Biolegend | 334106 | |
| Anti-human CD8 PerCP (clone SK1) | Biolegend | 344707 | |
| Anti-human CTLA-4 PerCP-e710 | ThermoFisher | 46-1529-42 | |
| Anti-human EGFR APC (clone AY13) | Biolegend | 352905 | |
| Anti-human FOXP3 eFluor 450 | ThermoFisher | 48-4776-42 | |
| Anti-human HELIOS PE | Biolegend | 137216 | |
| Ca2+ and Mg2+ free Dulbecco’s Phosphate Buffered Saline (DPBS) | Gibco | 14190144 | |
| Cell counter (TC20 Automated Cell Counter) | Bio-Rad | 1450102 | |
| Cell Counting Slides | Bio-Rad | 1450016 | |
| CellTrace Violet Cell Proliferation Kit | ThermoFisher | C34571 | |
| DNA LoBind Tubes | Eppendorf | 22431021 | |
| Easy 50 EasySep magnet | STEMCELL Technologies | 18002 | |
| EasySep Human CD4+ T cell Enrichment Kit | STEMCELL Technologies | 19052 | |
| EasySep Human CD8+ T cell Enrichment Kit | STEMCELL Technologies | 19053 | |
| EasySep magnet | STEMCELL Technologies | 18000 | |
| eBioscience Foxp3 transcription factor staining buffer set | ThermoFisher | 00-5523-00 | |
| Falcon Round-Bottom Polystyrene Test Tubes with Cell Strainer Snap Cap, 5 mL | Fisher Scientific | 08-771-23 | 40μm |
| Fetal Bovine Serum (FBS) | Gibco | 26140079 | |
| Flow cytometer | Beckman Coulter | CytoFLEX LX U3-V5-B3-Y5-R3-I2 | |
| Fluorescence-activated cell sorter | BD Biosciences | FACS Aria III Cell Sorter | |
| GlutaMAX | Gibco | 35050061 | |
| Human CD3/28 T Cell Expansion and Activation Dynabeads | Gibco | 11131D | |
| Invitrogen Neon Transfection System | ThermoFisher | 10431915 | |
| Invitrogen Neon Transfection System 100 μL Kit | ThermoFisher | 10114334 | |
| Lentivirus | VectorBuilder | ||
| MEM Non-Essential Amino Acids Solution | Gibco | 11140050 | |
| Myc Tag antibody A647 (clone 9B11) | Cell Signaling Technologies | 2233S | |
| Opti-MEM I Reduced Serum Medium | ThermoFisher | 31985062 | |
| Penicilin-Streptomycin solution | Gibco | 15140122 | |
| Recombinant human interleukin-2 (rhIL-2) | Peprotech | 200-02 | |
| RPMI 1640 medium, no glutamine | Gibco | 11875093 | |
| Sodium pyruvate | Gibco | 11360070 | |
| Spectral Flow Cytometer | Cytek | Northern Lights | |
| TRAC gRNA | Synthego | Sequence (CAGGGTTCTGGATATCTGT) | |
| TrueCut Cas9 Protein v2 | ThermoFisher | A36496 | |
| Trypan Blue solution | Sigma | T8154-100ML | |
| 1/10 Leukopak | STEMCELL Technologies | 200-0092 | 1-2 billion PBMC |
Referanslar
- Zhang, X., Zhu, L., Zhang, H., Chen, S., Xiao, Y. CAR-T cell therapy in hematological malignancies: current opportunities and challenges. Front Immunol. 13, 927153 (2022).
- Cappell, K. M., Kochenderfer, J. N. Long-term outcomes following CAR T cell therapy: what we know so far. Nat Rev Clin Oncol. 20 (6), 359-371 (2023).
- Choi, B. D., et al. Intraventricular CARv3-TEAM-E T cells in recurrent glioblastoma. N Engl J Med. 390 (14), 1290-1298 (2024).
- Brown, C. E., et al. Locoregional delivery of IL-13Ralpha2-targeting CAR-T cells in recurrent high-grade glioma: a phase 1 trial. Nat Med. 30 (4), 1001-1012 (2024).
- Bagley, S. J., et al. Intrathecal bivalent CAR T cells targeting EGFR and IL13Ralpha2 in recurrent glioblastoma: phase 1 trial interim results. Nat Med. 30 (5), 1320-1329 (2024).
- Ghobadinezhad, F., et al. The emerging role of regulatory cell-based therapy in autoimmune disease. Front Immunol. 13, 1075813 (2022).
- Sakaguchi, S., Yamaguchi, T., Nomura, T., Ono, M. Regulatory T cells and immune tolerance. Cell. 133 (5), 775-787 (2008).
- Sakaguchi, S., et al. Regulatory T cells and human disease. Annu Rev Immunol. 38, 541-566 (2020).
- Ferreira, L. M. R., Muller, Y. D., Bluestone, J. A., Tang, Q. Next-generation regulatory T cell therapy. Nat Rev Drug Discov. 18 (10), 749-769 (2019).
- Rosenblum, M. D., Gratz, I. K., Paw, J. S., Abbas, A. K. Treating human autoimmunity: current practice and future prospects. Sci Transl Med. 4 (125), 125sr121 (2012).
- Sawitzki, B., et al. Regulatory cell therapy in kidney transplantation (The ONE Study): a harmonised design and analysis of seven non-randomised, single-arm, phase 1/2A trials. Lancet. 395 (10237), 1627-1639 (2020).
- Spanier, J. A., et al. Tregs with an MHC class II peptide-specific chimeric antigen receptor prevent autoimmune diabetes in mice. J Clin Invest. 133 (18), e168601 (2023).
- Muller, Y. D., et al. Precision engineering of an anti-HLA-A2 chimeric antigen receptor in regulatory T cells for transplant immune tolerance. Front Immunol. 12, 686439 (2021).
- MacDonald, K. G., et al. Alloantigen-specific regulatory T cells generated with a chimeric antigen receptor. J Clin Invest. 126 (4), 1413-1424 (2016).
- Boardman, D. A., et al. Flagellin-specific human CAR Tregs for immune regulation in IBD. J Autoimmun. 134, 102961 (2023).
- Schreeb, K., et al. Study design: human leukocyte antigen Cclass I molecule A(*)02-chimeric antigen receptor regulatory T cells in renal transplantation. Kidney Int Rep. 7 (6), 1258-1267 (2022).
- Zimmerman, C. M., Robino, R. A., Cochrane, R. W., Dominguez, M. D., Ferreira, L. M. R. Redirecting human conventional and regulatory T cells using chimeric antigen receptors. Methods Mol Biol. 2748, 201-241 (2024).
- Tang, Q., et al. Selective decrease of donor-reactive T(regs) after liver transplantation limits T(reg) therapy for promoting allograft tolerance in humans. Sci Transl Med. 14 (669), eabo2628 (2022).
- Bender, C., et al. A phase 2 randomized trial with autologous polyclonal expanded regulatory T cells in children with new-onset type 1 diabetes. Sci Transl Med. 16 (746), eadn2404 (2024).
- Ferreira, L. M. Conference report: Advanced Therapies Week 2023. Regen Med. 18 (4), 297-299 (2023).
- Cochrane, R. W., et al. How to test human CAR T cells in solid tumors, the next frontier of CAR T cell therapy. Methods Mol Biol. 2748, 243-265 (2024).
- Roy, A., Krzykwa, E., Lemieux, R., Neron, S. Increased efficiency of gamma-irradiated versus mitomycin C-treated feeder cells for the expansion of normal human cells in long-term cultures. J Hematother Stem Cell Res. 10 (6), 873-880 (2001).
- Eyquem, J., et al. Targeting a CAR to the TRAC locus with CRISPR/Cas9 enhances tumour rejection. Nature. 543 (7643), 113-117 (2017).
- Negrini, M., Wang, G., Heuer, A., Bjorklund, T., Davidsson, M. AAV Production everywhere: a simple, fast, and reliable protocol for in-house AAV vector production based on chloroform extraction. Curr Protoc Neurosci. 93 (1), e103 (2020).
- Velasco Cardenas, R. M., et al. Harnessing CD3 diversity to optimize CAR T cells. Nat Immunol. 24 (12), 2135-2149 (2023).
- Boomer, J. S., Green, J. M. An enigmatic tail of CD28 signaling. Cold Spring Harb Perspect Biol. 2 (8), a002436 (2010).
- Suhoski, M. M., et al. Engineering artificial antigen-presenting cells to express a diverse array of co-stimulatory molecules. Mol Ther. 15 (5), 981-988 (2007).
- Fung, V. C. W., Rosado-Sanchez, I., Levings, M. K. Transduction of human T cell subsets with lentivirus. Methods Mol Biol. 2285, 227-254 (2021).
- Bailey-Bucktrout, S. L., et al. Self-antigen-driven activation induces instability of regulatory T cells during an inflammatory autoimmune response. Immunity. 39 (5), 949-962 (2013).
- Nakagawa, H., et al. Instability of Helios-deficient Tregs is associated with conversion to a T-effector phenotype and enhanced antitumor immunity. Proc Natl Acad Sci U S A. 113 (22), 6248-6253 (2016).
- Dawson, N. A. J., et al. Functional effects of chimeric antigen receptor co-receptor signaling domains in human regulatory T cells. Sci Transl Med. 12 (557), eaaz3866 (2020).
- Rana, J., et al. CAR- and TRuC-redirected regulatory T cells differ in capacity to control adaptive immunity to FVIII. Mol Ther. 29 (9), 2660-2676 (2021).
- Battaglia, M., Stabilini, A., Tresoldi, E. Expanding human T regulatory cells with the mTOR-inhibitor rapamycin. Methods Mol Biol. 821, 279-293 (2012).
- Brady, B. L., Steinel, N. C., Bassing, C. H. Antigen receptor allelic exclusion: an update and reappraisal. J Immunol. 185 (7), 3801-3808 (2010).
- Samarasinghe, S., et al. Functional characterization of alloreactive T cells identifies CD25 and CD71 as optimal targets for a clinically applicable allodepletion strategy. Blood. 115 (2), 396-407 (2010).
- Voss, K., et al. FOXP3 protects conventional human T cells from premature restimulation-induced cell death. Cell Mol Immunol. 18 (1), 194-205 (2021).
- Collison, L. W., Vignali, D. A. In vitro Treg suppression assays. Methods Mol Biol. 707, 21-37 (2011).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır