Bir Antimikrobiyal Tarama Modeli Olarak Galleria mellonella
Bu Makalede
Özet
Bu çalışma, klinik öncesi antimikrobiyal değerlendirmede kullanılmak üzere G. mellonella enfeksiyon modellerini optimize etmek için standartlaştırılmış bir çerçeve sunmaktadır. Klinik öncesi antimikrobiyal geliştirme hattının bir parçası olarak bir G. mellonella modelinin uygulanması, klinik çalışmalara ilerleyen etkisiz bileşiklerin sayısını azaltabilir.
Özet
Artan küresel antibiyotik direnci sorunuyla mücadele etmek için, yeni antibiyotiklerin hızlandırılmış gelişimi esastır. Mevcut klinik öncesi antimikrobiyal gelişme, klinik çalışmalardan önce veya klinik çalışmalar sırasında uygun olmadığı kanıtlanan önemli sayıda potansiyel müşteri ortaya çıkarmaktadır. Klinik öncesi gelişimin etkinliğini artırmak için ilgili, standartlaştırılmış, erişilebilir ve uygun maliyetli modeller geliştirilmelidir. Galleria mellonella (büyük balmumu güvesi) larvaları, mikrobiyal virülansı değerlendirmek, ilaç toksisite testi yapmak ve yeni antimikrobiyal bileşiklerin in vivo etkinliğini değerlendirmek için bir ön araç olarak hizmet etmek için bir enfeksiyon modeli olarak yaygın olarak kullanılmaktadır. Bu enfeksiyon modelleri, karşılaştırılabilir verime sahip birçok in vitro ekrandan daha fazla biyolojik öneme sahiptir ve antimikrobiyal testler için bir ön ekran olarak kullanıldığında memeli modellerine olan bağımlılığı azaltır. Bu protokol, bakteri türlerine ve tercih edilen antimikrobiyal terapötiklere uygulanabilen G. mellonella enfeksiyon modellerinin optimizasyonu için standartlaştırılmış bir metodolojiyi tanımlar. DSÖ'nün öncelikli patojeni Pseudomonas aeruginosa'yı örnek olarak kullanarak, tekrarlanabilir bir enfeksiyon ve terapötik test modeli geliştirmek için atılabilecek adımları özetliyoruz. Bu, deney kurulumu, numune hazırlama ve enfeksiyon ve tedavi protokolleri ile ilgili önerileri içerir. Bu modelin klinik öncesi antimikrobiyal geliştirme boru hatlarına entegrasyonu, memeli modellerine olan bağımlılığı azaltacak, klinik çalışmalara ulaşan etkisiz bileşiklerin sayısını azaltacak ve nihayetinde klinik öncesi antimikrobiyal geliştirmenin verimliliğini artıracaktır.
Giriş
Galleria mellonella (büyük balmumu güvesi) larvaları, biyolojik bilimlerde mikrobiyal türler için enfeksiyon modelleri olarak ve yeni ilaç bileşiklerinin toksisite testi için yaygın olarak kullanılmaktadır 1,2. Yüksek verime sahip oldukları, insan enfeksiyonunun integral in vivo özelliklerini çoğalttıkları ve araştırmada memeli türlerinin etik kullanımını yöneten azaltma, iyileştirme ve değiştirme ilkelerine uygun olarak memeli modellerine olan bağımlılığı azalttıkları için klinik öncesi bir antimikrobiyal test hattında önemli bir fayda potansiyeline sahiptirler.
Yeni antibiyotiklerin geliştirilmesi, klinik doğrulamadan önce in vitro ve in vivo modellerde kapsamlı klinik öncesi testler gerektirir3. Umut verici klinik öncesi veri paketlerine sahip sadece birkaç yeni ajan kliniğe tercüme edilmektedir ve bu yüksek yıpranma oranına katkıda bulunanlardan biri, klinik öncesi ekranların enfeksiyon ortamlarının karmaşıklıklarını yakalamadaki başarısızlığıdır4. Bu sorunlar sadece antimikrobiyal ajanların kliniğe düşük translasyon oranına değil, aynı zamanda geç evre klinik öncesi tarama sırasında deneysel omurgalı hayvanların kullanımının artmasına da katkıda bulunur. Yeni antimikrobiyallerin klinik öncesi değerlendirmesini iyileştirmek ve pahalı, zaman alıcı, karmaşık ve etik açıdan sorunlu in vivo modellerin kullanımını azaltmak için, omurgalı sistemlerinde teste ilerleyen umut verici olmayan bileşiklerin sayısını azaltan daha iyi erken aşama ilaç tarama araçlarına ihtiyaç vardır.
G. mellonella, dört yaşam evresinden oluşan 8 haftalık kısa bir yaşam döngüsüne sahiptir: yumurta, larvalar, pupa ve yetişkinler, bunların larva formu bu protokoldekullanılır 1. G. mellonella'nın özel ekipman veya özel bir hayvan araştırma tesisi gerektirmeden bir deney boyunca bakımı kolaydır. Kullanımları için etik onay alma zorunluluğu yoktur ve araştırmacılar deney kalitesini iyileştirmek için organizmayı kendi bünyesinde yetiştirebilirler 2,5,6,7. G. mellonella bağışıklık sistemi, 'kendi' ve 'benlik olmayan' uyaranlara yanıt verme yeteneği ile memelilerin doğuştan gelen bağışıklık sistemine çok benzer8. Hemositler, patojenle ilişkili moleküler örüntü tanıma ve müteakip fagositozdan sorumludur ve işlevsel olarak insanlardaki nötrofillerinkine benzer bir rol oynar9. G. mellonella, insanlara dizi homolojisi ile tanımlanan üç tip toll benzeri reseptörü kodlar ve fenoloksidazın melanin10'a aktivasyonu ve polimerizasyonunu takiben kendinden olmayan materyali tanıyan ve lokalize melanizasyon kompleksleri oluşturan kompleman benzeri proteinler üretir. Bu, kütikül melanizasyon ile koyulaştığı için enfeksiyon deneyleri sırasında larva sağlığının görsel bir okuması olarak hizmet edebilir. Bununla birlikte, fenoloksidaz içeren böceklerdeki melanizasyon ekseninin, memelilerdeki tirozinaz-melanin ekseninden önemli ölçüde farklı olduğu belirtilmelidir11,12. Ek olarak, G. mellonella, lizozim ve defensin homologları 13 dahil olmak üzere18 indüklenebilir antimikrobiyal peptit üretir. Bu benzerliğin yanı sıra basit larva bakım prosedürleri ve modelin yüksek verimli doğası, G. mellonella'yı yeni ilaçların değerlendirilmesinde yaygın olarak kullanılan bir organizma haline getirmiştir. Klinik öncesi antibiyotik geliştirmede, G. mellonella, aktif bağışıklığa sahip karmaşık bir ortamda konakçı-patojen-ilaç etkileşimlerini daha doğru bir şekilde modelleyebildikleri için in vitro modellere kıyasla daha fazla faydaya sahiptir.
Şu anda, Avrupa'da G. mellonella'nın standartlaştırılmış araştırma sınıfı tedarikçisi bulunmamaktadır. Araştırmacılar bunun yerine G. mellonella larvalarını yem dükkanlarından satın almalı veya kendi kolonilerini korumalıdır. Kurum içi bir G. mellonella kolonisini koruma yöntemleri tanımlanmış ve deneysel tutarlılığıartırabilse de 5,6,7, bu seçeneğin yalnızca larvaları sık kullananlar için çekici olması muhtemeldir. Bu nedenle, bu protokol, canlı bir yem tedarikçisinden larvaların satın alınmasını takiben deney düzeneğine odaklanmaktadır. Daha erişilebilir olmakla birlikte, bu yöntem deneysel karmaşıklığı artırır ve larvaların tedarikçilerden alındıkları noktada sağlığındaki tutarsızlıklar nedeniyle tahlillere ek değişkenlik getirebilir. Akademisyenlerin, endüstrinin ve düzenleyicilerin klinik öncesi antimikrobiyal geliştirme hattının bir parçası olarak G. mellonella testini kabul etmeleri ve benimsemeleri için, antimikrobiyal etkinliğin optimizasyonu ve değerlendirilmesi için standartlaştırılmış bir sistem gereklidir.
Bu çalışma, antibiyotik gelişimi için bir G. mellonella enfeksiyon modelinin deneysel tasarımını optimize etmektedir. G. mellonella enfeksiyon modelleritanımlanmış olsa da 14,15, mevcut metodoloji, tedarik tutarsızlığının neden olduğu ek karmaşıklığı azaltmak için ek adımları belgelemekte ve yeni antimikrobiyallerin değerlendirilmesi için bir çerçeve sunmaktadır. Bir test vakası olarak, G. mellonella, DSÖ'nün öncelikli bir patojeni olan Pseudomonas aeruginosa ile enfekte edildi ve bir aminoglikozit ajanı (tobramisin) ile tedavi optimize edildi. Şekil 1'de gösterilen bu çerçeve, yeni ajanlarla gelecekteki preklinik antimikrobiyal tarama çalışmaları için bir temel sağlar.
Protokol
Bu çalışmada, Galleria mellonella (büyük balmumu güvesi) larvaları, antibiyotik duyarlılık testi ve akut toksisite denemeleri için model olarak seçilmiştir. Galleria mellonella'nın deneysel kullanımı için herhangi bir etik onay gerekmemektedir. Kullanılan reaktiflerin ve ekipmanın ayrıntıları Malzeme Tablosunda listelenmiştir.
1. Deneysel tasarım
- Çalışmanın yakalamayı amaçladığı larva sağkalımındaki oransal değişime dayalı olarak uygun Galleria mellonella larva grup boyutlarını belirleyin. Tablo 1 , bir Pseudomonas aeruginosa suşu PAO1 enfeksiyon modeli kullanarak sağkalımdaki belirli yüzde değişikliklerini tespit etmek için gereken grup boyutlarını detaylandırmaktadır.
NOT: Yeni bir patojen kullanırken, önce enfekte olmuş ancak tedavi edilmemiş larvaların orantılı sağkalımındaki testler arası değişkenliği belirleyin, çünkü bu numune büyüklüğünün belirlenmesini etkileyecektir.- İki grup PBS kontrolü ekleyin: biri şırınganın keskin ve kullanıma uygun olduğundan emin olmak için enfeksiyonların geri kalanından önce enjekte edilir ve diğeri enfeksiyon grupları arasında uygun sterilizasyonu sağlamak için bakteriyel enfeksiyonlar sırasında veya sonrasında enjekte edilir. Yeni bir patojenle optimize ediliyorsa, ölümün yabancı partiküllere karşı bir bağışıklık tepkisinin sonucu olmadığından emin olmak için ısıl işlem görmüş bir kontrol ekleyin.
NOT: İnsülin şırıngaları enjeksiyonlar için kullanılabilir, bu da küntülenme ve kontaminasyon risklerini azaltır. Bununla birlikte, deneyler rutin olarak yüzlerce G. mellonella kullanabilir ve bu da insülin şırıngalarının kullanımını maliyetli ve savurgan hale getirir. - Antibakteriyel tedaviyi optimize eden çalışmalar için, iki ek kontrol ekleyin: bakterilerle enfekte olmuş ve daha sonra bir araç 'sahte' tedavisi enjekte edilmiş bir grup ve bir kez diğer durumlar için enfeksiyon anında ve bir kez tedavi sırasında olmak üzere araçla iki kez enjekte edilen bir grup.
NOT: İlki tedavi edilmemiş bir kontroldür, ikincisi ise enjeksiyonların neden olduğu herhangi bir travmayı kontrol eder. Künt iğneler kullanıldığında bu tür bir travma daha olasıdır.
- İki grup PBS kontrolü ekleyin: biri şırınganın keskin ve kullanıma uygun olduğundan emin olmak için enfeksiyonların geri kalanından önce enjekte edilir ve diğeri enfeksiyon grupları arasında uygun sterilizasyonu sağlamak için bakteriyel enfeksiyonlar sırasında veya sonrasında enjekte edilir. Yeni bir patojenle optimize ediliyorsa, ölümün yabancı partiküllere karşı bir bağışıklık tepkisinin sonucu olmadığından emin olmak için ısıl işlem görmüş bir kontrol ekleyin.
- G. mellonella'yı canlı bir yem tedarikçisinden sipariş edin veya daha önce açıklandığı gibi bir G. mellonella kolonisi bulundurun 5,6,7. Malzeme Tablosunda listelenen tedarikçi için, planlanan larva sayısının 1,8 katını sipariş edin, çünkü boyuta göre yaklaşık% 33'ü hariç tutulacak ve% 10'u kütikül sterilizasyonunu takiben ölebilir.
- Deneysel kullanımdan önce G. mellonella ağırlık değişkenliğini belirleyin ve ağırlık aralığının ortalamanın bir standart sapmasını aşmadığından emin olun.
NOT: Malzeme Tablosunda listelenmeyen tedarikçiler için, tedarikçinin yeni stok sağlamasını sağlayın.
- Deneysel kullanımdan önce G. mellonella ağırlık değişkenliğini belirleyin ve ağırlık aralığının ortalamanın bir standart sapmasını aşmadığından emin olun.
- Alındıktan sonra, 37 ° C'de inkübasyondan sonra meydana gelen koza olasılığını sınırlamak için G. mellonella'yı oda sıcaklığında saklayın.
NOT: Ticari tedarikçilerden gelen tüm larvalar, daha önce larva sağlığının bir göstergesi olarak kullanılan kozaları oluşturmaz16. - Larvaları alındıktan sonraki 1 hafta içinde kullanın, bu durumda beslenmeye ihtiyaç duymazlar.
NOT: Larva yaşam evresi partiler arasında farklılık gösterse de, çoğu larva pupa olmadan önceki son instar sırasında teslim edilir. Bu aşamada, beslenme önceki aşamalara kıyasla doğal olarak azalır17.
2. G. mellonella larvalarının sterilizasyonu ve seçimi
- Galleria mellonella larvalarını tartın ve larvaların ortalama ağırlığı artı veya eksi bir standart sapma olan 224 mg ± 49.2 mg aralığının dışında kalanları atın. Bu, larvaların yaklaşık% 33'ünün dışlanmasına neden olacaktır.
NOT: Ağırlık değişimi tedarikçiler arasında farklılık gösterebilir. Bu protokolde listelenmeyen tedarikçiler için uygun bir ağırlık aralığı hesaplayın. - Aseptik koşullar altında aşağıdaki adımları gerçekleştirin.
- Bir Petri kabına %70 etanol püskürtün ve tabağın altını kaplayacak kadar olduğundan emin olun.
- G. mellonella'nın yüzeyini 10-20 larvadan oluşan gruplar halinde sterilize edin.
- Her partiyi ayrı ayrı tabağa koyun ve larvalara iki kez% 70 etanol püskürtün.
- Larvaları yuvarlamak için cımbız kullanın ve tam kapsama alanı sağlayın.
- Larvaları etanolden çıkarın ve steril bir Petri kabına koyun. Larvaların kurumasını sağlamak için tabağı açıkta bırakın.
DİKKAT: G. mellonella'yı etanolde 15 saniyeden daha uzun süre bırakmak yüksek mortalite ile sonuçlanacaktır.
- Larvaların yaklaşık% 90'ı 2 saat sonra aktiviteyi geri kazandıktan sonra, geri kazanılan larvaları, Tablo 1'de ayrıntılı olarak açıklanan güç hesaplamalarına göre hayatta kalma değişikliklerinin yeterli şekilde tespit edilmesini sağlayacak büyüklükte gruplara ayırın.
- Sterilizasyondan sonraki 6 saat içinde G. mellonella kullanın.
3. Bakteriyel aşı yoğunluğunun optimize edilmesi
- Enfeksiyondan önce bilinen bir CFU / mL'lik bakteriyel enfeksiyon stoğu hazırlayın. Stok üretme yöntemleri organizmaya göre değişecektir. Burada, Pseudomonas aeruginosa , besin suyunda orta log fazına kadar büyütüldü, aliquoted edildi ve 6 x 107 CFU/mL yoğunlukta donduruldu.
- Enfeksiyon stoğunu oda sıcaklığında 10.000 x g'da 5 dakika santrifüjleyerek peletleyin ve PBS'de yeniden süspanse edin. Her larvaya 10μL inokülum enjekte edildiğini göz önünde bulundurarak, larva başına 10 1-107 CFU'luk bir dizi aşı dozu oluşturmak için bakteri stoğunu on kat seri olarak seyreltin.
NOT: Spesifik aşı doz aralığı, bakteriyel virülansa bağlı olarak değişecektir, ancak burada önerilen aralık çoğu patojenik tür için uygun olmalıdır. İn vitro büyüme hızının belirlenmesi, sıvı kültürdeki suşa özgü büyüme hızı larva mortalitesi ile ilişkili olduğundan, uygun bir doz aralığının seçimine bilgi verilmesine yardımcı olabilir. - Enfeksiyonlara başlamadan önce, aşı yoğunluğunu18 doğru bir şekilde belirlemek için aşıyı bir Miles ve Misra seri seyreltme ile numaralandırın.
- Steril dH2O,% 70 etanol veya steril PBS içeren üç adet 1 mL mikrofüj tüpü hazırlayın. Bunlar, larvaları enjekte etmek için kullanılan şırıngayı sterilize etmek için sürekli olarak kullanılacaktır.
- Steril bir 100 μL Hamilton şırıngayı inceleyin, iğne ucunun keskin olduğundan ve enfeksiyon bölgesinde önemli bir travmaya neden olacak bir kanca geliştirmediğinden emin olun.
DİKKAT: Bir Hamilton şırınga iğne ucu yaklaşık 300 enfeksiyondan sonra bükülmeye başlayacaktır. İğne ucu eğrilmişse değiştirilmelidir. - Enfeksiyonlardan önce şırıngayı dH2O, etanol ve PBS ile sırayla yıkayın, şırınganın maksimum kapasitesini çizin ve atın.
- Yeniden askıya alınan enfeksiyon aşısını vorteksleyin ve Hamilton şırıngasına larva başına 10 μL enjekte etmeye yetecek kadar maksimum 100 μL çekin.
- Her larvaya arka sağ prolegde 10 μL aşı enjekte edin. İğnenin vücuda yaklaşık 2 mm nüfuz ettiğinden emin olun.
NOT: Çeşitli enfeksiyon yöntemleri kullanılabilir. Bunlar, prolegleri açığa çıkarmak için larvayı bir pipet ucu üzerinde tutmayı, şırıngayı statik olarak sabitlemeyi ve G. mellonella'yı elle konumlandırmayı veya serbest elle enjekte etmeyi içerir. - Her bir enfeksiyon seti arasında, kalıntı cilt kommensallerinden kontaminasyonu önlemek için şırıngayı adım 2.5'te ayrıntılı olarak açıklandığı gibi sterilize edin.
- Enfekte larvaları, mikrobiyal büyüme için yeterli bir sıcaklıkta, 20 °C ile 42 °C arasında, G . mellonella'nın hayatta kalması için uygun bir aralık olan bir sıcaklıkta inkübe edin5.
- Ölüm zamanını doğru bir şekilde ölçmek için mortalitenin genellikle ilk gözlendiği zamandan itibaren düzenli aralıklarla G. mellonella sağkalımını izleyin. Bu, bir ilk ekranda değerlendirilmelidir. Ölü larvaları çıkarın ve ölüm zamanlarını kaydedin.
- 18 saate kadar% 50 mortalite ve 72 saate kadar% 80'in üzerinde mortalite sağlayan doza dayalı olarak terapötik bir test çalışması için optimum enfeksiyon dozunu seçin. Bu, yeterli virülans ve uygun bir terapötik pencere sağlarken hızlı bir tek günlük ekranın geliştirilmesine izin verir.
4. Enfekte olmamış larvalarda yeni antimikrobiyal ajanların toksisite testi
- Deneysel olarak enfekte olmuş larvalarla kullanılmadan önce Galleria mellonella'daki yeni antimikrobiyallerin ve seçilen araçların toksisitesini değerlendirin. Varsa, in vitro (örneğin, hücre hattı) toksisite verileri tarafından yönlendirilen, antimikrobiyalin beklenen terapötik aralığını aşan geniş bir doz aralığı hazırlayın.
- Larvalara 10 μL terapötik enjekte edileceğini düşünün. Terapötiğin verildiği konsantrasyonlarla eşleşen konsantrasyonlarda yalnızca araç kontrollerini hazırlayın.
- Sağlıklı, steril G. mellonella'yı , adım 3.2-3.10'da ayrıntılı olarak açıklandığı gibi, farklı antimikrobiyal ve PBS araç konsantrasyonları ile uygun grup boyutlarında enjekte edin. Bu çalışmada kullanılan antimikrobiyal tobramisin idi.
NOT: Çözücü olarak DMSO gerektiren ajan için, standart 22 gauge iğne yerine 26s gauge iğne ile enjekte edin, çünkü daha büyük iğnelerden kaynaklanan travma DMSO kullanırken mortaliteyi artırır. - Güvenli bir dozu, yalnızca PBS enjekte edilen larvalara kıyasla mortalitede önemli bir fark yaratmayan bir doz olarak tanımlayın.
5. G. mellonella bakteriyel enfeksiyonunun bir antimikrobiyal ajan ile tedavisinin optimize edilmesi
- Enfekte larvaların 10 μL'lik bir dozla tedavi edildiğini göz önünde bulundurarak, bir dizi antimikrobiyal ajan dozu hazırlayın. Adım 4'te değerlendirildiği gibi minimum toksisiteye sahip bir dizi doz kullanın.
- Galleria mellonella'yı önceden optimize edilmiş enfeksiyon dozunda uygun gruplarda hazırlamak ve enfekte etmek için bu protokolün 1. ve 2. adımlarını izleyin.
- Enfeksiyondan 2 saat sonra, larvaları hazırlanan antimikrobiyal ajan veya araç kontrol solüsyonu ile tedavi edin. Enfeksiyon sırasında enjekte edilenden karşı prolege enjekte ederek 3.2-3.8 adımlarını izleyin. İğneyi gruplar arasında sterilize edin.
NOT: Güçlü doz-yanıt verileri elde etmek için bu optimizasyon için 2 saatlik tedavi seçildi ve bundan sonra tedavi zamanlamasının optimizasyonu belirlendi19. - G. mellonella sağkalımını 30 dakikalık aralıklarla veya mortalitenin genellikle ilk gözlendiği zamandan itibaren daha sık izleyin. Ölü larvaları çıkarın ve ölüm zamanlarını kaydedin.
- Tedavi grupları arasındaki sağkalım oranlarındaki değişimi hesaplayın. Tedavinin larva mortalitesinde önemli ölçüde değişikliğe yol açıp açmadığını belirlemek için Kaplan-Meier sağkalım analizini kullanın. Çok gruplu analizlerde ikili çokluk için uygun post-hoc düzeltmeyi dahil edin.
6. Enfekte G. mellonella'nın tedavi zamanlamasının optimize edilmesi
- Galleria mellonella'yı önceden optimize edilmiş enfeksiyon dozunda uygun gruplarda hazırlamak için 1. ve 2. adımları izleyin.
- Antimikrobiyal ajanı daha önce adım 4'te optimize edilmiş dozda hazırlayın.
- Enfeksiyondan 2 saat, 4 saat, 6 saat, 9 saat veya 12 saat sonra, tedavi zamanlamasının mortaliteyi nasıl etkilediğini karşılaştırmak için 3.2-3.8 adımlarını izleyerek enfekte larvaları tedavi edin.
- G. mellonella sağkalımını 30 dakikalık aralıklarla veya mortalitenin genellikle ilk gözlendiği zamandan itibaren daha sık izleyin. Ölü larvaları çıkarın ve ölüm zamanlarını kaydedin. Optimum zamanlama, tedavi dozunun ilk optimizasyonunu takiben gözlenen sağkalımı koruyan zamanlamadır.
NOT: Antimikrobiyal etkinliği test ederken G. mellonella, hem tedavi dozunu hem de zamanlamayı ayrı ayrı optimize edin, ikincisindeki tedavi dozunu bilgilendirmek için ilkini kullanın.
Sonuçlar
G. mellonella ağırlığındaki parti değişiminin değerlendirilmesi
Enfeksiyon deneylerinde potansiyel bir istenmeyen varyasyon kaynağı, bireysel deney birimleri (yani larvalar) ve partiler arasındaki boyut farklılıklarından kaynaklanır. Bu varyasyonun etkileri, tedaviye veya enfeksiyon dozlarına göre ağırlığa göre ayarlanarak veya deneylerde kullanılmak üzere yalnızca tanımlanmış bir ağırlık aralığındaki larvaların seçilmesiyle hafifletilebilir. İkinci ayarlama daha pragmatiktir ve doz hazırlama sırasında ortaya çıkabilecek insan hatasına tabi değildir. Larvaları tartmanın ek bir avantajı, tedavi dozlarının larvalara uygulananlardan mg / kg insan eşdeğerlerine dönüştürülmesini sağlamasıdır. Partiler içindeki ve partiler arasındaki varyasyonu ölçmek için, farklı zamanlarda sipariş edilen 50 larvadan oluşan üç parti tartıldı. Her grupta ortalama ağırlık 225.5 mg, 230.54 mg ve 215.86 mg idi ve standart sapmalar sırasıyla 49.1 mg, 53.7 mg ve 44.3 mg idi (Şekil 2A). Partiler arasında ağırlıkta önemli bir fark yoktu. Partiler arasında, ağırlık 107.5 mg ila 341.0 mg arasında değişmekte olup, ortalama 224.0 mg ± 49.2 mg arasındadır.
Tekrarlanabilir sonuçlar elde etmek için, larvalar deneyden önce tartıldı ve ağırlıkları 224 mg ± 49.2 mg ise seçildi, ağırlık aralığı 233.5 mg'dan 98.4 mg'a düşürüldü ve larvaların% 33'ü çıkarıldı. Bu, 100 mg'dan daha büyük ağırlık bantlarına sahip MRSA ile enfekte olmuş larvaların sağkalımında önemli bir değişiklik tanımlayan önceki çalışmalarla uyumludur14,20. Ayrıca, G. mellonella'nın doğum noktasındaki ağırlığını, doğumdan bir hafta sonraki ağırlıkla karşılaştırdık, çünkü herhangi bir önemli kilo değişikliği, larvaların varışta hemen kullanılmadığı durumlarda deneysel sonuçları etkileyebilir. Ortalama G. mellonella ağırlığı 230.54 mg ± 53.7 mg idi. Doğumdan bir hafta sonra, ortalama ağırlık 221.8 mg ± 45.7 mg standart sapma idi (Şekil 2B). Varıştaki ağırlık ile bir hafta sonraki ağırlık arasında anlamlı bir fark yoktu, bu da larvaların doğumdan sonraki ilk hafta içinde herhangi bir noktada deneysel amaçlar için kullanılabileceği sonucuna vardık. Bu sonuçların yalnızca bir tedarikçiden satın alınan G. mellonella'yı temsil ettiğini ve ağırlığın tedarikçiler arasında veya larvalar farklı zamanlarda sipariş edildiğinde önemli ölçüde farklılık gösterebileceğini belirtmek önemlidir.
P. aeruginosa PAO1'in aşı yoğunluğunun optimize edilmesi
Yaygın olarak kullanılan üç laboratuvar suşu, PAO1, PA14 ve PAK ve kronik solunum yolu enfeksiyonu, LESB58 ve IST27-M'den iki klinik izolat dahil olmak üzere dört aşı yoğunluğunda beş P. aeruginosa izolatının virülansı değerlendirildi. Bunlar, Mahenthiralingam ve arkadaşları tarafından geliştirilen CF ile ilgili bir gerinim panelinin parçası olarak kullanıldı.21 ve türün küresel filogenisini temsil eder. Besin suyundaki ön büyüme verileri, kronik enfeksiyondan izole edilenler için daha düşük bir büyüme oranı göstermiştir (Şekil 3). Bunu göz önünde bulundurarak, G. mellonella, PAO1, PA14 ve PAK için 10μl PBS'de 10 1, 102, 103 veya 104 CFU / larva dozları ile 10larvadan oluşan gruplar halinde ve LESB58 ve IST27-M için 102, 103, 104 veya 105 CFU / larva dozları ile enfekte edilmiştir. 10 larvadan oluşan iki gruba da sadece PBS enjekte edildi, bir grup enfeksiyondan önce ve bir grup enfeksiyondan sonra. Enfeksiyonlardan önce PBS enjeksiyonları, kontamine PBS'yi veya iğnelerin Galleria kütikülünden mikrobiyal türlerle kontaminasyonunu kontrol ederken, enfeksiyondan sonra PBS enjeksiyonları, enfeksiyon sürecinde kullanılan bakterilerle iğnelerin herhangi bir kontaminasyonunu kontrol eder. PAO1, PA14 ve PAK için optimal dozlar 10 CFU / larva idi, çünkü daha yüksek yoğunluklar 18 saate kadar% 50'lik > ölümle sonuçlandı (Şekil 4). 10 CFU, enfeksiyon için güvenilir ve tekrarlanabilir bir şekilde hazırlanabilecek en düşük dozdu. İstenen sağkalım kinetiğini elde etmek için daha yüksek dozlarda LESB58 ve IST27-M gerekliydi, bu da bu izolatların in vitro koşullar altında daha yavaş büyümesini ve daha düşük taşıma kapasitesini yansıtıyordu (Şekil 4). Her ikisi için de optimum doz 104 CFU / larva idi. LESB58 ve IST27-M, kronik enfeksiyonları olan bireylerden klinik izolatlardır ve LESB58 daha önce kemirgen modellerinde PAO122'den daha düşük virülans göstermiştir.
Galleria mellonella'da tobramisin ve kolistinin toksisite testi
Yeni antimikrobiyal bileşiklerin etkinliğini değerlendirmeden önce, toksisiteleri, klinik olarak ilgili geniş bir doz yelpazesi enjekte edilerek değerlendirilmelidir. Bu, yüksek toksisiteye sahip bileşiklerin klinik öncesi boru hattının erken aşamalarında testten çıkarılmasına izin verir. Tobramisin ve kolistin, kistik fibrozisli (pwCF) kişilerde P. aeruginosa enfeksiyonunun tedavisi için yaygın olarak uygulandıkları için enfekte olmamış G. mellonella larvalarına karşı değerlendirildi23. Tobramisinin klinik kullanımı, kistik fibrozisi olmayan ağır hasta bireyler için günde 3 mg / kg ile kistik fibrozisi olanlar için her 24 saatte bir 11 mg / kg arasında değişmektedir24,25. Bu değerler, toksisite testi için seçilen 1 mg / kg, 2.5 mg / kg, 5 mg / kg, 10 mg / kg, 25 mg / kg, 50 mg / kg, 100 mg / kg, 250 mg / kg tobramisin ile Galleria mellonella'da dozlama için bir kılavuz olarak kullanılmıştır. Hiçbir konsantrasyonda ölüm gözlenmedi. Yüksek konsantrasyonlarda tobramisinin toksisitesinin olmaması göz önüne alındığında, kolistin toksisitesi daha önce pwCF'nin% 29.8'inde nefro veya nörotoksisite ile ilişkili olduğu için değerlendirildi, yükleme dozu 2.9 (±1.5) mg / kg ve toplam günlük doz 4.1 (±1.1) mg / kg26. Bu, onu toksisite testi için değerli bir aday haline getirdi, ancak insanlarda organa özgü etkiler toksisitenin G. mellonella'ya dönüşmeyebileceğini düşündürdü. Gerçekten de, 1 mg / kg, 2.5 mg / kg, 5 mg / kg, 10 mg / kg, 25 mg / kg, 50 mg / kg, 100 mg / kg ve 250 mg / kg kolistin dozları uygulandığında, 72 saat boyunca larva ölümü gözlenmedi. Bu nedenle, kolistinnihayet 2O'da 2000 mg / kg'da en yüksek çözünürlükte uygulandı. Tüm larvaların ölümü 12 saat içinde gözlendi, bu da ilaç toksisitesinin G. mellonella'da değerlendirilebileceğini, ancak insan toksisitesini tahmin etmeye çalışırken dikkatli olunması gerektiğini doğruladı.
P. aeruginosa PAO1 enfeksiyonuna karşı tobramisin tedavi dozunun optimize edilmesi
Tedavi dozunu optimize etmek için P. aeruginosa ile enfekte olmuş larvalara klinik olarak anlamlı bir dizi tobramisin dozu uygulandı. Yeni antimikrobiyaller için, dozaj başlangıçta benzer mevcut antibiyotiklerin klinik kullanımına veya et suyu minimum inhibitör konsantrasyonları gibi yeni ajan için klinik öncesi verilere dayanarak seçilebilir. P. aeruginosa PAO1'e karşı tobramisin etkinliğini değerlendirmek için, G. mellonella larvaları daha önce optimize edildiği gibi 10 CFU P. aeruginosa PAO1 ile enfekte edildi ve enfeksiyondan 2 saat sonra 1 mg / kg, 2.5 mg / kg veya 5 mg / kg tobramisin enjekte edildi. Bu dozlar, tobramisin ile önceki G. mellonella çalışmasına dayanarak seçilmiştir ve kistik fibrozisi olmayan bireylerde mevcut klinik tobramisin dozları ile uyumludur 24,27,28.
İlk başarı eşiği, tedavi edilmeyen kontrollere kıyasla G. mellonella sağkalımında% 50'lik bir artıştı. 1 mg / kg tobramisin ile PAO1 tedavisinin G. mellonella mortalitesi üzerinde çok az etkisi vardı ve enfeksiyondan 28 saat sonra% 90 ölüm vardı (Şekil 5). 2.5 mg / kg tobramisin ile tedavi mortaliteyi geciktirdi, ancak 5 mg / kg tobramisin ile genelde% 80 mortalite sağladı ve bu da optimal% 90 sağkalım ile sonuçlandı. PA14 için etkili doz 5 mg / kg idi, ancak PAK için 2.5 mg / kg idi. IST27-M için etkili doz 10 mg / kg'da daha yüksekken, larvaları LESB58 enfeksiyonundan kurtarmak için test edilmiş hiçbir tobramisin konsantrasyonu yeterli değildi. Bu eğilim, katyon ayarlı Mueller Hinton et suyunda tobramisin için minimum inhibitör konsantrasyon (MIC) değerleri ile korelasyon gösterdi, burada 1 μg/mL, 8 μg/mL'lik bir MIC'ye sahip olan LESB58 hariç tüm suşlarda büyümenin %90'ını inhibe etmek için yeterliydi. Bu nedenle, ilk MIC testi, suşlar arasındaki nispi direnci belirtmek için kullanılabilir, ancak ayrı ayrı optimize edilmesi gereken G. mellonella'daki doz aralıklarını belirlemek için kullanılmamalıdır.
P. aeruginosa PAO1 enfeksiyonuna karşı tobramisin tedavi zamanlamasının optimizasyonu
Antibiyotiklerin klinik uygulaması tipik olarak enfeksiyondan sonraki saatler içinde değil, günler veya haftalar sonra ortaya çıkar. Yeni antimikrobiyallerin bu şekilde test edilmesi G. mellonella'da mümkün değildir, çünkü P. aeruginosa PAO1 ile enfeksiyondan sonraki 24 saat içinde yüksek mortalite gözlenir. Enfeksiyon modelinin alaka düzeyini artırmak için, yeni antimikrobiyaller enfeksiyon sırasında mümkün olduğunca geç uygulanmalıdır. Tedavi zamanlamalarını optimize etmek için, PAO1 ile enfekte G. mellonella larvalarına enfeksiyondan 2 saat, 4 saat, 6 saat, 9 saat ve 12 saat sonra 5 mg / kg tobramisin uygulandı. Deneysel başarı, antibiyotik tedavisinin PAO1 enfeksiyonuna kıyasla sağkalımda %>50 artış sağlaması olarak tanımlandı. 9. ve 12. saatlerde yapılan tedavi mortaliteyi geciktirdi, ancak enfeksiyonu çözemedi (Şekil 6). 2 saat, 4 saat ve 6 saatte tedavi% 50'nin üzerinde sağkalım sağladı.
G. mellonella grup büyüklüğünün optimizasyonu
Deney grubu büyüklüğü, P. aeruginosa PAO1'in 10 CFU / larvası ile enfeksiyonu takiben G. mellonella sağkalımında gözlenen varyasyona göre hesaplandı. Grup büyüklüğü, herhangi bir çalışmada tedavi edilmeyen kontrol ve tedavi grubu arasındaki beklenen yüzde değişimine bağlı olarak farklılık gösterebilir (Tablo 1). Hesaplamalar, Charan ve ark.29 tarafından tarif edileni takip etti. Kullanılan denklem aşağıda açıklanmıştır.
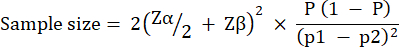
Nerede:
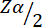 = %5'lik tip 1 hatada 1,96.
= %5'lik tip 1 hatada 1,96.
Zβ = 0.842 %80 istatistiksel güç sağlayan değerdir.
p1 = Test grubundaki olayların oranı, p2 + beklenen yüzde değişim olarak hesaplanır
p2 = Kontrol (tedavi edilmemiş enfeksiyon) grubundaki olayların oranı, P. aeruginosa PAO1 sağkalım değişkenliğine 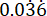 dayalı olarak hesaplanır.
dayalı olarak hesaplanır.
P = (p1 + p2)/2 olarak tanımlanan havuzlanmış yaygınlık.
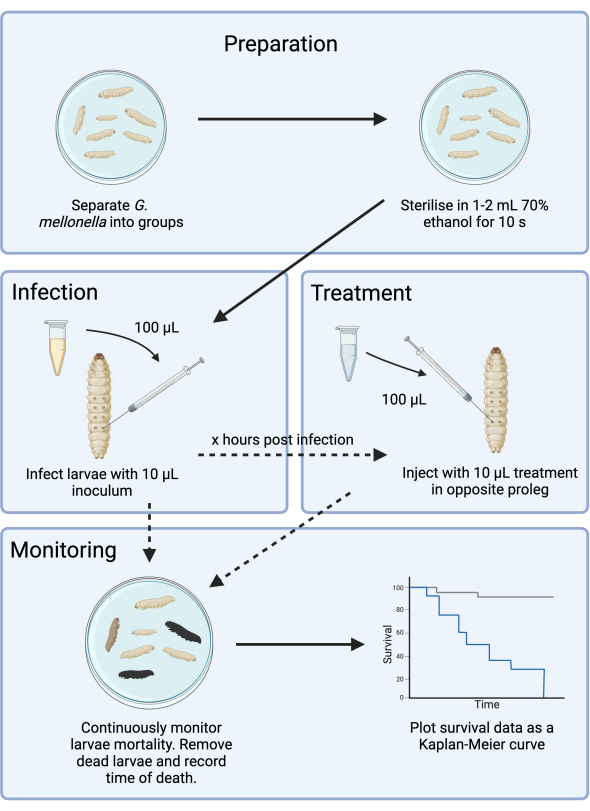
Şekil 1: Bir G. mellonella enfeksiyonu çalışmasının şeması. Genel protokol, enfeksiyondan önce G. mellonella larvalarının hazırlanmasını, 10 μL inokulum ile enfeksiyonu, enfeksiyondan birkaç saat sonra isteğe bağlı tedaviyi ve sürekli izlemeyi içerir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
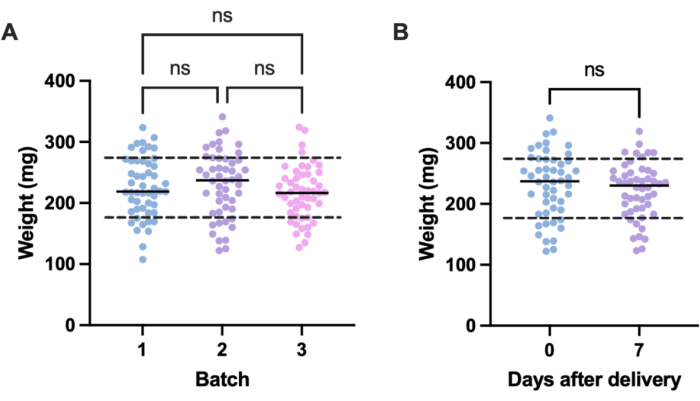
Şekil 2: Galleria mellonella larva ağırlığında toplu ve zamana bağlı değişim. (A) 50 Galleria mellonella larvasından oluşan üç partinin ağırlığı, teslimattan hemen sonra tartılır. Her parti farklı zamanlarda sipariş edildi. Tek yönlü bir ANOVA ile hesaplandığı gibi partiler arasında ağırlıkta anlamlı bir fark yoktu (P > 0.05). (B) Teslim alındıktan sonra tartılan 50 larvanın ağırlığı, bir hafta sonra tartılan aynı partiye kıyasla. Bir öğrencinin t-testi ile hesaplandığında ağırlıkta anlamlı bir fark yoktu (P > 0.05). ns: Önemli değil. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
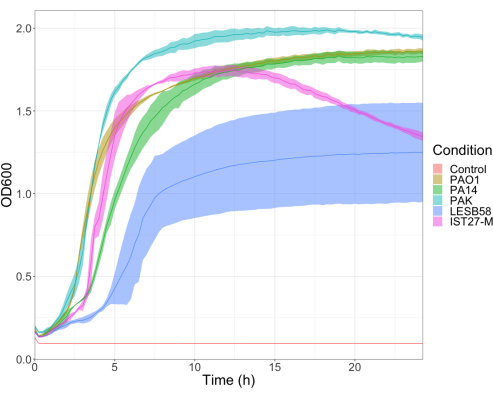
Şekil 3: P. aeruginosa suşları PAO1, PA14, PAK, LESB58 ve IST27-M'nin büyüme eğrileri. Her bir suş, 0.08-0.13'lük bir başlangıç OD600'den LB'de büyütüldü ve OD600 daha sonra 37 ° C'de 24 saatlik statik büyüme sırasında her 15 dakikada bir ölçüldü. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
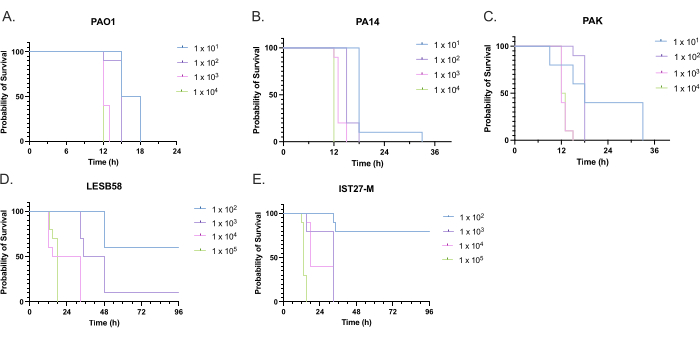
Şekil 4: Galleria mellonella larvalarının enfeksiyonu için Pseudomonas aeruginosa suşlarının aşı yoğunluğunun optimizasyonu. Larva başına farklı yoğunluklarda koloni oluşturan birimler (CFU) ile enjeksiyonu takiben Galleria mellonella larvalarının hayatta kalması. Test edilen aşı yoğunlukları, (A) PAO1, (B) PA14 veya (C) PAK için larva başına 10, 10², 10³ veya 104 CFU ve (D) LESB58 ve (E) IST27-M için larva başına 10², 10³, 104 veya 105 CFU idi. Grup başına on larva kullanıldı ve her birine sağ arka prolegde 10 μL inokülum enjekte edildi. Sağkalım, enfeksiyondan 16 saat sonra başlayarak her 30 dakikada bir izlendi ve ölüm zamanı kaydedildi. Tüm suşlar, anlamlılık için Log-rank (Mantel-Cox) testi ile belirlenen doza bağlı virülans gösterdi. PAK 10 1 vs. hariç tüm suş içi doz karşılaştırmaları için P <0.05. PAK 102, PAK 103'ekarşı PAK 104, LESB58 104'ekarşı. LESB58 105 ve IST27-M 103'ekarşı. IST27-M 104, önemli değildi. Bu rakam üç biyolojik kopyayı temsil etmektedir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
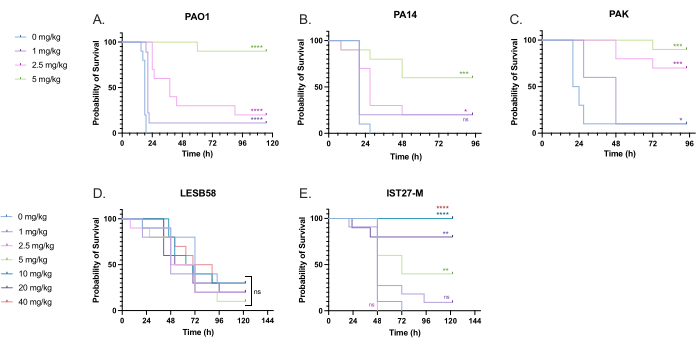
Şekil 5: P. aeruginosa panel suşları ile enjeksiyondan sonra Galleria mellonella larvalarının hayatta kalması ve enfeksiyondan 2 saat sonra tobramisin sülfat ile tedavi. Deney grubu başına 10 G. mellonella larvaları, 10 μL PBS'de larva başına 10 CFU (A) PAO1, (B) PA14 veya (C) PAK veya 103 CFU (D) LESB58 veya (E) IST27-M ile enfekte edildi. Enfeksiyonlar arka sol prolege uygulandı. Enfeksiyondan 2 saat sonra, PAO1, PA14 ve PAK, tedavi gerektirmeyen kontrol olarak 10 μL PBS, 1 mg / kg, 2.5 mg / kg veya 5 mg / kg tobramisin enjekte edildi, LESB58 ve IST27-M ile 10 μL PBS, 1 mg / kg, 2.5 mg / kg, 5 mg / kg, 10 mg / kg, 20 mg / kg veya 40 mg / kg tobramisin, şekilde gösterildiği gibi. Tobramisin distile suda seyreltildi ve sağ arka prolegde uygulandı. Sağkalım sürekli izlendi ve ölüm zamanı kaydedildi. Anlamlılık için log-rank (Mantel-Cox) testi vs. her suş için PBS kontrolü. ns: Önemli değil, *P < 0.05, **P < 0.005, ***P < 0.0005 ****P < 0.0001. Bu rakam üç biyolojik kopyayı temsil etmektedir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
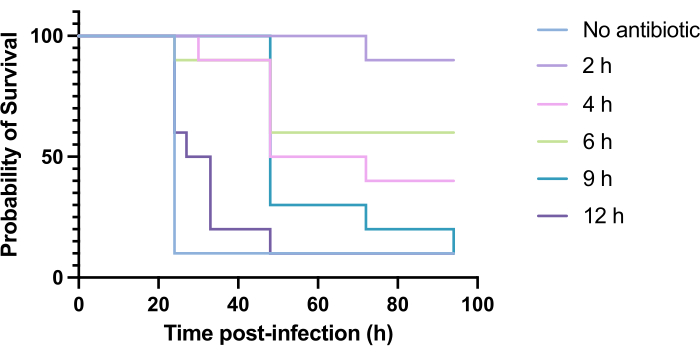
Şekil 6: Pseudomonas aeruginosa PAO1 ile enfeksiyonu takiben Galleria mellonella larvalarının hayatta kalması ve ardından enfeksiyon sonrası çeşitli zaman noktalarında tobramisin ile tedavi. Deney grubu başına 10 G. mellonella larvası, 10 μL PBS'de 10 CFU PAO1 ile enfekte edildi ve arka sağ prolege enjekte edildi. Larvalar daha sonra enfeksiyondan 2 saat, 4 saat, 6 saat, 9 saat veya 12 saat sonra arka sol prolegde 10 μL damıtılmış su içinde 5 mg / kg tobramisin sülfat ile enjekte edildi. Sağkalım sürekli izlendi ve ölüm zamanı kaydedildi. Anlamlılık için log-rank (Mantel-Cox) testi vs. tedavi edilmemiş kontrol. P < 0.0005, ****P < 0.0001. Bu rakam üç biyolojik kopyayı temsil etmektedir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| Sağkalımda beklenen değişim (%) | Grup büyüklüğü |
| 30 | 26 |
| 40 | 18 |
| 50 | 13 |
| 60 | 10 |
| 70 | 8 |
| 80 | 6 |
| 90 | 5 |
| 100 | 4 |
Tablo 1: G. mellonella larvalarının P. aeruginosa PAO1 ile 10 CFU/larva ile enfekte edildiği ve daha sonra bir ajan uygulandığı G. mellonella sağkalım deneyleri için grup büyüklüğü.
Tartışmalar
Antimikrobiyal direncin (AMR) yükü sürekli artmaktadır. 2019'da dünya çapında tahmini 4,95 milyon ölüm AMR ile ilişkilendirildi30. 2050 yılına kadar AMR'nin neden olduğu ölüm oranının 10 milyona ulaşacağı tahmin edilmektedir31. Bu riski ele almak için, yeni antimikrobiyaller verimli ve uygun maliyetli bir şekilde geliştirilmeli ve test edilmelidir, bu da antimikrobiyal etkinliği doğru bir şekilde tahmin eden klinik öncesi modellerin kullanılmasını gerektirir. Klinik çalışmalara çeviri sırasında gözlenen yüksek yıpranma oranı önemli bir sınırlayıcı faktördür. Bir çalışma, klinik çalışmalarda başarısız olan 13 antibiyotik adayını tanımladı ve 11'i faz II32'ye ilerleyemedi.
Bu çalışma, G. mellonella preklinik antimikrobiyal tarama çalışmalarının optimizasyonu için bir çerçeve ve antimikrobiyal etkinliğin değerlendirilmesi için bir yöntem sunmaktadır. G. mellonella larvaları, ilaç toksisitesinin, MIC tayininin ve virülans testinin değerlendirilmesinde önemli bir faydaya sahipken, klinik öncesi gelişimde kullanılan memelilerin azalmasına katkıda bulunur. Galleria mellonella larvaları nispeten yüksek verime sahiptir, biyolojik olarak ilgilidir ve daha karmaşık memeli modellerine iyi bir şekilde çevrilir. Bu arada, vahşi tip laboratuvar fareleri, fare başına ~ 7 £ haftalık bakım ile her biri 8 ila 30 £ arasında bir maliyete sahipken, G. mellonella 50 larva için ~ 2 £ 'a mal oluyor. Bu nedenle, bir G. mellonella modelinde 10 bileşiğin test edilmesi, farelerde aynı çalışma için 4000 £ 'a kıyasla ~ 60 £ 'a mal olacaktır. Ayrıca, önceki çalışmalar yeni bileşiklerin toksisitesini ve etkinliğini karşılaştırmış ve G. mellonella ile farelerde akut toksisite arasında bir korelasyon tespit etmiştir 8,19,33. Bu nedenle, fare modellerinde daha fazla test edilecek bileşiklere öncelik vermek için bir G. mellonella ekranının uygulanması önerilir.
Modelin açık faydasına rağmen, başarılı bir uygulama sağlamak için birkaç husus vardır. Araştırma derecesinde, steril larvaların eksikliği, etanol sterilizasyonu gerektiğinden veya araştırmacıların kontaminasyon riskini azaltacak ve genel deney kalitesini artıracak kendi G. mellonella kolonilerini korumaları gerektiğinden, deneysel kullanım için hazırlıklarını zorlaştırır 5,6. Yanlış sterilizasyon önemli ölçüde mortalite sağlayabilir ve daha uzun etanol maruz kalma süresi ölüme yol açtığından organizmayı tamamen sterilize etmek zordur. Alternatif sterilizasyon yöntemleri, enfeksiyondan önce her bir larvanın proleginin %70 etanol ile temizlenmesini içerir, bu da sterilizasyon sırasında mortaliteyi azaltır, ancak daha emek yoğun bir yöntemdir. Diğer antiseptikler de kullanılabilir, ancak bu çalışmada hiçbir alternatif değerlendirilmemiştir, çünkü etanol sterilizasyonu optimize edildikten sonra %<10 ölüm sağlamıştır. Ayrıca, tedarikçilerin G. mellonella'larını antibiyotiklerle tedavi edip etmedikleri genellikle belirsizdir, çünkü tedarikçiler larvalarını kolonileri kendileri korumak yerine diğer tedarikçilerden temin edebilirler.
G. mellonella biyolojisi, memelilerden önemli ölçüde farklıdır ve bu da faydalarına sınırlamalar getirir. Bağışıklık sistemleri, doğuştan gelen bağışıklığın temel çözünür ve hücresel yönleri mevcut olmasına rağmen, herhangi bir adaptif bağışıklıktan yoksundur. Hemositler, G. mellonella'nın doğuştan gelen temel bir bağışıklık savunmasıdır ve fagosit benzeri özellikler gösterir. Bu hücrelerin, diğerlerinin yanı sıra granülositler ve plazmatositler de dahil olmak üzere çeşitli alt kümeleri tanımlanmıştır34. G. mellonella ayrıca solunum veya mesane enfeksiyonları gibi ilgili enfeksiyon bölgelerini özetleyemez. Bununla birlikte, klinik öncesi bir boru hattında, G. mellonella , fare modellerine bir ön ekran görevi görecek ve yalnızca en umut verici bileşiklerin, insan enfeksiyon ortamlarına daha yakından benzeyen karmaşık memeli sistemine ilerlemesini sağlayacaktır. Son olarak, model, klinik olarak ilgili biyobelirteçlerdeki değişiklikleri değerlendirmek için uygunluğunu belirlemek için G. mellonella'nın daha fazla genomik karakterizasyonundan faydalanacaktır. Özellikle, bu, G. mellonella bağışıklığı hakkındaki anlayışımızı geliştirmeyi gerektirir.
Genel olarak, Galleria mellonella enfeksiyon modeli, memeli modellerinde değerlendirilmeden önce yeni antimikrobiyal bileşiklerin klinik öncesi değerlendirmesi için değerli bir araçtır. Kullanımları, tedarik standardizasyonu eksikliği nedeniyle karmaşık olsa da, uygulamaları yüksek verimli, basittir ve antimikrobiyal geliştirme ortamında geniş çapta uygulanabilir. Gelecekte, bu modelin standartlaştırılmış bir klinik öncesi boru hattına entegrasyonu, klinik öncesi değerlendirmeden klinik çalışmalara ilerleyen adayların oranını artırmak için yeni antimikrobiyal bileşiklerin geliştirilmesini hızlandırabilir.
Açıklamalar
Yazarların ifşa edecek hiçbir şeyi yok.
Teşekkürler
TB, AK, JF ve DN, Stratejik Araştırma Merkezi (SRC) "Kistik fibrozda antimikrobiyal terapötiklerin geliştirilmesi için kanıta dayalı bir preklinik çerçeve" (PIPE-CF; Proje No. SRC 022) UK Cystic Fibrozis Trust ve US Cystic Fibrozis Foundation'dan. LD ve JF, Kuzey Batı Böbrek Araştırmaları'ndan (Proje No. 49/19) fon aldığını kabul etti.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 22s gauge, Small Hub RN Needle, 2 in, point style 2 | Hamilton | 7758-03 | Replacement for the Hamilton syringe. |
| Bacterial infection stocks | Bacterial stocks of a known density (CFU/mL) frozen during mid-exponential phase of growth. | ||
| Ethanol | Fisher Scientific | 10610813 | Other manufacturers may be used. |
| G. mellonella larvae | Livefoods | 5.06045E+12 | For this supplier, orders are marked as “New stock for lab use”. As of April 2024, new stock is delivered to the supplier on Mondays. Orders should be placed then, for delivery on Wednesdays. |
| Microliter syringe | Hamilton | 80630 | The 80630 syringe has a 100 µL capacity. Other volumes exist, such as the 80430, 80530 or 80730. |
| Petri dish | Fisher Scientific | 12674785 | Other manufacturers may be used. |
Referanslar
- Menard, G., Rouillon, A., Cattoir, V., Donnio, P. Y. Galleria mellonella as a suitable model of bacterial infection: Past, present and future. Front Cell Infect Microbiol. 11, 782733 (2021).
- Piatek, M., Sheehan, G., Kavanagh, K. Galleria mellonella: The versatile host for drug discovery, in vivo toxicity testing and characterizing host-pathogen interactions. Antibiotics. 10 (12), 1545 (2021).
- Miethke, M., et al. Towards the sustainable discovery and development of new antibiotics. Nat Rev Chem. 5 (10), 726-749 (2021).
- Seyhan, A. A. Lost in translation: The valley of death across preclinical and clinical divide - identification of problems and overcoming obstacles. Transl Med Commun. 4 (1), (2019).
- Firacative, C., et al. Rearing and maintenance of Galleria mellonella and its application to study fungal virulence. J Fungus. 6 (3), 130 (2020).
- Pereira, M. F., Rossi, C. C. Overview of rearing and testing conditions and a guide for optimizing Galleria mellonella breeding and use in the laboratory for scientific purposes. APMIS. 128 (12), 607-620 (2020).
- Jorjão, A. L., et al. From moths to caterpillars: Ideal conditions for Galleria mellonella rearing for in vivo microbiological studies. Virulence. 9 (1), 383-389 (2018).
- Tsai, C. J. -. Y., Loh, J. M. S., Proft, T. Galleria mellonella infection models for the study of bacterial diseases and for antimicrobial drug testing. Virulence. 7 (3), 214-229 (2016).
- Gallorini, M., et al. Immunophenotyping of hemocytes from infected Galleria mellonella larvae as an innovative tool for immune profiling, infection studies and drug screening. Sci Rep. 14, 759 (2024).
- Smith, F. Q., Casadevall, A. Fungal immunity and pathogenesis in mammals versus the invertebrate model organism Galleria mellonella. Pathog Dis. 79 (3), ftab013 (2021).
- Sugumaran, M. Comparative biochemistry of eumelanogenesis and the protective roles of phenoloxidase and melanin in insects. Pigment Cell Res. 15 (1), 2-9 (2002).
- Sheehan, G., Garvey, A., Croke, M., Kavanagh, K. Innate humoral immune defences in mammals and insects: The same, with differences. Virulence. 9, 1625-1639 (2018).
- Wright, C. L., Kavanagh, O. Galleria mellonella as a novel in vivo model to screen natural product-derived modulators of innate immunity. Appl Sci. 12 (13), 6587 (2022).
- Newton, S. M., et al. Use of the invertebrate Galleria mellonella as an infection model to study the Mycobacterium tuberculosis complex. J Vis Exp. (148), e59703 (2019).
- Frankel, G., Collins, J. W., Schroeder, G. N., Harding, C. R. Use of Galleria mellonella as a model organism to study Legionella pneumophila infection. J Vis Exp. (81), e50964 (2013).
- Romera, D., et al. The Galleria mellonella infection model as a system to investigate the virulence of Candida auris strains. Pathog Dis. 78 (9), ftaa067 (2020).
- Kwadha, C. A., Ong'amo, G. O., Ndegwa, P. N., Raina, S. K., Fombong, A. T. The biology and control of the greater wax moth, Galleria mellonella. Insects. 8 (2), 61 (2017).
- Miles, A. A., Misra, S. S., Irwin, J. O. The estimation of the bactericidal power of the blood. J Hyg. 38, 732-749 (1938).
- Ignasiak, K., Maxwell, A. Galleria mellonella (greater wax moth) larvae as a model for antibiotic susceptibility testing and acute toxicity trials. BMC Res Notes. 10 (1), 428 (2017).
- Hesketh-Best, P. J., Mouritzen, M. V., Shandley-Edwards, K., Billington, R. A., Upton, M. Galleria mellonella larvae exhibit a weight-dependent lethal median dose when infected with methicillin-resistant Staphylococcus aureus. Pathog Dis. 79 (2), ftab003 (2021).
- Mahenthiralingam, E., Weiser, R., Floto, R. A., Davies, J. C., Fothergill, J. L. Selection of relevant bacterial strains for novel therapeutic testing: a Guidance document for priority cystic fibrosis lung pathogens. Curr Clin MicrobiolRep. 9 (4), 33-45 (2022).
- Carter, M. E. K., et al. A subtype of a Pseudomonas aeruginosa cystic fibrosis epidemic strain exhibits enhanced virulence in a murine model of acute respiratory infection. J Infect Dis. 202 (6), 935-942 (2010).
- Herrmann, G., et al. Colistin-tobramycin combinations are superior to monotherapy concerning the killing of biofilm Pseudomonas aeruginosa. J Infect Dis. 202 (10), 1585-1592 (2010).
- Hennig, S., Standing, J. F., Staatz, C. E., Thomson, A. H. Population pharmacokinetics of tobramycin in patients with and without cystic fibrosis. Clin Pharmacokinet. 52 (4), 289-301 (2013).
- Reyhanoglu, G., Reddivari, A. K. R. . Tobramycin. , (2023).
- Crass, R. L., Rutter, W. C., Burgess, D. R., Martin, C. A., Burgess, D. S. Nephrotoxicity in patients with or without cystic fibrosis treated with polymyxin b compared to colistin. Antimicrob Agents Chemother. 61 (4), e02329-e02416 (2017).
- Deacon, J., et al. Antimicrobial efficacy of tobramycin polymeric nanoparticles for Pseudomonas aeruginosa infections in cystic fibrosis: Formulation, characterization and functionalization with dornase alfa (DNase). J Control Release. 198, 55-61 (2015).
- Tamma, P. D., et al. Infectious Diseases Society of America 2022 guidance on the treatment of extended-spectrum β-lactamase producing enterobacterales (ESBL-E), carbapenem-resistant enterobacterales (CRE), and Pseudomonas aeruginosa with difficult-to-treat resistance (DTR-P. aeruginosa). Clin Infect Dis. 75 (2), 187-212 (2022).
- Charan, J., Kantharia, N. D. How to calculate sample size in animal studies. J PharmacolPharmacother. 4 (4), 303-306 (2022).
- Murray, C. J. L., et al. Global burden of bacterial antimicrobial resistance in 2019: A systematic analysis. Lancet. 399 (10325), 629-655 (2022).
- de Kraker, M. E. A., Stewardson, A. J., Harbarth, S. Will 10 million people die a year due to antimicrobial resistance by 2050. PLoS Med. 13 (11), e1002184 (2016).
- Prasad, N. K., Seiple, I. B., Cirz, R. T., Rosenberg, O. S. Leaks in the pipeline: A failure analysis of gram-negative antibiotic development from 2010 to 2020. Antimicrob Agents Chemother. 66 (5), e0005422 (2022).
- Wang, S., et al. A novel Galleria mellonella experimental model for zoonotic pathogen Brucella. Virulence. 14 (1), 2268496 (2023).
- Senior, N. J., Titball, R. W. Isolation and primary culture of Galleria mellonella hemocytes for infection studies. F1000Res. 9, 1932 (2021).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır