0:03
Concepts
2:33
Preparation of Materials and Dissection
3:39
Immune Cell Isolation
5:22
Magnetic Labeling of Immune Cells
6:59
Magnetic Separation of CD3-Positive Cells
7:48
Evaluation of Target-Cell Enrichment by Flow Cytometry
9:00
Data Analysis
מיון תאים המופעל מגנטי (MACS): בידוד של לימפוציטים T תימיים
מקור: מונירסילבן 1,2,3, פרצ'טתיבו 1,2,3, סופינובולט 4, רחל גולוב1,2,3
יחידה אחת ללימפופוליס, המחלקה לאימונולוגיה, מכון פסטר, פריז, צרפת
2 INSERM U1223, פריז, צרפת
3 100é Paris Diderot, סורבון פריז סיטה, צ'רול פסטר, פריז, צרפת
4 פלטפרום ציטומטריה זרימה, ציטומטריה וסמנים ביולוגיים UtechS, המרכז למדע תרגום, מכון פסטר, פריז, צרפת
הגנה מפני פתוגנים תלויה במעקב של מערכת החיסון. מערכת זו מורכבת וכוללת סוגי תאים רבים, כל אחד עם פונקציות ספציפיות. הרכב מורכב זה מאפשר תגובות חיסוניות למגוון גדול של פתוגנים ופציעות. חסינות אדפטיבית מאפשרת תגובות ספציפיות נגד פתוגנים ספציפיים. רוב התאים האחראים לסוג זה של חסינות הם הלימפוציטים (תאי B ותאי T). בדרך כלל, תאי B מגיבים לזיהומים חוץ תאיים (כגון זיהומים חיידקיים), ותאי T מגיבים לזיהומים תאיים (כגון זיהומים ויראליים). סוגים שונים של תאים באוכלוסיות לימפוציטים יכולים להתאפיין בשילוב של חלבוני פני התא שהם מבטאים ו / או על ידי פאנל של ציטוקינים מופרשים.
מיון מגנטי מאפשר העשרה של אוכלוסיות תאים ממוקדות באמצעות תכונות מגנטיות וביטוי של חלבון אחד או כמה חלבונים על פני התא (1, 2). טכניקה זו מורכבת משלושה שלבים. ראשית, התאים הם דגירה עם חרוזים מגנטיים כי הם יחד עם נוגדנים אחד או כמה חד שבטיים ספציפיים. תאים המבטאים חלבוני שטח שנקשרים לנוגדנים אלה מתחברים חרוזים מגנטיים. לאחר מכן, אוכלוסיות התאים הממוקדות נלכדות עם מגנט. כדי לסיים, התאים הממוקדים נבחנים מהמגנט. בסוף מתקבלים שני מוצרי מיון, אחד המכיל תאים ללא תווית והשני המכיל את תאי היעד בשילוב עם החרוזים המגנטיים. עמודות ניתן להשתמש כדי לשפר את היעילות של מיון מגנטי. בעמודה, רכיב לא מגנטי מאריך את נתיב התא דרך העמודה. לפיכך, זרימת התא מואטת, מקלה על לכידת התא על ידי המגנט.
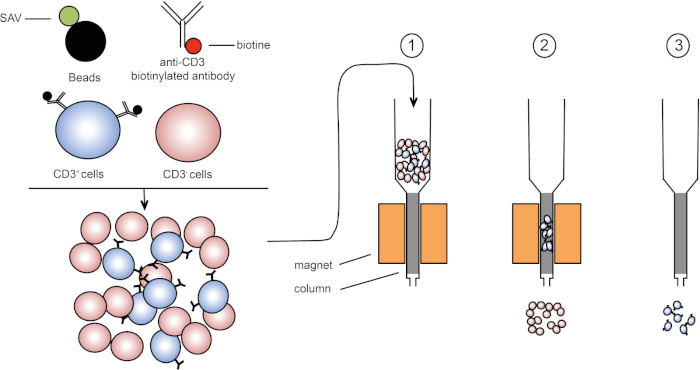
איור 1: ייצוג סכמטי של הפרדה מגנטית. לויקוציטים תימיים מוכתמים בנוגדנים ביוטינילים נגד CD3. לאחר הכביסה, סטרפטאבידין (SAV) חרוזים מצמידים במיוחד לתקן את הביוטין על נוגדנים נגד CD3. (1) תאים מועברים בעמודה. (2) המגנט אינו שומר על תאים ללא תווית, בעוד שתאים חיוביים CD3 נשארים בעמודה. לבסוף, העמודה מופרדת מהמגנט ו-(3) תאים חיוביים ל- CD3 נבחנים בינוניים. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
ישנם שני סוגים של מיון מגנטי (3). במיון חיובי, תאים מעניינים נלכדים עם החרוזים המגנטיים. במיון שלילי, תאים לא רצויים מוסרים על ידי לכידה עם החרוזים המגנטיים הנושאים את הנוגדנים המתאימים. טכניקת MACS זו מאפשרת העשרה טובה של תאים ממוקדים ומשפרת את אחוז התאים התאושש מ 1-20% ל 60-98% באיבר. לאחר המיון, יש צורך לאמת את טוהר התא ומיון לפי שיטות שונות (למשל cytometry זרימה). טכניקת MACS אידיאלית להעשרת אוכלוסיית יעד לניסויים אחרים כגון תרבית תאים או ניתוח מחזור תאים.
בתרגיל מעבדה זה, אנו מדגימים כיצד לבודד לויקוציטים תימיים ולאחר מכן להעשיר תאים חיוביים CD3 תימי מהתערובת באמצעות טכניקת מיון תאים מגנטיים.
1. הכנה
- לפני שתתחילו, לבשו כפפות מעבדה וביגוד מגן מתאים.
- לשטוף את כל כלי הניתוח, תחילה עם חומר ניקוי ולאחר מכן עם 70% אתנול ולאחר מכן לייבש אותם עם מגבת נייר נקי.
- הכן 200 מ"ל של תמיסת המלח המאוזנת של האנק (HBSS) המכילה 2% סרום עגל עוברי (FCS).
2. ניתוח
...בפרוטוקול זה, תאים חיוביים CD3 הועשרו מלוקוציטים תימיים באמצעות מיון תאים מגנטיים (איור 1). לפני העשרת תאים מגנטיים CD3 תאים חיוביים ייצגו 53.6% מכלל התאים התימין (איור 2, לוחות עליונים). לאחר העשרת התא המגנטי, אחוז התאים החיוביים ל-CD3 עלה ל-95% (איור 2, החלוניות התחתונות). לכן, MACS היא ...
טכנולוגיית הפרדה מגנטית היא שיטה נפוצה למיין בקלות ובמהירות אוכלוסיית תאי יעד. באמצעות תאי T נוגדנים ספציפיים וחרוזים מגנטיים העשרנו את תדירות תאי ה- T במדגם שלנו. שיעור הטוהר בסוף הניסוי תלוי באחוז תאי היעד בהשעיית התא הראשונית. תאים המתקבלים לאחר מיון תאים מגנטיים יכולים לשמש למטרות שונ?...
- Owen, C. S. and Sykes, N. L. Magnetic labeling and cell sorting. Journal of Immunological Methods. 73 (1), 41-48 (1984).
- Miltenyi, S., Müller, W., Weichel, W. and Radbruch, A. High gradient magnetic cell separation with MACS. Cytometry. 11 (2), 231-238 (1990).
- Plouffe, B. D., Murthy, S. K. and Lewis, L. H. Fundamentals and application of magnetic particles in cell isolation and enrichment: a review. Reports on Progress in Physics. 78 (1), (2014).
Explore More Videos
ABOUT JoVE
Copyright © 2024 MyJoVE Corporation. All rights reserved