Plaque Assay: A Method to Determine Viral Titer as Plaque Forming Units (PFU)
Source: Tilde Andersson1, Rolf Lood1
1 Department of Clinical Sciences Lund, Division of Infection Medicine, Biomedical Center, Lund University, 221 00 Lund, Sweden
Viruses that infect prokaryotic organisms, called bacteriophages or simply phages, were identified in the early 20th century by Twort (1) and d'Hérelle (2) independently. Phages have since been widely recognized for their therapeutic value (3) and their influence on human (4), as well as global, ecosystems (5). Current concerns have fueled a renewed interest in the use of phages as an alternative to modern antibiotics in treatment of infectious disease (6). Essentially all phage research relies on the ability to purify and quantify viruses, also known as a viral titer. Initially described in 1952, this was the purpose of the plaque assay (7). Decades and multiple technological advancements later, the plaque assay remains one of the most reliable methods for determination of viral titer (8).
Bacteriophages subsist by injecting their genetic material into host cells, hijacking the machineries for production of new phage particles, and eventually causing the host to release numerous progeny virions through cell lysis. Because of their minute size, bacteriophages cannot be observed using solely light microscopy; therefore, scanning electron microscopy is required (Figure 1). Additionally, phages cannot be cultivated on nutritional agar plates like bacteria, as they need host cells to prey on.
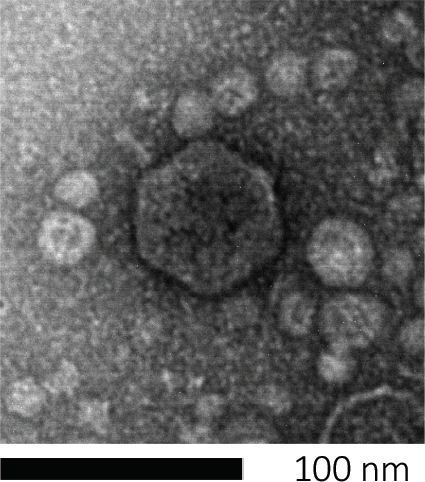
Figure 1: The morphology of a bacteriophage, here exemplified by an E. coli phage, can be studied using scanning electron microscopy. Most bacteriophages belong to Caudovirales (tailed bacteriophages). This particular phage has a very short tail structure and an icosahedral head, placing it in the family of Podoviruses.
The plaque assay (Figure 2) is based on incorporation of host cells, preferentially in log-phase growth, into the medium. This creates a dense, turbid layer of bacteria able to sustain viral growth. An isolated phage can subsequently infect, replicate within, and lyse one cell. With each lysed cell, multiple adjacent ones become immediately infected. Several cycles in, a clear zone (a plaque) can be observed in the otherwise turbid plate (Figure 2B/Figure 3A), indicating the presence of what was initially a single bacteriophage particle. The number of plaque forming units per volume (i.e. PFU/mL) of a sample, can thus be determined from the number of plaques generated.
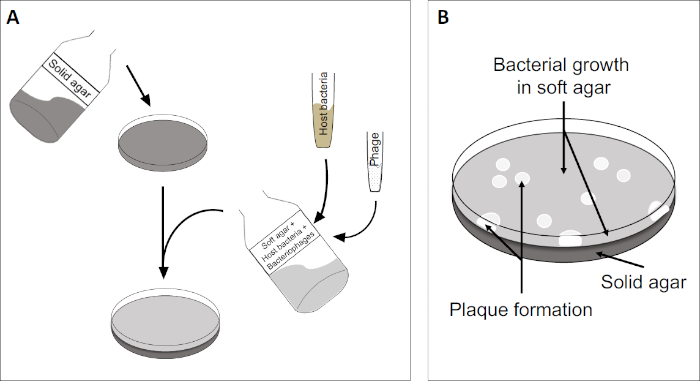
Figure 2: Testing for plaque forming units (PFU) is a common method for determining the number of bacteriophages in a sample. (A) The base of a sterile Petri dish is covered with an appropriate solid nutrient medium, followed by a mixture of soft media, susceptible host cells and a dilution of the original bacteriophage sample. Note that the phage-suspension could, in some cases, also be evenly spread-out across the surface of already solidified soft agar. (B) Growth of the host bacteria forms a lawn of cells in the top agar layer. Bacteriophage replication generates clear zones, or plaques, caused by host cell lysis.
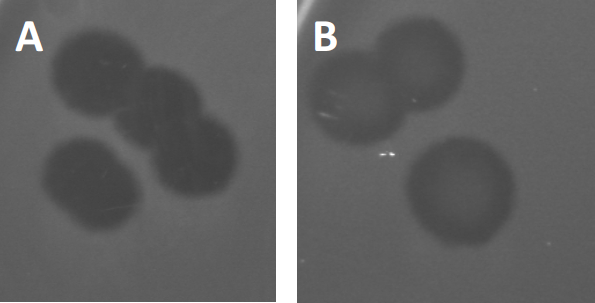
Figure 3: Results from PFU-testing show multiple plaques generated by bacteriophages. Due to lysis of susceptible host cells, plaques can be seen as clearing zones in the bacterial lawn, either with (A) full clearance, or (B) partial re-growth caused by generation of resistant bacteria (or possibly by temperate phages in the lysogenic cycle).
Certain temperate phages can adopt what is referred to as a lysogenic lifecycle, in addition to the formerly described lytic growth. In lysogeny, the virus assumes a latent state through incorporation of its genetic material into the genome of the host cell (9), often conferring resistance to further phage infections. This is sometimes revealed through a slight clouding of the plaque (Figure 3B). It is worth noting however, that plaques can also appear blurred due to re-growth of bacteria that have evolved resistance to the phage independent of previous phage infections.
Viruses can attach, or adsorb, to only a limited range of host bacteria (10). Host ranges are further limited by intracellular anti-viral strategies such as the CRISPR-Cas system (11). The resistance/sensitivity towards specific phages displayed by bacterial subgroups has historically been used to categorize bacterial strains into different phage types (Figure 4). Although the effectiveness of this method has now been surpassed by novel sequencing techniques, phage typing can still provide valuable information about bacteria-phage interactions, for instance, facilitating the design of a phage cocktail for clinical usage.
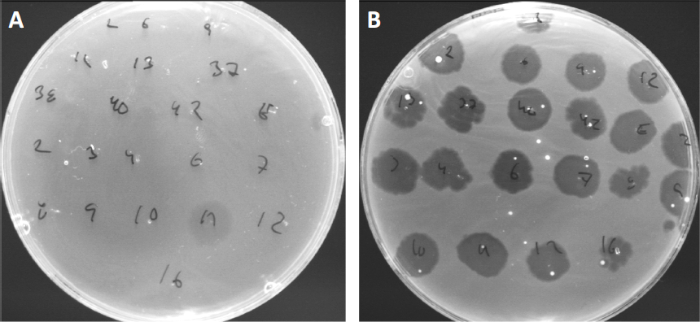
Figure 4: Phage sensitivity of different bacterial strains. Soft agar plates with Cutibacterium acnes strain (A) AD27 and (B) AD35, were spotted with 21 different C. acnes bacteriophages. Only phage 11 were able to infect and kill AD27 while strain AD35 showed sensitivity towards all phages. This technique, termed phage typing, can be used to divide bacterial species and strains into different subgroups based on phage susceptibility.
1. Set-up
- Before commencing any work involving microbes, make sure that the work space is sterilized (e.g. wiped with 70% ethanol). Always wear a lab coat and gloves, keep long hair tied back, and ensure that any wounds are particularly well protected.
- When finished, sterilize all surfaces and thoroughly wash/sterilize hands and wrists.
2. Protocol
- LB Media preparation
Note:
Despite multiple technological advances, plaque assays remain the gold standard for determination of viral titer (as PFU) and essential for isolation of pure bacteriophage populations. Susceptible host cells are cultivated in the top coat of a two layered agar-plate, forming a homogenous bed enabling viral replication. The initial event where an isolated bacteriophage in lytic lifecycle infects a cell, replicates within it, and eventually lyses it, is too small to observe. However, the virions released will infect adjace
- Twort, F. An investigation on the nature of ultra-microscopic viruses. Lancet. 186 (4814): 1241-1243. (1915)
- d'Hérelle, F. An invisible antagonist microbe of dysentery bacillus. Comptes Rendus Hebdomadaires Des Seances De L Academie Des Sciences. 165: 373-375. (1917)
- Cisek AA, Dąbrowska I, Gregorczyk KP, Wyżewski Z. Phage Therapy in Bacterial Infections Treatment: One Hundred Years After the Discovery of Bacteriophages. Current Microbiology. 74 (2):277-283. (2017)
- Mirzaei MK, Maurice CF. Ménage à trois in the human gut: interactions between host, bacteria and phages. Nature Reviews Microbiology. 15 (7):397. (2017)
- Breitbart M, Bonnain C, Malki K, Sawaya NA. Phage puppet masters of the marine microbial realm. Nature Microbiology. 3 (7):754-766. (2018)
- Leung CY, Weitz JS. Modeling the synergistic elimination of bacteria by phage and the innate immune system. Journal of Theoretical Biology. 429:241-252. (2017)
- Dulbecco R. Production of Plaques in Monolayer Tissue Cultures by Single Particles of an Animal Virus. Proceedings of the National Academy of Sciences of the United States of America. 38 (8):747-752. (1952)
- Juarez D, Long KC, Aguilar P, Kochel TJ, Halsey ES. Assessment of plaque assay methods for alphaviruses. J Virol Methods. 187 (1):185-9. (2013)
- Clokie MRJ, Millard AD, Letarov AV, Heaphy S. 2011. Phages in nature. Bacteriophage. 1 (1):31-45. (2011)
- Moldovan R, Chapman-McQuiston E, Wu XL. On kinetics of phage adsorption. Biophys J. 93 (1):303-15. (2007)
- Garneau JE, Dupuis M-È, Villion M, Romero DA, Barrangou R, Boyaval P, Fremaux C, Horvath P, Magadán AH, Moineau S.. The CRISPR/Cas bacterial immune system cleaves bacteriophage and plasmid DNA. Nature. 468 (7320):67. (2010)
Skip to...
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved