13.4 : تحديد ترتيب التفاعل
تصف قوانين المعدل العلاقة بين معدل التفاعل الكيميائي وتركيز المواد المتفاعلة فيه. في قانون المعدل ، يتم تحديد ثابت المعدل k وأوامر التفاعل بشكل تجريبي من خلال ملاحظة كيفية تغير معدل التفاعل مع تغير تركيزات المواد المتفاعلة. نهج تجريبي شائع لتحديد قوانين المعدل هو طريقة المعدلات الأولية. تتضمن هذه الطريقة قياس معدلات التفاعل لتجارب تجريبية متعددة أجريت باستخدام تركيزات مختلفة من المتفاعلات الأولية. تسمح مقارنة المعدلات المقاسة لهذه التجارب بتحديد أوامر التفاعل ، وبالتالي ، ثابت المعدل ، اللذين يتم استخدامهما معًا لصياغة قانون معدل.
معدل تفاعل ما، على سبيل المثال، يتضمن أكسيد النيتريك مع الأوزون [NO (g) + O3 (g) ⟶ NO2 (g) + O2 (g)] يمكن تحديده من البيانات التجريبية لطريقة المعدلات, الأولية في المختبر.
| Trial | [NO] (mol/L) | [O3] (mol/L) | Δ[NO2]/Δt (mol/L·s) |
| 1 | 1.00 × 10−6 | 3.00 × 10−6 | 6.60 × 10−5 |
| 2 | 1.00 × 10−6 | 6.00 × 10−6 | 1.32 × 10−4 |
| 3 | 1.00 × 10−6 | 9.00 × 10−6 | 1.98 × 10−4 |
| 4 | 2.00 × 10−6 | 9.00 × 10−6 | 3.96 × 10−4 |
| 5 | 3.00 × 10−6 | 9.00 × 10−6 | 5.94 × 10−4 |
من بيانات المعدّل، قانون معدل عام؛ المعدّل = k[NO]m[O3]n يمكن تشكيله. يمكن تحديد قيم أمري التفاعل m و n وثابت المعدل k من البيانات التجريبية باستخدام عملية من ثلاثة أجزاء:
في الخطوة 1، يتم تحديد قيمةm من البيانات التي تتغير فيها [NO] وتكون [O3] ثابتة. في التجارب 3 و 4 و 5، تختلف [NO] بينما يظل [O3] ثابتًا. عندما تتضاعف [NO] من التجربة 3 إلى 4، يتضاعف المعدل، وعندما يتضاعف [NO] ثلاث مرات من التجربة 3 إلى 5 ، يتضاعف المعدل أيضًا ثلاث مرات. وبالتالي، فإن المعدل أيضًا يتناسب طرديًا مع [NO] ، و m في قانون المعدل يساوي 1.
في الخطوة 2، يتم تحديد قيمة n من البيانات التي يتنوع فيها [O3] ويكون [NO] ثابتًا. في التجارب 1 و 2 و 3 ، تكون [NO] ثابتة وتختلف [O3]. يتغير معدل التفاعل بالتناسب المباشر مع التغيير في [O3]. عندما يتضاعف [O3] من التجربة 1 إلى 2 ، يتضاعف المعدل؛ عندما يتضاعف [O3] ثلاث مرات من التجربة 1 إلى 3 ، يزداد المعدل أيضًا ثلاث مرات. وبالتالي ، فإن المعدل يتناسب طرديًا مع [O3]، و n يساوي 1. قانون المعدل هو: المعدّل = k [NO]1 [O3]1 = k [NO][O3]
في الخطوة 3، يتم تحديد قيمة k من مجموعة واحدة من التركيزات (على سبيل المثال ، البيانات من التجربة 1) والمعدل المقابل لها.
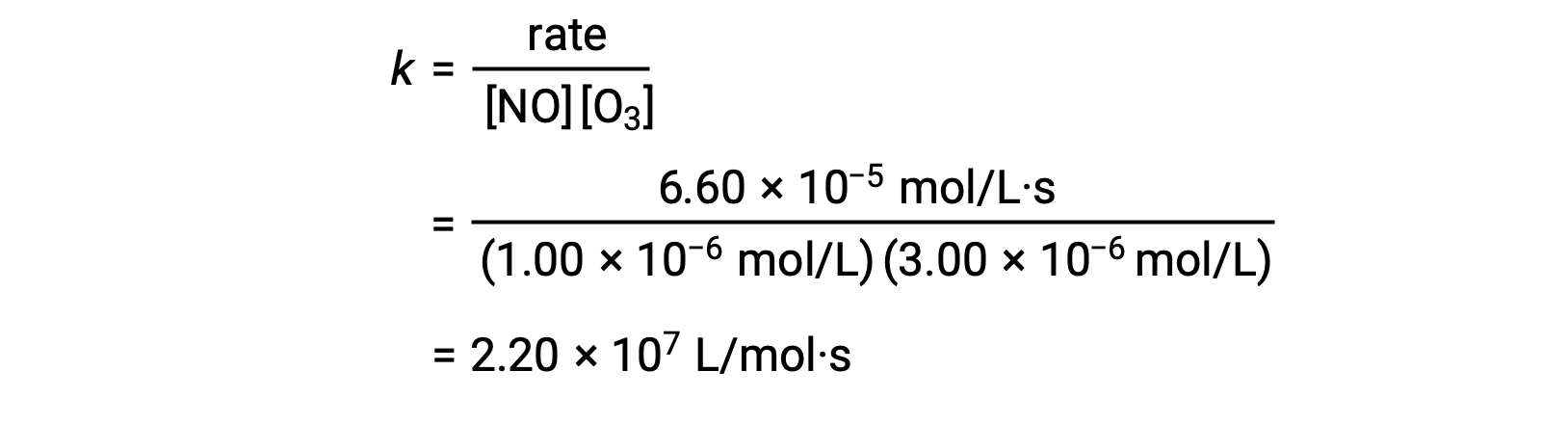
في التفاعلات التي لا تشير فيها البيانات من طريقة المعدلات الأولية مباشرة إلى العلاقة بين التركيزات الأولية والمعدلات الأولية ، يمكن استخدام الحساب الذي يتضمن نسبة قوانين المعدل لحساب ترتيب التفاعل وثابت المعدل.
على سبيل المثال ، قانون المعدل العام للتفاعل 2 NO (g) + Cl2 (g) ⟶ 2 NOCl (g) يتم التعبير عنه على النحو التالي: المعدّل = k [NO]m [Cl2]n.
البيانات من طريقة المعدّلات الأولية هي:
| Trial | [NO] (mol/L) | [Cl2] (mol/L) | Initial Rate (mol/L·s) |
| 1 | 0.10 | 0.10 | 0.00300 |
| 2 | 0.10 | 0.15 | 0.00450 |
| 3 | 0.15 | 0.10 | 0.00675 |
يمكن تحديد قيم m و n من البيانات التجريبية باستخدام منهج جبري، وبعد ذلك يتم تحديد قيمة k .
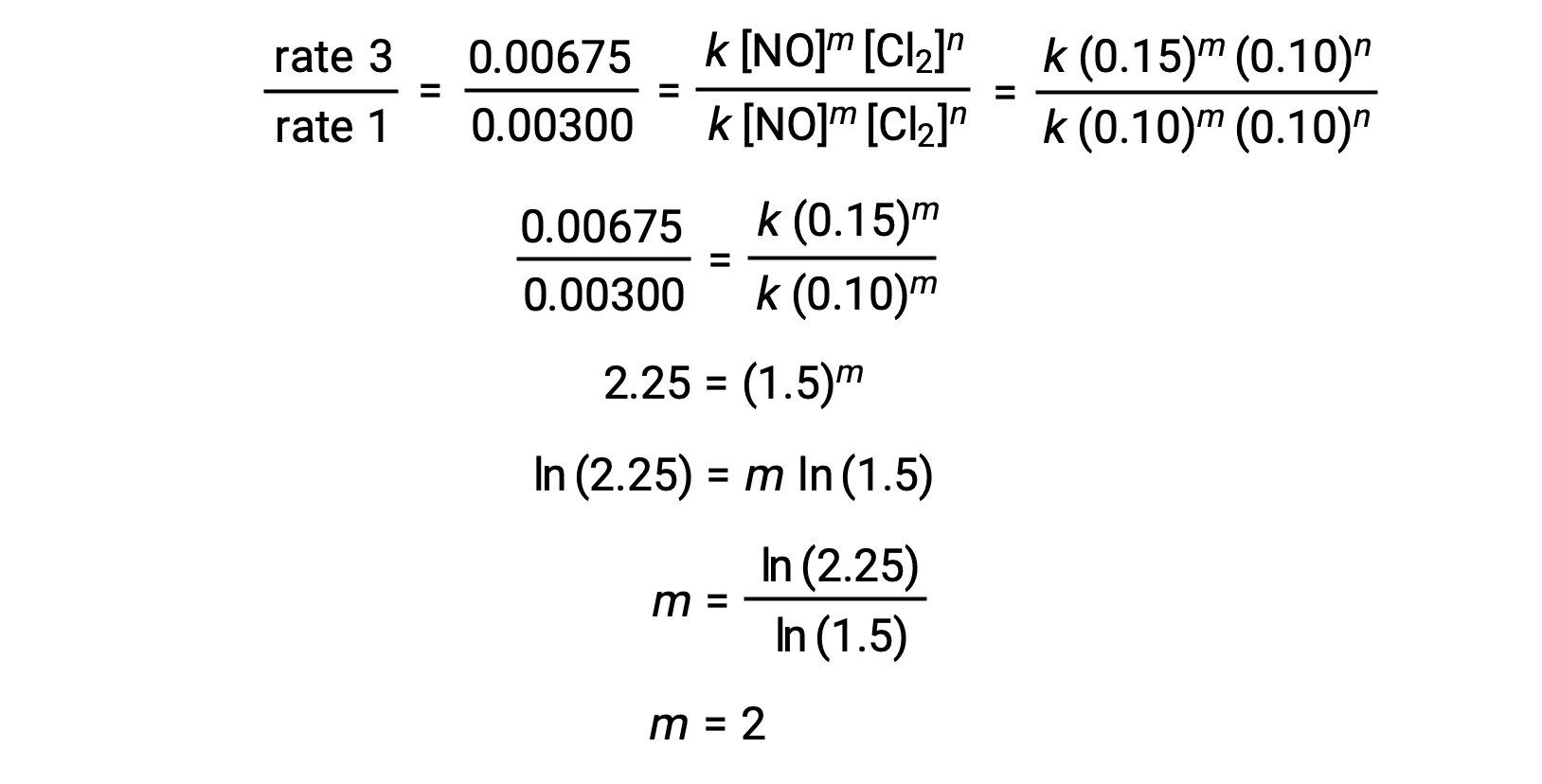
في الخطوة 1، يتم تحديد قيمة m من البيانات التي تختلف فيها [NO] وتكون [Cl2] ثابتة. يتم التعبير عن نسبة قوانين المعدّل عن طريق استبدال البيانات من تجربتين مختلفتين (على سبيل المثال، التجربة 3 والتجربة 1).
في الخطوة 2، يتم تحديد قيمة n من البيانات التي يتنوع فيها [Cl2] ويكون [NO] ثابتًا.
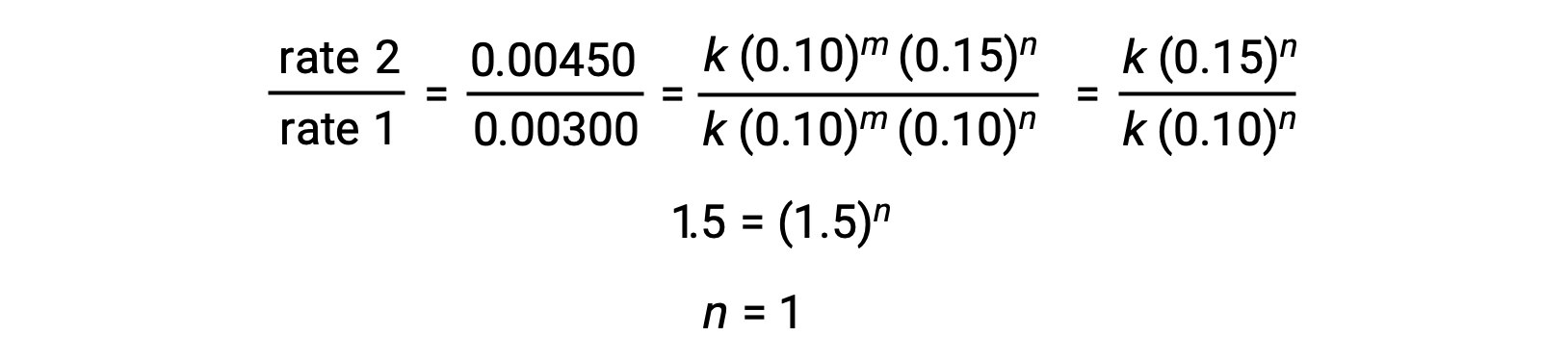
باستخدام القيم المحسوبة لـm و n يتم التعبير عن قانون المعدل بالصيغة: المعدّل = k [NO]2 [Cl2].
في الخطوة 3، تم تحديد القيمة العددية لثابت المعدل k بالوحدات المناسبة. وحدات معدل التفاعل هي مول/لتر. يتم الانتهاء من وحدات k عن طريق استبدال وحدات جميع المعلمات الأخرى في قانون المعدل. في هذا المثال، وحدات التركيز هي مول3/L3. يجب أن تكون وحدات k هي L L2/mol2· بحيث يكون المعدل معبّر عنه بالمول/ليتر·. يتم تحديد قيمة k بمجرد حل تعبير قانون المعدل، ببساطة عن طريق استبدال القيم من أي من التجارب التجريبية (على سبيل المثال التجربة 1).
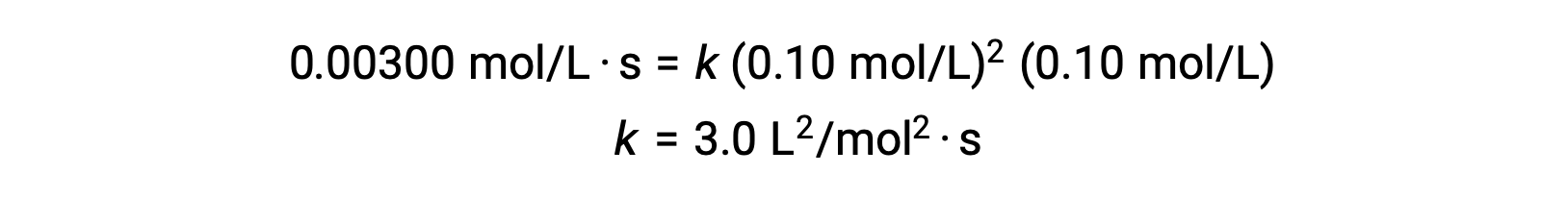
ترتيب التفاعل والوحدات الثابتة للمعدّلات
في بعض التفاعلات، تصادف أن تكون أوامر التفاعل في قانون المعدل هي نفسها المعاملات في المعادلة الكيميائية للتفاعل. هذه مجرد مصادفة وغالباً ما لا يكون الأمر كذلك. قد تعرض قوانين المعدل أوامر جزئية لبعض المواد المتفاعلة، وأحيانًا يتم ملاحظة أوامر التفاعل السلبية عندما تؤدي الزيادة في تركيز أحد المتفاعلات إلى انخفاض في معدل التفاعل. يتم تحديد قوانين المعدّل عن طريق التجربة فقط ولا يتم التنبؤ بها بشكل موثوق من خلال قياس العناصر المتفاعلة.
ستختلف وحدات ثابت المعدل حسب الاقتضاء لتلائم الترتيب العام للتفاعل. وحدة معدل ثابت للتفاعل الصفري هي مول/ليتر· (أو M/s) وتلك الخاصة بالتفاعل من الدرجة الأولى هي 1/s. وحدة ثابت المعدل لتفاعل من الدرجة الثانية هي مول/ليتر· (أو 1/M·s) وتلك الخاصة بالتفاعل من الدرجة الثالثة هي L2/mol2·s. على الرغم من الإشارة إلى الوحدات المحددة للتركيز والوقت على أنها (مول/لتر) و (s)، يمكن استخدام أي وحدات صالحة أخرى لتمثيل خصائص التركيز والوقت.
هذا النص مقتبس من Openstax, Chemistry 2e, Section 12.3: Rate Laws.
From Chapter 13:

Now Playing
13.4 : تحديد ترتيب التفاعل
Chemical Kinetics
55.1K Views

13.1 : معدّل التفاعل
Chemical Kinetics
51.3K Views

13.2 : قياس معدّلات التفاعل
Chemical Kinetics
24.5K Views

13.3 : قانون التركيز والمعدّل
Chemical Kinetics
30.1K Views

13.5 : قانون المعدّل المتكامل: اعتماد التركيز على الوقت
Chemical Kinetics
34.5K Views

13.6 : نصف عمر التفاعل
Chemical Kinetics
34.3K Views

13.7 : نظية الاصطدام
Chemical Kinetics
81.1K Views

13.8 : مخطّطات أرهينيوس
Chemical Kinetics
38.6K Views

13.9 : آليات التفاعل
Chemical Kinetics
25.4K Views

13.10 : خطوات تحديد المعدّل
Chemical Kinetics
31.7K Views

13.11 : التحفيز
Chemical Kinetics
26.6K Views

13.12 : الانزيمات
Chemical Kinetics
80.7K Views
Copyright © 2025 MyJoVE Corporation. All rights reserved