13.6 : نصف عمر التفاعل
إن نصف عمر التفاعل (t1/2) هو الوقت اللازم لاستهلاك نصف كمية معينة من المادة المتفاعلة. وفي كل فترة نصف عمر تالية، يتم استهلاك نصف التركيز المتبقي للمادة المتفاعلة. على سبيل المثال، أثناء تحلل بيروكسيد الهيدروجين، خلال نصف العمر الأول (من 0.00 ساعة إلى 6.00 ساعات) ، تركيز H2O2 ينخفض من 1.000 م إلى 0.500 م. خلال نصف العمر الثاني (من 6.00 ساعات إلى 12.00 ساعة)، ينخفض التركيز من 0.500 م إلى 0.250 م، بينما خلال النصف الثالث نصف العم ، ينخفض من 0.250 م إلى 0.125 م. ومن ثم، خلال كل فترة متتالية من 6.00 ساعات، ينخفض تركيز H2O2 بمقدار النصف.
يكون نصف العمر لتفاعل من الدرجة الأولى مستقل عن تركيز المادة المتفاعلة. ومع ذلك، فإن فترات نصف العمر للتفاعلات مع الترتيبات الأخرى تعتمد على تراكيز المواد المتفاعلة.
نصف العمر لتفاعلات الترتيب الأول
يمكن اشتقاق معادلة تتعلق بنصف عمر تفاعل من الدرجة الأولى بثابت معدلها من قانون المعدل المتكامل الخاص بها:
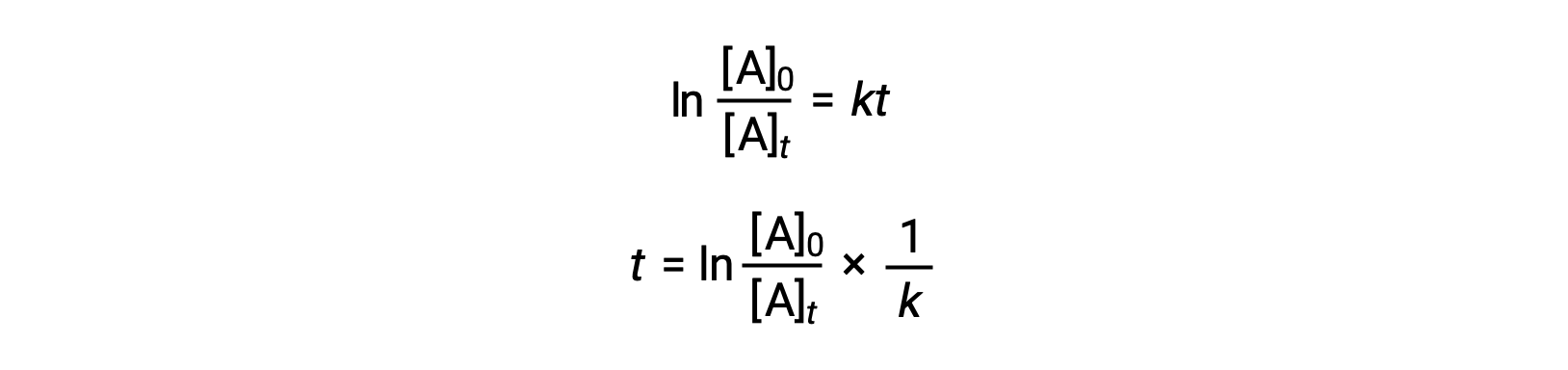
وفقًا لتعريف نصف العمر، في الوقت t1/2، يكون تركيز المادة المتفاعلة A هو نصف تركيزها الأولي. لذلك؛ t = t1/2 و [A]t = ½ [A]0.
يؤدي استبدال هذه المصطلحات في قانون المعدل المتكامل المعاد ترتيبها والتبسيط إلى إنتاج معادلة نصف العمر:
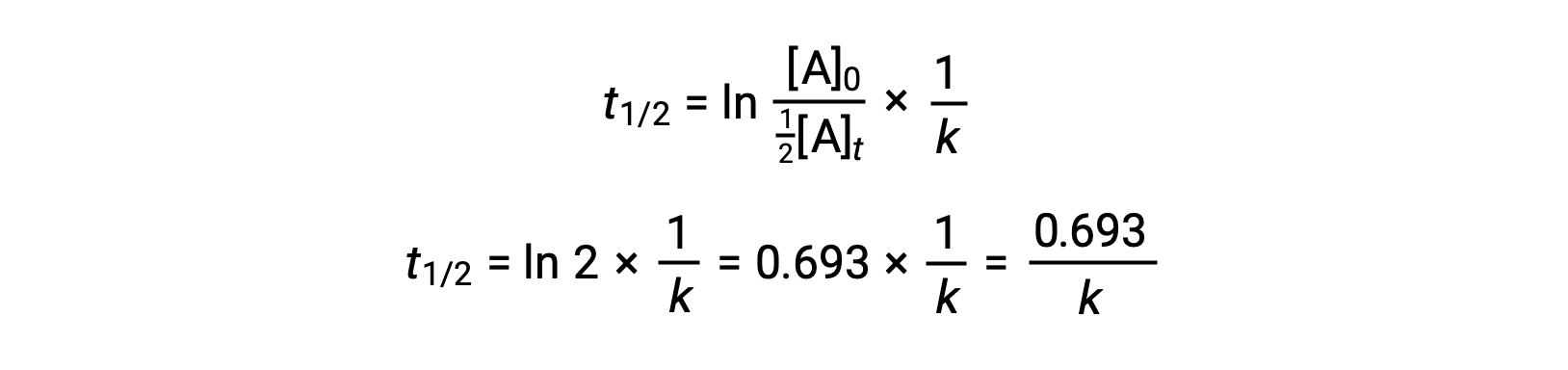
تصف معادلة نصف العمر هذه العلاقة العكسية المتوقعة بين عمر النصف للتفاعل وثابت معدله ، k. تُظهر التفاعلات الأسرع ثوابت معدل أكبر وعمر نصفي أقصر مقابل ذلك، بينما تظهر التفاعلات الأبطأ ثوابت معدل أصغر وعمر نصفي أطول.
عمر النصف لتفاعلات الترتيب الثاني
باتباع نفس النهج المتبع في التفاعلات من الدرجة الأولى ، يمكن اشتقاق معادلة تتعلق بنصف عمر تفاعل من الدرجة الثانية بثابت معدلها والتركيز الأولي من قانون المعدل المتكامل الخاص بها:
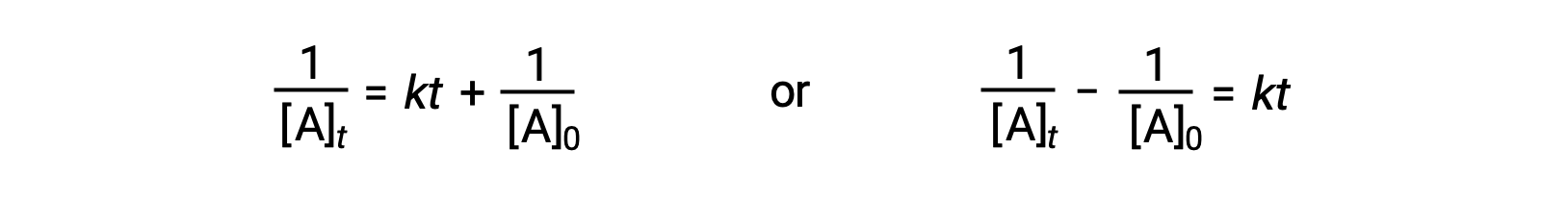
عند استبدال t = t1/2 , [A]t = ½[A]0، تم تبسيط قانون المعدّل المتكامل:
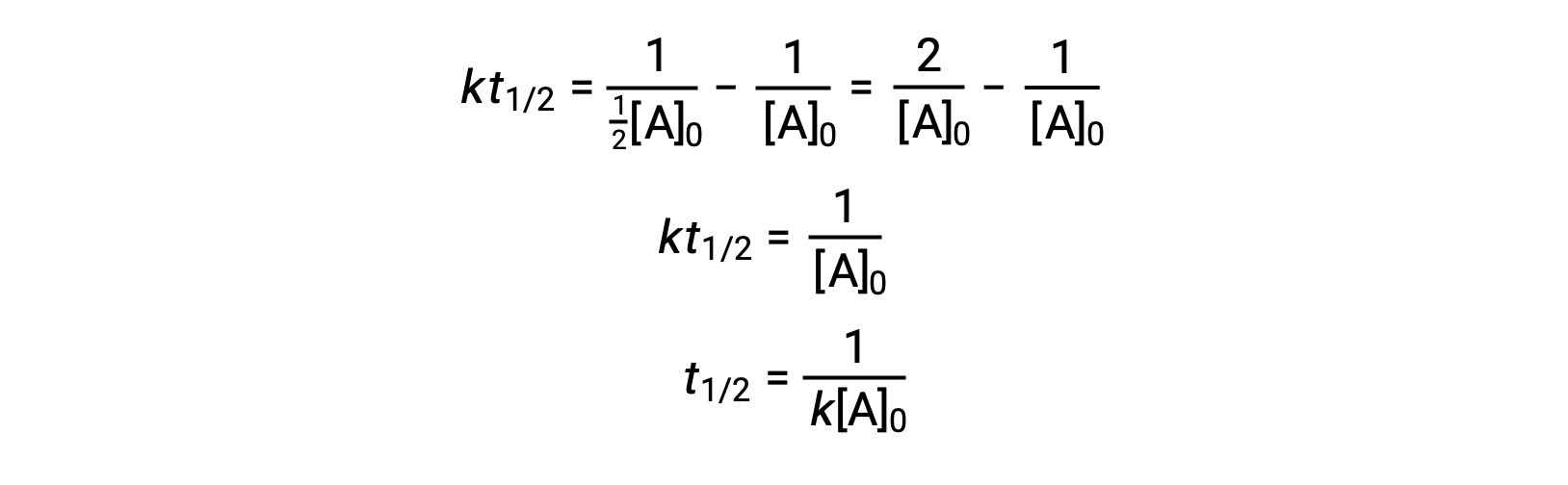
بالنسبة للتفاعل من الدرجة الثانية، يتناسب em>t1/2 عكسيًا مع تركيز المادة المتفاعلة، ويزيد عمر النصف مع استمرار التفاعل لأن ينخفض تركيز المادة المتفاعلة. على عكس التفاعلات من الدرجة الأولى، لا يمكن حساب ثابت المعدل لتفاعل من الدرجة الثانية مباشرةً من نصف العمر ما لم يكن التركيز الأولي معروفًا.
نصف عمر ردود الفعل الصفرية
يمكن أيضًا اشتقاق معادلة عمر النصف ذي الترتيب الصفري من قانون المعدل المتكامل الخاص بها:
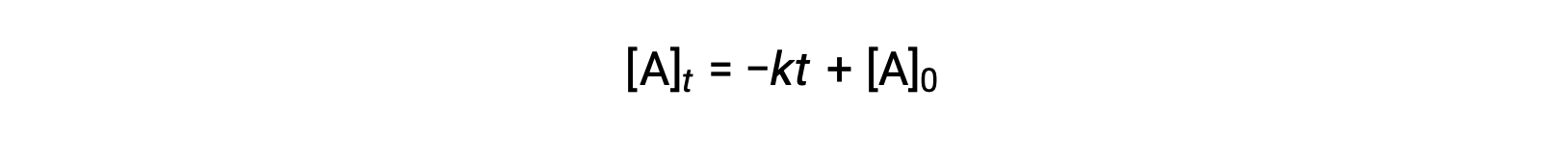
استبدال t = t1/2 و [A]t = ½ [A]0، في قانون المعدل الصفري المتكامل ينتج:
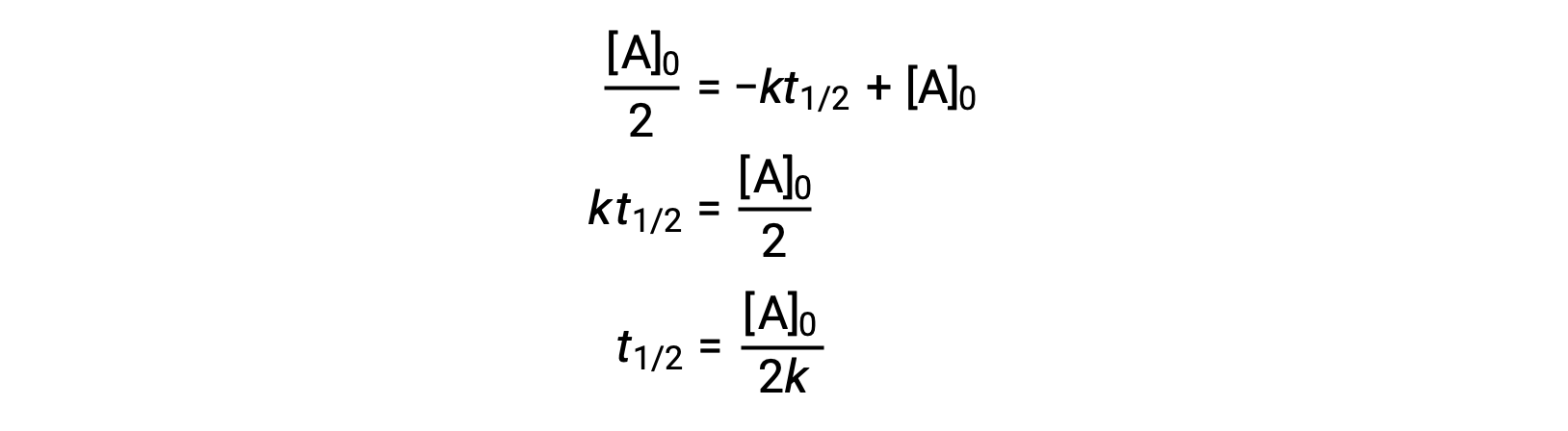
يتناسب نصف العمر للتفاعل الصفري عكسيًا مع معدله الثابت. ومع ذلك، فإن نصف العمر للتفاعل الصفري يزيد مع زيادة التركيز الأولي.
هذا النص مقتبس من Openstax, Chemistry 2e, Section 12.4: Integrated Rate Laws.
From Chapter 13:

Now Playing
13.6 : نصف عمر التفاعل
Chemical Kinetics
34.0K Views

13.1 : معدّل التفاعل
Chemical Kinetics
50.8K Views

13.2 : قياس معدّلات التفاعل
Chemical Kinetics
24.2K Views

13.3 : قانون التركيز والمعدّل
Chemical Kinetics
29.7K Views

13.4 : تحديد ترتيب التفاعل
Chemical Kinetics
54.7K Views

13.5 : قانون المعدّل المتكامل: اعتماد التركيز على الوقت
Chemical Kinetics
34.2K Views

13.7 : نظية الاصطدام
Chemical Kinetics
80.8K Views

13.8 : مخطّطات أرهينيوس
Chemical Kinetics
38.1K Views

13.9 : آليات التفاعل
Chemical Kinetics
25.1K Views

13.10 : خطوات تحديد المعدّل
Chemical Kinetics
31.5K Views

13.11 : التحفيز
Chemical Kinetics
26.5K Views

13.12 : الانزيمات
Chemical Kinetics
80.3K Views
Copyright © 2025 MyJoVE Corporation. All rights reserved