نظرية الاصطدام
يجب أن تتصادم الذرات أو الجزيئات أو الأيونات قبل أن تتفاعل مع بعضها البعض. يجب أن تكون الذرات قريبة من بعضها لتكوين روابط كيميائية. هذه الفرضية هي الأساس لنظرية تشرح العديد من الملاحظات المتعلقة بالحركية الكيميائية، بما في ذلك العوامل التي تؤثر على معدلات التفاعل.
تستند نظرية الاصطدام على الافتراضات القائلة بأن (1) معدل التفاعل يتناسب مع معدل تصادمات المواد المتفاعلة، (2) تصطدم الأنواع المتفاعلة في اتجاه يسمح بالاتصال بين الذرات التي ترتبط ببعضها البعض في المنتج، و (3) حدوث الاصطدام بطاقة كافية للسماح بالاختراق المتبادل للأنواع’ المتفاعلة أغلفة التكافؤ بحيث يمكن للإلكترونات إعادة ترتيب وتشكيل روابط جديدة (وأنواع كيميائية جديدة).
على سبيل المثال، في تفاعل الطور الغازي بين أول أكسيد الكربون والأكسجين، والذي يحدث عند درجة حرارة وضغط مرتفعين، تكون الخطوة الأولى هي التصادم بين الجزيئين.
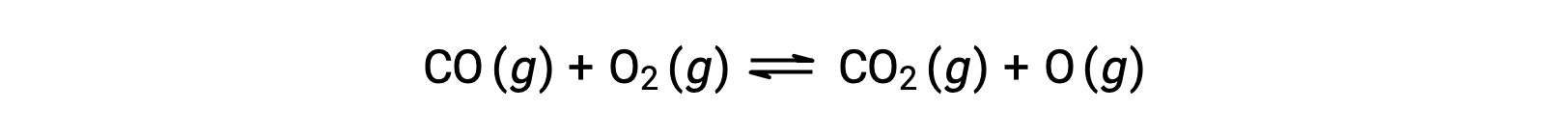
ومع ذلك، يمكن أن يكون هناك العديد من الاتجاهات النسبية المحتملة المختلفة التي يصطدم فيها الجزيئان. ومن ثم، فإن اتجاه الجزيئات المتصادمة له أهمية كبيرة في التحديد الجزئي لجدوى التفاعل الذي يحدث بينهما.
في إحدى الحالات، قد يتصادم جانب الأكسجين من جزيء أول أكسيد الكربون مع جزيء الأكسجين. في حالة أخرى، يمكن أن يتصادم جانب الكربون في جزيء أول أكسيد الكربون مع جزيء الأكسجين. من المرجح أن تؤدي الحالة الثانية إلى تكوين ثاني أكسيد الكربون، مع ذرة كربون مركزية مرتبطة بذرتين من الأكسجين (O = C = O).
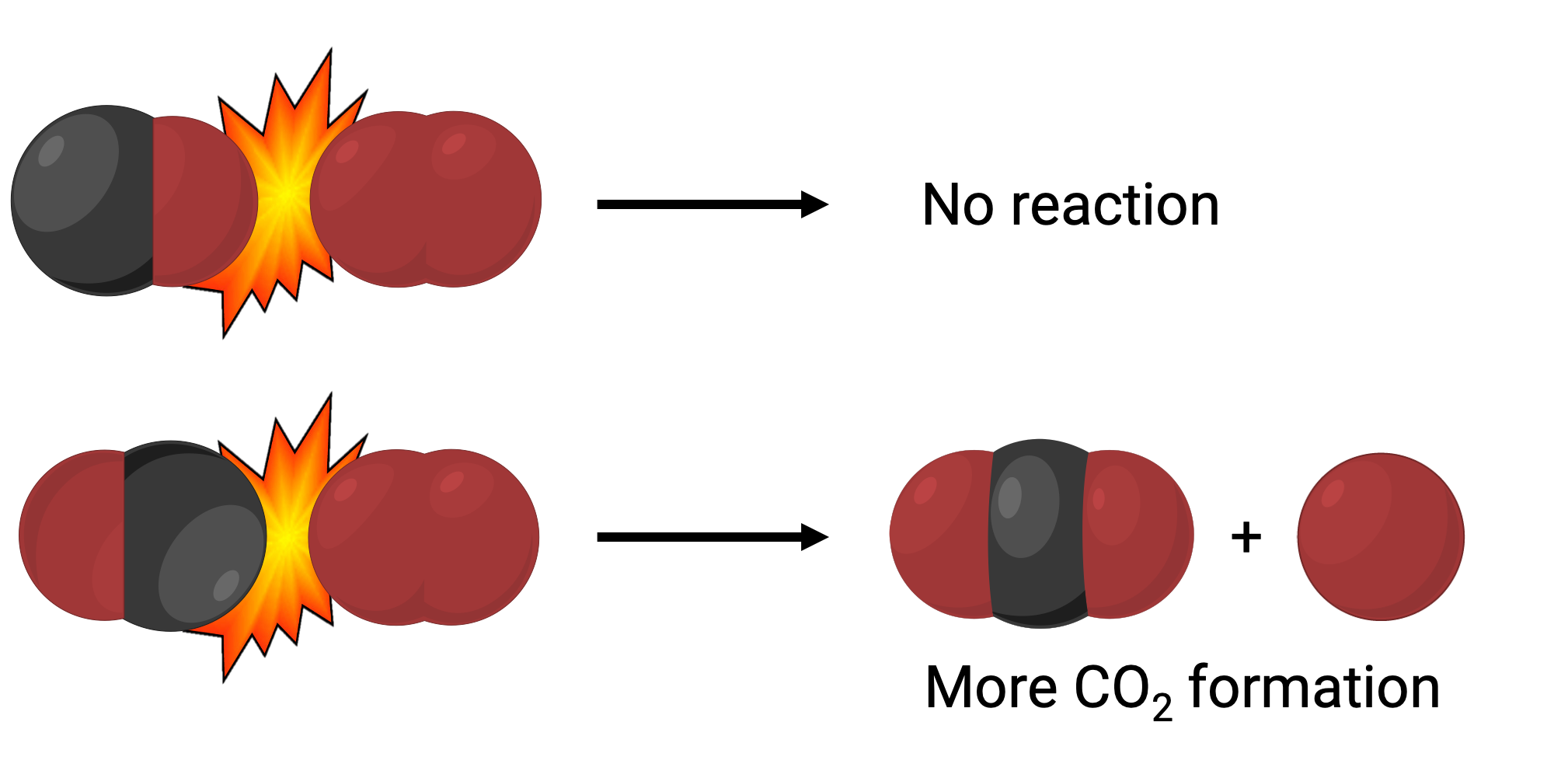
ومع ذلك، حتى إذا حدث التصادم في الاتجاه الصحيح، فإن ضمان استمرار التفاعل لتكوين ثاني أكسيد الكربون محدود. هذا لأنه، بالإضافة إلى التوجيه الصحيح، يجب أن يحدث التصادم أيضاً مع طاقة كافية تسمى طاقة التنشيط لتؤدي إلى تكوين المنتج. عندما تصطدم الأنواع المتفاعلة مع كل من الاتجاه الصحيح وطاقة التنشيط الكافية، فإنها تتحد لتشكل نوعاً غير مستقر يسمى المركب النشط أو الحالة الانتقالية. هذه الأنواع قصيرة العمر وعادة لا يمكن اكتشافها بواسطة معظم الأدوات التحليلية. في بعض الحالات، يمكن للقياسات الطيفية المعقّدة مراقبة حالات الانتقال هذه.
تشرح نظرية الاصطدام سبب زيادة معظم معدلات التفاعل مع ارتفاع درجة الحرارة؛ مع زيادة درجة الحرارة، يزداد تواتر الاصطدامات. يعني المزيد من الاصطدامات معدل تفاعل أسرع، على افتراض أن طاقة التصادمات كافية.
طاقة التنشيط
يُطلق على الحد الأدنى من الطاقة اللازمة لتكوين منتج أثناء الاصطدام بين المواد المتفاعلة طاقة التنشيط (Ea). يعد الاختلاف في طاقة التنشيط المطلوبة والطاقة الحركية التي توفرها جزيئات المتفاعلات المتصادمة عاملاً أساسياً يؤثر على معدل التفاعل الكيميائي. إذا كانت طاقة التنشيط أكبر بكثير من متوسط الطاقة الحركية للجزيئات، فسيحدث التفاعل ببطء، نظراً لأن عددًا قليلاً فقط من الجزيئات سريعة الحركة سيكون لديها طاقة كافية للتفاعل. إذا كانت طاقة التنشيط أصغر بكثير من متوسط الطاقة الحركية للجزيئات'، سيكون جزء كبير من الجزيئات نشطاً بشكل كافٍ، وسيستمر التفاعل بسرعة.
تُستخدم مخططات التفاعل على نطاق واسع في الخواص الحركية الكيميائية لتوضيح الخصائص المختلفة للتفاعل محل الاهتمام. يوضح كيف يتم تغير طاقة النظام' الكيميائي أثناء تعرضه للتفاعل، مما يؤدي إلى تحويل المواد المتفاعلة إلى منتجات.
على سبيل المثال، ضع في اعتبارك مخطط التفاعل التالي للتفاعل الطارد للحرارة: A + B & #A + B → C + D;
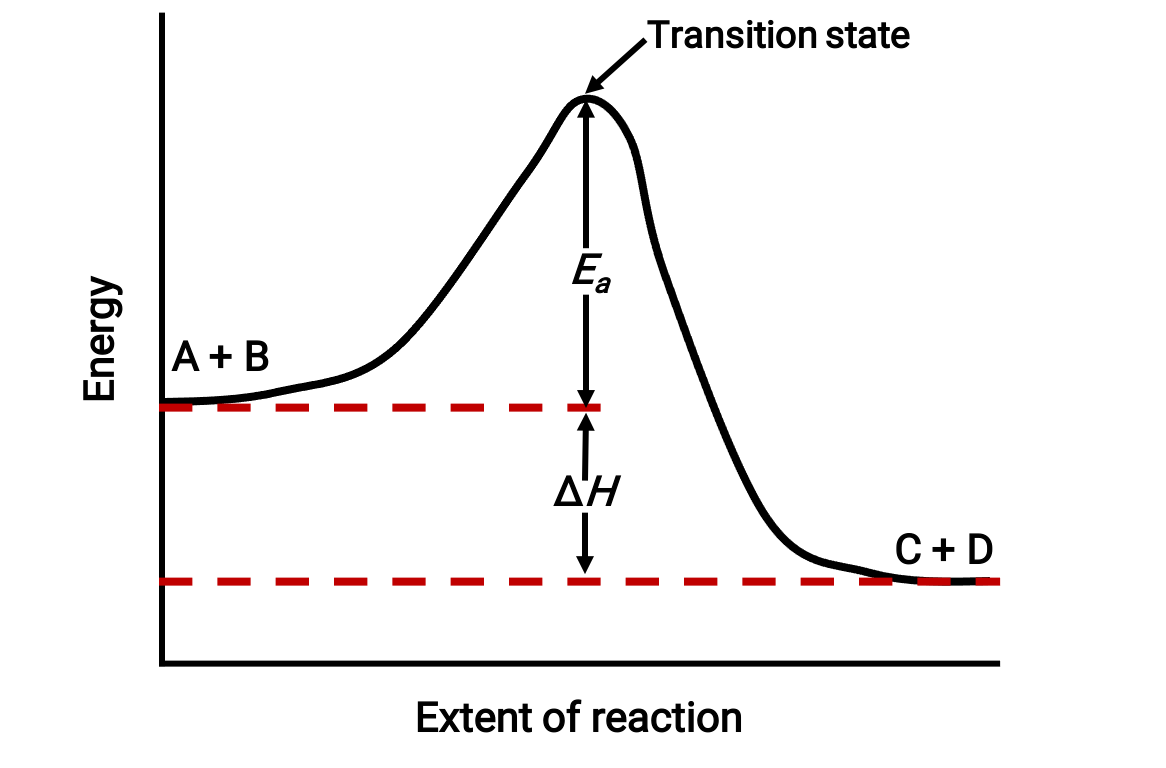
يتم عرض الرسم التخطيطي من اليسار إلى اليمين. في البداية، يتكون النظام من المواد المتفاعلة (A + B) فقط. بمجرد أن تتصادم جزيئات المادة المتفاعلة مع الطاقة الكافية، فإنها تشكل حالة معقدة أو حالة انتقالية عالية الطاقة. ثم تتلاشى حالة الانتقال غير المستقرة لاحقاً لإنتاج منتجات مستقرة (C + D).
يصور الرسم البياني طاقة تنشيط التفاعل، Ea، على أنها فرق الطاقة بين المواد المتفاعلة وحالة الانتقال. يتوافق فرق الطاقة بين المواد المتفاعلة والنواتج مع تغير المحتوى الحراري للتفاعل (ΔH). في هذه الحالة ، يكون التفاعل طارداً للحرارة (ΔH < 0)، لأنه ينتج عنه انخفاض في المحتوى الحراري للنظام.
معادلة أرهينيوس
إن معادلة أرهينيوس، k = Ae−Ea/RT تربط بين طاقة التنشيط وثابت المعدل، k، للعديد من التفاعلات الكيميائية.
في هذه المعادلة، R هو ثابت الغاز المثالي، الذي تبلغ قيمته 8.314 ·كيلوجول/مول، و T هي درجة الحرارة بالكلفن، و Ea هي طاقة التنشيط بالجول لكل مول، و e هو الثابت 2.7183، أما A هو ثابت يسمى عامل التردد، الذي يرتبط بتكرار التصادمات واتجاه الجزيئات المتفاعلة. تتلاءم معادلة أرهينيوس بشكل جيد مع افتراضات نظرية الاصطدام. يعكس عامل التردد، A، مدى جودة ظروف التفاعل في تفضيل الاصطدامات الموجهة بشكل صحيح بين الجزيئات المتفاعلة. يؤدي الاحتمال المتزايد للتصادمات الموجهة بشكل فعال إلى قيم أكبر لـ A ومعدلات تفاعل أسرع.
يصف المصطلح الأسّي ، e−Ea/RT، تأثير طاقة التنشيط على معدل التفاعل. وفقاً للنظرية الجزيئية الحركية، تعد درجة حرارة المادة مقياساً لمتوسط الطاقة الحركية للذرات أو الجزيئات المكونة لها؛ ينتج عن انخفاض طاقة التنشيط جزء أكثر أهمية من الجزيئات النشطة بشكل كافٍ وتفاعل أسرع.
يصف المصطلح الأسّي أيضًا تأثير درجة الحرارة على معدل التفاعل. تمثل درجة الحرارة المرتفعة جزءاً أكبر من الجزيئات التي تمتلك طاقة كافية (RT) للتغلب على حاجز التنشيط (Ea). ينتج عن هذا قيمة أعلى لثابت المعدل ومعدل تفاعل أسرع مقابل ذلك.
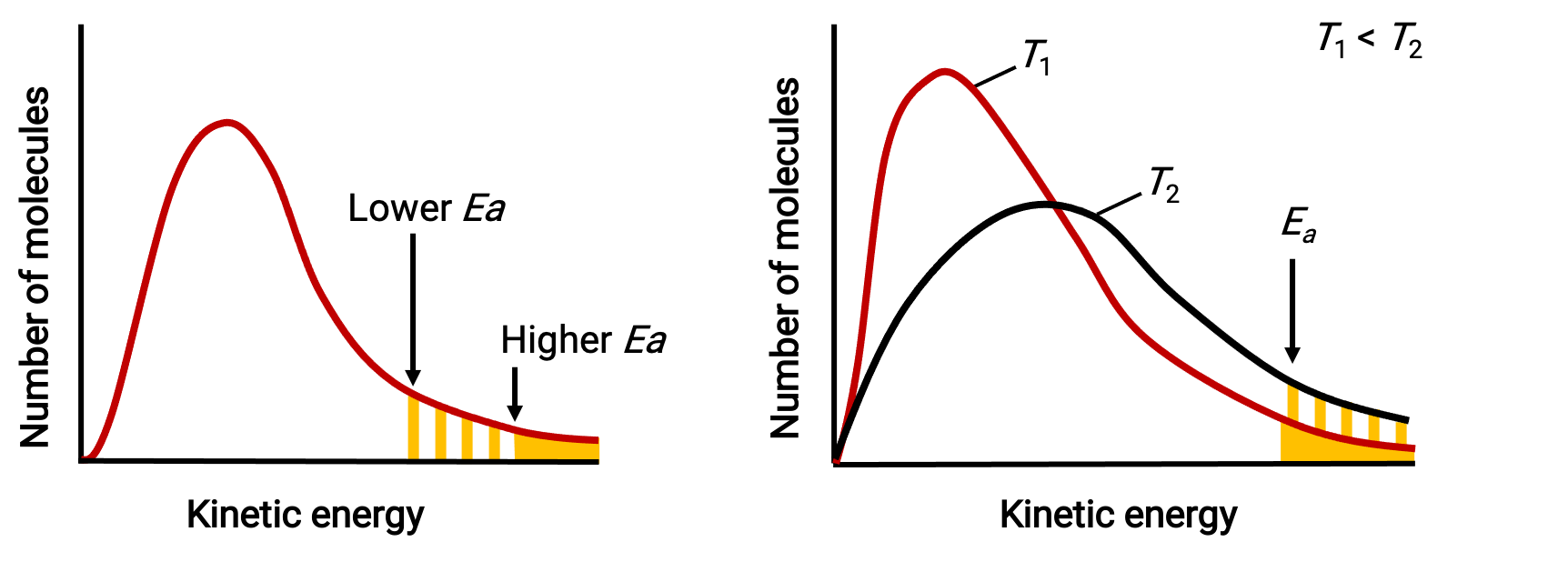
توضح توزيعات الطاقة الجزيئية عدد الجزيئات التي تتجاوز طاقاتها طاقتي تنشيط مختلفتين عند درجة حرارة معينة وطاقة تنشيط معينة عند درجتي حرارة مختلفتين.
هذا النص مقتبس من Openstax, Chemistry 2e, Section 12.5: Collision Theory.
From Chapter 13:

Now Playing
13.7 : نظية الاصطدام
Chemical Kinetics
80.2K Views

13.1 : معدّل التفاعل
Chemical Kinetics
49.9K Views

13.2 : قياس معدّلات التفاعل
Chemical Kinetics
23.7K Views

13.3 : قانون التركيز والمعدّل
Chemical Kinetics
29.2K Views

13.4 : تحديد ترتيب التفاعل
Chemical Kinetics
54.1K Views

13.5 : قانون المعدّل المتكامل: اعتماد التركيز على الوقت
Chemical Kinetics
33.5K Views

13.6 : نصف عمر التفاعل
Chemical Kinetics
33.4K Views

13.8 : مخطّطات أرهينيوس
Chemical Kinetics
37.2K Views

13.9 : آليات التفاعل
Chemical Kinetics
24.6K Views

13.10 : خطوات تحديد المعدّل
Chemical Kinetics
30.9K Views

13.11 : التحفيز
Chemical Kinetics
26.0K Views

13.12 : الانزيمات
Chemical Kinetics
79.8K Views
Copyright © 2025 MyJoVE Corporation. All rights reserved