碰撞理论
原子,分子或离子必须发生碰撞,才能相互反应。 原子必须彼此接近才能形成化学键。 这一前提是解释许多化学动力学观察的理论基础,包括影响反应率的因素。
碰撞理论基于以下假设: (i) 反应率值与反应物碰撞的率值成比例, (ii) 反应物种以允许在生成物中形成键合的原子之间发生接触的方向碰撞,(iii) 碰撞发生在适当的能量下,以允许相互穿透反应物种的价壳,从而电子可以重新排列并形成新的键 (和新的化学物种)。
例如,在高温和高压下发生的一氧化碳和氧气之间的气体相反应中,第一步是两个分子之间发生碰撞。
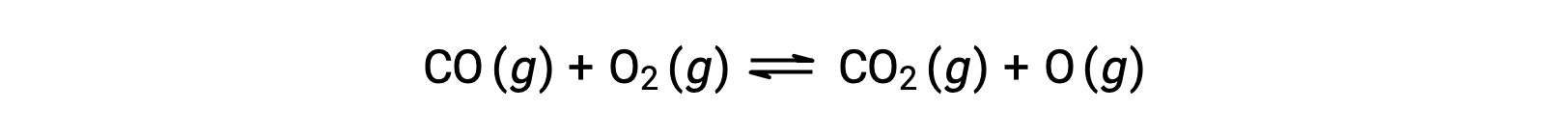
但是,两个分子可能发生多种不同的相对方向碰撞。 因此,碰撞分子的方向在部分确定中具有很大的意义,即它们之间发生反应的可行性。
在一种情况下,一氧化碳分子的氧侧可能与氧分子发生碰撞。 在另一种情况下,一氧化碳分子的碳侧可能与氧分子发生碰撞。 第二种情况更有可能导致二氧化碳的形成,其中心碳原子键合为两个氧原子 (O = C = O)。
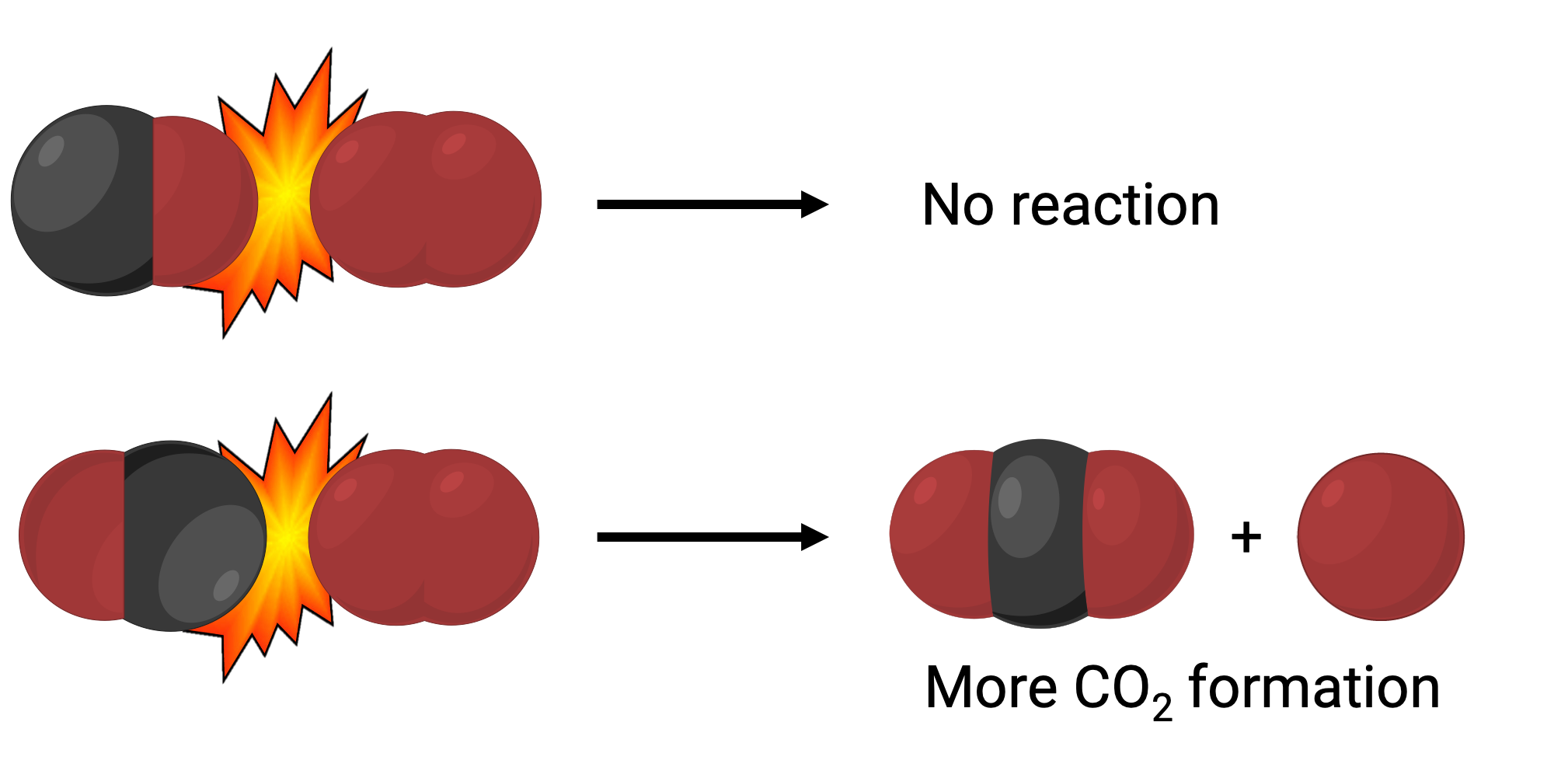
然而,即使碰撞发生在正确的方向,保证反应会形成二氧化碳的保证也是有限的。 这是因为,除了正确的方向外,还必须使用足够的称为激活能量的能量来发生碰撞,以导致生成物形成。 当反应物物种与正确的方向和足够的激活能量发生碰撞时,它们组合形成一个称为激活复合物或过渡状态的不稳定物种。 这些物种寿命短,通常无法被大多数分析仪器检测到。 在某些情况下,精密的光谱测量可以观察过渡状态。
碰撞理论解释了为什么大多数反应速率随着温度的升高而升高;随着温度的升高,碰撞频率会增加。 如果碰撞的能量足够,则碰撞越多意味着反应越快率值。
激活能量
在反应物之间发生冲突时形成生成物所需的最小能量称为激活能量 (Ea)。 碰撞反应物分子提供的激活能量和动能的差异是影响化学反应率值的主要因素。 如果活化能量比分子的平均动能大得多,反应将缓慢发生,因为只有少数快速移动的分子有足够的能量反应。 如果活化能量比分子的平均动能小得多,分子的很大一部分会有足够的能量,反应会迅速进行。
反应图广泛用于化学动力学中,用于说明各种感兴趣反应的性质。 它展示了化学系统的能量在发生反应时的变化,从而将反应物转换为生成物。
例如,考虑以下放热反应的反应图: A + B → C + D ;
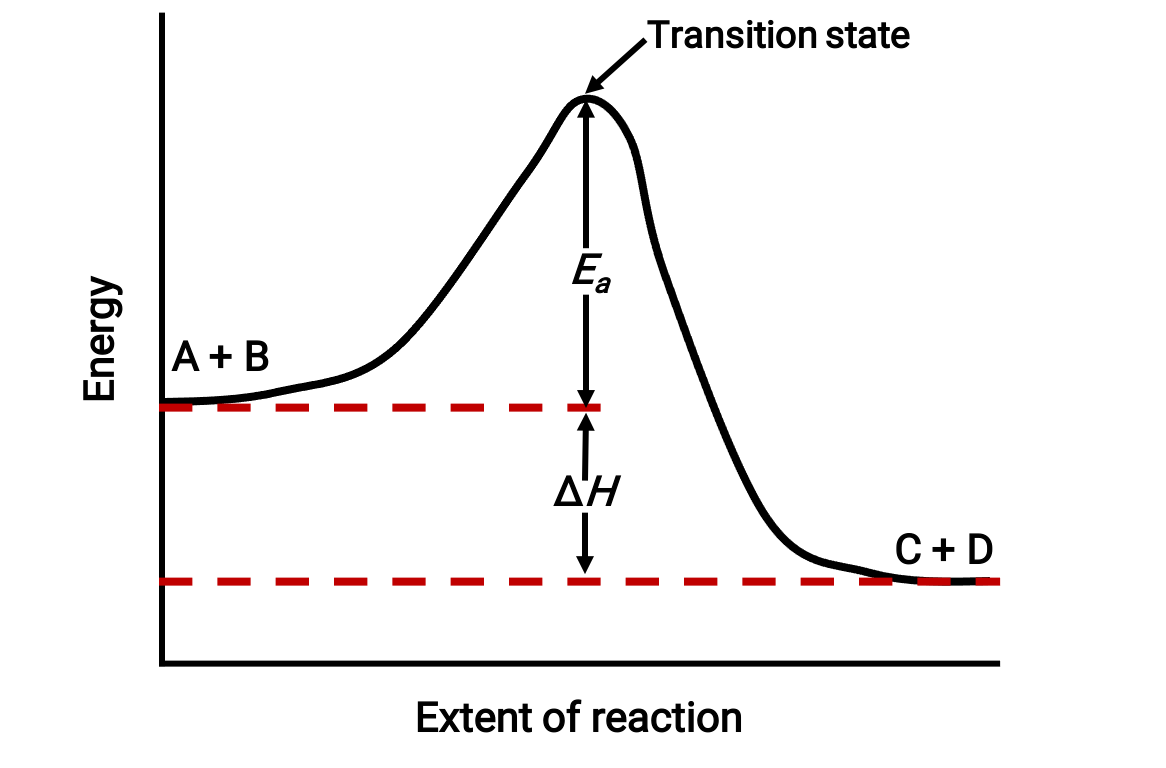
从左到右查看该图。 系统最初仅由反应物 (A + B) 组成。 一旦具有足够能量的反应物分子发生碰撞,它们就会形成高能量激活复合物或过渡状态。 随后,不稳定的过渡状态会衰减到产率稳定生成物 (C + D)。
该图描述了反应的激活能量 Ea ,即反应物和过渡状态之间的能量差异。 反应物和生成物之间的能量差值对应于反应的焓变化 (ΔH)。 在这种情况下,反应是放热(ΔH < 0),因为产率它会导致系统焓减少。
阿伦尼乌斯公式
阿伦尼乌斯方程,k = Ae−Ea/RT 将激活能量和率值常数 k 关联到许多化学反应。
在该方程中,R 是理想的气体常数,其值为 8.314 焦耳·/ 摩尔 K ,T 是开氏温度,Ea是每摩尔焦耳的激活能量,e 是常数 2.7183 ,A 是一个常量,称为频率系数, 这与碰撞频率和反应分子的方向有关。 阿伦尼乌斯方程很好地适应了碰撞理论的假设。 频率因子 A 反映了反应条件对反应物分子之间定向正确碰撞的有利程度。 有效定向碰撞的概率增加会导致A反应速率值增大,反应速率更快。
指数项e−Ea/RT描述了激活能量对反应率值的影响。 根据动力学分子理论的数据,物质温度是其成分原子或分子平均动能的一种测量值—较低的活化能量会导致充分通电分子的较高比例和更快的反应。
指数项还描述了温度对反应率值的影响。 温度越高,分子中拥有足够的能量(RT)以克服激活障碍(Ea)的分子的比例就越大。 该产率是率值常数的一个较高值,相应的反应率值更快。
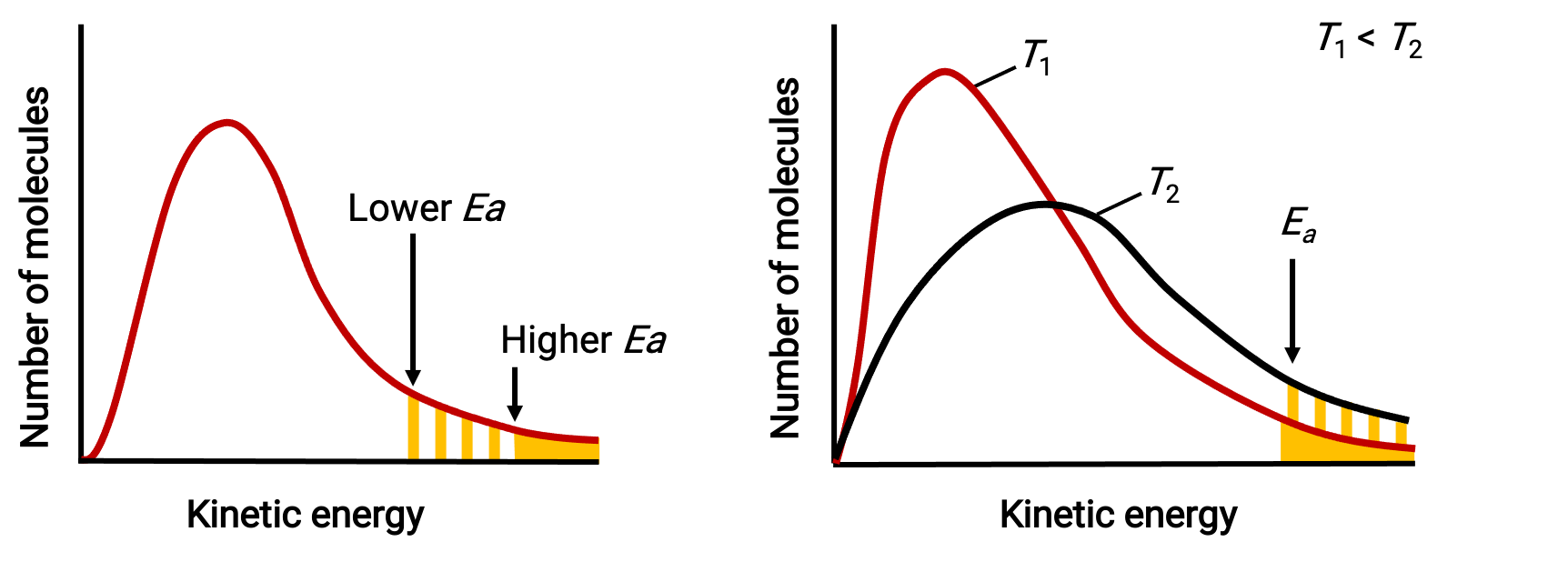
分子能量分布显示在给定温度下能量超过两种不同活化能量的分子数量,在两种不同温度下显示给定活化能量的分子数量。
来自章节 13:

Now Playing
13.7 : 反应速率的温度依赖性
化学动力学
80.2K Views

13.1 : 反应速率
化学动力学
49.9K Views

13.2 : 测量反应速率
化学动力学
23.7K Views

13.3 : 浓度和速率定律
化学动力学
29.2K Views

13.4 : 确定反应顺序
化学动力学
54.1K Views

13.5 : 积分速率定律:浓度对时间的依赖
化学动力学
33.5K Views

13.6 : 反应半衰期
化学动力学
33.4K Views

13.8 : 阿伦尼乌斯图
化学动力学
37.2K Views

13.9 : 反应机理
化学动力学
24.6K Views

13.10 : 速率确定步骤
化学动力学
30.9K Views

13.11 : 催化
化学动力学
26.0K Views

13.12 : 酶
化学动力学
79.8K Views
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。