14.1 : التوازن الديناميكي
يمثل التفاعل الكيميائي القابل للانعكاس عملية كيميائية تستمر في الاتجاهين الأمامي (من اليسار إلى اليمين) والعكس (من اليمين إلى اليسار). عندما تكون معدلات التفاعلات الأمامية والعكسية متساوية، فإن تركيزات المادة المتفاعلة والمنتج تظل الأنواع ثابتة بمرور الوقت ويكون النظام في حالة توازن. يتم استخدام سهم مزدوج خاص للتأكيد على الطبيعة القابلة للانعكاس للتفاعل.تختلف التركيزات النسبية للمواد المتفاعلة والمنتجات في أنظمة التوازن بشكل كبير ؛ تحتوي بعض الأنظمة في الغالب على منتجات في حالة توازن ، وبعضها يحتوي على معظمها مواد متفاعلة ، وبعضها يحتوي على كميات ملحوظة من كليهما.
التوازن الديناميكي في التفاعلات الكيميائية
ضع في اعتبارك التحلل العكسي لرباعي أكسيد ثنائي النيتروجين عديم اللون لإنتاج ثاني أكسيد النيتروجين البني، كما هو موضح في المعادلة:
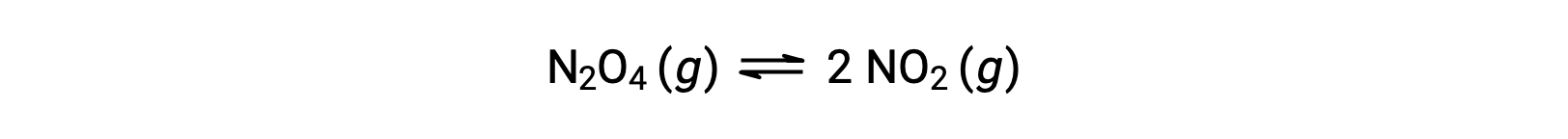
عندما يبدأ التفاعل (الوقت = 0) ، يكون تركيز المادة المتفاعلة N2O4 محدوداً وتركيز المنتج NO2 هو صفر، لذلك يستمر التفاعل الأمامي بمعدل محدود بينما يكون معدل التفاعل العكسي صفراً. مع مرور الوقت ، يتم استهلاكN2O4 وينخفض تركيزه ، بينما ينتج NO2 ويزداد تركيزه. يؤدي انخفاض تركيز المادة المتفاعلة إلى إبطاء معدل التفاعل الأمامي ، كما يؤدي تركيز المنتج المتزايد إلى تسريع معدل التفاعل العكسي. تستمر هذه العملية حتى تتساوى معدلات التفاعل الأمامية والعكسية، وفي ذلك الوقت يصل التفاعل إلى التوازن. من#8217; المهم التأكيد على أن التوازن الكيميائي ديناميكي ؛ وإن تفاعل ما عند التوازن لم “يتوقف,” لكنه يسير في الاتجاهين الأمامي والخلفي بنفس المعدل. وبالتالي، عند التوازن، لم تعد تركيزات N2O4 و NO2 تتغير لأن معدل تكوين NO2 يساوي تمامًا معدل استهلاك NO2، ومعدل تكوين N2O4 يساوي تمامًا بمعدل استهلاك N2O4.
التوازن متجانس وغير متجانس
التوازن المتجانس هو التوازن الذي توجد فيه جميع المواد المتفاعلة والمنتجات (وأي محفزات ، إن أمكن) في نفس المرحلة، إما في الطور المائي أو الغازي، كما هو موضح في الأمثلة التالية:
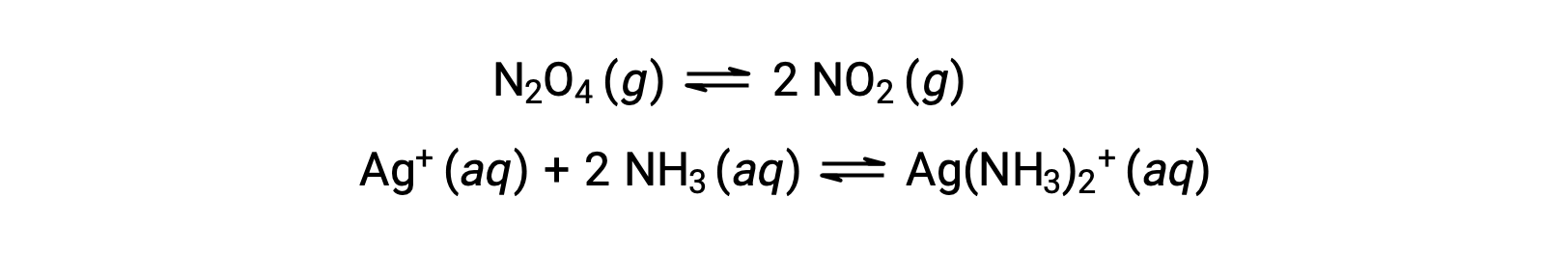
يشتمل التوازن غير المتجانس على المواد المتفاعلة والمنتجات في مرحلتين مختلفتين أو أكثر ، كما هو موضح في المثال التالي:
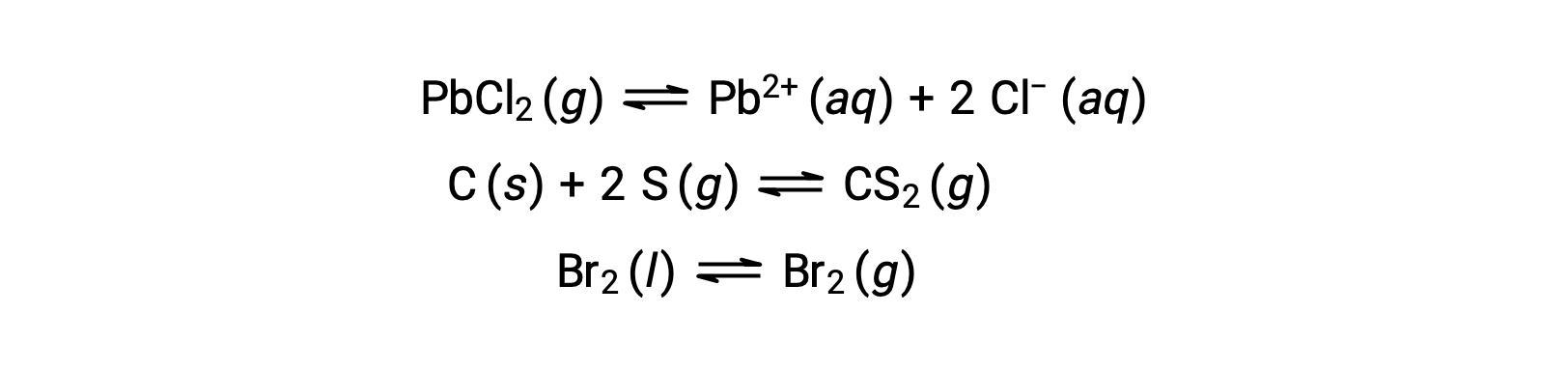
تم اقتباس هذا النص من Openstax, Chemistry 2e, Section 13.1 Chemical Equilibria.
From Chapter 14:

Now Playing
14.1 : التوازن الديناميكي
Chemical Equilibrium
50.4K Views

14.2 : ثابت التوازن
Chemical Equilibrium
46.7K Views

14.3 : التوازن اللتفاعلات الغازية والتفاعلات غير المتجانسة
Chemical Equilibrium
24.6K Views

14.4 : حساب ثابت التوازن
Chemical Equilibrium
31.0K Views

14.5 : حاصل قسمة التفاعل
Chemical Equilibrium
48.1K Views

14.6 : حساب تركيزات التوازن
Chemical Equilibrium
47.5K Views

14.7 : مبدأ لوشاتيليير: تغيير التركيز
Chemical Equilibrium
57.6K Views

14.8 : مبدأ لوشاتيليير: تغيير الحجم (الضغط)
Chemical Equilibrium
34.3K Views

14.9 : مبدأ لوشاتيليير: تغيير درجة الحرارة
Chemical Equilibrium
29.2K Views

14.10 : الافتراض الصغير
Chemical Equilibrium
45.9K Views
Copyright © 2025 MyJoVE Corporation. All rights reserved