يسمى التفاعل بين حمض برونستيدø-لوري والماء بتأين الحمض. على سبيل المثال، عندما يذوب فلوريد الهيدروجين في الماء ويتأين، يتم نقل البروتونات من جزيئات فلوريد الهيدروجين إلى جزيئات الماء، مما ينتج عنه أيونات الهيدرونيوم وأيونات الفلوريد:
يحدث التأين الأساسي لأحد الأنواع عندما يقبل البروتونات من جزيئات الماء. في المثال أدناه، تخضع جزيئات البيريدين، C5NH5، للتأين الأساسي عند إذابتها في الماء، مما ينتج عنه أيونات الهيدروكسيد والبيريدينيوم:
تشير تفاعلات التأين السابقة إلى أن الماء قد يعمل كقاعدة (كما في تفاعله مع فلوريد الهيدروجين) وحمض (كما في تفاعله مع الأمونيا). الأنواع القادرة على التبرع بالبروتونات أو قبولها تسمى برمائية، أو بشكل أعم، مذبذبة، وهو مصطلح يمكن استخدامه للأحماض والقواعد حسب التعريفات بخلاف برونستيدø-لوري. توضح المعادلات أدناه التفاعلين الحمضيين القاعدين المحتملين لنوعين برمائيات ، أيون البيكربونات والماء:
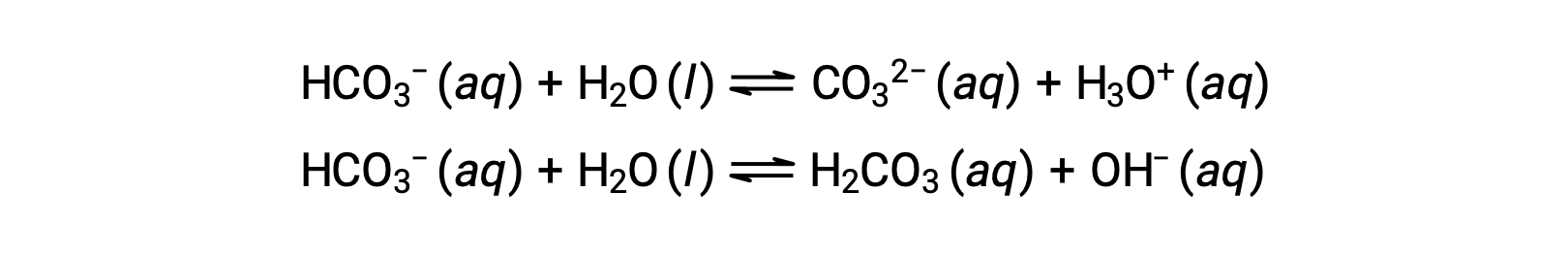
تمثل المعادلة الأولى تفاعل البيكربونات كحمض مع الماء كقاعدة، بينما تمثل المعادلة الثانية تفاعل البيكربونات كقاعدة مع الماء كحامض. عند إضافة البيكربونات إلى الماء، يتم إنشاء هذين التوازن في وقت واحد ويمكن تحديد تكوين المحلول الناتج من خلال حسابات التوازن المناسبة. في الحالة السائلة ، يمكن أن تتفاعل جزيئات مادة برمائية مع بعضها البعض كما هو موضح للمياه في المعادلات أدناه:
تسمى العملية التي تتفاعل فيها الجزيئات المتشابهة مع إنتاج الأيونات بالتأين الذاتي. يخضع الماء السائل للتأين الذاتي إلى حد ضئيل للغاية 25 °C، يتأين ما يقرب من اثنين من كل مليار جزيء ماء. ينعكس مدى عملية التأين الذاتي للماء في قيمة ثابت التوازن ، ثابت المنتج الأيوني للماء W:
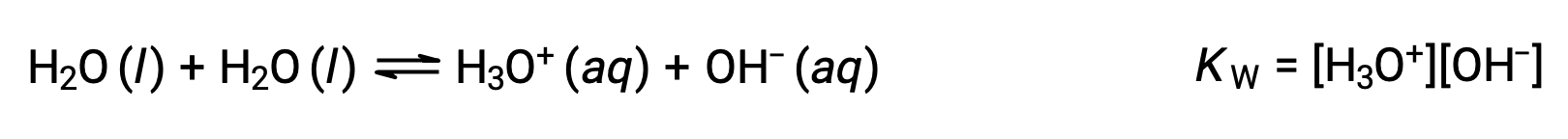
ينعكس التأين الطفيف للمياه النقية في القيمة الصغيرة لثابت التوازن ؛ في 25 °C, KW لها قيمة 1.0 × 10−14.
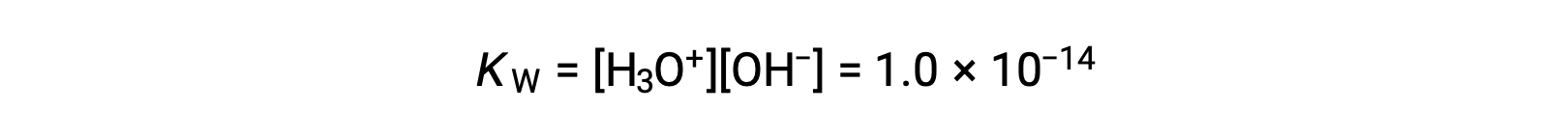
هذه العملية ماصة للحرارة، وبالتالي يزداد مدى التأين والتركيزات الناتجة من أيون الهيدرونيوم وأيون الهيدروكسيد مع زيادة درجة الحرارة. على سبيل المثال، عند 100 °C، تكون قيمة KW حوالي 5.6 × 10−13، تقريبًا أكبر بمقدار 50 مرة من القيمة عند 25 °C.
ينتج عن التأين الذاتي للماء نفس عدد أيونات الهيدرونيوم والهيدروكسيد. لذلك، في الماء النقي عند 25 °C:
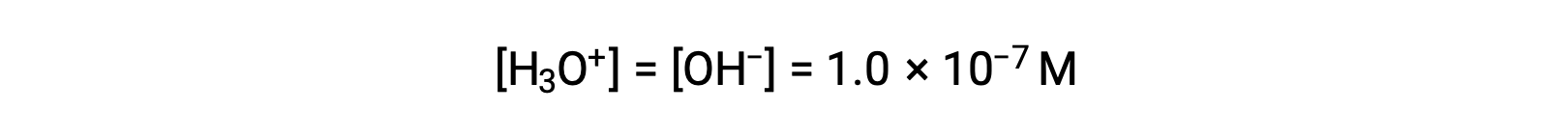
غالبًا ما تكون تركيزات هذه الأيونات في المحلول محددات حاسمة لخصائص المحلول والسلوكيات الكيميائية لمذاباته الأخرى، وقد تم تطوير مفردات محددة لوصف هذه التركيزات بمصطلحات نسبية. يكون المحلول متعادلاً إذا كان يحتوي على تركيزات متساوية من أيونات الهيدرونيوم والهيدروكسيد؛ حمضي إذا كان يحتوي على تركيز أيونات الهيدرونيوم أكبر من أيونات الهيدروكسيد؛ وأساسي إذا كان يحتوي على تركيز أقل من أيونات الهيدرونيوم من أيونات الهيدروكسيد.
ملخص العلاقات للحلول الحمضية والأساسية والمحايدة
| التصنيف | تركيزات الأيون النسبية | درجة حموضة 25 °C |
| حمضي | [H3O+] > [OH−] | الرقم الهيدروجيني < 7 |
| الوضع المحايد | [H3O+] = [OH−] | الرقم الهيدروجيني = 7 |
| أساسي | [H3O+] < [OH−] | الرقم الهيدروجيني > 7 |
تم اقتباس هذا النص من Openstax, Chemistry 2e, Section 14.1: Brønsted-Lowry Acids and Bases, and Section 14.2: pH and pOH.
Copyright © 2025 MyJoVE Corporation. All rights reserved